La comisurotomía mitral cerrada dio inicio a la cirugía cardíaca. Posteriormente, el reemplazo mitral protésico se impuso como el procedimiento de elección para la valvulopatía mitral. Sin embargo, las complicaciones tromboembólicas de las prótesis mecánicas y la limitada durabilidad de las bioprótesis se hicieron rápidamente evidentes. La introducción de la reparación mitral por Carpentier, basada en un análisis valvular, una triada fisiopatológica, una clasificación funcional de la insuficiencia mitral y el desarrollo de técnicas quirúrgicas específicas para cada tipo de lesión valvular mitral, hicieron que la reparación mitral pasara a ser el procedimiento de elección para la corrección quirúrgica de la insuficiencia mitral. El desarrollo de la ecocardiografía, en especial transesofágica, le dio un impulso adicional. Esto a su vez permitió distinguir dos tipos principales de insuficiencia mitral: primaria o valvular y secundaria o ventricular, haciéndose evidente que los resultados quirúrgicos eran muy disímiles, mejores en la primera y peores en la segunda. La insuficiencia mitral primaria a su vez reconoce principalmente dos tipos anatomopatológicos: la enfermedad de Barlow, propia del paciente joven, y la deficiencia fibroelástica, del adulto mayor. La insuficiencia mitral secundaria tiene como principal causa la isquemia miocárdica, lo que determina su pronóstico.
Closed mitral commissurotomy initiated cardiac surgery. Subsequently, prosthetic mitral valve replacement became the procedure of choice for mitral valve disease. However, the thromboembolic complications of mechanical prostheses and the limited durability of bioprostheses quickly became evident. The introduction of mitral repair by Carpentier, based on a valvular analysis, a pathophysiological triad, a functional classification of mitral regurgitation and the development of specific surgical techniques for each type of mitral valve lesion, made mitral repair the procedure of choice for the surgical correction of mitral regurgitation. The development of echocardiography, especially transesophageal echocardiography, gave additional impetus. This, in turn, made it possible to distinguish two main types of mitral regurgitation: primary or valvular and secondary or ventricular, and it became evident that the surgical results were very different between them, better in the former and worse in the latter. Primary mitral insufficiency recognizes two main anatomopathological types: Barlow's disease, typical of the young patient, and fibroelastic deficiency, of the older adult. Secondary mitral regurgitation is mainly caused by myocardial ischemia, which determines its prognosis.
La cirugía cardíaca propiamente tal se inicia en 1948, cuándo el 10 de junio de ese año Charles Bailey, en Filadelfia, efectúa la primera “comisurotomía” mitral y 6 días después Dwight Harken, en Boston, efectúa la primera “valvuloplastia” mitral. En ambos casos el procedimiento se efectuaba en forma ciega, a través de la orejuela izquierda. Con el desarrollo de la circulación extracorpórea por John Gibbon, Walton Lillehei y John Kirklin a mediados de los años 50, la cirugía mitral “cerrada” dio paso a la valvuloplastia mitral abierta para llegar, finalmente, al reemplazo valvular mitral en septiembre de 1960, en que Albert Starr, en Oregon, efectuó el primer reemplazo valvular mitral exitoso con una prótesis de “canastillo y bola”, diseñada por él en conjunto con el ingeniero Lowell Edwards. El reemplazo mitral protésico fue la respuesta para todo tipo de patologías de la válvula mitral, en especial para la insuficiencia mitral, en tiempos en que la enfermedad reumática y sus secuelas valvulares era altamente prevalente. Sin embargo, rápidamente se hicieron evidentes los problemas secundarios a la trombogenicidad de estas prótesis “mecánicas”, que requerían por esto de un tratamiento anticoagulante estricto de por vida. Estimulado por esta importante desventaja, Alain Carpentier, en Paris, desarrolló una prótesis “biológica” a partir de una válvula aórtica de cerdo, efectuando el primer implante en 1967. Si bien estas “bioprótesis” no requerían tratamiento anticoagulante, tenían una durabilidad limitada, especialmente en pacientes jóvenes, lo que era, a su vez, un grave problema1.
Pero, además de la trombogenicidad de las prótesis mecánicas y de la limitada durabilidad de las prótesis biológicas, el reemplazo valvular, con resección completa del aparato valvular mitral, compromete la función contráctil del ventrículo izquierdo, lo que aumenta la morbilidad y mortalidad operatoria y disminuye la sobrevida alejada, lo que fue observado ya a mediados de los años 60 por Walton Lillehei, quien recomendó, por lo mismo, conservar el velo mitral posterior al efectuar un reemplazo mitral2,3.
2El Aparato Valvular MitralLa válvula mitral, a diferencia de la válvula aórtica, es una estructura compleja, la que además de permitir un flujo unidireccional de sangre desde la aurícula izquierda al ventrículo izquierdo, participa en mantener la arquitectura y la geometría de este último, y, por lo tanto, participa también en la función contráctil de este.
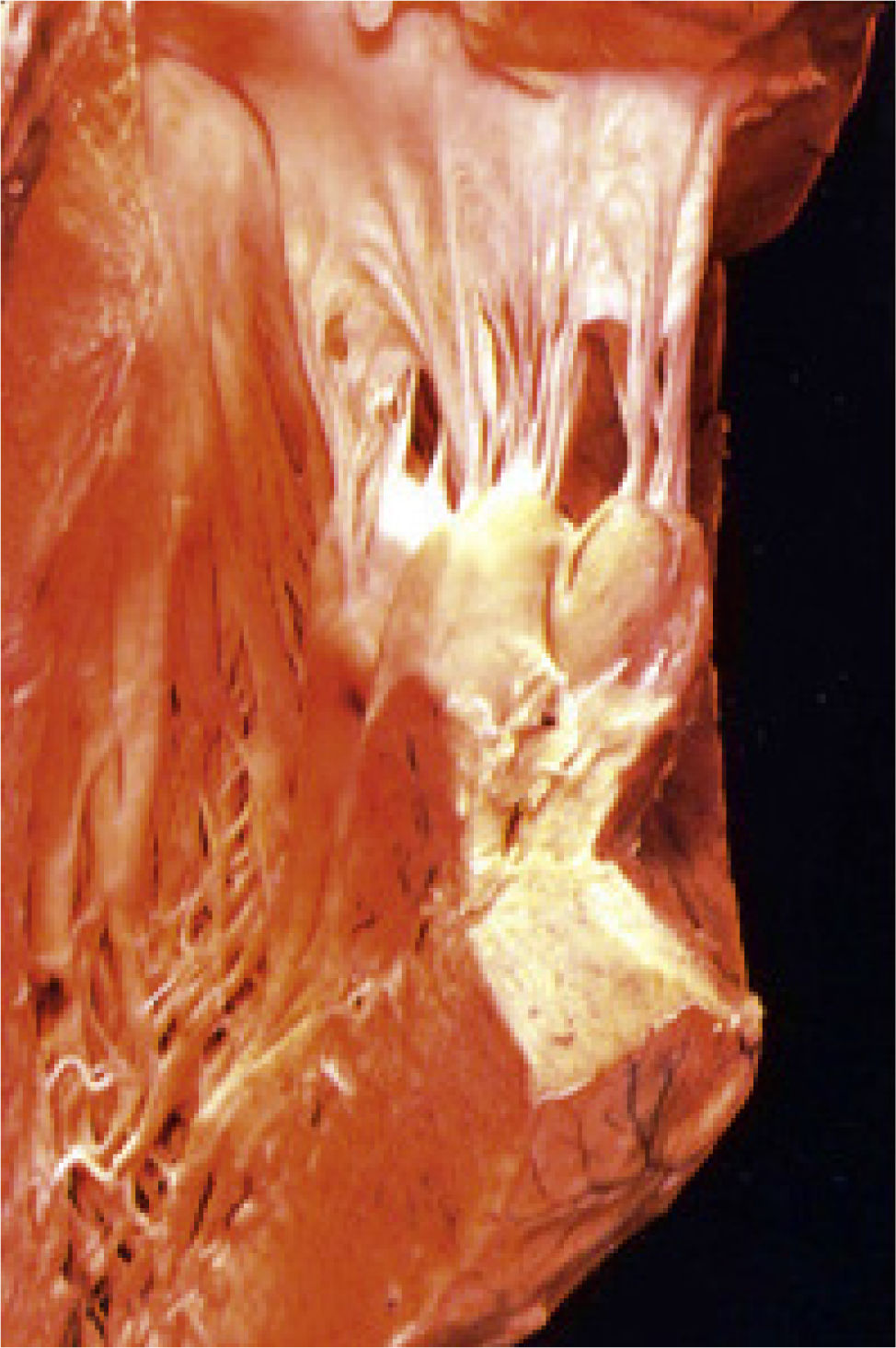
Como se observa en la Fig. 1, el aparato valvular mitral está constituido por el anillo mitral, parte integral del esqueleto cardíaco, del que se originan ambos velos mitrales, anterior y posterior, a los cuales se insertan las cuerdas tendíneas, numerosas, que se desprenden a su vez de los músculos papilares, también anterior y posterior, los que finalmente se insertan en la pared ventricular izquierda subyacente. Así, se establece un continuo entre el esqueleto fibroso del corazón y la pared libre del ventrículo izquierdo, lo que determina la geometría de la cavidad ventricular izquierda. Es esta relación anatómica la que explica, a su vez, el papel preponderante que juega el aparato valvular mitral en la normal función contráctil del ventrículo izquierdo, lo que fue vislumbrado ya en el siglo XV por Leonardo Da Vinci, quien comparó este aparato a una basílica romana4.
Aparato valvular mitral. Preparación anatómica del aparato valvular mitral. Es posible apreciar la continuidad estructural entre el esqueleto cardíaco y la pared libre del ventrículo izquierdo a través del anillo mitral, los velos mitrales, las cuerdas tendíneas y los músculos papilares, lo que a su vez determina la geometría y arquitectura de la cavidad ventricular izquierda, y, por lo tanto, la función contráctil del ventrículo izquierdo.
El anillo mitral no es un círculo, sino que se asemeja más bien a un riñón, en el cual la porción anterior o aórtica constituye el 30% del perímetro del anillo mitral y la porción posterior o mural el 70%. Las cuerdas tendíneas son de 3 ordenes: cuerdas tendíneas primarias son aquellas que se insertan en el borde libre de los velos y son las que dan la continencia a la válvula mitral; cuerdas secundarias son las que se insertan en el cuerpo de los velos y participan fundamentalmente en mantener la geometría ventricular izquierda y cuerdas terciarias son aquellas que se insertan en la cercanía del anillo mitral, de función incierta. Si bien los músculos papilares son 2, anterior y posterior, estos están constituidos cada uno por más de una cabeza o vientre muscular5.
Las cuerdas tendíneas y los músculos papilares constituyen lo que se conoce como aparato subvalvular mitral, el que actúa como un “sistema de suspensión”, facilitando, por una parte, la apertura de los velos mitrales durante la diástole, y, por otra, previniendo el prolapso de estos por sobre el plano anular durante la sístole5.
3El Auge de La Cirugía Mitral ReconstructivaEn los inicios de la cirugía valvular, la enfermedad reumática era la patología predominante, para la cual, con excepción de la estenosis mitral pura, el reemplazo valvular con prótesis mecánica era el procedimiento de elección, en especial para la insuficiencia mitral1,5,6. En los años ochenta, la enfermedad degenerativa comenzó a ganar preponderancia y en los noventa la insuficiencia mitral secundaria a la miocardiopatía, en especial isquémica, atrajo la atención de los cirujanos. En esos años, paulatinamente, los procedimientos no trombogénicos, como las prótesis biológicas, a pesar de su limitada durabilidad, y la cirugía valvular reparadora, a pesar de su mayor complejidad, comenzaron a ser cada vez más frecuentemente los procedimientos de elección para el tratamiento quirúrgico de la valvulopatía mitral5,7.
En 1984 el grupo de Carpentier publicó en Circulation el primer análisis comparativo entre el reemplazo mitral con prótesis mecánicas Starr Edwards y Bjork Shiley, el uso de bioprótesis y la reparación valvular mitral, demostrando fehacientemente la superioridad de esta última en cuánto a sobrevida libre de muerte valvular, mortalidad y morbilidad relacionada al procedimiento, tromboembolismo y reoperación8. Esto dio inicio al auge definitivo de la cirugía reconstructiva de la insuficiencia mitral.
Como señaló Alain Carpentier en su conferencia como “Invitado de Honor” al LXIII Congreso Anual de The American Association for Thoracic Surgery: “La cirugía valvular reparadora es un sistema amplio y completo de análisis valvular y técnicas relacionadas, basado en tres principios básicos: Restaurar o conservar la completa movilidad de los velos valvulares, crear una gran superficie de coaptación y remodelar el anillo mitral para producir un área valvular óptima y estable”9. Estos principios mantienen plena vigencia en la actualidad.
4El Análisis ValvularCarpentier introdujo el concepto de “análisis valvular”, lo que permitió unificar un lenguaje común para cirujanos y cardiólogos, con el que efectuar un diagnóstico preciso a partir del cual recomendar el procedimiento terapéutico más apropiado y efectivo. Igualmente, enunció una “triada fisiopatológica”, la que en la actualidad lleva su nombre, constituida por la etiología valvular, es decir, la causa de la enfermedad, la lesión valvular producto de la enfermedad y la disfunción valvular resultante de la lesión. Esta triada permitió una clarificación y organización de una multitud de términos que originaban una gran confusión al respecto, dificultando la comunicación entre los distintos especialistas y sus pacientes. En especial para estos últimos la triada de Carpentier tiene gran significado e importancia, ya que “el pronóstico alejado depende de la etiología, la estrategia terapéutica depende de la disfunción, y la técnica quirúrgica depende de la lesión”, como este lo estableció en su histórica conferencia, publicada posteriormente en el Journal of Thoracic and Cardiovascular Surgery, en 19835,9.
4.1La etiologíaLa válvula mitral puede verse afectada por numerosos procesos patológicos, los que pueden ser agrupados en dos grandes grupos etiológicos principales: la valvulopatía mitral primaria, en el que la causa de la enfermedad asienta en el aparato valvular propiamente tal, de aquí que se conozca también como “valvular”, y la valvulopatía mitral secundaria, resultado del daño de las estructuras que soportan a la válvula mitral, en este caso el ventrículo izquierdo, de aquí que se conozca también como “ventricular”. En la actualidad el principal proceso etiológico de la valvulopatía mitral primaria lo constituye la valvulopatía mitral degenerativa o mixomatosa, constituida, a su vez, por la enfermedad de Barlow, la deficiencia fibroelástica y el síndrome de Marfan5,9,10. Otra causa de insuficiencia mitral primaria, mucho menos frecuente, lo constituye la endocarditis infecciosa; la enfermedad reumática es en la actualidad muy infrecuente en los países desarrollados, así como también lo es en Chile.
En la insuficiencia mitral secundaria, los principales procesos etiológicos los constituyen las miocardiopatías, de las cuales la más frecuente e importante es la miocardiopatía isquémica. Menos frecuentemente, la insuficiencia mitral secundaria es el resultado de una dilatación auricular izquierda con dilatación del anillo mitral, en general resultado de una fibrilación auricular crónica, o de otras cardiomiopatías. En cualquier caso, el mecanismo de la insuficiencia mitral isquémica es Tipo IIIb de Carpentier, esto es, restricción al cierre de la válvula mitral, por desplazamiento de los músculos papilares por disfunción parietal y dilatación de la porción posterior del anillo mitral11,12.
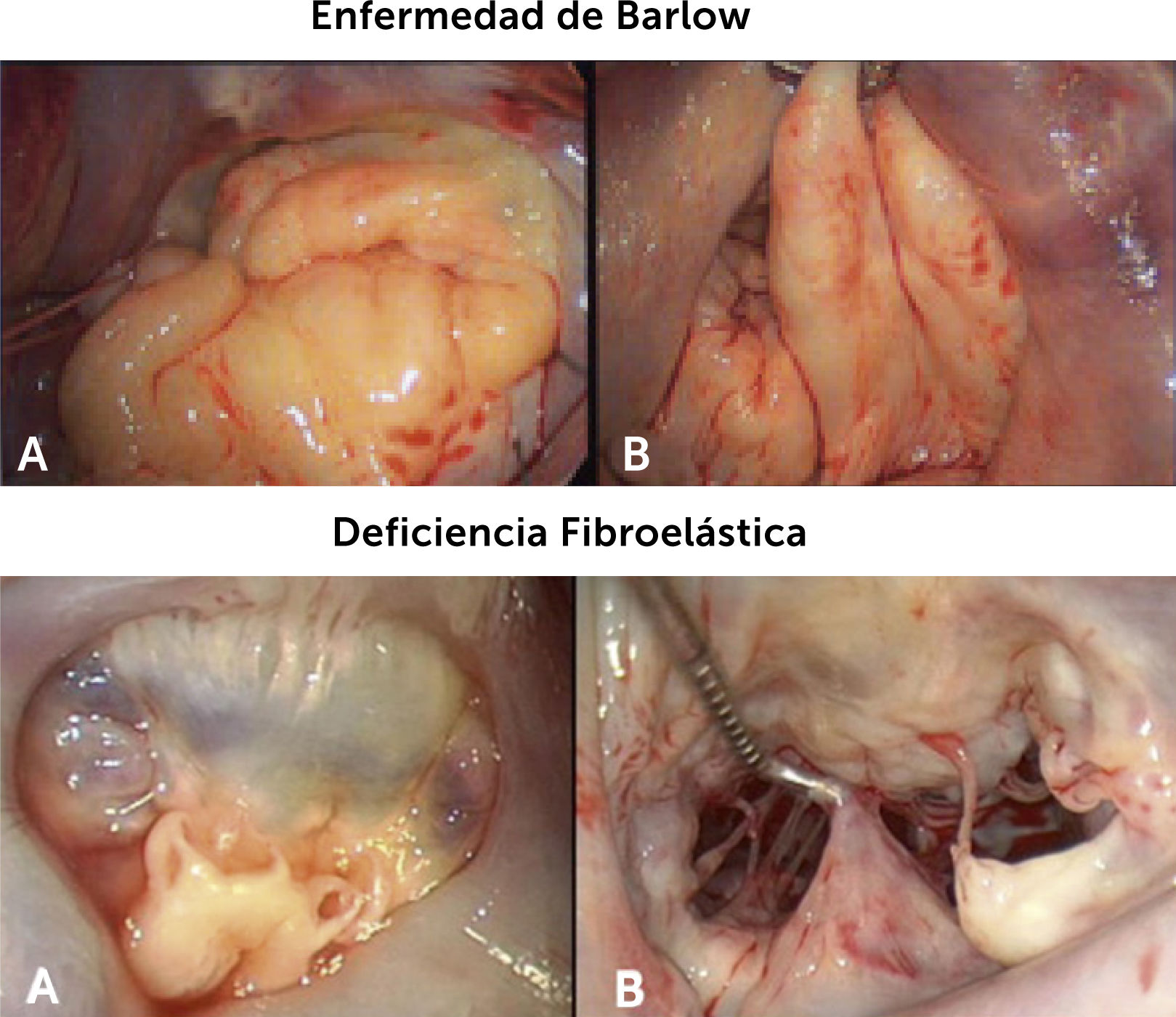
La Tabla 1 resume las principales diferencias entre las dos formas más frecuentes de valvulopatía mitral degenerativa, la enfermedad de Barlow y la deficiencia fibroelástica, y la Fig. 2 corresponde a fotografías intraoperatorias de las mismas, las que ilustran visualmente muy bien estas diferencias.
Comparación entre las dos principales formas de valvulopatía mitral degenerativa o mixomatosa
| Valvulopatía mitral degenerativa | |
|---|---|
| Enfermedad de Barlow | Deficiencia fibroelástica |
| Edad al diagnóstico <50 años | Edad al diagnóstico >50 años |
| Largo intervalo entre diagnóstico y cirugía | Corto intervalo entre diagnóstico y cirugía |
| Velos gruesos con tejido redundante | Poco tejido redundante excepto en segmento prolapsante |
| Típicamente cuerdas alargadas, a veces rotas | Típicamente una sola cuerda rota |
| Válvulas muy “grandes” | Válvulas de tamaño “normal” |
Dos principales formas de valvulopatía mitral degenerativa. Fotografías intraoperatorias de las dos principales formas de valvulopatía mitral degenerativa. Se observa la redundancia de tejido de la Enfermedad de Barlow, con compromiso de toda la válvula y lo limitado del proceso anatómico de la deficiencia fibroelástica, en este caso circunscrito a los segmentos medio y posterior del velo mitral posterior10.
En la insuficiencia mitral isquémica es importante diferenciar la insuficiencia mitral por enfermedad coronaria de la insuficiencia mitral concomitante con enfermedad coronaria, ya que la mortalidad operatoria y el pronóstico alejado es mucho peor en la primera situación13. Igualmente, la rotura de músculo papilar es una forma de insuficiencia mitral primaria o valvular, aunque su etiología sea isquémica14.
4.2La lesiónLas diferentes etiologías pueden producir una o más lesión a las distintas estructuras del aparato valvular mitral5,9.
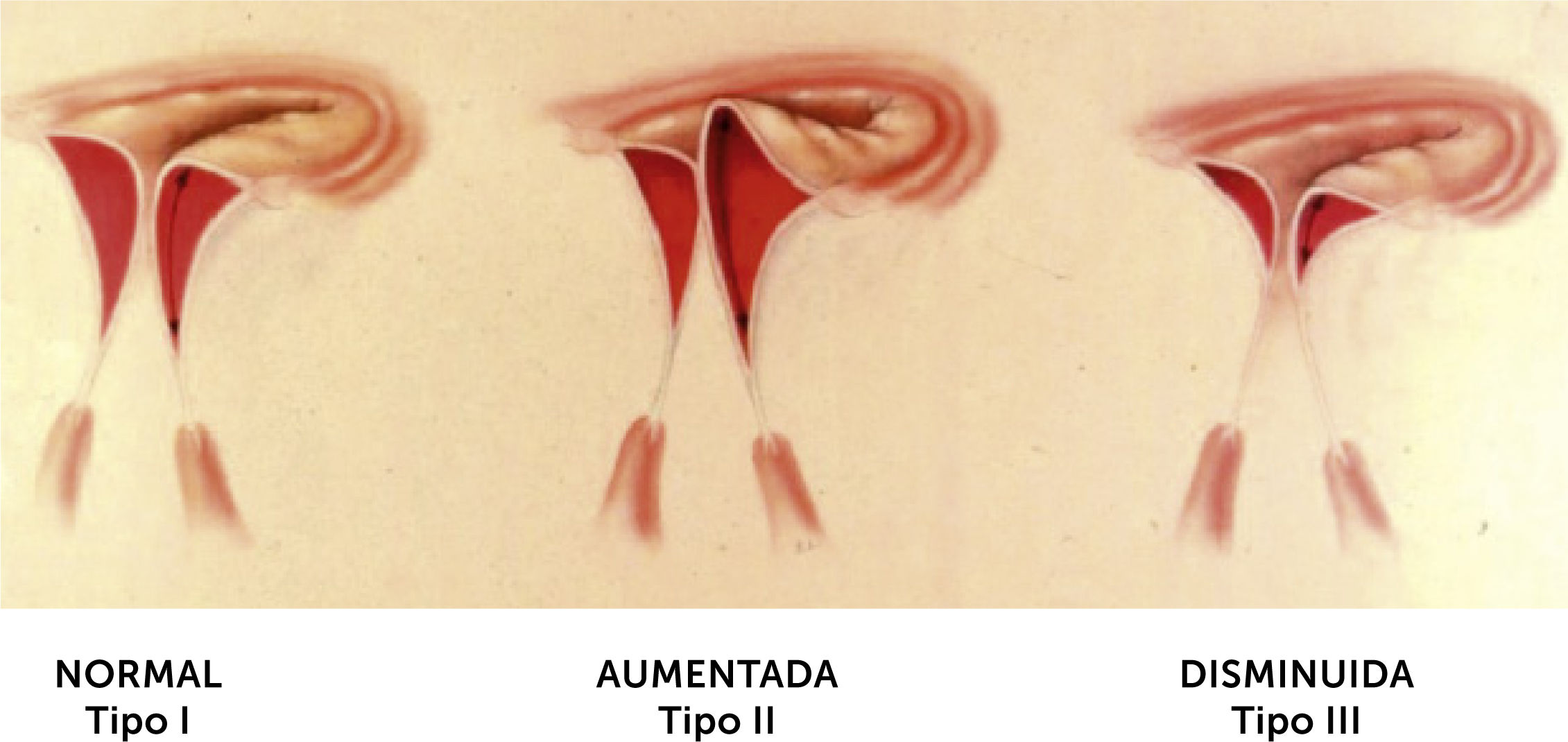
4.3La disfunciónLa o las lesiones, a su vez, pueden producir variados grados y tipos de disfunción valvular, que es lo que al final va a determinar la gravedad de la enfermedad valvular, en la que ya la simple clasificación anatomopatológica en estenosis o regurgitación mitral o la combinación de ambas, no basta para definir la terapia. Por esto, a fines de los años 70 Carpentier introdujo una “clasificación funcional” de la valvulopatía mitral basada en el análisis de la movilidad de los velos mitrales, determinada ecocardiográficamente en el preoperatorio en la actualidad -, y por la visión directa intraoperatoria del cirujano5,9. Así, Carpentier definió tres tipos de disfunción valvular: movilidad normal (Tipo I), movilidad aumentada (Tipo II) y movilidad restringida (Tipo III), de los velos mitrales (Fig. 3). Esta última, a su vez, puede ocurrir principalmente durante la apertura valvular (Tipo IIIa) o durante el cierre (Tipo IIIb).
El Tipo I puede ser el resultado de la perforación de un velo, habitualmente por endocarditis, o por una dilatación del anillo, con falta de coaptación de los velos, produciendo en ambos casos una regurgitación mitral.
El Tipo II, o prolapso mitral, puede ser consecuencia de un alargamiento o rotura de cuerda tendínea o de un alargamiento o rotura de músculo papilar, originando también una insuficiencia mitral.
El Tipo III, puede resultar en estenosis e insuficiencia en el subgrupo IIIa, con restricción a la apertura y cierre, o en regurgitación en su variante IIIb, con restricción solo al cierre mitral.
Esta clasificación funcional no solo permite evaluar las consecuencias hemodinámicas de las lesiones valvulares, en las que se basará, al menos en parte, la indicación operatoria, sino que, en especial, orientará con respecto a la probabilidad de reparación valvular.
Asimismo, a partir de esta definición funcional de la insuficiencia mitral, Carpentier diseñó diferentes procedimientos quirúrgicos para la corrección de esta, los que, con algunas variaciones, mantienen plena vigencia en la actualidad.
4.4Las técnicas quirúrgicas reconstructivasEstas pueden ser agrupadas en cinco técnicas básicas15:
1. Resección cuadrangular o cuadrilateral. Es el procedimiento quirúrgico básico y tiene su máxima y más efectiva aplicación en el prolapso de la porción media del velo posterior, habitualmente secundario a la deficiencia fibroelástica. Últimamente existe una tendencia, basada en el principio muy en boga de “respetar, no resecar”, de efectuar una resección más bien “triangular”. El principal inconveniente de esto último es que con frecuencia la sutura del velo queda bajo tensión, con lo que pierde flexibilidad y disminuye el área de coaptación, lo que a su vez puede comprometer la estabilidad alejada del procedimiento.
2. Deslizamiento del velo posterior. Complementario a la resección cuadrangular, en la que el remanente del velo posterior es desprendido del anillo mitral posterior y luego es resuturado a este deslizando el tejido remanente para cerrar la brecha en el velo posterior, dejada por la resección cuadrangular. Su mayor aplicación es en la enfermedad de Barlow.
3. Cuerdas artificiales. Para esto se utilizan puntos de sutura de Gore-Tex® para reemplazar cuerdas tendíneas rotas o alargadas. La principal dificultad es definir el largo de estas cuerdas con el corazón detenido y flácido, por los que existen tantas técnicas como cirujanos que la utilizan. Carpentier no favorece este procedimiento, prefiriendo la transferencia de cuerdas tendíneas nativas, primarias o secundarias, criterio que compartimos.
4. Comisuroplastia. Consiste en el cierre, parcial o total, de una comisura prolapsante o abierta con puntos separados invaginantes, de manera de reconstruirla.
5. Anuloplastia. Existe para esto una gran variedad de anillos protésicos ofrecidos por la industria. Su uso fue introducido por Carpentier quien conceptualizó y desarrollo el anillo “remodelante” o de “remodelación”, el cual persigue restaurar la normal configuración y tamaño sistólico del anillo mitral, para conseguir una óptima coaptación de los velos, a la vez que prevenir futuras deformaciones. Esto, necesariamente, implica un anillo completo semirrígido. Es importante tener presente que en la insuficiencia mitral primaria la anuloplastia es un complemento de la reparación; por el contrario, en la insuficiencia mitral secundaria, la anuloplastia es “la” reparación.
La apropiada selección del tamaño del anillo protésico, basada en el área del velo mitral anterior, es crucial para el éxito de una reparación mitral. La Fig. 4 muestra distintos tipos de anillos mitrales protésicos fabricados para las distintas etiologías y tipo de disfunción de la insuficiencia mitral, de acuerdo a los conceptos introducidos por Carpentier.
Anillos protésicos mitrales. Anillos protésicos mitrales Edwards Lifesciences®, Irvine, California, en concordancia con los principios de Carpentier. El anillo Classic fue el primer anillo diseñado por Alain Carpentier y utilizado principalmente en la valvulopatía reumática. El anillo Physio-Ring® fue diseñado por este para la insuficiencia mitral degenerativa o mixomatosa; posteriormente este anillo se rediseñó aumentando el diámetro anteroposterior y con un formato en “silla de montar”, con el nombre de Physio-Ring II® y es el más utilizado en la actualidad. El anillo Myxo-ETlogix® fue diseñado con este mismo propósito, pero no tuvo aceptación, al igual que el anillo GeoForm® para la insuficiencia mitral ventricular. El anillo Carpentier-McCarthy-Adams® fue diseñado por estos para la insuficiencia mitral isquémica e incluye ya una sobre reducción del anillo mitral. El anillo Cosgrove® es en la práctica una “banda” posterior y si bien tuvo en su momento una gran aceptación, ya que supuestamente preservaba la flexibilidad del anillo mitral nativo, esta fue menguando progresivamente, puesto que no cumple con una premisa básica de la anuloplastía, cual es remodelar el anillo mitral dilatado a su forma nativa, que se asemeja a un riñón.
Si bien la ecocardiografía transtorácica permite una adecuada evaluación del paciente con insuficiencia mitral en la mayoría de los casos, la ecocardiografía transesofágica, en especial tridimensional, la que ofrece una “visión del cirujano”, es fundamental para la decisión quirúrgica, permitiendo al cirujano una mejor comprensión preoperatoria de la anatomía de la válvula mitral, lo que a su vez permite predecir la probabilidad de reparar la válvula y planificar mejor el tipo de procedimiento a efectuar. Igualmente, la ecocardiografía transesofágica intraoperatoria post circulación extracorpórea, en condiciones hemodinámicas adecuadas, es fundamental para evaluar la calidad de la reparación y la magnitud de una eventual regurgitación residual12.
Cirugía reconstructiva de la insuficiencia mitral degenerativa La historia natural de la insuficiencia mitral degenerativa está condicionada por la severidad de la lesión anatómica, la sintomatología, la presencia de disfunción ventricular izquierda y si esta es corregible por un procedimiento reconstructivo en lugar de un reemplazo valvular12.
La indicación quirúrgica es categórica cuándo comienzan los síntomas, esto es, disnea de esfuerzo, ortopnea y/o intolerancia al ejercicio, aunque la función ventricular izquierda este conservada. Sin embargo, la regurgitación mitral puede ir empeorando paulatina y solapadamente y llevar a disfunción ventricular en ausencia de síntomas y signos12. La Clínica Mayo demostró que en un seguimiento a 10 años la mortalidad total fue de 53±5%, la mortalidad cardíaca 43±5% y la muerte súbita 19±4% para pacientes con insuficiencia mitral degenerativa severa no operados16. Por otra parte, la sobrevida a 10 años de los pacientes operados en capacidad funcional I-II fue 76±5% versus 48±4% cuándo lo eran en III-IV17. Finalmente, la misma Clínica Mayo demostró que la supervivencia a 10 años para los pacientes con reparación mitral fue 68±6%, igual a la esperada para una población normal, pero para los con reemplazo mitral fue 52±4%18. En la experiencia del autor, la supervivencia a 10 años fue 82±6% para la reparación versus 54±11% para el reemplazo mitral19.
Así, el objetivo terapéutico en la insuficiencia mitral degenerativa es corregirla antes que comience a fallar el ventrículo izquierdo, lo que va a definir el pronóstico alejado del paciente. La insuficiencia mitral primaria es un problema mecánico que requiere una solución mecánica, lo que en la actualidad implica una intervención quirúrgica. Esta debiera llevarse a cabo cuándo el ventrículo izquierdo se “acerca” a una disfunción sistólica, esto es, una fracción de eyección =60% o un diámetro de fin de sístole =40mm, idealmente efectuando una reparación, o en caso contrario, un reemplazo mitral protésico, de acuerdo con las guías clínicas American Heart Association/American College of Cardiology (AHA/ACC) 202012. Estas mismas guías recomiendan para el paciente con insuficiencia mitral severa, asintomática, con función ventricular izquierda normal, la intervención quirúrgica si la mortalidad operatoria esperada es <1% con una probabilidad de efectuar una reparación exitosa y estable a largo plazo >95%. Finalmente, las guías recomiendan una intervención percutánea tipo Mitraclip® solo en pacientes de riesgo quirúrgico elevado o prohibitivo.
En la experiencia del autor de más de 20 años de cirugía reparadora de la insuficiencia mitral degenerativa, la mortalidad operatoria para pacientes con reparación mitral exclusiva fue 0,8% y la probabilidad de éxito de esta fue 97,5%. La supervivencia global a 10 y 20 años fue 78% y 50% y la supervivencia libre de muerte cardíaca fue 89% y 70%, respectivamente. En el 75% de los pacientes se completó un seguimiento ecocardiográfico alejado; el 84% de los casos no tenía insuficiencia mitral o esta era leve (1+). Tres pacientes (2,5%) requirieron una reoperación valvular mitral20.
Cirugía reconstructiva de la insuficiencia mitral isquémica La reparación valvular en la insuficiencia mitral secundaria o ventricular isquémica consiste básicamente en una anuloplastia con un anillo completo y rígido, de manera de no solo disminuir el perímetro del anillo mitral, sino más bien remodelar este anillo, reduciendo mayormente el diámetro anteroposterior para obtener una mayor área de coaptación de los velos mitrales, estable en el tiempo. Para esto, debe efectuarse una “sobre reducción” del anillo mitral nativo, utilizando anillos protésicos uno o dos números inferiores al medido. En la actualidad existen anillos protésicos que ya incorporan esta sobre-reducción5,12,21,22 (Fig. 4).
Los resultados de la cirugía mitral reconstructiva en la insuficiencia mitral isquémica son definitivamente inferiores a los de la insuficiencia mitral degenerativa5,12,13. La Fig. 5 grafica la experiencia del autor a 20 años de seguimiento, comparando la supervivencia alejada entre la insuficiencia mitral degenerativa y la isquémica, siendo la probabilidad de estar vivo a 10 y 20 años significativamente mejor para la primera, lo que demuestra, además, indirectamente, que el factor determinante de la supervivencia en la segunda es la función ventricular izquierda23.
Análisis de supervivencia a 20 años posterior a cirugía de reparación mitral según etiología de insuficiencia mitral. Análisis de supervivencia a 20 años posterior a cirugía de reparación mitral según etiología de insuficiencia mitral, estimada por el método de Kaplan-Meier en base a la experiencia de Zalaquett R. et al.23.
Por esto, en la insuficiencia mitral isquémica hay 3 grandes preguntas para las cuales no hay 3 grandes respuestas: ¿Sólo revascularizar? ¿Anuloplastia mitral? ¿Reemplazo mitral?
La Cardiothoracic Surgical Trials Network (CTSN) llevó a cabo recientemente un estudio multicéntrico y aleatorio comparando la revascularización miocárdica exclusiva con la reparación mitral asociada a la revascularización en 301 pacientes con insuficiencia mitral isquémica “moderada”24. A dos años no se encontró diferencia en remodelamiento reverso del ventrículo izquierdo, pero los pacientes con revascularización exclusiva presentaron 3 veces más insuficiencia mitral residual moderada o severa que los pacientes con anuloplastia asociada (32,3% vs 11,2%, p<0,001), pero esto no significó una mejoría en la supervivencia ni una reducción en la incidencia de efectos adversos ni rehospitalizaciones. (Es difícil predecir si esto se mantendrá a más largo plazo).
La misma CTSN llevó a cabo un estudio similar en 251 pacientes con insuficiencia mitral isquémica, ahora “severa”, comparando la reparación versus el reemplazo mitral, no encontrando nuevamente diferencias significativas en cuánto a remodelamiento ventricular izquierdo reverso o sobrevida a dos años. Sin embargo, la recurrencia de insuficiencia mitral moderada o severa fue significativamente mayor para la reparación que para el reemplazo mitral (58,8% vs 3,8%, p<0,001) lo que se tradujo en una mayor incidencia de eventos adversos secundarios a insuficiencia cardíaca y rehospitalizaciones25.
Basados en la experiencia del autor, consideramos solo revascularizar en insuficiencia mitral leve, cuándo el aparato valvular mitral no está eco cardiográficamente traccionado y/o cuándo se espera reversibilidad del daño miocárdico. Asociamos la anuloplastía a la revascularización en insuficiencia mitral moderada y en la que se observa eco cardiográficamente una tracción igualmente moderada del aparato valvular, y cuándo se espera reversibilidad del daño miocárdico o este está ya establecido. En insuficiencia mitral severa procedemos al recambio mitral con conservación del velo posterior, con prótesis mecánica o biológica, según corresponda.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.