La insuficiencia tricúspidea (IT) es la lesión mas frecuente encontrada en la válvula. La IT leve es común y generalmente benigna. Sin embargo, la IT moderada y/o severa puede llevar a daño miocárdico irreversible y resultados adversos. A pesar de esto, pocos pacientes con IT significativa llegan a ser operados para corregir el defecto, aun habiéndose demostrado ser incorrecto que la resolución de la IT funcional ocurre por si sola una vez que se trata en forma exitosa la causa de base. El tratamiento de la IT secundaria o funcional permenece controversial debido a las altas tasas de IT residual o recurrencia después de la cirugía. Esta revisión pretende clarificar el manejo de la IT describiendo la anatomía, fisiopatología, diagnóstico, y tratamiento quirúrgico, incluyendo la terapia percutanea.
Tricuspid regurgitation (TR) is a manifestation of valvular heart disease due to the primary involvement of the valve or secondary to pulmonary hypertension or to the leftsided heart valve disease. The pathophysiology of secondary TR is complex and is intrinsically connected to the anatomy and function of the right ventricle. A better approach to diagnosis and assessment based on the severity of the TR, annular size, RV function and degree of pulmonary hypertension is needed. Nowadays, treatment of secondary TR is currently an essential concomitant procedure at the time of mitral surgery. Although the indications for surgical management of severe TR are now generally accepted, controversy persists related to the role of intervention for moderate TR. However, there is a trend in this setting, especially at the time of surgery for leftsided heart valve disease with significant tricuspid annular dilatation. Surgery remains the best approach for treatment of TR. Percutaneous tricuspid valve intervention but may become a reliable option in future, especially for high-risk patients with isolated primary TR or with secondary TR related to advanced left-sided heart valve disease.
La insuficiencia tricuspídea (IT) es una de las manifestaciones más comunes de las enfermedades valvulares cardíacas y pue- de afectar al 65-85% de la población1,2. Aunque una IT mínima o leve puede ser una variante normal en válvulas estructuralmente normales, una IT moderada a severa es generalmente patológica, producto de anormalidades en los velos y/o dilatación anular3. Las cifras de IT leves para hombres en los distintos grupos van de 9 a 13% en los menores de 60 años y de 21,9 a 25,8% en los ma- yores de 60 años, mientras que las de IT moderadas varían entre 0 a 0,3% y 0 a 1,5% respectivamente. Algo similar ocurre con las mujeres. Por tanto, el 65 a 85% está dado fundamentalmente por el hallazgo de “evidencias” de IT, lo cual se puede considerar como una imperfección normal del ser humano.
La IT primaria (orgánica) se debe a patología del aparato val- vular tricúspide debido a enfermedad reumática, degenerativa, congénita, infecciosa, traumáticaa o iatrogénicaa (secundaria a cables de marcapasos). La IT secundaria (o funcional) es por lejos más común y está relacionada a dilatación del ventrículo derecho (VD) y/o disfunción, dilatación anular y tracción de velos que, a su vez, son generalmente debido a enfermedad valvular izquierda, especialmente de la válvula mitral, fibrilación auricular o hipertensión pulmonar (HTP)4–6.
Históricamente, la IT funcional fue tratada en forma conservadora sin cirugía, basado en la idea errada de que mejoraría después de la corrección de la valvulopatía primaria izquierda. Sin embar- go, estudios recientes han demostrado que la IT progresa en un número significativo de pacientes a pesar de una cirugía exitosa sobre la válvula izquierda7. Más aún, la sobrecarga crónica del VD se asocia con el desarrollo de disfunción ventricular irreversible, cuyo pronóstico está relacionado con la severidad de la IT. Como consecuencia la reparación de la válvula tricúspide (VT) ha ganado importancia y aceptación en años recientes2.
El momento óptimo de la cirugía de la IT sigue siendo contro- vertido y la operación es efectuada en etapas tardías debido a que muchos pacientes permanecen asintomáticos a pesar de una función alterada del VD, o tienen un alto riesgo quirúrgico debi- do a comorbilidades y edad avanzada2–5. Otro hecho importante a considerar está relacionado a las diferentes técnicas de cirugía sobre la VT, ya que diferentes métodos de reparación han sido propuestos; y últimamente, varios abordajes percutáneos se han desarrollado en pacientes de alto riesgo6,7.
Las guías internacionales de la European Society of Cardiology (ESC) y la American Heart Association (AHA/ACC) contienen recomenda- ciones sobre el diagnóstico y tratamiento de la IT 8,9.
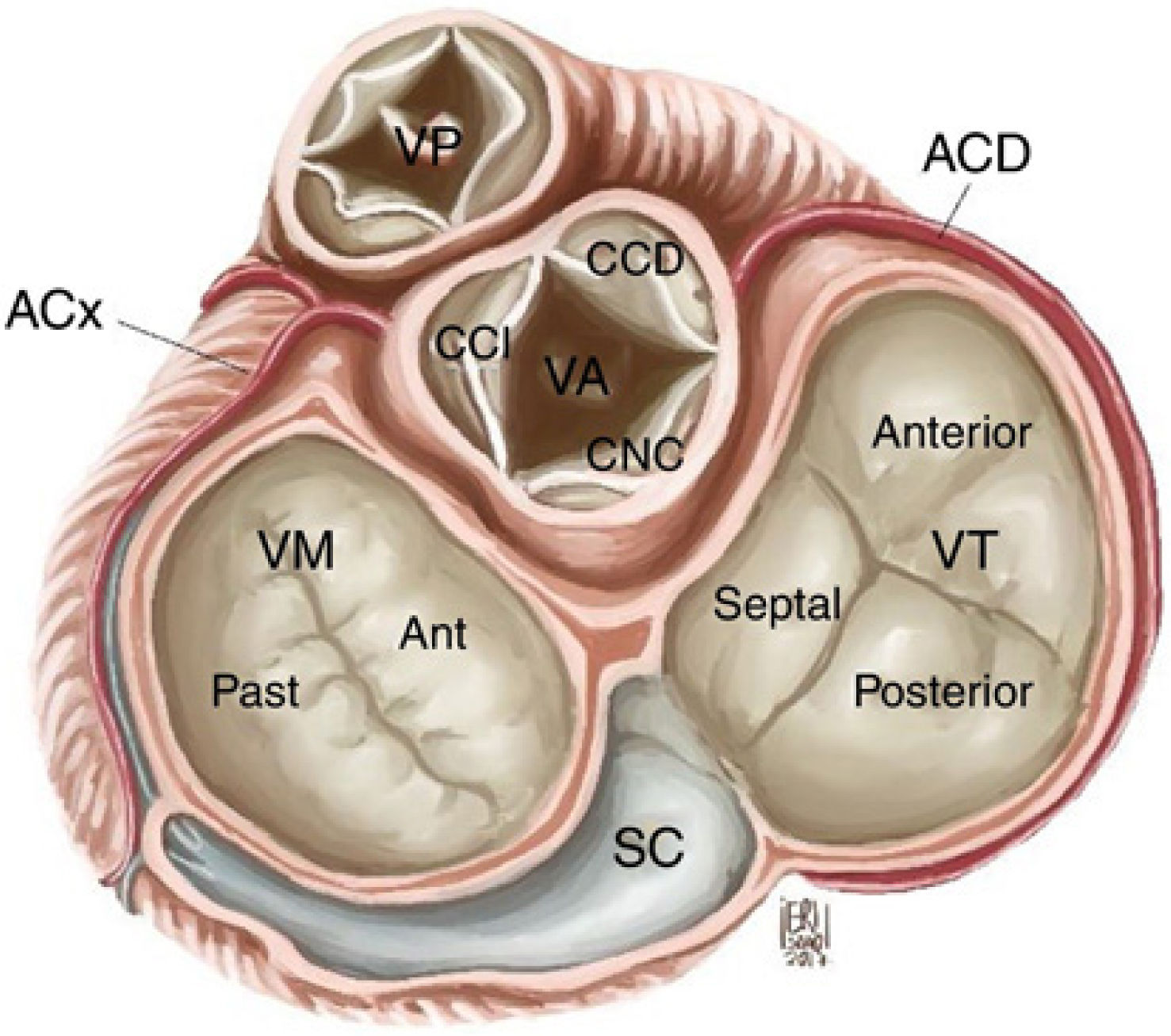
2Anatomía y Función de La Válvula Tricúspide (VT)La VT separa la aurícula y ventrículo derecho y está compuesta de 3 velos: anterior, posterior y septal como también de un anillo fibroso parcial, que es parte del esqueleto fibroso del corazón (Fi- gura 1)10. Ocasionalmente, pueden existir velos accesorios. Cada velo está relacionado con su músculo papilar homónimo, aunque el músculo papilar septal a menudo no existe y es reemplazado por pequeñas cabezas musculares que nacen directamente del septum interventricular. La función valvular es compleja e incluye cuerdas tendinosas, músculos papilares, la aurícula y el VD11.
Anatomía de la válvula tricúspide y relación con estructuras cardíacas. VT: válvula tricúspide, VM: válvula mitral, VA: válvula aórtica, VP: válvula pulmonar, SC: seno coronario, CCI: cúspide coronariana izquierda, CCD: cúspide coronariana derecha, CNC: cúspide no coronariana, ACx: arteria circunfleja, ACD: arteria coronaria derecha. Salazar G, Gelves J.10.
El anillo tricuspídeo tiene una forma tridimensional elíptica en individuos sanos. La porción posteroseptal es más baja y desviada hacia el ápex del VD, mientras que la porción anteroseptal es más alta y cercana al tracto de salida del VD y la válvula aórtica. La forma y tamaño del anillo cambia durante el ciclo cardíaco. En la IT funcional, el anillo se vuelve plano, dilatándose en dirección a la comisura anteroposterior resultando en una forma más circular, la porción septal es parte del esqueleto fibroso y tiene poca varia- ción12 (Fig. 2)10. Mientras más severa es la IT, el anillo se vuelve más plano y circular. La IT progresiva produce mayor dilatación del VD, la que como consecuencia produce falla ventricular de- recha. La VT está muy relacionada a dos estructuras importantes que pueden ser lesionadas durante la intervención. El haz de His cruza el segmento septal del anillo tricuspídeo aproximadamente a 5mm de la comisura anteroseptal. En ese punto, el haz penetra posteriormente debajo del septum membranoso hasta alcanzar la cresta del septum muscular. De igual importancia, la arteria co- ronaria derecha corre en el surco atrioventricular derecho, a esca- sos milímetros del segmento descendente del anillo tricuspídeo.
Estructura del anillo tricúspide y su comportamiento durante el ciclo cardíaco. Salazar G, Gelves J.10.
La IT puede ser consecuencia de patología primaria (orgánica) de los velos valvulares o comúnmente, una consecuencia secundaria de la dilatación del VD y anillo tricuspídeo en el contexto de HTP y falla VD13.
4Insuficiencia Tricuspídea PrimariaA nivel mundial la enfermedad reumática permanece como la causa más frecuente de enfermedad primaria de la VT, con la consiguiente cicatrización y retracción de los velos y/o cuerdas con restricción de la movilidad. Es frecuente encontrar lesiones combinadas con estenosis e insuficiencia de grado variable en severidad en asociación a lesiones de la válvula mitral, mientras que la estenosis tricuspídea aislada o pura es rara. El anillo por lo general se encuentra dilatado14.
La insuficiencia tricuspídea (IT) puede ser de etiología congénita, ya sea como una lesión aislada o en asociación con defectos tipo canal atrioventricular, aneurismas del septum o como compo- nente de la anomalía de Ebstein. El prolapso de la VT como re- sultado de degeneración mixomatosa es relativamente poco fre- cuente y a menudo asociada con cambios similares en la válvula mitral y defectos del septum atrial.
La IT primaria es una manifestación común del síndrome carci- noide, en el que placas carcinoides fibrosas se desarrollan en el endocardio de las cúspides valvulares, cámaras cardíacas y en la íntima de la grandes venas y seno coronario, con mayor compro- miso de la superficie ventricular de la válvula, resultando en ad- herencias de los velos a la pared libre ventricular15.
Otra causa adquirida común de IT primaria es la endocarditis (frecuentemente visto en adictos a drogas intravenosas con infección estafilocócica o en pacientes con cables de marca- paso16,17. Causas más raras incluyen drogas, mixoma cardíaco, fibrosis endomiocárdica y lupus eritematoso sistémico. Finalmente, el trauma directo o no-penetrante no es una causa in- frecuente de IT.
5Insuficiencia Tricuspídea SecundariaEsta forma más prevalente puede verse en pacientes con sobre- carga de presión del VD secundaria a cualquier enfermedad car- díaca o vascular pulmonar y refleja la presencia y severidad de la falla del VD. Las causas más frecuentes son patologías valvu- lares izquierdas, particularmente mitral pero también aórticas, hipertensión pulmonar primaria o secundaria, fibrilación atrial persistente con dilatación anular tricuspídea, isquemia del VD y cardiomiopatía.
La IT secundaria es comúnmente asociada con patologías valvu- lares reumáticas, como también debido a enfermedad mitral is- quémica y degenerativa como consecuencia de HTP y sobrecarga de volumen VD18. La fibrilación atrial persistente puede también llevar a IT secundaria a dilatación anular19.
En la Tabla 1 se muestra la clasificación de la insuficiencia tricus- pídea según su etiología.
Clasificación de la insuficiencia tricuspídea según su etiología.
| Primaria | Secundaria |
|---|---|
| Endocarditis infecciosa | Dilatación del VD |
| Traumatismos | Disfunción del VD |
| Enf. reumática | Hipertensión pulmonar |
| Enf. congénita (enf. Ebstein) | Dispositivos implantables |
| Enf. degenerativa | Fibrilación auricular |
| Sínd. carcinoide | |
| Tumores | |
| Iatrogenia | |
| Toxicidad |
VD: ventrículo derecho.
La relación entre IT y el VD es compleja y varía según el grado y el mecanismo de la insuficiencia. La IT primaria produce sobrecarga de volumen en cavidades derechas inicialmente normales3. Por otra parte, el crecimiento del VD es la mayor causa de IT secunda- ria, a través de la dilatación anular y tracción valvular20. La severi- dad de IT funcional y dilatación VD está altamente correlacionada con la presencia de tracción de los velos, y la dilatación anular es secundaria a la dilatación del VD.
El crecimiento del VD a menudo es la consecuencia del aumento en la postcarga debido a HTP, de tipo post capilar definida como>15mmHg, lo que refleja presiones de llenado izquierdo aumen- tadas. La HTP precapilar, definida como ≥15mmHg con resisten- cia vascular pulmonar >3 unidades Wood, es debida a enfermedades pulmonares intrínsecas o tromboembolismo pulmonar18–20.
Como el VD tiene menor masa muscular que el VI, la función sis- tólica es más sensible a la sobrecarga; de esta forma, la HTP lleva a una falla precoz en la fracción de eyección del VD lo que está asociado a crecimiento ventricular21. La sobrecarga de presión inicial rápidamente se traduce en una sobrecarga mixta de pre- sión y volumen, dilatación ventricular progresiva e IT secundaria, creando un círculo vicioso ya que la IT contribuye por si misma al crecimiento ventricular posterior, aumentando así la severidad de la IT20,21. Con menos frecuencia, la IT secundaria puede deberse a crecimiento del VD sin aumento en la postcarga (forma idiopática). La severidad de la IT secundaria y sus consecuencias en el VD pueden ser reversibles particularmente en casos de valvulopatías izquierdas22. Sin embargo, la disfunción VD puede ser irrever- sible, donde una alteración inicial de la función es un predictor independiente potente de sobrevida23, al igual que volúmenes aumentados de VD en IT aislada24. El crecimiento VD es también responsable de complejas interacciones con el VI, cuya alteración puede por sí misma producir reducción del volumen sistólico25.
Algunos pacientes con falla cardíaca y fracción de eyección pre- servada pueden tener disfunción diastólica, fibrilación atrial y grados variables de IT, lo que tiene un impacto pronóstico inde- pendiente26. Por último, el síndrome de restricción-dilatación se produce cuando la función sistólica cae; la presión diastólica au- menta y el septum interventricular se mueve hacia el VI durante la sístole, lo que aumenta la presión diastólica del VI y perpetúa la IT19,27 (Fig. 3)6.
Anatomía de la válvula tricuspídea. Anatomía de la válvula tricuspídea (A) y del anillo tricuspídeo normal (C, izquierda) con su punto alto situado en dirección anteroposterior y su punto más bajo en situación mediolateral. En pacientes con insuficiencia tricuspídea funcional, el anillo se torna más plano (C, derecha) dilatándose su diámetro anteroposterior (B). A: anterior P: posterior AD: aurícula derecha IT: insuficiencia tricuspídea. Tornos Mas P, et al.
La IT generalmente es clínicamente silente y los síntomas están re- lacionados con valvulopatías izquierdas concomitantes, pudiendo existir cansancio y disminución en la capacidad de ejercicio debido a reducción del gasto cardíaco; esto acompañado de congestión hepática y edema de extremidades, distensión yugular sistólica y hepatomegalia pulsátil. En casos avanzados se observan ascitis, falla hepática y caquexia. La IT primaria evoluciona lentamente y está aso- ciada con un exceso de mortalidad en comparación con la población general. La incidencia a 10 años de disnea o insuficiencia cardíaca congestiva se estima en 60% en pacientes asintomáticos y están fuertemente relacionados al crecimiento del VD28. La disfunción del VD, severidad de la IT e HTP son factores predictivos de sobrevida29–31.
La IT secundaria está frecuentemente asociada con valvulopatías izquierdas, lo que es el factor pronóstico más importante, siendo proporcional al grado de severidad incluso al ajustar por función ventricular y presión pulmonar32. Su evolución es impredecible, puede mejorar después de la cirugía sobre válvulas izquierdas, pero también, puede persistir e incluso empeorar, y una IT tardía se asocia con una disminución en la sobrevida33–35. La IT secundaria aislada es menos frecuente y el pronóstico depende de la severidad de la insu- ficiencia: 38% vs 70% a 10 años en casos severos22.
8Evaluación de La Válvula Tricúspide (VT)Los objetivos del diagnóstico por imagen en la IT son la determinación de la severidad, etiología y consecuencias, analizando el tamaño y fun- ción del VD, dimensión y presión de la arteria pulmonar, la detección de patología valvular izquierda concomitante y la evaluación de una válvula protésica. La ecocardiografía es la modalidad principal en la de- terminación de la morfología valvular y la severidad de IT. La evaluación con imágenes 3D es una herramienta muy útil, ya que permite evaluar en forma simultánea los 3 velos y comisuras36.
Es frecuente encontrar IT trivial/leve o IT fisiológica en población normal, la que se caracteriza por morfología normal de los velos y un jet central fino adyacente al cierre valvular36. La IT secundaria es consecuencia de la dilatación anular y tracción de velos, parámetros que son útiles para predecir IT. La evaluación 2D del diámetro anular subestima el tamaño debido a su forma elíptica. En adultos, el diá- metro anular normal es 28±5mm en visión de 4 cámaras en diás- tole. Las guías actuales del European Society of Cardiology/European Association for Cardio-Thoracic Surgery (ESC/EACTS, por sus siglas en inglés)37 sugieren un diámetro ≥40mm (>21mm/m2) como un in- dicador de consenso para cirugía38, pero este no tiene respaldo de evidencia tipo A y ha sido cuestionado por otros autores39.
El desplazamiento apical de los velos (tethering) es evaluado mi- diendo el área entre la superficie atrial de los velos y el plano anular a máximo cierre sistólico (tenting area) y la distancia de coaptación en visión de 4 cámaras36. Un área >1 cm2 y una profundidad de coaptación <8mm se asocian con IT severa40. (Tabla 2)10. La reso- nancia magnética cardíaca (CMR, por sus siglas en inglés) provee información complementaria, incluyendo cálculo del volumen y fracción regurgitante y gradiente transvalvular41. El orificio regur- gitante se estima por imágenes calculando el volumen sistólico del VD y el flujo pulmonar. Si la IT es la única lesión valvular, la diferencia entre volumen sistólico izquierdo y derecho se puede utilizar para estimar el volumen regurgitante41.
Evaluación ecocardiográfica de la insuficiencia tricúspide10
| Leve | Moderada | Severa | Observaciones | |
|---|---|---|---|---|
| Parámetros cualitativos | ||||
| Morfología de la válvula | Normal o anormal | Normal o anormal | Anormal, con flail o amplio defecto de coaptación | Evaluar en múltiples vistas de ECO transtorácico. No es específico para determinar severidad de la insuficiencia tricúspide. |
| Jet en doppler color | Pequeño y central | Intermedio | Gran jet central o muy excéntrico con efecto coanda | Nyquist entre 50-60cm/s, optimizar ganancia de color, al menos en dos vistas, tener en cuenta presión arterial. Solo ayuda para leves o severas. Inexacto, influenciado por técnica y hemodinamia. |
| Señal del doppler continuo (CW) | Débil/parabólico | Denso/parabólico | Denso, triangular con pico temprano. En insuficiencia tricúspide masiva la V esmáxmenor a 2m/s | En apical de 4 cámaras (donde mejor esté orientado). Difícil evaluar en jets muy excéntricos. |
| Parámetros semicuantitativos | ||||
| Ancho de la vena contracta | No definido | Menor a 7mm | Mayor o igual a 7mm Esp: 93,3%Sens: 88,5% | Apical de 4 cámaras. Nyquist 50-60cm/s. Identificar los 3 componentes del jet. Disminuir al máximo el sector del color y la profundidad. Hacerlo en zoom. Es el mejor parámetro para definir severidad y pronóstico. No válido para múltiples jets. Bueno en los extremos |
| Radio del PISA | Menor o igual a 5mm | 6–9mm | 10mm o más | Línea de base del Nyquist en 28cm/s. En mesosístole usando el primer aliasing. |
| Flujo venoso hepático | Dominancia sistólica | Atenuado en sístole | Flujo sistólico reverso Esp: 93%,Sens: 80% | Se toma en plano subcostal con PW dentro de la vena hepática, La FA y altas presiones de la AD atenúan su señal. |
| Flujo de entrada tricúspide | Normal | Normal | Onda E dominante de más de 1m/s | En apical de 4 cámaras, PW a nivel de las puntas de las valvas. Alterado en presiones altas de la AD y en FA. |
| Parámetros cuantitativos | ||||
| EROA | – | – | ≥ 0,4 cm2 | Con el PISA adecuado en mesosístole. Apical 4 cámaras. Línea de base Nyquist a 28cm/s. |
| Volumen regurgitante | – | – | ≥ 45ml | Validados en pocos estudios, variabilidad interobservador, errores en PISA son al cuadrado. |
| Otros parámetros | ||||
| Diámetro del anillo tricúspide | – | – | Diámetros mayores a 21mm/m2 | Medir de borde interno lateral a borde interno septal en el apical de 4 cámaras al final de la diástole. |
| Dimensiones de la AD, VD y vena cava inferior | Usualmente normales | – | Clásicamente dilatados en insuficiencia tricúspide crónica severa.En insuficiencia tricúspide aguda severa no alcanza a dilatar el VD. | Apical de 4 cámaras- Normales:Cava de menos de 15mm.Vol AD: <33ml/m2Área diástole VD: ≤28 cm2. Área sístole VD: ≤16 cm2. CAF: >32%VD diámetro medio ≤33mm |
El diagnóstico de IT y la decisión de intervenir debe ser hecho an- tes de la cirugía, ya que la severidad de la IT está influenciada por las condiciones intraoperatorias incluyendo los efectos de la anes- tesia. Si bien, la ecografía trans-esofágica (ETE) intraoperatoria es esencial en la determinación de la disfunción valvular mitral y aórtica, ésta puede subestimar la severidad de la IT y llevar a deci- siones incorrectas42. Por este motivo, la tendencia actual es indicar anuloplastía en casos de dilatación anular (>40mm or >21mm/m2 en la visión de 4 cámaras). La Fig. 4 muestra una insuficiencia tricuspídea severa mediante imagen ecocardiográfica43.
10Evaluación de La Función Ventricular Derecha (VD)Actualmente una evaluación completa de la geometría y función VD se puede lograr utilizando ecocardiografía 3D y CMR, ya que ambas se correlacionan bien dado que el ecocardiograma 3D subestima menos los volúmenes de fin de sístole y diástole con una reprodu- cibilidad superior que el ecocardiograma 2D44–46. Sin embargo, los volúmenes del VD son ligeramente menores que los obtenidos con CMR, con un límite menor de 44% para fracción de eyección del VD, y límite superior de 89ml/m2 y 45ml/m2 para volúmenes de fin de diástole y fin de sístole respectivamente38.
La excursión sistólica planar anular tricuspídea (TAPSE por sus siglas en inglés) determina el grado de desplazamiento anular hacia el ápex y refleja la función longitudinal del VD en forma precisa38. Las guías actuales del European Society of Cardiology/European Association for Cardio-Thoracic Surgery (ESC/EACTS por sus siglas en inglés)37 reco- miendan TAPSE <15mm, velocidad sistólica tricuspide <11cm/s y área de fin de diástole VD >20cm2 para identificar pacientes con disfunción VD. Sin embargo, estos valores pueden subestimar el grado de disfun- ción del VD en presencia de IT severa con sobrecarga de volumen y deben ser interpretado con precaución9.
La CMR se considera el gold standard para evaluar los volúmenes ventriculares izquierdo y derecho y la fracción de eyección, y am- bos parámetros predicen independientemente si existe IT residual significativa post cirugía39. Aunque no existen valores definidos en términos de volúmenes o fracción de eyección que indiquen cirugía en pacientes con IT, un volumen de fin de diástole ≥64ml/m2 predi- ce disfunción del VD en el seguimiento.
ECO transtorácico: ecocardiograma transtorácico; Vmáx: velocidad máxima del jet tricúspide; Esp: especificidad; Sens: sensibilidad; PW: doppler pulsado; FA: fibrilación auricular; AD: aurícula derecha; EROA: área del orificio regurgitante efectivo; VD: ventrículo derecho; CAF: cambio de área fraccional.
11Indicaciones de Intervención Valvular Tricuspídea (VT)Aunque la IT significativa con dilatación progresiva y disfunción del VD puede permanecer clínicamente silente por un período prolongado y así comprometer el resultado individual del pacien- te, el momento de la intervención quirúrgica permanece contro- vertido20,23,36. En un metaanálisis se demostró que la reparación concomitante de la IT durante una cirugía de válvulas izquierdas reduce la mortalidad cardiovascular y mejora los resultados en el seguimiento en el largo plazo47.
Tanto las guías de ESC/EACTS como las del American Heart Association/American College of Cardiology (AHA/ACC por sus siglas en inglés) recomiendan que la cirugía aislada de la VT está indicada en pacientes sintomáticos con IT severa primaria (Clase I) y debiera considerarse para pacientes asintomáticos o con poca sintoma- tología con crecimiento o deterioro de la función VD (Clase IIa)9. Aunque estos pacientes responden a terapia diurética, el retardo en la cirugía resulta en daño ventricular irreversible, insuficiencia cardíaca y peores resultados en una intervención tardía. Tabla 3.3
Comparación guías europeas y americanas para el tratamiento de la insuficiencia tricuspídea
| ESC/EACTS | AHA/ACC | |
|---|---|---|
| Insuficiencia tricuspídea (IT) primaria | ||
| IT grave aislada sintomática sin disfunción grave del ventrículo derecho (VD) | I | IIa |
| IT severa sometida a cirugía del lado izquierdo | I | I |
| IT moderada sometida a cirugía del lado izquierdo | IIa | No mencionado |
| IT leve o moderada aislada asintomática y dilatación progresiva del VD o deterioro de la función del VD | IIa | IIb (solo en IT severa) |
| Insuficiencia tricuspídea (IT) secundaria | ||
| IT severa sometida a cirugía del lado izquierdo | I | I |
| IT leve o moderada con anillo dilatado (≥40mm o >21mm/m2) sometida a cirugía del lado izquierdo | IIa | IIa (solo con dilatación progresiva del VD o insuficiencia cardíaca derecha previa) |
| IT e hipertensión pulmonar (HP) moderados sometidos a cirugía del lado izquierdo | No mencionado | IIb |
| IT severa persistente o recurrente después de cirugía de válvula del lado izquierdo | ||
| IT grave sintomática, dilatación progresiva del VD o deterioro de la función del VD, pero sin disfunción grave del VD o del VI, disfunción de la válvula del lado izquierdo e hipertensión pulmonar (HP) grave | IIa | |
| IT severa sintomática sin hipertensión pulmonar (HP) o disfunción del VD severo | IIb |
Traducido de Arsalan et al.3.
La cirugía de la VT está recomendada en pacientes con IT severa durante cirugía valvular izquierda, sin considerar síntomas (Clase I). Aunque no hay evidencia específica que confirme que la IT leve progresa a severa con o sin reparación, la cirugía debe conside- rarse (Clase IIa) en pacientes con IT leve/moderada secundaria y/o dilatación anular significativa (≥40mm o 21mm/m2) (Clase IIa)8,9.
Una cirugía precoz debe considerarse en IT severa después de una cirugía de válvulas izquierdas (con o sin intervención previa en la VT) (Clase IIa) en pacientes sintomáticos y en aquellos asinto- máticos en presencia de dilatación progresiva o disfunción del VD, a menos que la disfunción ventricular izquierda o derecha, o una enfermedad vascular pulmonar contraindique la cirugía. La indi- cación tardía se asocia con malos resultados ya que la disfunción ventricular es avanzada en muchos pacientes48,49.
11.1Técnicas quirúrgicasLos principios de la reconstrucción de la VT son similares a los de la válvula mitral, esto es restauración de la movilidad completa de los velos, corrección de prolapso, provisión de una superficie amplia de coaptación y estabilización anular. El acceso es por lo general a través de una esternotomía media, aunque una tora- cotomía derecha puede estar indicada en reoperaciones o en abordajes mini invasivos de rutina50,51. En general se efectúa bajo cardioplejía, aunque la cirugía con el corazón batiente se ha visto que disminuye el tiempo de isquemia y reduce el bloqueo AV, lo que es de particular importancia en pacientes de alto riesgo.
11.2Técnicas de reparaciónLas técnicas de anuloplastía están bien establecidas y mantienen el objetivo de disminuir el orificio valvular para lograr coaptación de los velos. Actualmente es el gold standard en el tratamiento de la IT secundaria52. La anuloplastía de De Vega todavía es utilizada por muchos cirujanos y consiste de una sutura circular doble del anillo anterior y posterior para llevar el orificio valvular a la dimen- sión determinada, más algunas modificaciones en uso que posee la técnica50 y tiene la ventaja de evitar la utilización de material protésico en casos de endocarditis activa, pero no restaura la for- ma normal del anillo. Otras técnicas han sido descritas a través de la historia de la cirugía tricuspídea, como la plastía de Kay o de bicuspidalización53, la plastía de Hetzer o plastía en 854 y la plastía de Alfieri o en forma de trébol55. Recientemente, se ha desarro- llado el concepto de orificio indexado para optimizar la reducción anular en la IT56. En las Figs. 5 y 6 se esquematizan las técnicas de DeVega y de Kay y, en la Fig. 7 se muestra una anuloplastía de Hetzer57.
Anuloplastía de De Vega. Consiste en una doble fila de sutura desde la comisura posteroseptal hasta la comisura anteroseptal. De esta manera se consigue plegar el anillo de la cara libre del ventrículo derecho (la zona más afectada por la dilatación del anillo) Roselló-Díez E.57.
Anuloplastía de Kay. Consiste en una sutura doble entre las comisuras posteroseptal y anteroposterior con el objetivo de plegar el velo y anillo posteriores, consiguiendo una válvula bicúspide. Roselló-Díez E.57.
Anuloplastía de Hetzer. El principio básico consiste en reducir la distancia entre los velos de tal forma que el velo con mayor movilidad (anterior), pueda coaptar con el velo opuesto, creando 2 orificios obteniendo competencia valvular. Roselló-Díez E.57.
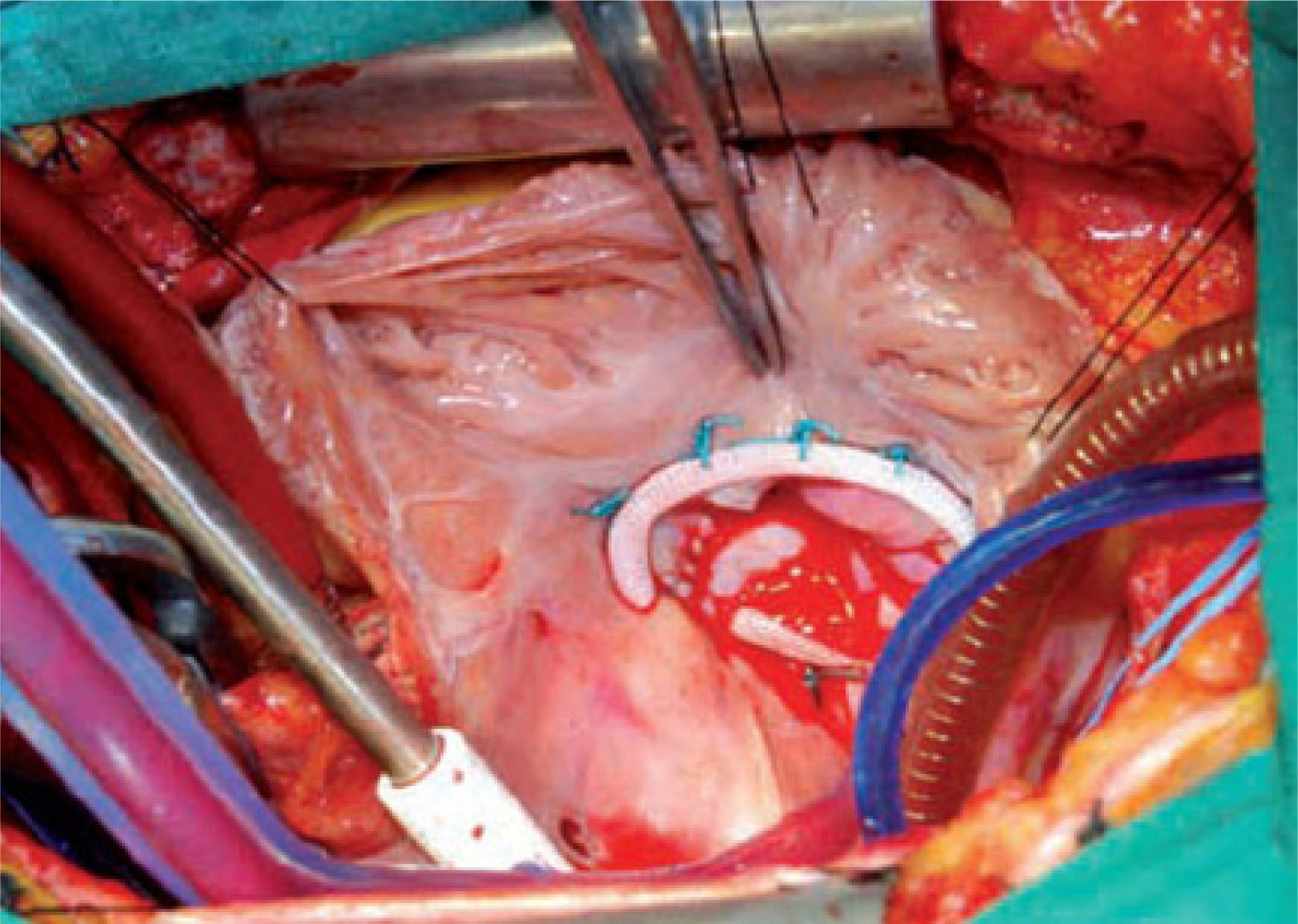
Anuloplastía tricuspídea mediante anillos protésicos. Resultado final en el que se aprecia coaptación total de los velos. Flores E, et al.43.
Actualmente existe una variedad de anillos con forma ovalada, los que replican la configuración sistólica del orificio tricuspídeo nor- mal. El tamaño del anillo debe ser determinado en forma cuida- dosa en relación a los velos y superficie corporal, y debe ser redu- cido en casos de tracción severa. Las suturas deben ser puestas en el anillo a 1-2mm del borde de los velos, con la precaución de no lesionar el anillo aórtico adyacente y la arteria coronaria derecha, como también evitar daño al haz de His en la mitad de la porción septal del anillo. En casos de deformación significativa de la vál- vula se utilizan procedimientos adicionales como uso de cuerdas artificiales y aumento del velo anterior, las que deben ser defini- das de acuerdo según la anatomía, la condición del paciente, la presencia de cables de marcapasos y la experiencia del cirujano56.
11.3Reemplazo valvular tricuspídeoActualmente el gold standard en el tratamiento quirúrgico de la IT secundaria es la anuloplastía. Sin embargo, los resultados son malos en pacientes con disfunción ventricular severa, anillo muy dilatado y velos muy separados, pacientes en los que el reem- plazo valvular tiene mejores resultados. La elección adecuada de la prótesis es esencial para no distorsionar la arteria coronaria derecha, y se recomienda que el reemplazo sea efectuado con múltiples suturas no evertidas apoyadas en pledgets en el ani- llo valvular en el aspecto ventricular, las que en la porción septal, entre la mitad del anillo y la comisura anteroseptal, deben incluir una porción del velo con preservación septal, para evitar lesión del haz de His. El tipo de válvula a utilizar debe ser elegido en forma juiciosa según características anatómicas y condición del paciente, edad, paridad y la presencia de fibrilación auricular en tratamiento anticoagulante oral.
La reparación tricuspídea tiene menor mortalidad perioperato- ria que el reemplazo y en general es la opción preferida. Para IT primaria no complicada la anuloplastía tiene mejores resultados, pero esto depende de la etiología, función ventricular y riesgo del paciente. La reparación en la IT secundaria concomitante con ci- rugía valvular izquierda no tiene impacto en términos de mortali- dad, a menos que exista una falla cardíaca severa y/o disfunción o dilatación ventricular derecha.
En contraste, una cirugía tricuspídea tardía post cirugía inicial aórtica o mitral se asocia con mayor morbimortalidad, lo que re- fleja la condición clínica del paciente, reportándose hasta un 30% de mortalidad incluso en centros con experiencia, donde los re- sultados a largo plazo son pobres en presencia de disfunción uni o biventricular irreversible58.
La anuloplastía con anillo tiene buenos resultados a largo plazo, siendo la técnica original de De Vega la que presenta el mayor porcentaje de recurrencia50, con una baja sobrevida en el largo plazo7, aunque se han visto mejores resultados con las modifica- ciones a la técnica5. En un estudio reciente se encontró resulta- dos similares con ambas técnicas en pacientes en que la repara- ción se hizo durante cirugía valvular mitral, incluso en presencia de diabetes, disfunción ventricular y edad avanzada, en los que los porcentajes de durabilidad y recurrencia de la IT fueron simi- lares en el largo plazo59. La dehiscencia en anillos rígidos es una complicación tardía potencial60. Por otro lado, hay que hacer hin- capié en que los mejores resultados de plastía se deben, en parte, a mejores condiciones de los pacientes, ya que los pacientes que van a reemplazo son los que se presentan con lesiones más com- plejas producto de la indicación tardía de cirugía61.
Los resultados con válvulas mecánicas y biológicas son similares, aunque actualmente se prefiere estas últimas con la ventaja de una posterior implantación de prótesis valve-in-valve en caso de degeneración protésica tardía62. La sobrevida a 10 años plazo está entre el 30% al 50%, y la mortalidad tardía puede predecirse por la clase funcional preoperatoria, la función de ambos ventrículos y las complicaciones relacionadas a la prótesis49,51.
11.4Intervenciones percutáneasNuevas técnicas transcatéter han ido emergiendo en los últimos años. La mayoría de las cuales se encuentran en fase inicial de aplicación clínica y con experiencias preliminares con las que no se ha demostrado aun su seguridad y eficacia. Por lo tanto, definir un rol con esta técnica en el futuro próximo no parece posible, por lo que muchos pacientes se mantendrán como candidatos quirúrgicos debido a que en el tratamiento de la falla ventricular se requiere la terapia más efectiva. Por otro lado, la opción trans- catéter sería más apropiada en pacientes inoperables con insufi- ciencia mitral y tricúspide, en quienes se puede resolver en una etapa63,64. Incluso pacientes de alto riesgo con IT tardía posterior a cirugía mitral podrían beneficiarse de esta técnica menos inva- siva65,66. Pero con el conocimiento actual la terapia percutánea es incapaz de proveer una corrección durable en sus etapas avan- zadas con dilatación anular severa y tracción de velos debido a disfunción y dilatación ventricular67.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.