El cáncer colorrectal y gastroesofágico representan patologías de cáncer predominantes a nivel mundial por la incidencia y la mortalidad asociada. La única terapia curativa para pacientes con estadios tempranos de estas enfermedades persiste siendo la cirugía. En los pacientes que debutan con enfermedad avanzada o se hacen metastásicos luego del tratamiento locorregional, la quimioterapia ha sido el tratamiento tradicional, con resultados más bien pobres, en términos de sobrevida o de sobrevida libre de progresión. El estudio de marcadores con la medicina de precisión ha comenzado a cambiar este panorama.
En este artículo se revisan los aspectos más relevantes en el avance en el tratamiento de ambas enfermedades
Colorectal and gastroesophageal cancer have a global high incidence and a high mortality rate. Surgery
persists as the only curative therapy for patients with early stages of both diseases. In those patients that are diagnosed with metastatic or unresectable cancer, or that become metastatic after locoregional treatment, chemotherapy has been the traditional therapy, with rather poor results in terms of survival or progression free survival. Precision medicine using molecular markers is changing this situation.
Herein we review the most relevant aspects with regards to advances in the treatment of both diseases.
Datos publicados en 2020 por Arnold et al., señalan que en el año 2018 hubo 4,8. millones nuevos casos de cánceres gastrointestinales (GI) y 3,4 millones de muertes relacionadas con esas enfermedades, a nivel mundial. Así, los cánceres GI representan el 26% de la incidencia global de cáncer y un 35% de las muertes por cáncer. El más común de estos cánceres es el cáncer de colon con 1,8 millones de nuevos casos y 811 mil muertes a nivel global ese año 2018. Le siguen cáncer gástrico, hígado, esófago y páncreas1.
Los cánceres digestivos a su vez comparten algunos hechos relevantes: el primero, es su poca sintomatología que los hace ser detectados tardíamente; el segundo es que en la terapia de los cánceres GI, la cirugía sigue siendo la única herramienta curativa con la que se cuenta, pero solo para los casos diagnosticados en fase temprana. Aun así, un porcentaje de pacientes diagnosticados en fase temprana se harán metastásicos.
El tercer hecho corresponde a una histórica falta de desarrollo de terapias médicas, siendo ellas basada principalmente en fluoropirimidinas para la mayor parte de los cánceres GI; y el cuarto es que una vez que la enfermedad adquiere el carácter de avanzado, salvo excepciones, no tiene curación.
A continuación, se describe la situación del cáncer colorrectal y gastroesofágico, como ha ido desarrollándose su tratamiento hasta llegar a nuestros días, con el avance de la medicina personalizada, entendida como el desarrollo de marcadores que nos ha ido mostrando un mayor conocimiento de la biología de la enfermedad.
2Cáncer colorrectalCáncer de colon y recto son los más frecuentes de los cánceres GI dando cuenta de 1,8 millones de los 4,8 millones de nuevos casos de cánceres digestivos reportados en 20181.
Hasta fines de la década de los 90, solo contábamos con 5-fluoruracilo (FU) para su tratamiento, que usado principalmente en combinación con leucovorina produce un aumento de la sobrevida global (OS, por sus siglas en inglés) desde 6 meses (solo con observación a 12 meses)2, el que es mayor cuando se compara el uso de FU en infusión en relación con su uso en bolo3.
Posteriormente el armamentario terapéutico se enriquece con irinotecán, medicamento desarrollado en la década de los 80 en Japón. En un estudio aleatorizado conducido en Europa, en pacientes que habían fracasado a FU, ellos fueron asignados a cuidados paliativos o a irinotecán como agente único. Luego de una mediana de seguimiento de 13 meses, la OS fue significativamente mejor en el grupo con irinotecán con un p=0,00014, resultados que fueron respaldados por los de Rougier et al.5.
Otro medicamento que se incorpora en ese tiempo es oxaliplatino que, aunque poco efectivo como agente único, presenta una sinergia cuando usado en conjunto con FU6. En el año 2000 se publica el uso de FOLFOX que es la combinación de oxaliplatino, leucovorina y FU en bolo y una infusión del mismo FU, de 46 horas que produce una mejoría de la sobrevida libre de progresión (PFS, por sus siglas en inglés) pero no de la OS7,8. Sin embargo, al combinar FU mas irinotecán, la mejoría de la sobrevida, modesta cuando usada con FU en bolo, se hace más notoria al usar un esquema conocido como FOLFIRI, idéntico a FOLFOX solo que reemplaza oxaliplatino por irinotecán9.
El último intento de mejorar la sobrevida con el uso de quimioterapia exclusiva vino de la mano del grupo italiano que describieron el esquema FOLFOXIRI que combina, FU, leucovorina, irinotecán y oxaliplatino que mostró un aumento de la OS desde 16,7 meses con FOLFIRI a 22,6 meses con el nuevo esquema propuesto10.
Todos los esquemas anteriores son esquemas de primera línea de tratamiento. De tal manera que el aporte de la quimioterapia en el manejo del cáncer de colon metastásico parecía tocar techo.
En la última década del siglo pasado, se conoce la contribución de los receptores celulares en la progresión del cáncer y cómo, los anticuerpos monoclonales podían hacer blanco en estos receptores y sus vías río abajo. Uno de tales receptores es factor de crecimiento epidérmico, parte de una súper familia con 4 receptores numerados del 1 al 4, siendo el uno el factor de crecimiento epidérmico (EGFR) y el dos el conocido como HER2, que se desarrollará más adelante.
EGFR es un receptor transmembrana involucrado en la génesis del cáncer de colon y varios otros cánceres. En la señalización intracelular río abajo están involucrados RAS y RAF que son una familia de proteínas expresadas en las células, pertenecientes la familia de las GTPasas, encargadas de transmitir señales intracelulares que llevan a una amplificación de señales intracelulares. RAS es una proteína que une GTP y que está río arriba de una vía de señales que incluyen RAF/MEK/ERK/PI3K/Akt11,12 (Fig. 1).
Vía de señalización del receptor del factor de crecimiento epidérmico (EGFR). La unión del ligando induce la dimerización y activación del EGFR. La autofosforilación posterior de los residuos de tirosina activa la señalización río abajo. Hay 2 ejes de cascadas de señalización importantes: Ras-Raf-MEK-ERK que controla el crecimiento, la diferenciación y la supervivencia celular (apoptosis); y el otro eje de la cascada de señalización la vía PI3K-AKT que es importante en la carcinogénesis colorrectal. La proteína AKT activada (p-AKT) activa varios objetivos que dan como resultado el crecimiento, la proliferación y la supervivencia celular (paralelo a la vía de señalización Ras-Raf-MEK-ERK). Es importante destacar que estos dos ejes están estrechamente relacionados y tienen cierta superposición. Figura propia realizada con BioRender.com.
Se desarrolló un anticuerpo monoclonal (mAb, por sus siglas en inglés) contra el receptor del factor de crecimiento epidérmico (EGFR, por sus siglas en inglés) como terapia biológica, que inicialmente fue denominado como C225, y que posteriormente sería conocido como cetuximab. Este mAb mostró actividad en un estudio fase I como agente único o en combinación con cisplatino en varios tipos tumorales estudiados, permitiendo así continuar con su desarrollo.
Posteriormente, se describió que EGFR es relevante en cáncer colorrectal debido a que su expresión (o sobreexpresión) ocurre en 60-80% de los casos, y esta sobreexpresión está asociada con una pobre sobrevida. Es lo que quizás, se pueda describir como el primer avance en medicina de precisión en cáncer de colon, en tiempos en que apenas se conocía el concepto en tumores sólidos. Ello llevó a posteriores estudios con el uso de cetuximab en pacientes refractarios a irinotecán y que sobreexpresaran EGFR, en lo que se llamó el estudio BOND que aleatorizó pacientes a recibir la combinación de irinotecán con cetuximab o solo cetuximab. La combinación mostró un aumento de la PFS13.
Los inhibidores de EGFR como cetuximab o panitumumab solo son activos cuando no existen mutaciones en la vía de señales río abajo. De esa forma cuando RAS, (ya sea en KRAS o NRAS), o BRAF sufren mutaciones, permanecen señalizando independientemente del uso de inhibidores de EGFR. Es por eso que la determinación del estatus mutacional de KRAS y BRAF son esenciales para el uso de estos medicamentos. La mutación de KRAS ocurre aproximadamente en el 40% de los casos de cánceres de colon, principalmente en el exón 1, codones 12 y 13. En el codón 12 las mutaciones más comunes son G12D, G12V y G12C, que como veremos más adelante, cobran relevancia terapéutica en la actualidad.
Las mutaciones en NRAS están presentes en un 3-5% de los tumores de pacientes con cáncer colorrectal, y esta mutación también confiere resistencia a terapias anti-EGFR.
BRAF es otro importante factor, tanto pronóstico en un inicio, como terapéutico (predictivo) en la actualidad. Junto con MEK y ERK son activados por RAS afectando el crecimiento celular, la proliferación, diferenciación, apoptosis, migración celular y sobrevida. BRAF presenta mutación en alrededor de un 10% de los pacientes con cáncer colorrectal metastásico, siendo la mayoría de las mutaciones una sustitución de valina por ácido glutámico en el codón 600 (V600E), lo que produce una activación de los otros componentes de la vía río abajo (MEK, ERK, MAP quinasa) aún en la ausencia de mutación de KRAS.
El siguiente hito en el desarrollo de la terapia anti-EGFR se dio con el estudio CRYSTAL, que también seleccionó pacientes con sobreexpresión de EGFR por inmunohistoquímica. Sin embargo, en este estudio se comprobó que la eficacia de los anti-EGFR como cetuximab o panitumumab, no estaba ligada a la sobreexpresión del receptor, sino que, a la mutación río abajo de RAS, en un principio KRAS, pero posteriormente se sumó NRAS, como factor predictivo negativo de la actividad de los mAb contra el EGFR. Hoy se acepta que la detección de mutaciones de RAS excluye pacientes para el uso de estos medicamentos en cáncer de colon metastásico. El porcentaje de RAS no mutado es de aproximadamente un 45%. Posteriormente se describiría que los pacientes con mutaciones en BRAF V600E tampoco responden al uso de terapias anti-EGFR14–17.
Paralelamente, se desarrolló otro mAb, esta vez contra el factor de crecimiento del endotelio vascular (VEGF), bevacizumab. Hasta hoy, no existe un marcador que prediga la eficacia de bevacizumab y su uso está dado por la presencia de mutaciones de EGFR, aún cuando puede ser eficaz también en pacientes con mutaciones en las proteínas de señalizacion río abajo18.
El estudio CALGB 80405 analizó más de 1000 pacientes KRAS no mutados y demostró que no había diferencias significativas en la PFS ni OS de los pacientes al ser tratados con quimioterapia más bevacizumab o quimioterapia más cetuximab. También demostró que con la combinación de quimioterapia más anticuerpos monoclonales, la sobrevida global se encumbra a los 30 meses, marcando un nuevo hito en el tratamiento del cáncer de colon metastásico en pacientes no mutados en KRAS, pero que los efectos de cada medicamento eran distintos según la localización del tumor. Así bevacizumab es más efectivo en cáncer de colon derecho y cetuximab más efectivo en cáncer de colon izquierdo. Siendo así el origen embriológico de los tejidos, un marcador de actividad para estos medicamentos19.
No obstante los avances descritos, la sobrevida de los pacientes con cáncer colorrectal metastásico a 5 años sigue siendo menor al 20%20,21. Hay por lo tanto una necesidad urgente de nuevas terapias que mejoren la sobrevida.
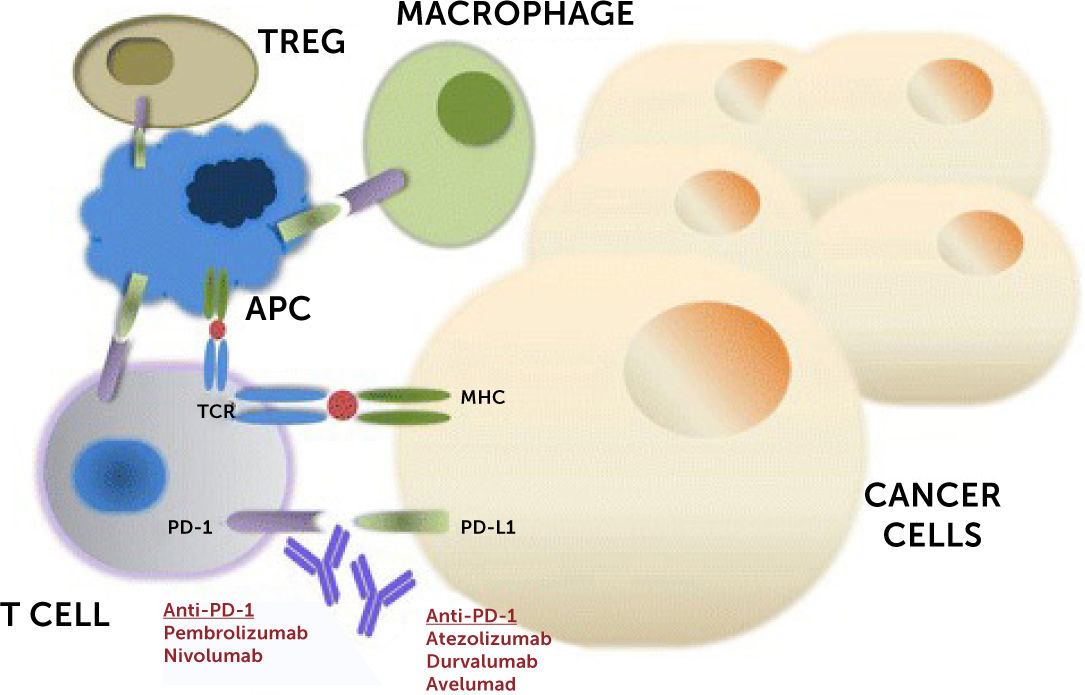
2.1El caso de los inhibidores de puntos de control inmunitarios (CPIs o check point inhibitors, en inglés)En melanoma, así como en otros tumores, un importante avance se ha obtenido con el uso de inmunoterapia, en pacientes con PD-L1+21,22. La terapia con inhibidores de los puntos de control inmunológicos ha mostrado un grupo de tumores que son altamente sensibles a una respuesta inmune adaptativa endógena. Cuando se bloquea la interacción entre los ligandos y su receptor en las células, se observa una respuesta antitumoral potente y durable. Sin embargo, en ocasiones esta respuesta puede acompañarse de autoinmunidad, lo que da cuenta de lo que se conoce como efectos colaterales inmunes. Esto, muestra que muchos pacientes con cáncer tienen en su sistema inmune la capacidad de reaccionar selectivamente contra sus tumores a través del reconocimiento de antígenos tumor-específicos. (Fig. 2)23.
Mecanismo de acción de los inhibidores de PD-1 y PD-L1. El receptor de muerte celular programada 1 (PD-1) se expresa en células T activadas, células B, macrófagos, células T reguladoras (Tregs) y células asesinas naturales (NK). La unión de PD-1 a su familia de ligandos B7, ligando de muerte programada 1 (PD-L1 o B7-H1) o PD-L2 (B7-DC) da como resultado la supresión de la proliferación y la respuesta inmunitaria de las células T. La activación de la señalización de PD-1/PD-L1 sirve como un mecanismo principal por el cual los tumores evaden las respuestas inmunológicas de células T específicas de antígeno. El bloqueo de anticuerpos de PD-1 o PD-L1 invierte este proceso y mejora la actividad inmunológica antitumoral. Abreviaturas: TCR, T-cell receptor de células T; MHC, complejo principal de histocompatibilidad; APC, célula presentadora de antígeno. Tomado de Gong J. et al. (2018). (Ref.23). Acceso abierto, bajo los términos de la licencia internacional Creative Commons Attribution 4.0.
Varios marcadores, incluyendo la expresión de PD-L1, firmas de expresión de RNA, la carga mutacional del tumor y el infiltrado linfocitario pudiesen ayudar a seleccionar pacientes que responderían a la terapia con agentes de inmunooncología. Sin embargo, ninguno de ellos parece ser completamente específico en predecir la respuesta en distintos tumores23–27.
La inestabilidad microsatelital (MSI) es un marcador molecular de una función defectuosa del sistema de la reparación de los errores de replicación del DNA que reconoce y repara los errores en la inserción, supresión y la incorporación errónea de bases que pueden producirse durante la replicación y recombinación del DNA, como también reparar algunas formas de daño del DNA. Además, los tumores con MSI alta (MSI-H) normalmente se acompañan de una alta carga de mutación tumoral (TMB), alta carga de neoantígenos e infiltración inmune, todos factores que pueden ayudar a una mejor respuesta a la terapia con CPIs23–27.
Como vocabulario definimos CPS (combined positive score) al número de células que tiñen para PD-L1, incluyendo las células tumorales, linfocitos y macrófagos, dividido por el número total de células tumorales viables. Por otro lado, el tumor proportion score (TPS) es definido como el porcentaje de células tumorales viables que tiñen sus membranas en forma completa o parcial, en relación a todas las células tumorales viables presentes en la muestra28.
Los microsatélites son regiones específicas del genoma que consisten en repetición de nucleótidos, lo que aumenta en forma importante los errores de la DNA polimerasa replicadora, conduciendo a inserciones o deleciones de bases, llevando a mal apareamiento de bases (mismatch) de la doble hélice del DNA. Las proteínas reparadoras, (como MSH2, MSH6, PMS2 y MLH1), deben reconocer y reparar estos errores de replicación. La pérdida de estas proteínas somáticas o germinales es la causa de los tumores con MSI-H, lo que a su vez lleva a mutaciones en otras proteínas teniendo un gran impacto inmunogénico, además con una alta carga mutacional.
En el caso de cáncer de colon, Le et al. describieron en 2015 que los cánceres con deficiencia de mismatch-repair, se asocian a un gran número de MANAs (mutation-associated neoantigens) que pueden ser reconocidos por el sistema inmune29,30.
En la misma publicación29, los autores presentan los casos de 86 pacientes consecutivos, con 12 tipos de tumores sólidos, todos con enfermedad que había progresado a al menos una terapia previa, y con deficiencia de mismatch repair analizado ya sea por reacción de la polimerasa en cadena (PCR) o por inmunohistoquímica, principalmente MSH2, MSH6, PMS2 y MLH1. Dentro de estos pacientes habían 27 con tumores sólidos y enfermedad evaluable por RECIST. Ellos fueron tratados con un anti-PD-1, pembrolizumab y un 53% obtuvo respuesta clínica con un 21% de respuesta clínica completa. En los pacientes con cáncer de colon un 52% presentó respuesta objetiva.
Estos estudios seminales abrieron la puerta para varios otros en pacientes con cáncer colorrectal con deficiencia de las proteínas reparadoras y que ha confirmado la actividad de la terapia inmune en ellos31–35.
Importante es mencionar el estudio fase II CheckMate 142, en el cual pacientes con cáncer de colon metastásico o irresecable, MSI-H/dMMR, sin tratamiento previo, fueron tratados con nivolumab cada dos semanas más dosis bajas de ipilimumab cada 6 semanas hasta la progresión o toxicidad inaceptable. El objetivo principal de dicho estudio fue la respuesta objetiva determinada por el investigador y objetivos secundarios la PFS y OS. Con una mediana de seguimiento de 29 meses, la respuesta objetiva y control de la enfermedad fueron 69% y 84%, respectivamente; con un 13% de respuestas completa. Si bien, la mediana de duración de la respuesta no se había alcanzado al momento de la publicación, el 74% de los respondedores mantuvo la respuesta. La mediana libre de progresión y la mediana de sobrevida no se habían alcanzado con un mínimo de 24,2 meses de seguimiento. El beneficio del tratamiento se observó independientemente de las características demográficas basales incluyendo el estado mutacional de BRAF o KRAS. Los eventos adversos relacionados con el tratamiento de grado 3-4 ocurrieron en el 22% de los pacientes; llevando en un 13% a la discontinuación del tratamiento debido a estos efectos colaterales32,34.
Por otra parte, el uso de nivolumab como agente único produjo un 31,1% de respuestas objetivas. A una mediana de 12 meses de seguimiento en el mismo grupo, el control de enfermedad alcanzó un 69%; la mediana de duración de la respuesta no se había alcanzado al momento de la publicación y todos los respondedores estaban vivos y 8 de ellos con respuestas que duraban 12 meses o más.
En el caso de pembrolizumab, el estudio KeyNote-177, un estudio fase III de etiqueta abierta con 307 pacientes portadores de cáncer de colon o recto metastásico, MSI-H, sin tratamiento previo fueron aleatorizados a recibir pembrolizumab cada 3 semanas o quimioterapia basada en FU con o sin bevacizumab o cetuximab. Los pacientes con quimioterapia podían cruzarse a la rama de pembrolizumab después de la progresión de la enfermedad. Los principales objetivos del estudio fueron PFS y OS. Con un seguimiento de 32,4 meses la mPFS con pembrolizumab fue superior a quimioterapia (16,5 vs. 8,2 meses con un HR de 0,60 y un valor de p =0,0002. La OS fue de 13,7 meses en pembrolizumab comparado a 10,8 meses en quimioterapia. Esta falta de diferencia en la OS es atribuible al cruce de los pacientes desde quimioterapia a pembrolizumab35.
La efectividad de los resultados en pacientes metastásicos está incluso haciendo que el uso de la terapia inmune se traslade a la fase preoperatoria. Efectivamente Chalabi, et al. publicaron un pequeño estudio fase I-II, conocido como NICHE en pacientes con dMMR y también con pMMR. Todos los pacientes con dMMR presentaron respuestas completas y un 27% de los pacientes con pMMR mostraron también respuestas patológicas. Los autores señalan que la infiltración de células T-CD8 positivas y el nivel de PD-L1, fueron predictores de la respuesta en pacientes con pMMR36.
No cabe duda de que el conocimiento sobre la biología de los tumores y la respuesta inmunológica nos permitirá seguir avanzando en el tratamiento de los pacientes con cáncer colorrectal. Por ahora, solo los pacientes con déficit en la reparación del mal apareamiento de bases, pueden ser tratados con terapia inmune, lo que se estima representa no más de un 5% del total de los pacientes con cáncer colorrectal metastásico (CCRm). Se debe tomar en cuenta la toxicidad para el paciente tanto fisiológica como económica de ellos, al indicar estas terapias.
2.2El caso de BRAF V600ELa presencia de mutaciones en BRAF constituyen un factor pronóstico con una PFS de 4,3 meses en comparación de los 12,5 meses de los pacientes sin mutaciones. La OS también es significativamente menor, del orden de los 11 meses con tratamiento con FOLFOX o FOLFIRI más o menos anti-EGFR.
Las mutaciones de BRAF se encuentran más en tumores de pacientes mujeres, con edad avanzada. Son tumores de tipo mucinoso, con MSI-H (alrededor del 20%), con diseminación peritoneal y ganglionar linfática y una mayor frecuencia de compromiso de colon derecho37.
El estudio TRIBE comparó el uso de FOLFOXIRI mas el mAb contra VEGF bevacizumab vs FOLFIRI mas bevacizumab y nos entregó una clara demostración del poder pronóstico de las mutaciones en CCRm. En efecto la sobrevida media fue de 37,1 meses en pacientes sin mutaciones de RAS ni BRAF comparado con 25,6 meses en pacientes con mutaciones de RAS y de tan solo 13,4 meses en los pacientes con BRAF mutado. Las respectivas PFS fueron de 12,8 meses, 10,2 meses y 7,0 meses38.
Por otra parte, sabemos que luego de una terapia estándar de primera línea, la posibilidad de respuesta con terapias subsecuentes es menor a 10%, con una PFS de más o menos dos meses y una OS entre 4-6 meses39–42. De lo anterior se desprende la urgente necesidad de contar con otros tipos de terapia para estos pacientes. Ello llegó luego que se demostrara la efectividad de agentes anti-BRAF y combinaciones en otros tumores como, por ejemplo, melanoma43.
No obstante, los buenos resultados obtenidos con agentes anti-BRAF en melanoma, los resultados en CCRm fueron pobres debido a una rápida reactivación de retroalimentación de la señalización vía MAPK. El siguiente paso fue adicionar un anti-EGFR a la terapia usando vemurafenib o dabrafenib como inhibidores de BRAF, mostrando un aumento de la inhibición de BRAF44. Siguiendo los pasos de melanoma, en el que la combinación de encorafenib (inhibidor de BRAF) y binimetinib (un inhibidor MEK) mostraron excelente actividad, se inicia el estudio BEACON, un estudio fase III de tres brazos que comparó encorafenib mas cetuximab con o sin binimetinib vs. cetuximab mas quimioterapia en pacientes BRAF mutados con enfermedad progresiva luego de una o dos líneas de quimioterapia. Los 30 primeros pacientes mostraron un 48% de respuestas con un 10% de respuestas completas45. El posterior estudio fase III, corroboró la mayor actividad de la triple terapia en relación al control, pero sin una diferencia clara entre el uso de dos o tres terapias blancos46.
2.3El caso de HER2 (ERBB2)Como en el caso de BRAF y la terapia en melanoma y cáncer de pulmón de células no pequeñas, para el uso de terapias anti-HER2 se tomó el exitoso ejemplo de cáncer de mama HER2+ luego de conocerse que más o menos un 4 y 5% de los pacientes con CCRm sin mutaciones de KRAS sobreexpresan HER2 según los datos de estudio HERACLE47. Ese mismo estudio fase 2 de prueba de concepto en pacientes que habían fracasado a líneas de terapias previas incluyendo agentes anti-EGFRs, mostró una respuesta de 30% con 1 paciente con respuesta completa en 48 pacientes estudiados utilizando trastuzumab y lapatinib. Otro estudio fase II, utilizando pertuzumab y trastuzumab, mostró un porcentaje de respuesta de 32% incluyendo un paciente con respuesta completa48. Estos dos estudios confirman que los pacientes sin mutaciones en KRAS y que habían fracasado a líneas de terapias previas pueden tener una alternativa de terapia con el uso de bloqueo dual de HER2, cuando esté sobreexpresado o mutado.
El estudio HERACLES-B utilizó pertuzumab mas trasatuzumab emtansina con un porcentaje de respuestas objetivas de solo un 9,7% y una PFS de 4,1 meses49.
Recientemente se publicó el estudio DESTINY-CRC01, en pacientes sin mutaciones en RAS y BRAF. En este estudio fase II, utilizando el compuesto conjugado TDXd (trastuzumab-deruxtecán), pacientes que habían progresado a 2 o más líneas previas de terapia, incluyendo otros anti-HER2, fueron estratificados de acuerdo al nivel de positividad de HER2 (3+ o 2+) tanto en tumor como en biopsia liquida. En 53 pacientes con HER2+, 24 de ellos presentaron una respuesta objetiva, lo que equivale a un 43% de esta serie de pacientes con mucho tratamiento previo, lo que es muy prometedor50. Los datos fueron actualizados en el congreso del American Society of Clinical Oncology (ASCO) 2021 reportándose una mediana de PFS de 6,9 meses y una mediana de OS de 15,5 meses para los pacientes con HER2 3+ por inmunohistoquímica51. La información entregada en el congreso del European Society for Medical Oncology (ESMO) mostraron que los pacientes que mejor responden son los que presentan tumores con inmunohistoquímica 3+ o con una amplificación de ERBB2 en plasma52.
Los resultados que se comentaron más arriba, abren una interesante avenida para los pacientes con CCRm que tiene amplificación de HER2, con el uso de trastuzumab-deruxtecán, no obstante, la toxicidad orgánica y económica asociado al uso de este medicamento.
3LA CAIDA DE LOS SANTUARIOSKRAS y TP53 son genes que comúnmente se encuentran mutados en tumores sólidos. Hasta ahora no existía terapia para los pacientes con mutaciones en estos dos genes, por lo que se les consideraban santuarios.
3.1KRAS G12CLas mutación G12C en el gen KRAS ocurre aproximadamente en el 3-4% de los CCR y se asocian a una PFS más corta que las otras mutaciones en KRAS53,54.
Se han desarrollado dos inhibidores covalentes directos de la mutación G12C de KRAS: sotorasib y adagrasib y conocemos los resultados de actividad como agentes únicos de estos medicamentos. Como ha sucedido con los inhibidores de BRAF, la actividad de estos medicamentos ha sido menor en CCR que en cáncer de células no pequeñas de pulmón. Ello debido a que se produce un loop con fosforilación del sitio transmembrana de EGFR55.
El estudio CodeBreak 100 presentado en ASCO 2020 mostró que el uso de sotorasib se asocia a un 7,1 a 12% (dependiendo de la dosis) de respuesta con una PFS de 4 meses56. Más recientemente en el ESMO 2021 se presentó el estudio KRYSTAL-1 con el uso de adagrasib como agente único o en combinación con cetuximab. El uso de adagrasib como agente único se asoció a un 22% de respuesta parcial, con una mediana de duración de la respuesta de 4,2 meses y una PFS de 5,6 meses. El uso combinado del mismo agente más cetuximab se asoció a una respuesta de 43% y un sorprendente 100% de control de la enfermedad (respuesta parcial más enfermedad estable). La cohorte de pacientes con adagrasib mas cetuximab tiene un muy corto periodo de seguimiento como para determinar duración de la respuesta o de la PFS57.
3.2Mutaciones en KRAS y TP53Los agentes que hacen blanco en la respuesta al daño del DNA (DNA Damage Response, DDR por sus siglas en inglés), han sido exitosos como monoterapia en tumores con alteraciones de en la vía de DDR.
Wee1 tiene un papel central en la progresión del ciclo celular y en la estabilidad genética. Es un regulador clave de la inhibición de G2/M e intra S es un punto de control. La inhibición de Wee1 causa disminución de dNTP (nucleótidos que sirven para generar las nuevas cadenas de DNA) y estrés en la replicación del DNA, llevando así a una acumulación de daño en el DNA y una entrada inapropiada y no programada a la mitosis. Los tumores con mutación en KRAS/TP53 tiene fallas en el control de G1/S y dependencia de en los controles intra S y G2/M lo que lleva a un estrés en la replicación durante la fase S del ciclo celular. En los tumores con mutación en KRAS/TP53, la inhibición de Wee1 por pequeñas moléculas produce una falla en los puntos de control del ciclo, disminución de dNTP lo que produce mayor estrés en la replicación del DNA58.
Recientemente se publicó un estudio fase II (FOCUS4-C) de adavosertib en el manejo de pacientes con cáncer colorrectal metastásico con mutaciones en KRAS/TP53 luego de 4 meses de quimioterapia. Luego de ello los pacientes fueron aleatorizados a observación activa o adavosertib con una mejoría en la PFS estadísticamente significativa para el grupo con adavosertiv: la mPFS fue de 3,61 meses vs. 1,87 meses para el grupo de observación activa con un HR de 0,35 con una p de 0,0022. La OS no fue diferente entre los dos grupos. Interesantemente, la actividad de adavosertiv fue mayor en pacientes con cáncer de colon izquierdo que de colon derecho59.
La posibilidad de hacer blanco con el uso de distintos medicamentos en cáncer de colon sin posibilidad terapéutica previa, sin duda constituye un avance muy importante ya qué nos está hablando de que un estudio profundo de la biología tumoral apoyado en la informática nos puede llevar a desarrollar avances en campos en los cuales previamente no teníamos ninguna posibilidad. Evidentemente los resultados no son los deseados, pero no hay duda de qué estudiando más a fondo las interacciones entre tumor y microambiente podremos llegar ojalá, a curar la enfermedad.
4Cáncer GástricoA pesar de una uniforme declinación de su incidencia en los últimos años, el cáncer gástrico produjo un millón de nuevos casos y más de 760.00 muertes en 2020, lo que lo constituye en el quinto cáncer más común a la vez que en la cuarta causa de muerte por cáncer. La tasa de incidencia es mayor en hombres que en mujeres y su tasa de incidencia es mayor en países asiáticos, así como en Chile y Costa Rica1. Si bien la cirugía es el tratamiento de elección para cáncer gástrico temprano o luego de quimioterapia de conversión, el pronóstico de la enfermedad avanzada es bastante pobre.
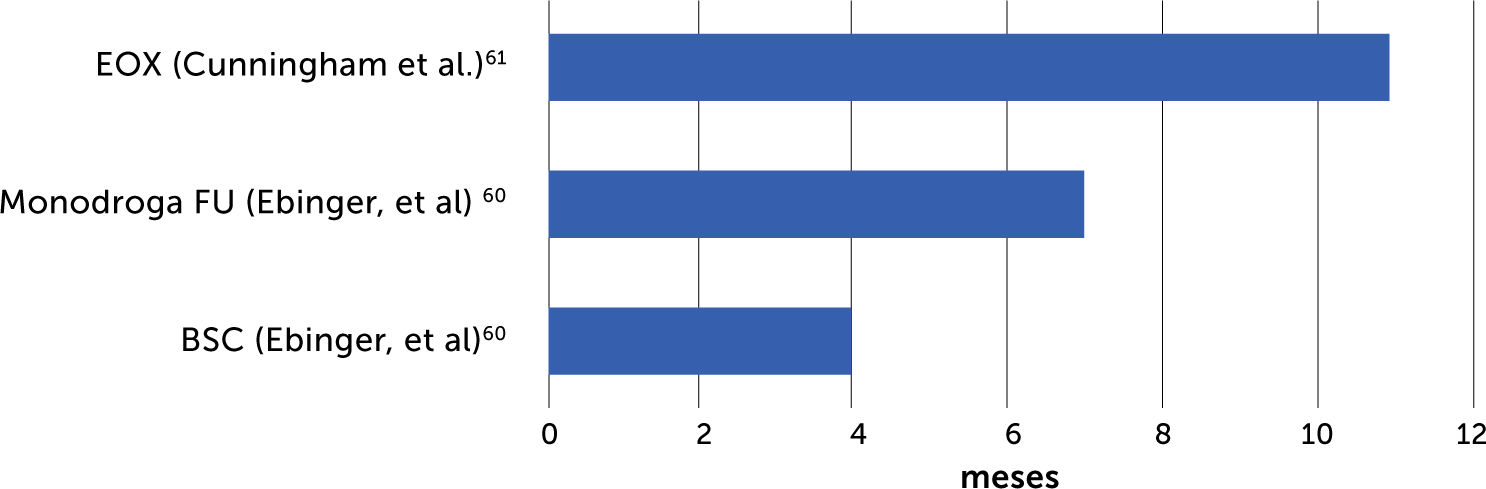
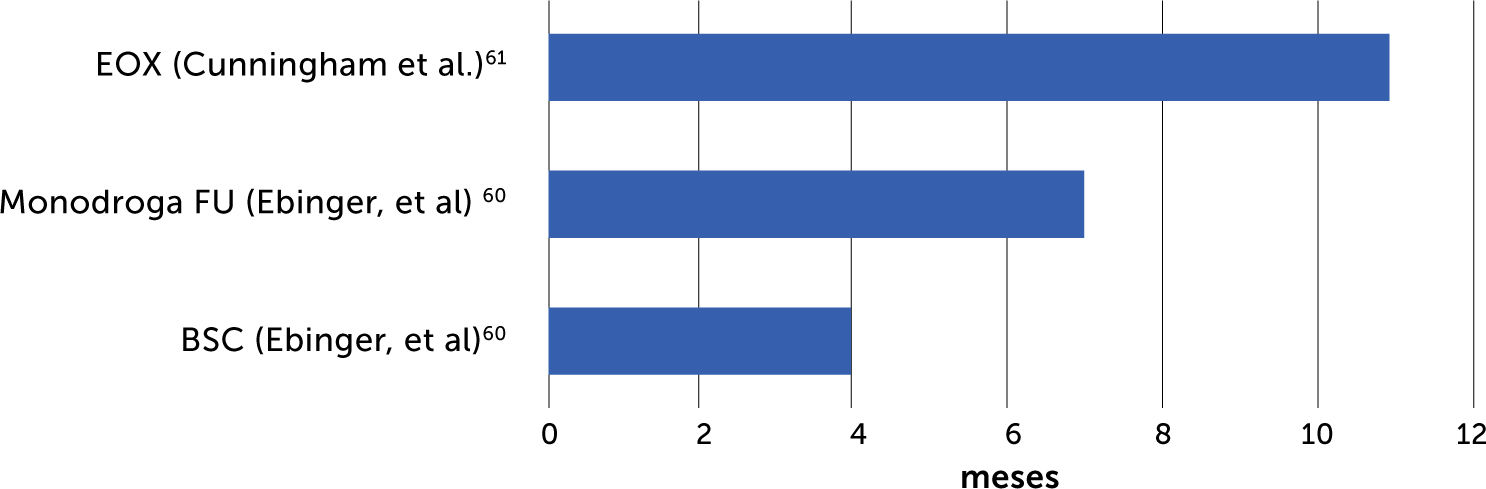
Por otra parte, y de acuerdo con Ebinger et al., en los pacientes con cáncer gástrico, entre el 38% y el 80% debutará con enfermedad irresecable o metastásica o bien se convertirá en metastásico en el transcurso de la evolución60.
Hasta hace poco tiempo atrás, para los pacientes con cáncer gástrico irresecable o metastásico, solo existían los cuidados paliativos o bien la quimioterapia paliativa que lograba aumentar escasamente el tiempo de sobrevida. Es de importancia señalar que, en los pacientes incurables, la intensidad de la quimioterapia no debiera comprometer la calidad de vida.
En el gráfico 1 se puede apreciar las ganancias que se han obtenido desde el tiempo de los cuidados paliativos, la quimioterapia con monodroga hasta la quimioterapia asociada.
En los pacientes con enfermedad potencialmente resecable, el uso de quimioterapia perioperatoria ha mejorado considerablemente la mOS de ese grupo de pacientes que son tratados con quimioterapia basada en esquema FLOT (FU, oxaliplatino y docetaxel) en forma previa y luego de la cirugía62.
Los intentos de avance en la terapia de cáncer gástrico metastásico o irresecable, se han visto dificultado por la heterogeneidad intra-paciente en cáncer gástrico con discordancias que pueden llegar hasta un 32% al comparar el tumor primario con las metástasis63. Desgraciadamente y como veremos más adelante, no siempre la selección de los pacientes para los estudios ha considerado esta variabilidad de las características biológicas inter e intra-pacientes. Probablemente eso se deba a que los estudios recientemente publicados o presentados se iniciaron en épocas previas a este entendimiento biológico.
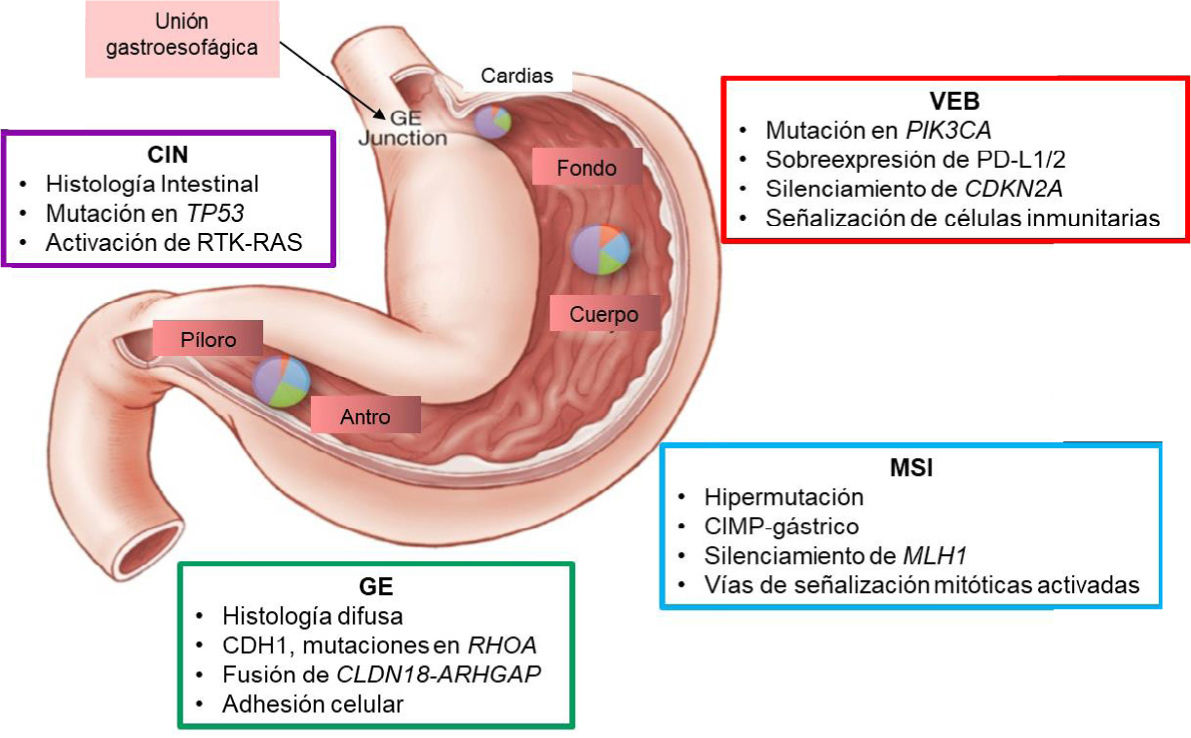
Lo mismo queda reflejado en la caracterización molecular de cáncer gástrico de TCGA publicado en Nature de 2014, por lo demás bastante coincidente con la clasificación molecular japonesa de la enfermedad y que nos ha permitido poder avanzar en el entendimiento de la biología y por tanto en mejorar las posibilidades terapéuticas de esta enfermedad64,65 (Fig. 3).
Los cuatro subtipos moleculares del adenocarcinoma gástrico descritos en el estudio TCGA, sus patrones mutacionales y ubicación. Abreviaturas: CIN: inestabilidad cromosómica; VEB: virus de Epstein-Barr; GE: unión gastroesofágica; GE: genómicamente estable; MSI: inestabilidad microsatelital. Este esquema describe algunas de las características más destacadas asociadas con cada uno de los cuatro subtipos moleculares de cáncer gástrico. La distribución de subtipos moleculares en tumores obtenidos de distintas regiones del estómago se representa mediante gráficos insertados. Traducido con licencia (CC BY-NC-SA 3.0) sin modificaciones de: Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014;513(7517):202-9. doi: 10.1038/nature13480. (Ref.64).
No queda duda que era y es urgentemente necesario contar con nuevas formas de tratamiento, pero no fue sino hasta 2010 cuando se produce la publicación de un artículo seminal para el tratamiento de cáncer gástrico avanzado. En efecto, en ese año se publica el estudio ToGA que aleatorizó a pacientes con cáncer gástrico avanzado o irresecable HER2 sobreexpresado, ya sea por inmunohistoquímica o por FISH, a recibir quimioterapia basada en fluoropirimidinas (FU o capecitabina) más o menos trastuzumab66, siguiendo el ejemplo de cáncer de mama, que mostró excepcionales resultados con el bloqueo de esta proteína.
El estudio ToGA fue un estudio fase III aleatorizado, controlado, de etiqueta abierta en pacientes con sobreexpresión de HER2. Los pacientes recibieron quimioterapia con capecitabina o FU más cisplatino, o bien la misma quimioterapia más trastuzumab. La mOS en el grupo de quimioterapia sola fue de 11,1 meses en comparación con 13,8 meses en el grupo con trastuzumab, con un HR de 0,74, con un valor de p igual a 0,004666. Este estudio estableció al menos dos cosas importantes: 1) La incidencia de la sobreexpresión de HER2 en cáncer gástrico, esófago y unión gastroesofágica es de más o menos un 22%, con variaciones de acuerdo con las localizaciones anatómicas67; 2) El uso de trastuzumab se asoció a un beneficio que, aunque modesto, marcó un antes y un después en el manejo del cáncer gástrico, clasificándolo en HER2+ y HER2-.
Con posterioridad se han hecho una serie de estudios con trastuzumab, como molécula base todos los cuales han fallado en mostrar un beneficio de la combinación de anti-HER2 más quimioterapia en comparación con quimioterapia sola.
Es lo que sucedió al comparar capecitabina mas oxaliplatino vs la misma quimioterapia más lapatinib en primera línea, que, si bien muestra un mayor porcentaje de respuesta, no mostró diferencias en sobrevida con un valor de p de 0,35, en el estudio TRIO-013/LOGiC68.
Semejante situación sucedió en el uso de paclitaxel más o menos lapatinib en terapia de segunda línea con paclitaxel mas lapatinib con un HR de 0,20 en el estudio TyTAN69.
El estudio GATSBY comparó el uso de TDM-1, un compuesto que conjuga el anticuerpo monoclonal de trastuzumab con el agente de quimioterapia, emtansina, contra paclitaxel en segunda línea de terapia para pacientes con cáncer gástrico, mostrando un efecto detrimental con -0,7 meses de sobrevida para los pacientes que recibieron TDM-1, con un HR de 0,8570.
Siguiendo lo que en cáncer de mama había sido exitoso, se combinó, en el estudio JACOB, trastuzumab mas pertuzumab, otro mAb anti-HER2 con cisplatino más una fluoropirimidina con un HR de 0,056 con una ventaja de 3,3 meses para la combinación de trastuzumab, pertuzumab y quimioterapia en comparación con el mismo esquema sin pertuzumab, con una mayor toxicidad en la combinación con pertuzumab en pacientes con cáncer gástrico o con cáncer de la unión gastroesofágica metastásicos con HER2+71.
Afortunadamente esta racha de malos resultados termina 10 años después de la publicación del ToGA, con el uso de trastuzumab-deruxtecan (T-DXd), un nuevo agente conjugado de trastuzumab más una carga de quimioterapia con una topoisomerasa I, en pacientes con al menos dos líneas de tratamiento previo, incluyendo trastuzumab, en lo que se conocen como estudios DESTINY-Gastric01 en países asiáticos72 y DESTINY- Gastric02 en países occidentales73.
El primero de ellos, en paciente con cáncer gástrico o de la unión gastroesofágica, avanzado, que expresan HER2 y con al menos ≥de dos líneas de terapia previa que debían incluir fluoropirimidinas y platinos, y que habían progresado con trastuzumab, fueron aleatorizados a recibir T-DXd o quimioterapia a elección del investigador, ya sea irinotecán o paclitaxel de una forma 2:1. El objetivo primario del estudio fue la tasa de respuesta general (ORR, por sus siglas en inglés) determinada por el investigador. La ORR fue 51,3% en el grupo de T-DXd comparado con un 1,3% de los pacientes que recibieron quimioterapia. La mOS fue de 12,5 meses para los pacientes con T-DXd en comparación a 8,4 meses del grupo de quimioterapia, con un HR de 0,5972. Eso ha hecho que esté compuesto haya sido aprobado para el tratamiento de cáncer gástrico avanzado en distintos países del mundo.
Por su parte, el estudio DESTINY-Gastric02 es un estudio fase II de una sola rama en el que pacientes con cáncer gástrico metastásico o irresecable con enfermedad HER2 positiva (inmuno histoquímica (IHQ) +++ o IHQ ++ ISH +) confirmada en laboratorio central, después de la progresión a una primera línea con trastuzumab, fueron tratados con T-DXd cada tres semanas. Un 38% de los pacientes mostró respuesta objetiva, y un 3,8% respuesta completa73 (Tabla 1).
Resumen de los estudios clínicos publicados de tratamientos de cáncer gástrico
| Estudio | Quimioterapia | Terapia blanco | HR para OS | Valor de p | Aumento de mediana de OS (meses) | Línea | Referencia |
|---|---|---|---|---|---|---|---|
| ToGA | cisplatino, FU/capecitabina | trastuzumab | 0,74 | 0,04 | +2,8 | primera | Bang, et al66 |
| LOGIC | oxaliplatino/ | lapatinib | 0,91 | 0,35 | +1,7 | primera | Hecht, et al68 |
| TyTAN | capecitabina | lapatinib | 0,84 | 0,001 | +2,1 | segunda | Satoh, et al69 |
| GATSBY | paclitaxel | TDM-1 | 1,15 | 0,85 | −0,7 | segunda | Thuss-Patience, et al70 |
| JACOB | TDM-1 vs. taxanos | trastuzumab y pertuzumab | 0,84 | 0,056 | +3,3 | primera | Tabernero, et al71 |
| DESTINY- | |||||||
| Gastric01 | cisplatino, FU/cape | trastuzumab deruxtecan | 0,59 | 0,01 | +4,1 | tercera | Shitara, et al72 |
| DESTINY- | |||||||
| Gastric02 | paclitaxel o irinotecán | trastuzumab deruxtecán | Van Cutsem, et al73 |
Hay un creciente interés en el uso combinado de trastuzumab mas CPI (inhibidores de puntos de control) o terapia inmune, debido a la observación de que el sistema inmune contribuye a los efectos terapéuticos de los anticuerpos anti-HER2 y que el tratamiento con trastuzumab puede aumentar la expresión de PD-L174. Además, el estudio PANACEA en cáncer de mama parece haber confirmado esta hipótesis75.
Eso ha sido en parte el racional para combinar trastuzumab, pembrolizumab y quimioterapia con oxaliplatino y capecitabina.
En un pequeño estudio fase II en pacientes HER2+, ellas recibieron ese tipo de tratamiento, con un objetivo primario de la PFS a 6 meses. EL 70% de los pacientes estaban vivos y libre de progresión a los 6 meses y la mPFS fue de 13 meses y la mOS de 27,3 meses. Todos los pacientes presentaron reducción de la enfermedad y la ORR fue de 91% en los pacientes con enfermedad medible, algo inédito en cáncer gástrico avanzado76.
Estos resultados se están confirmando en el estudio KeyNote 811, un estudio fase III a nivel mundial, en el que pacientes con HER2+, con cáncer gástrico o de la unión gastroesofágica, sin terapia previa, has sido aleatorizados a recibir quimioterapia mas trastuzumab, o bien, el mismo tratamiento más pembrolizumab. Recientemente en el congreso de ASCO 2021 se conocieron los resultados preliminares de respuesta de los primeros 264 participantes del estudio La ORR en la rama con pembrolizumab fue de 74,4% incluyendo un 11% de respuestas completas. En la rama de control la ORR fue 51,9% con un porcentaje de respuestas completas de un 3% La mediana de duración de la respuesta fue de 10,6 meses vs 9,5 meses respectivamente. En el futuro próximo esperamos poder tener resultados más acabados de este estudio77.
Margetuximab es una clase diferente de anti-HER2, que ha recibido un manejo de ingeniería de fragmento cristalizable (Fc) y que ha sido diseñado para potenciar más efectivamente la inmunidad innata en relación a trastuzumab. En un estudio combinado con pembrolizumab produjo una mejoría de la respuesta en pacientes previamente tratados con una ORR 28% en pacientes con HER2 sobreexpresado78.
Todo lo anterior más la importante cantidad de compuestos que se vislumbran en el futuro inmediato como mediato para el tratamiento de cáncer gástrico metastásico o irresecable HER2+, producen optimismo sobre el futuro de estos pacientes.
4.1Cáncer gástrico HER2 negativo (HER2-)Este grupo de pacientes que representa más del 70% de todos los cánceres gástricos avanzados, no ha tenido un desarrollo terapéutico tan importante como el HER2+. La quimioterapia persiste siendo la única herramienta para este grupo de pacientes que, probablemente se irá subdividiendo en otros subgrupos que puedan ser tributarios de terapias más específicas según los resultados del TCGA.
La inmunoterapia como agente único ha mostrado resultados muy modestos en cáncer gástrico avanzado HER2-, como se vio en el estudio fase II KeyNote-059 usando pembrolizumab, con tasas de respuestas objetivas del orden de 12% con un 2,3% de respuestas completas, con una mediana de duración de la respuesta de 8,4 meses, cifras que son evidentemente pobres para poder llegar a una curación de la enfermedad o al menos a una paliación prolongada79.
El estudio ATTRACTION-2, un estudio fase II, en pacientes asiáticos, con al menos dos líneas de terapia previas, comparó nivolumab vs. placebo. Nivolumab mostró una mOS de 5,26 meses en comparación a placebo que tuvo una mOS de 4,14 meses, que, aunque estadísticamente significativo, es clínicamente poco eficiente en términos de costo-efectividad80.
Recientemente se ha presentado y publicado el primer estudio positivo en este grupo de pacientes, el CheckMate 649, basado en el beneficio en OS de nivolumab, otro anticuerpo anti-PD-1, sobre placebo. El estudio selecciono pacientes con cáncer gástrico o gastroesofágico metastásico o irresecable HER2- y sin importar la expresión de PD-L1 en un inicio, (luego fue modificado a pacientes con CPS ≥5), que fueron aleatorizados a recibir quimioterapia con fluoropirimidinas mas oxaliplatino más o menos nivolumab. Una tercera rama de comparación, sin quimioterapia y tratamiento con un combo de nivolumab mas ipilimumab, debió suspenderse por toxicidad y aumento de la mortalidad precoz. Los dos objetivos principales del estudio fueron PFS y OS. Con una mediana de seguimiento de 13,1 meses, la mOS para los pacientes con CPS ≥5 fue de 14,4 meses en comparación con 11,1 meses para la rama de control con un HR de 0,71. La mPFS en pacientes con CPS ≥5 fue de 7,7 meses en comparación con 6,05 meses en la rama de control. Ello convierte a este estudio en el primero en ser positivos, luego de muchos años, en pacientes HER2-81. Una posterior actualización del estudio presentada en el congreso de ESMO 2021, mostró una sobrevivencia a 24 meses fue de 31% en la rama quimio inmuno vs. 19% en la rama de quimio sola. En todos los pacientes aleatorizados la mOS fue de 13,8 meses en nivo-quimio vs 11,6 meses en la rama de quimio sola con HR de 0,7982.
Sin duda, el tener un estudio positivo en cáncer gástrico HER2- es algo de relevante importancia, ya que abre avenidas de investigación para llegar a obtener nuevas terapias para una enfermedad que causa gran mortalidad. Sin embargo, debemos convenir que el aumentar la mOS 3,3 meses en los pacientes seleccionados por CPS >5, es solo un avance modesto dentro de lo que necesitamos para nuestros pacientes. Deben existir subpoblaciones que beneficien más de la terapia con nivolumab. Una de esas subpoblaciones es, al igual que en cáncer de colon y recto, la que tiene dMMR (o MSI-H) que presentan una mOS de 38,7 meses con la combinación de nivolumab mas quimioterapia vs 12,3 meses para los pacientes tratados solo con quimioterapia, con un HR de 0,38. Los pacientes pMMR tienen resultados semejantes a la de toda la población aleatorizada18.
Otros estudios también muestran que MSI-H es factor que predice mucho más adecuadamente para la respuesta a terapia inmune. Sin embargo, los pacientes que son MSI-H son una gran minoría, por lo que es indispensable poder ir más en profundo en la biología para encontrar nuevos marcadores que ayuden a una mejor selección de pacientes para esta terapia que puede ser tóxica tanto orgánica como económicamente83.
En cáncer de esófago epidermoide, donde la quimioterapia basada en fluoropirimidinas y platinos ha sido el estándar de tratamiento para los pacientes metastásicos o irresecables, el estudio KeyNote 590 abrió una luz esperanzadora. En efecto, es este estudio internacional, fase III aleatorizado, controlado contra placebo, doble ciego, en pacientes con cáncer de esófago no resecable o metastásico (92% de los pacientes aleatorizados), o de la unión gastro-esofágica Siewert tipo 1, independiente del estado de PD-L1, adenocarcinoma o carcinoma epidermoide (73% del total de los pacientes tratados tenían histología epidermoide), que no pudiesen ser tratado con radioterapia o radioterapia más quimioterapia fueron asignados a recibir quimioterapia con FU más cisplatino más placebo o bien la misma quimioterapia más pembrolizumab. En el primer análisis interino, pembrolizumab mas quimioterapia demostró una mayor OS (objetivo primario) en pacientes con cáncer de esófago epidermoide y PD-L1 CPS de 10 o más con un HR de 0,57 y con mediana de sobrevida de 13,9 meses vs 8,8 meses en la rama de control, con un p altamente significativo. Eso no fue así en pacientes con CPS menor de 10. En el grupo de pacientes con adenocarcinoma (minoría de los pacientes) sobrevida fue mayor en la rama experimental (mOS 11,6 meses vs. 9,9 meses en la rama de control con un HR de 0,74 (CI 0,54-1,02) lo que no es significativo84.
Para los interesados en tener una visión más panorámica del uso de terapia CPI en cáncer gastroesofágico es recomendable una revisión de Smyth, et al., que revisa los últimos avances en cáncer de esófago y esófago-gástrico con el uso de CPI85.
Otra avenida, hasta ahora de buenos frutos en cáncer gástrico avanzado, es el uso de claudina 18.2 como blanco terapéutico. Dicha proteína se encuentra en el complejo supramolecular de las uniones estrechas intercelulares, lo que la hace inaccesible, en tejido normal, al uso de anticuerpos monoclonales. Ello, sin embargo, cambia en cáncer, ya que la transformación maligna expone los epitopes de claudina 18.2 en la superficie tumoral86.
El uso de zolbetuximab, un anticuerpo monoclonal que se une a claudina 18.2 en la superficie de las células tumorales induciendo apoptosis a través de en efecto mediado por citotoxicidad celular dependiente de anticuerpos (ADCC) y por citotoxicidad dependiente de complemento (CDC). El uso de este mAb como agente único, en pacientes con cáncer gástrico o gastro-esofágico avanzado, con varias líneas de terapias previas, y con expresión ≥50% de claudina 18.2, produjo una respuesta de 9% y un 14% de beneficio clínico, lo que lo hizo tributario de mayor desarrollo87.
El estudio FAST aleatorizó pacientes a recibir esquema de quimioterapia EOX (epidoxorubicina, oxaliplatino y capecitabina) vs el mismo esquema de quimioterapia más zolbetuximab. En los pacientes con expresión moderada a fuerte de claudina 18.8 en la inmunohistoquímica, en más del 70% de las células, en primera línea de terapia, hubo un beneficio significativo tanto en mPFS (7,5 meses (95% CI, 5,6-11,3) con zolbetuximab+EOX y 5,3 meses (95% CI, 4,1-7,1) con EOX.), así como también en mOS (13,0 (95% CI, 9,7-18,7) versus 8,3 (95% CI, 6,9-10,2) meses; HR, 0,55; 95% CI, 0,39-0,77; p <0.0005)88.
Recientemente, un grupo de investigadores chinos presentó el uso de tecnología CAR-T cells para claudina 18.2, con resultados muy prometedores, en pacientes con cánceres digestivos89.
Se ha tratado de ofrecer una visión integral del pasado y del presente en el tratamiento de cáncer de colon y recto y gastroesofágico avanzado. Por la extensión del tema, es necesariamente limitado, y se centró en los marcadores de las enfermedades que están mostrando caminos a seguir en el desarrollo de nuevas terapias que mejoren, en la medida que entendamos mejor la biología de las enfermedades, la sobrevida de nuestros pacientes. Los avances actuales nos hacen ser esperanzados de que eso está ocurriendo y seguirá siendo aún mejor en el futuro cercano.
Declaración de conflicto de interésEl autor declara no tener conflictos de intereses.
Referencia no citada[61].