La medicina de precisión en enfermedades alérgicas se aplica tanto en el diagnóstico como en el tratamiento de las mismas: la pesquisa de inmunoglobulina (Ig) E específicas contra componentes alergénicos moleculares, aporta al diagnóstico, evaluación de riesgo y pronóstico de los pacientes. En cuanto al tratamiento de enfermedades como asma alérgica, dermatitis atópica o urticaria, se ha incorporado al arsenal terapéutico, el uso de anticuerpos monoclonales que intervienen en puntos específicos de regulación de la respuesta inmune alérgica.
En la siguiente revisión, describiremos aspectos generales y recientes de la medicina de precisión tanto en el diagnóstico como en el tratamiento de las principales enfermedades alérgicas por las cuales consultan los pacientes
Precision medicine in allergic diseases applies to diagnosis and treatment: specific IgE against molecular allergens, helps to diagnosis, risk assessment, and to establish prognosis. Monoclonal antibodies, interfering in specific allergy regulatory pathways have recently been included in the treatment of allergic asthma, atopic dermatitis and urticarial.
In the following review, we will describe general and recent aspects of precision medicine both in the diagnosis and in the treatment of the main allergic diseases for which patients consult.
La medicina de precisión en alergología ha permitido realizar una mejor fenotipificación de los pacientes, promoviendo tratamientos personalizados. La revolución tecnológica en las áreas de la biología molecular y estructural ha logrado la purificación, secuenciación, clonación y producción masiva de moléculas alergénicas y sus isoformas, con un significativo impacto no solo en el diagnóstico y manejo de los pacientes con enfermedades alérgicas, sino que también en la comprensión de los mecanismos fisiopatológicos de éstas.
Conocer las moléculas exactas a las cuales los pacientes se sensibilizan, ha permitido avanzar progresivamente en el uso de alergenos recombinantes para el diagnóstico, tanto in vivo como in vitro, estableciendo pronósticos más precisos de acuerdo a estos perfiles de sensibilización1.
Tradicionalmente el diagnóstico de las enfermedades alérgicas de perfil inmediato se basa en la pesquisa de IgE específicas contra el alergeno sospechoso, mediante técnicas in vivo (prick test) o in vitro. La composición y cantidad de alergenos en los extractos alergénicos usados en el diagnóstico presentan una gran variabilidad cualitativa y cuantitativa entre diferentes productores, dadas las distintas fuentes de obtención, métodos de extracción y purificación de los alergenos.
El diagnóstico molecular o por componentes alergénicos, permite mejorar la sensibilidad y especificidad del estudio, además de entregar información sobre los riesgos, reactividad cruzada entre distintas fuentes alergénicas (diferenciando la sensibilización primaria versus la reacción cruzada en pacientes polisensibilizados) y el pronóstico1,2.
La inmunoterapia alergeno-específica (IT) es una modalidad de terapia de precisión utilizada hace ya muchas décadas. Este enfrentamiento constituye el único tratamiento médico que posee la capacidad de cambiar la historia natural de las enfermedades alérgicas, así como evitar la progresión de la severidad de éstas3. Consiste en la administración del alergeno en dosis creciente y sostenida, con el objetivo de generar tolerancia inmunológica, vía anticuerpos neutralizantes de tipo IgG4 y cambio de linfocitos a un fenotipo tolerogénico. Esta terapia puede realizarse vía subcutánea, sublingual, oral entre otras4. El diagnóstico por componentes alergénicos ha permitido mejorar notablemente las indicaciones de inmunoterapia y establecer pronósticos más claros de las mismas5.
2Componentes alergénicos: nomenclatura y caracteristicas básicasLa convención existente para la nomenclatura de componentes alergénicos se basa en el nombre latino de la fuente. Las primeras 3 letras se derivan del género, seguido de 1 letra para indicar la especie, mientras que el número al final sirve para distinguir alergenos de la misma fuente. Ejemplo: el alergeno del gato (felis domesticus) Fel d 1.
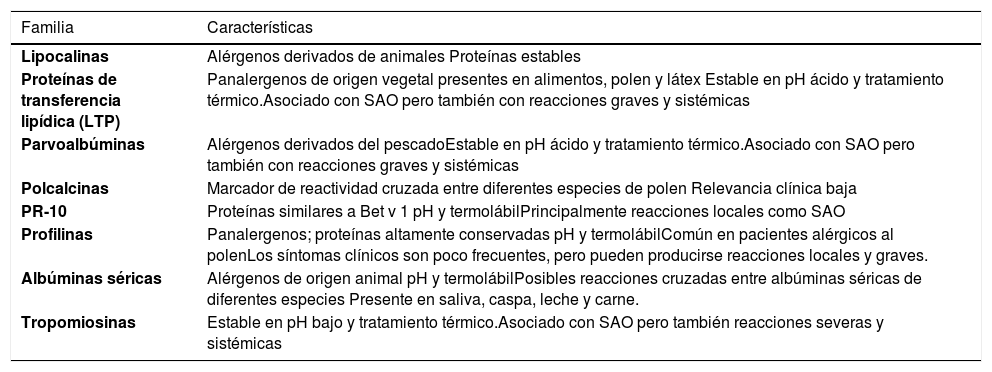
Otra clasificación de las moléculas alergénicas agrupa las diferentes familias de proteínas, basado en su estructura y función (Tabla 1). Este tipo de clasificación ayuda a predecir la probabilidad de desarrollar reacciones locales versus sistémicas5,6.
Características generales de las familias proteicas más comunes
| Familia | Características |
|---|---|
| Lipocalinas | Alérgenos derivados de animales Proteínas estables |
| Proteínas de transferencia lipídica (LTP) | Panalergenos de origen vegetal presentes en alimentos, polen y látex Estable en pH ácido y tratamiento térmico.Asociado con SAO pero también con reacciones graves y sistémicas |
| Parvoalbúminas | Alérgenos derivados del pescadoEstable en pH ácido y tratamiento térmico.Asociado con SAO pero también con reacciones graves y sistémicas |
| Polcalcinas | Marcador de reactividad cruzada entre diferentes especies de polen Relevancia clínica baja |
| PR-10 | Proteínas similares a Bet v 1 pH y termolábilPrincipalmente reacciones locales como SAO |
| Profilinas | Panalergenos; proteínas altamente conservadas pH y termolábilComún en pacientes alérgicos al polenLos síntomas clínicos son poco frecuentes, pero pueden producirse reacciones locales y graves. |
| Albúminas séricas | Alérgenos de origen animal pH y termolábilPosibles reacciones cruzadas entre albúminas séricas de diferentes especies Presente en saliva, caspa, leche y carne. |
| Tropomiosinas | Estable en pH bajo y tratamiento térmico.Asociado con SAO pero también reacciones severas y sistémicas |
Abreviaturas: SAO: síndrome de alergia oral.
La alergia al veneno de abejas, avispas, abejorros y, en algunos países, hormigas, es la principal causa de anafilaxia en adultos7. El veneno de estos insectos es una mezcla compleja de sustancias de bajo peso molecular (aminas biógenas, péptidos básicos, toxinas) y de proteínas de mayor peso molecular. Los principales alergenos de los venenos son proteínas con actividad enzimática como fosfolipasas y hialuronidasas1,7. La tecnología recombinante ha permitido identificar dentro de los alergenos del veneno de abejas, 5 alergenos mayores (a los cuales más del 50% de los individuos alérgicos está sensibilizado): Api m 1 (fosfolipasa A2), Api m 2 (hialuronidasa), Api m 3 (fosfatasa ácida), Api m 5 (dipeptidilpeptidasa IV) y Api m 10 (icarapina). En el veneno de avispas predomina la alergia a la fosfolipasa A1 (denominada Ves v 1 en el caso de chaquetas amarillas o Pol d 1 si es veneno de polistes) y el antígeno 5 (Ves v 5 o Pol d 5)7.
Los pacientes con reacciones graves causadas por el veneno de estos insectos deben ser tratados con IT subcutánea. Existen ocasiones en las que la decisión del tipo de veneno a utilizar, abeja versus avispa, puede verse dificultada: cuando el paciente no ha visto o no reconoce el insecto que lo picó, o cuando el paciente asegura tener reacciones con ambos. Esto se complica más aún si en estos casos tenemos en el estudio inicial IgE específicas positivas para ambos extractos de veneno entero; con las técnicas tradicionales no es posible diferenciar si se trata de verdaderas co-sensibilizaciones o de una reactividad cruzada sin relevancia clínica. Es en estos casos en los que el diagnóstico molecular tiene su mayor relevancia pues nos permite:
- 1.
Definir cuál es el veneno relevante para la IT, pesquisando la sensibilización a alergenos especie-específicos (Apim 1, Api m 3, Api m 4 y Api m 10 en el caso de abejas y Ves v 1 o Ves v 5 en el caso de avispa)7.
- 2.
Definir cuál reactividad cruzada entre venenos es clínicamente relevante:
- a.
La gran mayoría de las reacciones cruzadas entre veneno de abeja y avispa se deben a la presencia de IgE específicas clínicamente irrelevantes, dirigidas contra determinantes de carbohidratos (CCD) presente en ambos venenos. Las modificaciones de glicanos presentes en los insectos y ausentes de los carbohidratos humanos, los hacen muy inmunogénicos.
- b.
La presencia de IgE específicas contra Api m 2, Ves v 2, o Pol d 2 (hialuronidasas) en general indica una reactividad cruzada a nivel serológico, pero solo es clínicamente relevante en alergia a veneno de abeja.
- c.
La reactividad cruzada dada por alergenos homólogos en ambos tipos de veneno, como la dipeptidilpeptidasa IV (Apim 5, Ves v 3 y Pol d 3) indica alergia a ambos himenópteros.
- a.
El diagnóstico por componentes también nos permite establecer los riesgos específicos y pronóstico en cada paciente: un paciente con IgE específicas positivas para Api m 4, tienen mayor riesgo de presentar reacciones sistémicas durante la fase de ascenso de la IT en tanto que los pacientes sensibilizados a Api m 10, poseen mayor riesgo de no responder a esta inmunoterapia, dado que este alergeno está escasamente representado en el extracto1,7.
4Alergia alimentariaDurante las últimas décadas, se ha constatado un incremento sostenido de la incidencia de alergia alimentaria (AA): Se reporta una prevalencia de AA en niños de 10% en Australia y 1 a 5% en Europa y EE.UU. En adultos alcanza un 4% en EE.UU.8.
El diagnóstico de AA tradicionalmente se basa en la historia clínica, tests cutáneos y determinación de IgE específica a los alimentos sospechosos, lo cual determina la sensibilización a un alimento en particular. Por su parte, el test de provocación oral a alimentos es el método que confirma el diagnóstico de AA, sin embargo, éste no está exento de riesgos, es por esto que se han buscado nuevos biomarcadores que se correlacionen con un test de provocación oral positivo.
A modo general, un alimento posee varios componentes proteicos alergénicos diferentes que se relacionan con severidad y reactividad cruzada entre ellos. La medicina de precisión en AA busca estudiar el patrón de sensibilización de los pacientes con el fin de determinar presencia de IgE específicas dirigidas a aquellos componentes de mayor o menor riesgo de reacciones severas. Esto nos permite indicar el grado de evitación del alimento que el paciente debe realizar: por ejemplo, alimento completo versus trazas y tipo de evitación (por ej alimento cocido o crudo). Además, permite determinar la evolución e historia natural de cada paciente (resolución versus persistencia de la AA)5,8.
Algunos ejemplos relevantes del estudio molecular son: el síndrome de alergia oral (SAO) (prurito y/o edema de labios, boca o faringe frente a la ingesta de alimentos de origen vegetal) y la presencia de IgE específicas contra profilinas, que se asocia a reacciones leves y localizadas. En contraposición, la presencia de IgE contra proteínas de transferencia lipídica (LTP) y taumatinas se asocian a un mayor riesgo de reacciones anafilácticas.
Otros ejemplos importantes son:
Pru p 3 (LTP) se asocia a reacciones severas al durazno.
En el caso del maní, Ara h 2 y 6 se asocian a alergia alimentaria y reacciones severas anafilácticas, a diferencia de Ara h 8 que predice su tolerancia.
Bos d 8 (caseina de leche de vaca) y Gal d 1 (ovomucoide de huevo) son proteínas altamente termoestables, que se asocian a reactividad y persistencia de alergia a la leche de vaca y huevo cocido respectivamente9.
Por otra parte, Tri a 19 se asocia a reacciones severas al trigo, en relación con la realización de ejercicio.
En el caso de la avellana, en pacientes polínicos la presencia IgE específica contra Cor a 8, 9 y 14 se asocia a reacciones clínicas severas y permite diferenciar entre los pacientes sensibilizados (por reactividad cruzada con los pólenes) y los verdaderos alérgicos10.
En pacientes alérgicos al camarón, se ha determinado que la presencia de IgE anti Lit v 1,2,3, y 4 se asocia test de provocación oral positivo al camarón11.
El uso de otros métodos diagnósticos como el BAT (basophil activation test), que mide marcadores de activación del basófilo (CD 63 y 203c), podría ayudar a diferenciar entre sensibilización versus alergia, sin embargo, faltan estudios para masificar el uso de este método en AA.
Con respecto al tratamiento, la evitación del alimento ha sido el enfrentamiento clásico de ésta. Sin embargo, las dietas de exclusión de alimentos básicos y ubicuos como la leche, el huevo, el trigo, hacen difícil la adherencia y aun así se producen consumos accidentales asociados a reacciones severas en algunos casos. La inmunoterapia oral (ITO) en niños con alergia persistente al huevo y la leche ha logrado cambiar el umbral de reactividad, permitiendo el consumo de ciertas cantidades. Sin embargo, éste es un proceso largo que se puede asociar a reacciones severas, por lo que debe monitorizarse y ajustar los protocolos según cada paciente. La IT epicutánea también se ha realizado exitosamente para maní y leche, con menor tasa de efectos adversos12.
5Alergia a alergenos inhalatoriosLa alergia a aeroalergenos se asocia predominantemente con síntomas respiratorios, tanto de la vía aérea superior como inferior. Sin embargo, en ocasiones ocurre una sensibilización inicial, por vía inhalatoria, a panalergenos como profilinas o LTP, que posteriormente se traduce en síntomas orales tras la ingesta de alimentos vegetales5.
1.- Alergia a pólenes
La respuesta de IgE contra el polen de gramíneas (por ej, Phleum pratense) generalmente evoluciona de una etapa de sensibilización monomolecular simple a una oligomolecular y, finalmente a una polimolecular. Este fenómeno se ha definido como ‘propagación molecular’ (desarrollo secuencial de IgE a distintas moléculas que carecen de reactividad cruzada, perteneciendo a la misma fuente alergénica, comenzando con una molécula “iniciadora”). Phl p 1 corresponde a la molécula iniciadora en la mayoría de los pacientes, considerado esencial para establecer una verdadera sensibilización. La respuesta involucra sucesivamente a Phl p 5, el que posee valor pronóstico para indicar la gravedad de la enfermedad o una probable progresión de rinitis alérgica a asma bronquial. Posteriormente se observa la sensibilización a Phl p 12, alergeno perteneciente a la familia de las profilinas. En presencia de estos anticuerpos se debe investigar sobre el SAO desencadenado por la ingestión de profilinas de las frutas y verduras, con especial atención en la manzana, el apio en pacientes sensibilizados al abedul. Además, denota mayores antecedentes atópicos y/o una enfermedad de mayor duración. Finalmente, se observa la sensibilización a Phl p 7, polcalcina asociada con síntomas más graves, con mayor prevalencia de asma y una mayor frecuencia de comorbilidades alérgicas adicionales.
Aquellos pacientes que presentan sensibilización a panalergenos únicamente (Phl p 7/12) no son candidatos a IT alergeno-específica1,5.
2.- Alergia a ácaros
Los ácaros del polvo doméstico son uno de los alergenos más prevalentes, ocasionando síntomas durante todo el año. Este grupo incluye a los Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis y Euroglyphus maynei. En particular, las moléculas alergénicas Der p 1 y Der p 2 de Dermatophagoides pteronyssinus están altamente asociadas con síntomas de rinitis alérgica y asma bronquial, con una correlación significativa de dosis-respuesta6.
Por su parte, el recientemente descrito Der p 11 parece ser un marcador para identificar al subgrupo de pacientes alérgicos que presentan dermatitis atópica. En relación a la reactividad cruzada de éstos, se ha demostrado que la presencia de IgE anti Der p 10 se correlaciona con la sensibilización cruzada a alergenos del camarón, polilla y cucaracha (Penm 1, Ani s 3, y Bla g 7). A mayores niveles de IgE a rPen a 1 y rDer p 10, mayor es la correlación con test de provocación oral positivos al camarón5.
3.- Alergia a hongos
En relación a la alergia a hongos, es conocido que la exposición a alergenos micóticos en la infancia aumenta el riesgo de asma bronquial en niños en edad escolar, así como la severidad de ésta. La aspergilosis broncopulmonar alérgica (ABPA) afecta aproximadamente al 1-2% de los pacientes con asma y se asocia con exacerbaciones y empeoramiento de la función pulmonar. El diagnóstico molecular permite diferenciar entre pacientes asmáticos alérgicos a Aspergillus (IgE específicas contra Asp f 1 y Asp f 3) y pacientes con ABPA (IgE específicas contra Asp f 4 y Asp f 6). Por su parte, la Alternaria alternata presenta una alta tasa de afectación en pacientes con enfermedades alérgicas, predominando en ambientes exteriores. Alt a 1 es el alergeno principal, estando presente principalmente en la pared de esporas. La sensibilización a Alt a 1 se identifica en más del 90% de los pacientes. En estos momentos existe disponibilidad de Alt a 1 en forma aislada tanto para su uso en diagnósticos in vivo como en inmunoterapia y proporciona una alternativa a la variabilidad de extractos alergénicos completos de este hongo13.
4.- Alergia a mascotas
Los principales alergenos de los gatos son Fel d 1 y Fel d 4. Fel d 1 está asociado con la producción de hormonas y se encuentra principalmente en la saliva, glándulas sebáceas y en la orina de los machos. Las partículas transportadas de Fel d 1 pueden tener <5mm de diámetro; esto aumenta la probabilidad de alcanzar pequeños bronquiolos e inducir asma bronquial14.
Por su parte, los principales alergenos caninos corresponden a Can f 1 y Can f 5. Aunque pueden existir diferencias entre razas, todos los perros producen proteínas alergénicas que se encuentran en el epitelio, caspa, glándulas linguales, próstata y parótidas. El Can f 5, también conocido como calicreína prostática, está presente en cantidades significativas solo en machos no castrados. Un alergeno derivado del perro recientemente descubierto es Can f 6, que tiene una alta probabilidad de reacciones cruzadas debido a sus similitudes de secuencia con Fel d 4 y Equ c 1 (del caballo)6. La existencia de posibles reactividades cruzadas en pacientes sensibilizados a perros y gatos puede desencadenar SAO de difícil diagnóstico y manejo. En los pacientes alérgicos a los gatos, el principal síndrome de alergia alimentaria es el síndrome cerdo-gato, secundario a la reactividad cruzada de Fel d 2 con otras albúminas de mamíferos, lo que provoca reacciones anafilácticas tras consumir carne de cerdo, especialmente cruda o poco cocida. Otro síndrome es la “anafilaxia retardada debido a IgE a galactosa-alfa-1,3-galactosa (alfa-gal)”. En este caso, el epítope de carbohidratos alergénicos (alfa-gal) está presente en las IgA e IgM de gato (denominadas Fel d 5 y Fel d 6, respectivamente). Estos carbohidratos evocan síntomas alérgicos de inicio retardado después de la picadura de garrapatas, infusión de cetuximab y en la carne roja de mamíferos14.
6AnafilaxiaLas reacciones anafilácticas forman parte de los eventos inmunológicos agudos más graves, dado su potencial curso fatal. Es definida por la OMS como una reacción de hipersensibilidad sistémica severa, potencialmente mortal, caracterizada por un inicio rápido con compromiso de vía aérea, ventilatorio o circulatorio, potencialmente mortal.
Existen numerosos reportes que evidencian un alto porcentaje de subdiagnóstico de los cuadros anafilácticos, lo que retarda su manejo (aumentando así el riesgo de mala evolución). Por lo anterior, se requiere lograr una mayor precisión de los agentes causales, marcadores de riesgo frente a eventuales re-exposiciones, marcadores de respuesta a terapias y eventualmente, nuevos recursos terapéuticos.
En los últimos años se ha variado desde la definición clásica de anafilaxia, que la consideraba una entidad única, a una mirada más sindromática. Así, desde la perspectiva de la medicina de precisión, esta mirada ha propuesto fenotipos de presentación, con endotipos subyacentes y biomarcadores diagnósticos asociados15,16.
Los fenotipos de presentación clínica son: a) las reacciones de hipersensibilidad de tipo I, b) reacciones tipo tormenta de citoquinas y c) reacciones mixtas. Los endotipos subyacentes incluyen mecanismos IgE dependientes, IgE no dependientes, liberación de citoquinas, reacciones mixtas y activación directa de células. El fenotipo más conocido, con la clínica clásica, es el mediado por IgE, gatillado por alergenos ambientales, alimentarios, antibióticos, veneno de himenópteros, etc. Las células blanco son los mastocitos y basófilos, quienes liberan fundamentalmente histamina y triptasa. Se ha postulado que esta reacción podría también ser mediada por IgG, lo que aún no ha sido demostrado en humanos. El fenotipo de liberación de citoquinas estaría implicado frente a gatillantes como quimioterapia y anticuerpos monoclonales. En este caso las células blanco son los linfocitos T, macrófagos y monocitos, secretando predominantemente TNF alfa, IL-6 e IL-1 beta. En este mecanismo la clínica principal es fiebre, escalofríos, náuseas, cefalea, hipotensión y desaturación.
Los mismos gatillantes (quimioterapia y anticuerpos monoclonales) pueden desencadenar mecanismos mixtos, con una clínica a su vez mixta.
Finalmente, el último fenotipo es el que involucra la vía del complemento. Los gatillantes aquí son los medios de contraste, membranas de diálisis, glicosaminoglicanos, entre otros. Las cé-
lulas blanco son el mastocito y el basófilo, que por la vía del complemento liberan predominantemente histamina y triptasa. Los síntomas más frecuentes son hipotensión y desaturación. En este grupo se ha avanzado mucho en el diagnóstico de los desórdenes clonales de los mastocitos.
La epinefrina es el tratamiento agudo de elección en todos ellos. Frente a la sospecha de anafilaxia, uno de los biomarcadores más utilizados es la medición de triptasa, con niveles mayores a 11,4ng/ml que se asocian a activación aguda de mastocito (o aumento de 2ng/ml del nivel basal). Entre sus ventajas destaca su disponibilidad, elevada especificidad y su mayor duración en circulación. Corresponde a uno de los pilares en el estudio diagnóstico. Idealmente debe tomarse cercano a la reacción (dentro de las primeras 2 horas) y compararse también con los niveles basales.
En el fenotipo mediado por IgE, el desarrollo de los estudios moleculares antigénicos ha permitido predecir mejor el riesgo de futuras reacciones, su severidad y optimizar la decisión de terapias de desensibilización5,14.
Algunos ejemplos de componentes vegetales con riesgo de reacciones anafilácticas graves previamente mencionados son: en AA al maní: Ara h 2 y 6; soya: Gli m 5 y 6, trigo: Tri a 19 (anafilaxia inducida por ejercicio dependiente de trigo y alimentos). En fuentes antigénicas de origen animal, Gal d 1 del huevo se asocia con reacciones tanto al huevo crudo como cocido17,18.
7Anticuerpos monoclonalesLa incorporación de anticuerpos monoclonales a la terapia alergológica ha significado un avance significativo en la medicina personalizada y de precisión. El conocimiento cada vez más acabado de las vías de regulación de la respuesta inmune, ha permitido identificar un variado número de blancos para este tipo de terapia. En la Tabla 2 se resumen los principales anticuerpos monoclonales aprobados a la fecha en alergología, de uso habitual y sus indicaciones19.
Principales anticuerpos monoclonales en uso en enfermedades alérgicas (Ref.)19
| Molécula y vía de administración | Blanco | Acción | Usos clínicos |
|---|---|---|---|
| Omalizumab (sc) | IgE | Impide la unión de las IgE a sus receptores de alta y baja afinidadDisminuye el N° de receptores de IgE Disminuye la IgE libre | Asma bronquial Urticaria crónica |
| Mepolizumab (sc) Reslizumab (ev) | IL-5 | Impide su unión al receptor en eosinófilos y basófilos con lo cual se reduce la eosinofilia | Asma bronquial |
| Benralizumab (sc) | Receptor de IL-5 | Además de impedir la acción de la IL-5, aumenta la apoptosis de eosinófilos | Asma bronquial |
| Dupilumab (sc) | Subunidad alfa del receptor de IL-4/IL-13 | Bloquea la señalización de la IL-4 e IL-13 al bloquear la unión a su receptor | Dermatitis atópica Asma bronquialRinosinusitis crónica poliposa |
Abreviaturas: SAO: síndrome de alergia oral. (Ref.)19.
Además, los anticuerpos monoclonales se han utilizado como tratamiento adyuvante en pacientes altamente sensibilizados: el omalizumab, en forma combinada con las pautas de inmunoterapia subcutánea, sublingual u oral en el caso de alimentos, ha demostrado su capacidad de aumentar el umbral de tolerancia y disminuir la tasa de reacciones adversas12,20.
Existe una serie de otros anticuerpos monoclonales en diferentes fases de desarrollo, dirigidos contra puntos específicos de la cascada inflamatoria TH2: anti interleuquina (IL)13, anti IL-22, anti IL-33, anti linfopoyetina del estroma tímico (TSLP) e incluso anticuerpos más específicos anti Ara h 2 para tratar la alergia al maní (este último solo en modelo murino por ahora)19,21.
Declaración de conflicto de interésLas autoras declaran no tener conflictos de interés.