INTRODUCCION
La patología alérgica consiste en la reacción inmune producida por la puesta en contacto del individuo con un antígeno normalmente inocuo, como consecuencia de una desviación de la inmunidad natural, y una alteración de los mecanismos de protección corporales. Es una respuesta mediada por inmunoglobulina E (IgE), que condiciona en un segundo contacto la liberación de mediadores que desencadenan el cuadro clínico.
La clasificación de la patología alérgica es:
1. Alteración de vías respiratorias, la más frecuente en la edad pediátrica.
2. Alteración del tracto gastrointestinal (en forma de reacción de inflamación de parte alta, afectando a lengua, labios, o bien dolor abdominal, vómitos o deposiciones diarreicas en cuadros de anafilaxia gastrointestinal, malabsorción).
3. Reacción dérmica (anafilaxia, urticaria, angioedema o exacerbación de una dermatitis atópica ya establecida).
La prevalencia y gravedad de esta patología sigue incrementándose, desde la decada de 1970 (en las sociedades desarrolladas alcanza el 20 % de la población, mientras que en los países en vías de desarrollo estas enfermedades afectan entre 2,6 % y 6 % de la población). Este fenómeno es extrapolable a la población infantil.
Los factores etiopatogénicos implicados son:
1. La existencia de antecedentes familiares de enfermedad alérgica, implica una predisposición genética a padecer la enfermedad. De este modo el riesgo de una enfermedad poligénica en los familiares de primer grado es generalmente del 5 al 15 %.
Los genes o regiones implicados se están investigando actualmente en un total de 13 cromosomas humanos, encontrándose ligamiento y fuerte asociación en alelos de los cromosomas 5 y 11 así como de los cromosomas 6 y 14.
2. Se observan variaciones geográficas, relacionadas con factores ambientales, siendo reconocida como enfermedad de la civilización moderna. El incremento observado en las enfermedadades alérgicas que se ha producido en las últimas tres décadas, es demasiado rápido para ser atribuido a una mutación genética.
Las posibles influencias ambientales han sido ampliamente estudiadas:
a)La contaminación atmosférica.
b) Los alergenos domésticos.
c) La exposición al humo del tabaco tanto intraútero como en la infancia.
d) Las enfermedades infecciosas y las vacunas.
e) La dieta.
La respuesta alérgica depende de la IgE, iniciándose con la unión del alérgeno a la IgE que está fijada al receptor de alta afinidad localizado en la superficie del mastocito, desencadenando de este modo los síntomas de hipersensibilidad inmediata.
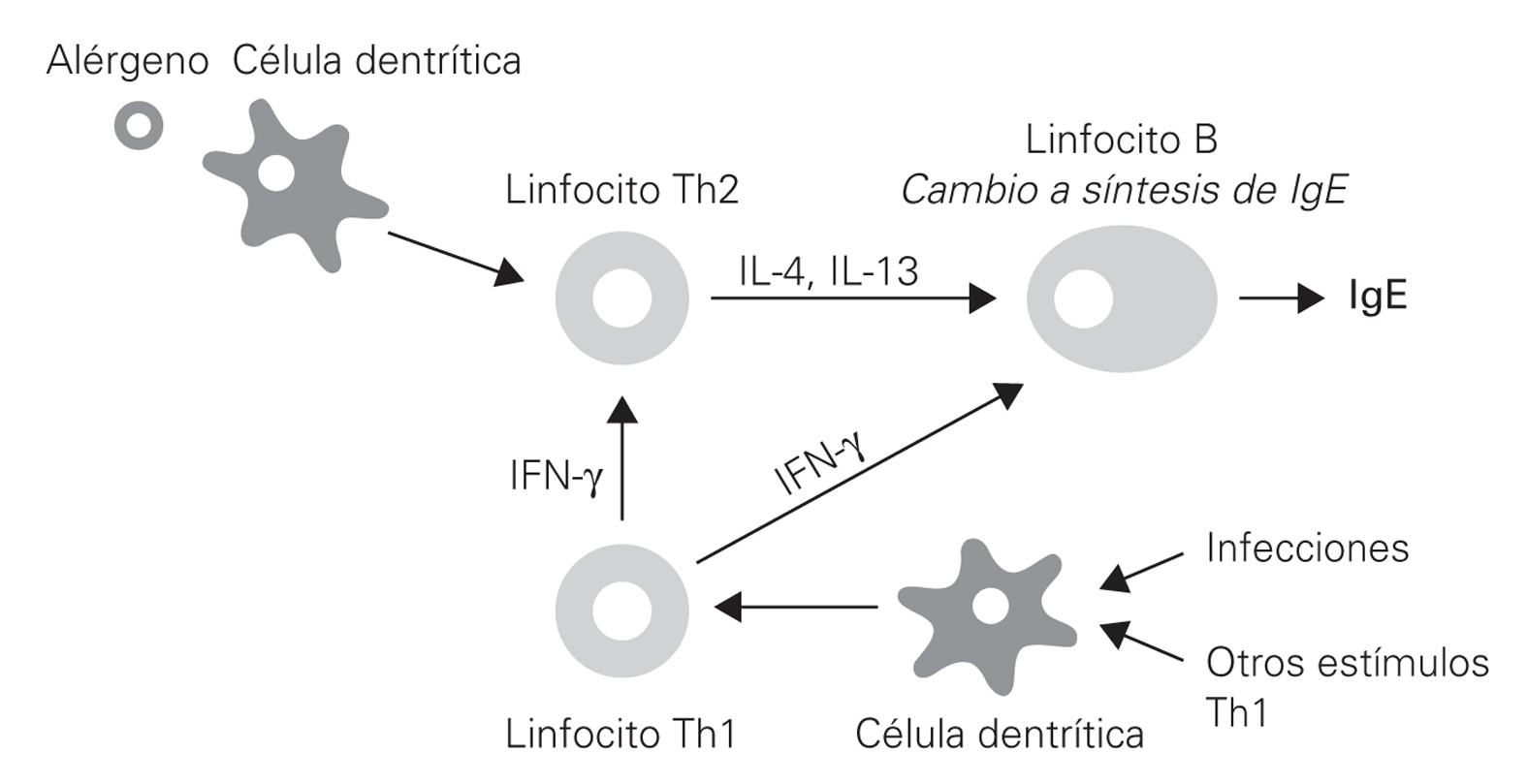
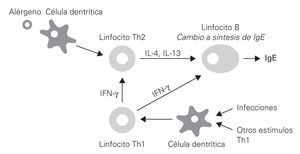
La producción de Ig E está regulada por dos tipos de sustancias producidas por lineas celulares diferentes; linfocitos Th 1 que producen IL 2 y el γ INF, que inhiben la producción de IgE por las células memoria; los linfocitos Th2, que producen IL 4, 10 y 13 que estimulan la producción de IgE, así como la IL 5 con función quimiotáctica de eosinófilos (fig. 1).
Figura 1.--Síntesis de IgE, regulación.
La IL 4 es producida por células T, eosinófilos, mastocitos y basófilos, y promueve la activación de células T y la diferenciación hacia el fenotipo Th2, así como la producción de IgE por las células B. La IL 10 es producida por células T, células B, macrófagos y monocitos e inhibe la proliferación de células T y regula a la baja la producción de citocinas proinflamatorias. La IL 13 producida por las células T y basófilos, promueve la producción de IgE por las células B.
El γ INF producido por células T, células NK, macrófagos y eosinófilos, inhibe las células Th2 e inhibe la diferenciación de células B.
Durante el embarazo, se produce un paso de células trofoblásticas del feto hacia la circulación materna. La madre presenta durante ese período un estado Th2 predominante y de este modo se previene el rechazo al aloinjerto fetal, mediado por una respuesta Th1. Este predominio Th2 supone una producción constante de IL 4 e IL 10 durante todo el embarazo; la IL 13 se produce en la placenta de la semana 16 a la 27, y por el feto de la 27 hasta la 37, donde decrece su producción hasta hacerse mínima en el recién nacido a termino. En el feto también existe un predominio de respuesta Th2 1-3.
En el momento actual, el único marcador fiable predictivo aceptado en la comunidad científica como válido para la detección del ulterior desarrollo de enfermedad alérgica es el aumento de IgE en sangre unido a la historia familiar de atopia (el aumento aislado de IgE sin enfermedad familiar de atopia, no es fiable).
El predominio de respuesta Th2 fetal que se ve acentuado en el caso de madres atópicas, debe implicar que la determinación de los valores cuantitativos de las sustancias implicadas en la respuesta Th2 deben estar directamente relacionadas con la susceptibilidad individual al desarrollo de enfermedad atópica, sirviendo por tanto como marcador precoz de alergia. Esto se puede correlacionar con la aparición posterior de alteraciones analíticas que se correspondan con aparición de sintomatología, mediante seguimiento posterior.
OBJETIVOS
Se plantean en este estudio un objetivo general, que consiste en la determinación de los valores de interleucinas en sangre de cordón en la población, y correlación con antecedentes familiares de enfermedad alérgica. Para ello relizaremos:
1. IL 4, IL 10, IL 13, γ INF en sangre de cordón de recien nacidos sanos, obteniendo valores normales para la población en estudio.
2. IL 4, IL 10, IL 13, γ INF en sangre de cordón de recién nacidos con historia familiar de atopia (respiratorio, dérmico, alergia a medicamentos) en primer grado.
MATERIAL Y MÉTODOS
Estudio de casos y controles, con un tamaño muestral de 70 niños, 47 en grupo control y en 23 grupo de estudio, en base a error a del 5 % y β del 20 %, con exposición en enfermos de 35 % y en no enfermos de 15 %, relación no enfermos/enfermos 1,9/1 y Odds Ratio de 5,05.
Los sujetos que entran en estudio son niños nacidos en el año 2002. Se solicita autorización paterna para la inclusión del recién nacido en el estudio tras una información detallada del mismo y firma de formulario de consentimiento.
1. El grupo control lo forman los recién nacidos a término sin historia familiar de atopia.
2. El grupo de estudio son recién nacidos con historia familiar de atopia en familiares de primer grado (padre, madre y hermanos).
3. Se excluyen del recién nacidos pretérmino (menos de 37 semanas de edad gestacional) y postérmino (más de 42 semanas de edad gestacional), así como parto traumático o con cualquier patología asociada.
Las variables que se analizan son las siguientes:
Marcadores clínicos. Historia clínica familiar en parientes de primer grado (padre, madre y hermanos) de enfermedad alérgica (respiratoria, digestiva, cutánea).
Marcadores bioquímicos. Il 4, 10 y 13, γ INF e IgE en sangre de cordón umbilical. Determinación cuantitativa de citocinas se realizará con los kits CLB, método ELISA (IL 4 sensibilidad 0,2 pg/ml; IL 10 sensibilidad 10 pg/ml; IL 13 sensibilidad 0,5 pg/ml; γ INF sensibilidad 1 pg/ml).
En el análisis de datos las variables citadas se procesarán mediante previa inclusión en una base de datos SPSS versión 11.5, procediéndose a su análisis estadístico:
RESULTADOS
Se ha obtenido los valores de sangre de cordón de IL 4, 10 y 13 así como de γ INF, correlacionando los datos con la existencia de antecedentes de enfermedad alérgica. No se han obtenido valores para IL 4 e IL 13, pero si para IL 10 y γ INF.
Relacionando valores en sangre de cordón con la existencia de antecedente familiar de enfermedad alérgica, se han encotrado para la IL 10 valores más altos en aquellos niños que presentan antecedentes familiares de enfermedad alérgica, pero no en todos los casos resulta significativa (tabla I):
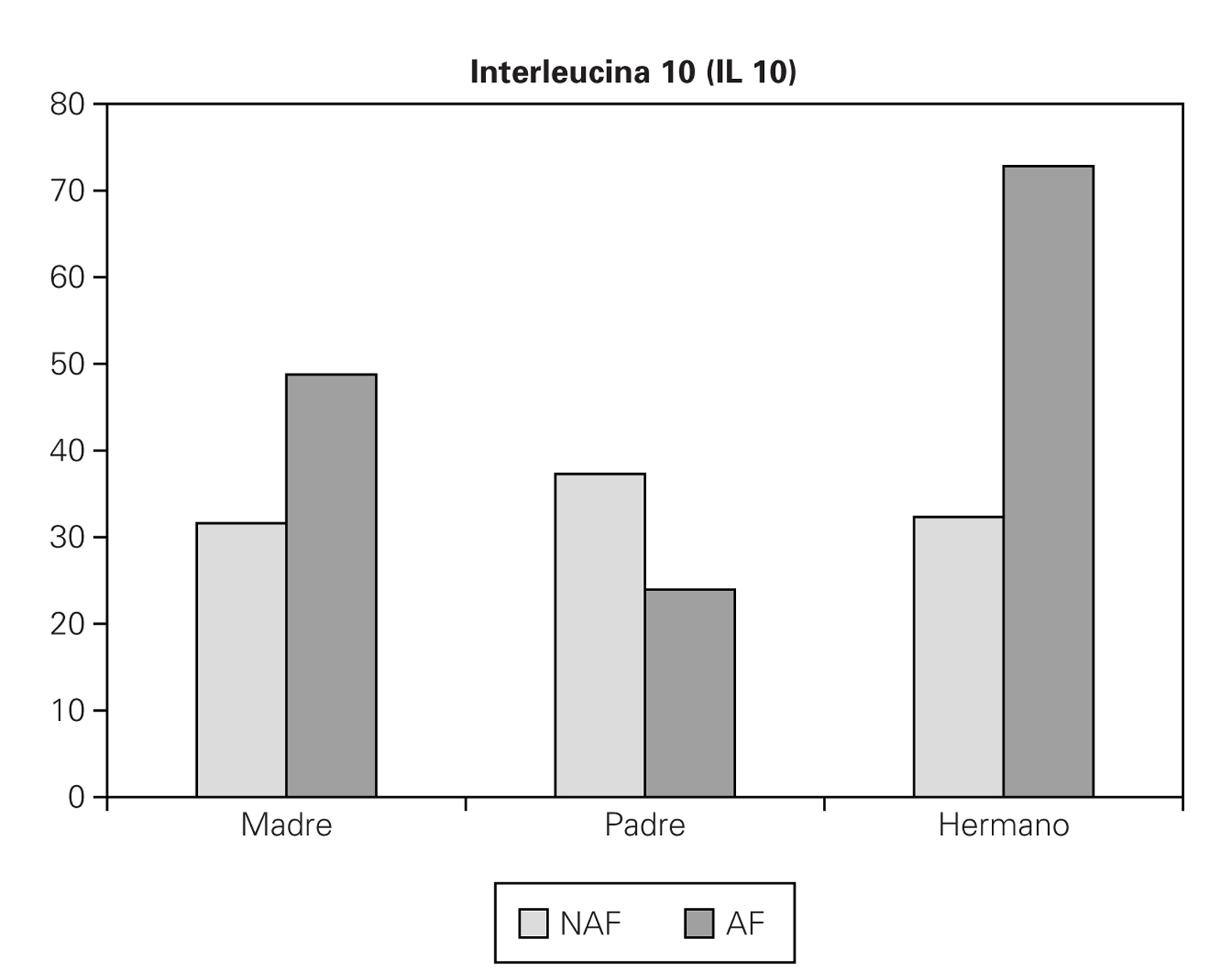
1. Hay nivel mayor de IL 10 en los niños con antecedente de enfermedad alérgica, pero no es significativo (p = 0,306) (no antecedente de enfermedad (NAF) 32,74 pg/ml, si antecedente de enfermedad (AF) 41,98 pg/ml).
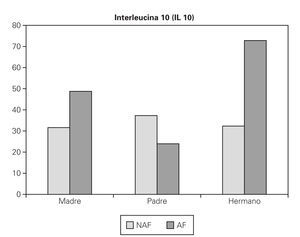
2. Si la madre es la que presenta la enfermedad, se obtiene un valor de IL 10 mayor (AF 48,75 pg/ml, NAF 31,62 pg/ml), pero no es significativa (p = 0,081) (fig. 2).
Figura 2.--Valores medios de IL 10 (pg/ml) teniendo en cuenta si hay antecedente familiar de enfermedad alérgica (AF: sí, NAF: no), y qué familiar es el que lo presenta.
3. Si es el padre el que presenta la enfermedad, curiosamente obtenemos un valor de IL 10 menor en estos niños (AF 23,94 pg/ml, NAF 37,3 pg/ml), pero no significativo (p = 0,316). (fig. 2).
4. Si es algún hermano el que presenta la enfermedad, se obtiene un valor muy superior de IL 10, frente a aquellos sujetos que no tienen hermanos afectos (AF 72,81 pg/ml, NAF 32,31 pg/ml), y si es significativo (p = 0,0062) (fig. 2).
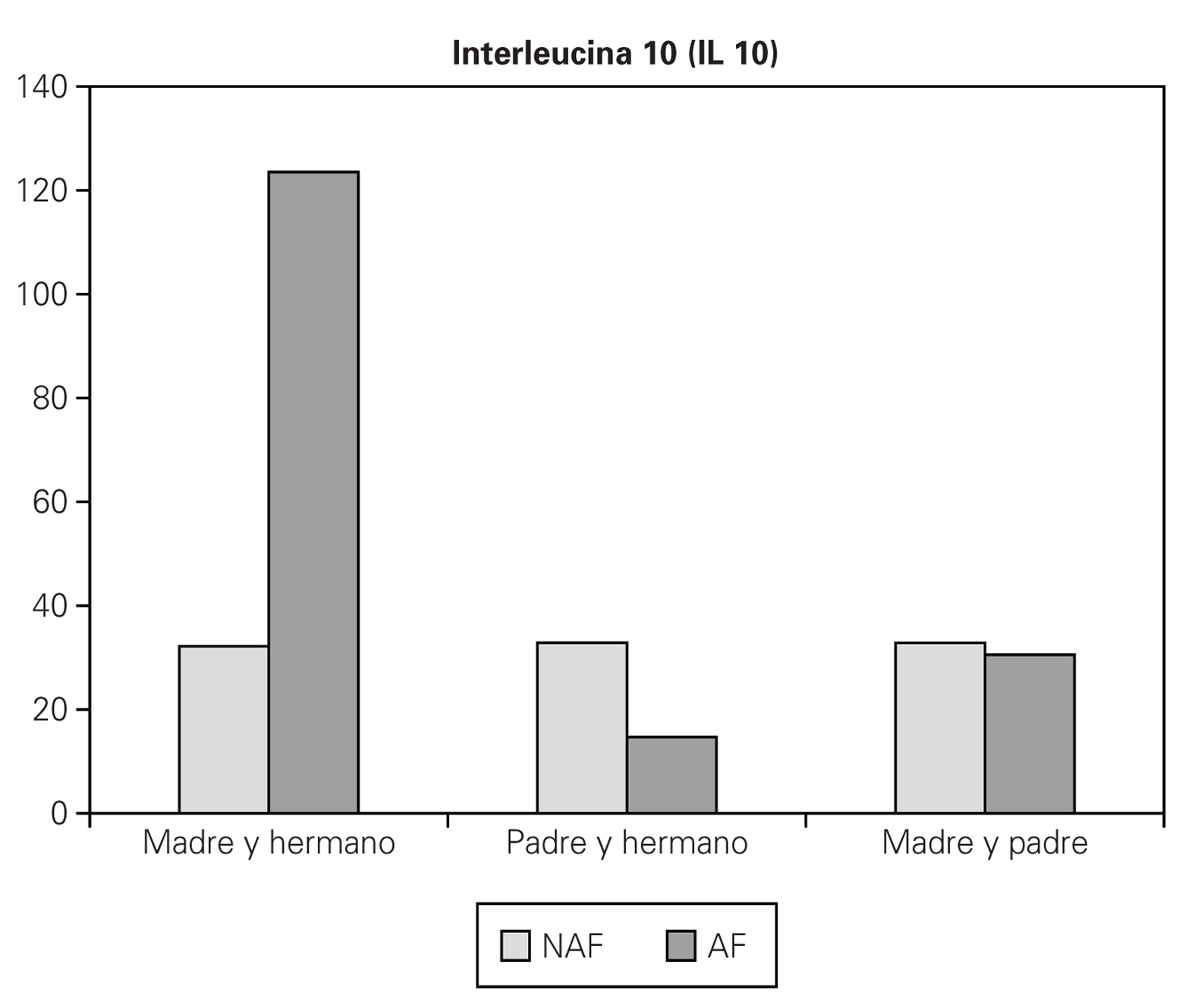
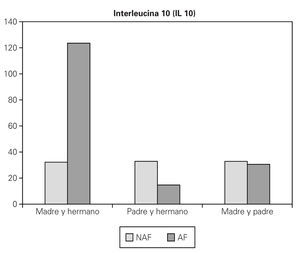
5. Si son el padre y algún hermano, o madre y padre los que presentan la enfermedad, no se encuentran valores mayores de IL 10 (fig. 3).
Figura 3.--Valores medios de IL 10 (pg/ml), considerando antecedentes familiares de enfermedad alérgica (NAF: no, AF: sí), con más de un familiar alérgico.
6. Si son la madre y algún hermano los que presentan la enfermedad, si que se encuentran valores mayores de IL 10, y además son significativos (AF 123,53 pg/ml, NAF 32,19 pg/ml) (p = 0,0003, ANOVA) (fig. 3).
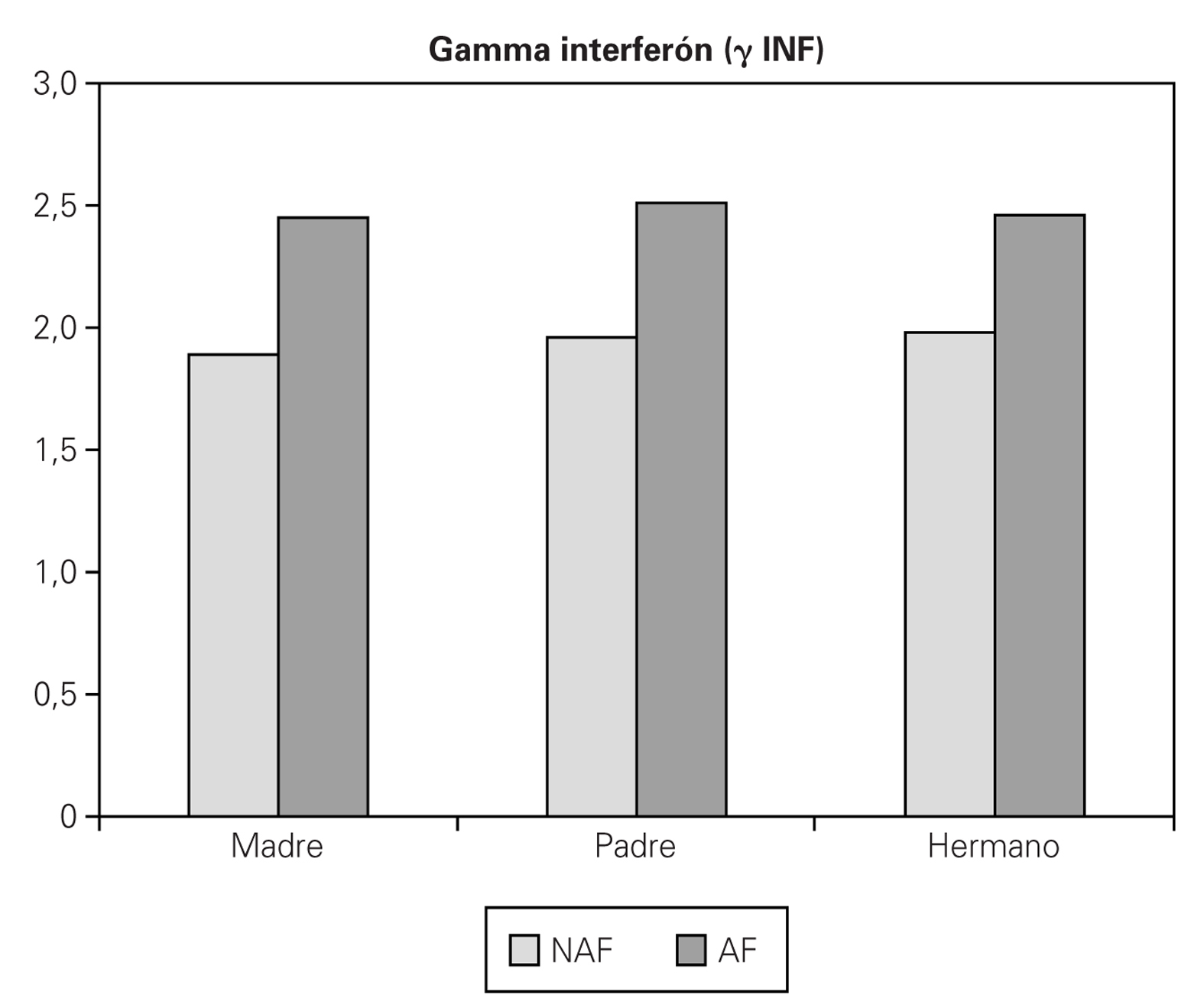
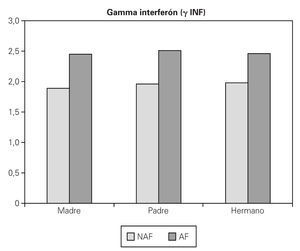
Para el γ INF se han encontrado valores muy similares tanto si hay antecedentes familiares como si no los hay, no encontrándose diferencia tampoco en relación a quién presente la enfermedad (AF 2,44 pg/ml, NAF 1,82 pg/ml) (fig. 4).
Figura 4.--Valores medios de g INF (pg/ml) teniendo en cuenta si antecedente familiar de enfermedad alérgica (AF: sí, NAF: no), y que familiar es el que lo presenta.
DISCUSION
Son numerosos los estudios que se están realizando en búsqueda de un marcador fiable predictor precoz de enfermedad alérgica, que se presenta en la mayoría de los casos como enfermedad respiratoria. Para ello se establecen seguimientos desde las etapas más precoces de la vida, siendo el período fetal el inicio para la determinación de distintas moléculas que ya en esta etapa puedan predecir la aparición posterior de enfermedad. Así, se comienza a describir el desarrollo de la inmunidad fetal (con predominio Th2) y mecanismos de sensibilización fetal en la gestación, con la influencia tan importante que ejerce el entorno materno y en especial la sensibilización a los antígenos alimentarios 1-3. También se determinan citocinas en células de placenta que reflejan distinta respuesta en caso de tratarse de niño con riesgo de enfermedad alérgica 4.
En estudios realizados en células de sangre de cordón, dirigidos a conocer la inmunidad, el tipo de células que actúan, así como la determinación de sustancias que puedan predecir desarrollo posterior de enfermedad alérgica, no se llega todavía a resultados claros.
Una elevación de IgE en sangre de cordón, se ha relacionado con un desarrollo posterior de enfermedad alérgica si bien por si solo no constituye un marcador sensible de enfermedad 5,6. En otros grupos de trabajo se ha evidenciado una modificación de respuesta inmunitaria en relación con la existencia de antecedentes maternos, paternos o ambos. In vitro y mediante estimulación de células mononucleares de sangre de cordón se ha evidenciado una menor respuesta de γ INF (lo que podría implicar una disfunción celular de producción) y mayor de IL 2 o IL 6 en niños que posteriormente desarrollan enfermedad alérgica frente a niños sanos 6-8; teniendo en cuenta los antecedentes de enfermedad alérgica en madre, padre o en ambos se ha obtenido una respuesta mayor de IL 4 y descenso de respuesta de γ INF en caso de padre y madre afectados, lo que implica que la carga genética es importante en la enfermedad 9; otros estudios reflejan mayores niveles de IL 10 en el líquido amniótico de madres atópicas, comparado con el de no atópicas; en recientes estudios in vitro se muestra en las células T obtenidas de sangre de cordón, en hijos de madre atópica una disminución de producción de γ INF y un aumento de producción de IL 4 en relación con hijos de madre no atópica.
En los primeros años de vida se ha demostrado en niños atópicos una mayor respuesta Th2 en relación a controles sanos, así como un descenso de respuesta Th1, todo ello medible con la relación IL 4 y γ INF. Los datos son contradictorios y no llegan a conclusiones claras, porque no evidencian modificaciones significativas en la determinación de las distintas citocinas 10-14.
La cuantificación de IgE se presenta como una prueba específica de atopia, pero es poco sensible; el descenso de γ INF no se relaciona con la producción de cuadros alérgicos aunque hay estudios en los que sí existe esta relación 15-17; los niveles de interleucinas en sangre de cordón no reflejan en todos los casos la posibilidad del desarrollo de cuadro asmático; la historia familiar de atopia sí se relaciona con aparición futura de alergia, siendo más sensible si la asociamos a un aumento de IgE 10,15,18.
Se ha propuesto la IL 10 como promotora de la acción Th2. Pero en la enfermedad alérgica influyen muchos factores ambientales y la carga genética también es importante, por lo que es necesario establecer el entorno en el que se desarrolla el niño, así como confirmar o no la existencia de padre, madre o hermano con antecedente de enfermedad alérgica.
Hay un trabajo reciente muy interesante que correlaciona los niveles de interleucinas en sangre de cordón con la aparición de enfermedad alérgica, episodios aislados de dificultad respiratoria y atopia (definida como sensibilización a algun agente inhalante), a los 6 años de edad. Concluyen que tienen bajo riesgo de enfermedad los sujetos que tienen niveles detectables en sangre de cordón de Il 4 y γ INF. La correcta respuesta Th1 y Th2 al durante el embarazo y al nacimiento depende de la función de la unidad fetoplacentaria. También introduce el tabaco materno antes y durante el embarazo como modificador de respuesta de interleucinas, y favorecedor de enfermedad en el niño a los 6 años de edad 19.
Como vemos existen estudios encaminados al conocimiento de las bases inmunitarias de la enfermedad alérgica, desde las etapas más precoces de la vida. Hasta ahora los resultados no son concluyentes, pero si orientativos hacia la relación de que los fenómenos inmunitarios en los niños alérgicos están alterados ya desde el nacimiento. Hoy se sabe que la enfermedad alérgica se relaciona con la existencia de antecedentes familiares junto a elevación desde etapas muy precoces de IgE.
Hasta ahora de lo analizado, se pone de manifiesto que los valores en sangre de cordón de IL 10 (células Th2) son mayores en caso de antecedente de enfermedad alérgica en madre y hermano o en hermano solo. La enfermedad alérgica en el padre no modifica los valores. Si es la madre la que presenta la enfermedad, se obtienen valores mayores pero no significativos (quizá aumentando la muestra obtendríamos resultados significativos). Según vemos se plantea que no solo hay que tener en cuenta la existencia de antecedente de enfermedad en familiar de primer grado; también es necesario conocer quién la presenta. El descenso de respuesta Th1 no se observa en nuestro estudio, obteniéndose valores similares en ambas muestras de γ INF. La no obtención de valores en las muestras para IL 4 e IL 13 puede deberse a error en el método, si bien es similar al utilizado en otros estudios descritos.
Todavía queda mucho por hacer y analizar, esperando obtener resultados aclaradores y de interés.
Estudio SAS n.º 213/01.