El SARS-CoV-2 se transmite de persona a persona por inhalación o por el contacto con gotas y aerosoles respiratorios. El período de incubación mediano es 5,1 días. Fiebre, tos seca, disnea y fatiga, son los síntomas más comunes. Casi la mitad de los casos son asintomáticos. El espectro de la enfermedad varía desde cuadros leves (81%) a críticos (5%). La edad avanzada, el sexo masculino y las comorbilidades impactan negativamente sobre la gravedad y la mortalidad de la COVID-19. El diagnóstico de la patología aguda se realiza con pruebas de reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) o de detección antigénica. En pacientes hospitalizados, el remdesivir reduce el tiempo de recuperación. Los corticoides orales se recomiendan en casos graves o críticos que requieren oxigenoterapia o ventilación mecánica. La tromboprofilaxis se sugiere en todos los casos graves y no graves con riesgo trombótico alto. La antibioterapia se limita a pacientes de alta sospecha de sobreinfección bacteriana. Los casos leves-moderados y graves tras el alta hospitalaria deben monitorizarse clínicamente durante un período mínimo de dos semanas
SARS-CoV-2 is transmitted from person to person by inhalation or contact with respiratory droplets and aerosols. The median incubation period is 5.1 days. Fever, dry cough, dyspnea and fatigue are the most common symptoms. Almost half of the cases are asymptomatic. The spectrum of disease varies from mild (81%) to critical (5%). Older age, male gender and comorbidities negatively impact on the severity and mortality of COVID-19. The diagnosis of acute COVID-19 is made with RT-PCR or antigenic detection tests. In hospital patients, remdesivir reduces recovery time. Oral steroids are recommended for severe or critical cases requiring oxygen therapy or mechanical ventilation. Thromboprophylaxis is recommended in all severe and non-severe cases with high thrombotic risk. Antibiotherapy is limited to cases of high suspicion of bacterial superinfection. Mild-moderate and severe cases after discharge from hospital should be clinically monitored for a minimum period of two weeks
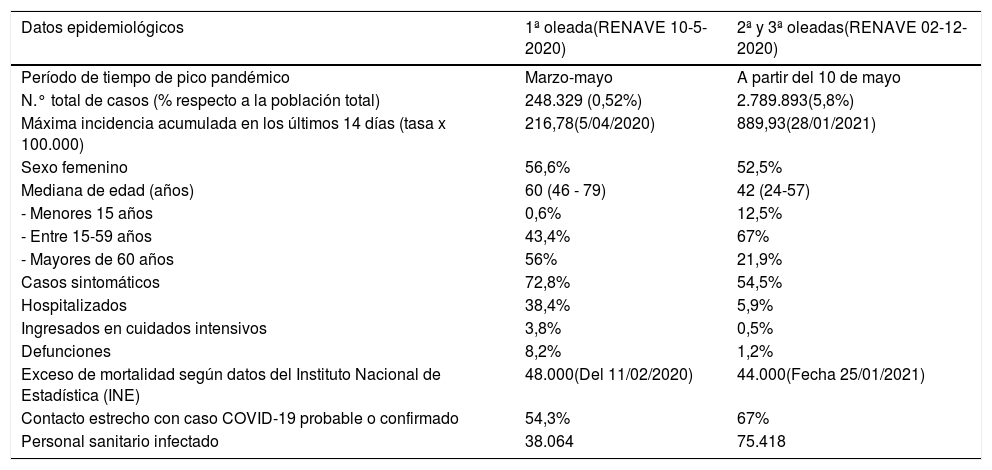
En España, entre marzo y diciembre del 2020, se ha notificado a la Red Nacional de Vigilancia Epidemiológica (RENAVE) 1,7 millones de casos de COVID-19.
Las características epidemiológicas han variado desde el cambio de estrategia diagnóstica en mayo del 2020 (tabla 1)1,2. Dicho cambio, rastreo-pruebas-aislamiento, ha aumentado el número de pacientes diagnosticados con antecedente de contacto con caso confirmado conocido previo (tabla 1).
Comparativo poblacional de la primera y segunda onda pandémicas por SARS-CoV-2 en España1,2
| Datos epidemiológicos | 1ª oleada(RENAVE 10-5-2020) | 2ª y 3ª oleadas(RENAVE 02-12-2020) |
|---|---|---|
| Período de tiempo de pico pandémico | Marzo-mayo | A partir del 10 de mayo |
| N.° total de casos (% respecto a la población total) | 248.329 (0,52%) | 2.789.893(5,8%) |
| Máxima incidencia acumulada en los últimos 14 días (tasa x 100.000) | 216,78(5/04/2020) | 889,93(28/01/2021) |
| Sexo femenino | 56,6% | 52,5% |
| Mediana de edad (años) | 60 (46 - 79) | 42 (24-57) |
| - Menores 15 años | 0,6% | 12,5% |
| - Entre 15-59 años | 43,4% | 67% |
| - Mayores de 60 años | 56% | 21,9% |
| Casos sintomáticos | 72,8% | 54,5% |
| Hospitalizados | 38,4% | 5,9% |
| Ingresados en cuidados intensivos | 3,8% | 0,5% |
| Defunciones | 8,2% | 1,2% |
| Exceso de mortalidad según datos del Instituto Nacional de Estadística (INE) | 48.000(Del 11/02/2020) | 44.000(Fecha 25/01/2021) |
| Contacto estrecho con caso COVID-19 probable o confirmado | 54,3% | 67% |
| Personal sanitario infectado | 38.064 | 75.418 |
RENAVE: Red Nacional de Vigilancia Epidemiológica.
Fuente: Elaboración propia.
La infección es una zoonosis, originada por el SARS-CoV-2, un betacoronavirus, que penetra en la célula, empleando como receptor a la enzima convertidora de angiotensina 2 (ACE-2)3,4. El SARS-CoV-2 se transmite principalmente por la inhalación o contacto a corta distancia (< 2 m) a través de los ojos, boca o nariz, con las gotitas respiratorias, emitidas al hablar, gritar, toser o estornudar3,5. La transmisión por fómites es posible, aunque inusual4. La propagación por aerosoles es probable, especialmente, en espacios cerrados y mal ventilados3,5. La vía de transmisión vertical se produciría fundamentalmente en el período postnatal, por el contacto estrecho del niño con las secreciones respiratorias de la madre; aunque se han detectado receptores ACE-2 en la placenta en mínimas cantidades, así como ARN del virus en la leche materna, no pudiéndose descartar la transmisión por contacto3,5. No se ha informado de esta por productos sanguíneos, pinchazos por agujas o fecal-oral. El período infectivo se inicia dos a tres días antes (fase presintomática), hasta siete a ocho días después del inicio de los síntomas3-6. En los casos más graves, esta transmisión sería más duradera3,4.
La transmisión predominante fue la intrafamiliar con una tasa de ataque secundario en contactos convivientes de entre un 7,6 y un 10,5%, llegando, incluso, al 35% en eventos sociales3.
El período de incubación mediano es de 5,1 días (rango 1 a 14 días). A los 11,7 días (IC 95%: 9,7 a 14,2) el 95% de los casos sintomáticos ya se han desarrollado3. El 99,7% de los pacientes de la serie de RENAVE, presentaban síntomas antes del día 102.
Manifestaciones clínicasLa infección por SARS-CoV-2 puede ser asintomática (33 a 50%) o un cuadro de infección respiratoria aguda leve, moderado o grave2,3.
Además de los síntomas respiratorios, existe una amplia gama de otros relacionados con distintos sistemas (tabla 2)3,4,7–12.
Síntomas más frecuentes descritos en diferentes series de COVID-19 en adultos
| Sistémicos y respiratorios3,4,7,8• Fiebre (Tª > 38°C) (47 - 87, 9%)a• Tos seca (25 - 69%)• Astenia (38 - 70%)• Mialgia (11 - 45%)• Ageusia, anosmia (5 - 65%)b• Cefalea (34%)• Disnea (29 - 47, 6%)• Expectoración (27 - 34%)• Dolor de garganta (22%)• Escalofríos (12 - 15%)• Dolor torácico (2 - 10%)• Rinorrea (< 10%)Gastrointestinales (10% como síntoma único)3,4• Diarrea (19 - 26,8%)• Nauseas/vómitos (8,7 - 12%)• Dolor abdominal (< 10%) | Síntomas menos frecuentes relacionados con distintos órganos y sistemas3,4• Neurológicos9: alteración del nivel de conciencia, accidente cerebrovascular, ataxia, epilepsia y neuralgia• Cardiológicos10: arritmias, fallo cardiaco o el daño miocárdico agudo, miocarditisc• Oftalmológicos11: ojo seco, visión borrosa, sensación de cuerpo extraño, congestión conjuntival• Cutáneas12: erupciones tipo rash (tronco), erupciones urticarianas, lesiones vesículosas similares a varicela, púrpura, lesiones acro-cianóticas en manos y pies (niños y adolescentes)d |
Los niños tienen tasas similares de infección a los adultos, pero más frecuentemente son asintomáticas y leves3,4,13. La ausencia de tos, disminuiría la transmisión. Esta última junto con la fiebre son las manifestaciones más frecuentes3,4,13. La sintomatología gastrointestinal puede presentarse sin clínica respiratoria. La acrocianosis parece más específica en niños y adolescentes18. Se han notificado casos graves por un síndrome inflamatorio sistémico, con características del de Kawasaki y el shock tóxico12. Las embrazadas tiene mayor riesgo de hospitalización, 3 veces mas de riesgo de ingreso en UCI y 1,7 veces más de fallecer14.
El riesgo de ingresar en la unidad de cuidados intensivos (UCI) en el embarazo y en el puerperio precoz es tres veces mayor y la probabilidad de morir por COVID-19 es de 1,7 veces más. No obstante, el riesgo absoluto de complicaciones, en relación con el conjunto de la población, es bajo3. La posibilidad de contraer COVID-19 grave se relaciona con la edad materna, el índice de masa corporal alto y las comorbilidades preexistentes15. Además, esta enfermedad aumenta el riesgo de parto prematuro y la probabilidad de ingreso del neonato en una UCI neonatal15.
En pacientes de edad avanzada, puede presentarse como caídas, astenia, delirio o alteración de la conciencia en caso de disfunciones cognitivas previas16.
Aunque el diagnóstico de sospecha de la infección por el SARS-CoV-2 es clínico, la presencia o ausencia de signos o síntomas no son lo suficientemente precisas como para confirmar una COVID-1917. Por esto, el diagnóstico de sospecha deber tener en cuenta los antecedentes epidemiológicos de contactos en las dos a tres semanas previas.
Entre un 80 a 85% de los casos son leves o moderados (incluye neumonía leve), un 10 a 14% son graves (neumonía grave), requiriendo hospitalización y un 5 a 6% son críticos (insuficiencia respiratoria, shock séptico y/o fallo multiorgánico) con elevada mortalidad3,4. Al inicio de la pandemia, la mediana de días entre el inicio de los síntomas y la hospitalización fue de seis (tres a nueve), de nueve (seis a 12) hasta el ingreso en la UCI y de 11 (siete a 18) hasta la defunción2. La edad (> 65 años), el sexo masculino y las comorbilidades tienen un gran impacto en la gravedad y en la mortalidad en la infección COVID-193,4,14,18 (tabla 3). Además, determinados hallazgos de laboratorio han sido identificados como marcadores de gravedad (tabla 3)4,19.
Factores de riesgo de severidad de la COVID-193,4,14,18,19
| Edad | Mayor de 65 añosa |
|---|---|
| Comorbilidades | Cardiopatías graves (insuficiencia cardiaca, cardiopatía isquémica, miocardiopatías, HTAb)Diabetes mellitusEnfermedad pulmonar crónica (no asma)Cáncer sólido o hematológicos activosEnfermedad renal crónica estadio moderado a grave (TFGe < 59 mL/min/1,73 m2)Inmunodepresión asociada al trasplante de órgano sólidoTrastorno neurológico crónicoDemenciaObesidad (IMC ≥ de 30 kg/m2)EmbarazoEnfermedad de células falciformes |
| Género | Varonesc |
| Alteraciones de laboratorio | Linfopenia, trombocitopenia, leucocitosisElevación: ALT, AST, LDH, PCR, proclacitonina, ferritina, IL-6, TNF-alfa, Dímero D, tiempo de protrombina, troponina y CPK-MB, cretainina |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CPK-MB: creatina-quinasa MB; HTA: hipertensión arterial; IL-6: interleucina-6; IMC: índice de masa corporal; LDH: lactato deshidrogenasa; PCR: reacción en cadena de la polimerasa; TFGe: tasa de filtrado glomerular; TNF-alfa: factor de necrosis tumoral alfa.
La mayor parte de los casos hospitalizados y las defunciones se concentran en las personas de mayor edad. Es difícil establecer un umbral a partir del cual el riesgo aumenta. Diferentes estudios coinciden en la edad > 65 años, aunque hay otros factores que pueden contribuir a aumentar este riesgo4.
La neumonía grave, generalmente bilateral con requerimientos de oxígeno y sin necesidad de ventilación mecánica (frecuencia respiratoria [FR] > 30 inspiraciones/min, dificultad respiratoria grave o saturación de oxígeno [SatO2] < 90% con aire ambiente) es la manifestación grave más frecuente en la infección COVID-19 y la principal causa de ingreso3,20. El síndrome de dificultad respiratoria aguda (SDRA) es una complicación crítica, caracterizada por la necesidad del uso de dispositivos mecánicos de ventilación. La septicemia y el fallo multiorgánico están relacionados con el alto riesgo de fallecimiento (40 a 50%)3,4,20. Otras complicaciones agudas y potencialmente mortales son: fenómenos inflamatorios vasculares y tromboembólicos (tromboembolismo pulmonar, coagulación intravascular diseminada y accidente cerebrovascular agudo), cardiovasculares (miocarditis, insuficiencia cardiaca, arritmias, síndrome coronario agudo y muerte súbita) o neurológicos (enfermedad cerebrovascular aguda, deterioro de la conciencia, convulsiones, meningoencefalitis, encefalopatía, encefalomielitis y síndrome confusional agudo)3,4,20. Al igual que en niños, en adultos se han descrito un síndrome inflamatorio multisistémico grave21.
Pruebas complementariasPruebas de detección microbiológicaLos cuadros clínicos sospechosos de COVID-19 o asintomáticos con un contacto estrecho reciente con un infectado confirmado deberían someterse a pruebas diagnósticas microbiologías para identificar el SARS-CoV-2.
La sensibilidad de las pruebas depende de la muestra, del tipo de test y del tiempo de inicio de la infección. Las pruebas virológicas son las más rentables para diagnosticar la infección en la fase aguda, en las dos primeras semanas22,23. Las pruebas serológicas no son adecuadas para detectar la enfermedad aguda y su utilidad diagnóstica es mayor a partir de la tercera semana22,23 (tabla 4).
Características de las pruebas microbiológicas usadas en la infección por SARS-CoV-2
| Prueba | Tipo de muestra toma | Características | POC (tiempo de respuesta) | Comentarios |
|---|---|---|---|---|
| RT-PCR22,23 | Tracto respiratorio superior: NF u OF, nasales, saliva.Inferior: esputo, aspirado endotraqueal, lavado broncoalveolar o broncoaspirado | NF/OF:S: 87,8% (IC: 81,5% - 92,2%)E: 87,7 - 100%Falsos negativos: 2 -29%Saliva escupida (auto-toma):a(carga viral baja): 5%a(cargas virales intermedias o altas: 97 - 100%E: 99 - 100% | No(2 - 6 h) | Prueba de referencia para la detección de infección aguda por SARS-CoV-2Interpretar en función de factores clínicos y epidemiológicosExudado preferiblemente NF y OF o solo exudado NFNo discrimina contagiosidad con precisiónS varía con el tiempo desde el inicio de los síntomas: máxima en 3 primeros díasMáxima rentabilidad diagnóstica: 2 días antes hasta 7 días después de inicio de los síntomas y en entre 3 y 10 días tras la exposición a un caso confirmado en asintomáticos25 - 30% de RT-PCR [+] prolongada (> un mes) o repositivizaciónFalsos negativos: toma inadecuada, pobre eliminación del virus o retraso en transporte y/o procesamiento de la muestra |
| Test antigénicos rápidos de última generación29 | Exudado NFSaliva | a(sintomáticos) ≤ 5 días ≈ 93 -98%a(asintomáticos): 45 - 94%E: ≥ 99%Prevalencia 10 -30%: VPN (≤ 5 días) 97,2 - 99,3%, y VPP: 94,5 - 98,5% | Sí(15 min) | Validar previamente en el entorno, población (sintomática o asintomática) y las condiciones clínicas dónde se utilizaráSolo debe usarse si la S ≥ 80% y E ≥ 97% (criterios de la OMS)Alta correlación (≈100%) con RT-PCR entre 2 días antes y 5 días después de inicio de los síntomasLos falsos negativos se producen principalmente en pacientes que llevan más de 5 días de síntomasMáxima rentabilidad en contactos asintomáticos entre el 3° y 7° días tras la exposición a un caso confirmado. |
| Pruebas serológicas de alto rendimiento (ELISA, CLIA)22,23,32 | Venopunción | a(IgG/IgM): 30% (1 ª sem), 72% (2 ª sem), 91,4% (3 ª sem), 96% (3ª - 5ª semE: 98% | No(2 - 6 h) | Más útiles para propósitos epidemiológicos que para diagnóstico de infección COVID-19La respuesta de Ac se suele producir ente 10 y 20 días después del inicio de la infección, coincidiendo con la disminución de la carga viralIgM e IgG aparecen entre 6 y 15 días después del inicio de la enfermedad y el tiempo de seroconversión es muy similarLa concentración de IgG permanecerá alta durante largo tiempoLa IgM disminuirá progresivamente a lo largo de los mesesSeroconversión:Ab: 40 - 50% (1 ª sem), ≈100% (2 ª sem)IgG: 3,6 - 50% (1 ª sem), 57 - 77% (2 ª sem), 93 -100% (3 ª sem)IgM: 11 - 60% (1 ª sem), 54 - 87% (2 ª sem), 74 -96% (3 ª sem)La seroconversión es más tardía en casos levesLa detección de IgG, indica infección resuelta y muy baja o nula probabilidad de transmisiónLa insuficiente sensibilidad de las pruebas rápidas, impiden su uso para el diagnóstico clínico |
| Pruebas serológicas22,23,33 («lateral-flow») | Punción digital | a70 - 85%E: > 95%El método CLIA es el más sensible | Sí(15 - 20 min) |
Ab: anticuerpos totales; CLIA: inmunoensayo de quimioluminiscencia; E: especificidad; ELISA: enzimoinmunoanálisis; IgG/IgM: inmunoglobulina G/inmunoglobulina M; NF: exudado nasofaríngeo; OF: exudado orofaríngeo; RT-PCR: detección del ARN viral del SARS-CoV-2 mediante técnicas de la reacción en cadena de la polimerasa con transcriptasa inversa; S: sensibilidad; VPN: valor predictivo de un resultado negativo, VPP: valor predictivo de un resultado positivo.
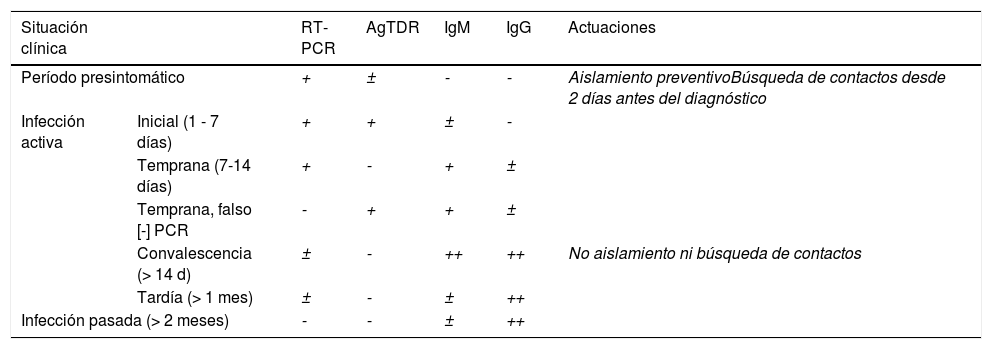
Todas ellas deben interpretarse con cautela pues, además de la sensibilidad y especificidad, dependen de la probabilidad estimada de la enfermedad preprueba, que se relaciona con la prevalencia local de la COVID-19. En un entorno de alta prevalencia, el valor predictivo positivo (VPP) aumenta y un resultado negativo debe comprobarse repitiendo la prueba. En entornos de baja prevalencia, el VPP disminuye y aumenta el valor predictivo negativo (VPN) por lo que los resultados positivos no permiten confirmar la enfermedad y deben ser interpretados con cautela, valorando cuidadosamente la clínica y la epidemiologia e incluso repetir la prueba para confirmar el resultado (tabla 5).
Interpretación del resultado de RT-PCR y pruebas serológicas realizadas conjuntamente en pacientes sintomáticos27
| Situación clínica | RT-PCR | AgTDR | IgM | IgG | Actuaciones | |
|---|---|---|---|---|---|---|
| Período presintomático | + | ± | - | - | Aislamiento preventivoBúsqueda de contactos desde 2 días antes del diagnóstico | |
| Infección activa | Inicial (1 - 7 días) | + | + | ± | - | |
| Temprana (7-14 días) | + | - | + | ± | ||
| Temprana, falso [-] PCR | - | + | + | ± | ||
| Convalescencia (> 14 d) | ± | - | ++ | ++ | No aislamiento ni búsqueda de contactos | |
| Tardía (> 1 mes) | ± | - | ± | ++ | ||
| Infección pasada (> 2 meses) | - | - | ± | ++ | ||
AgTDR: detección de antígenos virales mediante test antigénico; IgG: inmunoglobulina G; IgM: inmunoglobulina M; RT-PCR: detección del ARN viral del SARS-CoV-2 mediante técnicas de la reacción en cadena de la polimerasa con transcriptasa inversa.
Es la prueba de elección para realizar el diagnóstico microbiológico de COVID-19 en la fase temprana22,23. En los casos leve-moderados no se detecta virus viable en exudados nasofaríngeo (NF) u OR, después de los primeros nueve días y la RT-PCR se negativiza entre la segunda y tercera semanas6. No obstante, un 20 a 25% de los infectados prolonga la eliminación de material genético y el resultado positivo de la RT-PCR más de un mes6,24. Esta positividad alargada no se ha asociado con un empeoramiento clínico, ni con mayor riesgo de contagio de los contactos24,25, relacionándose el resultado con la presencia de material no infectivo. Al respecto, los valores del umbral de ciclo (Ct) de la RT-PCR superiores a 30 se correlacionan con menor carga viral en la muestra y menor capacidad infectiva26. Existe un vínculo positivo entre los valores del Ct más bajos (< 25) y un cultivo viral positivo e infección activa26.
Un resultado positivo es indicativo de infección activa, en casos sintomáticos o en asintomáticos con antecedente reciente (dos a tres semanas previas) de un contacto epidemiológico con un caso confirmado22,23. Un resultado negativo no descarta la infección si la sospecha clínico-epidemiológica es alta y obliga a repetir la RT-PCR dos o tres días después22,23.
Detección de antígenos virales mediante test antigénicoSe detecta de forma directa las proteínas N y las subunidades de la proteína espiga (S) del SARS-CoV-2, mediante la técnica de inmunocromatografía de difusión («lateral-flow») en exudado NF, con menor sensibilidad que la RT-PCR (tabla 4). El resultado se obtiene en 15 a 20 minutos, en el punto de atención sanitaria y mediante un procedimiento sencillo, rápido y a coste reducido27–29.
Son más rentables en situaciones con alta carga viral (Ct < 25) en presintomáticos y en los primeros cinco días de síntomas28–30y pierden utilidad en casos con Ct > 30 y clínica superior a siete días29. Existe menos experiencia de uso en pacientes asintomáticos. Por su relación directa con la carga viral, el rendimiento parece ser elevado en asintomáticos con alta concentración del virus en el tracto respiratorio, así como en la primera semana tras un contacto epidemiológico confirmado28,29.
Podría ser la primera prueba para realizar en los primeros cinco días de síntomas27. Un resultado positivo confirmaría la infección aguda por SARS-CoV-2, sin necesidad de confirmación por RT-PCR, incluso en asintomáticos, en entornos con probabilidad preprueba ≥ 10%27,28. En cambio, un resultado negativo necesitaría repetir la prueba antigénica (dos días después) o confirmarlo con RT-PCR27–29. En entornos de baja prevalencia podrían identificar rápidamente los casos altamente infecciosos. También podría usarse para descartar enfermedad asintomática en los contactos estrechos de un paciente confirmado, tres a siete días después de la exposición donde un resultado negativo, descartaría razonablemente la infección28,29. Si han pasado más de siete días desde la exposición, se recomienda realizar la RT-PCR.
Técnicas de detección de anticuerposLas pruebas serológicas detectan la presencia de anticuerpos (Ac) frente a la proteína N, subunidades de la proteína S o el dominio de unión al receptor (RDB-S) del SARS-CoV-2. La detección se realiza con pruebas cuantitativas automatizadas de laboratorio que utilizan técnicas de enzimoinmunoanálisis (ELISA) o de quimioluminiscencia (CLIA) o cualitativas, de ensayos de flujo lateral inmunocromatográfico22,23. Las pruebas detectan anticuerpos totales (Ab), inmunoglobulina M (IgM) e inmunoglobulina G (IgG) por separado, por término medio a los 11, 12 y 14 días de síntomas31. La sensibilidad es muy baja en la primera semana, moderada en la segunda y buena entre la tercera y quinta después del inicio de los síntomas32. La detección de IgG en personas que hayan presentado síntomas sospechosos confirma la infección en fase de recuperación o resuelta33. Por este motivo, no están indicadas para diagnosticar la enfermedad aguda.
Algunos estudios confirman la persistencia de la seropositividad de IgG con actividad neutralizante, en la mayoría de los infectados y de otros componentes de la memoria inmunológica del SARS-CoV-2, al menos seis meses después de la infección34.
Pruebas de imagenLos hallazgos radiológicos de la COVID-19 no son específicos para la infección por SARS-CoV-235 (tabla 6). La radiografía del tórax (RT) es la prueba inicial del estudio en los casos de COVID-19 con sospecha clínica de neumonía. La tomografía computarizada (TC) podría ser más útil en pacientes con enfermedades pulmonares preexistentes36,37.
Imágenes sugestivas de neumonía por COVID-19 20,35-37
| RT y TC:• Opacidad en vidrio esmerilado (72 - 81,5%)• Afectación bilateral (70 - 80%)• Distribución periférica (58 - 72%)• Afectación de campos pulmonares inferiores (55%)• Afectación multilobar (73 - 78%)• Engrosamiento septal interlobular o pleural (22 -47%)• Consolidación alveolar (23 - 45%)• Broncograma aéreo (33 - 51%) | Ecografía pulmonara:Líneas B (97%)Alteraciones de la línea pleural (70%)Engrosamiento pleuralDerrame pleuralConsolidaciónBroncograma aéreo |
RT: radiografía de tórax; TC: tomografía axial computarizada de tórax.
La saturación de oxígeno (SatO2) es un factor predictivo de mortalidad o de ingreso en la UCI. En la COVID-19, la saturación de oxígeno puede descender y precipitar una insuficiencia respiratoria aguda, sin la presencia de síntomas evidentes de dificultad respiratoria4,20. La automonitorización domiciliaria de la SatO2 permite detectar situaciones de hipoxia que no se traducen en signos y síntomas de compromiso respiratorio38. Se recomienda en pacientes con infección inicialmente leve o moderada que presentan problemas respiratorios previos. Cualquier valor menor de 90% a cualquier edad o menor de 92% en personas menores de 55 años debe valorarse clínicamente38.
La prueba de desaturación de oxígeno en esfuerzo se recomienda ante valores en reposo repetidos < 94%, mediante la prueba de sentado y de pie de un minuto (levantarse desde la posición sentada, tantas veces como pueda en un minuto) y la de 40 pasos (caminar 40 pasos sobre una superficie plana). El resultado es positivo con un descenso de la SatO2 basal antes de las pruebas ≥ 5 o un valor inferior a 90%4.
TratamientoEn la actualidad, no existe un tratamiento específico para SARS-CoV-2 con suficiente evidencia científica.
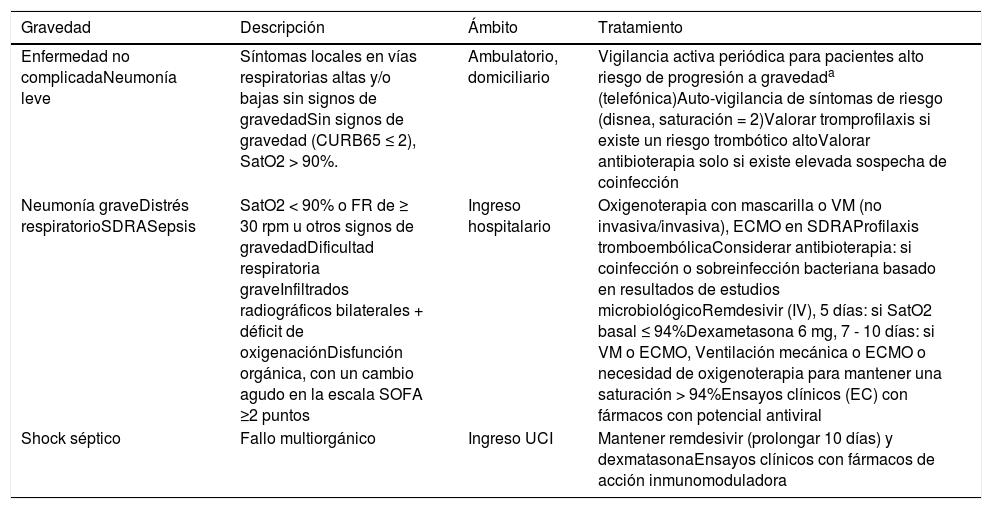
El manejo depende, principalmente, de la gravedad de la enfermedad y de la fase evolutiva de la infección39 (tabla 7). La mayoría de los casos de COVID-19 son cuadros asintomáticos o leve-moderados, se resuelven espontáneamente, con tratamiento sintomático. Estos requieren un seguimiento estrecho hasta su completa recuperación para diagnosticar precozmente el deterioro clínico que puede aparecer a partir del séptimo al noveno día (tabla 7). El tratamiento específico de la infección se reserva para los cuadros graves y críticos. La COVID-19 grave es una enfermedad bifásica, con una etapa inicial de replicación viral, seguida de una cascada de eventos inflamatorios40,41. En función de la fase de evolución de la infección grave, se empleará la terapia antiviral (en la primera y segunda semana después del inicio de los síntomas) o inmunomoduladora (a partir de la segunda semana)41.
Manejo terapéutico de los pacientes con COVID-194,20,39
| Gravedad | Descripción | Ámbito | Tratamiento |
|---|---|---|---|
| Enfermedad no complicadaNeumonía leve | Síntomas locales en vías respiratorias altas y/o bajas sin signos de gravedadSin signos de gravedad (CURB65 ≤ 2), SatO2 > 90%. | Ambulatorio, domiciliario | Vigilancia activa periódica para pacientes alto riesgo de progresión a gravedada (telefónica)Auto-vigilancia de síntomas de riesgo (disnea, saturación = 2)Valorar tromprofilaxis si existe un riesgo trombótico altoValorar antibioterapia solo si existe elevada sospecha de coinfección |
| Neumonía graveDistrés respiratorioSDRASepsis | SatO2 < 90% o FR de ≥ 30 rpm u otros signos de gravedadDificultad respiratoria graveInfiltrados radiográficos bilaterales + déficit de oxigenaciónDisfunción orgánica, con un cambio agudo en la escala SOFA ≥2 puntos | Ingreso hospitalario | Oxigenoterapia con mascarilla o VM (no invasiva/invasiva), ECMO en SDRAProfilaxis tromboembólicaConsiderar antibioterapia: si coinfección o sobreinfección bacteriana basado en resultados de estudios microbiológicoRemdesivir (IV), 5 días: si SatO2 basal ≤ 94%Dexametasona 6 mg, 7 - 10 días: si VM o ECMO, Ventilación mecánica o ECMO o necesidad de oxigenoterapia para mantener una saturación > 94%Ensayos clínicos (EC) con fármacos con potencial antiviral |
| Shock séptico | Fallo multiorgánico | Ingreso UCI | Mantener remdesivir (prolongar 10 días) y dexmatasonaEnsayos clínicos con fármacos de acción inmunomoduladora |
ECMO: oxigenador de membrana extracorpórea; FR: frecuencia respiratoria; CURB65: Confusion, Urea >20 mg/dL, Frecuencia resp. ≥30 rpm, TA sistolica ≤90 o diastolica≤60 mmHg y Edad ≥65 años: SatO2: saturación de oxígeno; SDRA: síndrome de dificultad respiratoria aguda; SOFA: Sepsis related Organ Failure Assessment; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
Factores de riesgo de enfermedad grave o letal: edad > 65 años; enfermedad pulmonar obstructiva crónica (EPOC), cardiopatías graves (insuficiencia cardiaca, cardiopatía isquémica, miocardiopatías), diabetes mellitus (DM) tipo 2, cáncer (sometidos a tratamiento activo), inmunosupresión (postrasplante de órganos sólidos y la asociada a trasplante de médula ósea, deficiencias inmunitarias, VIH, uso de corticoides), insuficiencia renal crónica (FG < 60 mL/min), obesidad (IMC ≥ de 30 kg/m2), embarazo, enfermedad de células falciformes.
Remdesivir es el único antiviral autorizado para el tratamiento del SARS-CoV-2. Inhibe la ARN polimerasa del SARS-CoV-2, bloqueando la replicación viral. Se administra por vía intravenosa, durante cinco días, tras una dosis de carga inicial. Produce efectos secundarios como elevación de transaminasas, hipotensión, náuseas, vómitos, sudoración y reacciones de hipersensibilidad al fármaco41.
Está autorizado para el tratamiento de la COVID-19 en mayores de 12 años y 40 kg, con neumonía que requieran oxígeno suplementario. No se recomienda en el embarazo y puede administrarse junto con corticoides en pacientes graves o críticos41.
Frente al placebo, reduce la necesidad de medidas de soporte, incluida la ventilación mecánica, y del tiempo hasta la mejoría clínica, en pacientes con enfermedad leve, moderada o grave que necesitan ayuda de oxígeno. No se ha demostrado beneficio en personas con enfermedad más grave o crítica41 Los datos del estudio Solidarity (Organización Mundial de la Salud [OMS]) determinan que el efecto es muy escaso o nulo en relación con la mortalidad a los 28 días y en la evolución de los pacientes hospitalizados42.
Tratamiento inmunomoduladorLos corticoesteroides sistémicos reducen la mortalidad a los 28 días en pacientes con enfermedades graves y críticas (número necesario para tratar [NNT]:14), con un nivel de evidencia de calidad moderada43. En la actualidad, estos fármacos (dosis bajas de dexametasona o hidrocortisona intravenosa u oral) se recomiendan, durante siete a 10 días, en casos graves o críticos que requieren oxigenoterapia y/o ventilación mecánica43.
Actualmente, hay otros tratamientos inmunomodulares en investigación (inhibidores de la interleucina-6 [IL-6], interleucina-1 [IL-1] o de las kinasas).
Tratamiento de las coinfecciones bacterianasLas coinfecciones y sobreinfecciones son poco frecuentes en la COVID-19 (10%)20,44. El riesgo es mayor en casos graves y críticos. La antibioterapia solo se recomienda si existe elevada sospecha de sobreinfección, atendiendo a criterios clínicos, pruebas de imagen y/o valores indirectos como los biomarcadores inflamatorios (proteína C reactiva y procalcitonina)44. También, debería usarse en casos con compromiso respiratorio grave y/o enfermedad crítica44. El cuadro clínico, en la mayoría de las veces, es una neumonía, la etiología es la típica de pacientes no-COVID de similar edad y perfil de morbilidad (neumococo, Haemophilus influenzae y Klebsiella pneumoniae). El tratamiento debe seguir las recomendaciones de las guías locales y/o nacionales20,44.
TromboprofilaxisLa incidencia de complicaciones trombolíticas como trombosis venosa profunda o embolismo pulmonar, en pacientes con COVID-19, es elevada20,45. El riesgo es mayor en los casos graves45. Por este motivo, en la actualidad, se recomienda la profilaxis farmacológica de la enfermedad tromboembólica venosa (ETEV), en todos los pacientes hospitalizados con COVID-19, salvo contraindicaciones. Se utiliza, habitualmente, heparina de bajo peso molecular (HBPM) a dosis profilácticas durante el ingreso y se mantienen siete a 10 días después del alta46.
En los casos leves a moderados tratados ambulatoriamente, se aconseja realizar una evaluación individualizada del riesgo trombótico de la ETEV, mediante anamnesis y con escalas de valoración de riesgo trombótico (Padua, IMPROVE) y hemorrágico (IMPROVE)46. En los pacientes con este riesgo elevado se realizará tromboprofilaxis con HBPM a dosis profiláctica, durante dos semanas. El embarazo y el puerperio suponen situaciones de riesgo alto de ETEV46. En estas circunstancias, se administrará HBPM a dosis profiláctica durante las dos semanas y hasta siete días tras la resolución de la COVID-19 e inicio de la movilización, en casos de inmovilización prolongada46.
SeguimientoEn los casos leves-moderados y graves tras el alta hospitalaria, debe realizarse una monitorización de la situación clínica durante un tiempo mínimo de dos semanas47. El objetivo es detectar el deterioro temprano de la fase aguda que recomiende su remisión a la urgencia hospitalaria (tabla 8) o la persistencia de los síntomas (COVID-19 postagudo) o secuelas tras la mejoría clínica. Después de la fase aguda, debe realizarse una valoración integral inicial (estado físico, nutricional, emocional, sueño, calidad de vida y fragilidad)47,48. En función de los hallazgos, se debe realizar un plan de seguimiento individualizado.
Criterios de derivación de los infectados COVID-19 desde atención primaria a la urgencia hospitalaria
| Al menos uno de los siguientes- Frecuencia respiratoria > 30 rpm- Frecuencia cardiaca > 125 lpm- Saturación basal O2 (SatO2)a:• SatO2 < 90% en cualquier edad, SatO2 < 92% en < 55 años• Prueba de desaturación O2 de esfuerzob positiva: descenso de la SatO2 ≥ 5 unidades, respecto a la prueba previa o un valor inferior a 90%.- Disnea intensa (mínimos esfuerzos o reposo)- Signos de dificultad respiratoria grave (cianosis, uso de musculatura accesoria, incapacidad para decir frases completas)- Hemoptisis- Hipotensión (TAS < 90 mmHg o TAD < 60 mmHg)- Alteración del estado de alerta: letargia, desorientación y/o confusión aguda- Incapacidad para la ingesta oral por vómitos incoercibles o número importante de deposiciones (> 10 en un día o entre 5 - 10 en 3 días consecutivos) que hagan prever deshidratación o alteraciones hidroelectrolíticas- Criterios radiológicos de neumonía moderada-gravec: patrón intersticial bilateral compatible con COVID-19, consolidaciones multilobares o derrame pleural |
TAD: tensión arterial diastólica; TAS: tensión arterial sistólica: SatO2: saturación de oxígeno.
Valoración cuantitativa de la SatO2 mediante un oxímetro de pulso o pulsioxímetro. Para tomar una decisión debe asegurarse una correcta realización de la prueba3.
Prueba de desaturación de oxígeno de esfuerzo (bajo la supervisión de un profesional). Las más comunes son la prueba de sentado y de pie de 1 minuto (levantarse desde la posición sentada, tantas veces como pueda en un minuto) y la prueba de 40 pasos (caminar 40 pasos en una superficie plana)3–6. Se recomienda realizar en pacientes con saturaciones en reposo repetidos < 94%3.
En los casos que no requieran ingreso hospitalario, en la fase aguda se recomienda un seguimiento no presencial (telefónico), con control de signos y síntomas agudos, utilizando procedimientos o cuestionarios de verificación protocolizados47. Para controlar la disnea, se recomienda la monitorización domiciliaria de la SatO2 (tabla 9). El seguimiento se prolongará hasta el control y/o resolución de los síntomas, normalmente a 10 días desde el inicio.
Indicación de pruebas complementarias durante el seguimiento de infectados por COVID-1947,48
| Prueba | Recomendación |
|---|---|
| Radiología de tórax de control | No realizar de forma rutinaria. Individualizar en función de la evolución clínicaCasos leves con buena evolución clínica no es necesario ningún estudio de imagen de controlCasos con neumonía grave que han necesitado hospitalización (± ingreso UCI o ± necesidad de ventilación):• Control radiológico en el momento del alta, como referencia para controles posteriores• Control radiológico a las 12 semanas después del alta hospitalaria si los hallazgos radiológicos no estaban resueltos al altaRealizar Rx tórax siempre que exista:• empeoramiento clínico o síntomas nuevos, persistentes, o progresivos• limitación de la función pulmonar, 12 semanas después de la resolución de la infección aguda |
| EspirometríaTAC | Si existen síntomas respiratorios persistentes, deterioro fisiológico o Rx tórax que permanece anormal (fibrosis u otras lesiones radiológicas), 12 semanas después del alta hospitalaria |
| Pulsioximetría (automonitorizacióna en domicilio) | En pacientes con necesidad de oxigenoterapia domiciliaria o de control de la disneaAutoobservaciones por el paciente con instrucciones sobre cómo autocontrolarse |
| Analítica | No realizar de forma rutinariaSolicitar según hallazgos de última analítica al alta o en función de situación clínica y/o comorbilidadesPruebas más frecuentes: función hepática, renal e iones, coagulación, dímero-D, CPK-MB |
| Otras pruebas necesarias | Para control de comorbilidades, priorizando aquellas que se hayan descompensado o supongan más riesgo en la situación del paciente |
CPK-MB: creatina-quinasa MB; Rx: rayos x; TAC: tomografía axial computarizada.
Técnica de medición adecuada: en reposo, sin esmalte de uñas, con la extremidad caliente, en 2°, 3° o 4° dedo de la mano, aceptando solo las medidas con una buena señal de pulso y eligiendo el valor que se repita más frecuentemente durante 30 - 60 segundos. Cualquiera con menos de 90% a cualquier edad o menor de 92% en personas menores de 55 años, aunque no tenga síntomas de compromiso respiratorio, implica la necesidad de valoración clínica directa.
Los pacientes hospitalizados que no han requerido ingreso en UCI ni ventilación mecánica pueden seguirse desde atención primaria (AP). En estos casos, se realizará un control periódico de la evolución de los síntomas residuales y de la aparición de otros problemas concurrentes47,48. El seguimiento se prolonga un mínimo de dos a seis semanas tras el alta hospitalaria. La necesidad de solicitar pruebas complementarias va a depender de la evolución de los síntomas (tabla 9).
Los pacientes con cuadros críticos tras el alta hospitalaria pueden tener necesidades de salud inmediatas y a más largo plazo, como las físicas (rehabilitación pulmonar y cardiaca, heridas de traqueostomía, úlceras por presión, disfagia, fatiga, neuropatía, debilidad muscular y trastornos respiratorios crónicos), psicológicas (ansiedad, depresión y trastorno de estrés postraumático), neuropsicológicas (delirio y deterioro cognitivo) y sociales. El seguimiento se realizaría en unidades clínicas o en consultas monográficas hospitalarias multidisciplinares coordinadas con AP47,48.
COVID-19 postagudoLa mayoría de los casos de COVID-19 no críticos, se recuperan en dos a cuatro semanas, pero algunos pueden presentar síntomas durante meses. En la actualidad, se emplea el término de «COVID-19 postagudo», para definir la prolongación de los síntomas más allá de las tres semanas desde el inicio de los primeros y COVID-19 crónico como el que se extiende más allá de las 12 semanas49. Casi el 90% de los pacientes hospitalizados que se recuperaron de COVID-19 informaron la persistencia de, al menos un síntoma, dos meses después del alta50. El 35% de los adultos con enfermedad leve no recuperan su estado de salud habitual a las dos o tres semanas51,52.
Los síntomas prolongados varían ampliamente. Generalmente, son de la fase aguda como tos, febrícula, dificultad respiratoria y astenia. También, se describen artromialgias, debilidad muscular, dolor torácico, cefalea, erupciones cutáneas o el control deficiente de la diabetes.
La mayoría de estos pacientes se recuperan de forma espontánea, con medidas conservadoras (apoyo holístico, descanso, tratamiento sintomático y aumento gradual de la actividad), sin necesidad de realizar pruebas complementarias adicionales. A pesar del curso benigno, los síntomas se pueden prolongan en exceso en el tiempo y, en ocasiones, enmascarar las complicaciones graves en curso o las comorbilidades49,52.
Secuelas del COVID-19La comprensión de las secuelas tardías de la infección por SARS-CoV-2 todavía es limitada21. Se han descrito aquellas que involucran manifestaciones cardiovasculares (insuficiencia cardiaca y aumento de la frecuencia cardiaca en reposo), pulmonares (fibrosis y deterioro de la función pulmonar), neurológicas (neuropatías y deterioro cognitivo a largo plazo), artromialgias prolongadas y psicológicas4,20,21. Podrían atribuirse a una respuesta inflamatoria o viral del huésped tardía (cuatro semanas después de la infección inicial) que continúan por una duración aún no caracterizada.
A veces, no es fácil diferenciar las secuelas inflamatorias de los síntomas de curación tardía (COVID-19 postagudo). En AP, las indicaciones para la realización de pruebas y la posible evaluación en la consulta especializada en COVID-19 incluyen los síntomas persistentes (dos meses en casos leves-moderados y tres en casos graves), progresivos o de nueva aparición20,48.
FinanciaciónPara la elaboración de este artículo no se ha contado con ningún tipo de financiación de agencias del sector público, privado ni de entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.