La esquistosomiasis humana es la enfermedad parasitaria con mayor morbimortalidad a nivel mundial después de la malaria. Es endémica en más de 78 países tropicales y subtropicales, sobre todo de África Subsahariana, estimándose que 236 millones de personas están infectadas. Puede causar graves complicaciones de salud a nivel genitourinario y hepatoesplénico, llegando a ocasionar la muerte de 300.000 personas cada año. El número de casos importados en los países occidentales se ha ido incrementado en los últimos años debido a la llegada de un importante número de migrantes procedentes de regiones endémicas y de un creciente número de viajeros que han visitado las mismas. Por otro lado, recientemente se han comunicado brotes de transmisión autóctona en Córcega (Francia) y Almería (España). Por todos estos aspectos, las autoridades sanitarias europeas han recomendado el cribado serológico de la enfermedad en todas las personas migrantes procedentes de zonas endémicas y que lleven menos de 5 años en Europa. Dado que atención primaria es habitualmente el primer punto de contacto de estas personas con el sistema sanitario, los médicos deben conocer los principales aspectos de la enfermedad, y ser dotados de los medios necesarios para su diagnóstico y tratamiento. Este documento ha sido elaborado por profesionales pertenecientes a 5 sociedades científicas de atención primaria (SEMFyC, SEMG, SEMERGEN), Pediatría (SEIP) y Medicina Tropical y Salud Internacional (SEMTSI), con objeto de establecer unas recomendaciones claras para el diagnóstico y el manejo de la esquistosomiasis en atención primaria.
Human schistosomiasis is the parasitic disease with the highest morbidity and mortality worldwide after malaria. It is endemic in more than 78 tropical and subtropical countries, especially in sub-Saharan Africa, and it is estimated that 236 million people are infected. It can cause serious health complications at the genitourinary and hepatosplenic level, leading to the death of 300,000 people each year. The number of imported cases in Western countries has increased in recent years due to the arrival of a significant number of migrants from endemic regions and a growing number of travelers who have visited them. On the other hand, outbreaks of autochthonous transmission have recently been reported in Corsica (France) and Almería (Spain). For all these reasons, the European health authorities have recommended serological screening for the disease in all migrants from endemic areas who have been living in Europe for less than 5 years. Since Primary Care is usually the first point of contact for these people with the Health System, doctors must know the main aspects of the disease, and be provided with the necessary means for its diagnosis and treatment. This document has been prepared by professionals belonging to five scientific societies of Primary Care (SEMFyC, SEMG, SEMERGEN), Pediatrics (SEIP) and Tropical Medicine and International Health (SEMTSI), in order to establish clear recommendations for the diagnosis and management of schistosomiasis in Primary Care.
La esquistosomiasis es una enfermedad parasitaria aguda que puede cronificarse, causada por un trematodo del género Schistosoma. También es conocida como «bilharziasis» en honor a Theodor Bilharz, médico alemán que identificó el parásito por primera vez en 1852.
Es la enfermedad parasitaria con mayor morbimortalidad después del paludismo. Según datos de la Organización Mundial de la Salud en el año 2019, 700 millones de personas vivían en áreas de riesgo de las que al menos 236 millones estarían infectadas1. Es endémica en más de 78 países de áreas tropicales y subtropicales de África, Sudamérica, Próximo Oriente, este de Asia y Filipinas, siendo África Subsahariana la región donde se concentra la mayor parte de la incidencia anual y se produce la mayor morbimortalidad. Recientemente se ha descrito la transmisión autóctona de la enfermedad en Francia y España, relacionándose esta expansión con el cambio climático y la globalización2,3.
La esquistosomiasis está considerada por la Organización Mundial de la Salud como una de las enfermedades tropicales desatendidas, candidata a la eliminación para el año 20304, con estrategias activas para conseguir la erradicación5. Varias vacunas están actualmente en desarrollo, aunque la más avanzada se encuentra aún en fase 16.
En los últimos años se ha producido un aumento de los movimientos migratorios en Europa, hecho que ha llevado a las autoridades sanitarias de la región a desarrollar y priorizar políticas comunes de salud. Hay pocos datos sobre la prevalencia de esquistosomiasis en Europa entre los migrantes procedentes de regiones endémicas. Algunos autores sitúan la seroprevalencia por encima del 24% en los migrantes subsaharianos7, hecho que ha motivado al Centro Europeo para la Prevención y Control de Enfermedades (ECDC) a recomendar el cribado serológico a todos los migrantes procedentes de países de alta endemia (África Subsahariana y áreas focales de Asia y Sudamérica) que han llegado en los últimos 5 años8. Por otro lado, el número de viajeros internacionales a regiones endémicas se ha incrementado de forma sustancial, provocando paralelamente un aumento de casos en este colectivo9.
El objetivo de este documento es establecer recomendaciones consensuadas entre los ámbitos de atención primaria y hospitalaria, que permitan un mejor diagnóstico y manejo clínico de la enfermedad. Los autores representan a 5 sociedades científicas (SEIP: Sociedad Española de Infectología Pediátrica; SEMERGEN: Sociedad Española de Médicos de Atención Primaria; SEMFyC: Sociedad Española de Medicina Familiar y Comunitaria; SEMG: Sociedad Española de Médicos Generales; y SEMTSI: Sociedad Española de Medicina Tropical y Salud Internacional) que son sensibles a la necesidad de formación en patología importada de todos los profesionales sanitarios.
EpidemiologíaHay 7 especies principales de Schistosoma (tabla 1) que pueden afectar al ser humano, siendo las más importantes por extensión geográfica y patogenicidad S. haematobium, S. mansoni y S. japonicum. Su distribución geográfica viene determinada por la presencia del hospedador intermediario, que es un caracol de agua dulce, siendo Biomphalaria spp. (S. mansoni) y Bulinus spp. (S. haematobium) las especies más implicadas.
Especies de Schistosoma que afectan al ser humano y su distribución geográfica
| Especie de Schistosoma | Distribución geográfica |
|---|---|
| S. haematobium | Gran parte de África Subsahariana, cuenca del río Nilo, Próximo Oriente (a lo largo de los ríos Tigris y Éufrates, y algunas zonas del sur de la Península Arábiga) |
| S. mansoni | Gran parte de África Subsahariana, cuenca del río Nilo, este de Sudamérica (principalmente Brasil) y algunas islas del sur del Caribe |
| S. japonicum | Delta del río Yangtze en China, el sur y este de Filipinas e Indonesia |
| S. intercalatum y S. guineensis | África Central (Guinea Ecuatorial, Congo, Gabón y Camerún en África Central) |
| S. mekongi | Delta del río Mekong en Laos y Camboya |
| S. malayensis | Malasia |
La distribución geográfica de la esquistosomiasis se muestra en la figura 1 y la tabla 1. De forma resumida, podemos indicar que S. mansoni está presente en gran parte de África Subsahariana, cuenca del río Nilo y algunos países de Sudamérica, S. haematobium en la mayor parte de África Subsahariana, cuenca del río Nilo y Próximo Oriente, y S. japonicum en China, Filipinas e Indonesia.
Un hecho relevante y cada vez más frecuente es la aparición de híbridos entre varias especies humanas y animales (fundamentalmente S. bovis, S. curassoni, S. mattheei)10, lo que puede complicar de forma importante las campañas para su erradicación.
En las áreas endémicas, la esquistosomiasis se adquiere principalmente durante la infancia, siendo los niños la población más vulnerable y los que presentan mayor sintomatología. En las personas adultas, aunque la prevalencia persiste elevada, la intensidad de la infección disminuye de forma considerable11.
En nuestro medio, la infección afecta mayoritariamente a migrantes y expatriados, pero también a viajeros internacionales procedentes de las regiones endémicas. La globalización y el aumento del turismo, que cada vez incluye con más frecuencia viajes fuera de las rutas habituales, están causando un incremento de esta patología al regreso del viaje. Un trabajo reciente basado en una revisión sistemática y metaanálisis de la infección en migrantes procedentes de países endémicos estima su seroprevalencia en el 18%, aumentando hasta el 24% cuando son de origen subsahariano7.
Recientemente se han descrito casos de transmisión de esquistosomiasis humana en regiones no endémicas por la presencia de hospedadores intermediarios, como el brote de esquistosomiasis urogenital por S. haematobium descrito en un grupo de bañistas que se produjo en el río Cavu en Córcega en 20132 o el de agricultores que se bañaron en una balsa de riego en Almería3.
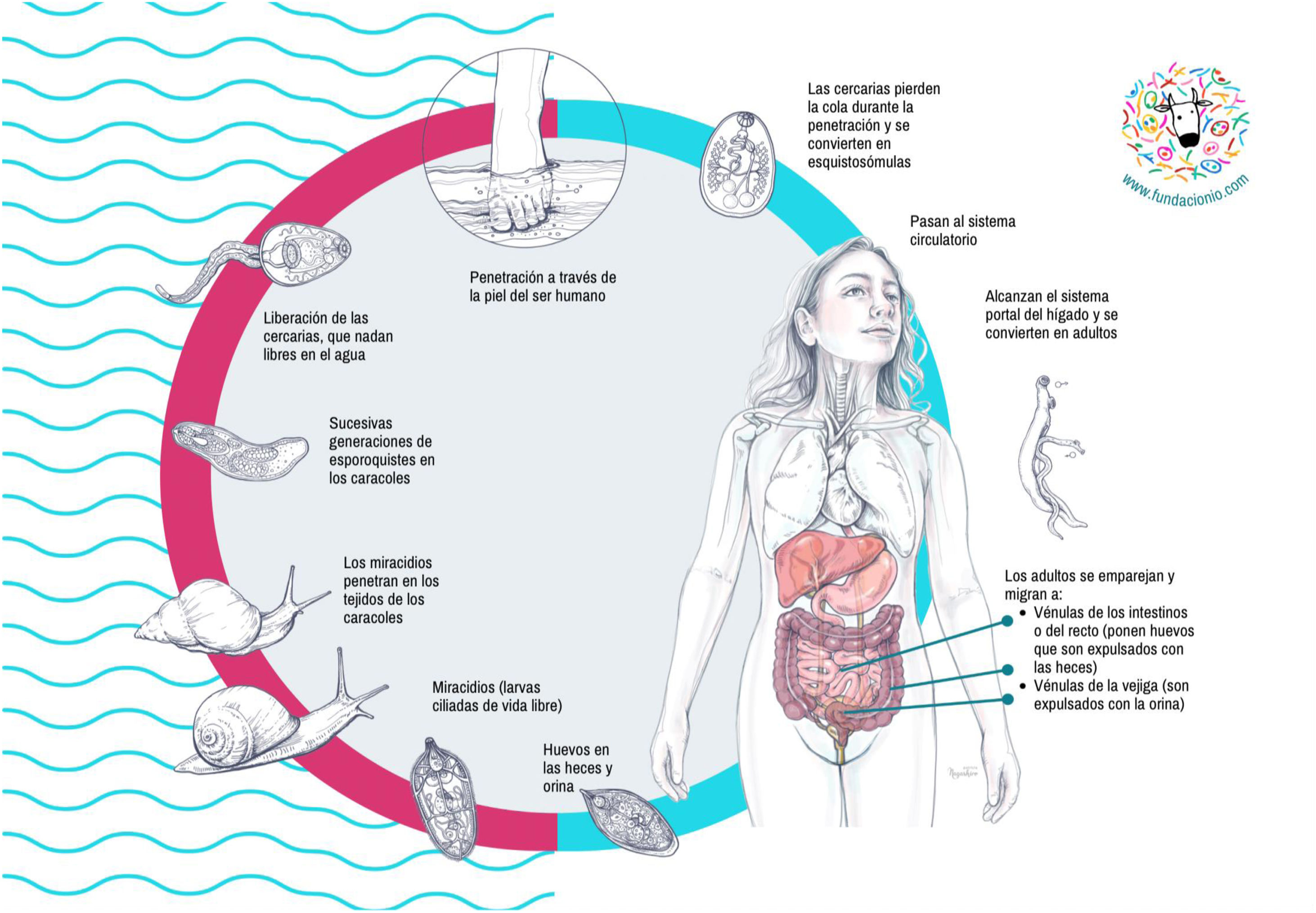
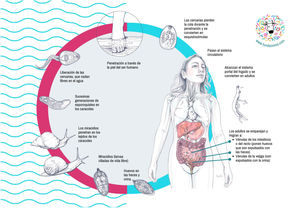
Ciclo biológicoEl ciclo de la esquistosomiasis es complejo y requiere hospedadores intermedios y definitivos (fig. 2). El contacto humano con agua dulce es necesario para la transmisión de la enfermedad. El ciclo comienza con la llegada de los huevos a colecciones de agua dulce a través de la orina (S. haematobium) o heces (resto de especies) de humanos o reservorios de animales infectados. Los huevos eclosionan y liberan miracidios, que son viables durante 7 días hasta que penetran en los caracoles hospedadores intermedios. Después de 4-6 semanas, se liberan las cercarias, que pueden sobrevivir hasta 2 días en el agua. Estas cercarias penetran la piel humana y se convierten en esquistosómulas, que migran a través de la circulación sanguínea hasta llegar al hígado, donde maduran y se convierten en adultos en 2-4 semanas. Los gusanos adultos migran por parejas (macho y hembra) vía sanguínea portal a las vénulas del plexo venoso vesical (S. haematobium) o mesentéricas (resto de especies). Después de 1 a 3 meses tras la infección, las hembras son capaces de emitir huevos que se depositan en las pequeñas vénulas de los sistemas mesentéricos o perivesical, atraviesan la pared intestinal o vesical, y finalmente se eliminan por las heces u orina. Los individuos adultos sobreviven por lo general de 5 a 7 años, pero pueden persistir hasta 30 años.
PatogeniaEl curso natural de la infección depende de la edad a la que se produce la primera exposición, la intensidad de la misma, la inmunidad/respuesta desarrollada por el individuo y de su susceptibilidad genética11.
En poblaciones de zonas endémicas con alta prevalencia de esquistosomiasis, la intensidad de la infección aumenta durante las 2 primeras décadas de la vida a medida que los niños acumulan exposiciones al parásito, para posteriormente descender a niveles muy bajos en los adultos, presumiblemente debido al desarrollo de una inmunidad adquirida12. La evidencia indica que son los huevos del Schistosoma y no los gusanos adultos los que principalmente inducen la respuesta inmune y el daño orgánico específico causado por su infección13.
La patogenia de la esquistosomiasis aguda se relaciona con el depósito de huevos, la liberación de antígenos durante la maduración de los gusanos adultos y los huevos, así como una respuesta inflamatoria exagerada del huésped13,14. Por otro lado, la invasión de las cercarias puede ocasionar dermatitis derivada de reacciones inflamatorias dérmicas y subdérmicas en respuesta a la muerte de estas.
En la esquistosomiasis crónica, la lesión de los tejidos está mediada por la formación de granulomas inducidos por los huevos «atrapados/depositados» en diferentes tejidos y la subsiguiente inflamación crónica local, con formación de granulomas, y aparición de fibrosis13. El tamaño de estos granulomas y la fibrosis resultante explicarían la mayoría de las lesiones fibroobstructivas crónicas características de la enfermedad.
Clínica y complicacionesEsquistosomiasis aguda (fiebre o síndrome de Katayama)El cuadro clínico agudo también es conocido como fiebre o síndrome de Katayama por ser descrito inicialmente en ese distrito japonés. Sin embargo, actualmente la mayoría de los autores abogan por utilizar el término esquistosomiasis aguda.
En general, la infección primaria es en muchas ocasiones asintomática, sobre todo en personas procedentes de zonas endémicas, probablemente en relación con la respuesta de linfocitos T y B del feto a las infecciones maternas13.
El cuadro agudo sintomático aparece habitualmente en viajeros «no inmunes» expuestos a aguas infectadas y cursa con un exantema maculopapular (lesiones de 1-3cm) pruriginoso (exantema o dermatitis del nadador) de predominio en la zona de penetración cutánea de las cercarias. El exantema suele aparecer a las pocas horas de la infección y desaparecer posteriormente de forma espontánea al cabo de unas horas, aunque igualmente se ha descrito entre 2-7 días después de la exposición15,16. Algunos pacientes presentan prurito sin lesiones cutáneas.
Entre 1 y 8 semanas (en algunos casos hasta casi 3 meses) después de la infección puede aparecer malestar general, fiebre, cefalea, artromialgias, dolor abdominal de predominio en hipocondrio derecho, diarrea y tos seca incluso con sensación disneica. En los casos de infecciones por S. haematobium puede aparecer hematuria. También puede existir un rash urticariforme e incluso angioedema. La duración de este cuadro clínico varía entre 2 y 10 semanas. La clínica de la infección aguda en los niños es similar a la de los adultos.
A la exploración física puede existir hepatoesplenomegalia dolorosa. La eosinofilia periférica (habitualmente>1000Eo/μL) es casi constante en los casos sintomáticos15.
Algunos pacientes pueden excepcionalmente presentar graves manifestaciones cardiacas (miocarditis, pericarditis e isquemia miocárdica silente), pulmonares (nódulos pulmonares y neumonitis intersticial) y neurológicas (alteración del nivel de conciencia, déficits motores, incontinencia, alteraciones del lenguaje, ataxia, crisis comiciales)13–16.
Esquistosomiasis crónica y complicacionesLa esquistosomiasis crónica (>3 meses desde la infección) es la forma más frecuentemente diagnosticada, pudiendo ser asintomática u oligosintomática hasta en el 40-60% de los casos en adultos y niños15,17. Ocurre más frecuentemente en personas que viven en zonas endémicas (exposiciones continuas y repetidas), aunque también puede aparecer tras exposiciones cortas (viajeros)15,18. El 5-10% de los pacientes con infección crónica padecerá complicaciones graves13,17.
La afectación de los diferentes órganos dependerá sobre todo del tropismo que presente la especie concreta de Schistosoma, siendo el aparato genitourinario (S. haematobium) y el digestivo (resto de especies) los más frecuentemente involucrados. La infección crónica puede ser además causa de otros síntomas inespecíficos, especialmente en niños, como anemia, malnutrición, retraso en el crecimiento, incapacidad para el ejercicio y desarrollo/empeoramiento cognitivo13,15,16.
Esquistosomiasis urogenitalLa afectación urogenital supone 2/3 de las infecciones crónicas19. Tras los síntomas iniciales que suelen aparecer a las 10-12 semanas de la infección (hematuria micro- o macroscópica terminal, piuria, disuria, polaquiuria y molestias suprapúbicas)13,15,16, la respuesta inflamatoria generada por los huevos puede dar lugar a lesiones granulomatosas, ulcerosas y polipoideas en la pared de vejiga y uréteres16,20. Estas lesiones granulomatosas-nodulares adquieren en ocasiones grandes dimensiones especialmente en niños y dan lugar a problemas obstructivos locales16,20. Las lesiones observadas en esta fase pueden ser reversibles con el tratamiento adecuado15, lo que pone de relevancia la importancia del diagnóstico precoz. En fases más avanzadas, la inflamación crónica puede producir calcificaciones en vejiga y uréteres que generen estenosis, hidronefrosis, deterioro de la función renal y predisposición a sobreinfecciones bacterianas13,16,17,20.
La infección crónica por S. haematobium también se ha relacionado con el desarrollo de carcinoma escamoso de vejiga en edades tempranas13,16,17,20,21.
En los niños es frecuente encontrar, como única sintomatología, una hematuria terminal indolora. Es importante preguntar de forma específica por este síntoma tanto en los niños como en los adultos en riesgo ya que en muchas ocasiones los pacientes migrantes no viven la hematuria como una enfermedad debido a la muy elevada prevalencia que presenta en sus regiones de origen.
Mención especial merece la esquistosomiasis genital, sobre todo la femenina (EGF). Es también consecuencia de la respuesta inmune y del daño secundario que generan los huevos, que migran desde plexos adyacentes alojándose en el tracto genital22,23. Es una de las afecciones ginecológicas más frecuentes de África, estimándose que entre 20-56 millones de mujeres la padecen16,19,22,23. Puede generar lesiones hipertróficas y ulcerativas de vulva, vagina o cérvix. Clínicamente se puede manifestar como dolores locales, sangrado poscoital, prurito genital, alteraciones del flujo, incontinencia de estrés y dispaurenia19,23. Se ha relacionado con embarazos ectópicos, aumento de riesgo de abortos e infertilidad, llegando a considerarse como una de las causas más probables de infertilidad femenina en las zonas endémicas19,22,23. Además, varios estudios indican que la EGF puede ser un factor de riesgo independiente para la infección por VIH, pudiendo incrementar 3-4 veces el riesgo de infección19,23,24. El diagnóstico se realiza mediante la observación de huevos en muestras ginecológicas. Es importante un tratamiento precoz ya que las lesiones ya establecidas pueden no revertir pese al tratamiento19. La afectación genital masculina puede manifestarse como hematospermia, orquitis, prostatitis, dispareunia y oligospermia. A diferencia de la afectación femenina, las lesiones suelen revertir más fácilmente tras el tratamiento13.
Esquistosomiasis intestinal y hepatoesplénicaLa enfermedad intestinal, inflamación hepatoesplénica y fibrosis hepática son producidas fundamentalmente por S. mansoni y S. japonicum13,16.
Los huevos retenidos en la pared intestinal inducen inflamación, hiperplasia, ulceración, formación de microabscesos y poliposis. Los síntomas de la enfermedad gastrointestinal incluyen dolor tipo cólico hipogástrico o dolor en la fosa ilíaca izquierda, diarrea (especialmente en niños) que puede alternar con estreñimiento y hematoquecia. La enfermedad intestinal crónica grave puede provocar estenosis rectal o colónica, una enteropatía pierde-proteínas, hemorragia intestinal y anemia ferropénica. En casos raros, una masa inflamatoria puede provocar obstrucción o apendicitis aguda.
Los niños, que suelen asociar dolor abdominal, pueden desarrollar una enteropatía pierde-proteínas que favorece la desnutrición y ferropenia con mayor o menor grado de anemia.
Además, los pacientes con infección por S. mansoni y S. haematobium pueden convertirse en portadores crónicos de Salmonella entérica y sufrir episodios recurrentes de bacteriemia15.
La esquistosomiasis hepatoesplénica es un cuadro clínico complejo con características fisiopatológicas distintas de la cirrosis hepática25. Los huevos embolizados en el hígado provocan una hipertensión portal presinusoidal, que a su vez causa esplenomegalia y la formación de vasos colaterales portosistémicos, varices esofágicas y un tipo de fibrosis portal característico denominado «fibrosis en pipa de Symmer o fibrosis periportal». A diferencia de la cirrosis, en la esquistosomiasis hepatoesplénica, la función hepática está preservada25–27. Las manifestaciones clínicas son malestar abdominal superior con hepatomegalia nodular, dura y palpable, a menudo con esplenomegalia. Las complicaciones de la hipertensión portal, como la ascitis y la hematemesis por várices esofágicas, pueden conducir rápidamente a la muerte. La fibrosis periportal puede ocurrir en niños incluso de 6 años, mostrando la necesidad de detección y tratamiento de los niños en edad preescolar.
Localizaciones ectópicasSistema nervioso centralLos síntomas de la afectación del sistema nervioso central por Schistosoma o neuroesquistosomiasis son consecuencia del efecto masa e inflamación que generan huevos y granulomas localizados en el cerebro y en la médula espinal. Pueden presentarse también en viajeros y en la fase aguda de la enfermedad13,16,18.
La afectación medular es más frecuente en África y suele manifestarse como una mielitis transversa aguda o mielorradiculopatía subaguda. Los síntomas comprenden dolor lumbar, dolor radicular de las extremidades inferiores, debilidad muscular, pérdida sensorial y disfunción/incontinencia intestinal y vesical28.
La afectación cerebral es más frecuente en infecciones por S. japonicum. Puede causar lesiones intracerebrales únicas o múltiples y presentarse con una amplia variedad de síntomas que incluyen convulsiones, deterioro motor y/o sensorial, alteración del nivel de conciencia (delirio), o un síndrome cerebeloso13,16.
PulmónAunque pueden observarse en las primeras etapas de la infección, ocurren con mayor frecuencia en pacientes que están en la fase crónica de la enfermedad. El desarrollo de la circulación colateral (shunt porto-cava) favorece la migración de huevos a los vasos pulmonares pudiendo generar una arteritis granulomatosa y consiguiente hipertensión pulmonar y cor pulmonale13,16. La disnea es la manifestación clínica más frecuente.
Otras manifestaciones y complicacionesEs poco frecuente el desarrollo de glomerulonefritis mediada por inmunocomplejos que puede dar lugar a proteinuria y síndrome nefrótico15,16. Otras complicaciones sistémicas inespecíficas son la anemia, la disminución de la capacidad aeróbica, el empeoramiento cognitivo, la malnutrición y el retraso del desarrollo infantil. Son especialmente importantes en niños de zonas endémicas, donde las infecciones repetidas que padecen en las primeras décadas de la vida dan lugar a una situación de inflamación crónica que, en ausencia de tratamiento, puede generar lesiones persistentes e irreversibles.
Diagnóstico de esquistosomiasisEn relación con el diagnóstico de la esquistosomiasis, hay que considerar tanto el cribado en personas asintomáticas procedentes de regiones endémicas como el diagnóstico en aquellas que presenten síntomas compatibles.
El cribado en personas asintomáticas se justifica por: a) la elevada prevalencia estimada de esta infección parasitaria entre migrantes y viajeros procedentes de países endémicos (fig, 1); b) la posibilidad de prevenir potenciales complicaciones graves (mediante la detección temprana de casos y su tratamiento) y c) evitar transmisiones secundarias. Las autoridades sanitarias europeas recomiendan este cribado en migrantes recién llegados (estancia inferior a 5 años en Europa)8, aunque dado que los parásitos pueden vivir más de una década y que existe el riesgo de reinfecciones en los migrantes debido a los viajes periódicos a sus países de origen, este grupo de trabajo recomienda realizar el cribado en todas las personas en riesgo, independientemente del tiempo de estancia fuera de zonas endémicas. Bien es cierto que la probabilidad de que un paciente presente una enfermedad activa va disminuyendo a medida que aumenta el tiempo desde que dejó la zona donde adquirió la esquistosomiasis y no ha regresado a zona endémica. En aquellas personas ya cribadas, se volvería a repetir el estudio tras cada estancia en regiones endémicas siempre que hayan realizado actividades de riesgo (baños en ríos, lagos u otras fuentes de agua dulce).
De forma general, si no se dispone de acceso a las pruebas diagnósticas o al tratamiento, se recomienda la derivación de los pacientes a una consulta específica con experiencia en la atención a enfermedades importadas. De forma más específica, este grupo de trabajo propone los siguientes criterios de derivación:
Paciente con antecedente de viaje, estancia o procedencia de zonas endémicas y exposición a fuentes de agua dulce y algunas de las siguientes situaciones:
- -
Existe sospecha clínica o analítica de esquistosomiasis aguda.
- -
Paciente asintomático que presenta alteraciones en las pruebas complementarias sugerentes de esquistosomiasis crónica y no se disponga de las exploraciones necesarias para su diagnóstico y/o tratamiento.
- -
Pacientes con complicaciones graves.
En la analítica general, la presencia de eosinofilia (>450Eo/μL) suele ser una constante en la esquistosomiasis aguda15. Sin embargo, en la esquistosomiasis crónica, la eosinofilia está presente en una proporción muy inferior de casos, y cuando aparece suele ser leve8,29,30. La anemia es más frecuente en niños y la trombocitopenia aparece en casos avanzados con esplenomegalia secundaria a la hipertensión portal. Otras alteraciones analíticas que se pueden observar son ferropenia, hipergammaglobulinemia, elevación de las transaminasas y de los parámetros de colestasis (GGT, FA y bilirrubina) y prolongación de los tiempos de coagulación, así como de la urea y creatinina en casos de uropatía obstructiva.
La tira reactiva de orina puede detectar presencia de hematíes y proteinuria, aunque un test negativo no descarta la infección en la esquistosomiasis urogenital30.
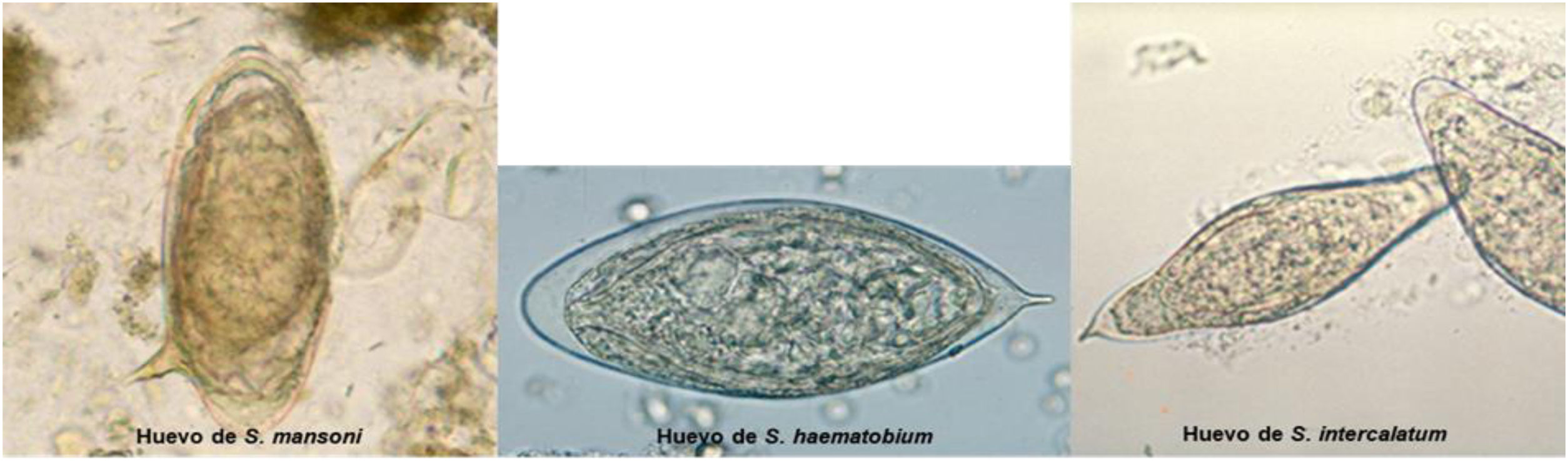
El diagnóstico parasitológico directo es el patrón oro. El aislamiento de huevos en orina, heces o tejidos permite establecer un diagnóstico de certeza y además posibilita la identificación de especies en función de las características morfométricas de los huevos (fig. 3). Para la esquistosomiasis urinaria se recomienda el análisis de una única muestra de orina obtenida entre las 10 y las 15h. Si el resultado es negativo y la sospecha clínica es alta, valorar tomar nuevas muestras de orina. La orina se debe analizar tras un proceso de centrifugación o de filtración.
Para el estudio de heces, se recomienda analizar al menos 3 muestras obtenidas a días alternos dado que la sensibilidad del estudio parasitológico directo en la esquistosomiasis intestinal es inferior que en la genitourinaria. Las heces deben ser procesadas con una técnica de concentración (FLOTAC, Kato Katz)13. La realización de biopsias en tejidos afectados, fundamentalmente en casos en los que no ha sido posible el diagnóstico por otros medios o existen dudas diagnósticas, puede demostrar también la presencia de huevos del parásito.
En la esquistosomiasis aguda las pruebas parasitológicas solo son de utilidad a partir de los 30-50 días tras la infección, una vez que los parásitos han madurado y emigrado a las zonas de oviposición13.
En relación con el diagnóstico serológico, existen comercializados un gran número de test que detectan anticuerpos frente a esquistosomas. Debido a su elevada sensibilidad y su disponibilidad, son las técnicas recomendadas por las autoridades sanitarias europeas para realizar el cribado de la enfermedad en las personas asintomáticas8. A pesar de estas recomendaciones, no suelen estar disponibles en atención primaria. La sensibilidad de los mismos puede variar ampliamente, por lo que es conveniente que el laboratorio disponga de una técnica con una buena sensibilidad. La principal limitación de estas pruebas serológicas es que no diferencian entre infección activa o pasada, por lo que no son de utilidad para el seguimiento de la enfermedad tras el tratamiento14,31. En el caso de la esquistosomiasis aguda, estas pruebas pueden tardar varias semanas en positivarse.
Las técnicas moleculares como la reacción en cadena de la polimerasa (PCR) o la amplificación isotérmica de ácidos nucleicos mediada por bucles (LAMP) y los test de detección de antígenos (antígeno catiónico circulante [ACC]) en orina y sangre suelen estar disponibles exclusivamente en centros de referencia o de investigación32.
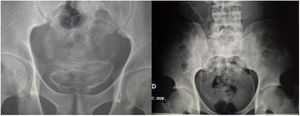
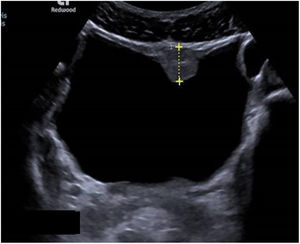
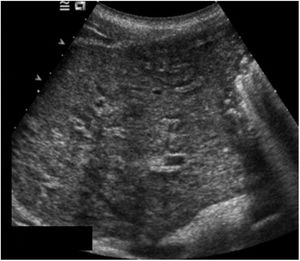
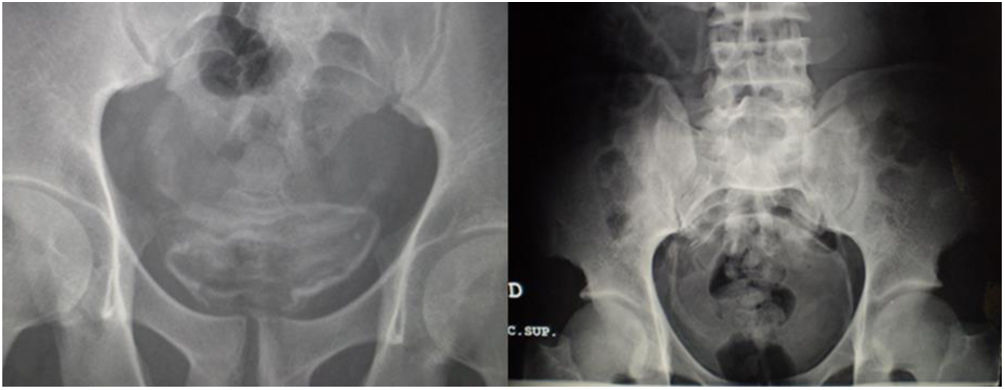
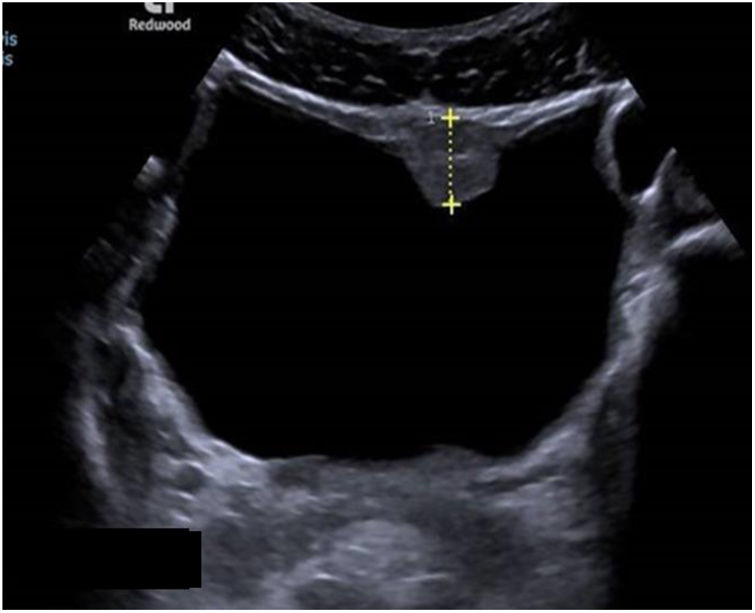
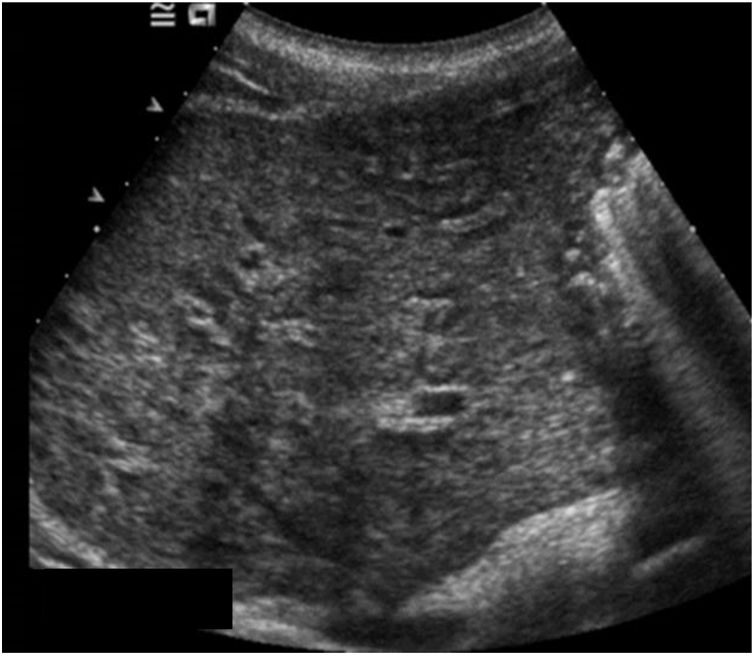
Las exploraciones radiológicas desempeñan un papel importante en el diagnóstico de la enfermedad y sus complicaciones9,29. La radiografía de abdomen puede mostrar principalmente calcificaciones en la pared de la vejiga (fig. 4). La ecografía es la exploración más rentable, permitiendo diagnosticar lesiones en vejiga urinaria como engrosamientos de la mucosa, nódulos (fig. 5), ureterohidronefrosis o la fibrosis periportal (fig. 6) con o sin hipertensión portal característica de la afectación hepatointestinal. Otras exploraciones como la TAC o la RMN pueden ayudar al diagnóstico, sobre todo en casos de localizaciones ectópicas como puede ser el pulmón o el sistema nervioso central. La tabla 2 muestra resumidas las características de las principales pruebas empleadas en el diagnóstico de la esquistosomiasis.
Técnicas diagnósticas empleadas en el diagnóstico de la esquistosomiasis
| Técnica diagnóstica | Comentarios |
|---|---|
| Analítica general | - La eosinofilia es una constante en la fase aguda. En las formas crónicas su presencia es variable y cuando está presente suele ser leve- Otras alteraciones del hemograma: anemia (sobre todo en niños), trombocitopenia- Elevación de transaminasas, enzimas de colestasis y bilirrubina, prolongación tiempos de coagulación (fases avanzadas), ferropenia, elevación urea y creatinina (si uropatía obstructiva)- Tira reactiva de orina: hematuria, proteinuria, en ocasiones leucocituria |
| Detección de huevos en heces y orina | - Baja sensibilidad- Precisa de laboratorios con cierta experiencia- Precisa de técnicas de concentración o filtración- En la esquistosomiasis aguda tardan en detectarse los huevos de 30 a 50 días |
| Diagnóstico serológico | - Múltiples técnicas comercializadas (ELISA, radioinmunoanálisis, hemaglutinación indirecta, inmunofluorescencia indirecta, Western Blot y fijación del complemento)- Elevada sensibilidad pero muy variable entre las diferentes técnicas- Son las técnicas recomendadas para el cribado de la enfermedad en poblaciones de riesgo- No diferencian entre infección activa o pasada ni sirven para el control de la efectividad del tratamiento |
| Diagnóstico molecular y detección de antígenos | - Varias técnicas moleculares (PCR, LAMP) y de detección de antígenos (ACC) pero disponibles solo en centros de referencia |
| Radiología | - La radiología simple es útil para detectar calcificaciones vesicales- La ecografía es la técnica más rentable tanto para el diagnóstico de las lesiones a nivel urinario como hepatoesplénico |
ACC: antígeno catiónico circulante; LAMP: loop mediated isothermal amplification (amplificación isotérmica mediada por bucles); PCR: reacción en cadena de la polimerasa.
Dado que atención primaria es habitualmente el primer punto de contacto de estos pacientes con el Sistema Sanitario, sus médicos deben, además de conocer los principales aspectos de la enfermedad, ser dotados de los medios necesarios para su diagnóstico y tratamiento. Esta estrategia diagnóstica debe enmarcarse en el manejo general de los pacientes con eosinofilia importada33. Los nuevos modelos de e-consulta o telemedicina, que posibilitan un contacto rápido y estrecho entre especialistas hospitalarios y de atención primaria, pueden desempeñar un papel fundamental en la atención compartida a pacientes con este tipo de enfermedades.
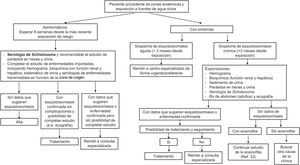
El algoritmo propuesto por los autores para el diagnóstico de la esquistosomiasis en atención primaria se muestra en la figura 7.
TratamientoEl objetivo principal del tratamiento de la esquistosomiasis es la curación de la enfermedad mediante la eliminación de los gusanos adultos y el cese de la producción de huevos. El tratamiento permite habitualmente la reversión de las complicaciones en estadios iniciales, e incluso la mejoría de algunas de las afectaciones crónicas en casos avanzados34.
Los tratamientos antiparasitarios recomendados son considerados actualmente medicación extranjera, lo que dificulta el acceso a los facultativos tanto desde la atención primaria como desde la atención especializada. Los circuitos para su adquisición pueden variar entre comunidades autónomas pero de forma general se precisa la receta del medicamento (nombre, pauta, duración), un informe justificativo de la necesidad de esa medicación y el pago de una tasa.
El praziquantel (Biltricide®, comprimidos de 600mg) es el antiparasitario de elección para las distintas especies de Schistosoma. Actúa modificando la permeabilidad de las membranas, provocando una parálisis muscular y alteraciones en el tegumento de las formas maduras del gusano. Administrado a las dosis recomendadas, se ha constatado una disminución en el número de huevos de un 85-95%34,35. El praziquantel es una medicación segura. La Organización Mundial de la Salud recomienda su uso incluso en mujeres embarazadas y lactantes en base a las evidencias de seguridad36–38. En España, sin embargo, el praziquantel está autorizado solo para uso oral en niños mayores de 4 años.
La dosis recomendada para S. haematobium, S. mansoni, S. intercalatum y S. guineensis es de 40mg/kg 1 día, administrado por vía oral, en una sola toma o en 2 tomas separadas (tabla 3). En el caso de S. japonicum, S. mekongi y S. malayensis se recomienda una dosis de 60mg/kg 1 día, repartido en 2 dosis separadas al menos 3h34. Algunos autores propugnan la administración de praziquantel a dichas dosis pero durante 3 días consecutivos39 con el fin de incrementar las tasas de curación, si bien no existe un consenso al respecto.
Tratamiento esquistosomiasis crónica
| Medicamento (nombre comercial) | Presentación | Dosis | Efectos adversos | Precauciones | Observaciones |
|---|---|---|---|---|---|
| Praziquantel(Biltricide®) | Comprimidos 600mg (6 comp, ranurados en 150mg) | 40mg/kg/día160mg/kg/día2 | Digestivos: náuseas, diarreasNeurológicos: mareos, vértigos, cefaleaDermatológicos: urticariaPoco frecuentes (<1%):dolor abdominal, bradicardia, mialgias, reacción tipo Jarisch-Herxheimer3 | Tomar con o después de la comidaSeparar al menos 4 semanas de tratamientos metabolizados por citocromo P450, como la rifampicinaEl tratamiento concomitante con corticoides puede disminuir su eficacia | El tratamiento puede repetirse si hay evidencia de persistencia de la infección a los 3 meses |
1 En una o 2 tomas. Indicada para infecciones por S. haematobium, S. mansoni y S. intercalatum, S. guineensis (o en caso de tratamiento por serología positiva, o especie indeterminada).
2 En 2 tomas con, al menos, 3h de separación. Indicada para infecciones por S. japonicum, S. mekongi, S. malayensis.
3 En el tratamiento de esquistosomiasis aguda.
En los pacientes con afectación del sistema nervioso central se recomienda su asociación con corticoides por el riesgo de provocar una fuerte respuesta inflamatoria40. En estos casos, habría que descartar la coinfección con Strongyloides stercoralis o realizar tratamiento empírico con ivermectina para evitar el riesgo de hiperinfección por este helminto.
Los niveles plasmáticos de praziquantel pueden verse disminuidos por la administración conjunta con corticoides14, así como alterados cuando se emplean inductores del citocromo P450 como es el caso de la rifampicina41.
El tratamiento de la esquistosomiasis aguda, especialmente cuando los pacientes presentan síntomas, debería realizarse en una unidad especializada debido al riesgo de sufrir complicaciones graves. Está contraindicada en estos casos la administración de praziquantel en monoterapia dado que puede agravar el cuadro clínico en pacientes sintomáticos (sobre todo con complicaciones neurológicas), y en los pacientes asintomáticos puede provocar la aparición de clínica14,40,42. En cualquier caso, una comunicación estrecha con facultativos hospitalarios con experiencia en estos casos puede permitir una valoración individualizada de cada paciente y decidir las mejores opciones terapéuticas y de seguimiento, así como el ámbito en el que realizarlo.
Existen otros tratamientos antiparasitarios (metrifonato, oxamniquina), aunque son raramente utilizados y no suelen estar disponibles43. Los derivados de la artemisinina se han propuesto para el tratamiento de las formas agudas debido a su actividad frente a las formas inmaduras –esquistosómulas– del Schistosoma, sobre las que no actúa el praziquantel. Sin embargo, actualmente no existe una recomendación general de su uso, precisando de más estudios13.
SeguimientoNo existen recomendaciones precisas para el seguimiento de la esquistosomiasis tras el tratamiento. La desaparición de la eosinofilia no es un parámetro preciso debido a que está presente en aproximadamente solo en el 50% de los casos en el momento del diagnóstico9,29,30. Una eosinofilia persistente debería llevar a una investigación más exhaustiva de otros parásitos o de causas no parasitarias.
La serología tampoco es de utilidad dado que en la mayoría de las casos no se negativiza tras el tratamiento, y por tanto, no diferencia entre infección presente o pasada14,31.
La microscopia puede ser útil en los pacientes diagnosticados inicialmente con estudio parasitológico directo. Sin embargo, es posible que tras un tratamiento efectivo se sigan eliminando huevos por orina o heces aunque en número menor y en su mayor parte huevos no viables. La limitación de esta técnica es principalmente la laboriosidad del recuento de huevos y de la detección de la viabilidad de los mismos, técnica que no se realiza en la mayoría de los laboratorios32,44,45.
Otras técnicas, como la detección de antígenos o técnicas de diagnóstico molecular, solo están disponibles en centros de referencia o con fines de investigación.
En relación con las lesiones radiológicas, es importante constatar la resolución de las lesiones ecográficas, sobre todo a nivel vesical (engrosamientos focales o difusos, pólipos, etc.). La persistencia de las mismas a los 6 meses tras el tratamiento obliga a descartar otras patologías como la existencia de un carcinoma escamoso de vejiga, siendo obligatorio la realización de una cistoscopia. Las calcificaciones no se modifican tras el tratamiento.
Por todo ello, los autores de este documento recomiendan realizar el seguimiento de forma global en todos los casos de esquistosomiasis aproximadamente a los 3 meses tras el tratamiento.
RetratamientoAunque un único curso de tratamiento con praziquantel es normalmente curativo, la respuesta inmune en pacientes con infecciones leves puede ser menos consistente y puede ser necesario repetir el tratamiento para aumentar la efectividad. El retratamiento se realizará de nuevo con praziquantel a las dosis anteriormente referidas. La resistencia al praziquantel, aunque posible in vitro, no se ha evidenciado hasta la fecha, a pesar de su uso masivo en campañas de erradicación46.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
FinanciaciónLa publicación del manuscrito cuenta con la financiación de la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI).
Consideraciones éticasEste documento de consenso no precisa de la aprobación de un Comité de Ética de la Investigación.
- •
La esquistosomiasis afecta al menos a 236 millones de personas en el mundo, principalmente en África Subsahariana.
- •
Puede producir graves complicaciones a nivel genitoruinario y hepatoesplénico, siendo la causa de la muerte de unas 300.000 personas cada año.
- •
Se ha producido un incremento del número de casos importados en Europa, fundamentalmente en población migrante subsahariana, aunque también en viajeros.
- •
Las autoridades sanitarias europeas recomiendan el cribado serológico de la enfermedad en las personas en riesgo.
- •
Los médicos de atención primaria deben conocer la enfermedad y disponer de las herramientas necesarias para su diagnóstico y tratamiento.
Los autores quieren agradecer a la Fundación iO, y especialmente a la ilustradora Patricia Nagashiro y a la diseñadora digital Cristina Juesas su contribución a la realización de los gráficos y mapas de esta publicación. También agradecer a todas las sociedades científicas que están representadas la disposición y ayuda para la elaboración del documento: SEIP (Sociedad Española de Infectología Pediátrica); SEMERGEN (Sociedad Española de Médicos de Atención Primaria); SEMFyC (Sociedad Española de Medicina Familiar y Comunitaria); SEMG (Sociedad Española de Médicos Generales y de Familia); y SEMTSI (Sociedad Española de Medicina Tropical y Salud Internacional).







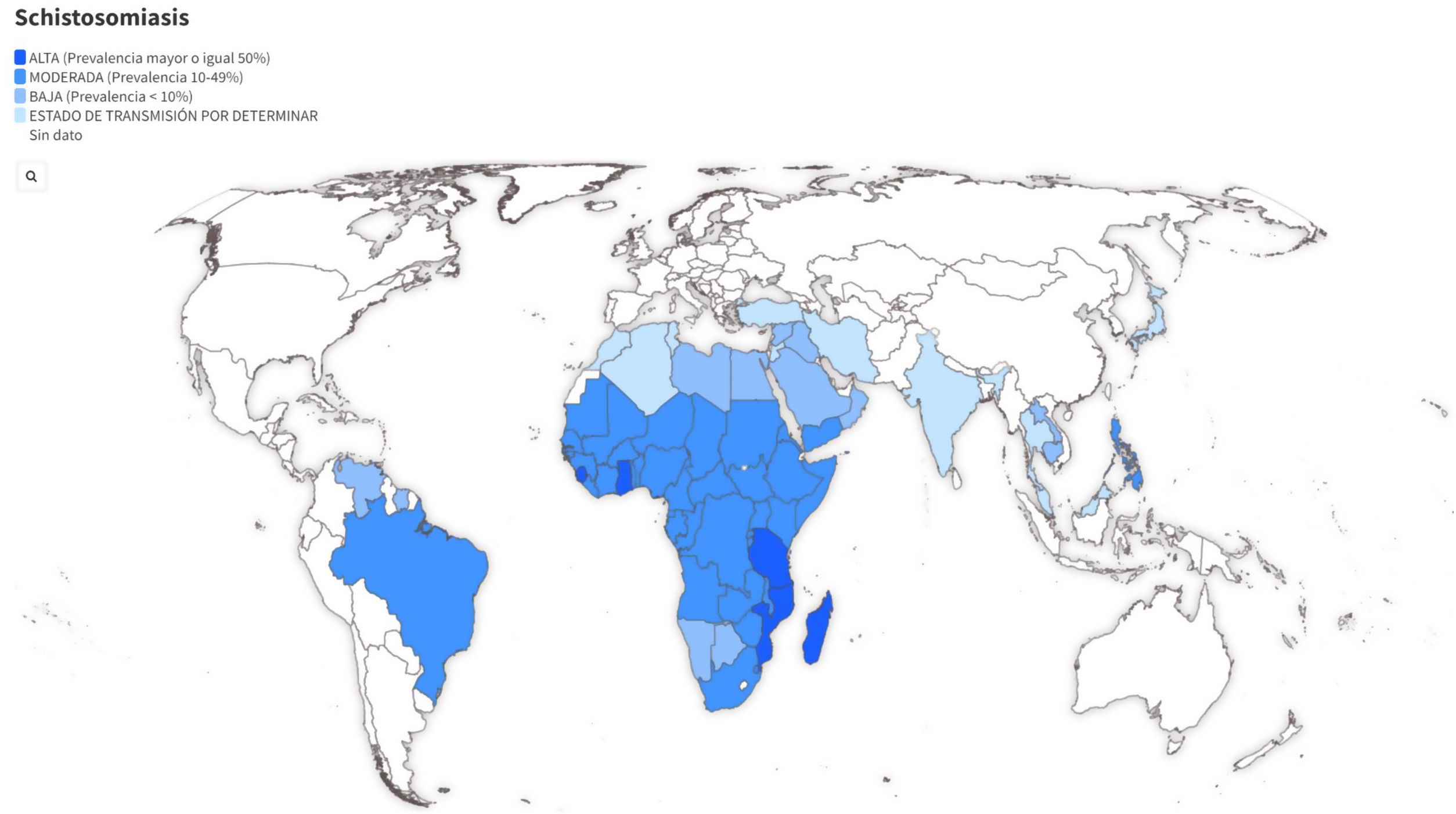
![Mapa interactivo de distribución geográfica y prevalencia de Schistosoma spp. Fuente de datos: CDC (2020). Elaboración Fundación iO. Disponible en: https://public.flourish.studio/visualisation/8236463/ [consultado 9 May 2022]. Mapa interactivo de distribución geográfica y prevalencia de Schistosoma spp. Fuente de datos: CDC (2020). Elaboración Fundación iO. Disponible en: https://public.flourish.studio/visualisation/8236463/ [consultado 9 May 2022].](https://static.elsevier.es/multimedia/02126567/0000005400000008/v1_202207260552/S0212656722001287/v1_202207260552/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Imágenes de huevos de Schistosoma. Disponibles en: https://www.cdc.gov/dpdx/schistosomiasis/index.html [consultado 9 Mayo 2022]. Imágenes de huevos de Schistosoma. Disponibles en: https://www.cdc.gov/dpdx/schistosomiasis/index.html [consultado 9 Mayo 2022].](https://static.elsevier.es/multimedia/02126567/0000005400000008/v1_202207260552/S0212656722001287/v1_202207260552/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)