La donación en asistolia controlada se ha convertido en una de las principales estrategias para aumentar el número de donantes. Hasta el momento el corazón de este tipo de donantes no era valorado por el riesgo de lesión isquémica durante la limitación del soporte vital. En los últimos años, con los sistemas de perfusión ex situ se iniciaron programas de donación cardiaca en asistolia controlada que demostraron la viabilidad miocárdica. El uso de perfusión regional normotérmica en nuestro medio y la experiencia de otros países en la recuperación cardiaca nos lleva a elaborar un protocolo de extracción cardiaca en asistolia controlada con valoración in situ y conservación en frío.
MétodosSe conforma un equipo multidisciplinar que realiza un protocolo de extracción cardiaca con donante en asistolia controlada. Tras una fase de experimentación animal, dicho protocolo es aprobado por el Comité de Ética para la Asistencia Sanitaria y por la Organización Nacional de Trasplantes.
ResultadosSe realiza un protocolo que establece los criterios de selección de donantes y receptores y que regula el procedimiento de donación con perfusión toracoabdominal tras exclusión de los troncos supraaórticos. La valoración cardiaca es in situ y la conservación estática, en frío. Este protocolo se comunica al resto de hospitales donantes, y esto nos lleva a realizar el primer trasplante cardiaco en España con asistolia controlada.
ConclusionesEl trasplante cardiaco con donación en asistolia controlada es una realidad clínica que permitirá aumentar el número de potenciales donantes. Las características técnicas del procedimiento hacen que este tipo de donación se deba concentrar en centros con experiencia.
Donation after circulatory death has become one of the main strategies to increase the number of donors. Until now, the heart of this type of donor was not evaluated due to the risk of ischaemic injury during the withdrawal of life support. In recent years, ex situ perfusion systems have initiated cardiac donation programmes after circulatory death that have demonstrated myocardial viability. The use of normothermic regional perfusion in our environment and the experience of other countries in cardiac recovery led us to develop a protocol for cardiac procurement in donation after circulatory death with in situ assessment and cold preservation.
MethodsA multidisciplinary team was formed to create a cardiac extraction protocol with donation after circulatory death. After a phase of animal experimentation, the protocol was approved by the Ethics Committee for Health Care and by the National Transplant Organization.
ResultsA protocol was drawn up establishing the criteria for donor and recipient selection and regulating the donation procedure with thoracic-abdominal perfusion after exclusion of the supra-aortic trunks. Cardiac evaluation is in situ and static preservation in cold storage. This protocol was sent to the rest of the donor hospitals and this led us to perform the first heart transplant in Spain with this donation modality.
ConclusionsCardiac transplantation with donation after circulatory death is a clinical reality that will increase the number of potential donors. The technical characteristics of the procedure mean that this type of donation should be performed in experienced centres.
El trasplante cardiaco sigue siendo el tratamiento de elección en los pacientes en insuficiencia cardiaca terminal refractaria a tratamiento médico óptimo, aportando a los receptores una mejora en la supervivencia y en la calidad de vida1.
Actualmente, el desequilibrio entre la oferta y la demanda de órganos ha sido uno de los mayores limitantes para la expansión del trasplante como terapia. Además, el cambio en el perfil del donante en muerte encefálica (DME) ha obligado al uso de criterios ampliados en la aceptación de órganos y a la búsqueda de alternativas que puedan incrementar el número de órganos disponibles. Una de las más novedosas se relaciona con la consideración de órganos procedentes de donación en asistolia controlada.
La donación tras la muerte circulatoria, más conocida como donación en asistolia controlada (DAC), consiste en la utilización de órganos provenientes de pacientes con daño cerebral catastrófico, enfermedades neurodegenerativas, cardiacas o respiratorias en fase terminal. En todos ellos se ha tomado la decisión clínica de limitar el tratamiento de soporte vital (LTSV) por considerarlo fútil y porque resulta previsible una muerte precoz2. Este modo de donación representa una importante fuente de órganos en los países con programas activos3,4, y en nuestro país ha experimentado un progresivo incremento hasta representar el 35% de todos los procedimientos de donación de cadáveres5.
En la DAC el procedimiento de preservación y extracción de los órganos se ha ido modificando a lo largo de los años y según el marco legal de cada país. Inicialmente se utilizaron técnicas de extracción rápida de los órganos. Posteriormente se sustituyeron por técnicas de protección con perfusión abdominal fría, en las que se utilizaba un catéter de doble balón y triple luz. En la actualidad se opta por el uso de la perfusión regional normotérmica con dispositivos de oxigenación por membrana extracorpórea (PRN-ECMO)4,6. En España, la PRN-ECMO se ha convertido en la práctica más común, ya que esta técnica permite la reperfusión sanguínea in situ7-9 y ha obtenido resultados favorables en los injertos hepáticos y renales, describiendo menores complicaciones biliares y menor disfunción retardada renal10-12.
Gracias a la DAC se ha visto aumentado el número de trasplantes abdominales y pulmonares en todo el mundo. En cambio, la extracción cardiaca no se adoptó inicialmente, ya que se pensó que podría existir daño isquémico irreversible sobre el órgano por la LTSV y durante la parada cardiaca13. Sin embargo, en la última década se han comunicado resultados alentadores con el trasplante de corazón procedente de DAC en Australia14, Reino Unido15-17 y Bélgica18, arrojando resultados tempranos similares a los obtenidos con injertos procedentes de DME16. Las experiencias iniciales se realizaron con explante directo tras LTSV, seguido de preservación y recuperación ex vivo en un Sistema de Cuidado de Órganos (Organ Care System [OCS]™)14 o mediante la recuperación con PRN-ECMO toracoabdominal15,16. La ventaja de la PRN-ECMO toracoabdominal es que permite el restablecimiento de la función cardiaca, realizándose la evaluación funcional del órgano tras la determinación del fallecimiento y antes de la extracción15. En la mayoría de las experiencias esta recuperación de la función cardiaca se acompañaba de preservación del órgano ex situ con OCS™, pero recientemente se ha descrito que el uso de PRN-ECMO seguido de extracción y conservación en frío del órgano reduce la complejidad del procedimiento y disminuye los costes globales18,19.
Basándonos en la evidencia actual sobre la extracción cardiaca en DAC y en nuestra experiencia previa con el uso de PRN-ECMO en DAC, un equipo multidisciplinar del Hospital Universitario Puerta de Hierro-Majadahonda, compuesto por la Unidad de Coordinación de Trasplantes y los departamentos de Cirugía Cardiaca, Cardiología, Cirugía Torácica y Medicina Intensiva, diseñó un protocolo para la obtención de corazones de donantes de DAC basado en el uso de PRN-ECMO toracoabdominal sin dispositivos de preservación ex situ.
MétodosTras revisar la bibliografía disponible, a principios del año 2019 se organizó un comité multidisciplinar con el objetivo de, adaptando a nuestro entorno medicolegal las experiencias previas, formular un protocolo de donación cardiaca dentro del programa de DAC ya implantado en nuestro centro. Para ello se llevaron a cabo reuniones entre los equipos de Coordinación de Trasplantes, Medicina Intensiva, Cirugía Cardiovascular, Cardiología y Cirugía Torácica, elaborando un formulario de consenso sobre el procedimiento de valoración y extracción cardiaca sin poner en riesgo el resto de órganos torácicos y abdominales.
Tras redactar el protocolo, se realizó un pilotaje del mismo en modelo porcino de DAC mediante desconexión de la ventilación mecánica y parálisis muscular, induciendo así la parada circulatoria por anoxia. La finalidad de esta experimentación fue la comprobación de ausencia de flujo cerebral mediante electroencefalograma plano, la ausencia de daño pulmonar durante el procedimiento, con toma de biopsias pulmonares para estudio, así como el entrenamiento del personal implicado en la extracción. Tras realizar la experimentación y las modificaciones oportunas en el protocolo, este fue presentado a la Comisión de Trasplantes y al Comité de Ética para la Asistencia Sanitaria del centro, siendo aprobado en junio de 2019. Posteriormente, se presentó en sesión clínica a cada uno de los equipos médicos relacionados con el procedimiento y en sesión interdisciplinar para todo el personal del centro implicado. Una vez validado por el centro, este protocolo fue evaluado y modificado por la Comisión de Trasplantes del Consejo Interterritorial del Sistema Nacional de Salud y por la Organización Nacional de Trasplantes (ONT), siendo aprobado definitivamente el 25 de septiembre de 2019. El protocolo se compartió con todos los hospitales donantes de la región, con la intención de que estos centros pudieran remitir a cualquier potencial donante de DAC que cumpliera los criterios de elegibilidad para la donación de corazón.
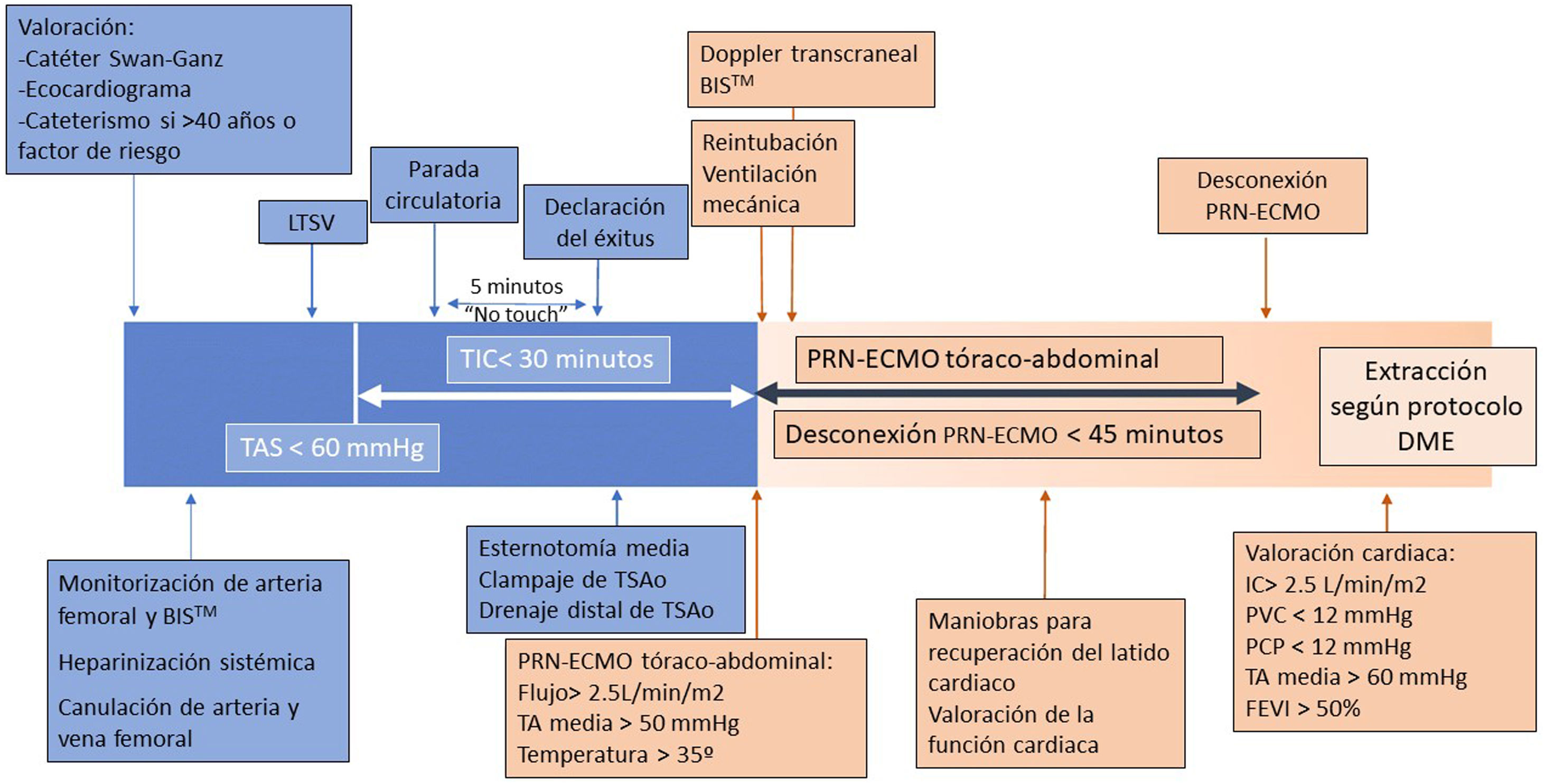
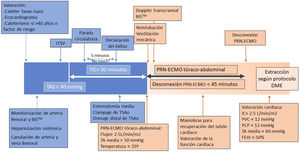
ResultadosProtocoloNuestro protocolo está alineado, en los aspectos fundamentales, con el resto de los aprobados por la ONT, basándose todos ellos en la PRN-ECMO toracoabdominal (fig. 1), la preservación estática en frío del corazón y el implante en el mismo centro donante.
Gráfico temporal de donación en asistolia controlada.
BISTM: espectrometría biespectral; FEVI: fracción de eyección del ventrículo izquierdo; DME: donación en muerte encefálica; IC: índice cardiaco; LTSV: limitación de terapias de soporte vital; PCP: presión capilar pulmonar; PRN-ECMO: perfusión regional normotérmica con oxigenación de membrana extracorpórea; PVC: presión venosa central; TA: tensión arterial; TAS: tensión arterial sistólica; TIC: tiempo de isquemia caliente; TSAo: troncos supraaórticos.
Se incluye como potencial donante de corazón a todo paciente que cumple criterios de DAC o muerte circulatoria controlada con edad comprendida entre los 18 y los 45años, con consentimiento informado para la donación y con ecocardiograma reglado previo que demuestre una adecuada contractilidad cardiaca. Además, el donante deberá cumplir con una estimación de fallecimiento tras la LTSV de menos de 120minutos.
Se excluyen del proceso los donantes con cardiopatía conocida o esternotomía previa, con infarto cardiaco o parada de causa cardiaca/etiología desconocida o con necesidad de soporte inotrópico a altas dosis, así como los donantes con infecciones o antecedentes oncológicos que contraindiquen su validez.
Selección del receptorSe considera potencial receptor a todo paciente en lista de espera para trasplante cardiaco electivo, no portador de dispositivos de asistencia ventricular, que haya firmado el consentimiento informado para poder recibir un órgano de DAC. Por otro lado, se excluye a los pacientes con cirugía cardiaca previa, resistencias vasculares pulmonares fijas mayores de 2,5uW o gradiente transpulmonar mayor a 8mmHg.
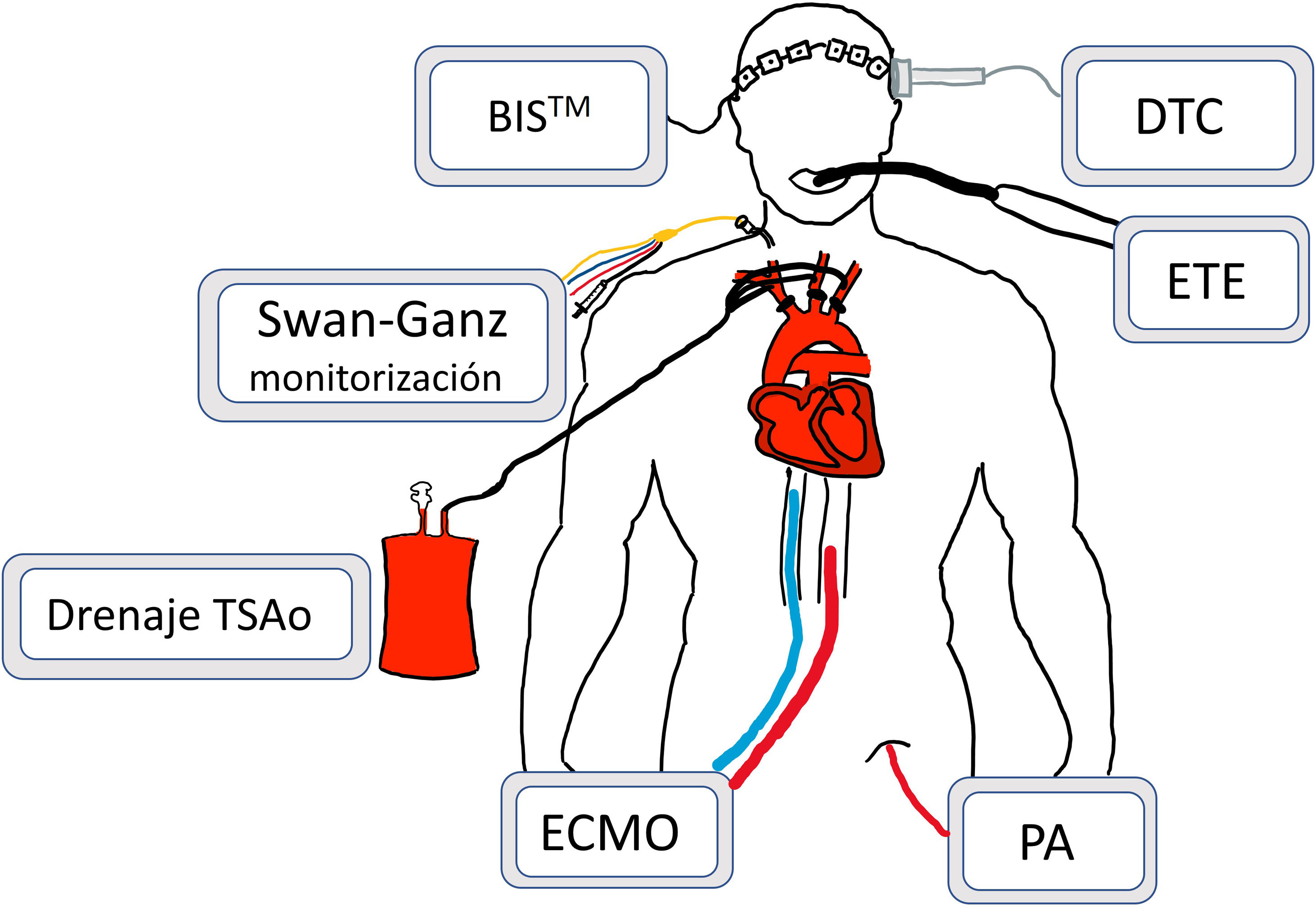
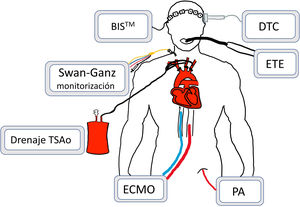
Preparación del donantePrevio a la retirada del soporte vital y habiendo consentido la familia la manipulación pre mortem, se lleva a cabo la valoración cardiaca con coronariografía en pacientes mayores de 40años o con riesgo de enfermedad coronaria. Se realiza un ecocardiograma a todos los potenciales donantes y se procede a la monitorización tanto arterial como de las presiones pulmonares mediante catéter de Swan-Ganz (fig. 2). Además, se canulan una vena y una arteria femoral tras heparinización sistémica para iniciar la PRN-ECMO toracoabdominal.
Monitorización del donante durante la perfusión regional normotérmica toracoabdominal.
BISTM: espectrometría biespectral; DTC: doppler transcraneal; ECMO: membrana de oxigenación extracorpórea; ETE: ecocardiografía transesofágica; PA: línea de presión arterial; TSAo: troncos supraaórticos.
Parte de este proceso se puede realizar directamente en el quirófano.
Limitación del tratamiento de soporte vitalSiempre que se valore la extracción cardiaca la LTSV se realiza en el quirófano, facilitando el acompañamiento de la familia hasta la parada circulatoria.
Tras la LTSV y la extubación terminal según el procedimiento habitual, se administra una nueva dosis de heparina (500-1.000UI/kgi.v.). Una vez confirmada la parada circulatoria se respetan 5 minutos de no touch y se certifica el fallecimiento ante la ausencia de pulso arterial confirmado a través de la monitorización arterial. Es decir, la parada cardiaca debe ser hemodinámica, aunque exista actividad eléctrica sin pulso.
Procedimiento de valoración in situUna vez certificado el fallecimiento se inicia el procedimiento quirúrgico y la valoración cardiaca in situ.
Se realiza una esternotomía media ampliada con cervicotomía izquierda, apertura de pericardio y localización del arco aórtico intrapericárdico para realizar la disección y el pinzamiento de los troncos supraaórticos, asegurando la ausencia de flujo cerebral antes de la instauración de la PRN-ECMO toracoabdominal. Posteriormente se instaura el soporte ECMO periférico a un flujo de al menos 2,5l/min/m2, manteniendo una presión arterial media mayor de 50mmHg. Finalmente, y según la última modificación del protocolo, se realiza el drenaje de cada uno de los troncos supraaórticos en la parte distal a su pinzamiento.
Una vez establecida la PRN-ECMO, se procede a la reintubación y a la ventilación mecánica del paciente, iniciando las maniobras de resucitación y recuperación del latido cardiaco. A continuación se confirma la ausencia de perfusión y actividad cerebral mediante doppler carotídeo, doppler transcraneal y espectrometría biespectral (BIS™). Si en algún momento del proceso de donación se recuperase la actividad cerebral, se procedería a excluir la aorta torácica de la perfusión, detener la reperfusión cardiaca y suspender la donación cardiaca, intentando asegurar la correcta preservación y obtención del resto de órganos.
Tras restablecerse el ritmo cardiaco se intenta llevar a cabo la desconexión del ECMO, realizando una valoración continua de la función cardiaca mediante ecocardiograma transesofágico, presiones del catéter Swan-Ganz e inspección visual por parte del cirujano cardiaco. Si tras 45minutos de reperfusión cardiaca no se consigue la desconexión de ECMO por inestabilidad hemodinámica, se desestimará la extracción del corazón y se continuará la del resto de órganos como en un DME convencional.
El tiempo máximo de isquemia caliente funcional (TIC), periodo entre el descenso de la tensión arterial sistémica por debajo de 60mmHg y el inicio de la PRN-ECMO toracoabdominal, será de 30minutos. Si después de este tiempo no se han podido excluir los troncos supraaórticos e iniciar la PRN-ECMO, se realizará el pinzamiento de la aorta descendente y se procederá a la valoración de pulmones y órganos abdominales según el protocolo de DAC habitual.
Durante la reperfusión se extraen muestras de sangre al menos cada 30minutos para determinar los gases arteriales, el lactato, las troponinas, así como los parámetros de la función hepática.
Primera experiencia nacionalTras la aprobación del protocolo y de la difusión de este a los hospitales donantes de la Comunidad de Madrid, a principios del 2020 se realizó el primer trasplante cardiaco con DAC de España.
La donante fue una mujer de 43años con antecedente de asma bronquial con mal control sintomático y necesidad de ingresos hospitalarios por reagudización de su patología. En el último ingreso presentó una nueva reagudización asmática con necesidad de ventilación mecánica no invasiva y antibioterapia, pero a pesar del tratamiento, sufrió una parada cardiorrespiratoria por hipoxemia. Tras la reanimación avanzada se diagnosticó de encefalopatía hipóxico-isquémica severa. Posteriormente se planteó la LTSV a la familia y la posibilidad de donación, aceptando el traslado a nuestro centro para valorar la DAC, previo consentimiento informado.
El receptor seleccionado fue un varón de 59años con diagnóstico de miocardiopatía por amiloidosis TTR hereditaria con mutación patogénica Val142del incluido en lista de trasplante cardiaco electivo. El receptor se encontraba en clase funcional NYHAIII con necesidad de ingresos periódicos para tratamiento deplectivo. Tras informarle de la posibilidad del trasplante con un corazón de DAC, se obtuvo su consentimiento.
El proceso de DAC se realizó según el protocolo descrito previamente, con un tiempo desde el inicio de la esternotomía al pinzamiento de troncos supraaórticos de tan solo 4minutos. El TIC fue de 16minutos. En este caso, se recuperó el latido cardiaco en menos de 1minuto tras la reperfusión cardiaca y se confirmó la ausencia de perfusión y actividad cerebral mediante doppler transcraneal, doppler carotídeo y BIS™. Se consiguió la desconexión de ECMO sin necesidad de soporte vasoactivo confirmando la validez cardiaca, pero dados los antecedentes de la donante se decidió reiniciar la PRN-ECMO a 1l/min/m2 para asegurar la oxigenación. Durante el proceso de reperfusión toracoabdominal se inició el procedimiento con el receptor de forma simultánea. Tras 90minutos de PRN-ECMO para la valoración de los órganos abdominales se procedió a la extracción multiorgánica siguiendo el protocolo habitual en DME.
El implante cardiaco ortotópico se realizó según la técnica de Lower-Shumway, con un tiempo de isquemia fría de 55minutos. Se recuperó el latido cardiaco en ritmo sinusal tras un choque eléctrico interno de 10julios. El receptor fue trasladado a la unidad de cuidados posquirúrgicos con necesidad de soporte vasoactivo a dosis bajas, pudiendo ser extubado a las 36horas de la cirugía. El ingreso hospitalario se prolongó hasta los 64días del postoperatorio por una mediastinitis por Staphylococcus aureus. Tras el alta el paciente presentó una evolución favorable, sin necesidad de reingresos ni evidencia de rechazo tras más de un año desde el implante.
DiscusiónLa escasez de donantes ha llevado a desarrollar estrategias alternativas a la DME para aumentar el número de órganos. Entre estas estrategias, la DAC ha surgido como una de las mejores opciones para aumentar el número de donantes, estimándose que la utilización de corazones de DAC tendría el potencial de aumentar la actividad de los trasplantes de corazón entre el 15 y el 50%, dependiendo de los países20,21. En España, teniendo en cuenta la limitación de la edad menor de 45años y los criterios de inclusión para ser donantes cardiacos, se estima que esta técnica podría incrementar en un 5 al 10% el número de donantes de corazón, lo que supondría entre 15-30 corazones más trasplantados al año22,23.
La limitación de los criterios de selección de los donantes hace necesaria la colaboración de otros hospitales donantes. Además, las peculiaridades técnicas de la extracción cardiaca en DAC hace necesario concentrar los posibles donantes en centros con protocolos establecidos y experiencia en la PRN-ECMO24.
En España, las intervenciones pre mortem en los potenciales donantes no están prohibidas, siempre que exista el consentimiento familiar y que estas no interfieran en el proceso de la muerte25. Este marco legal permite la canulación previa a la LTSV, ayudando a reducir los TIC y facilitando que se cumplan los criterios de isquemia caliente menor a 30minutos y que se pueda realizar la extracción cardiaca sin poner en riesgo el resto de órganos.
Una de las mayores preocupaciones en la DAC con PRN-ECMO toracoabdominal es la posibilidad de restablecer la circulación cerebral, lo que anularía retroactivamente el diagnóstico de muerte basado en criterios circulatorios26. Esta preocupación se hizo mayor tras la publicación de Manara et al.27, en la que se describe la posible existencia de flujo de sangre a baja presión en el polígono de Willis a pesar del pinzamiento de los troncos supraaórticos a través de circuitos colaterales procedentes de arterias intercostales, mamarias y epigástricas. Esta publicación motivó que en diciembre de 2020 se reunieran todos los equipos nacionales con protocolos de donante cardiaco en DAC aprobados por la ONT, con la finalidad de modificar dichos protocolos, asegurando la ausencia de flujo sanguíneo en el polígono de Willis al establecerse la PRN-ECMO toracoabdominal. Siguiendo la propuesta de Manara et al.27, se decidió que una vez pinzados los troncos supraaórticos se realizaría el drenaje distal al pinzamiento de los tres troncos y se valoraría la posibilidad de conectar dicho drenaje a presión negativa. En nuestro caso no se realizó dicho drenaje tras su pinzamiento, ya que aún no estaba recogido en el protocolo, pero se aseguró la ausencia de perfusión cerebral anterior y posterior mediante doppler transcraneal y la monitorización continua de la actividad eléctrica cerebral con el BIS™, el cual siempre se mantuvo en la marca 00 y mostró una tasa de supresión de 100, que indica un electroencefalograma isoeléctrico28-30.
En la actualidad, la mayor parte de las series publicadas de DAC cardiaca refieren que los corazones se someten a un periodo de perfusión ex situ en un OCS™ tras la extracción14,15,17. Sin embargo, previamente a la experiencia en España22,23, se había reportado la viabilidad de DAC con PRN-ECMO toracoabdominal sin perfusión ex situ en el Reino Unido y Bélgica18,19. Esta modalidad de DAC cardiaca simplifica en parte la logística del procedimiento y supone un gran ahorro de costes, facilitando la expansión de la donación cardiaca en DAC. Además, la valoración cardiaca in situ permite una evaluación funcional del corazón más realista y similar a la del DME y asegura la perfusión de los órganos abdominales, con lo que la extracción cardiaca no dificulta la extracción multiorgánica22,23. En nuestra experiencia, los pulmones no fueron valorados por el antecedente de asma grave de la donante, pero como se ha descrito en el artículo de Messer et al.31, la PRN-ECMO toracoabdominal no impide la donación pulmonar.
Los protocolos de donante cardiaco en DAC aprobados en España inicialmente presentan unos criterios de inclusión restrictivos de los potenciales donantes, con la intención de garantizar buenos resultados, pero ello limita el número de candidatos a esta modalidad de donación. Además, por el momento solo se permite la donación para implante local, con la finalidad de garantizar unos tiempos de isquemia fría cortos. Tras sobrepasar la curva de aprendizaje, será necesario valorar la posibilidad de expandir los criterios de inclusión y aumentar la tolerancia a tiempos de isquemia fría más prolongados. Dadas las limitaciones actuales que disminuyen el número de potenciales donantes cardiacos con DAC, se hace necesaria la difusión del protocolo y la colaboración de los hospitales que aportan donantes para concentrar estos casos en los centros con protocolos aprobados.
Dado lo novedoso de la técnica y la escasa experiencia en nuestro entorno, desde la ONT se ha propuesto la realización de reuniones periódicas de los grupos con protocolo aprobado para compartir las experiencias y reevaluar periódicamente los protocolos.
ConclusionesEl trasplante de corazón a partir de DAC es una realidad clínica que puede aumentar significativamente la disponibilidad de corazones para trasplante. El uso de la PRN-ECMO toracoabdominal es factible y permite evaluar la función cardiaca antes de la extracción del órgano sin impacto negativo sobre los órganos abdominales ni los pulmones. Los protocolos aprobados en nuestro país se basan en la PRN-ECMO toracoabdominal, en la preservación estática en frío tras la extracción y en el implante en el mismo centro donante, lo que reduce los costes de los sistemas de OCS y hace más viable económicamente la expansión de esta modalidad de donación.
Responsabilidades éticasEl programa de donación cardiaca con donante en asistolia controlada obtuvo la aprobación del Comité de Ética para la Asistencia Sanitaria del centro. Se obtuvo el correspondiente consentimiento informado de los familiares del donante y del paciente receptor antes de realizar el procedimiento.
Conflicto de interesesLos autores declaran que no tienen intereses económicos conocidos ni relaciones personales que puedan parecer influir en el trabajo presentado en este artículo.
Quisiéramos agradecer la colaboración a todo el equipo que hace posible que siga adelante el programa de trasplante cardiaco y que nos permite llevar a cabo iniciativas como la de la donación en asistolia controlada. Además de agradecer la colaboración a todos los donantes y sus familias, que son los auténticos artífices del éxito de nuestro programa nacional de trasplante.