A pesar de los múltiples avances en el tratamiento de la insuficiencia cardíaca, tanto aguda como crónica, todavía no existe un equivalente al trasplante cardíaco como tratamiento a largo plazo para la insuficiencia cardíaca terminal. Sin embargo, el trasplante está limitado por la escasez y la calidad de los injertos. La protección miocárdica es un factor indispensable para la función del injerto y está relacionada con el fallo primario del injerto agudo y crónico. La preservación del corazón donado alcanza 4-6 h utilizando isquemia fría, soluciones de preservación y sistemas de trasporte estándar con hielo. Se han explorado varias opciones en los últimos años y se han desarrollado estrategias novedosas para optimizar la preservación del injerto y potencialmente aumentar el grupo de donantes. Dentro de estos dispositivos destacan el SherpaPakTM Cardiac Transport System (Paragonix), que proporciona una temperatura de almacenamiento más fiable y clínicamente aceptable en comparación con el almacenamiento convencional, pudiendo así disminuir el daño cardíaco y el fallo primario del injerto, y el Organ Care System (OSCTM, TransMedics), que realiza una perfusión normotérmica ex vivo tras la extracción, pudiendo realizar una evaluación in situ del órgano tras la extracción y recuperar órganos marginales. En esta revisión analizamos la práctica actual en la obtención de órganos, así como los nuevos dispositivos que permiten mejorar y ampliar la preservación.
Despite multiple advances in the treatment of heart failure, both acute and chronic, there is still no equivalent to heart transplantation as long-term treatment for end-stage heart failure. However, transplantation is limited by the scarcity and quality of grafts. Myocardial protection is an indispensable factor for graft function, and it is related to acute and chronic primary graft failure. The donor heart can be preserved for 4-6 hours using cold ischaemia, preservation solutions, and standard ice transport systems. Several options have been explored in recent years and cutting-edge strategies have been developed to optimize graft preservation and potentially increase the donor pool. Notable among these devices are the SherpaPakTM Cardiac Transport System (Paragonix), which provides a more reliable and clinically acceptable storage temperature compared to conventional storage, thus potentially decreasing cardiac damage and primary graft failure, and the Organ Care System (Transmedics) which performs ex vivo normothermic perfusion after extraction, being able to perform an in-situ evaluation of the organ after extraction and retrieve marginal organs. In this review, we analyse current practice in organ procurement as well as the new devices that improve and extend preservation.
A pesar de los avances en el tratamiento médico y las asistencias circulatorias mecánicas de larga duración, el gold standard en los estadios finales de la insuficiencia cardíaca avanzada sigue siendo el trasplante cardíaco en pacientes seleccionados. Sin embargo, el trasplante está limitado por la escasez y la calidad de los injertos. Si bien la supervivencia a largo plazo de estos pacientes ha aumentado de manera considerable en las últimas décadas, especialmente debido a la mejora del tratamiento inmunosupresor, los determinantes básicos del éxito en el trasplante cardíaco no lo han hecho. Son, en esencia: 1) la calidad del injerto en sí mismo; 2) la obtención, conservación y almacenamiento del injerto; 3) el tiempo de isquemia; 4) la complejidad de la operación y 5) el estado del receptor.
La disminución progresiva en la disponibilidad de corazones óptimos para trasplante ha supuesto un cambio en el perfil del donante de órganos en nuestro país, con la consecuente flexibilización en los criterios de aceptación de corazones para trasplante, como ha ocurrido con el resto de órganos sólidos. Encontramos donantes más añosos, especialmente en Europa, donde, al igual que en España, la edad media de los donantes se encuentra en torno a los 45 años. Cada vez más, los donantes mueren como resultado de una hemorragia intracerebral y tienen comorbilidades cardiovasculares que van desde hipertensión no tratada, hipertrofia ventricular izquierda, diabetes o tabaquismo1. Todo ello repercute en una peor calidad del injerto que escapa a nuestro control.
Asimismo, encontramos un aumento de la complejidad técnica del propio trasplante debido al mayor número de pacientes reoperados, con cardiopatías congénitas o dispositivos de asistencia ventricular. Como consecuencia, la cirugía de trasplante cardíaco es significativamente más desafiante con cirugías más complejas, más largas y de mayor riesgo, lo que inevitablemente desemboca en tiempos de isquemia más prolongados.
Las características de los receptores también han cambiado progresivamente en las últimas dos décadas. La edad, las comorbilidades y el riesgo inherente de nuestros receptores también son mayores, con una mayor prevalencia de hipertensión pulmonar e insuficiencia renal. Este peor escenario clínico hace que cada vez encontremos un mayor número de trasplantes realizados en situación de urgencia y/o con dispositivos de asistencia ventricular para intentar que los receptores lleguen al trasplante en la mejor situación clínica posible.
Dado que no podemos cambiar ni donantes ni receptores, y que disminuir el tiempo de isquemia cardíaca no siempre es posible por las distancias interhospitalarias y la mayor complejidad quirúrgica, los aspectos en los que podemos influir con mayor impacto y que más se han estudiado en los últimos años son la obtención, protección y preservación del órgano donante. Con ello se pretende minimizar el daño que la isquemia induce en nuestro órgano, haciéndolo susceptible de lesiones celulares o histológicas y fallo primario del injerto. Analizaremos las distintas soluciones de preservación, técnicas y dispositivos utilizados en la obtención de corazones para trasplante cardíaco.
Métodos de preservación cardíacaLa cuestión de la preservación del corazón donado salió a la luz después del primer trasplante de corazón humano realizado por Barnard en 1967. La obtención del corazón donante es una parte importante del proceso del trasplante cardíaco, siendo crucial una correcta estrategia de preservación para lograr un trasplante exitoso. El explante del corazón donado es un proceso altamente coordinado, con varios equipos que trabajan simultáneamente. No hay que olvidar que una buena extracción y preservación del órgano no conducirá necesariamente a un buen resultado del trasplante, pero una mala obtención del órgano conducirá inevitablemente a problemas.
Los métodos de preservación del corazón tienen como objetivo minimizar la disfunción del injerto causada por la lesión por isquemia-reperfusión que inevitablemente ocurre durante el intervalo de trasporte ex vivo, debida a la necrosis por acidosis a pesar de condiciones hipotérmicas. En la actualidad, la técnica estándar de conservación del corazón consiste en una parada cardíaca seguida de un periodo de almacenamiento en frío en una solución cristaloide de conservación.
Aunque la investigación ha logrado avances significativos en la mejora de la tecnología de preservación del corazón donante, la lesión por isquemia-reperfusión todavía ocurre en una cierta proporción de injertos cardíacos debido a una preservación ineficaz y/o un trasporte prolongado. La calidad del injerto cardíaco es directamente proporcional al tiempo de isquemia en frío, que no debe superar las 6 h2. En consecuencia, existen dos estrategias básicas para mejorar los resultados de la preservación del corazón del donante:
- •
Acortar el tiempo de isquemia fría.
- •
Perfeccionar las técnicas de preservación, tanto en lo referente a las soluciones de preservación como a los métodos de trasporte.
Ha habido muchos estudios en relación con la solución de conservación, pues esta podría reducir la lesión isquémica y acelerar la recuperación de la función ventricular después del trasplante cardíaco. Los objetivos principales de cualquier solución de preservación son: lograr un paro metabólico hipotérmico, preservar la estructura celular/viabilidad de los tejidos durante la hipotermia y reducir los efectos nocivos de la lesión por reperfusión. Las soluciones más utilizadas son la Celsior®, la de la Universidad de Wisconsin (UW) o solución de Belzer y la solución HTK (histidina-triptófano-cetoglutarato) o solución de Bretschneider (Custodiol®).
Muchos estudios han intentado comparar estas distintas soluciones, pero como muestra una reciente revisión, encontramos resultados contradictorios a favor de una u otra solución, con estudios que no muestran diferencias en mortalidad ni incidencia de fallo biventricular3,4. En otra revisión5 se sugiere que la solución de la UW presenta mejores resultados, aunque tanto Celsior® como Custodiol® parecen proporcionar una mejor protección del corazón donante. Debido a que los corazones de donantes envejecidos tienen un mayor riesgo de fallo precoz del injerto, su respuesta a las distintas cardioplegias también ha sido estudiada. Lee et al. observaron que la solución Custodiol (HTK) proporcionó mejor protección para los corazones de donantes añosos que la Celsior6.
Otra opción que se ha estudiado ha sido añadir aditivos a estas soluciones, pues aunque la hipotermia y la solución de preservación retrasan la muerte celular, pueden activar procesos que afecten negativamente al órgano. Así se han estudiado diversos agentes antiisquémicos, antioxidantes, reductores del edema miocárdico, de la sobrecarga de calcio y acidosis intracelular, e incluso inotrópicos7, pero ninguno ha demostrado ser mejor que la preservación en frío para prevenir la disfunción ventricular después del trasplante.
En definitiva, no se han encontrado resultados concluyentes que evidencien claras diferencias entre las distintas soluciones en cuanto a protección miocárdica. Esto sugiere que ninguna de las ellas es netamente superior al resto, y en la práctica clínica habitual, su elección suele estar en manos del equipo trasplantador.
Sistemas de conservación y trasporteTrasporte tradicionalDesde que se realizó el primer trasplante cardíaco, la técnica más utilizada para preservar el corazón ha sido el almacenamiento isquémico frío a 4-8°C directamente después de la obtención del injerto y hasta el implante en el receptor. Previo al almacenamiento, la administración anterógrada de la solución de preservación reduce el metabolismo aeróbico y el consumo cardíaco, optimizando la preservación celular. Este método se basa en dos principios básicos: la solución de preservación cesa la actividad eléctrica celular y protege el órgano a nivel celular/tisular y la hipotermia disminuye la actividad/demanda metabólicas. Hay que destacar que la hipotermia no detiene el metabolismo, pero lo ralentiza, de modo que cada disminución de 10°C disminuye entre 1,5 y 2 veces la liberación de enzimas autolíticas que pueden provocar la muerte celular, y reduce el daño mitocondrial, la inflamación y la apoptosis.
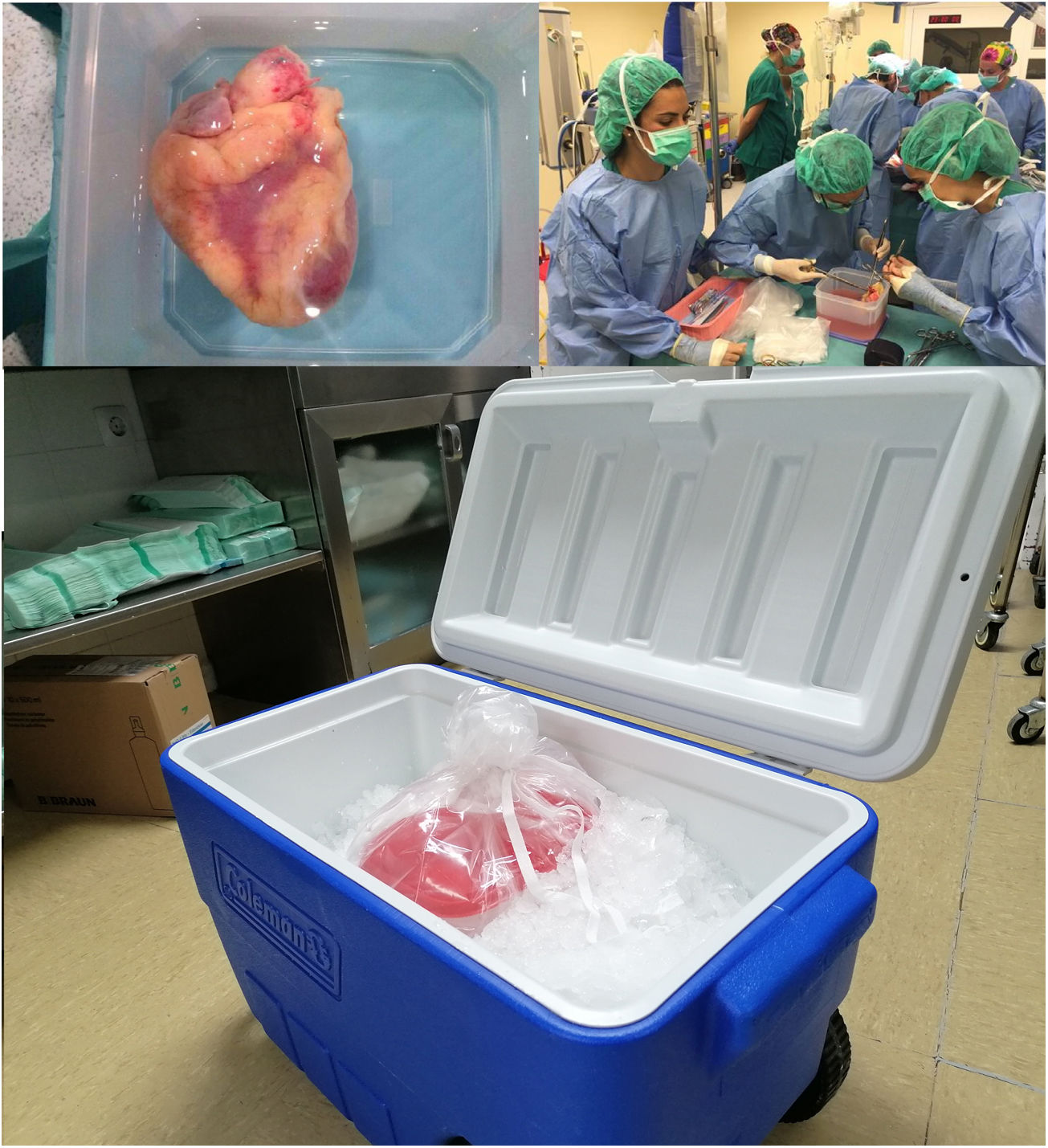
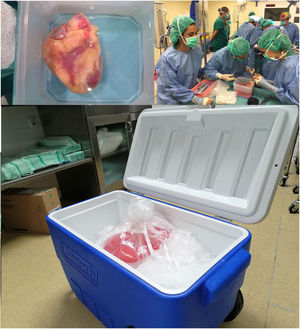
En este modo de trasporte del órgano cardíaco, al igual que muchos otros órganos, se coloca el corazón tras la extracción en un recipiente o bolsa estéril repleto de solución de preservación fría, que a su vez se coloca dentro de otras dos bolsas estériles más, y posteriormente se introduce en el contenedor (nevera) con hielo pilé para el traslado (fig. 1).
Esta técnica presenta tres problemas básicos: 1) el enfriamiento del corazón al colocarlo directamente sobre hielo puede ser muy rápido, poco homogéneo y con ello producir daño por congelación del tejido; 2) no sabemos con certeza a qué temperatura se está trasportando el órgano; y 3) el almacenamiento isquémico frío tiene limitaciones significativas de tiempo, pues la conservación del corazón se circunscribe de 4 a 6 h. Hay que tener en cuenta que si el corazón presenta temperaturas demasiado altas aumentará la lesión isquémica, pero si la temperatura baja demasiado se producirá desnaturalización de las proteínas y daño celular. De hecho, dado que las soluciones de preservación se congelan a temperaturas más bajas de 0°C, los corazones en la conservación tradicional en frío pueden alcanzar temperaturas en torno a 2°C en menos de 30 min, produciéndose lesión irreversible por frío.
El tiempo de isquemia prolongado es uno de los factores de riesgo más importantes para la disfunción temprana del injerto que es, a su vez, la causa más frecuente de muerte en el primer mes después del trasplante cardíaco, como se observa en los registros de la International Society for Heart and Lung Transplantation (ISHLT), donde el riesgo de mortalidad a un año después del trasplante aumenta de forma constante con cada minuto de tiempo de isquemia superior a las 3 h. Este aumento de mortalidad se mantiene a lo largo del tiempo, siendo uno de los factores independientes de mortalidad al año, a los cinco años e incluso a los 15 años del trasplante8. Marasco et al.9 estimaron que el riesgo de fallo primario del injerto aumentaba en un 43% por cada hora de tiempo isquémico adicional más allá de las 4 h. En el estudio de Russo et al.10 no hubo ningún efecto adverso detectable del tiempo de isquemia sobre la supervivencia después del trasplante cardíaco cuando el donante tenía menos de 20 años de edad. En cambio, cuando esta edad aumentaba, la prolongación del tiempo de isquemia tenía un impacto negativo significativo en la supervivencia, especialmente más allá de los 35 años. Esta asociación del aumento de la edad del donante con el fallo primario del injerto probablemente esté relacionada con la disminución de la capacidad del corazón añoso para tolerar las agresiones isquémicas, así como con el aumento de la incidencia de patología cardíaca intrínseca con la edad11.
Todos estos factores han provocado enormes desafíos organizativos a la hora de gestionar los traslados desde los centros donantes, con necesidad de un ajuste preciso de los tiempos de cirugía y la incapacidad de obtener órganos a mayor distancia. Como consecuencia, e intentando ser precavidos ante el riesgo de una isquemia significativa, el grupo disponible de donantes se ve aún más limitado.
SherpaPak™ Cardiac Transport SystemEl SherpaPak™ Cardiac Transport System (CTS, Paragonix Technologies, Inc, Cambridge, Massachusetts, EE UU) es un dispositivo que se basa en la preservación hipotérmica estática y ofrece algunas ventajas sobre el trasporte clásico en hielo:
- •
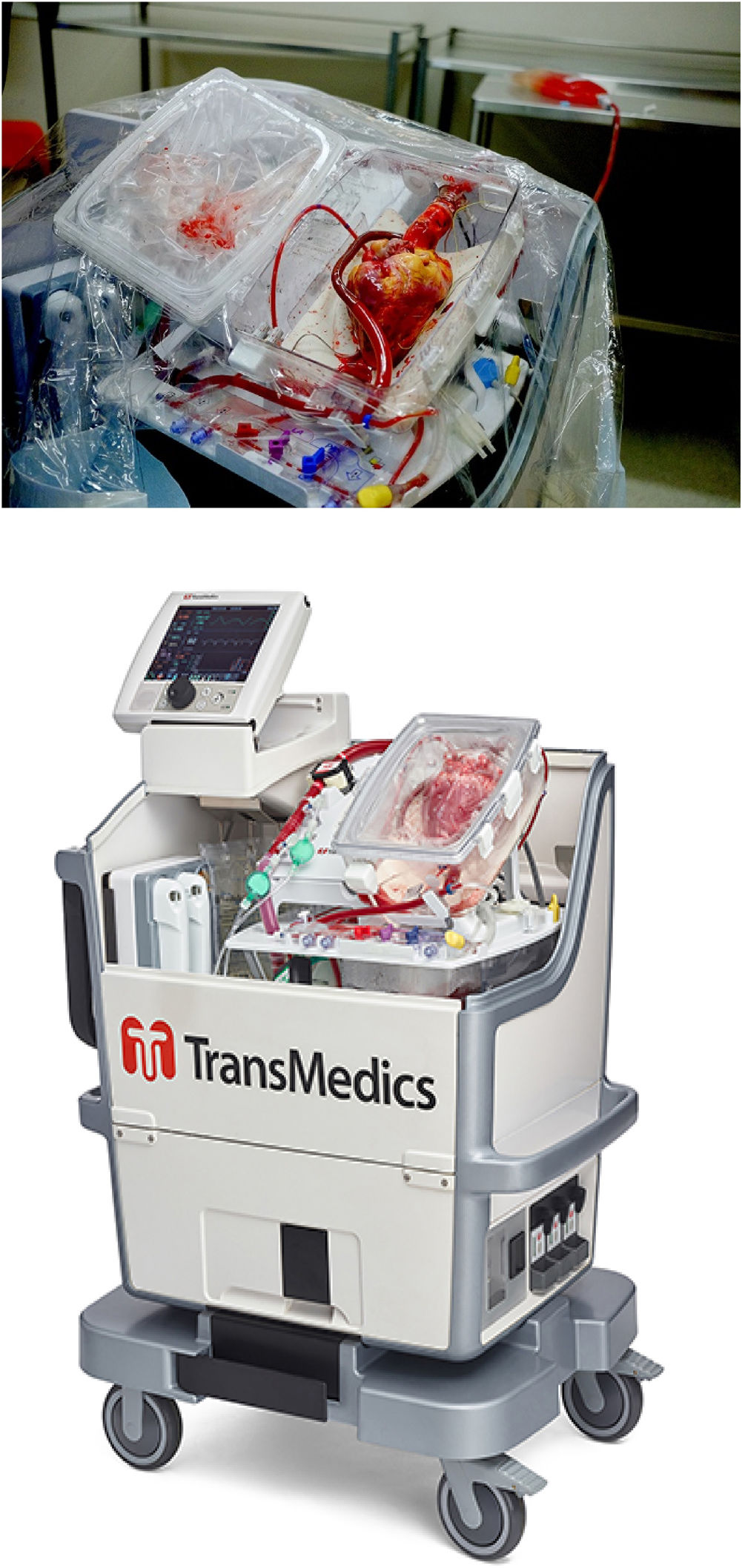
Mantiene la temperatura de conservación del órgano dentro de un rango seguro por encima del punto de riesgo de congelación. Este sistema de preservación consta de dos recipientes herméticos que se colocan uno dentro del otro y sustituyen las bolsas del método clásico (fig. 2). El recipiente interno se rellena de solución de preservación para que el corazón vaya completamente sumergido. Posteriormente, se introducen en una nevera de trasporte dentro de la cual no encontramos hielo a diferencia del trasporte convencional, sino que los recipientes van rodeados de unos paquetes de un material con cambio de fase (en forma de gel congelado a -20°C durante al menos 48 h), cuyas características fisicoquímicas permiten que se mantengan más tiempo en torno a 5°C, temperatura ideal para el trasporte del órgano. Todo ello consigue un descenso de la temperatura paulatino y mantenido dentro de un rango seguro.
Figura 2.SherpaPakTM CTS de Paragonix. Arriba: dos recipientes estériles donde el corazón se encuentra completamente suspendido y sumergido. Abajo izquierda: colocación del recipiente en la nevera rodeado de los paquetes congelados. Derecha: dispositivo durante el traslado marcando la temperatura del órgano a lo largo de todo el almacenamiento.
(0.32MB). - •
El corazón donante, además, se encuentra completamente sumergido y suspendido en solución de conservación anclado a la tapa del recipiente interno a través del cayado aórtico. Esto garantiza un enfriamiento uniforme y evita el enfriamiento parcheado.
- •
Permite medir y registrar la temperatura de los órganos para confirmar el correcto almacenamiento. El SherpaPak™ CTS incorpora un sistema de monitorización a través de bluetooth que permite el control en tiempo real de la temperatura durante cualquier tipo de trasporte por tierra o aire.
Estas ventajas ya se reflejan en el último documento de consenso de la ISHLT sobre la obtención de órganos para trasplante12, donde se establece que la temperatura ideal del corazón es probablemente entre 5°C y 10°C, pudiendo producirse congelaciones del miocardio si existe contacto directo del hielo, y se recomienda el uso de estas nuevas tecnologías de empaquetado para evitar la congelación. Aunque ya existían experiencias en animales que demostraban su utilidad13, Radakovic et al.14 muestran en una de las primeras experiencias con el sistema de trasporte SherpaPak™ que este proporciona una temperatura constante durante el trasporte con una monitorización permanente sin disminuir de los 4°C y con una función ventricular perioperatoria normal.
El almacenamiento convencional en hielo es un método económico y testado ampliamente para la preservación del corazón donante y se considera seguro con tiempos de isquemia por debajo de 4 h. Los corazones con más de 6 h de isquemia fría rara vez se trasplantan, y aquellos con un tiempo de isquemia de 4 a 6 h tienen una reducción de la supervivencia del 5% a los cinco años después del trasplante15. Existen ya publicados algunos casos clínicos y series cortas con este dispositivo con buenos resultados, a pesar de tiempos de isquemia prolongados. Naito et al.16 describen un caso de más de 5 h de isquemia con buen funcionamiento del injerto tras el trasplante, y sugieren que en estos casos donde se espere isquemias largas, el SherpaPak™ asegura mejor la temperatura, pudiendo reducir así el riesgo primario del injerto. Actualmente, se encuentra en marcha un registro internacional denominado Global Utilization And Registry Database For Improved Heart Preservation (GUARDIAN)17, con la colaboración de 15 centros (entre ellos el nuestro) que ya incluye alrededor de 500 pacientes trasplantados, en el que se compara el trasporte convencional con el dispositivo SherpaPak™. Este registro muestra resultados prometedores en reducción de fallo primario del injerto y necesidad de ECMO posoperatorio.
En nuestro centro utilizamos este método de preservación cardíaca con excelentes resultados, especialmente con tiempos de isquemia largos. Desde 2018 se ha utilizado en 13 trasplantes, todos ellos con isquemias entre 4 y 7 h (tiempo medio 324 ± 105 min). La supervivencia hospitalaria de la serie es de 85% (ninguna muerte fue de causa cardiológica), y con un seguimiento medio de 17 meses no encontramos ningún caso de rechazo ni muerte por causa cardiológica (solo un paciente de la serie murió a causa de neumonía por COVID-19).
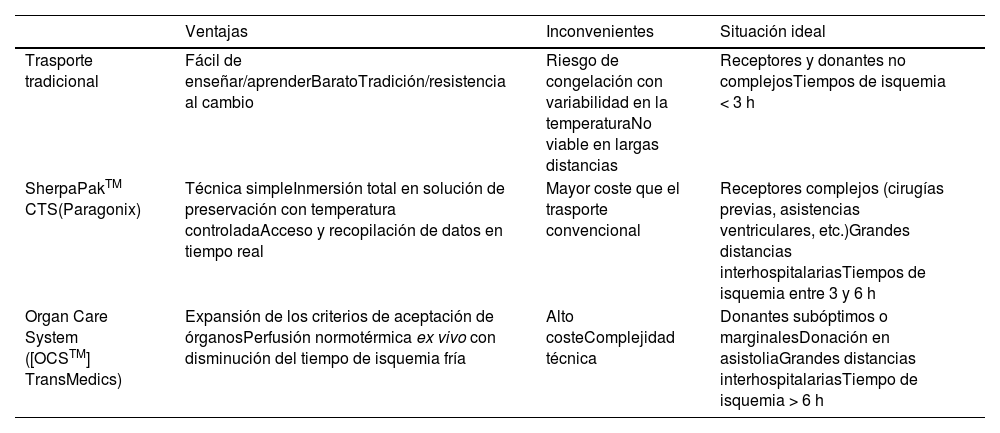
Hemos realizado una revisión reciente de pacientes trasplantados desde 2013 con isquemias superiores a 5 h comparando el trasporte con isquemia fría (n = 18) vs. el sistema de trasporte SherpaPak™ (n = 8), cuyos resultados se observan en la tabla 1. Vemos cómo los receptores de ambos grupos son pacientes complejos, teniendo la mayoría de ellos cirugía previa y aproximadamente la mitad de ellos necesitaron algún tipo de asistencia circulatoria mecánica previa al trasplante, lo que se ve reflejado en el elevado número de trasplantes en situación de urgencia. En ambos grupos, el tiempo medio de isquemia estuvo alrededor de los 350 min, con distancias a los hospitales donantes de más de 800 km. Aunque al analizar los resultados posoperatorios no se alcanza la significación estadística, dado el escaso número de pacientes, se objetiva una tendencia a menor fallo de ventrículo derecho, menor necesidad de oxigenación por membrana extracorpórea (ECMO) o soporte mecánico tras la cirugía y menor tasa de fallo primario del injerto en el grupo en el que se utilizó el dispositivo SherpaPak™. La mortalidad intrahospitalaria también fue menor en este grupo.
Resultados con el sistema de trasporte SherpaPakTM (CTS) en el Hospital Universitario 12 de Octubre en pacientes con isquemia prolongada (> 5 h)
| Trasporte clásico | SherpaPakTM (CTS) | p | |
|---|---|---|---|
| Sexo (hombre) | 61% | 62,5% | 0,94 |
| Edad (años) | 48,6 ± 22 | 44,1 ± 36 | 0,42 |
| Cirugía cardíaca previa | 77,7% | 87,5% | 0,65 |
| Inotrópicos pretrasplante | 38,9% | 33,3% | 0,6 |
| SCM pretrasplante | |||
| ECMO | 16,7% | 25% | 0,41 |
| DAVI | 27,8% | 37,5% | |
| Distancia hospital donante (km) | 807,5 ± 1.300 | 821,9 ± 1.595 | 0,96 |
| Prioridad | |||
| Electivo | 61,1% | 50% | 0,24 |
| Urgencia 1 | 16,7% | 0% | |
| Urgencia 0 | 22,2% | 50% | |
| Tiempo de isquemia cardíaca | 342,5 ± 71 | 337,5 ± 152 | 0,82 |
| Resultados | |||
| Inotrópicos (horas) | 140 ± 490 | 136 ± 1.920 | 0,48 |
| SBGC | 50% | 62,5% | 0,7 |
| Fallo derecho | 27,7% | 12,5% | 0,2 |
| Necesidad ECMO/SCM | 22% | 0% | 0,08 |
| Fallo primario/Rechazo agudo | 22% | 0% | 0,08 |
| Mortalidad hospitalaria | 27,8% | 12,5% | 0,2 |
SCM: soporte circulatorio mecánico; ECMO: extracorporeal membrane oxygenation; DAVI: dispositivo de asistencia ventricular izquierda (incluye CentriMag, EXCOR Berlin Heart, Impella 5.0 y HeartMate 3); SBGC: síndrome de bajo gasto cardíaco.
Aunque el trasporte con el sistema SherpaPak™ se basa, al igual que el trasporte tradicional, en la preservación hipotérmica estática, un mayor control de la temperatura con un enfriamiento más homogéneo y paulatino podría mejorar la preservación del órgano, especialmente en pacientes complejos de alto riesgo con tiempos de isquemia prolongados. Aunque son necesarios más estudios que validen esta experiencia a más largo plazo, tanto nuestros resultados como la limitada evidencia publicada hasta el momento parecen corroborar la seguridad de la utilización de este sistema con tiempos de isquemia más allá de las cinco horas a corto y medio plazo.
Organ Care System (OCS™)La escasez de órganos también ha estimulado el desarrollo de sistemas de perfusión de órganos ex vivo que pueden ayudar a mejorar la calidad y disponibilidad del injerto cardíaco, especialmente en situaciones en las que los injertos pueden ser susceptibles a lesiones isquémicas. Esta tecnología ha hecho posible el trasplante de órganos con criterios ampliados, incluidos los donantes con muerte en asistolia controlada, donde es especialmente útil para el reacondicionamiento de dichos corazones. Asimismo, también hace posible la obtención de órganos a grandes distancias, ya que permite un tiempo fuera del cuerpo de más de 12 h sin aumentar el tiempo de isquemia fría del corazón.
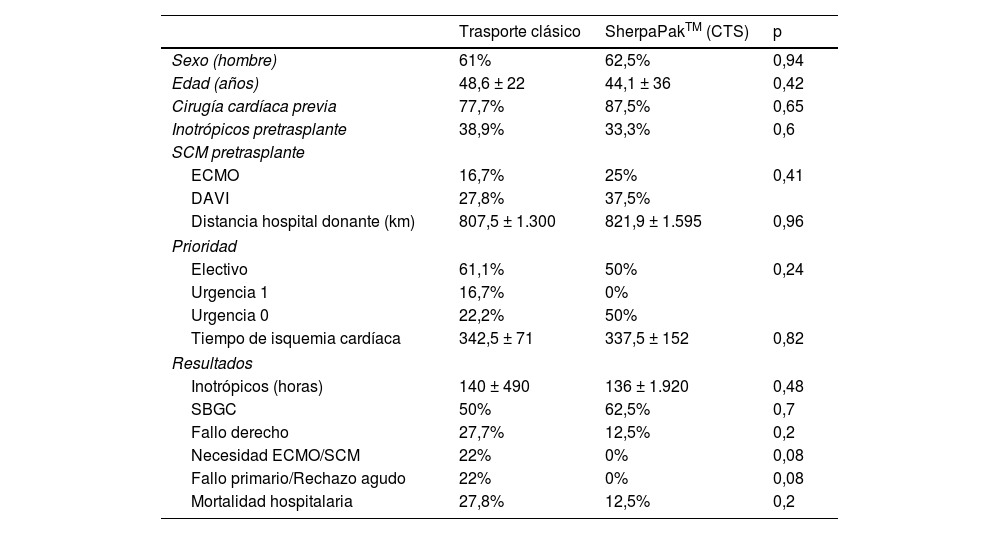
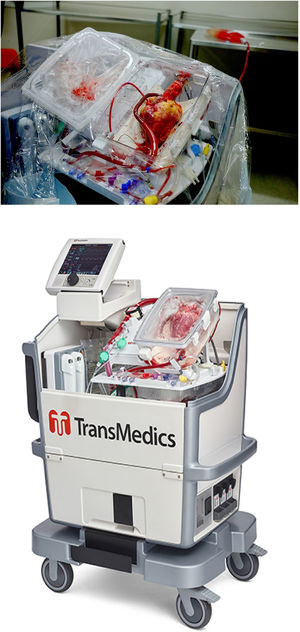
Tal y como muestra la figura 3, el OCS™ de TransMedics (Andover, MA, EE UU) es un dispositivo portátil con un monitor inalámbrico y un módulo de perfusión con una solución de mantenimiento. Para el purgado del sistema se extraen, previo al clampaje, entre 1.200-1.500 mL de sangre del propio donante, que pasa a través de un filtro de leucocitos y se añade al depósito de la bomba junto con 500 mL de una solución de cebado que contiene metabolitos y nutrientes. Tras la obtención del corazón, según la técnica estándar, se canula la aorta y la arteria pulmonar. El corazón se coloca dentro del sistema y se bombea a la aorta sangre tibia oxigenada complementada con infusión de epinefrina y la solución de mantenimiento patentada que contiene adenosina, glucosa y varios aminoácidos, lo que permite perfundir las arterias coronarias. Ambas venas cavas se cierran y el flujo del seno coronario que pasa a través de la válvula tricúspide es expulsado por el ventrículo derecho hacia la arteria pulmonar, que devuelve la sangre a un reservorio. Para evaluar la calidad del injerto, una vez el órgano se ha introducido en el sistema y se encuentra perfundido, se evalúan variables como frecuencia cardíaca, ritmo, presión aórtica, flujo coronario y lactato.
El OCS™ ha sido desarrollado para la perfusión normotérmica del injerto, siendo actualmente el único sistema disponible que permite preservar el corazón del donante latiendo (descargado) y perfundido en normotermia hasta su implantación en el receptor. Debido a este mantenimiento normotérmico, el tiempo de isquemia fría se acorta, se logra obtener órganos a distancias mayores e incluso mejorar órganos subóptimos para su utilización18,19.
Ardehali et al.20 en el estudio aleatorizado de no inferioridad PROCEED II compararon 130 pacientes con trasplante cardíaco con técnica de conservación clásica vs. el uso de OCS™. Al analizar la supervivencia y funcionalidad del injerto a 30 d, no se observaron diferencias entre ambos grupos, pero sí se redujo el tiempo de isquemia fría con un aumento del tiempo total de conservación. Aunque los investigadores concluyen que los resultados en el grupo OCS™ no eran inferiores, cinco corazones de este grupo se consideraron inadecuados para el trasplante después de su preservación con el OCS™, de modo que este sistema pudo identificar corazones patológicos subóptimos que se hubieran trasplantado en el caso de la conservación clásica en frío. Cabe destacar que la reducción del tiempo de isquemia fría no se asoció con ningún beneficio clínico. Este hallazgo sugiere que en el donante óptimo, la preservación del corazón puede ser más complicada que la simple reducción de la isquemia fría, pudiendo haber un componente inflamatorio que aumente el edema miocárdico durante la perfusión ex vivo.
En las series publicadas con este sistema de preservación frente al almacenamiento convencional en frío en donantes convencionales, la supervivencia del injerto a corto plazo, así como la incidencia de vasculopatía del injerto, presenta buenos resultados. Sin embargo, probablemente la mayor utilidad de este sistema se encuentra en la recuperación de órganos subóptimos, bien por tiempos de isquemia prohibitivos o por mala calidad del injerto, pudiendo así expandir el pool de donantes. La utilización de esta tecnología ha permitido el trasplante exitoso a corto plazo de corazones con hipertrofia ventricular izquierda significativa, fracción de eyección ventricular izquierda reducida, enfermedad coronaria palpable o tiempos de isquemia fría prolongados previstos después de la evaluación ex vivo21.
El OCS™ tiene el potencial de aumentar el número de trasplantes de corazón mediante la mejora de la preservación de los donantes con criterios ampliados (incluidos aquellos que se encuentran a grandes distancias y conllevarían tiempos de isquemia prohibitivos) y de los donantes en asistolia, en los que este tipo de preservación para el traslado del corazón entre centros presenta resultados equiparables a aquellos realizados con donantes en muerte encefálica, como demuestran múltiples estudios. Messer et al.22 analizaron una serie de casi 30 pacientes que comparaba donantes en asistolia controlada (14 de ellos con utilización de OCS™) y en muerte encefálica, no objetivando diferencias significativas en mortalidad a 90 días (92 vs. 96%, p = 1, respectivamente). Chew et al.23, en su serie de trasplantes de donantes en asistolia utilizando el OCS™ obtuvieron muy buenos resultados del trasplante a pesar de un mayor requerimiento de soporte circulatorio mecánico postransplante, principalmente en receptores con dispositivos de asistencia ventricular, pero con una supervivencia general y rechazo comparables a los resultados de los donantes contemporáneos con muerte cerebral en el seguimiento a cuatro años.
Las principales limitaciones al uso del OCS™ de TransMedics han sido la complejidad del manejo del dispositivo con la necesidad de formación técnica para ello, el requisito de más de 1.000 mL de sangre del donante para preparar el circuito ex vivo, la logística adicional del trasporte del dispositivo hacia y desde el hospital donante y su elevado coste. Sin embargo, si el uso de la perfusión normotérmica logra una disminución de fallo primario del injerto (por la mejora de la calidad del órgano donante) y aumenta la disponibilidad de injertos para trasplante, este dispositivo podría resultar costo-efectivo.
Futuros sistemas de preservación cardíacaAsporto Heart Preservation DeviceAsporto (Hibernicor LLC, Delaware, EE UU) es un dispositivo médico electrónico de trasporte en el que el corazón se encuentra almacenado en frío, pero con la administración continua de un líquido a base de solución salina de preservación a través de la raíz aórtica. Este dispositivo permite controlar:
- •
Temperatura: Mantiene los corazones en un estado hipotérmico entre 5 y 8°C, disminuyendo la velocidad de degradación de los tejidos al reducir la demanda de energía celular y la actividad enzimática.
- •
Perfusión: la cardioplegia (solución salina) se bombea a la aorta y a las arterias coronarias disminuyendo los metabolitos dañinos (como el ácido láctico) fuera del corazón.
El dispositivo presenta una interfaz de pantalla táctil que permite realizar el cebado para preparar el almacenamiento y controlar la cantidad de líquido que circula en el corazón mediante un programa predeterminado. Con el dispositivo actual Asporto se permitiría prolongar la conservación del corazón del donante hasta 6 h24. Aunque la U.S.Food and Drug Administration (FDA) y la Conformité Européenne (CE) aún no lo han aprobado para uso humano, se están iniciando estudios preclínicos.
LifeCradle™ Cardiac Preservation Transport System (Bridge to Life Ltd. Northbrook, IL, EE UU).El sistema de trasporte de preservación cardíaca LifeCradle™ permite la conservación, el almacenamiento, la monitorización y el trasporte de corazones de donantes mediante una perfusión enriquecida, hipotérmica y oxigenada desde el momento de la obtención del órgano hasta el trasplante en el receptor. Se trata de un dispositivo pequeño, ligero y portátil que permite una visualización y registro continuo de las condiciones de conservación, completamente autónomo. Este dispositivo actualmente se encuentra en desarrollo, pendiente de evaluación clínica y la autorización reglamentaria por la FDA y la CE.
HeartPort© SystemEl sistema HeartPort© (Organ Recovery Systems, Itasca, Il, EE UU) es una versión modificada del sistema LifePort© diseñado para la perfusión y preservación de injertos renales. El corazón se encuentra suspendido dentro de un recipiente estéril y se le administra una perfusión retrógrada continua con solución de preservación mezclada con sangre a 4°C y oxigenada. El sistema incluye una unidad que permite registrar continuamente la temperatura, la presión de perfusión y el flujo.
Este dispositivo se ha testado con éxito en corazones de donaciones en asistolia en modelos animales, que tras reperfundirse con este sistema mostraron recuperación de la función después de tiempos de isquemia caliente de hasta 44 min25.
Ex Vivo Non-Ischemic Heart PreservationLos estudios preclínicos de trasplante cardíaco han demostrado que la preservación del corazón no isquémica ex vivo (NIHP) se puede utilizar de forma segura durante 24 h. Aunque estos sistemas aún no se encuentran aprobados ni comercializados para su uso en trasplante cardíaco, un estudio de fase II no aleatorizado que compara el NIHP con la preservación clásica con isquemia fría ha mostrado resultados prometedores con ausencia de mortalidad, fallo primario del injerto, necesidad de ECMO o rechazo celular agudo ≥ 2 R a los tres meses del trasplante a diferencia de la preservación clásica donde estos eventos ocurrieron en el 18% de los pacientes26.
DiscusiónAunque los criterios de aceptación para los corazones donantes continúan ampliándose, los predictores tradicionales de fallo primario del injerto permanecen constantes. Según los registros internacionales, la mortalidad a los 30 días después del trasplante cardíaco es del 8%, siendo la principal causa de muerte el fallo primario del injerto. La fisiopatología y los factores de riesgo de este fallo han sido ampliamente estudiados, encontrando como principales factores de riesgo la edad del donante y del receptor, la necesidad de soporte inotrópico del donante, la situación hemodinámica del receptor, la desproporción donante-receptor (mismatch) y el tiempo de isquemia.
La protección del corazón del donante sigue dependiendo de la parada cardiopléjica seguida de la conservación hipotérmica con un período obligatorio de isquemia fría. En condiciones de hipotermia profunda, los requisitos metabólicos del corazón siguen siendo muy bajos. Es ampliamente reconocido que el tiempo total de isquemia es un factor de riesgo para el fallo primario del injerto y la consecuente mortalidad tras el trasplante cardíaco, de modo que un aumento de este tiempo de 3 a 6 h se asocia con el doble de riesgo de fallo primario del injerto y muerte después del trasplante cardíaco.
Dadas estas características cambiantes del donante y el receptor y las limitaciones reconocidas del almacenamiento estático en frío para la preservación del corazón del donante, se ha renovado el interés en el uso de nuevos sistemas de trasporte, protección y preservación de órganos. Aunque no encontraremos un sistema de conservación tan sencillo y económico como la técnica tradicional de almacenamiento en frío con hielo, este limita el número de injertos disponibles para trasplante. Por ello, si se pretende una expansión de los criterios para aceptación de donantes, el obtener órganos a mayor distancia y con isquemias más prolongadas precisa de la utilización nuevos dispositivos.
A pesar de su efecto protector, la hipotermia también puede ser perjudicial para los órganos conservados a través de inflamación celular, edema extracelular, acidosis celular, lesión por reperfusión, sobrecarga de calcio y lesión endotelial. Las temperaturas entre 4 y 8°C han sido ampliamente estudiadas como el mejor rango para una conservación óptima, un bajo riesgo de lesiones por frío y una buena función postrasplante27. El sistema de trasporte SherpaPakTM de Paragonix podría ser una alternativa para mejorar la preservación, ya que proporciona una temperatura de almacenamiento clínicamente apropiada y fiable, incluso con tiempos de isquemia prolongados. Este hecho podría ayudar a aumentar el pool de donantes, pudiendo ser especialmente útil para el trasporte de larga distancia o para receptores complejos con tiempos de cirugía prolongados. Según muestran nuestros resultados es seguro realizar trasplantes con tiempos de isquemia superiores a 5 h con un bajo riesgo de fallo primario del injerto y con una buena funcionalidad del injerto a medio plazo. Además, a diferencia de otros sistemas más complejos, se trata de un sistema fácil de usar, reproducible y que no requiere para su utilización de un mayor número de personas que el trasporte clásico. Aunque se requieren más estudios y mayor tiempo de seguimiento y son muchos los factores determinantes del éxito del trasplante, parece que mejorar el control de la temperatura durante la preservación del miocardio podría disminuir el daño cardíaco y el fallo del injerto.
Existen múltiples beneficios potenciales de la máquina de perfusión ex vivo del corazón donante durante el intervalo entre la obtención y la implantación con el sistema OCSTM de TransMedics. Estos incluyen el aporte de oxígeno y nutrientes, la disminución del daño isquémico al corazón, la eliminación de productos de metabolismo y otros subproductos potencialmente tóxicos, la capacidad de administrar agentes citoprotectores e inmunomoduladores y la capacidad de evaluación de la viabilidad funcional del corazón del donante para confirmar la idoneidad para el trasplante. Además, el aumento del tiempo «fuera del cuerpo» permite una mayor flexibilidad logística en la organización de los tiempos para el trasplante, hecho especialmente útil en pacientes con cirugías previas o dispositivos de asistencia ventricular, donde puede resultar especialmente complejo extraer el corazón nativo. Sin embargo, la mayor utilidad de este dispositivo para aumentar el pool de donantes probablemente se centre en la recuperación de órganos marginales y donantes en asistolia, donde la perfusión cardíaca normotérmica ex vivo con el sistema OCSTM de TransMedics presenta superioridad en comparación con el almacenamiento isquémico frío. No obstante, hoy en día las dificultades logísticas asociadas, los mayores requerimientos en cuanto a número y formación de personal y sus altos costos, hacen que este dispositivo todavía tenga un uso limitado.
Nuestra propuesta, tal y como muestra la tabla 2, basándonos en nuestra experiencia y con la evidencia publicada hasta el momento, es que cada técnica de trasporte y preservación del órgano donante estaría indicada en un caso determinado. De este modo, en receptores y donantes no complejos, con tiempos de isquemia menores a 3 h, el trasporte tradicional ha demostrado su utilidad y seguridad. En aquellos casos en los que encontremos receptores complejos (cirugías previas, cardiopatías congénitas del adulto, asistencias ventriculares, etc.) o la distancia al centro donante sea mayor, con tiempos esperables de isquemia entre 3 y 6 h, la utilización del dispositivo SherpaPakTM parece ser una buena opción, pues aunque su coste es más elevado que el trasporte clásico, la experiencia muestra buenos resultados a corto y medio plazo. Finalmente en aquellos casos en los que encontremos donantes subóptimos o marginales en los que se quiera evaluar la funcionalidad del injerto, en donaciones en asistolia y cuando encontremos distancias interhospitalarias que hagan esperar un tiempo de isquemia mayor de 6 h, el sistema de perfusión ex vivo del corazón OCSTM de TransMedics parece el más indicado a pesar de su elevado coste.
Ventajas e inconvenientes de los principales métodos de trasporte
| Ventajas | Inconvenientes | Situación ideal | |
|---|---|---|---|
| Trasporte tradicional | Fácil de enseñar/aprenderBaratoTradición/resistencia al cambio | Riesgo de congelación con variabilidad en la temperaturaNo viable en largas distancias | Receptores y donantes no complejosTiempos de isquemia < 3 h |
| SherpaPakTM CTS(Paragonix) | Técnica simpleInmersión total en solución de preservación con temperatura controladaAcceso y recopilación de datos en tiempo real | Mayor coste que el trasporte convencional | Receptores complejos (cirugías previas, asistencias ventriculares, etc.)Grandes distancias interhospitalariasTiempos de isquemia entre 3 y 6 h |
| Organ Care System ([OCSTM] TransMedics) | Expansión de los criterios de aceptación de órganosPerfusión normotérmica ex vivo con disminución del tiempo de isquemia fría | Alto costeComplejidad técnica | Donantes subóptimos o marginalesDonación en asistoliaGrandes distancias interhospitalariasTiempo de isquemia > 6 h |
El trasplante cardíaco sigue siendo el tratamiento gold standard de la insuficiencia cardíaca en etapa terminal. Los donantes y receptores siguen cambiando en términos de edad y comorbilidades, con una disponibilidad y calidad de los corazones en disminución en todo el mundo.
Si bien la isquemia fría en contenedor con hielo es el método más utilizado para la conservación del corazón, este método de trasporte clásico y eficaz no permite homogeneizar ni controlar la temperatura de trasporte, limitando el tiempo de isquemia ideal a menos de 4 h.
El sistema de trasporte cardíaco SherpaPakTM de Paragonix es una alternativa innovadora para mejorar la preservación de los órganos que podría aumentar el pool de donantes permitiendo mayores tiempos de isquemia cardíaca y disminuir a su vez la tasa de fallo primario del injerto.
El dispositivo OCSTM de TransMedics permite recuperar órganos subóptimos y permite tiempos prolongados desde el explante al implante del órgano (> 12 h), disminuyendo el tiempo de isquemia fría del órgano.
En definitiva, todas estas estrategias novedosas permiten, en general, optimizar la preservación del injerto y, potencialmente, aumentar el número de donantes útiles.
Consideraciones éticasSe garantiza por parte de los autores la obtención, tratamiento, conservación, comunicación y cesión de los datos se ha realizado conforme a lo dispuesto en la normativa española sobre protección de datos de carácter personal vigente (Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.