La extracción de dispositivos de estimulación cardiaca es una técnica segura en manos expertas, con una tasa de complicaciones entre el 0,5-15%. Estas complicaciones deben ser conocidas y siempre tenidas en cuenta por el operador, por lo que es siempre útil poder prevenirlas o al menos minimizar sus consecuencias.
El objetivo de este trabajo es poner en valor la utilidad de las técnicas de imagen como herramientas diagnósticas que nos permiten realizar un abordaje seguro en la extracción de dispositivos, analizando sus características esenciales.
La radiografía de tórax convencional aporta información del estado del generador y los electrodos (número, tipo, fijación, estado y recorrido). La tomografía axial computarizada (TAC) nos revela el recorrido intravascular de los electrodos, las eventuales perforaciones en las cámaras cardiacas, una obstrucción en la vena cava superior y, también, la enfermedad asociada. La tomografía por emisión de positrones/TAC (PET/TAC) nos ayuda a diagnosticar en algunos casos una infección incierta. La ecocardiografía intraoperatoria permite un registro dinámico de las cavidades cardiacas, detectando de forma precoz las eversiones bajo tracción del ventrículo derecho y las roturas valvulares o cardiacas que pueden ocurrir durante el procedimiento. La toracoscopia permite además, bajo visión directa el diagnóstico precoz de complicaciones vasculares (subclavias, tronco innominado y cava superior) o cardiacas. Finalmente, con la realidad aumentada obtenemos imágenes en 3D que superponemos con las obtenidas por radioscopia, identificando bucles y adherencias con mucha facilidad.
En conclusión, las técnicas de imagen son una ayuda esencial para la prevención de complicaciones durante la extracción percutánea y, en caso de producirse, actuar rápidamente en consecuencia.
The removal of cardiac pacing devices is a safe technique in experienced hands, with a complication rate between 0.5-15%. These complications should be known and always taken into account by the operator, so it is always useful to prevent them or, at least, minimize their consequences.
The aim of this work is to highlight the usefulness of imaging techniques as diagnostic Con tecnología de Editorial Manager® y ProduXion Manager® de Aries Systems Corporation tools that allow us to perform a safe approach in the extraction of devices, analyzing their essential characteristics.
Conventional chest X-ray provides information on the state of the generator and electrodes (number, type of electrode, fixation, state and route). Axial computed tomography reveals the intravascular path of the electrodes, possible perforations in cardiac chambers, obstruction in the superior vena cava and associated pathology.
Positron emission tomography (PET-CT) helps us to diagnose in some cases an uncertain infection. Intraoperative echocardiography allows a dynamic recording of the cardiac cavities, detecting early eversions under traction of the RV and valvular or cardiac ruptures that may occur during the procedure. Thoracoscopy also allows early diagnosis of vascular (subclavian, innominate trunk and superior cava) or cardiac complications under direct vision. Finally, with Augmented Reality we obtain 3D images that we superimpose with those obtained by fluoroscopy, identifying loops and adhesions very easily.
In conclusion, imaging techniques are an essential aid in preventing complications during percutaneous extraction and, should they occur, to act quickly accordingly.
La extracción de dispositivos de estimulación cardiaca (DEC), ya sean marcapasos (MP) o desfibriladores automáticos implantables (DAI) mediante la técnica de tracción percutánea endovascular (TPE) es una técnica segura en manos expertas1.
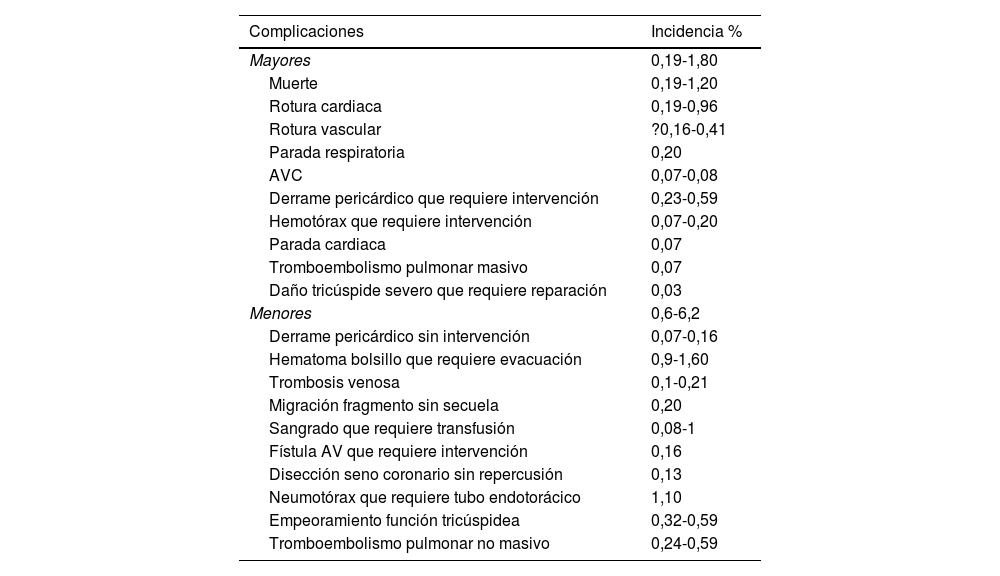
El porcentaje de complicaciones varía según series americanas y europeas, y oscila entre el 0,5-15%, estando las complicaciones mayores entre un 0,5 y el 4,8% con una media del 2,9%, y las menores entre un 3 y un 14,7%, y una media del 8,4%2.
En un estudio de Nationwide Inpatient Sample que incluye 91.890 pacientes con infección de DEC sometidos a extracción, las principales complicaciones encontradas fueron: el sangrado que requiere transfusión (2,6%), el compromiso respiratorio que requiere ventilación mecánica (2,3%), el daño vascular (2%), el neumotórax o hemotórax (1,5%) y el derrame pericárdico (1,4%), con necesidad de cirugía cardiaca en el 0,2%3. Un detalle de las complicaciones se recogen en la tabla 11,4.
Complicaciones de las extracciones de electrodos con tracción percutánea endovascular
| Complicaciones | Incidencia % |
|---|---|
| Mayores | 0,19-1,80 |
| Muerte | 0,19-1,20 |
| Rotura cardiaca | 0,19-0,96 |
| Rotura vascular | ?0,16-0,41 |
| Parada respiratoria | 0,20 |
| AVC | 0,07-0,08 |
| Derrame pericárdico que requiere intervención | 0,23-0,59 |
| Hemotórax que requiere intervención | 0,07-0,20 |
| Parada cardiaca | 0,07 |
| Tromboembolismo pulmonar masivo | 0,07 |
| Daño tricúspide severo que requiere reparación | 0,03 |
| Menores | 0,6-6,2 |
| Derrame pericárdico sin intervención | 0,07-0,16 |
| Hematoma bolsillo que requiere evacuación | 0,9-1,60 |
| Trombosis venosa | 0,1-0,21 |
| Migración fragmento sin secuela | 0,20 |
| Sangrado que requiere transfusión | 0,08-1 |
| Fístula AV que requiere intervención | 0,16 |
| Disección seno coronario sin repercusión | 0,13 |
| Neumotórax que requiere tubo endotorácico | 1,10 |
| Empeoramiento función tricúspidea | 0,32-0,59 |
| Tromboembolismo pulmonar no masivo | 0,24-0,59 |
AV: arteriovenosa; AVC: accidente vascular cerebral.
En la aparición de complicaciones durante el procedimiento de tracción percutánea endovascular intervienen 4 factores:
- 1.
Factores dependientes del DEC:
- -
Electrodos implantados de >10 años
- -
Implante por vena subclavia derecha>que por subclavia izquierda, cefálica o femoral
- -
Fijación pasiva>activa
- -
Número de electrodos insertados >3
- -
Tipo de electrodos: DAI>marcapasos>resincronización
- 2.
Factores dependientes de las herramientas usadas en la extracción:
- -
Vainas láser>vainas mecánicas
- -
Lazo femoral>vainas
- 3.
Factores dependientes del operador:
- -
Experiencia en el procedimiento con una curva de aprendizaje inadecuada (<40 casos)
- -
Número de extracciones anuales <40
- 4.
Factores dependientes del paciente:
- -
Edad >68 años y sexo femenino
- -
Comorbilidad asociada: diabetes mellitus e insuficiencia renal crónica
Pensamos que las extracciones deben llevarse a cabo en el quirófano con monitorización adecuada del paciente y la posibilidad de utilizar circulación extracorpórea (CEC) para solucionar de manera inmediata cualquier posible complicación. Cuando estas aparecen, afortunadamente no todas son de igual gravedad. Así, podemos tener complicaciones menores entre las que destacan la infección del bolsillo del implante contralateral o la trombosis venosa de subclavia, que suelen resolverse con tratamiento médico sin dejar secuelas para el paciente, o bien complicaciones mayores que pueden comprometer la vida del paciente e incluso provocarle la muerte como consecuencia de roturas vasculares o cardiacas1,5.
El uso adecuado de las técnicas de imagen, puede ayudar a minimizar estas complicaciones o a realizar un diagnóstico precoz de las mismas.
El objetivo del trabajo es poner en valor la utilidad de las técnicas de imagen como herramientas diagnóstica que nos permiten realizar un abordaje seguro en la TPE.
Herramientas diagnósticasRadiografía de tóraxUna radiografía de tórax tanto en proyección antero-posterior (AP) como lateral es crucial para obtener información acerca del generador y los electrodos implantados. Así podemos observar:
- -
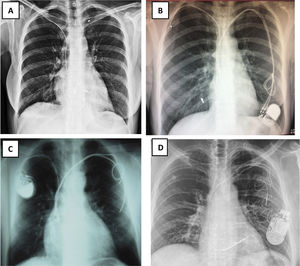
Número de electrodos existentes (figs. 1 y 3)
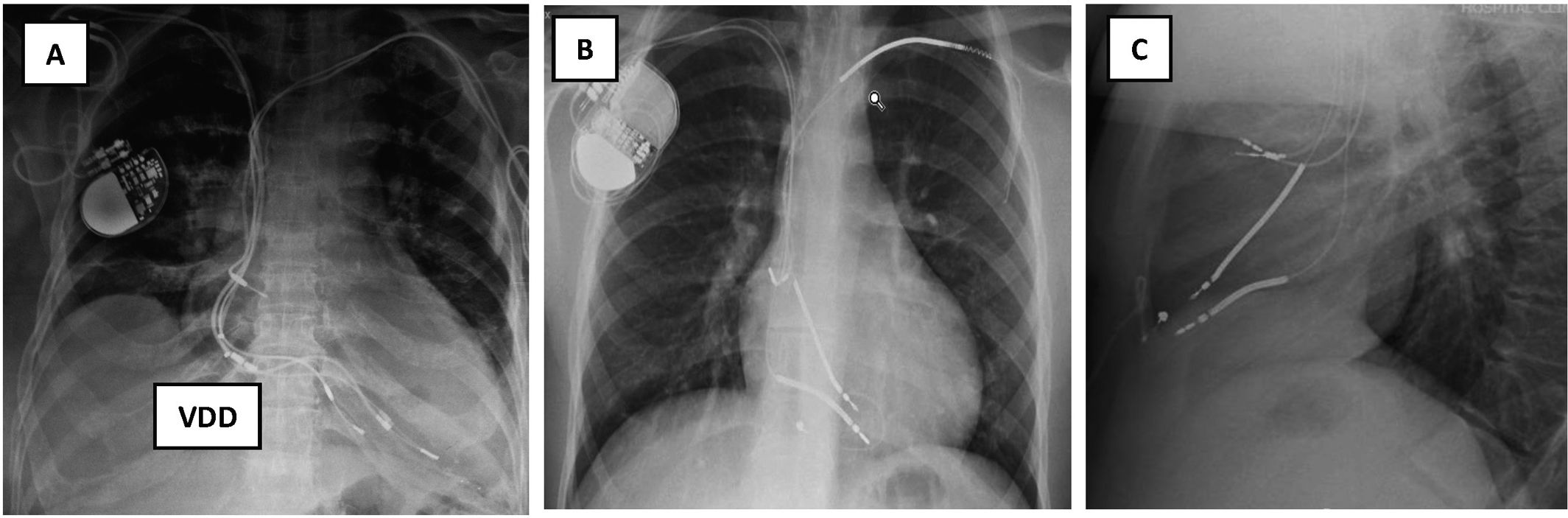
Figura 1.Radiografía de tórax: A) Rx AP: Implante de electrodos de marcapasos de fijación pasiva: 4 electrodos implantados, 2 por subclavia izquierda abandonados y 2 VDD por subclavia derecha, uno abandonado y otro conectado al generador, que está desplazado hacia abajo. VDD: sensores en AD. B y C) Electrodos de DAI implantados por ambas subclavias. B) Rx de tórax AP: Subclavia derecha: 2 electrodos de fijación activa con una angulación de entrada en VCS mucho más aguda que por el lado izquierdo. Por ella entra un electrodo de MP insertado en AD y otro de DAI monobobina en VD. Subclavia izquierda: 2 electrodos de fijación activa cortados y traccionados: el de MP de AD presenta el conductor deshilachado y el de DAI de VD tiene rectificado su trayecto en VD fruto de la tracción sufrida y el estilete de contratracción cortado antes de entrar en subclavia izquierda. C) Rx de tórax lateral: 2 electrodos en AD y 2 electrodos de VD, uno de ellos elongado.
AD: aurícula derecha; AP: antero-posterior; DAI: desfibrilador automático implantable; MP: marcapasos; Rx: radiografía; VCS: vena cava superior; VD: ventrículo derecho; VDD: marcapasos VDD.
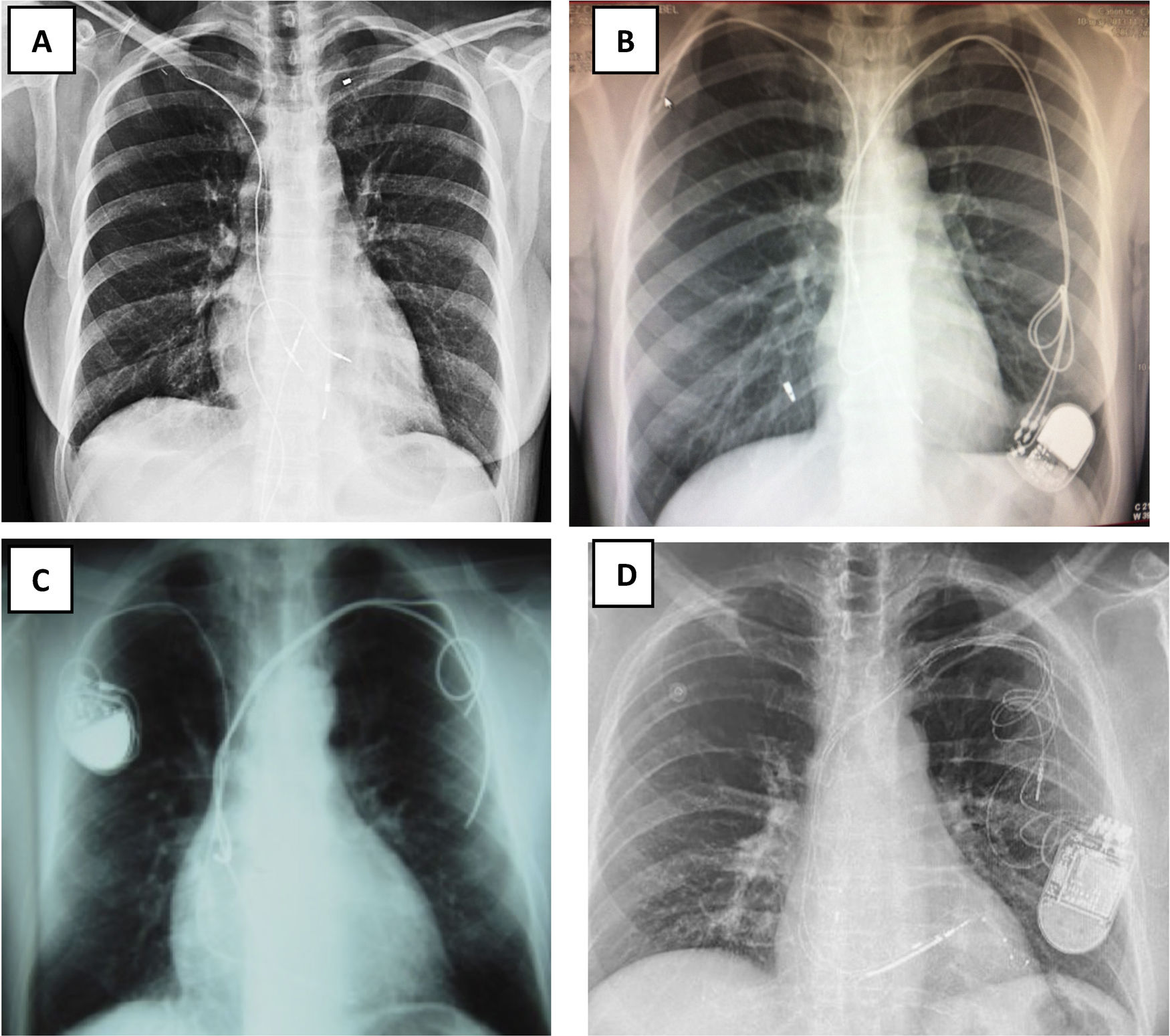
(0.13MB).Figura 3.Electrodos abandonados. A) Fragmento intravascular desde la vena subclavia derecha B) Electrodo traccionado, cortado y abandonado en territorio-subclavio derecho, y 2 electrodos por vena subclavia izquierda conectados a un generador desplazado. C) Dos eectrodos de MP cortados y abandonados por vena subclavia izquierda, con otro por vena subclavia derecha conectado a su generador. D) Cuatro electrodos por vena subclavia izquierda, 3 de ellos conectados a un generador DAI-TRC desplazado: un electrodo de DAI monobobina de fijación activa en VD, un electrodo de MP en AD de fijación pasiva y otro de VI a través de seno coronario de fijación pasiva. El otro es un electrodo de MP de fijación pasiva en VD y abandonado en región infraclavicular izquierda, con bucles.
AD: aurícula derecha; DAI: Desfibrilador automático implantable; MP: marcapasos; VCS: vena cava superior; VD: ventrículo derecho; VI: ventrículo izquierdo.
(0.27MB). - -
Lugar de inserción de los electrodos (figs. 1 y 3)
- -
Habitualmente son implantados mediante la canalización de la vena subclavia izquierda, aunque también puede usarse la subclavia derecha, la vena cefálica o la vena femoral, derecha o izquierda. Es importante identificar una inserción por la vena cava izquierda, que drena en la aurícula derecha (AD) a través del seno coronario, o un implante previo de electrodos epicárdicos no retirados.
- -
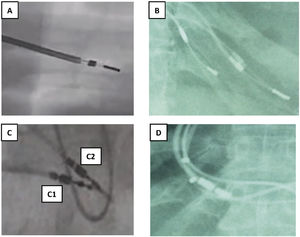
Tipo de fijación en endocardio (fig. 2)
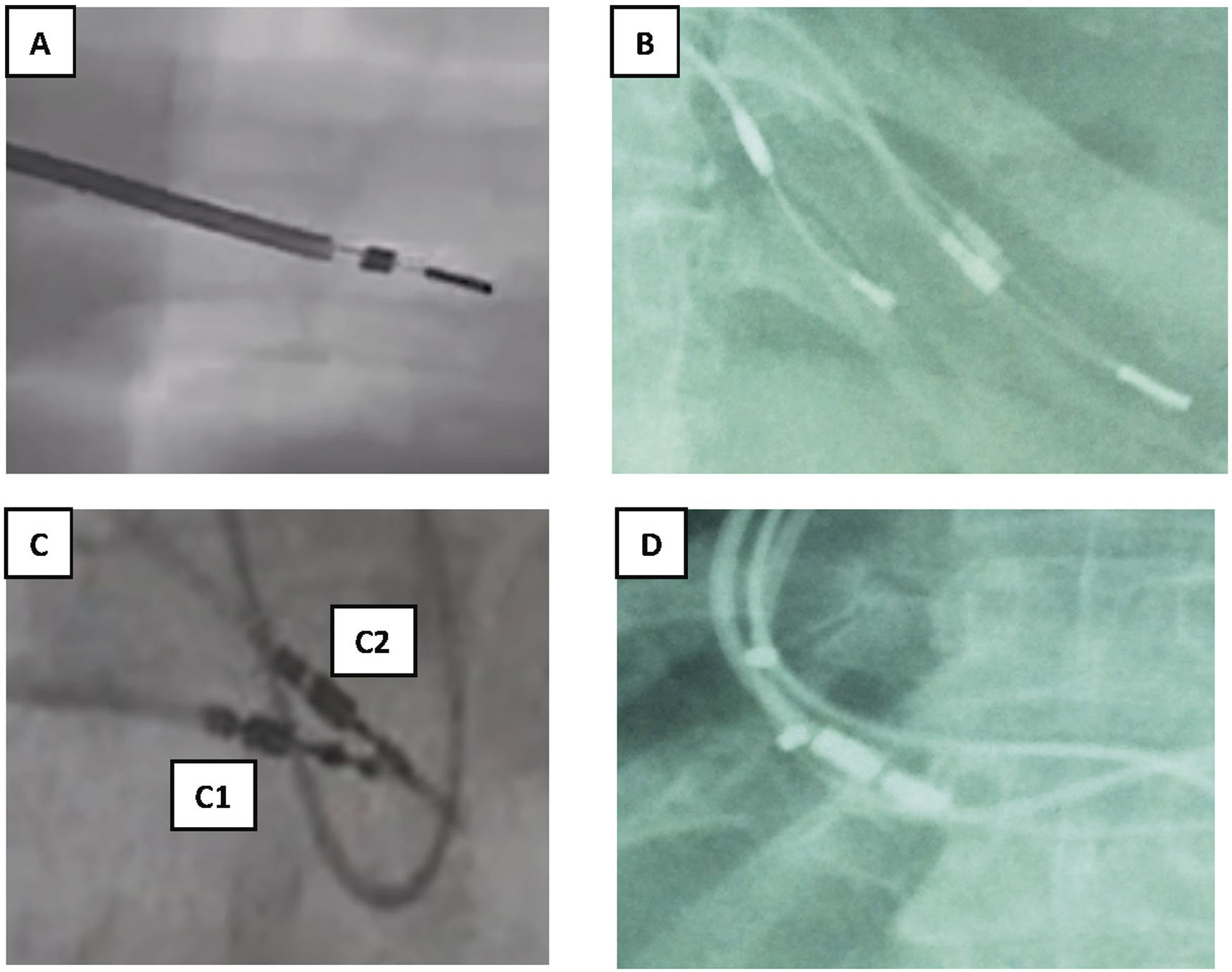
Figura 2.Tipos de fijación a endocardio y sensor de MP VDD. A y B) Electrodos de fijación pasiva con dos estructuras metálicas separadas entre sí 1-1,5cm y entre ellas un fino hilo metálico. C) Electrodos de fijación activa: C1: 2 puntos metálicos pequeños separados al desplegar la hélice de fijación. C2: un solo punto metálico mayor con la hélice plegada. D) Dos puntos metálicos en cada cable correspondiente a los sensores de AD en los MP VDD.
AD: aurícula derecha; MP: marcapasos; VDD: marcapasos VDD.
(0.14MB). - -
En los electrodos implantados mediante fijación pasiva, el extremo distal del electrodo es un arpón de silicona enclavado en endocardio, que se visualiza como 2 estructuras metálicas separadas 1-2cm, aproximadamente, mientras que en los implantes mediante fijación activa, se observa la hélice desplegada como 2 pequeños puntos metálicos separados 0,5cm, que se enclava en la zona de endocardio, ya sea aurícula o ventrículo derecho (VD), que habitualmente se aproximan cuando la hélice se recoge.
- -
Tipo de electrodo (figs. 1-3)
- •
Los electrodos de estimulación de ventrículo izquierdo (VI), que se colocan a través del seno coronario y progresan hasta las venas cardiales de la cara posterior, suelen ser más finos y generalmente, por suerte, de fijación pasiva, observándose como varios puntos metálicos pequeños en su anclaje y terminado en una oliva distal. Existen electrodos de fijación activa en seno coronario (p. ej., los Starfix®) que añaden un plus de dificultad para la extracción, ya que las paredes del seno coronario son muy finas y el riesgo de rotura muy alto.
- •
Los electrodos de DAI suelen ser de mayor diámetro y, además, este se incrementa en el lugar de las bobinas de desfibrilación, que pueden ser una (los monobobinas, en la zona de entrada del VD o 2 (los bibobinas, uno en la zona de vena cava superior (VCS) y otro en la entrada del VD, y generalmente implantándose en endocardio mediante fijación activa.
- •
Los electrodos de MP tienen un diámetro intermedio entre los 2 anteriores. Una peculiaridad para destacar son los electrodos de estimulación VDD, que poseen uno o 2 sensores metálicos a nivel auricular en los que también se incrementa su tamaño y constituyen un punto de debilidad a la hora de la extracción por la frecuente rotura a este nivel.
- -
Estado de los electrodos (figs. 1 y 3)
Los electrodos pueden tener un aspecto y morfología normal con conexión de los mismos a su generador, el cual puede conservar su posición inicial o estar desplazado. También podemos encontrarnos que estén abandonados sin conexión al generador, pero con aspecto normal, o por el contrario que estén traccionados, con rectificación de su trayecto intracardiaco, con el conductor elongado y la envoltura de silicona rota o bien una fractura completa de los mismos, quedando como fragmentos intravasculares. Afortunadamente, en casos excepcionales aparecen electrodos cortados y elongados con estiletes de contratracción en su interior sin desinserción de su punta y conductor deshilachado, lo cual complica enormemente la técnica de extracción percutánea.
- -
Recorrido intravascular de los electrodos (figs. 1 y 3)
- •
Los electrodos pueden tener el recorrido anatómicamente normal desde su entrada por el acceso vascular usado hasta el lugar de anclaje en el endocardio, pero también pueden tener anomalías que deben ser reconocidas antes de iniciar la extracción, como es el implante a través de una vena cava izquierda permeable, o existencia de bucles, rectificaciones, tracciones o angulaciones («kinking») de los mismos, como hemos descrito anteriormente.
- •
Especial importancia tienen los bucles que se originan al inicio de la VCS, o en la AD con progresión hacia la vena cava inferior (VCI) o aquellos que están muy acostados en su entrada a VD, que pueden generar adherencias difíciles de resolver. La rectificación de los mismos en la vena innominada, es también un signo indirecto de adherencias fibrosas importantes.
- •
Hay que vigilar y ser cauto en las extracciones con electrodos que forman un ángulo muy agudo en la incorporación a la VCS, que suele ser mucho más marcado en los que están insertados por el lado derecho, lo que va a dificultad la progresión con algunas vainas que tienen una flexibilidad limitada.
- -
Posición del generador (figs. 1 y 3)
- •
Pueden estar bien posicionados en región infraclavicular derecha o izquierda, o bien tener desplazamientos hacia la línea axilar anterior o media, o incluso hacia la región mamaria o diafragmática, lo cual en ausencia de traumatismo, puede estar relacionado con una infección crónica del bolsillo.
- •
En el denominado síndrome de Twiddler, se produce un enrollamiento de los electrodos en torno al generador por giros voluntarios del mismo por parte del paciente (habitualmente deficientes mentales o pacientes psiquiátricos), de manera que el/los electrodos están desinsertados del endocardio y dispuestos alrededor del generador.
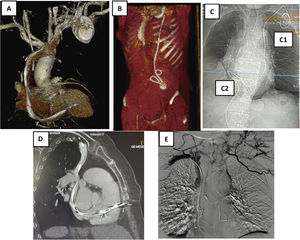
La realización de una tomografía axial computarizada (TAC) de tórax con contraste es fundamental para visualizar el territorio venoso por el que los electrodos acceden al corazón y su relación con el mismo. Hoy día ha desplazado a la flebografía por la gran información adicional que aporta. Con un buen estudio obtenemos información sobre (fig. 4)6–8:
- -
Recorrido intravascular de los electrodos
- -
Podemos visualizar si el trayecto es el anatómicamente correcto o si por el contrario acceden por una vena cava izquierda. También podemos sospechar la existencia de adherencias entre los cables y la pared, o entre los mismos cables, cuando hay más de uno o bien, los cruces o enrollamientos que se producen entre ellos. Igualmente, puede aportar información sobre el grado de endotelización, el grosor de la pared vascular y las angulaciones o «kinking» a lo largo de su recorrido. Todo ello fundamental de conocer para elaborar una estrategia adecuada de extracción.
- -
Perforación de la pared
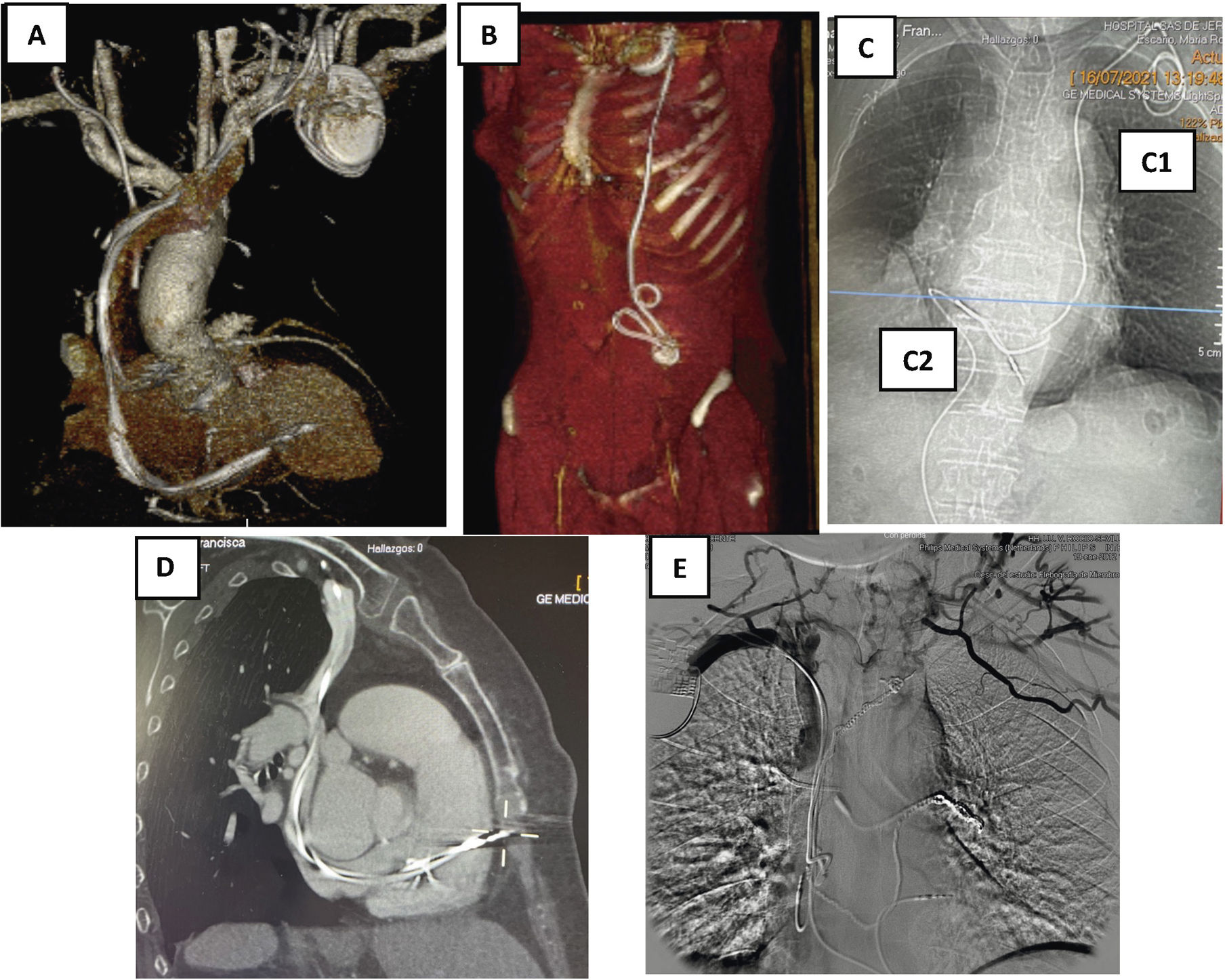
Angio-TAC de tórax. A) Recorrido de los electrodos con zonas de fibrosis en VCS y AD. B) Electrodos tunelizados hasta región periumbilical con bucles y fibrosis. C) Electrodo de MP de fijación pasiva que se implanta en VD. C1) a través de vena cava izquierda y C2) a través de vena femoral derecha. D) Perforación de electrodo de MP de fijación activa en el VD. E) Obstrucción de VCS y desarrollo de gran cantidad de circulación colateral en paciente con restos de múltiples electrodos traccionados y retenidos.
AD: aurícula derecha; MP: marcapasos; VCS: vena cava superior; VD: ventrículo derecho.
Habitualmente los electrodos quedan enclavados en el endocardio de AD o VD, o en el endotelio del seno coronario, sin perforar su pared. Sin embargo, en raras ocasiones (1-2%), durante su implante perforan la pared del vaso o del corazón, produciendo cuadros de derrames pericárdicos con/sin taponamiento cardiaco que pueden precisan tratamiento médico o quirúrgico. En situación aún más extraordinarias, los electrodos pueden producir mínimas perforaciones que pasan desapercibidas porque en el momento del implante quedan controladas por la formación de un pequeño trombo, asociado o no con un derrame pericárdico pequeño, que cursa sin repercusión clínica ni hemodinámica y no se diagnostica, por tanto, en ese momento. Sin embargo, estas situaciones de perforación evidentes o no, hay que conocerlas antes de iniciar una extracción para estar alerta sobre la aparición de posibles complicaciones durante el procedimiento, ya que al traccionar del cable puede producirse una rotura de pared. De hecho, en presencia de una perforación evidente es recomendable una cirugía combinada, realizando la tracción a la par que una esternotomía media, para resolver de manera inmediata la complicación.
- -
Obstrucción de la vena cava superior9
En pacientes con electrodos antiguos, cuando se ha realizado previamente una extracción dificultosa o incluso cuando hay implantado también algún catéter intravascular por otra patología o tratamiento (como puede ser un Port-a-Cath® para tratamiento quimioterápico o un Shaldon para hemodiálisis), es recomendable la realización de la TAC para identificar posibles obstrucciones de VCS o del eje subclavio innominado. La TAC no solo muestra la existencia de obstrucción, sino también el grado (total o parcial), el lugar exacto, el tamaño, la extensión y la existencia de circulación colateral, ya que con frecuencia existe una trombosis del territorio venoso afectado que va a dificultar la extracción.
- -
Enfermedad asociada
Las infecciones de los DEC se asocian con gran frecuencia con fenómenos inflamatorios, decúbitos o extrusiones del bolsillo, o bien con fiebre, hemocultivos positivos y vegetaciones, en cuyo caso el diagnóstico de sospecha y certeza es bastante fácil. Sin embargo, no en pocas ocasiones las infecciones sistémicas, comienzan con cuadros paucisintomáticos que pueden pasar desapercibidos y al realizar una TAC encontramos de forma casual, imágenes de infartos pulmonares sépticos o espondilodiscitis secundarias a la diseminación del proceso infecciosos.
Ecocardiografía transesofágicaLa ecocardiografía transesofágica (ETE) durante el proceso de extracción con técnicas percutáneas tiene un triple valor: en su fase preoperatoria, intraoperatoria y postoperatoria10–13:
- 1.
Durante el período preoperatorio, aporta información que permite la planificación de la cirugía. Así, valoramos:
- -
Cámaras cardiacas
- •
La morfología, el tamaño y la función de las cámaras derechas por estimación cualitativa
- •
La morfología de la válvula tricúspide, su relación con los electrodos y su grado de insuficiencia
- •
La función ventricular sistólica del VI por estimación de la fracción de eyección del ventrículo izquierdo (FEVI)
- •
La presencia de trombos intracavitarios o de vegetaciones valvulares
- -
Vena cava superior e inferior
- •
El grosor de su pared, así como su distancia con los electrodos y el movimiento de los mismos en su interior. En paredes finas con electrodos próximos y con escaso movimiento, debemos pensar en adherencias fuertes que pueden dificultad el procedimiento de extracción y estar muy alerta por posibles roturas en dicho nivel
- •
Adherencias con la pared o entre los cables
- •
Trombos con oclusión completa o parcial, así como la extensión y movilidad de los mismos
- •
Bucles intraluminares
- -
Pericardio: presencia o no de derrame pericárdico y su cuantificación exacta
- -
Los electrodos
- •
Recorrido y adherencias desde su entrada en VCS hasta su anclaje en cavidades derechas o seno coronario. La escasa movilidad de los mismos dentro del árbol vascular nos debe hacer sospechar un grado importante de endotelización o adherencias
- •
Su grado de adherencias y presencia de vegetaciones
- -
Masas intracardiacas: vegetaciones o trombos con su lugar y tamaño. Hay que tener en cuenta que vegetaciones de gran tamaño (>2cm) pueden desprenderse del cable durante la tracción y producir una embolia pulmonar con repercusión clínica
- 2.
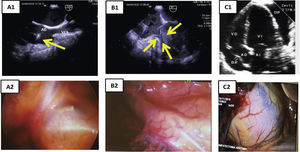
Durante el periodo intraoperatorio, aporta información para el control del procedimiento y diagnóstico precoz de las complicaciones, permitiendo (fig. 5):
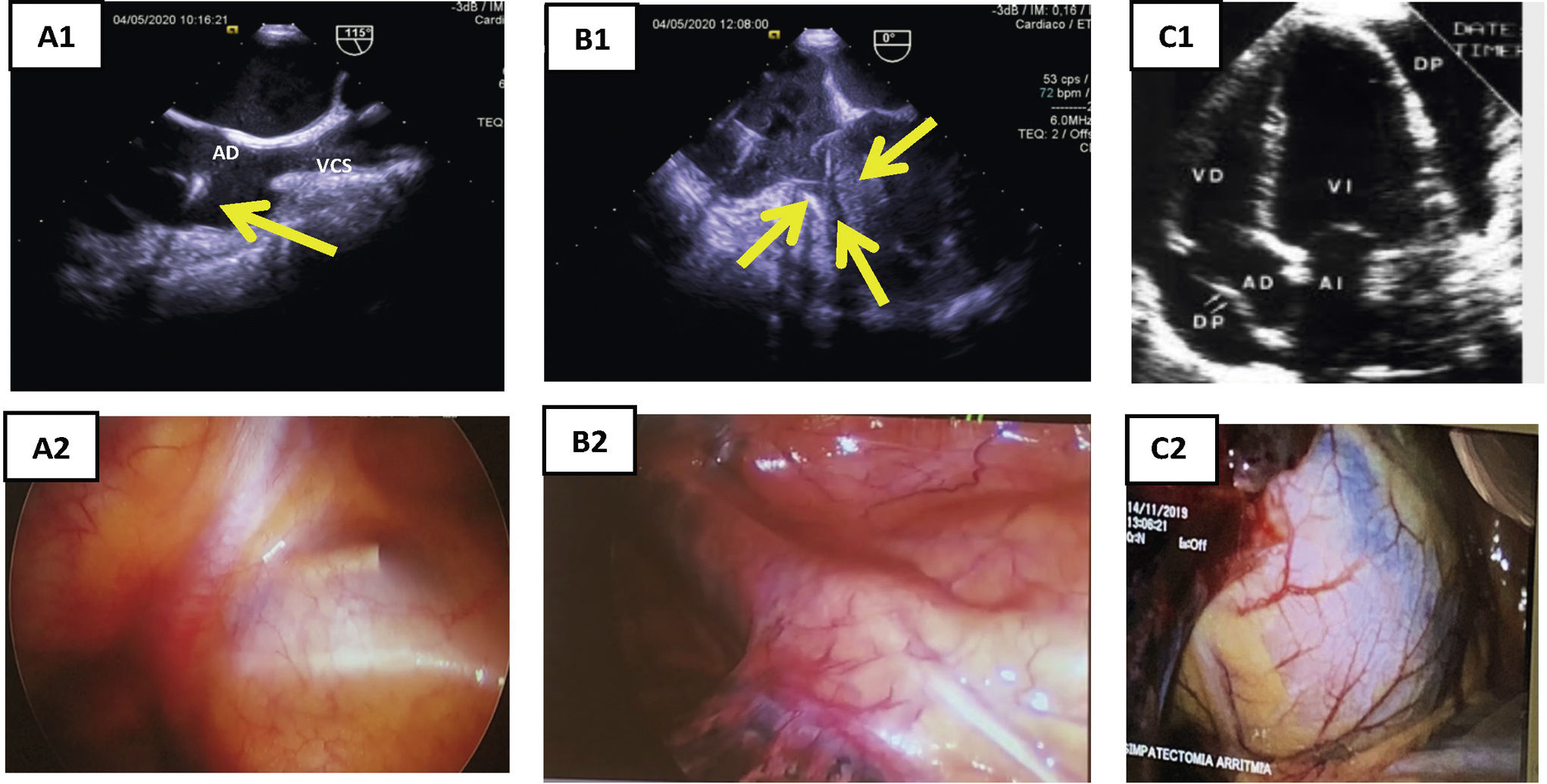
Figura 5.Concordancia ecocardiografía-toracoscopia. A1) ETE: plano BIcava. Paso de electrodo por VCS y presencia de verruga en electrodo auricular (flecha amarilla). A2) toracoscopia: visualización de extremo distal de vaina mecánica por transparencia de la pared de VCS. B1) ETE: tracción de electrodo de VD, con colapso en el ápex del VD (flechas). B2) toracoscopia: visualización de las vainas a través de la pared de VD. C1) ETE: derrame pericárdico. C2) toracoscopia: tinción hemática de pericardio por hemopericárdico.
AD: aurícula derecha; ETE: ecocardiografía transesofágica; VD: ventrículo derecho; VSC: vena cava superior.
(0.21MB). - -
La visualización del VD desde todos los planos, el grado de retracción y el colapso generado por los movimientos de tracción, así como su llenado y función contráctil
- -
La evaluación continua del espacio pericárdico desde múltiples planos y la detección precoz de derrame
- -
La visualización de vegetaciones/trombos sobre los electrodos y si se movilizan o se desplazan con la tracción de los mismos
- -
La rectificación, desplazamiento o suelta de los electrodos durante la tracción
- -
La anatomía de la válvula tricúspide durante los movimientos de tracción
- 3.
Y, finalmente, durante el postoperatorio proporciona datos sobre la evolución del paciente. Podemos comprobar:
- -
La ausencia de electrodos intracavitarios rotos y abandonados durante el procedimiento
- -
La normofunción de la válvula tricúspide
- -
La presencia o no de derrame pericárdico
- -
La existencia de «fantasmas» (ghosts) o restos de tejidos fibrosos tras la extracción de electrodos, que deben diferenciarse de los restos de cables retenidos. Algunos autores han sugerido la prolongación del tratamiento antimicrobiano en presencia de estos restos fibrosos
- -
La persistencia de verrugas en cavidades o sobre válvula tricúspide
El rendimiento de la ecocardiografía transtorácica (ETT) para el diagnóstico de infecciones sistémicas de los DEC es muy bajo (<30%) frente al 60-95% que proporciona la ETE. Aun así, es preciso aclarar aquí que la no visualización de vegetaciones sobre el cable o la válvula tricúspide no excluye el diagnóstico de infección en cuyo diagnóstico son indispensables los criterios clínicos y microbiológicos. Por otra parte, es preciso resaltar que hasta el 12% de los DEC no infectados pueden mostrar imágenes filiformes adheridas a los cables14–16.
Tomografía por emisión de positrones/tomografía axial computarizadaLa PET/TAC puede ayudar a diagnosticar una infección local con pocos signos clínicos aparentes por la captación del generador, o una infección sistémica por la captación de los cables, aunque en este caso el rendimiento es mucho más bajo17,18.
Hay que resaltar que esta prueba no sirve de mucho en DEC recién implantados, ya que hay captación entre 2 y 8 semanas y que, también, puede dar un falso negativo si el paciente recibe tratamiento antimicrobiano.
A pesar de sus limitaciones y, aunque se requiere más experiencia para definir bien su papel, es una técnica de imagen que puede ayudar al diagnóstico y precisar el tipo de infección en casos dudosos. Algunos ejemplos serían: 1) molestias persistentes en la zona del generador sin signos flogósicos, 2) hemocultivos negativos en presencia de clínica sistémica por toma previa de antimicrobianos o 3) detección de masas adheridas a cables sin contexto clínico de infección19,20.
ToracoscopiaLa cirugía torácica asistida con video mediante puertos de entrada en hemitórax derecho puede ser de gran utilidad para el diagnóstico precoz de complicaciones en pacientes de alto riesgo, al visualizar el contenido hemático en el saco pericárdico, incluso antes del deterioro hemodinámico y la detección de derrame pericárdico por ETE intraoperatoria.
A pesar de esta ventaja, la toracoscopia supone añadir agresividad al procedimiento, por lo que solo la consideramos indicada en pacientes de alto riesgo, como son los electrodos implantados por subclavia derecha en pacientes jóvenes, mujeres y en sistemas con tiempo de implante >10 años, especialmente si son DAI.
En estas situaciones antes mencionadas, la extracción suele ser tremendamente dificultosa y la toracoscopia es la única técnica de imagen que nos permite monitorizar la progresión de las vainas por la vena subclavia derecha en su porción próxima a la VCS, por lo que sería la única forma de establecer un diagnóstico precoz de rotura en esta zona, siendo también útil en la detección de complicaciones (roturas) en AD o VD (fig. 5)21,22.
Su uso nos ha permitido visualizar la progresión de las vainas a través de las delgadas paredes de la VCS y la formación de hematomas a su paso, sin que hayan tenido repercusión clínica ni hemodinámica. Igualmente se ha observado las tracciones en AD y VD.
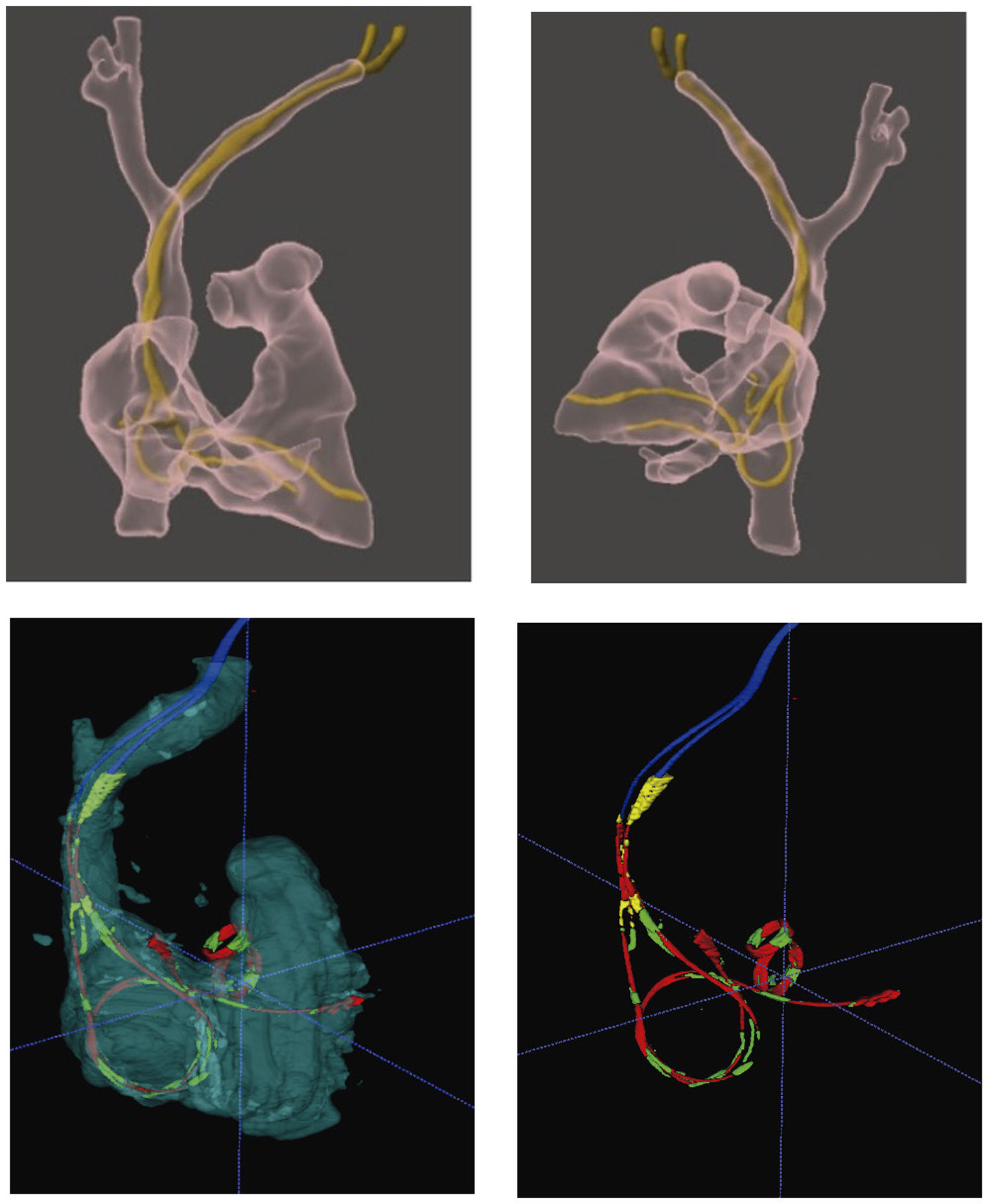
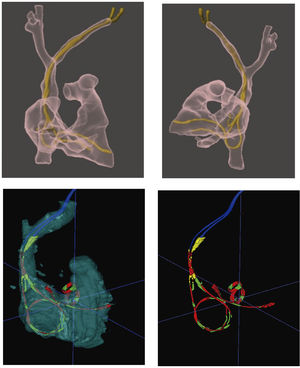
Realidad aumentada/mixtaLa realidad aumentada/mixta permite superponer un holograma virtual sobre el espacio real. Las imágenes 3D son obtenidas con anterioridad a partir de la TAC, dada su excelente resolución espacial para identificar el trayecto de los electrodos y su localización dentro de las estructuras cardiovasculares. Una vez obtenidas, mediante el uso de dispositivos específicos (gafas de realidad virtual), se proyecta el holograma de la anatomía cardiovascular y los DEC sobre el mundo real, bien sea sobre el paciente o bien sobre la imagen de escopia, que es la que utilizamos para guiarnos durante todo el proyecto de la extracción La utilización de esta tecnología sirve tanto para la planificación como para el guiado y asistencia durante el procedimiento. La visualización previa en 3D (realidad aumentada) de los electrodos y sus trayectos intravasculares permite identificar con gran precisión adherencias, bucles, torsiones o enrollamientos, anticipando así posibles complicaciones. Además, los hologramas 3D pueden proyectarse sobre las imágenes dinámicas de escopia, lo que permite un plus de información y seguridad para el paciente, a la hora de realizar la extracción con técnicas percutáneas (fig. 6)23–25.
ConclusiónLa extracción de los DEC por técnicas percutáneas es una técnica segura en manos expertas con una escaso número de complicaciones, pero algunas de ellas con alta tasa de mortalidad, como las roturas vasculares o cardiacas.
Para minimizar o prevenir su aparición es necesario elaborar una adecuada estrategia quirúrgica donde juegan un papel crucial las técnicas de imagen como herramientas diagnósticas. Entre ellas, cabe señalar la radiografía simple de tórax, el angio-TAC de tórax, la ETE, el PET/TAC, la toracoscopia y la realidad aumentada. Todas ellas aportan información muy valiosa sobre el recorrido y disposición de los electrodos, así como sobre su adhesión a las paredes venosas, paso por la válvula tricúspide e implantación en el endocardio de las cámaras cardiacas. Tener en cuenta estos elementos es fundamental para elaborar una estrategia de actuación que nos permita enfrentar casos complicados: vía de acceso (subclavia o femoral), tipo de herramienta de extracción a utilizar (estiletes de tracción, vainas de disección mecánicas ó laser, asa femoral) o incluso la necesidad de una cirugía abierta combinada.
Del mismo modo, la monitorización durante el acto operatorio (escopia/ETE/toracoscopia) nos va a permitir detectar de manera precoz las complicaciones derivadas de la extracción y actuar sobre ellas en el entorno de un quirófano de cirugía cardiaca. En suma: prevenir, detectar y actuar rápido si algo falla: todo ello va a redundar en una mayor seguridad para el paciente y también para el operador, que son la garantía principal para el éxito.
FinanciaciónEste estudio no recibió ninguna financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.