El implante de dispositivos de electroestimulación cardiaca (DECI) constituye una terapia útil para el tratamiento de diferentes cardiopatías. Sin embargo, su utilización no está exenta de complicaciones. La infección relacionada con los dispositivos de electroestimulación es una de las más frecuentes y serias que pueden producirse. La extracción intravenosa del sistema de electroestimulación es un procedimiento seguro y eficaz, dirigido al tratamiento de múltiples situaciones relacionadas con los dispositivos.
Objetivo y métodosEn el presente artículo abarcamos las complicaciones relacionadas con los procedimientos de extracción, identificamos los factores de riesgo asociados a la morbimortalidad de los pacientes, y establecemos una guía de prevención y tratamiento de las complicaciones cardiovasculares mayores.
ResultadosA pesar del crecimiento del número de procedimientos de extracción y del desarrollo de nuevos instrumentos, su práctica implica un riesgo potencial de complicaciones mayores y de morbimortalidad asociada. La realización de la técnica presentada, la correcta evaluación del riesgo quirúrgico del paciente y la estandarización del tratamiento completo como proceso asistencial son los 3 pilares básicos del tratamiento seguro y eficaz de las complicaciones relacionadas con los DECI.
ConclusiónEl procedimiento de extracción de los DECI que presentamos es eficaz y debe realizarse en un entorno seguro, implicando necesariamente un quirófano de cirugía cardiovascular, monitorización completa, ecocardiografía transesofágica y posibilidad de realizar esternotomía y cirugía de forma inmediata. Es necesario evaluar las posibles complicaciones y elaborar un proceso asistencial completo, teniendo en cuenta que las decisiones tomadas durante el implante inciden directamente en el potencial riesgo de la extracción.
Implantation of cardiac electrostimulation devices (CIED) is a useful therapy for the treatment of various heart diseases. However, its use is not free of complications. Infection related to electrostimulation devices is one of the most common and serious complications. Intravenous removal of the electrostimulation system is a safe and effective procedure, aimed at the treatment of multiple pathological situations related to the devices.
Objectives and methodsIn the present article, we cover complications related to extraction procedures, identify risk factors associated with patient morbidity and mortality, and establish a guideline for the prevention and treatment of major cardiovascular complications.
ResultsDespite the growth in the number of extraction procedures and the development of new instruments, its practice involves a potential risk of major complications and morbi-mortality associated with the treatment. The performance of the technique presented here, the correct assessment of the patient's surgical risk, and the standardization of the entire process are the three basic pillars for a safe and effective treatment of complications related to CIED.
ConclusionThe extraction procedure for CIED that we present is effective and should be performed in a safe environment, necessarily involving a cardiovascular surgery operating room, complete monitoring, transesophageal echocardiography, and the possibility of an immediate sternotomy and surgery. It is necessary to evaluate possible complications and develop a complete care process, considering that the decisions made during implantation have a direct impact on the potential risk of extraction.
El implante de dispositivos de electroestimulación cardiaca (DECI) es un procedimiento quirúrgico muy frecuente en nuestro medio, con unas tasas de éxito elevadas, bajo riesgo para los pacientes y una optimizada estandarización de la técnica. En este sentido, tanto el implante de marcapasos (unicamerales, bicamerales o tricamerales), como el implante de desfibriladores automáticos implantables, han experimentado un crecimiento exponencial en los últimos años. Para dimensionar el número de implantes que se realizan podemos resaltar que solamente en EE. UU. en el año 2009 se implantaron más de 133.000 desfibriladores y más de 225.000 marcapasos1,2.
Asociado al incremento de implantes de los DECI, se ha experimentado un claro aumento de las complicaciones asociadas al procedimiento, al momento de su recambio o a su permanencia en funcionamiento. Dentro de las complicaciones más frecuentes y con un mayor impacto en el pronóstico de los pacientes y en el coste sanitario, destacamos las infecciones tanto locales como sistémicas.
La cuantificación del porcentaje de infecciones presenta como problema añadido la dificultad de su cálculo. Esto es debido a la ausencia de un registro general obligatorio, a la práctica universalización de su implante en todo tipo de centros hospitalarios, y al seguimiento, ya que la observación debería realizarse durante toda la vida del paciente. La tendencia al alza de las complicaciones infecciosas de los DECI es un hecho evidente y constatado por numerosos grupos, y se estima que aparecen en torno al 2% (1,61-2,41%) de los dispositivos implantados2. Numerosos trabajos muestran que la mortalidad a largo plazo de los pacientes que sufren una infección de los DECI es 1,5-2,5 veces mayor que los que no han sufrido ninguna3, con unas tasas de mortalidad entre el 6-15% al año y entre el 14-33% a los 3 años, potenciando además, las diferentes causas de muerte competitiva como consecuencia de las comorbilidades y la edad de los pacientes4.
Todo ello ha implicado necesariamente el incremento del número de procedimientos de extracción/explante de los DECI. Si a estos procedimientos de extracción debido a causa infecciosa añadimos otras indicaciones de extracción tales como la disfunción de electrodos o la trombosis venosa5, el número total de extracciones que se realizan es muy elevado, superando las 10.000-15.000 extracciones de DECI al año a nivel mundial, y su número sigue al alza6.
Complicaciones asociadas a los procedimientos de extracción y morbimortalidadLos procedimientos de extracción han ido perfeccionándose y complementándose con el desarrollo de nuevos sistemas e instrumentos. Actualmente, la extracción intravenosa, sin cirugía abierta, utilizando diferentes sistemas de estiletes, lazos y vainas mecánicas o láser se considera el «gold standard».
A pesar de la seguridad de los procedimientos de extracción, no puede obviarse el riesgo de que se produzcan complicaciones potencialmente mortales. Por ello, ante la presencia de un problema infeccioso o de otra naturaleza que precise la extracción del dispositivo, es imprescindible hacer una correcta valoración del riesgo-beneficio de la estrategia terapéutica a llevar a cabo7.
Las potenciales complicaciones son múltiples, pudiendo estratificarse en complicaciones mayores (avulsión cardiaca, laceración vascular, taponamiento cardiaco, rotura de válvula tricúspide, tromboembolismo pulmonar con repercusión hemodinámica, hemotórax, neumotórax, etc.), complicaciones menores (derrame pericárdico, trombosis vascular, etc.) y otras situaciones potenciales (fragmento intracardiaco, fragmento intravascular, fragmento móvil intracavitario, tejido móvil intracavitario, etc.)8,9 (tabla 1).
Complicaciones relacionadas con los procedimientos de extracción intravenosa de dispositivos de electroestimulación
| 1. Complicaciones mayores: |
| Avulsión cardiaca |
| Laceración vascular |
| Taponamiento cardiaco |
| Hemotórax |
| Neumotórax |
| ACV |
| Insuficiencia tricúspide significativa posprocedimiento |
| Parálisis diafragmática |
| Parada cardiaca |
| Parada respiratoria |
| Cuadro séptico |
| TEP con repercusión hemodinámica |
| Fístula A-V con repercusión hemodinámica |
| Etc. |
| 2. Complicaciones menores: |
| Derrame pericárdico |
| Hematoma/sangrado local |
| Neumotórax |
| Embolismo pulmonar |
| Arritmias peri-procedimiento |
| Lesión de vena femoral |
| Etc. |
| 3. Otras: |
| Fragmento residual intravascular |
| Fragmento residual intracardiaco |
| Fragmento móvil intracavitario |
| Tejido móvil residual |
| Etc. |
ACV: accidente cerebrovascular; TEP: tromboembolismo pulmonar; Fístula A-V: fístula arteirovenosa.
Distintos grupos han reportado tasas de complicaciones mayores que oscilan entre el 1 y el 2%10, destacando la serie de Brunner, con más de 5.500 electrodos extraídos, que evidencia una tasa de complicaciones mayores del 1,8%. Congruente con los datos aportados por estos trabajos, el estudio ELECTRa que incluyó 3.510 pacientes sometidos a extracción, encuentra una incidencia de complicaciones mayores del 1,7% (IC 95%: 1,3-2,1), dos tercios de las cuales fueron en la fase intraoperatoria. De entre ellas, las complicaciones cardiovasculares son las más frecuentes8. Más recientemente, el estudio PROMET muestra una incidencia de complicaciones mayores del 1% en un total de 2.205 pacientes11.
En relación con la aparición de complicaciones menores, los distintos estudios muestran una incidencia alrededor del 3%12,13,14. De esta forma, la incidencia global de complicaciones (mayores y menores) durante los procesos de extracción de los DECI puede situarse en torno al 5% de los casos.
Mención especial requiere el riesgo de una potencial lesión de la válvula tricúspide durante los procedimientos de extracción. La incidencia de empeoramiento de una insuficiencia tricúspide (IT) previa o la aparición de una IT significativa oscila entre el 3,5 y el 15%15,16,17,18, y es debido a la lesión de los velos o de las cuerdas tendinosas durante la extracción. El pronóstico de esta valvulopatía iatrogénica es variable y requiere de un seguimiento más estrecho de los pacientes que la presentan.
Si atendemos a la mortalidad asociada a la extracción de dispositivos, tenemos que distinguir 2 aproximaciones. La primera, referida a la fase intraoperatoria. Durante este periodo, la mortalidad reportada en los diferentes estudios se sitúa entre el 0,4-0,5%. Sin embargo, si nos centramos en la mortalidad a 30 días, que incluye la fase intraoperatoria y la fase posprocedimiento, las cifras se sitúan entre el 5 y el 8%, con una morbilidad intrahospitalaria del 2-3%4,8,12. Este hecho evidencia la gran importancia del manejo apropiado de las complicaciones de los DECI, ya que la mortalidad asociada al tratamiento de las infecciones, principalmente endovasculares, a 30 días es más elevada que muchos procedimientos cardioquirúrgicos bajo circulación extracorpórea (CEC). Dentro de las complicaciones mayores, la rotura vascular y la avulsión cardiaca implican un especial riesgo vital para los pacientes. De hecho, de producirse, la mortalidad asociada a la complicación llega hasta el 36% de los casos, siendo la detección precoz el factor pronóstico más relevante, junto con el contexto estructural que permita realizar una cirugía cardiaca de emergencia19 (fig. 1).
Factores de riesgo implicados en la extracción de dispositivos de electroestimulaciónAtendiendo a los estudios de Segreti et al.20, podemos identificar diferentes factores de riesgo relacionados con la probabilidad de que se produzca una complicación mayor. Casi todos ellos son factores promotores de una mayor adherencia y una mayor fibrosis endovascular y/o endocavitaria peri-electrodo. Entre ellos, destacamos como factores directamente relacionados con la rotura vascular o cardiaca, el tiempo de implante, el sistema de fijación pasiva de los electrodos y el doble coil de los electrodos de desfibrilación. Por el contrario, aunque dificulta la extracción, la localización del dispositivo en el lado derecho del tórax no parece implicar una mayor incidencia de complicación mayor.
En suma a lo anterior, debemos considerar que si bien la presencia de una complicación mayor se correlaciona directamente con la mortalidad del procedimiento, sin embargo, la mortalidad a 30 días, muy superior a la que se produce durante el procedimiento de extracción (5-8%), depende también de otras muchas circunstancias clínicas paciente/dependiente tales como su situación basal, las comorbilidades existentes o la presencia de infección sistémica. Dentro de los factores de riesgo de mortalidad a 30 días, Brunner et al. destacan la edad, el índice de masa corporal, la hemoglobina basal, la presencia de enfermedad renal, la fracción de eyección, la causa infecciosa de la extracción, el doble coil y la experiencia del equipo en la extracción. Una vez identificados estos factores, propuso un instrumento predictivo de la mortalidad a 30 días, con la finalidad de estratificar el riesgo global del procedimiento y poder realizar una correcta evaluación del riesgo-beneficio. Resulta llamativo que, en su trabajo, el tiempo de implante o el número de electrodos a extraer no sean factores decisivos relacionados con la mortalidad a 30 días7.
Por otro lado, Aleong et al. analizaron la evolución de 8.304 pacientes sometidos a extracción de electrodos por causa infecciosa. Este estudio, además de evaluar la mortalidad a 30 días, identifica la incidencia de eventos adversos mayores mediante la construcción de una variable combinada «Major Adverse Events» (MAE) que incluye muerte, taponamiento cardiaco, hemotórax y necesidad de cirugía cardiaca emergente. La concurrencia de MAE en los pacientes sometidos a extracción por causa infecciosa fue del 9,2%, con una mortalidad global del 4,6%. Como podemos observar, la morbimortalidad del tratamiento de las infecciones de los DECI que implique la extracción del electrodo es muy elevada. Además, aunque el agente etiológico más frecuente es el estafilococo, la incidencia de MAE y la mortalidad fue mucho mayor en las infecciones por estreptococos (14,1 y 5,4%, respectivamente). En los casos de extracción de dispositivos por fractura de electrodos, la incidencia de MAE fue inferior al contexto de eventos generados en las complicaciones infecciosas (4,1 vs. 9,2%). Sin embargo, si ambas situaciones son concurrentes en el paciente (infección y fractura), la incidencia de MAE se eleva hasta el 10,4%21.
Por lo tanto, es preciso subrayar que la causa infecciosa de la extracción es un factor determinante en la valoración del riesgo del procedimiento y del pronóstico de los pacientes.
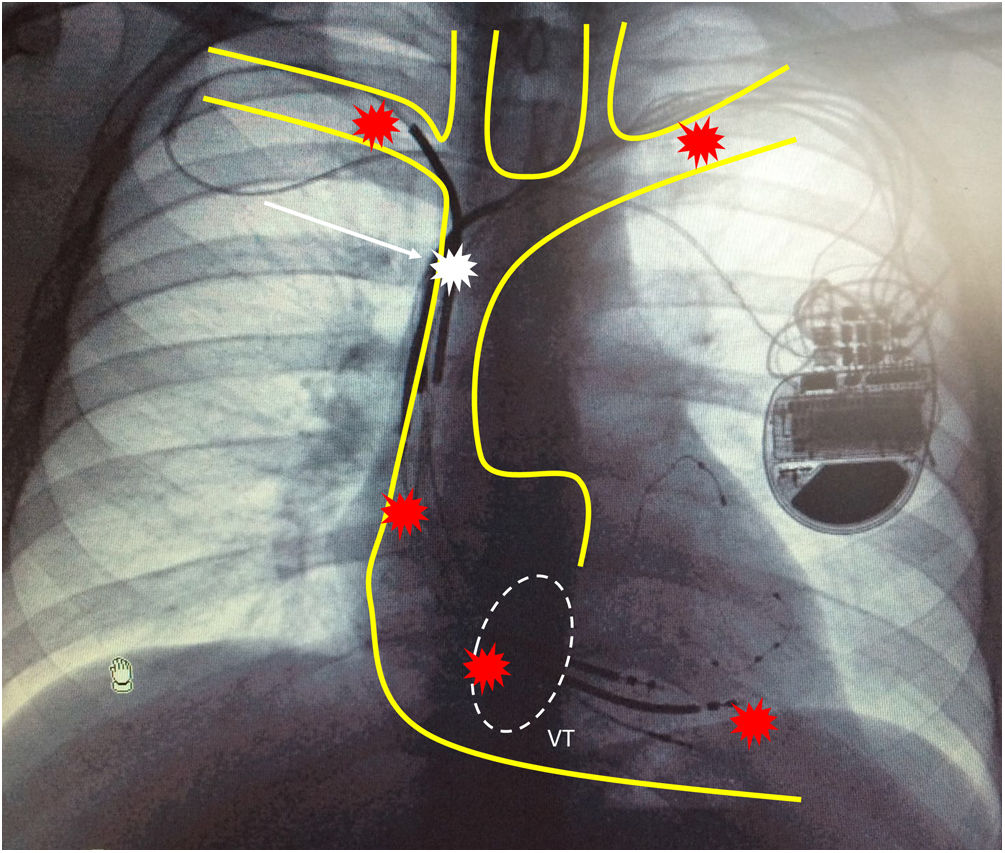
Procedimiento de extracción. Safeguards and pitfalls. ¿Cómo reducir la probabilidad de complicaciones?Como hemos señalado previamente, las complicaciones cardiovasculares son las más frecuentes durante el procedimiento de extracción, y además son las que implican un mayor riesgo vital. Las distintas estructuras anatómicas donde pueden producirse roturas o laceraciones vasculares y/o cardiacas son principalmente: vena subclavia izquierda, vena subclavia derecha, tronco venoso innominado, vena cava superior, aurícula derecha y ventrículo derecho. De entre todas ellas, la zona que más frecuentemente se afecta es la región más distal de la vena cava superior, en el segmento más cercano a la confluencia con el tronco venoso innominado (fig. 2)9,19.
Representación esquemática del sistema vascular venoso superior sobre radiografía de tórax de la aurícula derecha, válvula tricúspide y ventrículo derecho. Los puntos rojos evidencian los sectores del sistema cardiovascular con mayor riesgo potencial de complicación mayor por rotura. El punto blanco señala la porción distal de la vena cava superior adyacente a su conexión con el tronco venoso innominado (segmento de mayor riesgo de rotura durante un procedimiento de extracción). VT: representación esquemática de la válvula tricúspide.
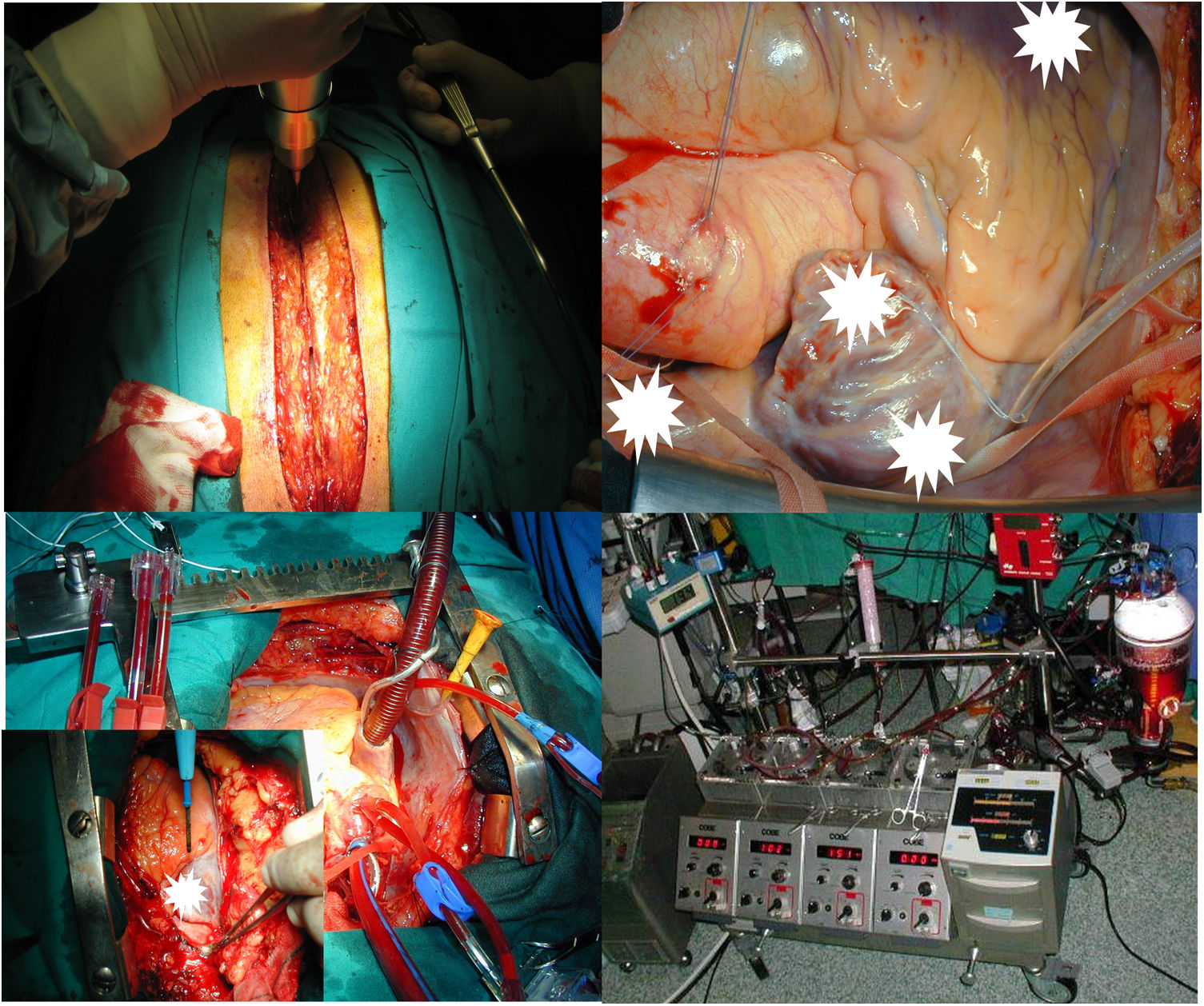
En primer lugar, y teniendo en cuenta la morbimortalidad asociada al tratamiento de las complicaciones de los DECI, especialmente de causa infecciosa, debemos garantizar la seguridad del paciente en caso de que sea necesario llevar a cabo un procedimiento de extracción de electrodos-dispositivo. Para ello, es básico tener disponible un entorno cardioquirúrgico apropiado. Tal y como indicábamos, los procedimientos de extracción presentan una tasa de complicaciones mayores cardiovasculares intra-procedimiento que oscila entre el 1 y el 2%, con una elevada mortalidad en caso de producirse. El diagnóstico precoz y la actuación inmediata constituyen la mejor estrategia de rescate posible. Los procedimientos de extracción deben realizarse en un quirófano de cirugía cardiovascular o quirófano híbrido, con el paciente bajo anestesia general, intubación orotraqueal, monitorización arterial invasiva, acceso venoso central, ecocardiografía transesofágica, circulación extracorpórea disponible de forma inmediata y posibilidad de cirugía cardiaca abierta durante el procedimiento. Es decir, estos procedimientos deben contar con los mismos sistemas de seguridad, monitorización y garantía de ejecución que cualquier otro tratamiento cardioquirúrgico realizado bajo circulación extracorpórea. Otra opción de entorno terapéutico supone una demora injustificable del tratamiento quirúrgico de rescate, ya que las complicaciones cardiovasculares mayores de los procedimientos de extracción (rotura vascular, avulsión auricular o ventricular, etc.) suponen una urgencia cardiovascular con un elevado riesgo vital. Además, la monitorización ecocardiográfica es esencial, ya que nos permite identificar situaciones de hipotensión por tracción, la valoración dinámica de un eventual derrame pericárdico, la monitorización de la función cardiaca derecha e izquierda, evaluar el riesgo de embolización, taponamiento cardiaco, la función de la válvula tricúspide (antes, durante y después), y cualquier otra situación de compromiso vital de forma simultánea a su generación. Cualquier otro método diagnóstico o de monitorización resulta mucho menos eficiente en relación con la puesta en marcha del plan de contingencia cardiovascular que debe estar disponible y bien estructurado con antelación, y que dependerá de las características de cada equipo quirúrgico. La extracción por tracción-contracción mediante lazo intravenoso femoral es una de las opciones que más se beneficia, en nuestra opinión, de la monitorización ecocardiográfica.
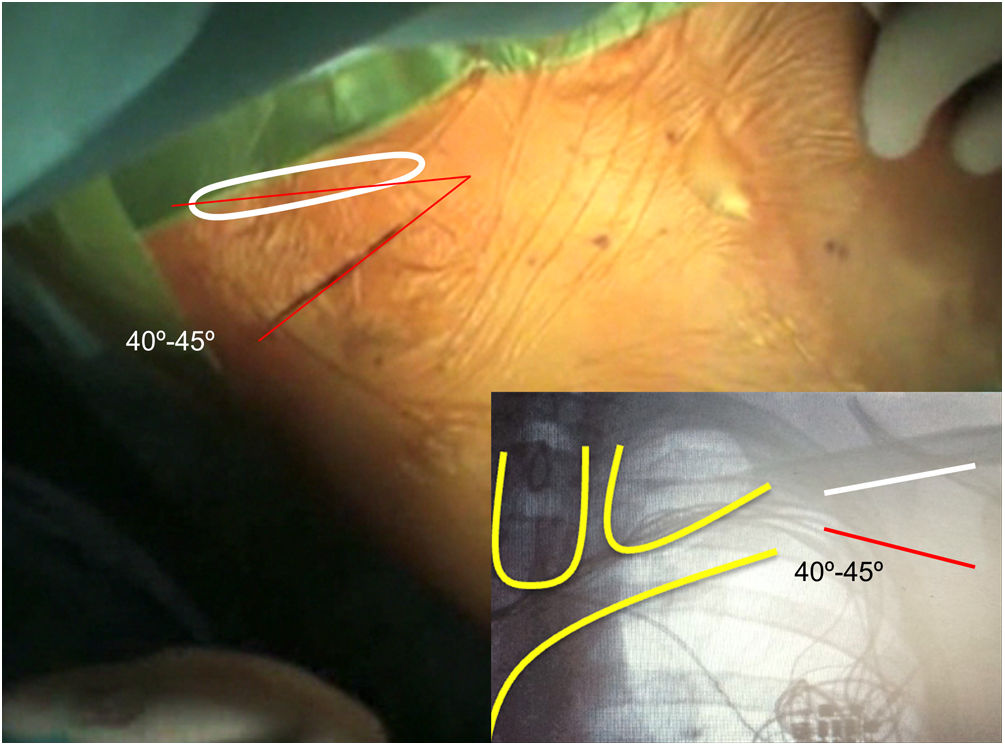
El abordaje inicial se lleva a cabo realizando una incisión en el surco deltopectoral, que permita la extracción del generador y que se aproxime hacia el punto de curvatura del reborde clavicular, situado aproximadamente entre la articulación esternoclavicular y 1/3-1/2 de la longitud de la clavícula. Esta incisión resulta mucho más eficiente para el control de la fibrosis de los electrodos en la bolsa del dispositivo, y de su entrada al sistema vascular, si se orienta 40-45° respecto al plano clavicular (fig. 3). Tras la apertura de la bolsa y la retirada del generador, se recomienda realizar una disección completa y minuciosa de la porción extravascular de los electrodos, inclusive prolongando la misma hasta 1cm en el espacio subclavio, desde el reborde clavicular hacia la ubicación subósea de los electrodos. Estas maniobras de disección deben realizarse con el bisturí eléctrico, en su función de «corte» y no «coagulación», para permitir la liberación de los electrodos sin que el incremento excesivo de temperatura conduzca a su rotura y nos dificulte el procedimiento. Además, una disección completa y en profundidad, nos facilita un buen acceso en caso de sangrado o complicaciones vasculares, y nos permite una introducción mucho más sencilla de las vainas de extracción directamente a nivel subclavio, superando la intensa fibrosis que con frecuencia encontramos entre la bolsa del dispositivo y los electrodos dispuestos de forma circular y/o en bucle. Así, evitamos también uno de los principales problemas de inicio, que es dañar el sistema de extracción con maniobras iniciales de entrada al eje venoso subclavio. Si los electrodos son de fijación activa y con integridad estructural, tras la introducción de la guía de electrodo, se procederá al desatornillado de la hélice de fijación. Independiente del tipo de electrodo, bien sea activo o pasivo, la introducción de una guía de electrodo nos permite verificar la permeabilidad de la luz del cable o la eventual obliteración de la misma y el nivel al que se produce. Un caso especial son los electrodos sólidos utilizados para la estimulación de la rama izquierda del haz de His.
Posteriormente deben introducirse los estiletes en todos los electrodos. Si el paciente no tiene escape en frecuencia ni con la administración de isoproterenol, mantendremos el ritmo cardiaco mediante la utilización de un sistema de marcapasos transitorio transfemoral. La introducción de las vainas de extracción se lleva a cabo bajo control radiológico, y se recomienda una adecuada alineación con el eje venoso subclavio y con los electrodos. Dado que la presencia de fibrosis supone uno de los principales factores de riesgo para la rotura de estructuras, todo aquello que la favorezca será un elemento que aumente el riesgo durante la extracción, debiendo ser tenido en cuenta durante el procedimiento (tiempo de implante, el uso de electrodos de fijación pasiva, el electrodo de doble coil, etc.)20.
Además, la fibrosis o fibrocalcificación peri-electrodo puede extenderse a electrodos adyacentes y configurar una envoltura común en varios puntos. Por ello, en nuestra experiencia recomendamos realizar una disección continua con la vaina mecánica/láser con presión controlada, dando tiempo al sistema de extracción para que vaya permitiendo un avance progresivo, escindiendo el tejido fibrótico, en lugar de fracturarlo con un empuje excesivo. En este punto es recomendable utilizar la vaina externa de contratracción de forma periódica, manteniendo la tracción del electrodo para evitar el «kinking» del cable y el avance no controlado de la vaina (fig. 4). Si la fibrosis es importante, deberemos avanzar sobre la fibrosis con una disección alternante de los distintos electrodos, lo que facilita mucho la progresión controlada del sistema de extracción.
Un elemento importante a destacar es la presencia de una fibrosis/fibrocalcificación de amplio diámetro. El avance con las vainas de extracción ante esta situación puede ser muy complejo y lento, por lo que debe realizarse de forma continua sin presiones bruscas y con la verificación periódica de que no encontramos ninguna porción fibrótica peri-electrodo atrapada dentro de la vaina. En caso de encontrarla, es preferible la retirada del sistema y llevar a cabo su exéresis mediante electro-bisturí para facilitar que actúe el sistema rotacional que incorporan las vainas mecánicas o el giro manual que podemos realizar con el láser.
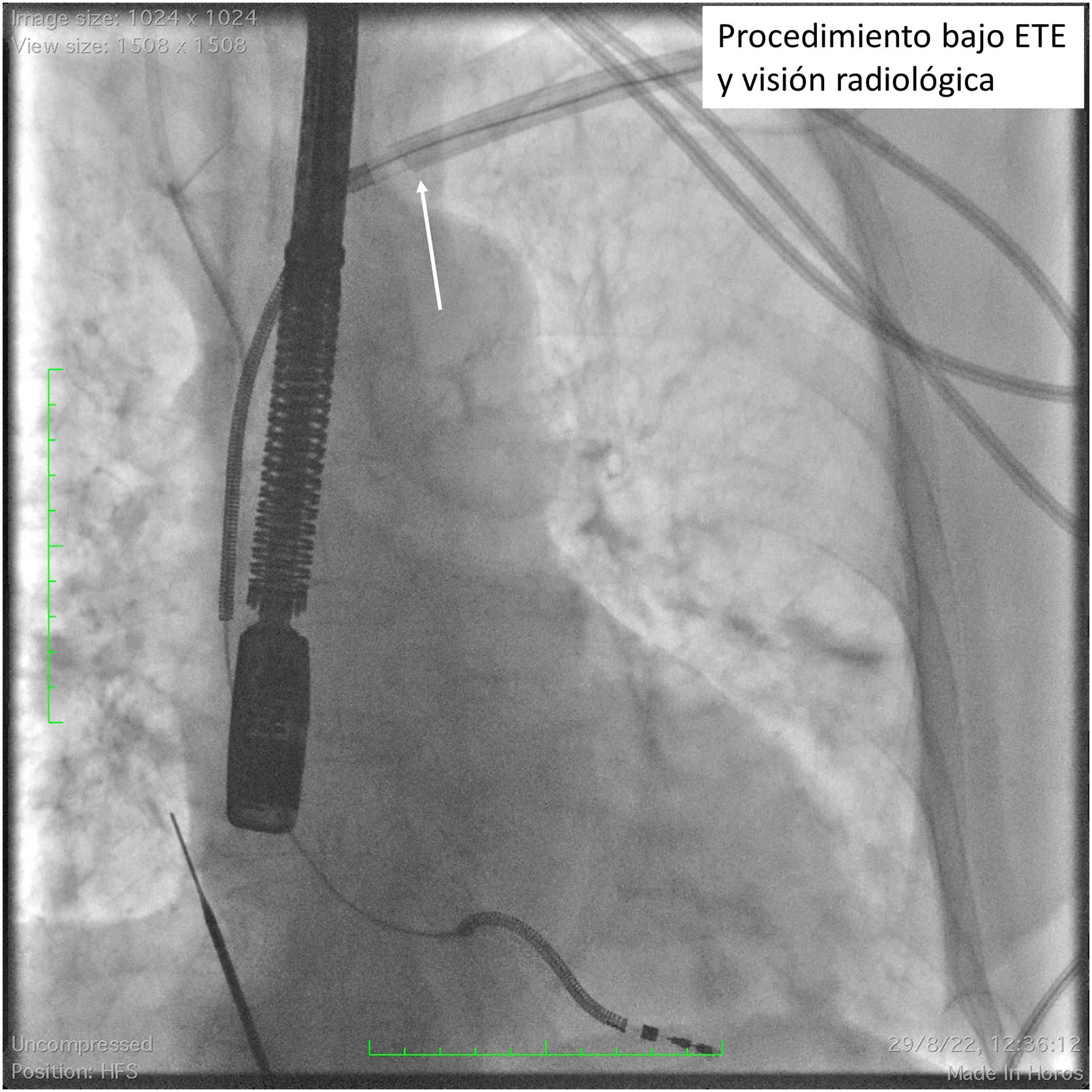
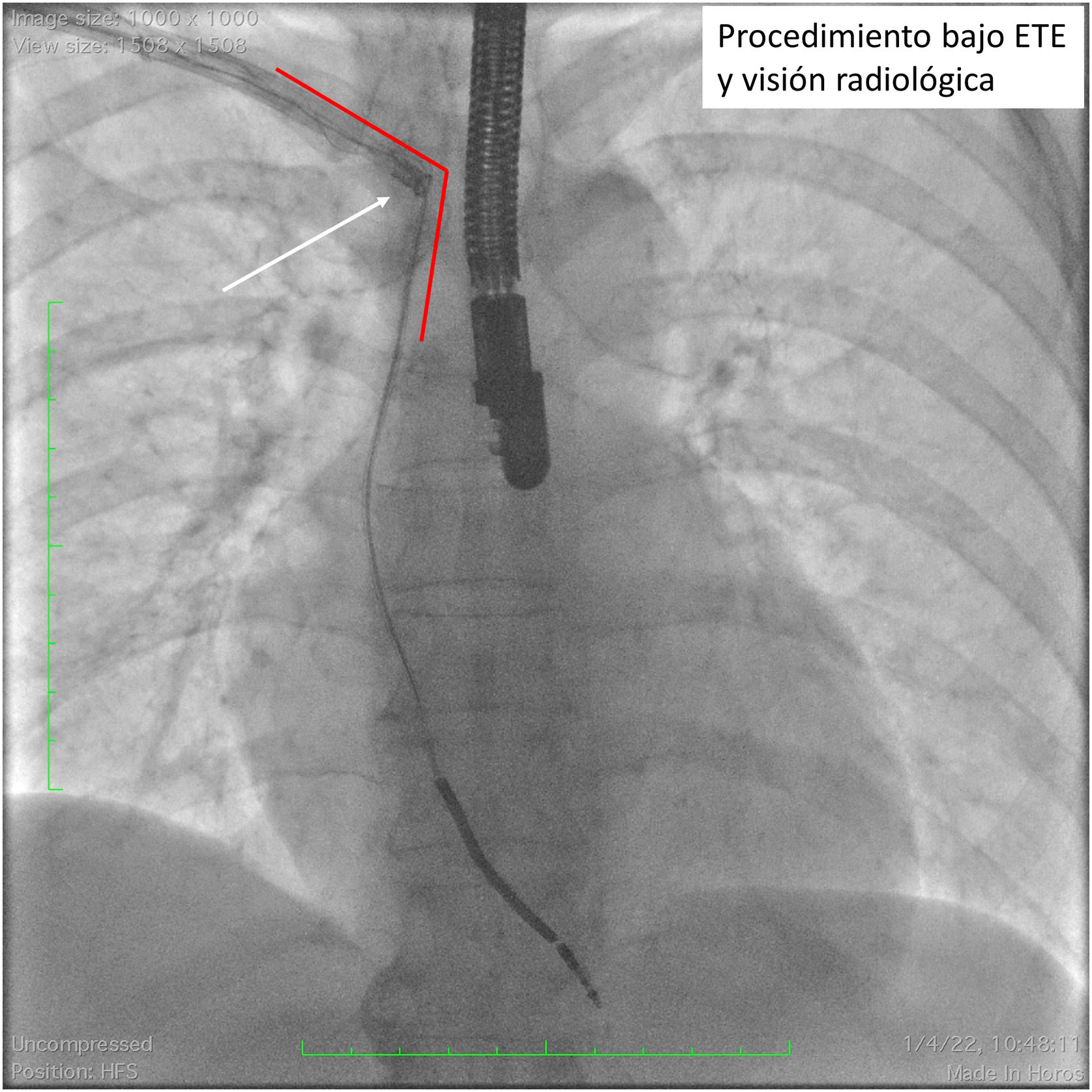
El paso a través de la confluencia entre el tronco venoso innominado y la vena cava superior es un punto crítico en la extracción. La rotura o laceración de la vena cava superior es una grave complicación que puede llegar a conducir al fallecimiento del paciente hasta en un 31,6% de los casos22. La fibrosis y la adherencia es especialmente importante a este nivel. La curvatura que implica el avance a la vena cava superior hace que el empuje de la vaina de extracción tienda a impactar directamente contra la pared vascular (fig. 5). Debido a ello, la presión debe ser aún más controlada a este nivel, dejando actuar el sistema de corte o láser, y traccionando de forma efectiva del electrodo para mantener un alineamiento correcto de la vaina y rectificar las curvas del circuito vascular venoso. Resulta igual de importante la utilización de la vaina externa de contratracción para el avance progresivo del sistema.
Visión radioscópica de un procedimiento de extracción de un electrodo de desfibrilación mono-coil. La flecha blanca muestra la deformación del sistema vascular venoso por empuje excesivo, forzando un ángulo en el que la vaina de extracción presiona sobre la pared venosa con el potencial riesgo de rotura.
Cabe destacar además, que el territorio derecho, por su gran angulación (90° en muchos casos), constituye un elemento de posible complicación o dificultad para que progresen las vainas de extracción. En este sentido, las vainas flexibles son una importante ayuda para la extracción del segmento inicial.
La rotura vascular ocurre sobre todo a nivel de la vena cava superior, bien por encima o por debajo de la reflexión pericárdica, y pueden presentarse como taponamiento cardiaco o inestabilidad hemodinámica, precisando tratamiento cardioquirúrgico emergente. Como opción para controlar el sangrado y poder llevar cabo la resolución quirúrgica de la complicación, es posible utilizar un balón compliante intravascular mientras se realiza la esternotomía y la reparación directa del vaso9,23. De hecho, el taponamiento cardiaco con riesgo vital es la complicación mayor más frecuente en todas las series estudiadas, llegando hasta una incidencia del 1,47%24.
Un número importante de electrodos presentan su mayor grado de adherencia a nivel del eje vascular, resultado su extracción óptima con el avance de las vainas de extracción a dicho nivel. Si no ha sido suficiente, avanzaremos hasta la cavidad auricular. El electrodo auricular presenta un punto de riesgo en su anclaje a la orejuela derecha, siendo importante que la vaina externa quede bien apoyada en la pared auricular antes de realizar la tracción final del electrodo.
Para el avance del electrodo ventricular derecho, debemos tener en cuenta la curvatura hacia la válvula tricúspide, realizando una correcta curvatura en la porción inferior de la aurícula derecha. Para ello la tracción del electrodo debe ser continua y hay que evitar el empuje excesivo de la vaina, dejando que el sistema de corte actúe de forma progresiva.
El cruce de la válvula tricúspide es otro punto potencialmente problemático. En primer lugar, esto es debido a que el paso del electrodo al ventrículo derecho no siempre es controlado en cuanto a su ubicación espacial se refiere, pudiendo ubicarse en múltiples zonas de la válvula tricúspide, o incluso atravesar la porción más posterior del velo septal. Además, las adherencias a los velos y al aparato subvalvular no es predecible en el momento del implante. La disección debe realizarse despacio y progresivamente, con apoyo continuo de la vaina externa. La tracción del electrodo-estilete debe ser suave, y la monitorización ecocardiográfica es mandatoria, especialmente ante electrodos como mucho tiempo de implante.
La fase final de extracción del electrodo ventricular puede implicar el avance de la vaina de extracción hasta la pared del ápex derecho o del tabique interventricular, en función de donde se ubique el electrodo. Este avance debe ser progresivo, con una cada vez mayor utilización de la vaina externa. Debemos tener en cuenta que la tracción del electrodo, una vez que se ha liberado de su fijación del resto del circuito vascular y auricular, puede generar un colapso parcial del ventrículo derecho y una caída de la tensión arterial y del gasto cardiaco. Por ello, la monitorización ecocardiográfica es esencial para diferenciar rápidamente lo que es un efecto momentáneo de una maniobra de tracción, de lo que puede ser una complicación importante por perforación/avulsión cardiovascular. Para la extracción final, la vaina externa aporta seguridad y eficacia en cuanto a la retirada completa del electrodo, ya que la porción final de los mismos puede escindirse con mayor facilidad y permanecer como material intracardiaco residual.
La utilización de la vaina externa para realizar un apropiado soporte sobre las estructuras cardiacas y llevar a cabo maniobras de tracción-contratracción es muy importante para minimizar el potencial riesgo de avulsiones auriculares, tricuspídeas o ventriculares (Video 1 del material adicional).
Los electrodos de resincronización, posicionados a través del seno coronario, no suelen implicar una mayor complejidad de tratamiento en su extracción. Sin embargo, aquellos electrodos de resincronización de fijación activa, tales como el Starfix®, sí suponen una mayor complejidad de extracción, pero con igual buen resultado potencial25. En estos casos, la monitorización ecocardiográfica es esencial para la manipulación del sistema en el seno coronario y las venas epicárdicas del ventrículo izquierdo.
Un reto actual que tendrá su desarrollo en los próximos años es la potencial necesidad de extracción intravenosa de los sistemas de marcapasos sin electrodo (MICRA®). Aunque la experiencia inicial ha sido satisfactoria con estrategias endovasculares y utilización de diferentes tipos de catéteres lazo26, habrá que esperar a evaluar la posibilidad real de extracción a largo plazo.
Cardiocirugía de respuesta inmediata. Seguridad y eficacia en el rescate de una complicación de urgencia vitalLa causa intra-procedimiento de riesgo vital más frecuente es la laceración vascular venosa de vena cava superior, o la avulsión de pared libre cardiaca, principalmente auricular. Ante esta situación de urgencia, la actuación inmediata es el principal determinante de supervivencia.
En este sentido, es esencial la disponibilidad de acceso rápido vascular arterial y venoso femoral (introductores de 5F) para una rápida canulación e instauración inmediata de la CEC. Del mismo modo, es básico disponer de material quirúrgico para la realización de esternotomía media completa inmediata y llevar a cabo un procedimiento cardioquirúrgico de rescate.
Si el paciente cursa con hipotensión severa y shock circulatorio, en relación con la presencia de derrame pericardio severo y taponamiento cardiaco, verificado mediante ETE, debe procederse a realizar esternotomía media emergente. En la mayor parte de las ocasiones, la descompresión cardiaca tras la apertura del pericardio genera una recuperación de la tensión arterial y la estabilización del enfermo. Asimismo, puede identificarse rápidamente la estructura vascular o cardiaca lesionada, controlando el sangrado de forma efectiva, la mayor parte de las veces sin necesidad de entrar en CEC. Durante el procedimiento de esternotomía, y de forma simultánea, es recomendable proceder a realizar canulación periférica arterial y venosa de rescate. Para ello, se introducirán sobre guía, una cánula de 15/17F arterial y 21/23F venosa, conectando el circuito para una eventual entrada en CEC. Si la descompresión cardiaca es compleja, y el paciente se encuentra en parada cardiocirculatoria o shock refractario postaponamiento, la necesidad de entrada en CEC es inmediata; llevándose a cabo mientras se continua con la esternotomía. De no poder realizar ambas actuaciones simultáneas, en este contexto de dificultad o demora en la descompresión cardiaca, debe priorizarse el mantenimiento vital instaurando la CEC, asegurando una correcta perfusión tisular, y posteriormente continuar con la esternotomía y pericardiotomía.
Por lo tanto, podemos afirmar que la mortalidad asociada a esta situación de urgencia clínica, en la mayor parte de los casos, no se relaciona con la complejidad quirúrgica de su resolución, sino con la rapidez de actuación para resolver el taponamiento cardiaco y/o mantener una presión de perfusión adecuada. Además, debemos señalar que, ante un contexto de taponamiento cardiaco agudo, la punción pericárdica aislada suele ser poco efectiva, ya que la rápida formación de coágulos en saco pericárdico hace que el drenaje sea poco eficiente.
En caso de que la solución de continuidad vascular o cardiaca sea de pequeño tamaño, la producción de derrame pericárdico hemático puede ser monitorizada mediante ETE, evidenciando la aparición de un derrame de novo y su progresivo incremento. Ante esta situación, es factible realizar una punción pericárdica, y como alternativa a la apertura inmediata si no se resuelve el derrame pericárdico, es la introducción a través de la vena femoral de un catéter diagnóstico que subiremos hasta la vena cava superior, verificando la solución de continuidad mediante inyección de contraste. Si el paciente comenzara a inestabilizarse, y tras identificar el punto de rotura en cava superior, puede avanzarse un balón compliante (sobre guía de soporte intermedio) para taponar el punto de fuga (previa intercambio del introductor femoral por una 12F) y permitir una actuación reglada más controlada y con mayor tiempo disponible para su ejecución.
En determinados casos en los que se determine que existe un elevado riesgo de rotura de vena cava superior y/o tronco venoso innominado, puede colocarse directamente el introductor 12F en vena femoral, y avanzar la guía de progresión del balón hasta la vena yugular o tronco venoso innominado. En caso de realizar este posicionamiento de forma previa, se recomienda la disponibilidad de un doble acceso venoso femoral. La problemática radica en la identificación de los casos que potencialmente pueden beneficiarse de esta actuación de pre-posicionamiento de la guía y acceso vascular del balón: pacientes con más de 3 electrodos, antigüedad importante de implante, gran fibrosis/calcificación en la bifurcación cava-innominada, estenosis de vena cava asociada a patrón cicatricial, trombosis parcial o total de sector venoso, etc.
En definitiva, los equipos quirúrgicos deben adaptar su protocolo de cirugía cardiaca mayor a la especial situación de urgencia que supone una complicación cardiaca o vascular producida durante el procedimiento de extracción. Sobre la base de lo expuesto, resulta evidente que los procedimientos de extracción deben realizarse en un quirófano que permita el abordaje descrito. Si bien la frecuencia de aparición de este tipo de eventos es muy baja, y en nuestros registros supone menos del 1%, la probabilidad de rescate y supervivencia a la complicación es sinónimo de actuación de cardiocirugía inmediata.
ConclusionesComo conclusión al breve análisis de las complicaciones y morbimortalidad asociada a los procedimientos de extracción de dispositivos de electroestimulación que presentamos, podemos decir que deben realizarse en un entorno seguro, implicando necesariamente un quirófano de cirugía cardiovascular, equipo de circulación extracorpórea, monitorización completa, ecocardiografía transesofágica y posibilidad de realizar esternotomía y cardiocirugía de forma inmediata. Es necesario evaluar, aplicando un modelo predictivo, el riesgo de complicaciones y mortalidad perioperatoria a 30 días. Es mandatorio elaborar un proceso asistencial completo que diferencie en metodología diagnóstica y terapéutica cada uno de los potenciales contextos clínicos (decúbito, infección local, infección sistémica, preventivo, disfunción, trombosis, etc.). Y, finalmente, resulta imprescindible considerar al paciente candidato a un sistema de electroestimulación como sujeto a un proceso continuado en el tiempo, en el cual, las decisiones tomadas durante el implante inciden directamente en el potencial riesgo de la extracción tales como evitar electrodos de doble coil, evitar la presencia de un elevado número de electrodos abandonados (cementerio de electrodos), evitar electrodos de fijación pasiva (auricular y ventricular derecho), evitar electrodos de fijación activa de ventrículo izquierdo y evitar implantes por el lado derecho o la tunelización de electrodos.
Consideraciones éticasSe contó con el consentimiento informado de los pacientes para la obtención y difusión de las imágenes y el vídeo del artículo. Además, no se incluyen datos que permitan identificar a dichos pacientes.
Conflicto de interesesJosé Manuel Garrido ha proctorizado procedimientos de extracción de dispositivos de electroestimulación en diferentes centros hospitalarios con los sistemas de extracción de Cook Medical.