El implante de dispositivos electrónicos implantables cardíacos ha aumentado significativamente en respuesta al incremento de sus indicaciones basadas en la evidencia y, paralelamente, ha asociado también un ascenso en el número de dispositivos electrónicos implantables cardíacos a extraer por diferentes causas. Los electrodos de dispositivos electrónicos implantables cardíacos crónicamente implantados desarrollan frecuentemente tejido fibroso a nivel de la interfase entre electrodos adyacentes, endotelio venoso y endocardio, lo que implica una extracción de electrodos transvenosa facilitada por herramientas especializadas para liberar dichas adherencias.
La extracción de electrodos transvenosa con láser excimer proporciona excelentes tasas de éxito completo del procedimiento y de éxito clínico, permitiendo tratar algunos pacientes que difícilmente podrían ser abordados con las otras técnicas existentes.
El abordaje multidisciplinar «Heart Team» en un entorno apropiado para el procedimiento, con adecuado entrenamiento del personal, es fundamental para la detección precoz y el manejo exitoso de las complicaciones cardiovasculares de la extracción de electrodos transvenosa facilitada con láser.
The increase in the implantation rate of cardiac implantable electronic devices in the last decade has given rise to the need for transvenous lead extraction techniques, frequently in high-risk patients. Chronically implanted cardiac leads tend to develop a fibrous scar tissue surrounding them and among the venous endothelium and cardiac endocardium. This phenomenon makes necessary to resort to powered sheaths for TLE procedures.
Laser-facilitated transvenous lead extraction of cardiac implantable electronic devices is a safe and highly effective procedure even in high-risk patients.
A multidisciplinary “Heart Team” approach and an appropriate surgical work-up are mandatory for early identification and treatment of major cardiovascular complications.
En la última década hemos asistido a un incremento exponencial en el número de dispositivos electrónicos implantables cardíacos (DEIC), lo que ha conducido inexorablemente a un aumento en la necesidad de extracción de electrodos transvenosa (EET) por infección del dispositivo, disfunción de electrodo y otras causas menos frecuentes en pacientes complejos y de alto riesgo1–4.
Los electrodos de DEIC crónicamente implantados desarrollan frecuentemente tejido fibroso a nivel de la interfase entre electrodos adyacentes, endotelio venoso y endocardio, lo que implica que su explante mediante tracción simple no sea posible. En dichos casos, se requiere la extracción mediante herramientas especializadas para liberar las adherencias de los electrodos.
Hoy en día existen diversas herramientas y técnicas para la extracción de electrodos de marcapasos y/o desfibriladores que han demostrado ser eficaces, pero todas ellas asocian un cierto riesgo para el paciente4–7. Con el tiempo se desarrolla un tejido fibroso que atrapa al electrodo en las venas y cámaras cardíacas8,9. La cirugía abierta, la tracción manual, la tracción mecánica asistida y los sistemas de extracción con estilete bloqueante se han visto superados por tecnologías más avanzadas, como las vainas de radiofrecuencia o las vainas de láser frío.
La EET en determinadas anatomías venosas (oclusión completa o estenosis severa crónica en el trayecto vascular) y en pacientes frágiles o con múltiples comorbilidades puede implicar lesiones, mayoritariamente transmurales, a nivel del endotelio venoso, hasta en el 15% de los pacientes10, si bien la tasa de complicaciones mayores, como perforación cardíaca, laceración vascular o muerte, presentan una incidencia más baja, de entre el 1-4%3,11. No obstante, la mortalidad de los pacientes con complicaciones cardiovasculares mayores que requieren cirugía urgente abierta o endovascular se sitúa frecuentemente por encima del 30%11,12. Por todo ello, la valoración y tratamiento de estos pacientes necesita una estrecha colaboración multidisciplinar en un «Heart Team» específico, que en nuestra institución está constituido por electrofisiólogos, cardiólogos clínicos, anestesistas y cirujanos cardíacos.
Por último, el éxito de la EET puede ser definido también según el objetivo que se busque. Así, se definen como «éxito radiológico» o «extracción completa» aquellos casos en los que todo el electrodo ha podido ser retirado. La «extracción parcial» supone que alguna porción del cable (en general menor de 2cm) no ha podido ser retirada, al quedar retenida en alguna zona del corazón o del sistema venoso. Sin embargo, en ocasiones es suficiente alcanzar el «éxito clínico», que implica lograr el objetivo clínico último que se pretendía. Por ejemplo, en el caso de disfunción de electrodos, si se extrae el electrodo disfuncionante prácticamente entero, aunque permanezca la punta, y siempre que se pueda implantar un nuevo sistema sin interferencia, el objetivo clínico se cumple.
Sistema de láser excimerEl sistema láser excimer CLeaRS® (Koninklijke Philips N.V.) para extracción de electrodos de DEIC está compuesto por 3 dispositivos complementarios. El primero, denominado Lead Locking Device (LLD®, Koninklijke Philips N.V.), es un estilete que se expande radialmente proporcionando cuerpo a la totalidad de la longitud del cable. El segundo dispositivo es una vaina asociada a un láser excimer frío (50°C) de cloruro de xenón capaz de disecar, mediante una combinación de mecanismos fotolíticos y fototérmicos, el tejido fibroso cicatricial circundante al cable.
Actualmente existe una amplia investigación sobre la interacción del láser excimer con el tejido humano13–15. Una combinación de fotoquimiolisis y ablación fototérmica desintegra el tejido en contacto con la punta de la vaina en partículas de menos de 5μm de diámetro.
El sistema láser CVX-300 Excimer XeCl (Koninklijke Philips N.V.) emite pulsos de 135ns (longitud de onda de 308nm). La fluencia (salida de energía por unidad de área de fibra) en el extremo distal de la vaina puede regularse entre valores de 30 a 60mJ/mm2). Dado que la profundidad de penetración de un haz de 308nm en el tejido vascular es aproximadamente de 100μm, el haz láser es absorbido completamente por el tejido justo delante de la punta. Esto produce una eliminación precisa y controlada solo del tejido fibrótico que rodea al electrodo16.
El sistema de EET con láser excimer fue desarrollado originariamente por Spectranetics Corporation (Colorado Springs, Colorado) y ha sido empleado con éxito desde la década de los noventa17,18. El modelo inicial de vaina láser Spectranetics Laser Sheath (SLS I®, Spectranetics Corporation, Colorado Springs, Colorado) fue modificado y una segunda generación de vainas láser SLS II® se incorporó al mercado en 2002 (Spectranetics Corporation, Colorado Springs, Colorado). En 2012 se comercializó la tercera generación de vaina láser excimer, llamada GlideLight™ (Spectranetics Corporation, Colorado Springs, Colorado). Aunque la fluencia de energía en el extremo distal tanto de las vainas SLS II® como de las vainas GlideLight™ puede regularse entre valores de 30 a 60mJ/mm2, la frecuencia de repetición de pulsos emitidos por el sistema láser CVX-300 se incrementó de 40Hz con la vaina SLS II® a 80Hz con la tercera generación GlideLight™.
La vaina láser GlideLight™ permite una alta seguridad perioperatoria y eficacia en extracciones de electrodos crónicamente implantados de marcapasos y desfibriladores4.
La nueva generación de vainas láser GlideLight™ permite además adaptarse a diversos escenarios en la extracción de electrodos y aumenta en un 62% la eficiencia del avance a través de las adherencias electrodo-vaso. Asimismo, la vaina láser GlideLight™ mejora el control de la extracción al emplear hasta un 55% menos de fuerza para el avance comparado con SLS II®. En resumen, el láser puede ser programado para suministrar 2× veces el número de pulsos de energía en el mismo tiempo con la vaina GlideLight™, si bien emite la misma energía por pulso con ambas generaciones de vainas y, por tanto, no hay diferencias en la dispersión de calor, y la profundidad de penetración se mantiene en menos de 50μ (menos que el diámetro de un pelo humano).
La nueva vaina GlideLight™ de 80Hz ha sido comparada con la SLS II® de 40Hz, demostrando ser no inferior a la segunda generación en cuanto a tiempo de uso de láser, retirada completa de electrodos y complicaciones mayores19.
Desde el punto de vista operativo, existen 3 diámetros de vaina disponibles: 12, 14 y 16Fr. La longitud operativa de cada vaina es de aproximadamente 35cm, pero su longitud total oscila de 65 a 85cm. La porción operativa de la vaina, de 35cm de longitud, está compuesta por 2 capas de polímero, una interna y otra externa, entre las que se encuentra una capa única de fibras ópticas dispuestas en espiral16. En el extremo distal de la vaina, las fibras presentan un anillo circunferencial simple entre ambas capas de polímero. En el extremo proximal de la vaina, las fibras pasan a través de un cable conector al generador láser.
El sistema se completa con un tercer dispositivo, una vaina externa de teflón, que facilita la extracción del cable-electrodo mediante disección mecánica de las adherencias y facilitando el giro de la vaina láser en los ángulos agudos. Estas vainas externas sirven para realizar una disección mecánica adicional y para ayudar a la liberación del extremo distal del electrodo mediante una maniobra de tracción (vaina láser)-contratracción (vaina teflón). Asimismo, una vez retirada la vaina láser y el electrodo, puede ser empleada como introductor para implantar un nuevo electrodo intravascular y mantener la permeabilidad del eje venoso.
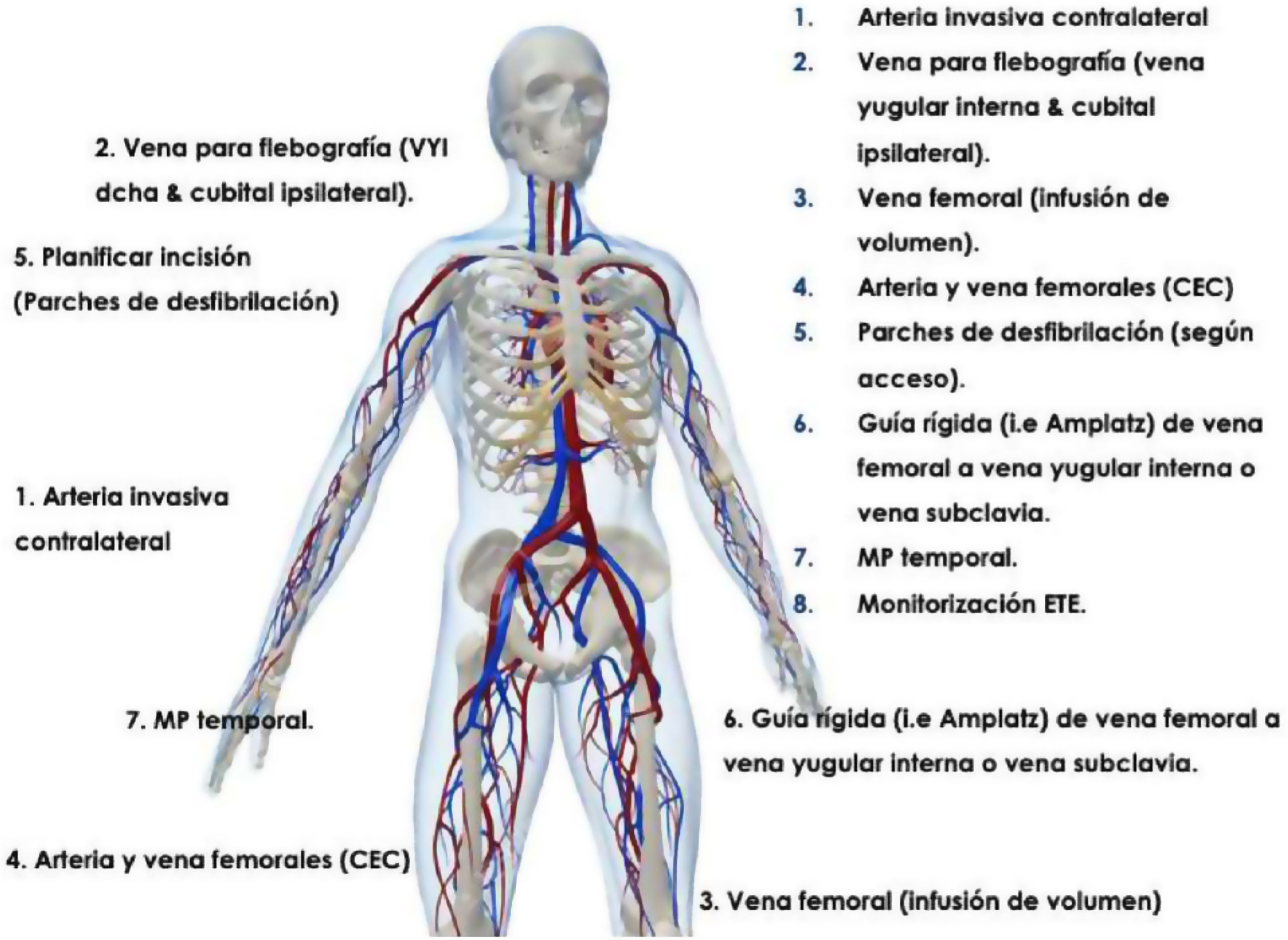
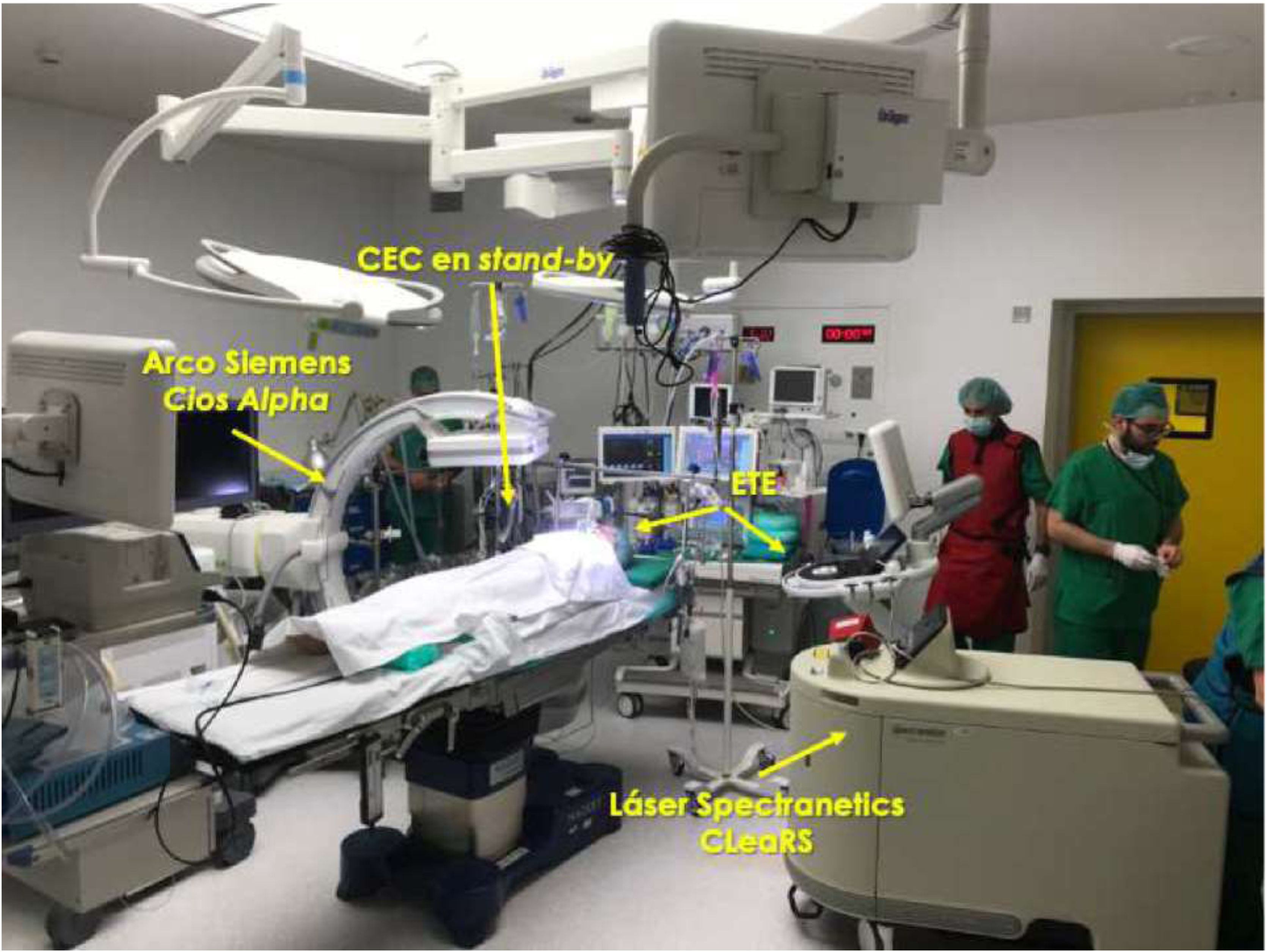
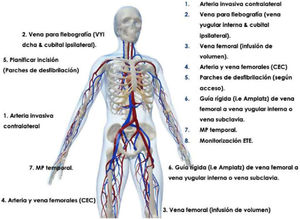
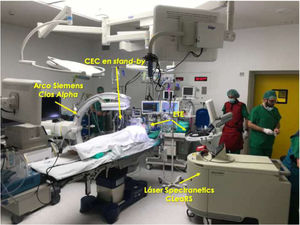
Monitorización intraoperatoriaEs recomendable realizar las extracciones mediante láser en un quirófano de cirugía cardíaca bajo anestesia general. El paciente debería estar preparado en caso de necesitar una esternotomía o toracotomía de urgencia, incluyendo monitorización invasiva de la arterial radial y colocación de un catéter venoso central (fig. 1). Asimismo, un equipo de circulación extracorpórea y perfusionista debe hallarse disponible en el quirófano.
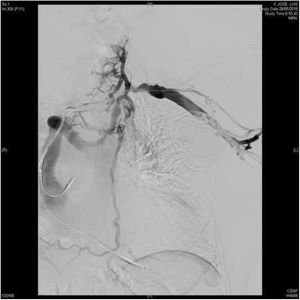
El procedimiento ha de efectuarse siempre bajo control fluoroscópico, siendo igualmente aconsejable la monitorización mediante ecocardiografía transesofágica para la detección precoz de complicaciones cardíacas de la EET (fig. 2).
Asimismo, es aconsejable disponer en el quirófano de palas de estimulación de marcapasos y/o electrodo endocavitario transitorio por si fuera necesario, dada la frecuencia de extracción en pacientes completamente dependientes de la estimulación.
Como ya reportó nuestro grupo en 20106, los criterios que consideramos para la extracción láser son:
- •
Pacientes con electrodos de más de 2 años de antigüedad en los que un intento inicial de extracción mecánica con estilete fuese fallido.
- •
Pacientes con electrodos de más de 2 años de antigüedad en los que una flebografía de miembros superiores demostrase trombosis-oclusión del sistema venoso subclavioinnominado.
Por su parte, los criterios definidos por nuestro grupo6 para la exclusión de pacientes en esta técnica son:
- •
Pacientes con electrodos de menos de 2 años de antigüedad.
- •
Pacientes con endocarditis sobre electrodo con vegetaciones>2cm.
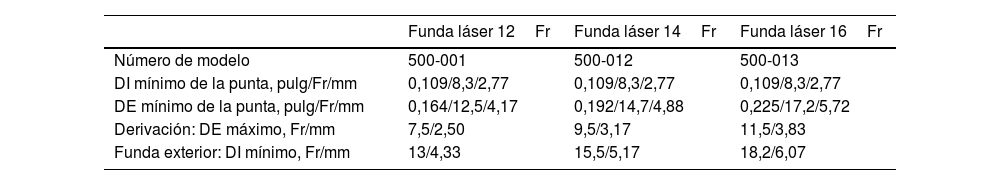
Se debe seleccionar una vaina láser de calibre interno adecuado al diámetro de electrodo que se desea extraer. La vaina de 12Fr tiene un diámetro interno de 8,4Fr (2,8mm) y un calibre externo total de 12,4Fr (4,1mm).
Previamente a la entrada del paciente en el quirófano debe comprobarse la compatibilidad de la vaina láser con el calibre externo de los electrodos de DEIC a extraer. La tabla 1 muestra la compatibilidad dimensional entre el calibre interno de las diferentes vainas láser y el diámetro externo de los electrodos.
Compatibilidad dimensional entre el calibre interno de las diferentes vainas láser y el diámetro externo de los electrodos
| Funda láser 12Fr | Funda láser 14Fr | Funda láser 16Fr | |
|---|---|---|---|
| Número de modelo | 500-001 | 500-012 | 500-013 |
| DI mínimo de la punta, pulg/Fr/mm | 0,109/8,3/2,77 | 0,109/8,3/2,77 | 0,109/8,3/2,77 |
| DE mínimo de la punta, pulg/Fr/mm | 0,164/12,5/4,17 | 0,192/14,7/4,88 | 0,225/17,2/5,72 |
| Derivación: DE máximo, Fr/mm | 7,5/2,50 | 9,5/3,17 | 11,5/3,83 |
| Funda exterior: DI mínimo, Fr/mm | 13/4,33 | 15,5/5,17 | 18,2/6,07 |
DE: diámetro externo; DI: diámetro interno.
Es necesario purgar la vaina láser seleccionada con una jeringa de 10cm3 con suero salino. Se recomienda humedecer la superficie externa de la vaina láser con una compresa húmeda.
Antes de emplear la vaina láser, esta debe ser calibrada con el generador CVX-300 para descartar posibles errores en su funcionamiento. Se avanzará la vaina láser sobre el estilete y electrodo hasta alcanzar el punto de inserción vascular. Debe mantenerse en todo momento una tracción firme (no excesiva) sobre el estilete y suturas para rectificar el trayecto no adherido del electrodo y evitar que se formen bucles intravasculares. Este punto es de vital importancia porque si se avanza la vaina láser sobre un bucle se puede producir una laceración al impactar la vaina contra la pared venosa.
La vaina láser es mantenida siempre recta en dirección coaxial al electrodo y observada directamente bajo fluoroscopia siempre que el láser es activado. Al hacer avanzar la vaina láser por una curva, se debe mantener el extremo distal biselado de la vaina orientado hacia el interior de la curva (fig. 3). En todos los procedimientos de extracción, pero especialmente al retirar electrodos de DAI de doble bovina, es fundamental una tracción sólida y una posición estable del «raíl» con respecto al electrodo, mientras se conserva la alineación coaxial de la vaina láser y el bisel en la curvatura interior de la vena cava superior (VCS). Antes de acceder a la VCS, se debe detener la progresión para asegurarse de que se mantiene una tracción sólida y una posición estable del «raíl».
Si se está empleando también disección mecánica con vaina externa de teflón, se ha de realizar la técnica de «movimiento de gusano»: se hace avanzar de forma alternativa la vaina exterior de teflón y la vaina láser sobre el electrodo.
Debemos sospechar una obstrucción intravascular cuando:
- ∘
La vaina láser no avanza hacia la vena.
- ∘
La vaina láser se inclina ligeramente hacia fuera al aplicar la presión longitudinal.
- ∘
La fluoroscopia muestra que la punta de la funda no avanza con relación al electrodo.
Si se encuentra una obstrucción y la vaina láser no puede avanzar:
- ∘
Utilizar vistas fluoroscópicas ortogonales para asegurarse de que la punta de la vaina láser está alineada con el eje longitudinal del electrodo.
- ∘
Retirar la vaina exterior si se está usando, de modo que su extremo distal no solape la funda de láser. Se debe empujar con cuidado la funda de láser hacia el tejido obstruido.
- ∘
Empleo de la vaina láser.
Para emplear los pulsos electromagnéticos del láser, primeramente se debe colocar el láser CVX-300 en modo READY. A continuación, se presionará el interruptor de pedal, activando así el láser. Mientras el láser se acciona, se hará presión con cuidado sobre la vaina láser para hacer avanzar el dispositivo aproximadamente 1mm/s mientras se aplica tracción igual y en dirección contraria al dispositivo de tracción. Si la funda de láser se rompe a través de la obstrucción al aplicar el láser, se debe soltar el interruptor de pedal.
El avance de la funda de láser a través de tejidos moderadamente calcificados puede requerir más impulsos de energía láser que a través de sobrecrecimientos de cicatrices fibrosas.
Si no es posible hacer avanzar la vaina láser, debe interrumpirse la maniobra. En ese caso, el cirujano deberá estar preparado para pasar a una vaina láser más grande, cambiar a otro electrodo, probar con un abordaje femoral, considerar el abandono del electrodo o valorar la reconversión a un procedimiento abierto.
Debemos tener en cuenta que si el dispositivo de tracción desbloquea o rompe el estilete, será necesario extraer la vaina de láser y aplicar un nuevo dispositivo de tracción antes de continuar con la vaina láser. Además, no es aconsejable avanzar la vaina láser a menos de 1cm de la punta del electrodo, ni aplicar el láser sobre el miocardio para extraer la punta de la derivación.
Si es necesario al llegar al corazón, debemos ejercer contratracción mediante la funda exterior y el dispositivo de tracción para liberar la punta de la derivación de la pared del corazón.
El vídeo 1 muestra el procedimiento de extracción de un electrodo de marcapasos con una vaina de segunda generación SLS II®, y el vídeo 2 presenta la extracción con una vaina de tercera generación GlideLight™ (material adicional).
La retirada de la funda de láser y la funda exterior puede realizarse en cualquier momento durante el procedimiento. Si el electrodo está liberado, debemos aproximarlo a la vaina láser antes de extraer el electrodo, la vaina y la vaina exterior del vaso sanguíneo.
En caso de rotura o laceración vascular de la VCS (normalmente a nivel de la confluencia yuguloinnominada o de la unión cavoatrial), una opción para controlar el sangrado y poder proceder a la reparación quirúrgica abierta de la lesión es el empleo de un balón compliante intravenoso. Existen balones específicamente diseñados para las lesiones vasculares en estas localizaciones, como el balón Bridge™ (Philips Spectranetics). Se trata de un balón muy compliante, de baja presión (2,5-5atm), con un rango de diámetro (20-30mm) y que es capaz de adaptarse a todo tipo de anatomías y electrodos implantados sin extender el desgarro vascular. En nuestro servicio hemos utilizado también con éxito otro tipo de balones compliantes para la oclusión de desgarros en la VCS o AD, como el balón Reliant™ (Medtronic) y el Coda™ (Cook). En cualquier caso, el empleo de estos balones para oclusión intravascular requiere de un acceso venoso femoral con un introductor de 12Fr o mayor. Por esta razón, en la preparación intraoperatoria de estos casos recomendamos disponer de un acceso venoso femoral (preferiblemente derecho) con una guía de 0,035” (idealmente de alto soporte) colocada desde la vena femoral hasta la VCS. Asimismo, para roturas o laceraciones de venas de menor calibre, como la vena innominada o la vena subclavia, hemos empleado con éxito el balón periférico Armada™ 35 (Abbott) de 12 o de 14mm.
Cuando es necesario realizar la EET y un nuevo implante de dispositivo, el protocolo de nuestra unidad es el que exponemos a continuación. Excepto en indicaciones infecciosas, realizamos siempre el implante simultáneo ipsilateral del nuevo sistema cuando hemos podido repermeabilizar el eje venoso correspondiente tras la extracción del dispositivo con la vaina láser (aprovechamos la vaina externa de teflón como «introductor»). En caso de que el eje venoso ipsilateral no se pueda recanalizar tras la extracción o haya quedado comprometido, se efectúa un implante contralateral tras la extracción de los cables antiguos, pero casi siempre en el mismo acto quirúrgico. En caso de pacientes dependientes de marcapasos y sin ritmo propio de escape, se coloca un marcapasos intravenoso provisional mientras se realiza la extracción. En aquellos casos de etiología infecciosa, se individualiza en cada caso dependiendo de múltiples factores (presencia de bacteriemia o endocarditis, ritmo propio del paciente, microorganismo, anatomía venosa, etc.).
Evidencia científica actualEn la actualidad disponemos de varios estudios multicéntricos y registros que presentan la técnica del láser excimer como una alternativa segura y eficaz para la extracción de cables de marcapasos retenidos, así como la única opción terapéutica posible en un amplio número de pacientes.
Uno de los estudios originarios más valiosos disponibles es el estudio multicéntrico, prospectivo, aleatorizado, denominado Pacemaker Lead Extraction withthe Excimer Sheath (PLEXES)18. Dicho estudio englobó a 301 pacientes con un total de 465 electrodos a explantar, comparando la tecnología de la vaina láser excimer con las técnicas no-láser (mecánicas y radiofrecuencia). La tasa de extracción completa del electrodo fue del 94% en el grupo del láser frente a un 64% en el grupo no-láser. De hecho, el láser excimer fue usado como alternativa con éxito en un 88% de los casos en los que las técnicas mecánicas y de radiofrecuencia (no-láser) habían fallado. El tiempo medio de extracción y de exposición radiológica fue significativamente más bajo en el grupo de pacientes tratados con técnica de láser excimer (10,1±11,5min) que en el grupo en el que se utilizaron las técnicas mecánicas/radiofrecuencia (12,9±19,2min). No se registraron diferencias significativas en la tasa de complicaciones de ambos grupos. Los investigadores del estudio PLEXES demostraron en este estudio que la técnica del láser excimer obtiene mejores resultados y es más eficaz que las técnicas no-láser (mecánicas y radiofrecuencia) en la extracción de cables de marcapasos retenidos, reduciendo también los tiempos operatorios de forma significativa18.
En junio de 2007 se publicó el resultado del estudio europeo Pacing LeadSurveillance Study in Europe (PLESSE)20 sobre el uso del láser excimer para la extracción de cables de marcapasos retenidos. Este amplio estudio recogió la experiencia de 14 centros que realizaron esta técnica en 292 pacientes (edad media 61,6 años, rango de 13 a 96 años) entre agosto de 1996 y marzo de 2001, siendo un total de 383 los electrodos extraídos (170 auriculares y 213 ventriculares). La extracción completa del electrodo se logró en un 90,9%, y parcial en un 3,4% de los casos. No presentaron mortalidad intrahospitalaria y la tasa de complicaciones mayores fue del 3,4%. A nivel europeo, además del estudio multicéntrico PLESSE20, existen series de un único centro entre las que destaca la reportada por Kennergren et al., del Servicio de Cirugía Cardiotorácica del Hospital Universitario de Sahlgrenska (Göteborg, Suecia)7,21. Esta amplia serie recoge a 647 pacientes en los que se extrajeron 1.032 electrodos. El 35% de los electrodos pudo ser explantado con técnicas no-láser, pero un 60% de los electrodos requirió el empleo de las vainas láser excimer para lograr su extracción y en casi un 5% de los casos se optó por la cirugía abierta. La antigüedad media de los electrodos extraídos con técnicas no-láser fue de 69 meses, mientras que la antigüedad media en el grupo del láser fue de 91 meses. En ningún caso hubo mortalidad intrahospitalaria y no se registraron diferencias en la incidencia de complicaciones entre grupos21.
En nuestra serie de 110 casos publicada en 20197 obtuvimos unas tasas de éxito completo del procedimiento y de éxito clínico del 96,8 y 97,9%, respectivamente. Estas cifras se situaron por encima de las publicadas en los estudios multicéntricos iniciales, tanto en el estudio norteamericano PLEXES18, con una tasa de extracción completa de electrodo del 94%, como en el posterior estudio europeo PLESSE20, con una tasa de extracción completa del 90,9%. Más recientemente, el estudio LeadExtraction in the Contemporary Setting (LexICon), en el que ya se empleó la vaina láser SLS II®, reportó una tasa de extracción completa de electrodo del 96,5% y de éxito clínico del 97,7% en 1.449 pacientes22. Otras revisiones actuales han situado la tasa de extracción completa en torno a un 93,5 y un 95,1%2,23.
El sistema láser excimer permite la extracción de electrodos de DEIC incluso cuando el sistema venoso está parcial o totalmente ocluido (fig. 4). La complejidad de los pacientes tratados en las series más recientes viene definida tanto por la antigüedad de los electrodos extraídos como por la elevada prevalencia de alteraciones en la permeabilidad del eje venoso del miembro superior con el DEIC4,7,24,25. En nuestra serie, la flebografía preoperatoria mostró, al menos, un grado moderado de estenosis en el eje venoso del DEIC en un 36,2% de los pacientes y una oclusión completa en el 14,9% de los casos7. De hecho, hemos reportado una tasa de repermeabilización venosa tras el uso del láser excimer superior al 80% en trombosis totales7.
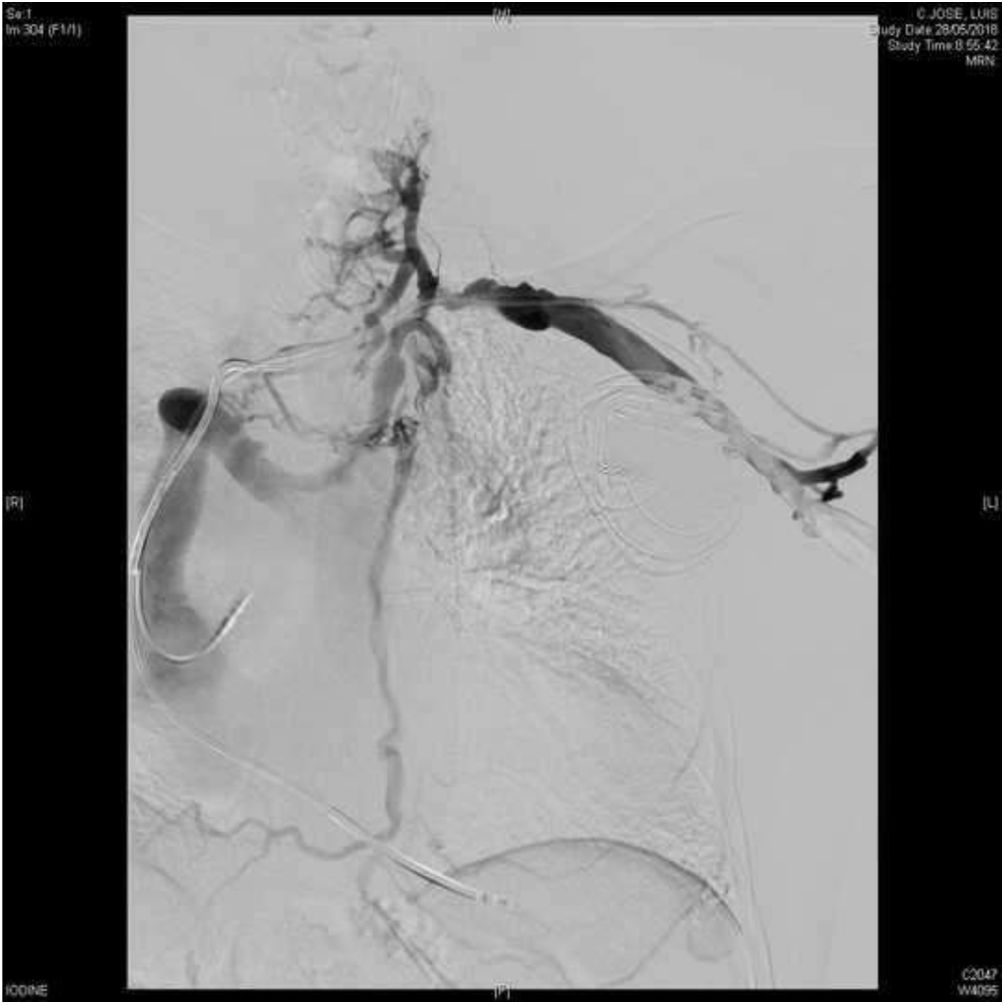
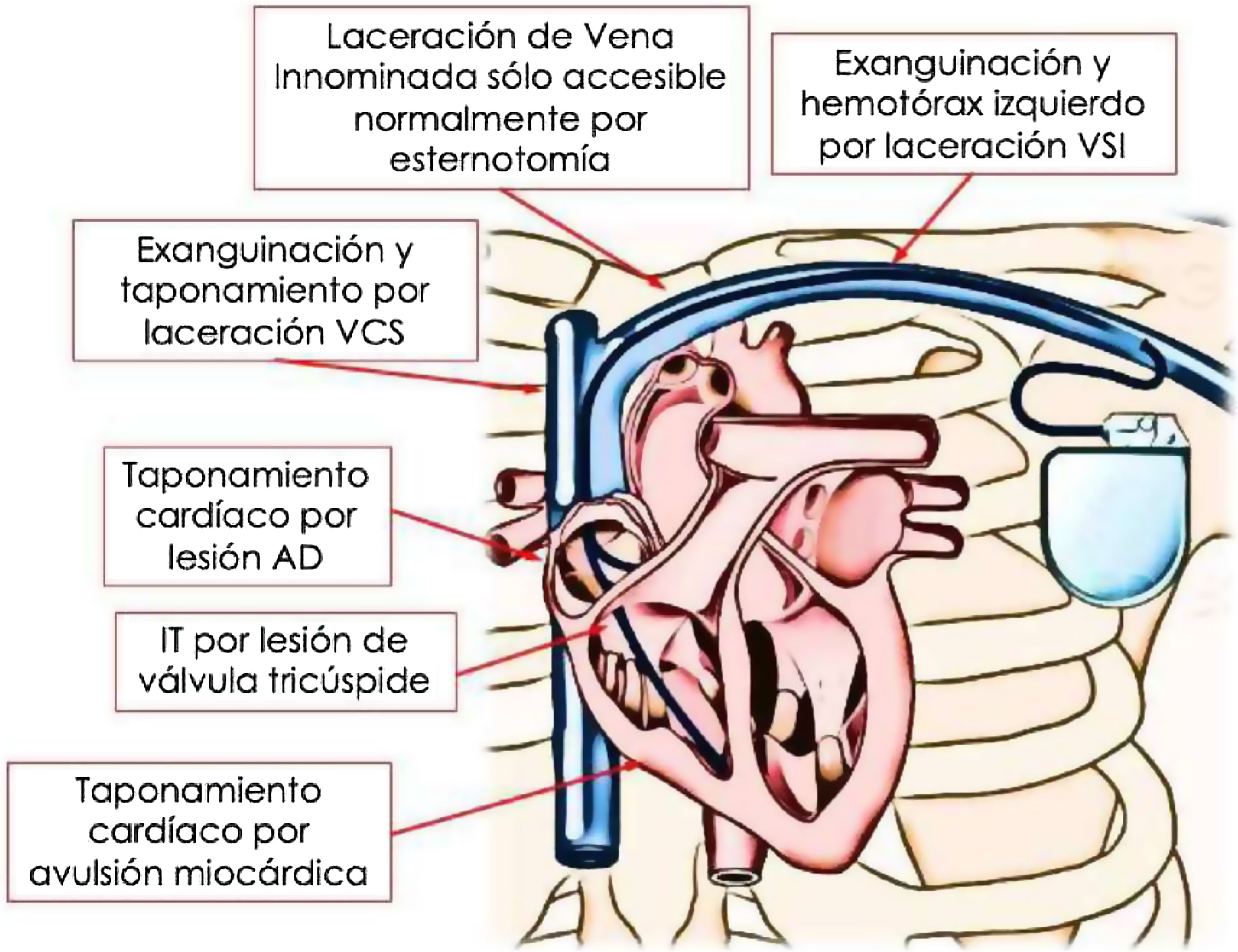
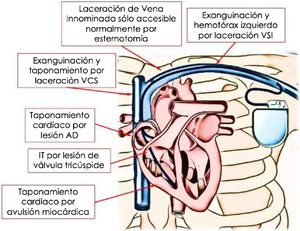
Las complicaciones cardiovasculares durante la EET pueden ocurrir incluso sin el empleo de vainas potenciadas (radiofrecuencia, rotacionales o láser) en pacientes de bajo riesgo, incluyendo un 2,5% de complicaciones mayores y un 0,6% de mortalidad5. La figura 5 muestra las principales complicaciones cardiovasculares que se pueden producir durante la extracción de electrodos de DEIC con vaina láser excimer.
El grupo de la Cleveland Clinic reportó que, incluso en ausencia de complicaciones cardiovasculares, lesiones a nivel microscópico en la pared venosa se pueden identificar hasta en un 15,6% de los pacientes sometidos a EET10. Dicho porcentaje se elevó a un 29% de lesiones venosas en el subgrupo de pacientes que habían tenido alguna complicación cardiovascular mayor10.
El principal factor de riesgo independiente para las complicaciones cardiovasculares mayores fue la extracción de un electrodo bibobina de DAI, que incrementó el riesgo en 28 veces respecto a otros tipos de electrodos, seguida de la oclusión completa del eje venoso ipsilateral, con un riesgo casi 14 veces superior en dichos pacientes; y finalmente, la antigüedad del electrodo en años con incremento del riesgo de complicación mayor del 42,7% por año7. Otros factores de riesgo identificados en la literatura son un índice de masa corporal<25kg/m222, enfermedad cerebrovascular, FEVI≤15%, trombocitopenia, rango internacional normalizado>1,223, antigüedad del electrodo mayor de 5 años, hipertensión arterial y diabetes mellitus10.
Más recientemente, el estudio Canadian Lead ExtrAction Risk (CLEAR)24 identificó varios factores de riesgo asociados a efectos adversos durante el procedimiento de EET. Entre los predictores de perforación vascular se encontraban la ausencia de historia de cirugía cardíaca, el sexo femenino, la función sistólica del ventrículo izquierdo preservada, la edad del electrodo superior a los 8 años, la extracción de 2 o más electrodos, y la diabetes. La asociación con la ausencia de cirugía cardíaca se ha basado en el efecto protector que causarían las adherencias pericárdicas, hipótesis basada en datos de estudios con animales, que objetivaron adherencias significativas tras la apertura del pericardio en el área del ventrículo y aurícula derechas.
Yagishita et al.25 encontraron que, en población anciana de más de 80 años, la extracción con láser excimer puede ser segura y reproducible en pacientes de bajo índice de masa corporal, sin diferencias respecto a pacientes de menor edad en la ratio de retirada completa y de complicaciones mayores25.
Por otra parte, para poder identificar estas complicaciones en un menor tiempo y poder manejar una laceración vascular desde su aparición, se han propuesto distintas alternativas para reducir el riesgo intraoperatorio. La monitorización mediante toracoscopia videoasistida por acceso uniportal durante la extracción de electrodos con láser excimer puede ser segura y no reduce el tiempo operatorio ni la estancia hospitalaria en los grupos que lo han empleado26. Esta técnica podría ser útil para la detención de complicaciones graves, no obstante, necesitaría de operadores experimentados para permitir el manejo directo del sangrado.
Diversos autores han reportado tasas de complicaciones cardiovasculares mayores entre el 1,8-5,2%11,18,20,27–29, siendo la localización más frecuente de las lesiones la VCS, seguida del ventrículo derecho11,12. A pesar de su baja frecuencia, estas complicaciones cardiovasculares mayores requieren normalmente una reparación compleja y su mortalidad es notablemente elevada. En una revisión del registro Manufacturer and User Facility Device Experience (MAUDE) de la Food and DrugAdministration, la mortalidad de las complicaciones durante la extracción con láser que requirieron tratamiento urgente se situó por encima del 50%30. Gaca et al. publicaron una mortalidad del 75% en análogas condiciones en una serie retrospectiva de la Universidad de Duke31. Más recientemente, Brunner et al. describieron una mortalidad del 36% en los pacientes con tratamiento urgente abierto o endovascular durante la EET11. En 2017, el estudio multicéntrico European Lead ExtractionConTRolled (ELECTRa)29 reveló que 49 de los 3.555 pacientes enrolados experimentaron una complicación cardiovascular mayor durante la EET mediante diferentes técnicas. En ese subgrupo de pacientes que requirió un tratamiento urgente se registraron 12 muertes, lo que supuso una mortalidad del 24,5%18. Las complicaciones de estas técnicas de extracción se concentran en la parte inicial de la curva de aprendizaje3,7.
ConclusionesLa EET de DEIC mediante láser excimer presenta una excelente eficacia y seguridad incluso en pacientes de alto riesgo, obteniendo tasas de éxito completo del procedimiento y tasas de éxito clínico superiores al 95% en la mayoría de las series reportadas en la literatura.
El uso del sistema de extracción de electrodos de DEIC láser excimer requiere una estrecha colaboración multidisciplinar «Heart Team» en un entorno apropiado para el procedimiento, con adecuado entrenamiento del personal implicado.
Las complicaciones cardiovasculares mayores asociadas al empleo de las vainas láser son infrecuentes, pero potencialmente letales. Su identificación y tratamiento precoz es fundamental para la supervivencia del paciente. Estas complicaciones se concentraron en la parte inicial de la curva de aprendizaje.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses con respecto a este estudio.