La implantación de prótesis valvulares aórticas transcatéter (TAVI) ha representado una verdadera revolución en el tratamiento de la estenosis aórtica grave y sintomática. Varios avances han propiciado un aumento significativo en el número de implantes, así como una disminución gradual de las complicaciones asociadas. Un factor clave para el éxito de la TAVI ha sido el papel desempeñado por las técnicas de imagen cardiaca no invasivas en la planificación previa al procedimiento y en la selección de candidatos. Estas técnicas permiten determinar el tipo y tamaño de la prótesis a implantar, prever los riesgos, evaluar la idoneidad del acceso vascular, supervisar el procedimiento y realizar un seguimiento después del implante. En esta revisión se analiza el papel de las técnicas de imagen no invasivas antes, durante y después de la implantación de una prótesis aórtica transcatéter.
Transcatheter aortic valve implantation (TAVI) has been a true revolution in the treatment of severe symptomatic aortic stenosis. Various advances have led to an exponential growth in the number of implants and a progressive reduction in their complication rate. One key factor in the success of TAVI has been the role of non-invasive cardiac imaging techniques in pre-procedural planning and candidate selection. These techniques enable the determination of the type and size of the prosthetic valve to be implanted, prediction of risks, assessment of the suitability of vascular access, procedure monitoring, and post-implant follow-up. This review addresses the role of non-invasive imaging techniques before, during, and after transcatheter aortic valve implantation.
En los últimos años, el implante de prótesis valvular aórtica transcatéter (TAVI) ha supuesto una auténtica revolución en el manejo de la estenosis aórtica grave. Diversos avances han permitido un crecimiento exponencial del número de implantes y una reducción progresiva de su tasa de complicaciones. Uno de los factores clave del éxito de la TAVI ha sido el papel de las técnicas de imagen cardiaca no invasivas en la planificación previa al procedimiento y en la selección de candidatos. Estas técnicas permiten la determinación del tipo y tamaño de la prótesis a implantar, la predicción de los riesgos, la valoración de la idoneidad del acceso vascular, la monitorización del procedimiento y el seguimiento post-implante1–5. En esta revisión se aborda el papel de las técnicas de imagen no invasiva antes, durante y después del implante de una prótesis aórtica transcatéter.
Evaluación pre-procedimientoEl primer pilar de la evaluación previa a un procedimiento de TAVI es la ecocardiografía transtorácica (ETT). El estudio ecocardiográfico debe incluir, entre otros elementos, la valoración de la morfología valvular aórtica, el grado y localización del calcio valvular y perivalvular, la hemodinámica de la válvula aórtica (velocidad máxima transvalvular, gradiente medio, área valvular y volumen sistólico), las dimensiones de la raíz aórtica y aorta torácica, el tamaño y función del ventrículo izquierdo (fracción de eyección, función diastólica), su motilidad parietal y la posible presencia de trombos intracavitarios, el grado de hipertrofia ventricular izquierda y la morfología septal, la presencia de otras valvulopatías concomitantes o de obstrucción subaórtica, el tamaño y función del ventrículo derecho y la estimación de la presión arterial pulmonar2,6.
El segundo pilar de la evaluación pre-TAVI es la tomografía computarizada (TC). Su papel ha ido ganando relevancia con el paso de los años hasta convertirse en un elemento imprescindible en la planificación pre-procedimiento7. Los tomógrafos de última generación ofrecen importantes ventajas para los pacientes, ya que permiten obtener imágenes con mayor detalle y fiabilidad para el diagnóstico en menos tiempo, con menos dosis de radiación y menor cantidad de contraste.
El estudio de TC pre-TAVI debe incluir una adquisición del volumen cardiaco (o al menos del anillo aórtico) sincronizada con el electrocardiograma, y una adquisición de la aorta y de los accesos vasculares que no precisa sincronismo cardiaco, todo ello idealmente en un protocolo con una única dosis de contraste. La adquisición del volumen cardiaco debe realizarse al menos en fase sistólica, ya que las dimensiones del anillo aórtico suelen ser máximas en esta fase, aunque la adquisición de todo el ciclo cardiaco aporta información adicional. Los tomógrafos con detectores de 16cm de cobertura permiten la adquisición axial prospectiva de todo el volumen cardiaco en un único latido. Con equipos con cobertura limitada del detector, la adquisición retrospectiva permite adquirir todo el ciclo cardiaco y ofrece mayor flexibilidad y menor probabilidad de artefactos en caso de variabilidad de la frecuencia cardiaca que la técnica prospectiva. No suele ser necesario realizar una adquisición sin contraste, si bien el score de calcio valvular aórtico puede ser útil en caso de incertidumbre en cuanto a la gravedad de la estenosis. El uso rutinario de betabloqueantes no está recomendado, aunque se pueden emplear con cautela en casos seleccionados, especialmente si se pretende valorar el árbol coronario y evitar una coronariografía invasiva. La nitroglicerina sublingual se considera contraindicada en estos enfermos7.
La TC puede proporcionar información adicional acerca de la gravedad de la estenosis aórtica; el valor del score de calcio de la válvula aórtica permite establecer una clasificación de acuerdo a la probabilidad de que se trate de una estenosis grave: altamente probable (>3.000 unidades Agatston [UA] en varones o ≥1.600 UA en mujeres), probable (≥2.000 UA en varones o ≥1.200 UA en mujeres) o improbable (<1.600 UA en varones o <800 UA en mujeres)8. Además, el área del tracto de salida del ventrículo izquierdo estimada mediante TC puede combinarse con los parámetros Doppler obtenidos mediante ecocardiografía para recalcular mediante imagen «híbrida» el área valvular aórtica9, con un valor de corte para establecer gravedad <1,2 cm2.
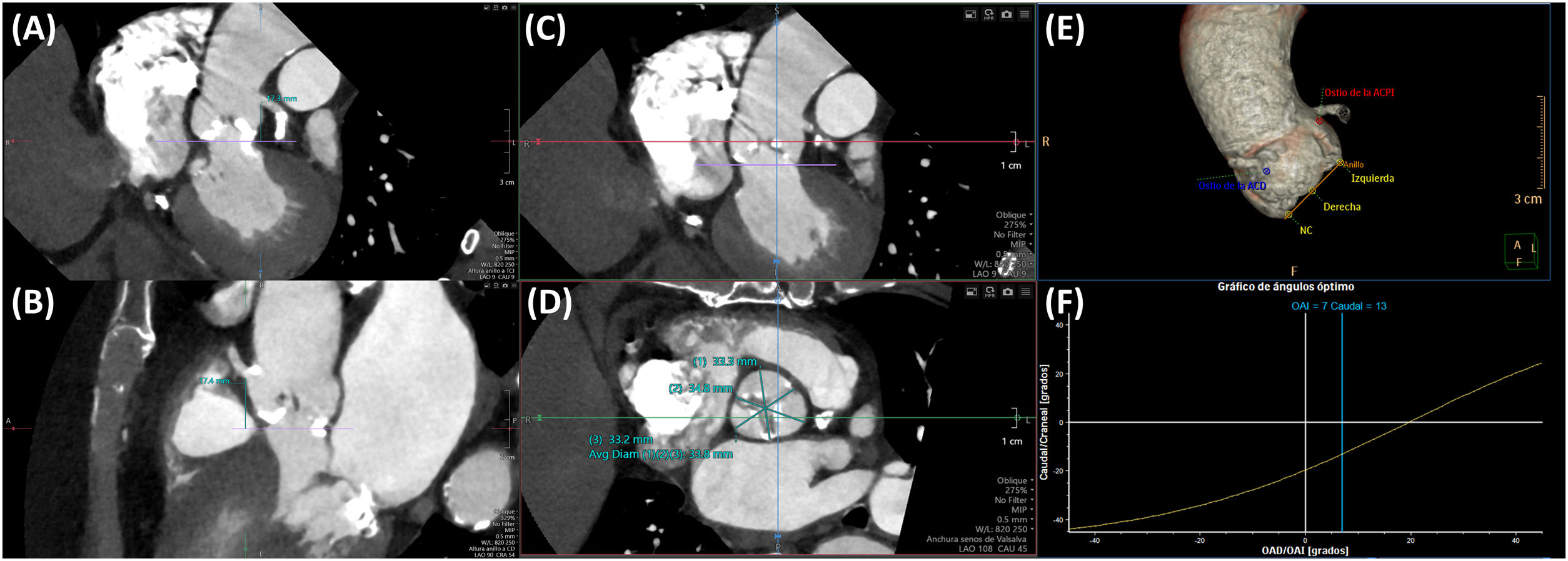
El tamaño de la prótesis a implantar se decide con base en las dimensiones del anillo valvular aórtico, que se define por el contorno luminal del plano virtual que une los puntos más bajos (nadires) de las inserciones de las sigmoideas en la raíz aortica10. Este plano se puede determinar manualmente7 o con ayuda de software de post-procesado semiautomático. Es importante realizar la medición del anillo en el momento del ciclo cardiaco en el que sus dimensiones sean máximas, lo que generalmente ocurre en mesosístole, y se debe determinar el área y el perímetro, así como sus correspondientes diámetros derivados (Fig. 1A). Tradicionalmente, el tamaño de las prótesis expandibles con balón se establece de acuerdo al área del anillo, mientras que el de las prótesis autoexpandibles se decide con base en el perímetro.
Otro parámetro a tener en cuenta es la morfología valvular. La valvulopatía aórtica bicúspide se puede asociar con anillos de mayor tamaño y más ovalados, calcificación valvular prominente y asimétrica, y aortopatía, lo que a su vez puede entrañar mayor riesgo de regurgitación periprotésica y de otras complicaciones11. Se ha propuesto una clasificación de la valvulopatía aórtica bicúspide en tres tipos, con base en el número de comisuras y la presencia o no de rafe12: tricomisural (también conocida como válvula aórtica bicúspide funcional o adquirida), bicomisural con rafe (cuando existe un rafe que no alcanza la altura de la comisura), y bicomisural sin rafe. En el caso de la morfología bicomisural sin rafe (Sievers tipo 0) los senos de Valsalva sólo presentan dos nadires, lo que complica la determinación del plano anular, ya que por dos puntos se pueden trazar infinitos planos. En estos casos, el plano óptimo en el que debemos medir el anillo valvular aórtico se obtiene basculando el plano de corte transversal en torno al eje que resulta de unir esos dos nadires hasta conseguir la menor área luminal13.
Es importante valorar la localización y el grado de calcificación valvular, anular y subanular (a nivel del tracto de salida del ventrículo izquierdo) (Fig. 1B), que determinan el riesgo de complicaciones. Así, la presencia de calcificación a nivel del borde libre de las sigmoideas coronarianas se asocia a un mayor riesgo de oclusión coronaria, mientras que la calcificación anular y subanular predice un mayor riesgo de regurgitación periprotésica, rotura del anillo y, cuando se localiza subyacente a la sigmoidea no coronariana, trastornos de la conducción aurículo-ventricular14. La longitud del septo membranoso en el plano coronal es un marcador de la distancia entre el anillo valvular aórtico y el haz de His, de forma que una longitud <8mm constituye otro predictor de desarrollo de bloqueo aurículo-ventricular de alto grado15.
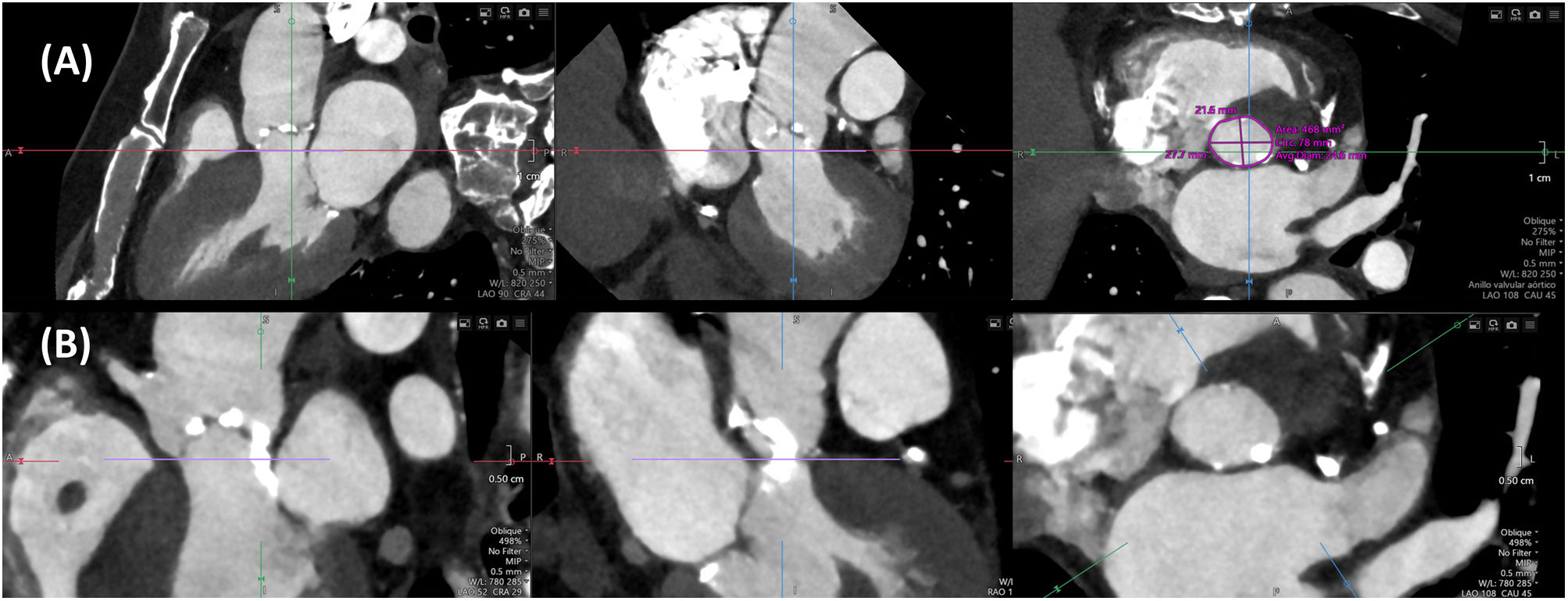
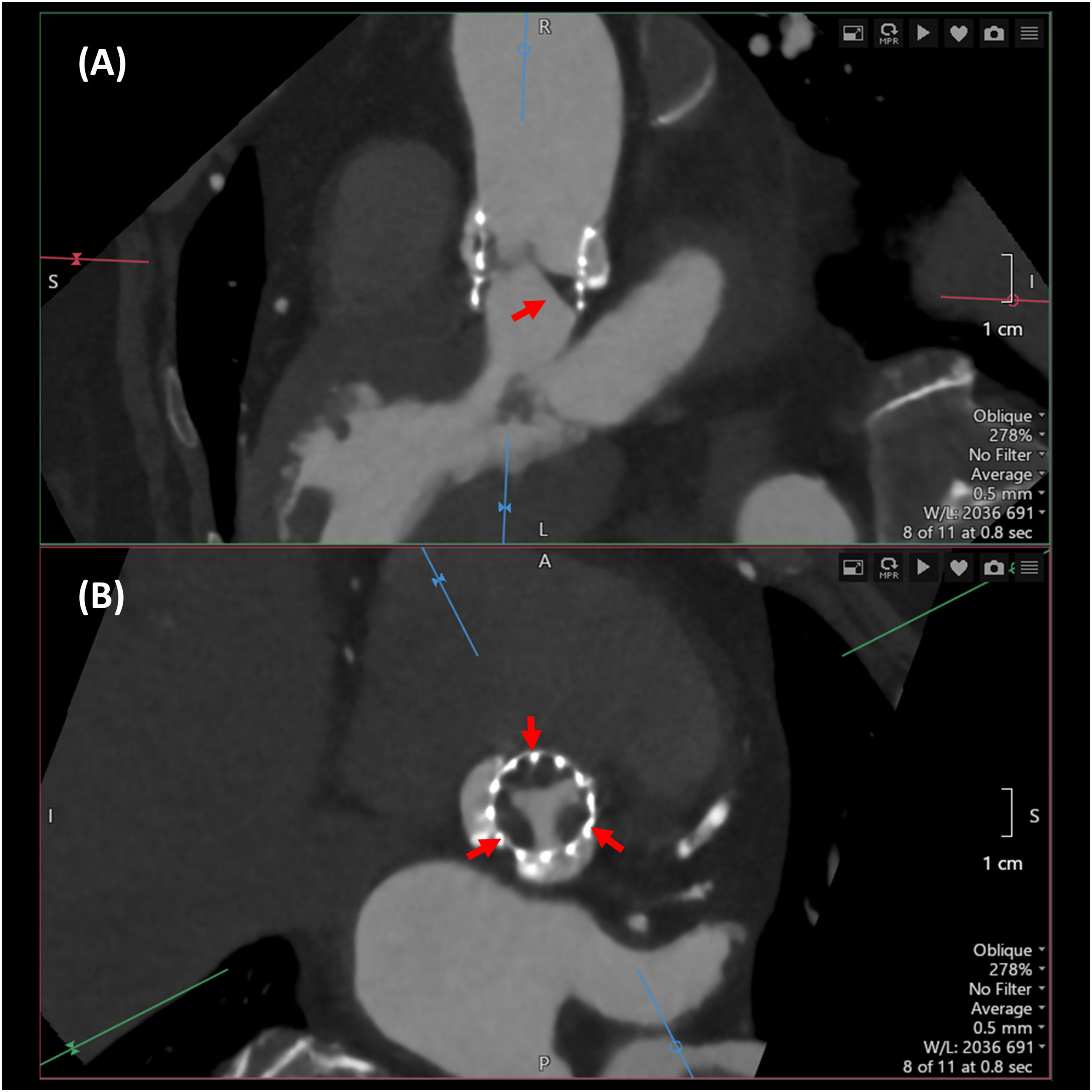
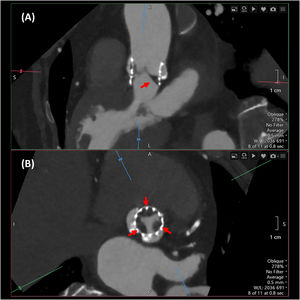
La altura desde el plano anular aórtico hasta el origen de las arterias coronarias (Fig. 2A y 2B) es otro determinante del riesgo de oclusión coronaria que se incrementa con una altura inferior a 12mm, aunque no constituye una contraindicación absoluta para el implante. También es importante medir el diámetro de los senos de Valsalva, la unión sinotubular y la aorta ascendente. La medición a nivel de los senos de Valsalva (Fig. 2C y 2D) debe realizarse de seno a comisura opuesta, con el plano de corte paralelo al del anillo valvular aórtico; unos diámetros inferiores a 30mm incrementan el riesgo de oclusión coronaria, ya que se reduce el espacio para acomodar el calcio que se proyecta en los senos de Valsalva tras el despliegue protésico. Debe medirse, asimismo, la altura de los senos de Valsalva desde el plano anular hasta la unión sinotubular.
(A) y (B): medición de la altura desde el anillo hasta los ostia coronarios mediante TC; (A): tronco de la coronaria izquierda; (B): arteria coronaria derecha. (C) y (D): medida de los senos de Valsalva, de seno a comisura. (E) y (F): predicción de la proyección coplanar óptima mediante TC.
Del mismo modo, la tomografía computarizada permite predecir la proyección más adecuada del arco de fluoroscopia que alinee los nadires de los senos de Valsalva («proyección de trabajo» o coplanar) (Fig. 2E y 2F), así como la que permite superponer los senos de Valsalva coronarianos y aislar el seno no coronariano («cuspoverlap»), contribuyendo de esta forma a reducir el tiempo de escopia y el uso de contraste16.
En procedimientos de implante «valve-in-valve», las dimensiones de la bioprótesis valvular aórtica quirúrgica indicadas por el fabricante se pueden usar para determinar el tamaño de la prótesis transcatéter a implantar en su interior; la aplicación móvil «ViV aortic» es útil en estos casos. Si se desconoce el tamaño de la bioprótesis quirúrgica, las dimensiones internas de su anillo basal se pueden determinar mediante TC.
El riesgo de oclusión coronaria en los procedimientos «valve-in-valve» es mayor que en la valvulopatía nativa, ya que durante el despliegue de la prótesis transcatéter los velos de la prótesis quirúrgica son proyectados hacia los senos de Valsalva, creando un cilindro que puede sellar el flujo coronario a nivel de la unión sinotubular, dando lugar a un «secuestro de senos». Además de las alturas a los ostia coronarios, en caso de prótesis biológicas quirúrgicas con soporte, si los velos de dichas prótesis se extienden por encima de los orígenes de las arterias coronarias, deben determinarse las distancias virtuales de la prótesis transcatéter simulada a los ostia coronarios (VTC) y a la unión sinotubular (VTSTJ)17. Estas distancias se pueden evaluar mediante reformateo multiplanar y trazando una región de interés circular de un diámetro específico que simule la prótesis transcatéter desplegada, o bien mediante software dedicado. Si la VTC es inferior a 4mm, o bien el velo se extiende por encima de la unión sinotubular y la VTSTJ es estrecha (<3,5mm) se considera que el riesgo de oclusión coronaria es elevado. En estos casos, el procedimiento BASILICA (laceración del velo problemático antes del despliegue de la prótesis transcatéter) o el implante de stents coronarios «en chimenea» pueden reducir dicho riesgo. Si las arterias coronarias se originan por encima de los velos de la prótesis quirúrgica, no hay riesgo de oclusión coronaria. En el caso de prótesis valvulares quirúrgicas «stentless» y sin sutura, se puede proceder de forma similar a los casos de valvulopatía nativa, valorando el riesgo mediante la altura de las coronarias y la anchura de los senos de Valsalva.
La TC puede emplearse para despistaje de enfermedad coronaria previo a TAVI. Su valor predictivo negativo para descartar estenosis significativas a nivel de los segmentos proximales del árbol coronario es elevado18, permitiendo evitar la coronariografía invasiva pre-TAVI en más del 40% de los casos19. La importante prevalencia de factores desfavorables para la adecuada interpretación del estudio en esta población de edad avanzada, como la presencia de calcificaciones coronarias o fibrilación auricular, así como las precauciones señaladas previamente para la optimización farmacológica de la coronariografía no invasiva, son limitaciones a tener en cuenta.
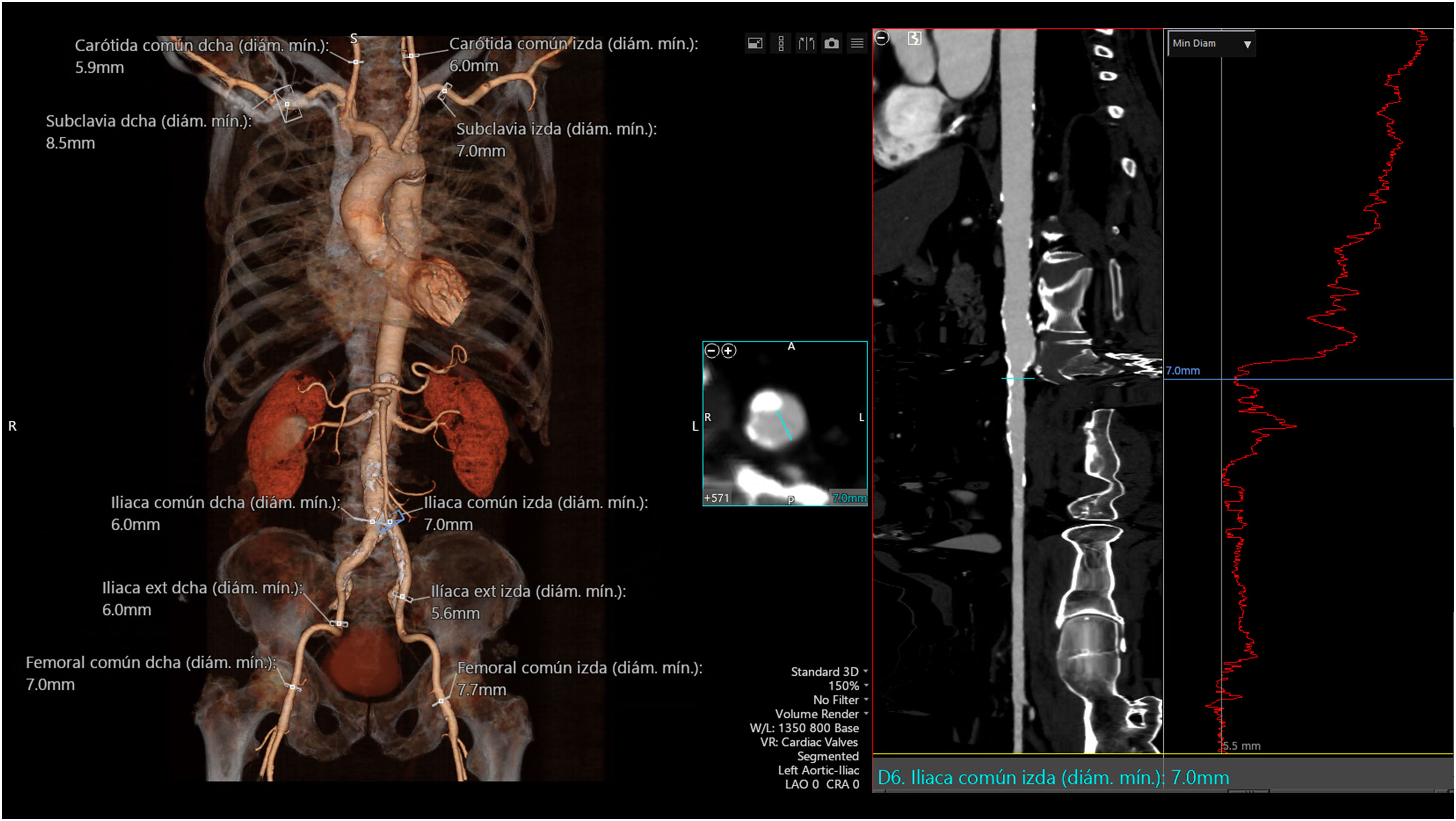
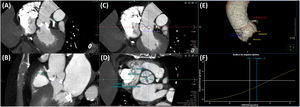
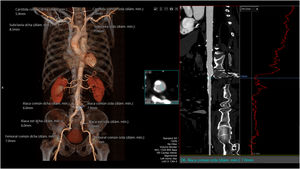
La TC también permite evaluar el acceso vascular y establecer la idoneidad del abordaje transfemoral o, en su caso, la de accesos alternativos (subclavio, axilar, carotídeo, transaórtico, transcava o transapical) (Fig. 3). La valoración debe incluir el diámetro mínimo de la luz del trayecto arterial (medido de forma perpendicular al eje largo del vaso), el grado y la localización de la calcificación vascular (especialmente si presenta más de 270° de extensión circunferencial o afecta a la pared anterior de la zona de punción vascular), el grado de tortuosidad, la altura de la bifurcación femoral (tomando como referencia la cabeza femoral) y toda la patología vascular (oclusiones, aneurismas, disecciones) que afecte al trayecto arterial. Las recomendaciones en cuanto a diámetro vascular, dependen del sistema de liberación de la prótesis a implantar, pero en general se requiere un diámetro luminal mínimo de al menos 5,5-6mm en ausencia de calcificación o tortuosidad graves. En casos de abordaje transapical, la TC permite predecir el punto óptimo de acceso intercostal.
Aunque durante los primeros años tras la introducción del procedimiento, la ecocardiografía transesofágica (ETE) se consideraba imprescindible20–22, su importancia ha decrecido conforme la TC ha ganado terreno. La ETE pre-TAVI23,24 puede resultar útil si el estudio de TC no está disponible, está contraindicado o es de calidad subóptima, pudiendo realizarse como parte de la valoración previa al procedimiento o como el paso inicial de la monitorización intraprocedimiento.
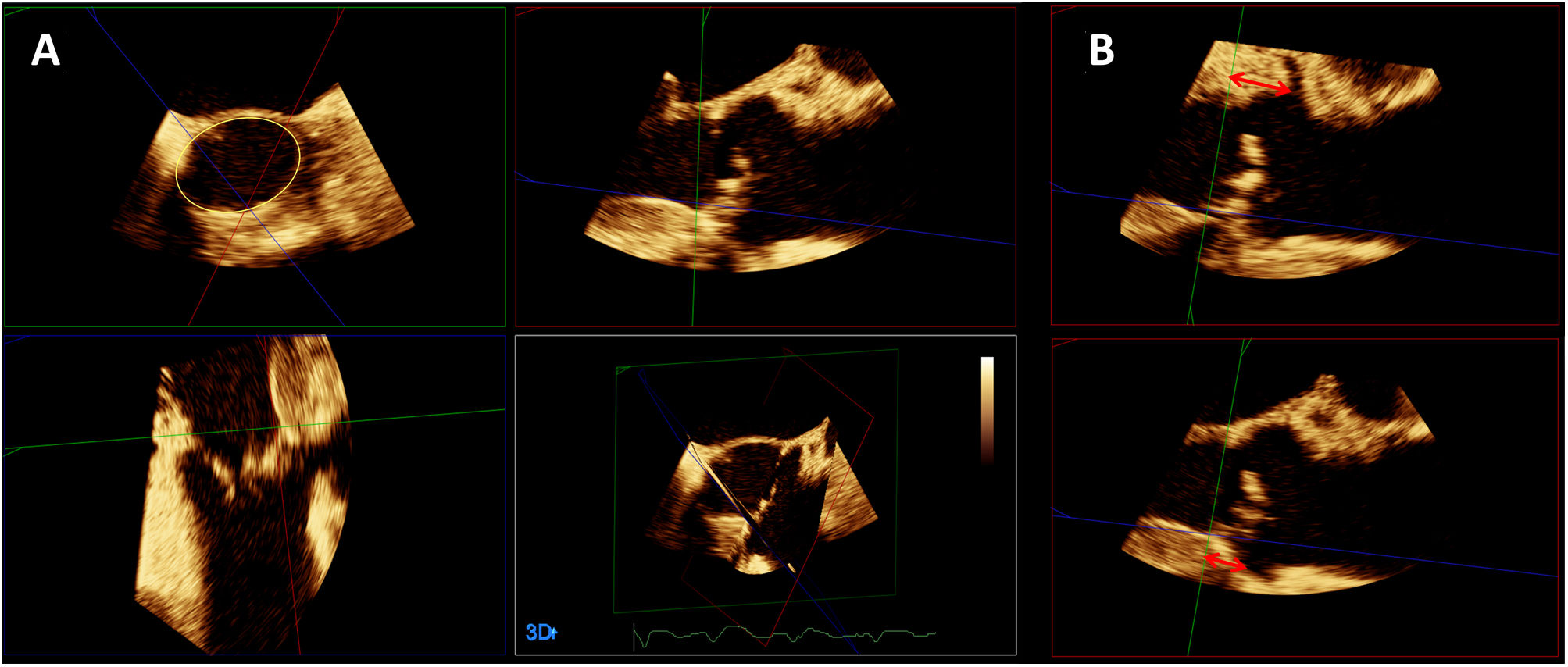
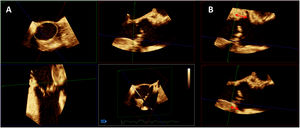
La ETE puede proporcionar información adicional a la ETT con respecto a la morfología valvular, la gravedad de la estenosis, la raíz aórtica, el septo interventricular, la presencia de valvulopatías concomitantes y otra patología asociada. El uso de ecógrafos y sondas con capacidad tridimensional es particularmente útil. Mediante ETE 3D y reformateo multiplanar podemos determinar las dimensiones del anillo valvular aórtico (Fig. 4A), ya sea como alternativa razonable a la TC o como técnica complementaria. La ETE tiene la ventaja de que permite múltiples mediciones repetibles, pero presenta una serie de limitaciones, como la presencia de artefactos de «blurring» y menor resolución lateral, habiéndose reportado una ligera infraestimación sistemática en las mediciones del anillo con respecto a la TC25. También permite valorar la morfología valvular, el grado y localización de la calcificación, las dimensiones de la raíz aórtica y la altura desde el plano anular aórtico hasta los orígenes de las coronarias (ya sea mediante ETE 3D y reformateo multiplanar en el caso del ostium coronario izquierdo, o en el plano 2D de eje largo medioesofágico en el caso del ostium coronario derecho) (Fig. 4B).
Monitorización intra-procedimientoLa monitorización del procedimiento se lleva a cabo fundamentalmente mediante fluoroscopia, cuyos requisitos óptimos incluyen idealmente un sistema de última generación con un amplio campo de visión, ya sea montado en el techo o en el suelo, en lugar de un sistema portátil3. La guía suplementaria mediante ecocardiografía, ya sea transesofágica o transtorácica, ofrece ventajas e inconvenientes. La utilidad más importante de la ETE en este contexto se basa en su capacidad de detección precoz de complicaciones, pero requiere al menos de sedación moderada. Aunque durante los primeros años tras la introducción del procedimiento la monitorización mediante ETE se consideraba imprescindible, la incidencia de complicaciones se ha ido reduciendo considerablemente con el paso del tiempo, por lo que cada vez más grupos han abogado por lo que se conoce como «TAVI minimalista», empleando sedación consciente y prescindiendo de la anestesia general y del ETE, especialmente en procedimientos realizados por vía transfemoral.
La ecografía vascular es útil para determinar la zona más adecuada de punción arterial y para reducir las complicaciones vasculares26. En los abordajes por vía transapical, la ETT permite localizar el espacio intercostal óptimo para el acceso.
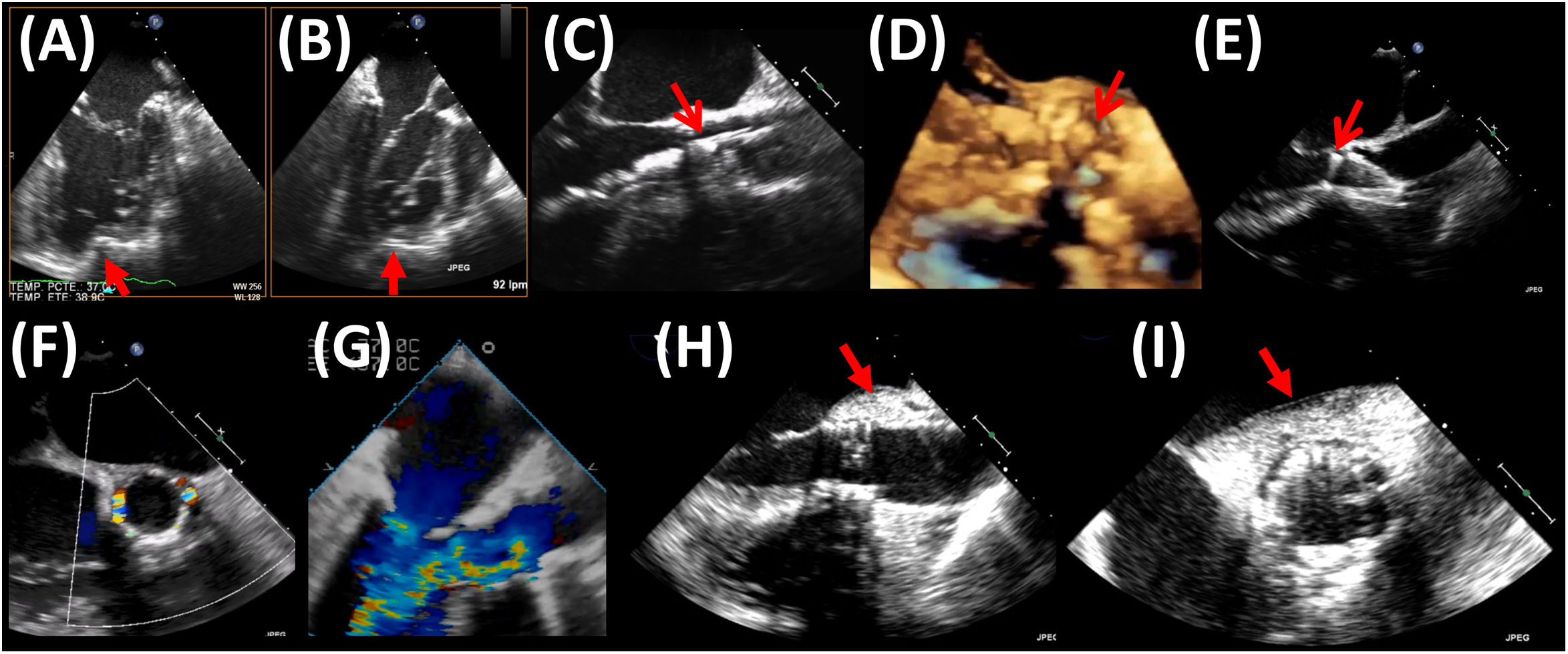
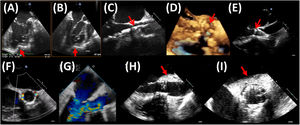
En caso de que se emplee ETE, debe realizarse en primer lugar un estudio ecocardiográfico basal completo23, que servirá como referencia en caso de sospecha de complicaciones durante el procedimiento. En el caso de procedimientos por vía transapical, el punto más adecuado de punción a nivel del ápex del ventrículo izquierdo se puede confirmar mediante palpación digital monitorizada mediante ETE (Figs. 5A y 5B). Durante el procedimiento, la ETE permite realizar un seguimiento de guías y catéteres y valorar su posible interferencia con las cuerdas tendinosas mitrales27, así como evaluar la eficacia y resultado de la valvuloplastia (en caso de que se lleve a cabo) y el comportamiento del calcio valvular durante la misma. También puede complementar a la fluoroscopia en el posicionamiento de la prótesis previo al despliegue28, sobre todo en el caso de las prótesis expandibles con balón, para las que el criterio para un correcto posicionamiento consiste en que el borde aórtico de la prótesis se sitúe entre el borde libre de las sigmoideas y la unión sinotubular (Figs. 5C y 5D); aunque menos útil, si se trata de prótesis autoexpandibles, el borde ventricular del stent visualizado mediante ETE debería situarse entre 3 y 5mm por debajo del plano del anillo (Fig. 5E). El despliegue puede monitorizarse mediante ETE 2D o 3D29. Como ya se comentó con anterioridad, la TC pre-procedimiento permite predecir la proyección óptima de fluoroscopia para el implante, con los tres nadires alineados en el mismo plano, siendo el central el coronariano derecho. Asimismo, puede resultar útil predecir la proyección de superposición de senos, que aisla el seno no coronariano y permite el alineamiento comisural entre la válvula aórtica nativa y la prótesis. La imagen de fusión (eco-fluoroscopia y/o TC-fluoroscopia) podría ser de utilidad para reducir la dosis de radiación y de contraste, si bien sus ventajas son inferiores a las que puede proporcionar en otros procedimientos de intervencionismo estructural.
(A) y (B): detección mediante ETE (planos ortogonales) de la impronta del dedo del operador indicando el punto de punción apical (flechas). (C), (D) y (E): posicionamiento mediante ETE de prótesis transcatéter previo al despliegue; (C): ETE 2D y (D): ETE 3D de una prótesis expandible con balón; las flechas señalan el borde aórtico de la prótesis plegada; (E): ETE 2D de una prótesis autoexpandible; la flecha indica el borde ventricular de la prótesis. (F) y (G): ejemplos de regurgitación (F) periprotésica (en eje corto) y (G) intraprotésica (en eje largo). (H) e (I): hematoma periaórtico post-implante de una prótesis valvular aórtica transcatéter; (H): eje largo; (I): eje corto.
Tras el despliegue, la posibilidad de obtener de forma simultánea 2 planos ecocardiográficos ortogonales (eje largo y eje corto) de la prótesis es muy útil para llevar a cabo una valoración rápida del resultado. La ETE nos permite evaluar el correcto posicionamiento de la prótesis y la posible presencia de insuficiencia intraprotésica (plano de corte a través de la prótesis) o periprotésica (plano de corte situado a nivel del tracto de salida del ventrículo izquierdo, por debajo del plano protésico). Al contrario que la ecocardiografía, con frecuencia la angiografía no permite determinar el origen ni el mecanismo de una regurgitación protésica, información que tiene implicaciones terapéuticas (Figs. 5F y 5G). La valoración del grado de regurgitación tras el implante de una prótesis transcatéter mediante ecocardiografía debe ser multiparamétrica30. Un parámetro particularmente útil consiste en la evaluación de la extensión circunferencial de la regurgitación mediante Doppler color, de forma que una extensión inferior al 10% correspondería a una insuficiencia leve, y una superior al 20%, a una insuficiencia grave. Ya sea mediante ETE o ETT, tras el despliegue debe valorarse asimismo la morfología de la prótesis, la hemodinámica protésica, la función sistólica global y segmentaria del ventrículo izquierdo y la permeabilidad de los ostia coronarios. El desarrollo de alteraciones de la contractilidad segmentaria del ventrículo izquierdo debería levantar la sospecha de oclusión coronaria31. La raíz aórtica y aorta ascendente deben ser evaluadas meticulosamente para descartar rotura del anillo (al espacio pericárdico o al ventrículo derecho), hematoma periaórtico o intramural (Figs. 5H y 5I) o datos de disección aórtica. La aparición aguda de derrame pericárdico puede conducir a un rápido deterioro hemodinámico y debería alertar sobre la posibilidad de rotura del anillo o perforación yatrogénica del ventrículo derecho (si se ha colocado cable de marcapasos endocavitario) o del izquierdo.
Seguimiento post-procedimientoEl seguimiento rutinario tras un procedimiento de TAVI se lleva a cabo fundamentalmente mediante ETT5. Otras técnicas de imagen pueden ser útiles en caso de sospecha de complicaciones.
Se recomienda la realización de un ETT antes del alta o en los 30 días siguientes al implante, tras seis meses y al año, y posteriormente de forma anual, o bien cuando aparecen signos y/o síntomas sugestivos de disfunción protésica1,3. El ETT pre-alta proporciona la información basal con la que se compararán futuras evaluaciones.
De acuerdo con el consenso VARC-332, existen cuatro tipos de disfunción valvular bioprotésica: 1) deterioro valvular estructural: cambios permanentes intrínsecos a la prótesis valvular, incluyendo desgaste y rotura, disrupción de un velo, velo «flail», fibrosis y/o calcificación, y fractura o deformación del stent; 2) disfunción valvular no estructural: anomalías no intrínsecas a la prótesis valvular, como regurgitación periprotésica, mismatch prótesis-paciente, posición protésica inadecuada, embolización, u otras; 3) trombosis (subclínica o clínica); 4) endocarditis.
Los estudios ecocardiográficos durante el seguimiento deben incluir una valoración de la posición de la prótesis, su interacción con estructuras adyacentes, la morfología, grosor y movilidad de los velos, la función protésica (incluyendo evidencias de estenosis o regurgitación intra o periprotésica), la presencia de otras valvulopatías, la función biventricular, y la presión arterial pulmonar. En caso de dudas, la ETE puede aportar información adicional; por su parte, la resonancia magnética también permite una evaluación no invasiva de la función protésica y ventricular, y puede ser particularmente útil en caso de dudas sobre la gravedad de una regurgitación protésica.
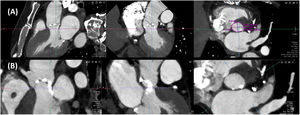
La trombosis de velos es una entidad cada vez más reconocida que puede afectar tanto a las prótesis biológicas transcatéter, como quirúrgicas. La TC es más sensible que la ecocardiografía para la detección de trombosis de velos, y permite valorar tanto el engrosamiento hipoatenuado de los velos, como la restricción de su motilidad, aunque requiere administración de contraste. El engrosamiento hipoatenuado de los velos (hypoattenuated leaflet thickening o HALT) se define como un aumento del grosor de los velos con una morfología típica en menisco en eje largo33, siendo más ancho a nivel de la base del velo y extendiéndose en mayor o menor grado hacia el centro. Se debe valorar tanto la localización del engrosamiento como su extensión, mediante reformateo multiplanar en fase diastólica (Fig. 6). La restricción de la motilidad de los velos (reduced leaflet motion o RELM) consiste en una apertura incompleta de los mismos en sístole, para cuya valoración mediante TC se requiere una adquisición retrospectiva completa de todo el ciclo cardiaco34.
Engrosamiento con hipoatenuación de los velos (flechas) en una prótesis Sapien 3 Ultra. (A): reconstrucción multiplanar en eje largo alineada con el centro de la sigmoidea en posición no coronariana, que muestra un engrosamiento hipoatenuado de dicho velo con la característica forma de cuña o menisco. (B): reconstrucción en eje corto, mostrando un engrosamiento hipoatenuado en la base de los tres velos protésicos.
En pacientes con sospecha de endocarditis infecciosa, la ETT constituye la modalidad de imagen de primera línea, si bien en portadores de una prótesis valvular se recomienda la realización de ETE. La TC es superior a la ecocardiografía para la detección de complicaciones periprotésicas, aunque ésta última sigue siendo superior para la detección de lesiones valvulares y vegetaciones, especialmente si son de pequeño tamaño. La TC cardiaca está indicada cuando la ETE no es concluyente o no es factible, y tanto la TC como la tomografía por emisión de positrones (PET) con flúor-18-fluorodeoxiglucosa (18F-FDG)/TC se recomiendan en pacientes con endocarditis valvular protésica posible (todas ellas indicaciones de clase I, nivel de evidencia B)35. La tomografía por emisión de fotón único (SPECT)/TC es una alternativa cuando la PET/TC no está disponible. La detección de lesiones protésicas o periprotésicas características de endocarditis mediante cualquiera de estas modalidades de imagen, se consideran criterios mayores de endocarditis.
ConclusionesLas técnicas de imagen multimodalidad tienen un papel clave en todos los estadíos del manejo de pacientes con estenosis aórtica grave que son considerados para TAVI. La información proporcionada por estas técnicas tiene relevancia para la selección de candidatos, la planificación y monitorización del procedimiento, la detección de complicaciones y el seguimiento post-implante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.