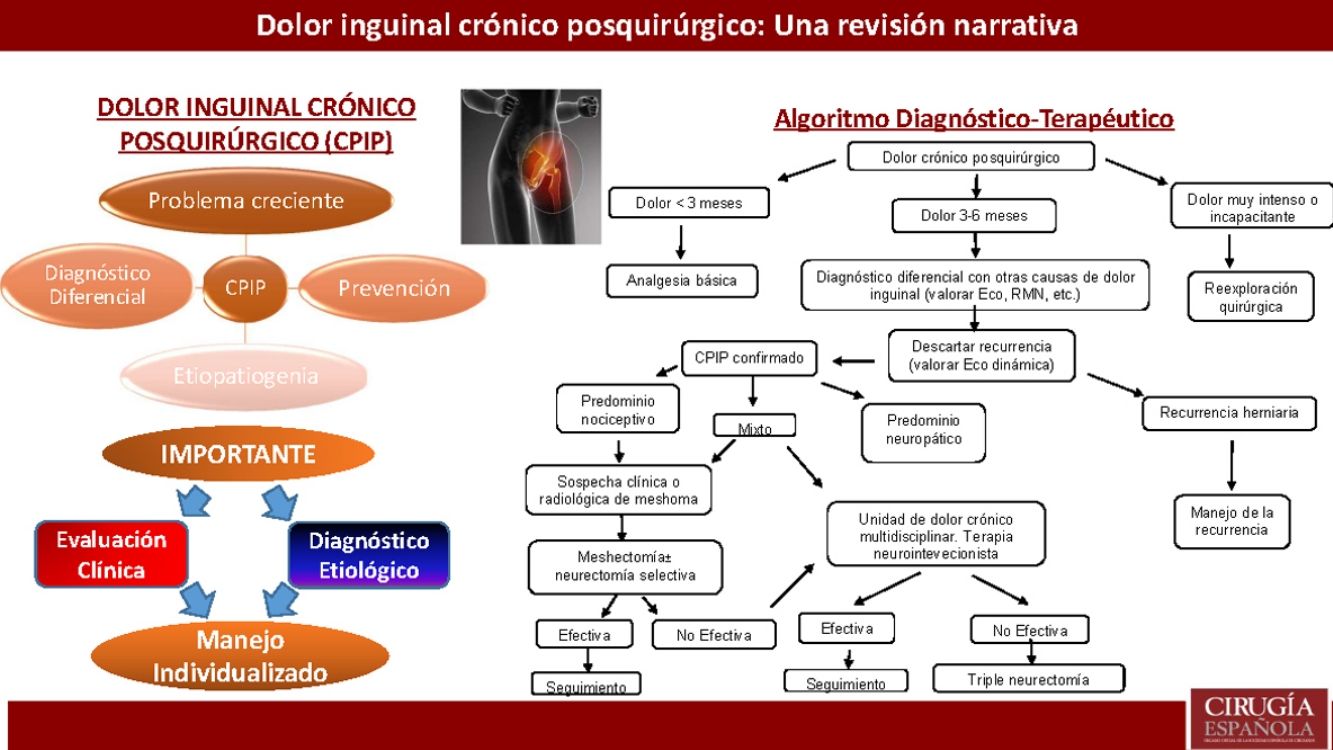
El dolor inguinal crónico posquirúrgico constituye una complicación de incidencia variable entre los pacientes intervenidos de hernia inguinal. La tendencia actual de medición de resultados en términos de calidad de vida (patient reported outcome measurment) ha puesto de manifiesto la importancia de esta complicación, debido a las limitaciones de actividad diaria e implicaciones socioeconómicas que genera. En este artículo se realiza una revisión narrativa de la literatura disponible en las plataformas PUBMED, EMBASE y Cochrane Library y se discuten los principales aspectos concernientes a la epidemiología, etiología, prevención, diagnóstico y tratamiento del dolor inguinal crónico posquirúrgico, proponiéndose un algoritmo para su manejo. Los pacientes que padecen dolor inguinal crónico posquirúrgico presentan un amplio espectro de manifestaciones clínicas y su diagnóstico supone un auténtico desafío. No existe un tratamiento estándar y el éxito del mismo radica en un adecuado diagnóstico etiológico para poner a disposición del paciente el amplio abanico de medidas terapéuticas de las que se dispone de forma individualizada.
Inguinodynia or chronic postoperative inguinal pain is a growing problem between patients who undergo surgical repair of an inguinal hernia. The change in results measurement proposed by many authors towards Patient Reported Outcome Measurement has underlined the importance of chronic postoperative inguinal pain, because of the great limitations in everyday life and the huge socioeconomic impact that it causes. In this article a narrative review of the available literature in PUBMED, EMBASE and Cochrane Library is performed and the most relevant aspects about epidemiology, etiology prevention, diagnosis and treatment of chronic postoperative inguinal pain are discussed. A new management algorithm is also proposed. The variability in its incidence and clinical presentation makes diagnosis of chronic postoperative inguinal pain a very challenging issue. There is no standardized therapy and an adequate etiological diagnosis is key point for a successful treatment. There are many treatment options that have to be sequentially used and adjusted to each patient and their clinical features.
La reparación de una hernia inguinal constituye una de las intervenciones quirúrgicas más realizadas, con más de 20 millones de procedimientos en el mundo1. Gracias al éxito de las técnicas protésicas en la reducción de los índices de recidiva, se ha producido un cambio de percepción entre la comunidad científica en cuanto a la medición de sus resultados. Muchos autores abogan por medir los resultados en términos de incidencia de inguinodinia o de calidad de vida determinados por el propio paciente (Patient-Reported Outcome Measurement)2–4.
La inguinodinia posquirúrgica o dolor inguinal crónico posquirúrgico (DICP) se define como el dolor inguinal de nueva aparición o de características distintas a las del dolor preoperatorio, que persiste más allá de tres meses tras la cirugía inicial y que aparece como consecuencia directa de una lesión nerviosa o afectación del sistema somatosensorial tras la reparación herniaria5,6. Los pacientes que la padecen pueden sufrir importantes limitaciones en sus actividades diarias y su calidad de vida7. Por todo ello, este problema tiene importantes implicaciones socioeconómicas generando grandes costes tanto directos (derivados de la atención sanitaria) como indirectos (incapacitación temporal/permanente, demandas judiciales, etc.)8.
En este artículo, realizamos una revisión narrativa de los distintos aspectos que conciernen a la epidemiología, etiología, prevención, diagnóstico y tratamiento del DICP.
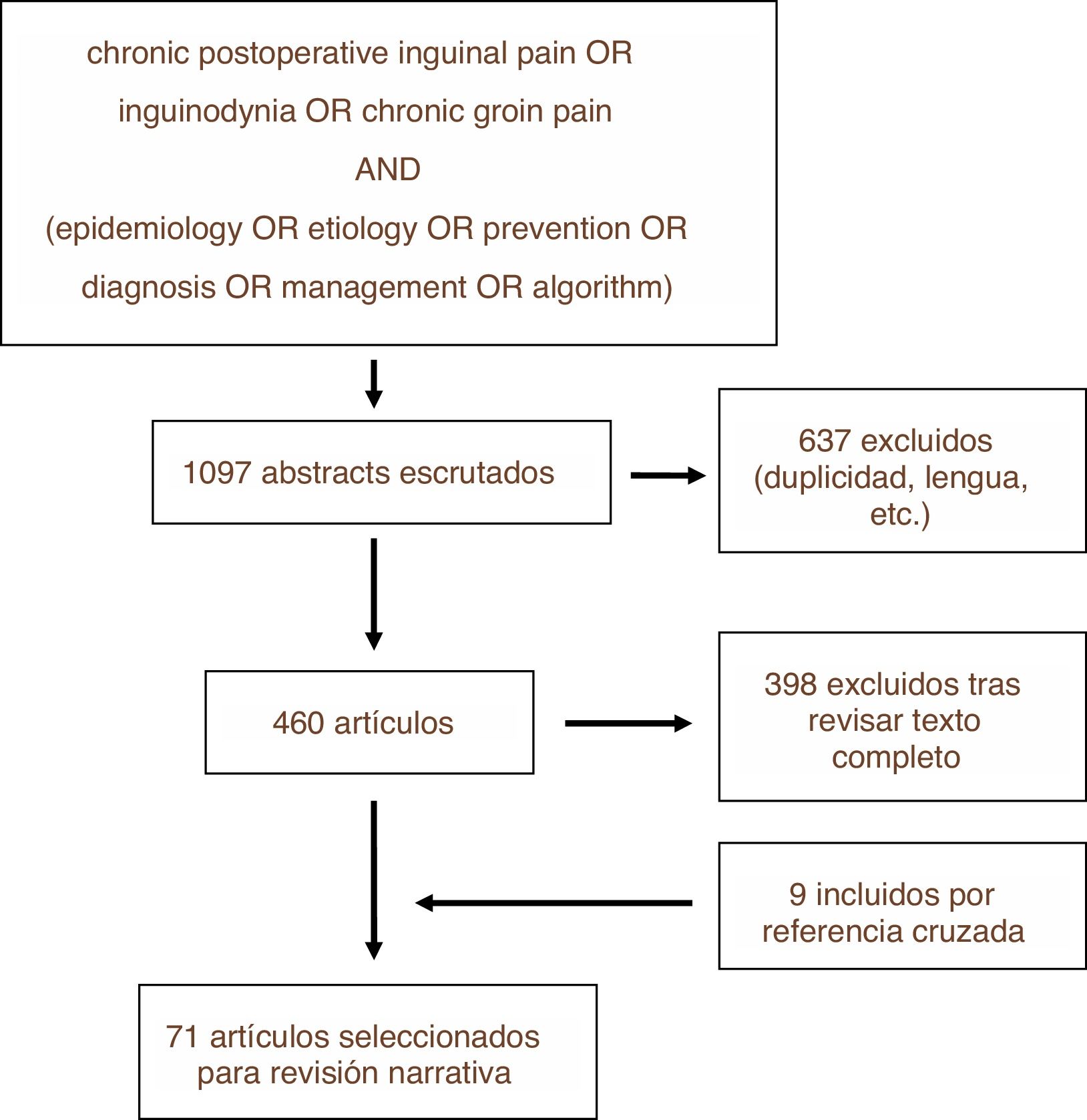
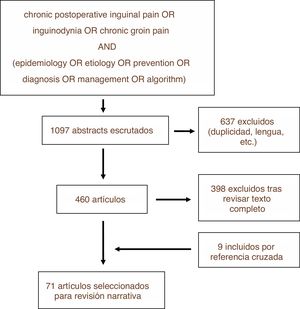
MetodologíaSe ha realizado una revisión narrativa en las plataformas PUBMED, EMBASE y Cochrane Library con la estrategia de búsqueda que se detalla en la figura 1. La búsqueda se llevó a cabo en diciembre de 2018. De entre los artículos encontrados se excluyeron aquellos que no se ajustaban a los objetivos de esta revisión así como aquellos escritos en lengua distinta al inglés o castellano, realizándose posteriormente la revisión narrativa a partir de los textos de los artículos no excluidos y priorizando con dicho fin aquellos de mayor calidad metodológica. Se repitió dicho proceso con algunas de las referencias cruzadas de esos trabajos, añadiéndose a la revisión narrativa en caso de considerarse relevantes para el desarrollo de cada uno de los epígrafes que se detallan. La revisión fue llevada a cabo por los dos primeros autores de forma independiente recurriéndose al tercer autor para resolver las discrepancias. Se priorizaron las recomendaciones de guías clínicas y los resultados obtenidos por ensayos clínicos randomizados y controlados.
ResultadosDel total de 1097 estudios encontrados con la estrategia de búsqueda descrita, fueron finalmente 71 los seleccionados para formar parte de esta revisión, bien por su calidad metodológica o bien por la relevancia de sus resultados o aseveraciones. En la figura 1 se detalla el proceso de selección de artículos para la revisión (fig. 2).
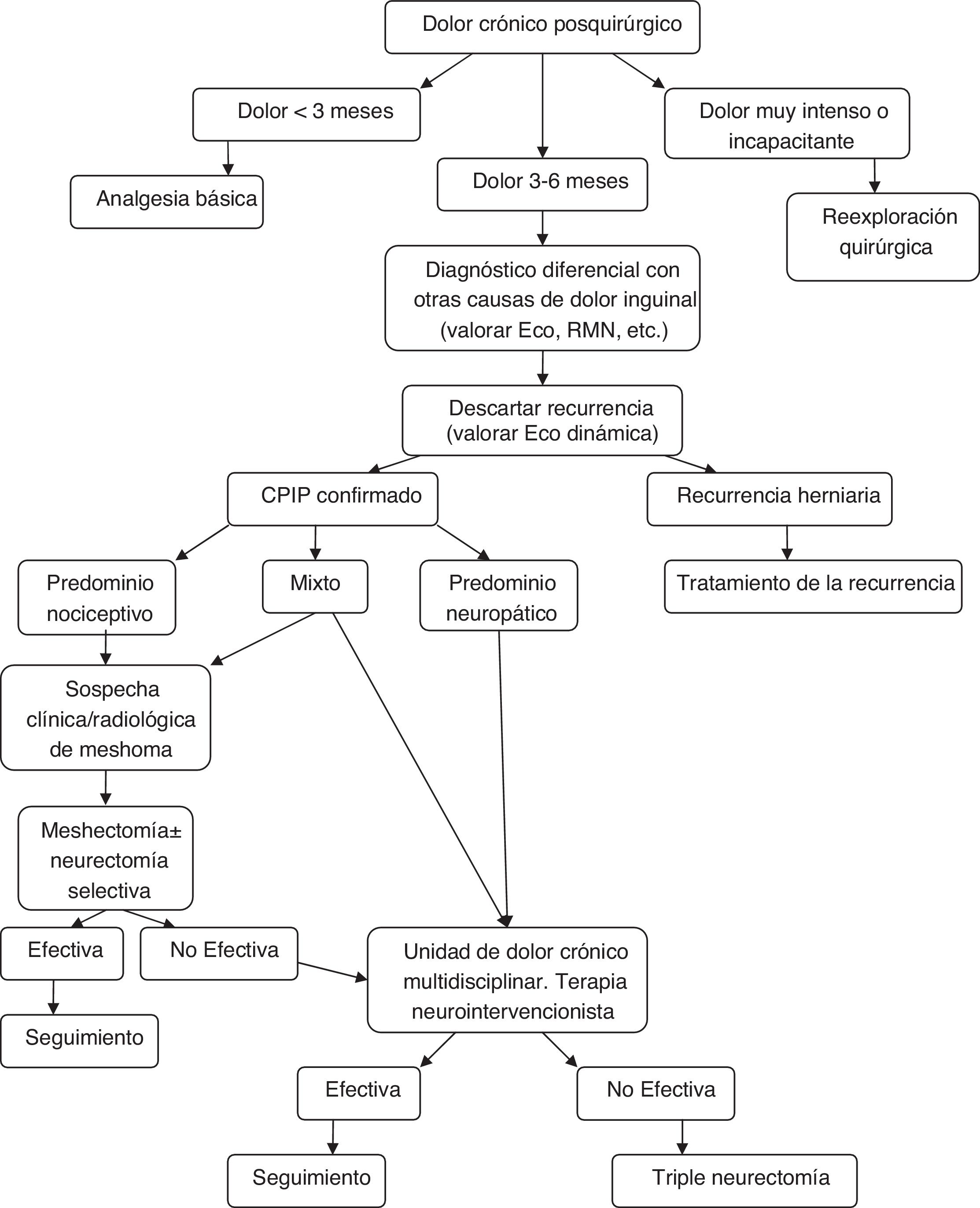
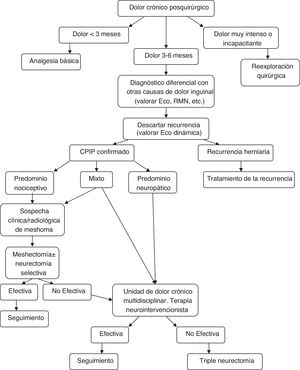
Algoritmo de manejo diagnóstico-terapéutico para pacientes con CPIP Modificado de Lange et al.15.
Se han reportado incidencias muy variables de DICP dependiendo de la técnica quirúrgica estudiada, la definición aplicada en cada estudio y de los métodos de evaluación y seguimiento de pacientes empleados. Dichas cifras oscilan entre 0-76%5,7,9–11 y se calcula que entre el 10 y el 15,2% de los pacientes que sufren esta complicación presentan un dolor moderado-severo o que afecta a sus actividades diarias12,13. La evolución natural del dolor es decreciente, tendiendo a disminuir tanto la intensidad como su impacto sobre la vida diaria con el tiempo9.
EtiopatogeniaPara poder entender las causas de DCIP es preciso conocer que la presentación clínica de esta complicación puede ser muy variable, distinguiéndose entre dos tipos fundamentales de dolor: neuropático y nociceptivo. En su etiopatogenia pueden intervenir diferentes componentes que pueden provocar un dolor neuropático, nociceptivo o que combine características de ambos tipos. Saber reconocer la potencial etiología del dolor es clave para instaurar un tratamiento apropiado.
El dolor neuropático suele predominar entre los pacientes con CPIP, hecho favorecido por la gran variabilidad anatómica que existe en la disposición de los nervios de la región inguinal, fundamentalmente los nervios ilioinguinal, iliohipogástrico y la rama genital del genitofemoral14. Este tipo de dolor puede ser causado por lesión nerviosa directa o por irritación perineural, generalmente provocada por compresión, fibrosis, material protésico, suturas u otros elementos de fijación15,16.
El CPIP de predominio nociceptivo es causado generalmente por reacción perióstica a nivel del pubis, por tejido cicatricial o bien por presión mecánica generada en torno a lo que se conoce como «meshoma», una masa conformada por la retracción de la malla y la fibrosis periprotésica16–18. Además, las recurrencias herniarias también pueden presentarse en forma de dolor predominantemente nociceptivo19,20.
Se han descrito también otras formas de presentación de DICP de origen visceral en forma de orquialgia o diseyaculación, con una incidencia no desdeñable (aproximadamente 10%)21,22 habiéndose propuesto la erosión de la malla sobre las estructuras del cordón espermático con afectación de la inervación autonómica del conducto deferente como mecanismo patogénico22,23.
Factores de riesgoAlgunas revisiones sistemáticas de estudios prospectivos y ensayos randomizados han identificado al abordaje endoscópico de la hernia inguinal (transabdominal preperitoneal [TAPP]; totally extraperitoneal [TEP]) como factor protector frente al desarrollo de DICP, comparado con técnicas de reparación convencionales (protésicas o no)7,24–26. De hecho, la EndoHernia Society establece una recomendación GRADE A para hernioplastia laparoscópica de cara a reducir la incidencia de DICP27.
Existe un aspecto técnico que ha mostrado comportarse como factor protector con un alto nivel de evidencia científica; la fijación de la malla con pegamentos de fibrina en lugar de otros métodos de fijación tanto en cirugía abierta como laparoscópica28,29.
Se han propuesto diversos factores de riesgo para el desarrollo de DICP; Fränneby et al. identificaron como tales a la edad por debajo de la mediana, un alto nivel de dolor preoperatorio y la aparición de complicaciones postoperatorias inmediatas como seromas/hematomas o infecciones30. Estos son, junto al sexo femenino, algunos de los factores de riesgo para los que se ha alcanzado mayor consenso en la literatura10,11,31.
Otros potenciales condicionantes que no gozan de tanta unanimidad son la realización de hernioplastia por recurrencia herniaria9,11; el tipo de malla utilizada32,33 o la aparición de dolor o disfunción sensorial durante el postoperatorio inmediato34. Incluso se ha sugerido una posible influencia genética35.
En la tabla 1 se resumen los distintos factores de riesgo identificados en la literatura para el desarrollo de DICP36.
Factores de riesgo para el desarrollo de dolor crónico postoperatorio
| Preoperatorios | Edad (jóvenes > mayores) |
| Sexo (♀ > ♂) | |
| Elevada intensidad de dolor | |
| Bajo nivel de optimismo preoperatorio | |
| Afectación de actividades diarias | |
| Hernia recurrente | |
| Predisposición genética (haplotipo HLA DQB1*03:02) | |
| Experimentales | Alta intensidad de dolor a la estimulación con calor |
| Perioperatorios | Cirujano poco experimentado/centro no especializado en hernia |
| Cirugía abierta | |
| Tipo de malla (bajo peso o poro ancho vs. elevado peso o poro estrecho | |
| Fijación de la malla (tackers o grapas > pegamentos de fibrina) | |
| Neurólisis nervio ilioinguinal en hernioplastia tipo Lichtenstein | |
| Postoperatorios | Complicaciones en postoperatorio inmediato (hematoma, infección) |
| Elevada intensidad de dolor postoperatorio | |
| Baja capacidad para controlar el dolor | |
| Disfunción sensorial sobre la ingle |
Adaptada de Bjurstrom et al.36.
Para prevenir esta complicación, algunos autores han propuesto la estrategia de observación o «watchful waiting» para pacientes seleccionados con hernia inguinal. Esta estrategia ha mostrado una baja incidencia de complicaciones como incarceración o estrangulación en pacientes con hernias asintomáticas o mínimamente sintomáticas a corto-medio plazo, sin grandes diferencias en términos de dolor o calidad de vida con respecto a los pacientes intervenidos. Sin embargo, a largo plazo, gran parte de esos pacientes se decantan por un tratamiento quirúrgico debido a la progresión sintomática37,38. Además, hay que tener en cuenta la morbimortalidad asociada al tratamiento quirúrgico urgente de la hernia inguinal incarcerada o estrangulada39. El grupo HerniaSurge reconoce que la observación puede ser segura y razonable en pacientes asintomáticos correctamente seleccionados, recomendando valorar el momento de la intervención según las circunstancias sociolaborales y el riesgo quirúrgico de cada paciente6.
Se han propuesto múltiples medidas intraoperatorias para prevenir el DICP, especialmente en cuanto al manejo de las estructuras nerviosas inguinales. En la tabla 2 se exponen las medidas propuestas por Amid, aunque no todas se encuentran avaladas por una evidencia científica consistente16. A continuación, se desglosan algunas de las medidas propuestas y se detalla el grado de evidencia que las avala, así como las recomendaciones al respecto según las guías clínicas más recientes.
Medidas intraoperatorias para prevenir la aparición de DICP propuestas por Amid et al
| Medidas | Evitar incisión indiscriminada de tejido celular subcutáneo |
| Evitar sección/resección extensa de fibras cremastéricas | |
| Evitar disección extensa/levantamiento del nervio ilioinguinal de su lecho | |
| Reconstruir una anillo inguinal superficial demasiado estrecho | |
| Evitar colocación de suturas en el borde inferior del músculo oblícuo interno (atrapamiento del nervio iliohipogástrico) | |
| Identificación sistemática y preservación de estructuras nerviosas |
Fuente: Amid et al.16.
En primer lugar, se ha planteado la necesidad de realizar una identificación nerviosa sistemática durante la intervención e incluso, si una vez identificados los nervios es preferible su sección o su preservación. El trabajo más relevante al respecto es el de Alfieri et al., un estudio de cohortes prospectivo y multicéntrico que reporta una incidencia de dolor crónico significativamente menor en los pacientes en los que se identificaron los nervios ilioinguinal, iliohipogástrico y la rama genital del nervio genitofemoral40, resultado corroborado por una revisión sistemática posterior41. El grupo HerniaSurge establece una recomendación fuerte para el simple reconocimiento del recorrido del nervio sin disección completa del mismo6.
En cuanto a la neurectomía profiláctica, la más estudiada ha sido la neurectomía selectiva del nervio ilioinguinal. Tres metaanálisis (dos de ellos a partir de ensayos clínicos randomizados) abordan este tema con resultados contradictorios e importante heterogeneidad. Además, alguno de ellos reporta una mayor incidencia de parestesias-disestesias en la región, lo cual impide establecer una recomendación a favor de esta maniobra profiláctica41–43. Al margen del nervio ilioinguinal, la literatura disponible para la neurectomía profiláctica del iliohipogástrico o de la rama genital del genito-femoral no permite establecer ninguna recomendación6.
Otro de los aspectos estudiados ha sido la «neurectomía pragmática». Consiste en la realización de neurectomía en aquellos casos en los que el nervio haya sido lesionado o se encuentre en riesgo de atrapamiento por la malla o cualquier elemento fijador. Smeds et al. reportan una incidencia de dolor crónico a los 3 meses significativamente menor entre los pacientes en los que se realizó esta maniobra44. A pesar de que existen otros estudios de cohortes (sin grupo control) con conclusiones contradictorias45, las últimas guías sobre manejo de la hernia inguinal establecen una recomendación fuerte a favor de la neurectomía pragmática6.
Se conocen otras potenciales fuentes de dolor de predominio nociceptivo como consecuencia de reacción perióstica. Diversos estudios sugieren que las suturas que incluyen periostio púbico para la fijación protésica pueden desencadenar DCIP6,18, estableciéndose una recomendación fuerte para evitar ese tipo de suturas6.
Para prevenir la orquialgia, minimizar la manipulación y traumatismo sobre el cordón espermático goza de una recomendación fuerte en las últimas guías, a pesar de que no existe una evidencia científica sólida que la respalde6.
Se han evaluado también algunas estrategias de analgesia perioperatoria para evitar el DCIP. La administración preoperatoria de gabapentina o pregabalina constituye una medida prometedora aunque aún escasamente estudiada46,47.
DiagnósticoCualquier tipo de dolor constituye un síntoma con una gran carga de subjetividad, tanto por parte del paciente dependiendo de su umbral de dolor, profesión, actividades diarias, factores desencadenantes, etc.; como por parte del cirujano a la hora de evaluarlo. Por ello, al enfrentarnos a un paciente con DICP no debemos caer en el desarrollo de prejuicios, transferencia o contratransferencia.
En primer lugar, hemos de tener en cuenta la posibilidad de que el dolor sea de causa ajena a la cirugía. El paciente puede presentar alguna patología distinta de la hernia inguinal que pudiera ser la causa del dolor incluso desde antes de la intervención. Solo así seremos capaces de realizar un diagnóstico diferencial adecuado con otras entidades; por ejemplo patología de índole musculoesquelética (entesitis de los aductores, osteítis del pubis, etc.), patologías del tracto genitourinario, del sistema nervioso periférico (radiculopatía lumbar, síndromes de atrapamiento del nervio obturador o pudendo,…), etc. Su mera sospecha puede indicar la realización de otras pruebas complementarias, como ecografía, RMN o incluso pruebas neurofisiológicas (electromiograma)19,48,49.
Por todo ello, una exhaustiva anamnesis y una minuciosa exploración física por un cirujano experimentado, constituyen las claves del diagnóstico diferencial en un paciente con sospecha de DICP. Son esas características las que nos permitirán, en primer lugar, descartar la existencia de otras patologías subyacentes y, por otra parte, extraer datos cruciales para orientar el diagnóstico etiológico15.
Una vez excluida otra patología subyacente sin relación con la hernia o su tratamiento, el primer paso a seguir será descartar la existencia de una recurrencia. Para ello, además de la historia clínica y exploración física, podemos recurrir a pruebas complementarias, fundamentalmente a la ecografía dinámica de la región inguinal, aunque algunos autores defienden también la utilidad de la herniografía15,50.
A partir de ahí, serán las características del dolor las que permitirán diferenciar entre un dolor de predominio neuropático o nociceptivo, así como la asociación con orquialgia u otra sintomatología acompañante. En muchos casos no existe una distinción clara y el diagnóstico etiológico puede complicarse aún más en presencia de fenómenos de neuroplasticidad, apareamiento de fibras nerviosas somáticas y vegetativas y centralización del dolor. A todo ello, hay que añadirle la influencia de circunstancias genéticas, cognitivas y socioeconómicas.
Los pacientes con dolor neuropático suelen referir rasgos de dolor de tipo quemante o lancinante, irradiado a la región genital o la cara medial del muslo combinado con síntomas como hipo-/hiperestesia, alodinia, o hiperalgesia. En cambio, el dolor nociceptivo es un dolor mejor localizado, normalmente continuo y que es descrito como una «tirantez» o «sensación de cuerpo extraño» especialmente frecuente a nivel del tubérculo púbico. Además, suele empeorar con ciertas posturas (al cruzar las piernas) o aliviar con otras (en posición supina), sobre todo en presencia de un «meshoma»20,36. Asimismo, es importante evaluar la presencia de síntomas que sugieran algún tipo de disfunción autonómica asociada, especialmente en forma de disfunción sexual o diseyaculación; su presencia también puede condicionar el tratamiento23.
En los casos de dolor de predominio neuropático podemos recurrir a maniobras diagnósticas como los bloqueos nerviosos o el mapeo de dermatomas, introducido por Álvarez et al. y posteriormente validado como una herramienta diagnóstica útil para distinguir entre dolor neuropático y nociceptivo, así como para identificar el nervio afecto con mayor probabilidad51,52. La principal utilidad de la ecografía dinámica radica en su capacidad de descartar la presencia de una recurrencia clínicamente no evidente aunque algunas publicaciones destacan su capacidad para diagnosticar la presencia de un «meshoma»19,20. La RMN también podría resultar útil para orientar el origen del dolor53.
TratamientoA pesar de los avances realizados, el tratamiento de los pacientes con DICP continúa representando un desafío. La falta de consenso a la hora de definir si un tratamiento es o no efectivo dificulta la interpretación y comparabilidad de resultados de los distintos tratamientos que, por tanto, han de ser interpretados con cautela. Actualmente, las recomendaciones continúan basándose en series de casos y opiniones consensuadas entre expertos6,36.
Ante la ausencia de un tratamiento universal, a cada paciente se le ha de proponer un plan terapéutico individualizado, adaptado a las características clínicas y los hallazgos intraoperatorios, en el caso de optar por tratamiento quirúrgico. Por ello, tanto la evaluación clínica como el tratamiento deben ser llevados a cabo por un cirujano experto (habiéndose creado el término «herniólogo» para designar a dicha figura5,15,16,36. En cualquier caso, el manejo debe realizarse en el seno de unidades multidisciplinares de dolor crónico para establecer estrategias de tratamiento multimodal.
Salvo en casos de dolor de gran intensidad y extremadamente incapacitante de entrada, el tratamiento conservador constituye la terapia inicial comenzando con la administración de analgesia, terapia tópica y tratamientos no farmacológicos como la fisioterapia y terapia cognitivo-conductual54.
En cuanto al tratamiento farmacológico, son escasos los estudios que evalúan su efectividad en pacientes con CPIP específicamente, pero parece razonable extrapolar su eficacia probada en pacientes con otros tipos de dolor neuropático como la neuralgia posherpética o la neuropatía diabética55. En sus últimas recomendaciones sobre tratamiento del dolor neuropático, la Asociación Internacional para el Estudio del Dolor considera a los antidepresivos tricíclicos (amitriptilina/clomipramina), los inhibidores de la recaptación de serotonina-noradrenalina (venlafaxina) y los inhibidores de canales de calcio voltaje-dependientes (gabapentina/pregabalina) como tratamiento de primera línea56, mientras que la capsaicina o lidocaína tópicas quedan relegados como segunda elección, por su reducida eficacia y sus potenciales efectos adversos57,58. Para el tratamiento del dolor nociceptivo se utilizan antiinflamatorios no esteroideos (AINE) o incluso corticoides con distinto grado de eficacia. Su espectro de efectos adversos limita su utilización prolongada36.
Los tratamientos neurointervencionistas también se consideran parte del tratamiento multimodal conservador y pueden ser útiles en pacientes seleccionados. No obstante, la evidencia científica que avala estos métodos proviene fundamentalmente de pequeñas series.
Los bloqueos nerviosos con anestésico local del nervio ilioinguinal o iliohipogástrico constituyen una medida ya mencionada como maniobra diagnóstica, pero que también puede utilizarse con fines terapéuticos. Aunque más complejo, también se puede realizar el bloqueo del nervio genitofemoral59. La ayuda de la ecografía o la utilización de neuroestimuladores permiten realizar esta maniobra con mayor precisión, reduciendo los efectos adversos y la cantidad a infiltrar. Sin embargo, los estudios que evalúan su eficacia resultan contradictorios60,61. En cualquier caso, a tenor de los resultados de un reciente ensayo clínico, parece que el tratamiento quirúrgico mediante neurectomía selectiva es más efectivo que el bloqueo nervioso62.
Las técnicas neuroablativas (radiofrecuencia, crioablación) constituyen otra alternativa, especialmente en casos en los que los bloqueos nerviosos consiguen aliviar el dolor por un tiempo limitado36. No obstante, la evidencia científica que avala estas técnicas es escasa, según concluye una revisión sistemática reciente sobre la neuroablación con radiofrecuencia pulsada63.
La última alternativa neurointervencionista es la neuromodulación periférica o central. Aunque no se conoce el mecanismo por el cual consigue sus beneficios64, todas las series publicadas presentan resultados favorables en términos de alivio del dolor, calidad de vida y reducción del consumo de analgésicos65,66. A pesar de su efectividad, la complejidad del tratamiento, su coste y su escasa disponibilidad, hacen que los potenciales candidatos deban ser sometidos a un estricto proceso de selección. En él, se han de evaluar factores psicosociales (motivación, apoyo sociofamiliar, capacidad de seguir las recomendaciones, etc.), así como la respuesta a un test preliminar64. Todo ello puede actuar como sesgo a la hora de interpretar sus prometedores resultados.
El tiempo razonable para extender medidas de tratamiento conservador en función de la respuesta a las distintas opciones es de 3 a 6 meses15, aunque algunos autores proponen prolongarlo hasta un año5,67. Posteriormente, puede ser necesario un tratamiento quirúrgico, para el cual disponemos de distintas alternativas. Para maximizar el éxito de cualquier intervención, es imprescindible que el cirujano tenga un amplio conocimiento de la anatomía de inguinal y retroperitoneal68.
La neurectomía constituye el tratamiento quirúrgico de elección para pacientes con DICP de predominio neuropático. Se han publicado resultados favorables tanto para la neurectomía selectiva69 como triple, ya sea por abordaje abierto a nivel inguinal16 o endoscópico retroperitoneal70. Por el momento, el único estudio prospectivo disponible que evalúe la eficacia de la neurectomía triple es el de Chen et al., obteniendose mejoría subjetiva del dolor en los 20 pacientes sometidos a neurectomía triple retroperitoneal endoscópica67.
No existen estudios que comparen la neurectomía selectiva con la triple. Los detractores de la selectiva, aluden a la variabilidad anatómica de la disposición nerviosa, a la importante red de conexiones existente en la zona y a la dificultad de identificar tanto clínica- como intraoperatoriamente qué nervio es responsable de la sintomatología como razones para abogar por la triple neurectomía15,71. Se recomienda que los nervios sean seccionados proximalmente al antiguo campo operatorio, que se liguen los muñones del nervio tras la sección y se «entierren» en el músculo circundante para prevenir la formación de neuromas o su regeneración5,36,71. Algunas guías continúan dejando la elección entre neurectomía triple o selectiva a criterio del cirujano6; otras se decantan por la triple5.
Aunque no existen estudios comparativos entre neurectomía endoscópica o abierta, el abordaje endoscópico retroperitoneal aúna las ventajas de su mínima invasividad con las de una sección más proximal del nervio siendo esta más eficaz sobre todo en casos de DICP tras TEP o TAPP o un abordaje abierto preperitoneal15,67,68. También es posible extender la neurectomía al tronco común del nervio genitofemoral en su trayecto retroperitoneal sobre la cara anterior del músculo psoas a través de un abordaje abierto71.
Otra de las opciones de tratamiento quirúrgico es la extirpación del material protésico (explante de malla o «meshectomía»), que ha mostrado ser segura y efectiva a largo plazo para pacientes con dolor nociceptivo en presencia de un «meshoma». Puede combinarse con una neurectomía triple o selectiva en aquellos pacientes que presenten características mixtas de dolor o en aquellos casos en los que intraoperatoriamente se evidencie atrapamiento o lesión nerviosa72,73. También se asociaría neurectomía selectiva si la disposición del nervio interfiriese con el explante. Algunos autores defienden la utilidad del explante por sí solo, sin asociar neurectomía20. Recientemente se han reportado casos de meshectomía con abordaje laparoscópico para pacientes con DICP tras hernioplastia laparoscópica con buenos resultados74. La extirpación de la malla conlleva una serie de riesgos; al margen de los inherentes a la reexploración quirúrgica de la ingle (sangrado, lesión nerviosa, necrosis testicular, …) existe el potencial riesgo de recurrencia herniaria. Para minimizarlo, en la mayoría de las series se asocia algún tipo de hernioplastia adicional. Para pacientes con DICP tras hernioplastia Lichtenstein o similar sometidos a explante de malla por vía anterior, se han conseguido índices de recurrencia de 0% asociando una hernioplastia endoscópica, aunque se trata de series de pequeño tamaño75,76.
Otro de los aspectos a tener en cuenta de cara a escoger la mejor alternativa quirúrgica es la presencia de orquialgia o diseyaculación. La neurectomía triple no parece ser suficientemente efectiva para estos pacientes. Al existir una mayor implicación etiológica del material protésico y la reacción fibrosa que este genera sobre el conducto deferente y su inervación23, el explante de malla parece una mejor alternativa. En casos refractarios puede ser necesaria la resección del conducto deferente o la orquiectomía15,23.
Atendiendo a todo lo expuesto anteriormente y a la aparición de estudios posteriores al último algoritmo terapéutico de Lange et al. que así lo acreditan20,73,77, los autores creen que se debe otorgar un papel más protagonista al explante (solo o asociada a neurectomía) dentro del tratamiento quirúrgico del CPIP, basándonos siempre en las características del dolor y los hallazgos intraoperatorios. En la figura 2 se expone un nuevo algoritmo diagnóstico-terapéutico, añadiendo esas modificaciones al algoritmo propuesto por Lange et al.15.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimiento al Dr. Gonzalo Gómez Guerra por su mentoría y su transmisión de conocimientos en el terreno de la cirugía de pared abdominal.