La cirugía robótica se ha convertido en una vía de abordaje segura y efectiva para el tratamiento de la patología quirúrgica pulmonar. Sin embargo, la adopción de nuevas técnicas quirúrgicas requiere de la evaluación de la curva de aprendizaje. El objetivo de este estudio es analizar la curva de aprendizaje de las resecciones pulmonares anatómicas por vía robótica.
MétodosAnálisis retrospectivo de todas las resecciones pulmonares anatómicas por vía robótica realizadas por un mismo cirujano entre junio de 2018 y marzo de 2020. La curva de aprendizaje se evaluó utilizando gráficas CUSUM para estimar los cambios en la tendencia del tiempo y los fallos quirúrgicos y la aparición de complicaciones cardiorrespiratorias postoperatorias a lo largo de la secuencia de casos.
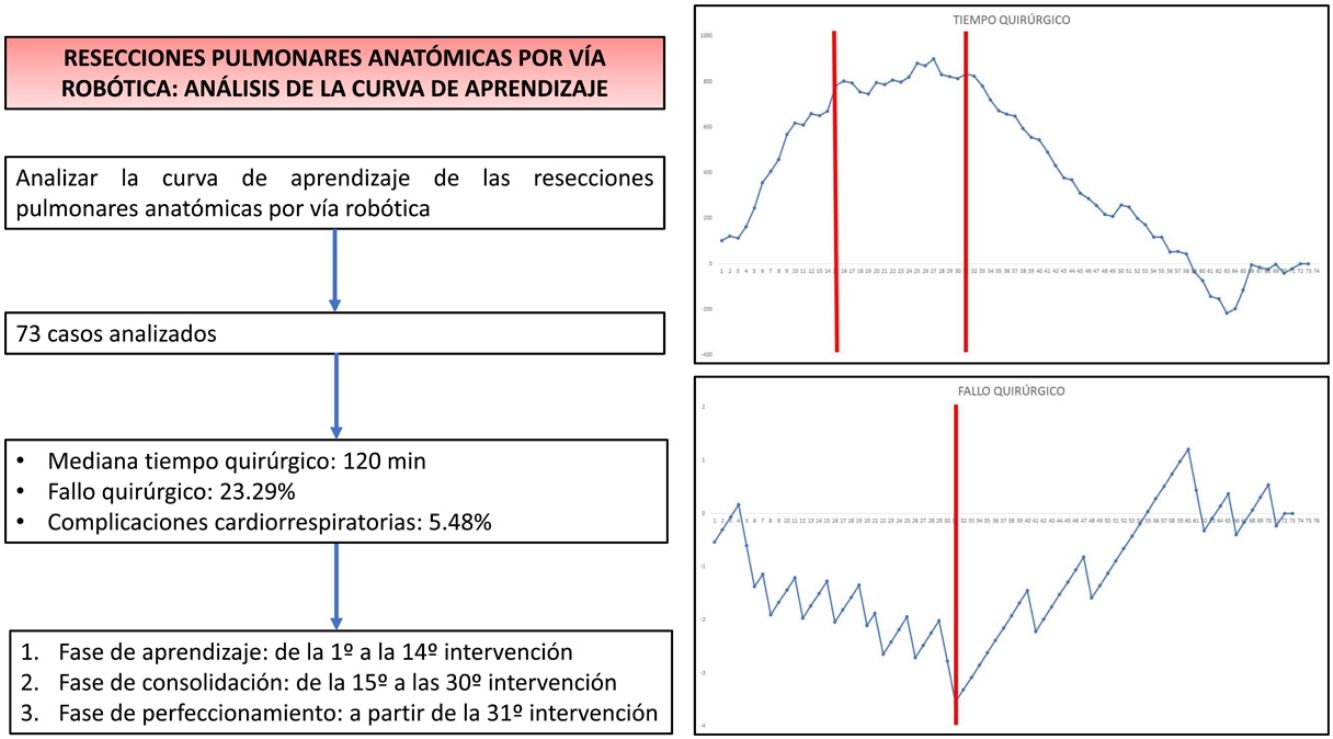
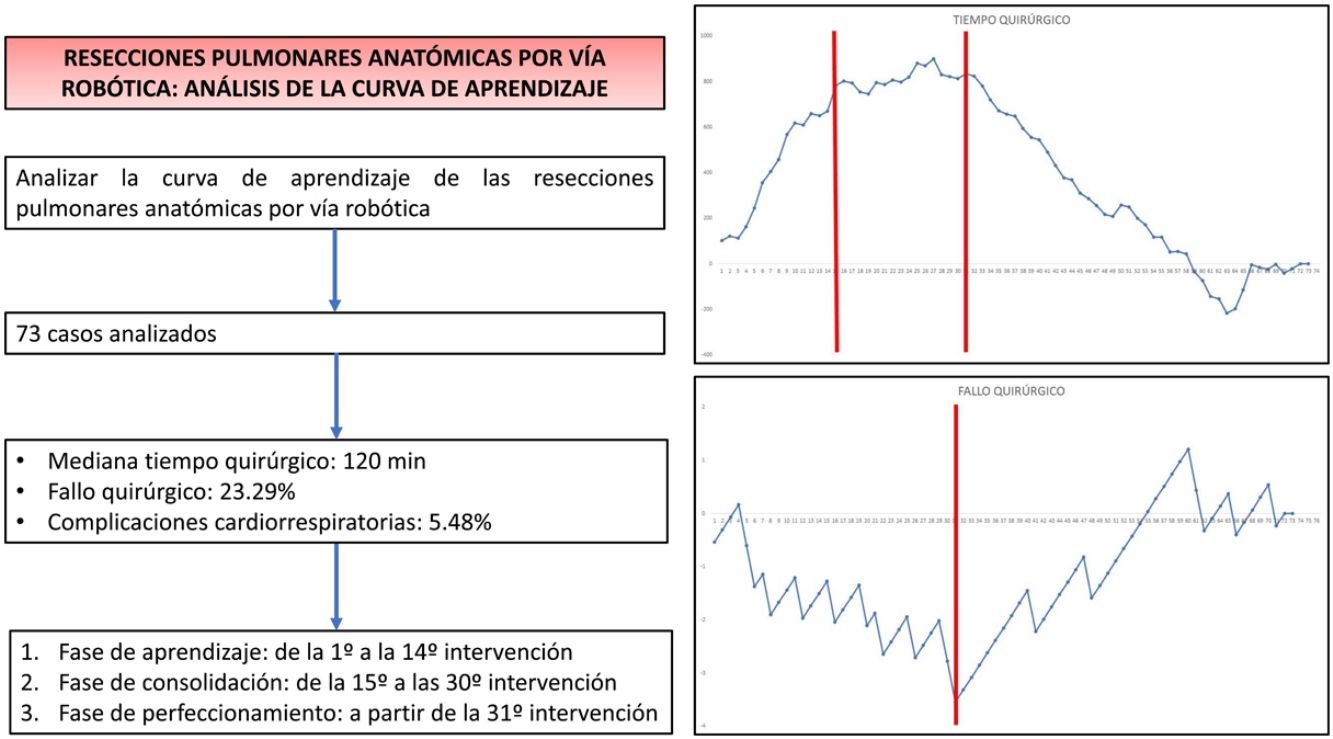
ResultadosEl estudio incluyó un total de 73 casos. La mediana de duración de todas las intervenciones fue de 120min (rango intercuartílico: 90-150min), la prevalencia de fallo quirúrgico fue del 23,29%, mientras que 4/73 pacientes presentaron alguna complicación cardiorrespiratoria postoperatoria. Con base en el análisis CUSUM, la curva de aprendizaje fue dividida en 3 fases diferentes: fase i (desde la primera hasta la 14.a intervención), fase ii (entre la 15.a y la 30.a intervención) y fase iii (a partir de la 31.a intervención).
ConclusionesLa curva de aprendizaje para las resecciones pulmonares anatómicas por vía robótica puede dividirse en 3 fases. La competencia técnica que asegura resultados perioperatorios satisfactorios se consiguió en la fase iii, a partir de la 31.a intervención.
Robotic surgery has become a safe and effective approach for the treatment of pulmonary surgical pathology. However, the adoption of new surgical techniques requires the evaluation of the learning curve. The objective of this study is to analyze the learning curve of robotic anatomical lung resections.
MethodsRetrospective analysis of all robotic anatomical lung resections performed by the same surgeon between June 2018 and March 2020. The learning curve was evaluated using CUSUM charts to estimate trend changes in surgical time, surgical failure and the occurrence of post-operative cardiorespiratory complications throughout the sequence of cases.
ResultsThe study included a total of 73 cases. The median duration of all complications was 120min (interquartile range: 90-150min), the prevalence of surgical failure was 23.29%, while 4/73 patients had any postoperative cardiorespiratory complication. Based on the CUSUM analysis, the learning curve was divided into 3 different phases: phase i (from the first to the 14th intervention), phase ii (between the 15th and 30th intervention) and phase iii (from the 31st intervention).
ConclusionsThe learning curve for robotic anatomical lung resections can be divided into 3 phases. The technical competence that guarantees satisfactory perioperative outcomes was achived in phase iii from the 31st intervention.
En los últimos años, la cirugía robótica ha surgido como una nueva vía de abordaje mínimamente invasiva para el tratamiento de la patología quirúrgica torácica. Varios estudios han demostrado que se trata de una técnica factible, segura y oncológicamente eficaz1,2, capaz de obtener resultados similares, en términos de morbimortalidad postoperatoria, a los conseguidos con la videotoracoscopia (VATS) cuando se compara con el abordaje abierto convencional3–5. Además, algunos autores describen beneficios adicionales relacionados con una mejor ergonomía, la visión tridimensional y la optimización de la maniobrabilidad gracias a la rotación de los instrumentos 360° 6.
A pesar de que las primeras lobectomías por vía robótica fueron descritas en 20037,8, la adopción de la tecnología robótica en cirugía torácica es aún limitada y su utilización en resecciones pulmonares ha comenzado a crecer recientemente.
La implementación de nuevas técnicas quirúrgicas requiere de la evaluación de la curva de aprendizaje del cirujano. Aunque estudios iniciales han mostrado que la curva de aprendizaje para las resecciones anatómicas pulmonares por vía robótica oscila entre los 14 y los 32 procedimientos9–11, estos estudios han centrado su análisis en la evaluación del tiempo quirúrgico y la morbilidad postoperatoria. Sin embargo, dado que la ocurrencia de complicaciones postoperatorias viene determinada principalmente por las características de los pacientes12, consideramos que esta variable no es un reflejo fiable de la curva de aprendizaje. Por el contrario, el análisis de las complicaciones perioperatorias relacionadas con la técnica (fallo quirúrgico) podría considerarse una herramienta más precisa para la evaluación de la adquisición de las competencias técnicas necesarias para obtener resultados perioperatorios satisfactorios.
El objetivo de este estudio es analizar la curva de aprendizaje de las resecciones pulmonares anatómicas por vía robótica mediante la evaluación del tiempo y los fallos quirúrgicos y la morbilidad cardiorrespiratoria utilizando el análisis de suma acumulada (CUSUM) y CUSUM ajustada por riesgo.
MétodosEntre junio de 2018 y marzo de 2020, 73 pacientes se sometieron a una resección pulmonar anatómica por vía robótica utilizando el sistema Da Vinci® (Modelo X; Intuitive Surgical, Sunnyvale, CA, EE. UU.), realizada por un único cirujano (MJ) en nuestro centro. Antes de comenzar a utilizar el robot para resecciones pulmonares, el cirujano había realizado más de 200 resecciones pulmonares anatómicas por VATS y 4 timectomías por vía robótica.
Los criterios de selección de los pacientes candidatos a resección pulmonar por vía robótica se basaron en la evaluación fisiológica del paciente recomendada por las guías de práctica clínica vigentes13 y en las características de la lesión objeto de resección. Aquellos casos en los que una resección extendida (asociada a pared torácica, aurícula, vena cava, diafragma, vértebra, tumores de Pancoast, resecciones en manguito, neumonectomías o neumonectomía intrapericárdicas) podía ser potencialmente necesaria no fueron considerados para este tipo de abordaje. El manejo perioperatorio de los pacientes fue uniforme durante todo el período de estudio.
La técnica quirúrgica se basa en la utilización de los 4 brazos robóticos y un puerto accesorio. En primer lugar, introducimos la cámara a través de un trócar de 8mm a nivel del octavo espacio intercostal en la línea axilar media. La cavidad pleural se analiza con una cámara de 0° de angulación. Después, introducimos 2 trócares robóticos de 12mm a nivel del octavo espacio intercostal en línea axilar anterior a la altura de la inserción del diafragma y a nivel de la línea escapular, respectivamente. El último trócar robótico se inserta en el octavo espacio intercostal a nivel del triángulo auscultatorio a la altura del segmento 6 pulmonar. Finalmente, introducimos un puerto accesorio en el noveno espacio intercostal a nivel de la inserción del diafragma, justo entre el trócar de la cámara y el primer o tercer trócar, creando un triángulo equilátero. La posición de este trócar depende del lóbulo objeto de resección: entre el trócar de la cámara y el puerto anterior para los lóbulos inferiores y entre el trócar de la cámara y el tercer trócar para los lóbulos superiores. Utilizamos insuflación con CO2 a una presión de 6-10mmHg. Los vasos, la cisura y el bronquio se disecan principalmente con una pinza disectora bipolar tipo Maryland y se seccionan con endograpadoras manuales o robóticas. La pieza es extraída con la ayuda de una bolsa alargando el puerto más anterior. Al final, insertamos un tubo de 24F a través de la incisión de la cámara. En todos los casos se coloca al inicio del procedimiento un catéter para analgesia paravertebral con control endoscópico.
Se evaluó la curva de aprendizaje en función de los siguientes resultados: tiempo quirúrgico, fallo quirúrgico y complicaciones cardiorrespiratorias postoperatorias. Como tiempo quirúrgico se consideró la duración total de la intervención (de piel a piel), que incluye tanto el tiempo de docking como el tiempo de trabajo en la consola del cirujano. Los efectos adversos perioperatorios relacionados con la técnica (fallo quirúrgico) incluyeron: complicaciones intraoperatorias, conversión, reintervención y complicaciones postoperatorias de tipo técnico (hemotórax, fuga aérea prolongada, quilotórax, empiema, parálisis recurrencial, hematoma de herida y fístula bronquial). Se consideraron complicaciones cardiorrespiratorias postoperatorias: insuficiencia respiratoria, necesidad de reintubación, necesidad de ventilación mecánica>24h, neumonía, atelectasia que precisara broncoscopia, síndrome de distrés respiratorio agudo, arritmia que precisara tratamiento, infarto agudo de miocardio, insuficiencia cardíaca aguda, accidente cerebrovascular e insuficiencia renal aguda. Todas las complicaciones fueron definidas con antelación siguiendo las recomendaciones publicadas en el documento conjunto de la Sociedad de Cirujanos Torácicos y de la Sociedad Europea de Cirujanos Torácicos14.
Análisis estadísticosLa curva de aprendizaje en función de los distintos resultados se analizó mediante el método CUSUM para variables continuas (tiempo quirúrgico) y los métodos CUSUM estándar no ajustado por riesgo y CUSUM ajustado por riesgo para las variables dicotómicas (fallo quirúrgico y complicaciones cardiorrespiratorias postoperatorias).
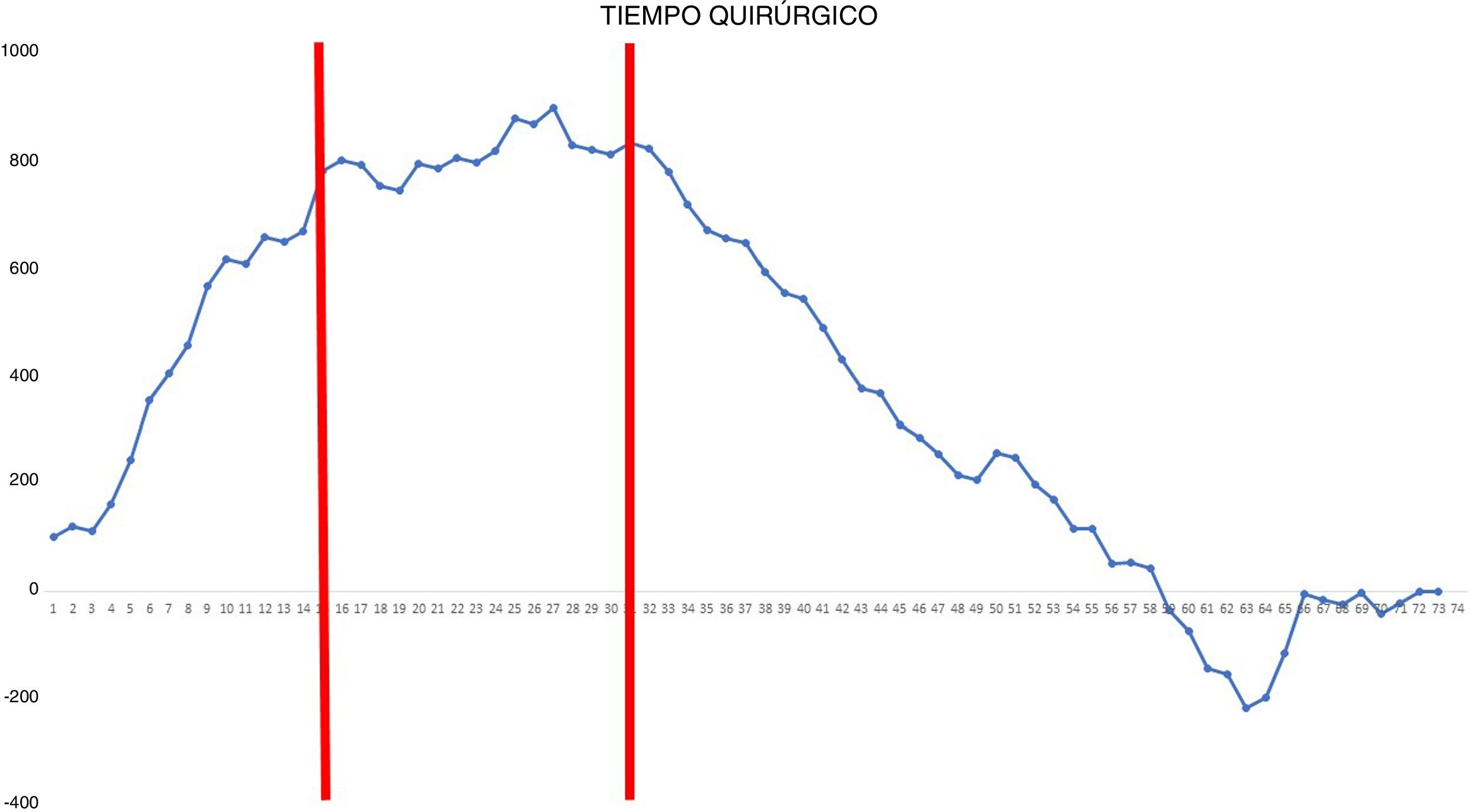
El tiempo quirúrgico fue analizado mediante el método CUSUM, que determina las diferencias del total acumulado entre los datos individuales y la media de todos los datos15. Los pacientes fueron ordenados cronológicamente desde el primer caso operado en junio de 2018 hasta el último caso intervenido en marzo de 2020. Posteriormente se calculó para cada paciente la diferencia entre el resultado obtenido y la media de todos los datos. Finalmente, se realizó la suma acumulada de estas diferencias y se representaron de forma gráfica. La línea 0 de la gráfica representa el valor de referencia que corresponde a la media del tiempo quirúrgico.
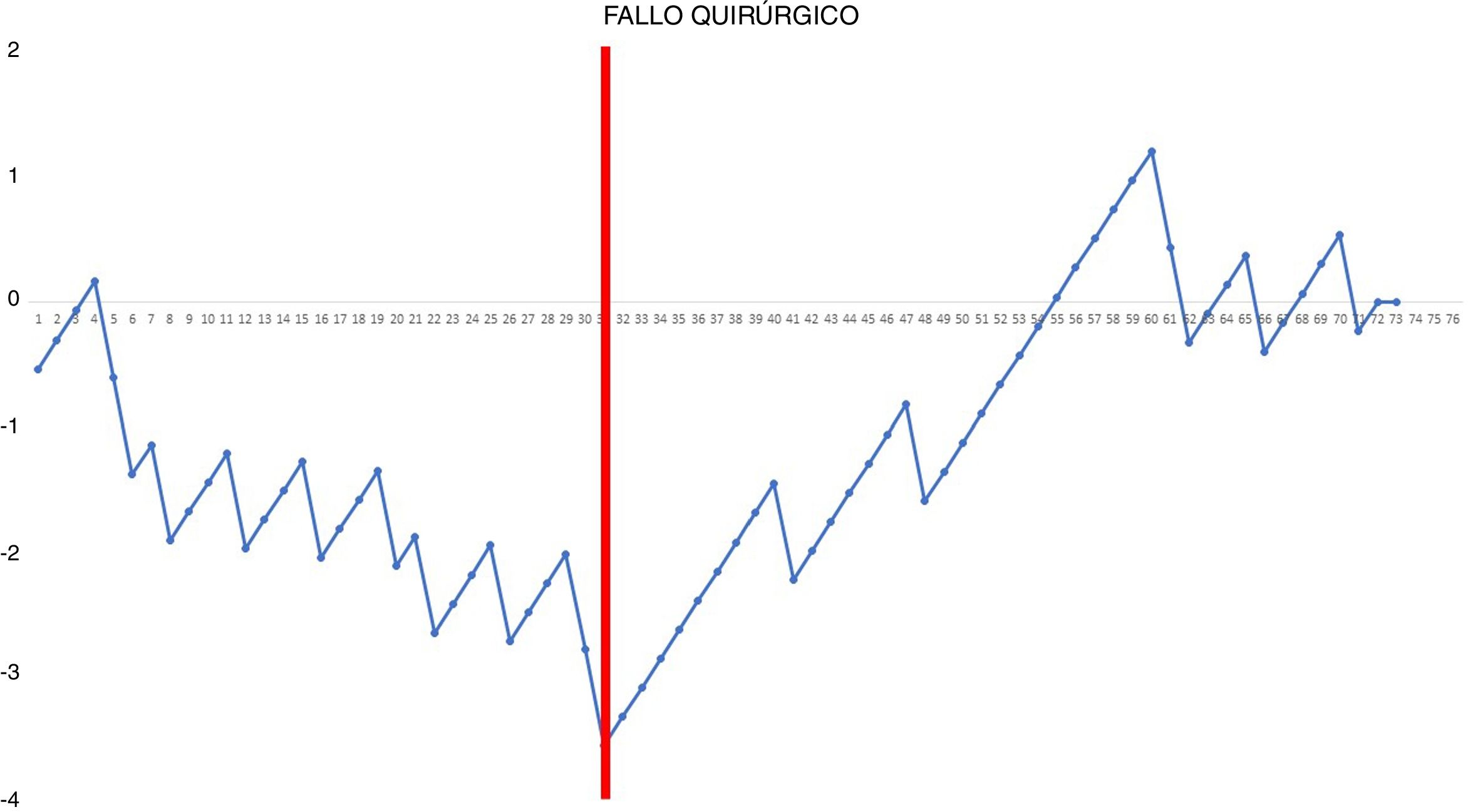
La ocurrencia de fallo quirúrgico fue analizada mediante el método CUSUM estándar (no ajustado por riesgo)15. Dado que el principio básico de este tipo de análisis es recompensar o penalizar en función del riesgo de fallo que es constante para cada caso, antes de realizar el análisis, calculamos el riesgo de fallo quirúrgico de la serie global. Tras ordenar cronológicamente a los pacientes con su resultado (0=no efectos adversos y 1=sí efectos adversos), se calculó para cada paciente la diferencia entre el resultado obtenido (0 o 1) y el esperado (riesgo de fallo quirúrgico de toda la serie). De manera que cuando el paciente no presentó fallo quirúrgico, la recompensa obtenida fue equivalente al riesgo de la serie global de presentarlos: −(0−riesgo de la serie global). Sin embargo, cuando un paciente presentó algún efecto adverso relacionado con la técnica, la penalización resultó ser de −(1−riesgo de la serie global). Finalmente, se realizó la suma acumulada de estas diferencias y estas fueron representadas gráficamente. La línea 0 de la gráfica representa el valor de referencia que corresponde a la prevalencia general de fallo quirúrgico.
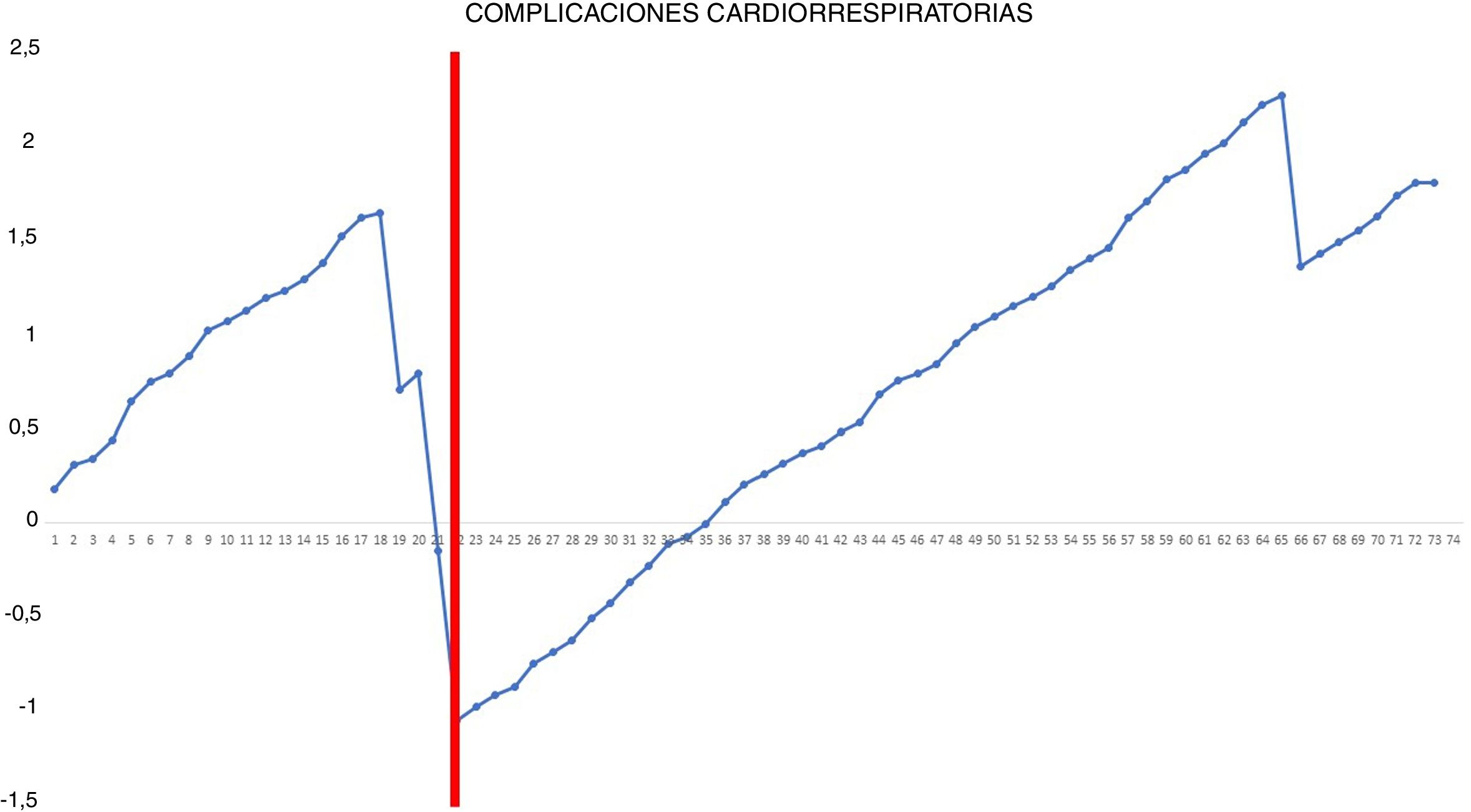
La ocurrencia de complicaciones cardiorrespiratorias postoperatorias fue analizada mediante el método CUSUM ajustado por riesgo15. Puesto que este tipo de análisis considera la heterogeneidad de las características clínicas de los pacientes, antes de realizar el análisis se calculó el riesgo individual de complicaciones cardiorrespiratorias postoperatorias según el modelo de riesgo Eurolung 116. Tras ordenar cronológicamente a los pacientes con su resultado (0=no complicaciones cardiorrespiratorias y 1=sí complicaciones cardiorrespiratorias), se calculó para cada paciente la diferencia entre el resultado obtenido (0 o 1) y el esperado (riesgo individual de complicaciones según el modelo). De manera que cuando el paciente no presentó ninguna complicación cardiorrespiratoria postoperatoria, la recompensa obtenida fue equivalente al riesgo individual de presentarla: −(0−riesgo individual de complicaciones según el modelo). Sin embargo, cuando el paciente presentó alguna complicación de este tipo, la penalización resultó ser de −(1−riesgo individual de complicaciones según el modelo). Finalmente, se realizó la suma acumulada de estas diferencias y estas fueron representadas gráficamente.
El análisis de las características demográficas y clínicas de la población se llevó a cabo mediante el software estadístico SPSS® versión 26 (IBM Corp, Chicago, IL, EE. UU., 2019), mientras que la elaboración de los gráficos CUSUM se realizó con el programa Excel® (Microsoft, Redmond, WA, EE. UU.).
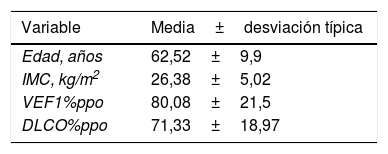
ResultadosEl estudio incluyó un total de 73 casos. Las características demográficas y clínicas de los pacientes están recogidas en la tabla 1.
Características demográficas y clínicas de los pacientes de la serie
| Variable | Media±desviación típica |
|---|---|
| Edad, años | 62,52±9,9 |
| IMC, kg/m2 | 26,38±5,02 |
| VEF1%ppo | 80,08±21,5 |
| DLCO%ppo | 71,33±18,97 |
| N (%) | |
|---|---|
| Sexo (hombre) | 32 (43,8) |
| Enfermedad coronaria | 2 (2,7) |
| Insuficiencia renal | 1 (1,4) |
| Enfermedad cerebrovascular | 0 (0) |
| Diabetes | 3 (4,1) |
| Hipertensión arterial | 18 (24,7) |
| Arteriopatía periférica | 2 (2,7) |
| Neoplasia previa | 32 (43,8) |
| Tipo de resección | |
| Lobectomía | 56 (76,7) |
| Segmentectomía reglada | 17 (23,3) |
| Diagnóstico | |
| Carcinoma pulmonar | 58 (79,5) |
| Metástasis de origen extrapulmonar | 8 (11) |
| Benigno | 7 (9,6) |
DLCO%ppo: capacidad de difusión de monóxido de carbono predicha postoperatoria; IMC: índice de masa corporal; VEF1%ppo: volumen espiratorio forzado en el primer segundo predicho postoperatorio.
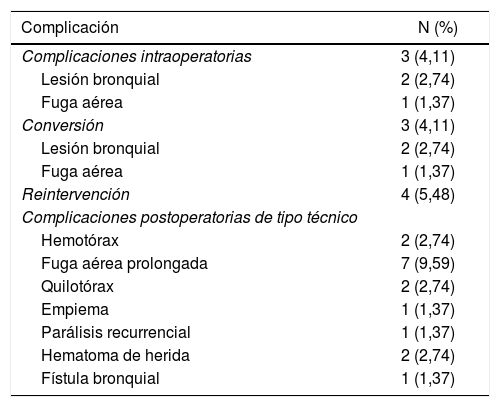
La mediana de duración de todas las intervenciones fue de 120min (rango intercuartílico: 90-150min). Diecisiete de 73 pacientes presentaron fallo quirúrgico. En la tabla 2 se detallan los distintos efectos adversos perioperatorios relacionados con la técnica hallados en la serie. La prevalencia de complicaciones cardiorrespiratorias fue del 5,48%. Se registraron 2 fibrilaciones auriculares, una neumonía y un accidente cerebrovascular. La media del riesgo de complicaciones cardiorrespiratorias según el modelo Eurolung 1 fue de 7,95%. No se registró mortalidad en la serie.
Efectos adversos perioperatorios relacionados con la técnica
| Complicación | N (%) |
|---|---|
| Complicaciones intraoperatorias | 3 (4,11) |
| Lesión bronquial | 2 (2,74) |
| Fuga aérea | 1 (1,37) |
| Conversión | 3 (4,11) |
| Lesión bronquial | 2 (2,74) |
| Fuga aérea | 1 (1,37) |
| Reintervención | 4 (5,48) |
| Complicaciones postoperatorias de tipo técnico | |
| Hemotórax | 2 (2,74) |
| Fuga aérea prolongada | 7 (9,59) |
| Quilotórax | 2 (2,74) |
| Empiema | 1 (1,37) |
| Parálisis recurrencial | 1 (1,37) |
| Hematoma de herida | 2 (2,74) |
| Fístula bronquial | 1 (1,37) |
Las gráficas CUSUM para tiempo quirúrgico, fallo quirúrgico y morbilidad cardiorrespiratoria postoperatoria pueden verse en las figuras 1, 2 y 3, respectivamente.
Gráfica CUSUM para el tiempo quirúrgico. La gráfica representa cada procedimiento de la serie ordenado cronológicamente de izquierda a derecha. Se observan 2 puntos de inflexión en la curva, en el caso 15.o y en el caso 31.o (marcados en rojo), que permitieron identificar 3 etapas: etapa i (desde la primera hasta la 14.a intervención), en la que la curva tiene una tendencia ascendente, indicando que el tiempo quirúrgico era mayor que la media de la serie; etapa ii (entre la 15.a y la 30.a intervención), en la que la curva se mantiene relativamente estable, apuntando a que el tiempo quirúrgico era similar a la media de tiempo de la serie global, y etapa iii (a partir de la 31.a intervención), en la que la curva tiene una tendencia descendente, indicando que el tiempo quirúrgico era menor que la media de la serie global.
Gráfica CUSUM no ajustada por riesgo para fallo quirúrgico con un riesgo constante de 20,55%. La gráfica representa cada procedimiento de la serie ordenado cronológicamente de izquierda a derecha con la curva moviéndose hacia abajo en caso de fallo quirúrgico y hacia arriba en caso de éxito. Se identificó un único punto de inflexión a nivel de la 31.a intervención (marcado en rojo).
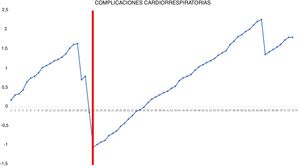
Gráfica CUSUM ajustada por riesgo para la ocurrencia de complicaciones cardiorrespiratorias postoperatorias. La gráfica representa cada procedimiento de la serie ordenado cronológicamente de izquierda a derecha con la curva moviéndose hacia abajo en caso de aparición de complicaciones cardiorrespiratorias y hacia arriba en caso de ausencia de estas. Se identificó un único punto de inflexión a nivel de la 22.a intervención (marcado en rojo).
En la gráfica de tiempo quirúrgico se identificaron 2 puntos de inflexión en los que se observaba un cambio en la tendencia de la duración de la intervención. La curva de aprendizaje fue dividida en 3 etapas: i (desde la primera hasta la 14.a intervención), en la que la curva tiene una tendencia ascendente que indica que el tiempo quirúrgico era mayor que la media de la serie; ii (entre la 15.a y la 30.a intervenciones), en la que la curva se mantiene relativamente estable, apuntando a que el tiempo quirúrgico era similar a la media de tiempo de la serie global, y iii (a partir de la 31.a intervención), en la que la curva tiene una tendencia descendente, indicando que el tiempo quirúrgico era menor que la media de la serie global. En la gráfica de fallo quirúrgico se identificó un único punto de inflexión a la altura de la 31.a intervención, después del cual la curva mostraba una tendencia ascendente, indicando que la competencia técnica necesaria para asegurar resultados perioperatorios satisfactorios se conseguía a partir de esta intervención. En la gráfica de complicaciones cardiorrespiratorias se identificó un punto de inflexión a nivel de la 22.a intervención, a partir del que la curva mostraba una tendencia ascendente continua, que indica la ausencia de complicaciones a partir de ese procedimiento.
Con base en el análisis combinado de estas gráficas, la curva de aprendizaje fue dividida en 3 fases: inicial de aprendizaje (desde la primera hasta la 14.a intervención), consolidación (entre la 15.a y la 30.a intervención) y perfeccionamiento (a partir de la 31.a intervención).
DiscusiónLa cirugía robótica representa un abordaje alternativo al VATS como estrategia de tratamiento mínimamente invasivo de la patología quirúrgica torácica. Aunque varios estudios han demostrado que se trata de una técnica segura y eficaz2,3, su implementación requiere de la evaluación de la curva de aprendizaje del cirujano.
Las gráficas CUSUM se engloban dentro de las gráficas de control de calidad y son las que mejor se adaptan a la monitorización de los procesos clínico-asistenciales17. Las principales ventajas de estas gráficas son su sencillez, la interpretación visual intuitiva y la capacidad de detectar cambios en las tendencias independientemente del tamaño muestral. Mediante las gráficas CUSUM se consigue monitorizar el proceso en tiempo real desde su inicio, por lo que son útiles para estudiar curvas de aprendizaje18,19.
En nuestro estudio, la evaluación del tiempo quirúrgico mediante gráficas CUSUM permitió identificar 3 períodos diferentes en la curva de aprendizaje del cirujano. Sin embargo, el tiempo quirúrgico por sí solo no es suficiente para llevar a cabo un análisis multidimensional de dicha curva. La competencia técnica debería considerar otros resultados quirúrgicos20. El análisis del fallo quirúrgico, entendido como la ocurrencia de efectos adversos perioperatorios relacionados con la técnica, puede ser un indicador más preciso del proceso de adquisición de las competencias técnicas en cirugía robótica.
Por otro lado, nuestro estudio demuestra que la ocurrencia de complicaciones cardiorrespiratorias postoperatorias no es un indicador útil para la evaluación de la curva de aprendizaje, dada la baja frecuencia de estos eventos (solo 4 en nuestra serie) y que son más dependientes de las características intrínsecas de los pacientes que de la competencia técnica del cirujano; si bien es cierto que la mayoría se produjeron al inicio de la segunda fase.
Los resultados de nuestro estudio son concordantes con los obtenidos en análisis previos. Así, Meyer et al.10 analizaron la curva de aprendizaje de la lobectomía robótica en una serie de 185 pacientes con base en el tiempo quirúrgico, la mortalidad y la comodidad del cirujano, y fijaron la curva de aprendizaje en 15, 20 y 19 casos, respectivamente. Song et al.11 analizaron la curva de aprendizaje de la lobectomía robótica por cáncer de pulmón en una serie de 208 pacientes mediante análisis CUSUM en función de la duración del docking, el tiempo de consola y la duración total de la intervención, y establecieron la curva de aprendizaje en 20, 34 y 32 casos, respectivamente. Toker et al.9 analizaron los resultados de 102 resecciones anatómicas por vía robótica entre las que incluyeron lobectomías y segmentectomías, y establecieron la duración de la curva de aprendizaje en 14 casos. Por otro lado, Zhang et al.21 estudiaron la curva de aprendizaje de la segmentectomía por vía robótica objetivando una disminución del tiempo quirúrgico a partir de la 47.a intervención, mientras que la competencia técnica necesaria para asegurar resultados perioperatorios satisfactorios se lograba a partir del 40.o procedimiento.
La principal limitación de este estudio se basa en la posible heterogeneidad de los pacientes intervenidos en cuanto a la complejidad quirúrgica, que es, en muchas ocasiones, no valorable preoperatoriamente. En segundo lugar, el tamaño muestral es relativamente pequeño para la valoración de todos los niveles de complejidad quirúrgica. En tercer lugar, el cirujano tenía una amplia experiencia en resecciones pulmonares mediante VATS y cierto grado de experiencia robótica, por lo que la curva de aprendizaje podría ser más larga en cirujanos sin este tipo de experiencia previa.
En conclusión, nuestro estudio demuestra que la curva de aprendizaje para las resecciones pulmonares anatómicas por vía robótica puede dividirse en 3 fases: las primeras 14 intervenciones forman parte del período de aprendizaje inicial, las siguientes 16 intervenciones constituyen la fase de consolidación, mientras que el período de perfeccionamiento comienza a partir de la 31.a intervención. La competencia técnica que asegura resultados perioperatorios satisfactorios se consiguió en la fase iii, a partir de la 31.a intervención.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado directa o indirectamente con los contenidos del manuscrito.