El embarazo se caracteriza por un aumento fisiológico y esencial de los niveles plasmáticos de colesterol total (CT) y triglicéridos (TG), impulsado por el aumento de resistencia a la insulina, estrógenos, progesterona y lactógeno placentario. Durante la gestación, los TG pueden incrementarse hasta 300mg/dl y el CT hasta 350mg/dl, aunque se desconocen con exactitud sus valores de referencia. Cuando la concentración de colesterol excede el percentil 95 (hipercolesterolemia familiar [HF] e hipercolesterolemia materna transitoria), existe una predisposición al estrés oxidativo en los vasos fetales, exponiendo al recién nacido a mayor formación de estrías grasas y mayor riesgo de arteriosclerosis. Sin embargo, el tratamiento actual de la gestante con hiperlipidemia consiste en dieta y suspensión de fármacos hipolipemiantes.
La hipertrigliceridemia (HTG) materna más prevalente es debida a causas secundarias (diabetes, obesidad, fármacos, etc.), siendo la HTG grave debida a causas genéticas, menos prevalente y representa un mayor riesgo de complicaciones maternofetales, tales como pancreatitis aguda (PA), preeclampsia, parto prematuro y diabetes gestacional. La PA por HTG grave es una complicación del embarazo poco prevalente, pero potencialmente letal para la madre y el feto, más frecuente en el tercer trimestre o en el posparto inmediato y no existen protocolos específicos para su diagnóstico y tratamiento.
Como conclusión, cabe destacar que se debe evaluar cuidadosamente la dislipemia en el embarazo, no solo por las complicaciones agudas que conlleva, sino también por la morbimortalidad cardiovascular futura en el recién nacido. Es por ello necesario el establecimiento de algoritmos o guías de consenso para su manejo.
During pregnancy there is a physiological increase in total cholesterol (TC) and triglycerides (TG) plasma concentrations, due to increased insulin resistance, oestrogens, progesterone, and placental lactogen, although their reference values are not exactly known, TG levels can increase up to 300mg/dL, and TC can go as high as 350mg/dL. When the cholesterol concentration exceeds the 95th percentile (familial hypercholesterolaemia (FH) and transient maternal hypercholesterolaemia), there is a predisposition to oxidative stress in foetal vessels, exposing the newborn to a greater fatty streaks formation and a higher risk of atherosclerosis. However, the current treatment of pregnant women with hyperlipidaemia consists of a diet and suspension of lipid-lowering drugs.
The most prevalent maternal hypertriglyceridaemia (HTG) is due to secondary causes, like diabetes, obesity, drugs, etc. The case of severe HTG due to genetic causes is less prevalent, and can be a higher risk of maternal-foetal complications, such as, acute pancreatitis (AP), pre-eclampsia, preterm labour, and gestational diabetes. Severe HTG-AP is a rare but potentially lethal pregnancy complication, for the mother and the foetus, usually occurs during the third trimester or in the immediate postpartum period, and there are no specific protocols for its diagnosis and treatment.
In conclusion, it is crucial that dyslipidaemia during pregnancy must be carefully evaluated, not just because of the acute complications, but also because of the future cardiovascular morbidity and mortality of the newborn child. That is why the establishment of consensus protocols or guidelines is essential for its management.
El embarazo representa un estado fisiológico único en el que han de producirse los cambios metabólicos necesarios en la madre para asegurar unas reservas energéticas (glucosa, aminoácidos y lípidos) suficientes que garanticen el adecuado desarrollo y crecimiento fetal.
La glucosa es cuantitativamente el nutriente más importante que cruza la placenta, seguido de los aminoácidos1, y el desarrollo fetal depende de su disponibilidad. Sin embargo, aunque la transferencia placentaria de lípidos es muy limitada2, las adaptaciones maternas del metabolismo lipídico que se producen durante la gestación tienen unas consecuencias muy importantes para el desarrollo fetal. Las dos principales son la acumulación de lípidos en los tejidos maternos3 y el desarrollo de hiperlipidemia materna4.
Durante los dos primeros tercios de la gestación se produce un aumento de los depósitos grasos de la madre3, resultado tanto de la hiperfagia como del incremento en la síntesis lipídica5. En este periodo temprano, la actividad lipoproteína lipasa (LPL) del tejido adiposo no cambia o incluso puede estar aumentada6, controlando la captación de grasas por el mismo y generando así un estado anabólico.
Sin embargo, durante el tercer trimestre de embarazo y coincidiendo con el máximo crecimiento fetal, esta actividad de LPL disminuye2, lo cual unido al aumento de la actividad lipolítica y catabólica causada por la resistencia a la insulina que se produce durante este periodo7 provoca una disminución acelerada de los depósitos grasos y un aumento de los triglicéridos (TG) séricos maternos, siendo menores los aumentos de fosfolípidos y colesterol.
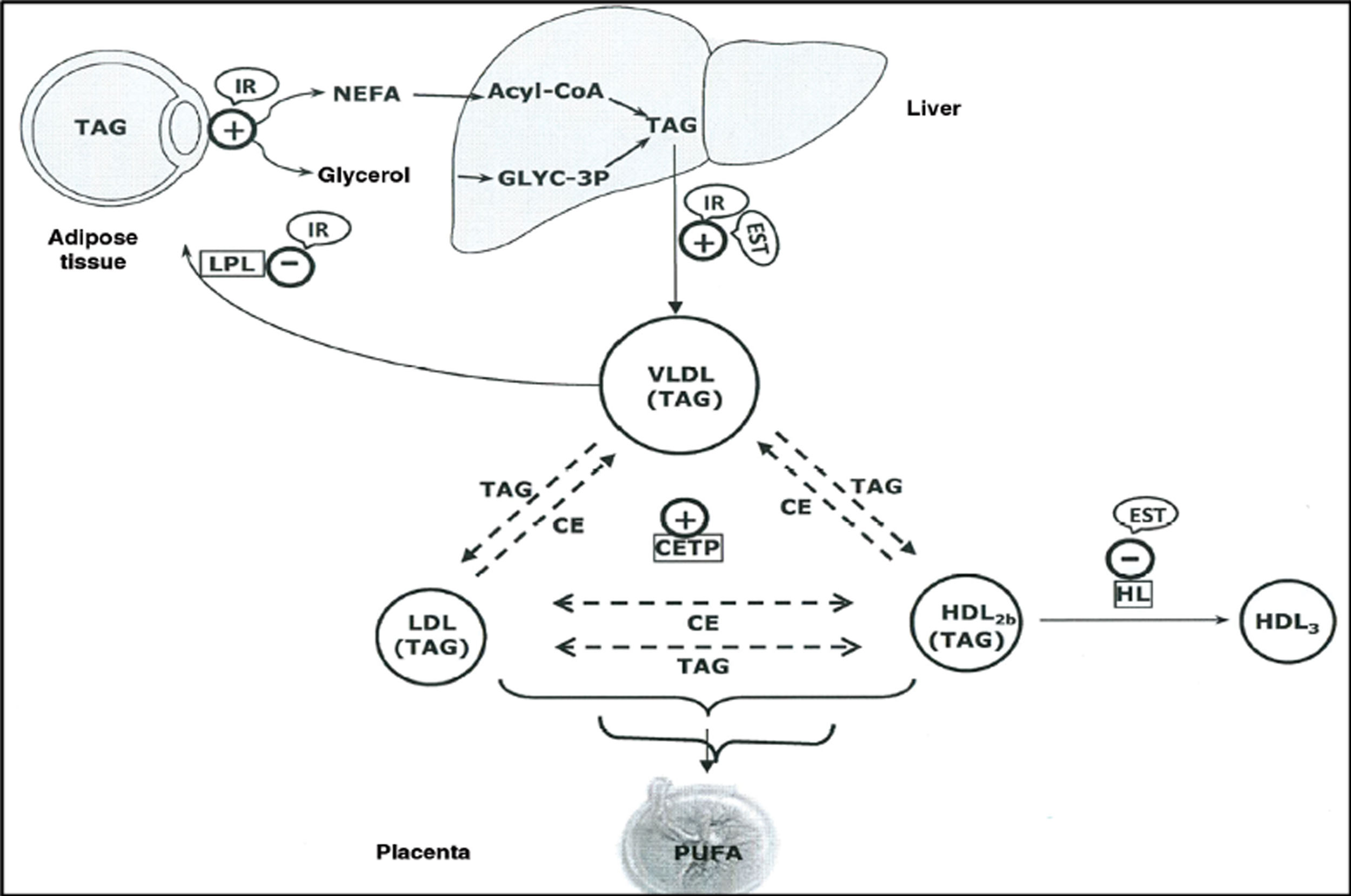
La elevada producción de estrógenos durante la gestación hace que aumente la producción hepática de lipoproteínas de muy baja densidad (VLDL)8, y de VLDL enriquecidas en TG9, la cual junto con el incremento en la actividad de la proteína transferidora de esteres de colesterol alrededor de la mitad de la gestación10,11, y la disminución en la actividad de la lipasa hepática en la última fase del embarazo, parecen contribuir a la acumulación de TG en las lipoproteínas de baja densidad (LDL) y en las lipoproteínas de alta densidad (HDL)9 y a la hipertrigliceridemia (HTG) materna (fig. 1).
Representación esquemática de las interacciones lipoproteicas producidas durante el tercer trimestre de embarazo.
CE: esteres de colesterol; CETP: proteína transferidora de esteres de colesterol; EST: estradiol; HDL: lipoproteínas de alta densidad; HL: lipoproteína hepática; IR: resistencia a insulina; LDL: lipoproteínas de baja densidad; NEFA: ácidos grasos no esterificados; PUFA: ácidos grasos poliinsaturados; TAG: triacilglicéridos; VLDL: lipoproteínas de muy baja densidad.
Fuente: Modificado de Herrera E, Desoye G. Horm Mol Clin Investig. 2016;26(2):109-27.
Los TG maternos que transportan las lipoproteínas en plasma son hidrolizados y captados por la placenta, cuyas células trofoblásticas expresan proteínas relacionadas con receptores VLDL-Apo E y receptores LDL, reesterificándose para proporcionar un reservorio de ácidos grasos11. Es así como el feto consigue los ácidos grasos esenciales necesarios para su desarrollo. Tras la hidrólisis intracelular de los TG, los ácidos grasos liberados difunden al plasma fetal y son transportados por la alfa fetoproteína12 al hígado fetal donde son reesterificados y segregados de nuevo a la circulación en forma de TG.
El colesterol también juega un papel importante en el desarrollo embrionario y fetal. Es un componente esencial de las membranas celulares y precursor de ácidos biliares y esteroides. El feto es capaz de efectuar una importante síntesis endógena de colesterol total (CT)13, aunque también utiliza CT materno. La barrera fisiológica que debe superar el CT materno para llegar al feto es el saco vitelino hasta la cuarta semana de gestación y posteriormente el sincitiotrofoblasto y los microvasos fetales de la placenta14.
La presencia de diversos receptores lipoproteicos en la placenta15 y en menor extensión en el saco vitelino16 permite a estos tejidos captar CT a partir de las lipoproteínas maternas, aunque el transporte se completa con otras vías activas y pasivas y la utilización de otros receptores, proteínas de unión y LPL placentaria14. No obstante, todavía no se conoce el mecanismo exacto de este proceso.
Valores de referencia de los lípidos durante el embarazoLos cambios en la concentración de los lípidos durante la gestación se empiezan a producir ya desde la decimosegunda semana, progresando conforme avanza la misma17, y aunque se ha demostrado repetidamente que la concentración de lípidos aumenta considerablemente durante el embarazo, sigue siendo muy difícil definir cuál es el rango de normalidad dentro de este periodo.
Ordovas et al.4 ya describieron en el año 1984 que el CT experimentaba un incremento en torno al 49% durante el embarazo, alcanzando un máximo entre las semanas 33 y 36, y que los TG llegaban a alcanzar unos niveles alrededor de 3 veces los habituales en la mujer no gestante entre las semanas 37 y 40 de gestación. Sin embargo, los rangos de referencia reportados por los diferentes autores varían ampliamente18–20.
Piechota y Staszewski20 realizaron un estudio en Polonia en el año 1992 que incluía 719 gestantes sanas, en el cual pudieron comprobar que la concentración de todos los lípidos, incluyendo apolipoproteína A (Apo A) y apolipoproteína B (Apo B) aumentaba significativamente durante el segundo y tercer trimestre de embarazo, siendo el incremento más pronunciado en la concentración de TG que alcanzó valores de 2,7 veces el límite superior de referencia durante el tercer trimestre. La concentración de colesterol HDL (c-HDL) empezaba ya a aumentar en el primer trimestre, alcanzando su máxima elevación (25%) durante el segundo trimestre y disminuyendo en el tercero.
Posteriormente, Ying et al. en el año 201521 realizaron otro estudio en China en el que midieron la concentración de lípidos en 3.200 mujeres gestantes frente a 3.200 mujeres sanas no gestantes en edad de procrear, encontrando en todos los parámetros lipídicos concentraciones significativamente más altas en el grupo de mujeres gestantes frente al grupo control (p<0,05). Los TG eran el parámetro que más se elevaba, incrementándose gradualmente a lo largo de la gestación (p<0,01) y la relación c-LDL/c-HDL fue inferior a la de las mujeres no gestantes en todas las etapas del embarazo.
El estudio Life Child, publicado en el año 201922, ha sido realizado en una cohorte de mujeres gestantes sanas representativa de la población caucásica, en función del trimestre de embarazo. Se estudiaron un total de 748 gestantes entre julio de 2011 y agosto de 2018 y excepto para Apo A la concentración de todos los parámetros lipídicos en suero mostraba un incremento significativo entre el segundo y tercer trimestre, observándose el incremento más pronunciado en los TG, al igual que en el resto de estudios.
La concentración de colesterol LDL (c-LDL), TG, Apo A y Apo B fue aproximadamente 0,1-0,5mmol/l superior a la del estudio de Piechota y Staszewski, divergencia que puede ser debida a la diferencia en el límite superior de referencia propuesto por ambos autores (97,5 vs. 95 percentil); sin embargo, la concentración de c-HDL sigue siendo 0,3-0,4mmol/l superior en el estudio Life Child tras ajustar los rangos. En este estudio, a diferencia del realizado por Piechota y Staszewski, no se ha observado un aumento en los niveles de Apo A entre trimestres.
El cociente c-LDL/c-HDL medido en el segundo y tercer trimestre fue inferior al cut-off recomendado de 1,523,24, encontrando sin embargo valores más elevados en el estudio chino de Ying et al.21.
Basándonos en el bajo cociente encontrado en esta cohorte, así como en que la concentración de lípidos vuelve a niveles basales tras el embarazo, podría considerarse que no existe evidencia de mayor riesgo de eventos cardiovasculares en la mujer embarazada caucásica25, aunque no pueden establecerse conclusiones sobre el riesgo aterogénico de la mujer embarazada, fundamentadas en datos de la mujer no gestante.
Los valores medios encontrados en el estudio Life Child también son similares a los encontrados por Lippi et al.26 en Italia en un número bastante inferior de mujeres gestantes (n=57). Sin embargo, otros estudios llevados a cabo en distintas poblaciones muestran diferencias sobre todo en la concentración de c-HDL, siendo bastante inferior en el estudio de Landázuri et al.27 realizado en Colombia y en el estudio de Pusukuru et al.28 llevado a cabo en mujeres embarazadas de origen indio.
Tampoco existe unanimidad en el criterio de que la concentración de c-HDL aumenta a lo largo del embarazo, y aunque algunos autores sostienen que se eleva, otros no han detectado dicho aumento. En un estudio publicado en el año 2019 y realizado en China por Wang et al.29 en 1.283 mujeres gestantes sanas, al igual que en el estudio de Shen et al.30 y Piechota y Staszewski20, se observó que el c-HDL aumenta durante el primer y segundo trimestre de embarazo y muestra un ligero descenso durante el tercer trimestre.
De forma general, se puede afirmar que los niveles lipídicos durante el embarazo están influidos de forma multifactorial por factores étnicos y geográficos31,32, por lo que surge la necesidad de establecer niveles de referencia nacionales para los lípidos séricos en la mujer gestante, pero a día de hoy no existe consenso sobre cuáles son los valores lipídicos normales durante el embarazo.
Sin embargo, los cambios observados en lípidos y lipoproteínas durante el embarazo en el estudio Life Child son consistentes con la mayor parte de los datos de la literatura20,21,28, confirmando así investigaciones anteriores.
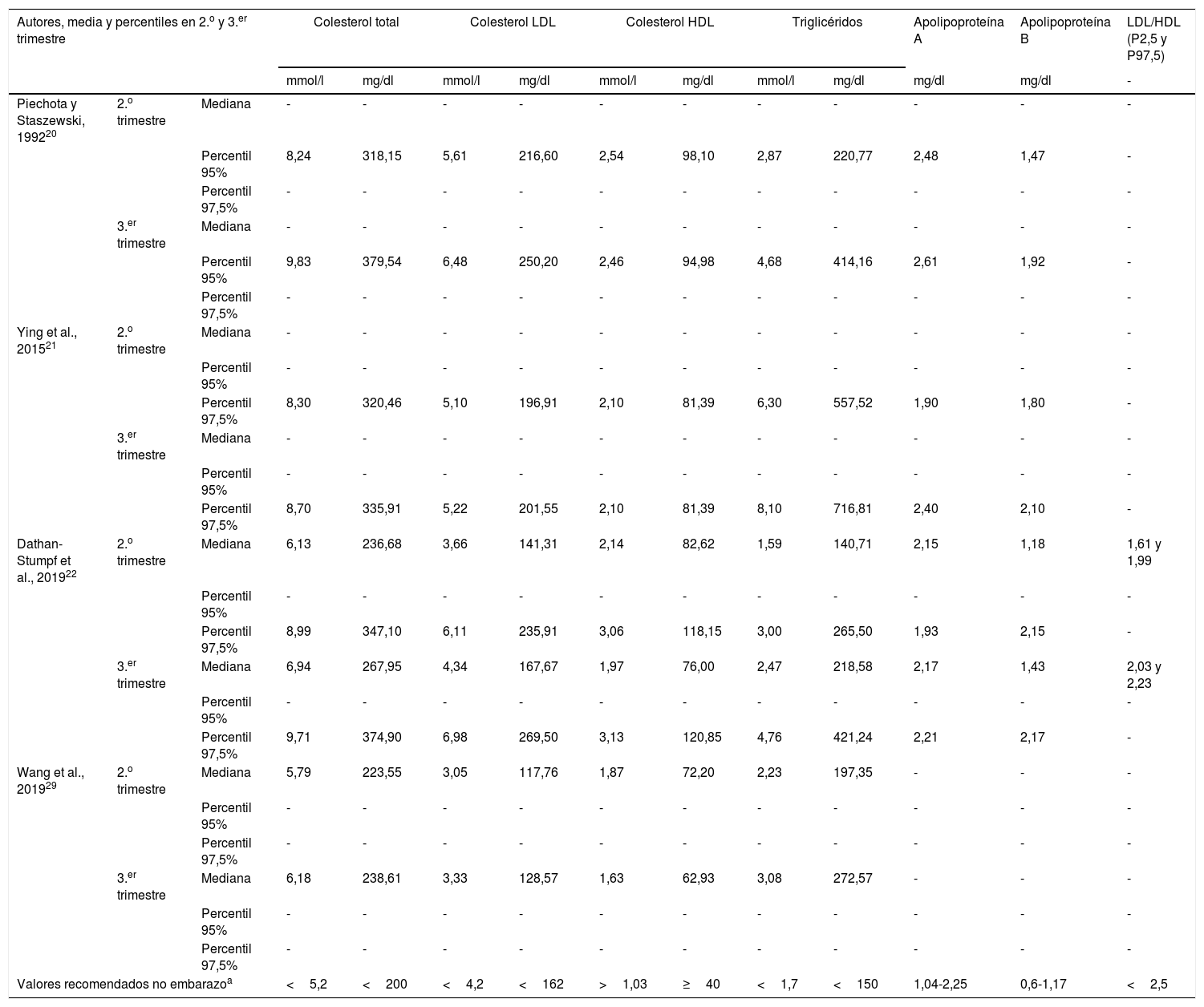
En la tabla 1 se muestra el límite superior de referencia y los valores medios de los distintos parámetros lipídicos durante el segundo y tercer trimestre de embarazo, según los estudios más significativos.
Media y percentiles del perfil lipídico en el 2.o y 3.er trimestre de embarazo, según distintos autores
| Autores, media y percentiles en 2.o y 3.er trimestre | Colesterol total | Colesterol LDL | Colesterol HDL | Triglicéridos | Apolipoproteína A | Apolipoproteína B | LDL/HDL (P2,5 y P97,5) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| mmol/l | mg/dl | mmol/l | mg/dl | mmol/l | mg/dl | mmol/l | mg/dl | mg/dl | mg/dl | - | |||
| Piechota y Staszewski, 199220 | 2.o trimestre | Mediana | - | - | - | - | - | - | - | - | - | - | - |
| Percentil 95% | 8,24 | 318,15 | 5,61 | 216,60 | 2,54 | 98,10 | 2,87 | 220,77 | 2,48 | 1,47 | - | ||
| Percentil 97,5% | - | - | - | - | - | - | - | - | - | - | - | ||
| 3.er trimestre | Mediana | - | - | - | - | - | - | - | - | - | - | - | |
| Percentil 95% | 9,83 | 379,54 | 6,48 | 250,20 | 2,46 | 94,98 | 4,68 | 414,16 | 2,61 | 1,92 | - | ||
| Percentil 97,5% | - | - | - | - | - | - | - | - | - | - | - | ||
| Ying et al., 201521 | 2.o trimestre | Mediana | - | - | - | - | - | - | - | - | - | - | - |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | 8,30 | 320,46 | 5,10 | 196,91 | 2,10 | 81,39 | 6,30 | 557,52 | 1,90 | 1,80 | - | ||
| 3.er trimestre | Mediana | - | - | - | - | - | - | - | - | - | - | - | |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | 8,70 | 335,91 | 5,22 | 201,55 | 2,10 | 81,39 | 8,10 | 716,81 | 2,40 | 2,10 | - | ||
| Dathan-Stumpf et al., 201922 | 2.o trimestre | Mediana | 6,13 | 236,68 | 3,66 | 141,31 | 2,14 | 82,62 | 1,59 | 140,71 | 2,15 | 1,18 | 1,61 y 1,99 |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | 8,99 | 347,10 | 6,11 | 235,91 | 3,06 | 118,15 | 3,00 | 265,50 | 1,93 | 2,15 | - | ||
| 3.er trimestre | Mediana | 6,94 | 267,95 | 4,34 | 167,67 | 1,97 | 76,00 | 2,47 | 218,58 | 2,17 | 1,43 | 2,03 y 2,23 | |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | 9,71 | 374,90 | 6,98 | 269,50 | 3,13 | 120,85 | 4,76 | 421,24 | 2,21 | 2,17 | - | ||
| Wang et al., 201929 | 2.o trimestre | Mediana | 5,79 | 223,55 | 3,05 | 117,76 | 1,87 | 72,20 | 2,23 | 197,35 | - | - | - |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | - | - | - | - | - | - | - | - | - | - | - | ||
| 3.er trimestre | Mediana | 6,18 | 238,61 | 3,33 | 128,57 | 1,63 | 62,93 | 3,08 | 272,57 | - | - | - | |
| Percentil 95% | - | - | - | - | - | - | - | - | - | - | - | ||
| Percentil 97,5% | - | - | - | - | - | - | - | - | - | - | - | ||
| Valores recomendados no embarazoa | <5,2 | <200 | <4,2 | <162 | >1,03 | ≥40 | <1,7 | <150 | 1,04-2,25 | 0,6-1,17 | <2,5 | ||
En el embarazo normal, la mujer muestra un incremento fisiológico del 30-50% de CT en plasma en un proceso conocido como hipercolesterolemia materna fisiológica33. En la hipercolesterolemia familiar (HF) y en algunos casos de mujeres con CT normal previo al embarazo, el CT durante la gestación se eleva por encima del rango fisiológico, con valores que superan los 280-300mg/dl34. Este último supuesto es denominado por algunos autores hipercolesterolemia materna suprafisiológica (HMSF)35,36 y se desconoce su prevalencia en mujeres anteriormente normolipémicas, ya que no se suele determinar el perfil lipídico a la mujer embarazada. Existe una correlación positiva entre el CT en sangre materna y fetal durante el segundo y tercer trimestre de embarazo, pero el CT del recién nacido de madres con HMSF es bajo37, salvo que exista un defecto genético del metabolismo lipídico, como en el caso de la HF.
Las células endoteliales sintetizan óxido nítrico (NO), un potente vasodilatador que se genera por las NO sintasas (NOS) y prosigue con la oxidación de L-arginina en un proceso dependiente de la bioactividad de varios cofactores, que incluyen la tetrahidrobiopterina (BH4)38,39. Una concentración baja de BH4 y/o su baja actividad favorece la generación del anión superóxido (O22−) en lugar de NO, produciéndose disfunción endotelial40,41. Las pacientes con hipercolesterolemia presentan niveles bajos de NO, de BH4 y un incremento de la actividad de arginasa34,36, lo que conduce a que la dilatación de la vena umbilical esté reducida y es uno de los mecanismos de inicio de la arteriosclerosis en el feto.
Así pues, la disfunción endotelial, fase inicial del desarrollo de la arteriosclerosis y las primeras lesiones arterioscleróticas en forma de estrías grasas, comienzan durante la vida intrauterina en los vasos fetales, como consecuencia de los niveles aumentados de CT en las madres con hipercolesterolemia34,42 y puede ser consecuencia del desequilibrio descrito entre vasodilatadores y vasoconstrictores circulantes en la circulación fetoplacentaria43–45, ya que no existe inervación autónoma en la placenta ni en los vasos del cordón umbilical. Los cambios lipídicos durante el embarazo se acompañan de un perfil oxidante/antioxidante aumentado46 y de reducción de la actividad de paraoxonasa-147 sugiriendo que la hiperlipidemia materna puede provocar una mayor susceptibilidad al estrés oxidativo durante el embarazo14.
Existe la teoría de que la hipercolesterolemia materna programa el metabolismo del CT en el recién nacido. Este hecho ha sido avalado por estudios epidemiológicos34, incluso si la hipercolesterolemia materna es solo temporal durante el embarazo. Algunos estudios de lipidómica sobre la composición de fosfolípidos para la síntesis de ecosanoides en la hipercolesterolemia gestacional también contribuyen a afianzar esta teoría48. El estudio FELIC (Fate of Early Lesions in Children)49, que analizó los hallazgos de autopsias practicadas a 156 niños de entre 1 y 14 años con CT normal, concluyó que la hipercolesterolemia materna se asoció a una mayor progresión de la arteriosclerosis en el niño. En otro estudio, las madres con niveles de c-LDL muy elevado a partir del segundo trimestre de embarazo tenían hijos con c-LDL elevado a la edad de 6 a 13años50. La hipercolesterolemia materna y el estrés oxidativo asociado pueden conducir a una acumulación de LDL oxidada en las estrías grasas y a una desregulación de los genes implicados en el metabolismo de los lípidos del recién nacido, por mecanismos de epigenética, y aumentar la susceptibilidad posnatal a la arteriosclerosis37,50,51.
Por otra parte, numerosos estudios concluyen que es la HTG durante el embarazo la que está involucrada en el desarrollo de preeclampsia, si bien la hipercolesterolemia puede participar en su fisiopatología a través de la disfunción endotelial y la inflamación arterial14,52.
Hipercolesterolemia familiar heterocigotaEl aumento fisiológico normal del 30% en los niveles de CT durante el embarazo también se observa en mujeres con HF53,54 y empeora gravemente la hipercolesterolemia de base. Además, las mujeres embarazadas deben interrumpir el tratamiento con estatinas55.
Por otro lado, en mujeres sin perfil lipídico conocido antes del embarazo, la hipercolesterolemia durante la gestación nunca nos debe hacer plantear en este periodo el diagnóstico de HF ni el estudio de una posible mutación. Desde un punto de vista teórico, la hipercolesterolemia materna conduce a un perfil más procoagulante que en mujeres sin HF, porque existe un menor descenso en la resistencia vascular útero-placentaria que el observado en mujeres sanas56 y consecuentemente podría facilitar el parto prematuro en las madres con HF. Sin embargo, las mujeres con HF no parecen tener mayor riesgo de parto prematuro, lactantes con bajo peso al nacer o malformaciones congénitas según el resultado del estudio de una cohorte retrospectiva noruega con 2.319 nacimientos de 1.093 mujeres con HF57.
No hay estudios sobre la influencia del embarazo en el inicio de enfermedad cardiovascular entre las mujeres con HF, ya que se necesitarían extensos estudios de cohortes para llegar a alguna conclusión al respecto.
Los mecanismos de la epigenética, que incluyen la metilación del ADN, modificación de las histonas, el remodelado de la cromatina y alteraciones del microARN, son alteraciones heredables en la actividad de los genes que no implican cambios en el código genético pero que permiten a las células responder de formas diferentes a los cambios ambientales58,59. Respecto al recién nacido, la epigenética puede explicar la programación fetal del metabolismo de su colesterol por el impacto de la hipercolesterolemia materna, que actúa como un factor de riesgo intrauterino para el posterior desarrollo de enfermedad cardiovascular durante la edad adulta58,59.
La herencia mendeliana de la HF hace que se transmita por igual a ambos sexos. Algunos estudios han investigado la importancia de la herencia en el fenotipo de HF, ya que los recién nacidos con HF heredada de la madre han estado expuestos a mayores niveles de CT en el útero que los que la heredan del padre60–65. La mitad de estos estudios no han observado diferencias en los niveles plasmáticos de CT del recién nacido entre los que han heredado la HF de la madre o del padre60,61, mientras que el resto de estudios sí las han observado. Entre ellos, el estudio de Van der Graaf et al.65 con 2.339 adultos con HF encontró un ligero incremento de CT y del c-LDL del orden de 0,16 y 0,19mmol/l, respectivamente, entre los que recibieron la herencia materna respecto a la paterna. En un estudio de pedigree holandés63 en el que se efectuó el seguimiento durante 7 generaciones de los descendientes de 161 individuos con una mutación concreta del receptor LDL, se demostró mayor mortalidad entre los que heredaron la HF de la madre.
El tipo de mutación del receptor LDL condiciona el perfil lipídico de los individuos adultos con HF y debe considerarse el factor dominante en el fenotipo HF66. Sin embargo, los estudios mencionados sobre herencia materna o paterna indican que la exposición a la hipercolesterolemia en el útero, a largo plazo puede afectar desfavorablemente al fenotipo en términos de manifestaciones ateroscleróticas59.
Así pues, los genes, la dieta y los estilos de vida que comparten las madres e hijos con HF, y también los efectos directos de la exposición a la hipercolesterolemia materna junto a otros posibles factores asociados, son los que modularán en gran parte la salud cardiovascular durante el crecimiento50.
Estatinas y embarazoLas principales guías clínicas y documentos de consenso de expertos coinciden en que no se deben tomar estatinas durante el embarazo al estar contraindicadas por riesgo de teratogénesis, especialmente durante el primer trimestre67–70. Tal afirmación se deriva de que todas las estatinas están consideradas por la Food and Drug Administration (FDA) en la categoría X, por lo que se debe aconsejar su retirada al menos un mes antes de la concepción y durante el embarazo y la lactancia, debido a que diversos estudios en modelos animales con ratas y conejos mostraron anomalías en el sistema nervioso central y extremidades con el uso de altas dosis de estatinas71. La información disponible en humanos relacionada con anomalías congénitas proviene inicialmente de la comunicación de casos aislados, registros de pacientes y estudios de pequeñas cohortes, aunque fueron estudios no controlados y limitados por sesgo de selección72,73.
En los últimos años existe un incremento en la prescripción de estatinas en mujeres en edad fértil debido a un aumento de la obesidad, la inactividad física, dietas altas en grasa, diabetes tipo 2 y mayor diagnóstico de HF. Además, se estima que la mitad de los embarazos no están planificados74,75. Por todo ello, es fácil pensar que algunas mujeres han iniciado su embarazo expuestas al tratamiento con estatinas. En estudios de series de casos76, de cohortes77,78, estudios basados en registros57, un pequeño estudio aleatorizado y controlado79 y varias revisiones sistemáticas71,74,75,80 se pudo comprobar que la prevalencia de anomalías congénitas en madres expuestas a estatinas fue similar a la prevalencia en el resto de población gestante en los grupos control. En contraste con los primeros estudios de casos, la mayoría de estos estudios son estudios controlados para factores de confusión como la diabetes y la obesidad que por sí mismas se asocian a mayor teratogénesis. Sin embargo, con la información disponible en la actualidad, se debe seguir recomendando la interrupción de las estatinas durante el embarazo76.
Respecto a otras complicaciones como el parto prematuro, la muerte fetal o el aborto espontáneo en el primer trimestre de embarazo, el pequeño número de pacientes incluido en los estudios hace difícil llegar a alguna conclusión71,78. Pero un amplio estudio británico basado en un registro de datos de medicina primaria81 mostró una mayor proporción de embarazos que finalizaron en aborto espontáneo cuando se utilizaron estatinas, en comparación con las embarazadas que no tomaron estatinas.
Es de destacar la evidencia emergente del papel potencial de las estatinas para prevenir la preeclampsia por su efecto vasodilatador sobre las venas umbilicales82–84. En particular, las estatinas hidrofílicas como pravastatina, de la cual se encuentran concentraciones inferiores al límite de detección en el cordón umbilical y que quizás tenga menos efectos adversos sobre el feto que el resto de estatinas. Los estudios en desarrollo para demostrar la prevención y la reversión de la insuficiencia placentaria con este fármaco84 nos ampliarán los conocimientos sobre esta condición clínica.
Otros tratamientos en el embarazoExisten pocos datos sobre el efecto teratógeno de otros hipolipemiantes. Ezetimiba, fibratos y ácido nicotínico se han asociado con malformaciones en estudios animales y clasificados en la categoría C de la FDA y de la Pregnancy and Lactation Labeling Rule (PLLR)14. No se aconseja su uso durante el embarazo ni en la lactancia.
Entre los fármacos en la categoría B se encuentran las resinas secuestradoras de ácidos biliares, colesevelam y mipomersen, sobre los que hay algún estudio controlado en mujeres embarazadas, sin efectos adversos sobre el feto. A pesar de la contradicción de que colestiramina se encuentra clasificada en el grupo C, los únicos medicamentos que se acepta utilizar durante el embarazo son colesevelam y colestiramina porque no pasan a la circulación sistémica y no deberían aumentar el riesgo de malformaciones congénitas54,55,69,85.
No hay estudios con inhibidores de PCSK9 en el embarazo ni sobre daño fetal cuando se administraron a mujeres embarazadas con HF. Estudios en primates con evolocumab demostraron que puede cruzar la barrera placentaria, sin que se observaran alteraciones embrionarias o fetales68. Hoy por hoy y ante la falta de información, se han de retirar los inhibidores de PCSK9 antes de la concepción.
En mujeres embarazadas con HF heterocigota con cardiopatía isquémica, HF homocigota, y pancreatitis aguda (PA) por HTG, existe un amplio consenso en utilizar la aféresis de lipoproteínas como tratamiento, si así se considera indicado por las circunstancias clínicas individuales86.
Hipercolesterolemia familiar homocigotaEl embarazo en mujeres con hipercolesterolemia familiar homocigota (HFHo) está poco documentado porque los casos publicados son excepcionales y no alcanzan el centenar. El incremento del volumen y del gasto cardíaco y el resto de cambios fisiológicos que se producen en el embarazo pueden empeorar lesiones arteriales preexistentes y desencadenar episodios agudos cardiovasculares en un 30% de los casos87. Es por ello que se recomienda una detallada evaluación de la situación cardiovascular de la mujer con HFHo que desee quedarse embarazada y que pueda contraindicar la gestación88.
No hay guías clínicas de terapéutica para manejar el embarazo de mujeres con HFHo, pero se recomienda la aféresis de lipoproteínas para descender el c-LDL y prevenir complicaciones89. La Sociedad Americana de Aféresis la indica en HFHo con categoría I y grado de evidencia IA90 en todas sus modalidades. Los resultados de casos publicados con este tratamiento refieren una buena tolerancia y sin mayores efectos secundarios que en mujeres no embarazadas87,91.
El abordaje de la mujer gestante con HFHo es un reto médico que exige una planificación multidisciplinar de personal especializado, cardiólogos, obstetras, lipidólogos, médicos de cuidados intensivos y psicólogos, entre otros, así como del soporte de las administraciones para implementar todas las técnicas necesarias para su manejo92,93.
Hipertrigliceridemia y embarazoMetabolismo lipídico durante el embarazo y patogenia de la pancreatitis inducida por hipertrigliceridemiaComo ya se ha mencionado con anterioridad, el embarazo normal se caracteriza por cambios adaptativos en el metabolismo lipídico destinados a garantizar las necesidades placentarias y los requerimientos de glucosa y lípidos en el crecimiento del feto94,95. En mujeres cuyo metabolismo lipoproteico es anormal, los cambios en dicho metabolismo lipídico pueden conducir a una HTG grave y pueden precipitar una PA96.
Durante el embarazo existe un incremento plasmático de los TG, sobre todo durante el segundo y tercer trimestre del embarazo. Habitualmente la concentración de TG plasmáticos aumenta de 2 a 4 veces en el último trimestre97, y usualmente no excede de 300mg/dl, por lo cual su relevancia clínica suele ser escasa52,98.
La HTG severa asociada al embarazo es una condición rara, que habitualmente ocurre durante el tercer trimestre del embarazo97. La HTG grave se define como TG en plasma superior a 1.000mg/dl; dichas gestantes muestran un mayor riesgo de complicaciones agudas y además tienen riesgo de presentar hiperlipidemia en el futuro99. Cabe destacar, que esta situación clínica amenaza el pronóstico maternofetal al aumentar la incidencia de complicaciones como la macrosomía fetal52,97 y expone a la madre a su mayor complicación, la PA100. No obstante, la prevalencia de PA es de un caso por cada 1.000-12.000 embarazos101–103. Las causas más frecuentes de PA durante el embarazo son colelitiasis, HTG grave e idiopáticas. También podrían aparecer otras complicaciones, tales como síndrome de hiperviscosidad, preeclampsia52,104,105 o desprendimiento de placenta106. Esta situación clínica requiere atención urgente basada principalmente en medidas dietéticas y la extracción fetal si la maduración fetal lo permite107,108.
Las causas más prevalentes de HTG durante el embarazo son las causas secundarias, tales como diabetes con mal control metabólico, síndrome metabólico y obesidad, alcoholismo y fármacos (corticoides, betabloqueantes, diuréticos, tamoxifeno y antipsicóticos, entre otros)109,110. Sin embargo, la mayoría de los casos de HTG grave gestacional que han sido descritos previamente, aun siendo menos prevalentes, fueron causados por síndrome quilomicronémico familiar (SQF) o HTG familiar111,112. Hasta la actualidad se han descrito mutaciones raras en los genes LPL, APO E, APO C2, Apo A5 que condicionan quilomicronemia en el embarazo113–115. También han sido descritos en la literatura casos de HTG secundaria al propio embarazo108,116.
Claves diagnósticas de pancreatitis aguda durante el embarazoEl diagnostico de PA durante el embarazo es difícil debido a que los síntomas pueden imitar un dolor abdominal de cualquier otra causa, incluso el inicio del parto. A veces también la propia PA puede desencadenar el inicio del parto debido a la propia irritación peritoneal96. Inicialmente se recomienda la realización de análisis de sangre, debido a que ayudarán a establecer el diagnóstico de PA y también a evaluar la gravedad. En cuanto a los parámetros analíticos específicos, tanto la amilasa como la lipasa se consideran marcadores fiables de PA durante el embarazo. La concentración plasmática de amilasa es normal o levemente aumentada durante el embarazo y la lipasa no varía117. Si se observa un incremento simultáneo de la alalina aminotransferasa >3 veces el límite superior de la normalidad, nos orientará hacia una etiología biliar118.
La ecografía abdominal es la técnica inicial de elección para descartar etiología biliar119 y no irradia al feto. En las embarazadas se prefiere la resonancia magnética nuclear (RMN) o RMN colangiopancreatografía (no ionizantes) evitando las radiaciones ionizantes que pueden emitir la Rx o la tomografía axial computarizada (TAC)120.
Es importante realizar el diagnóstico diferencial de patologías tales como infarto de miocardio, ulcus péptico, apendicitis, colecistitis, isquemia mesentérica aguda, pielonefritis, etc. Por supuesto también se deben descartar complicaciones obstétricas como preeclampsia, síndrome HELLP, desprendimiento de placenta y rotura uterina121. En los casos de gestación a término que presentan colección peripancreática, suele ser muy difícil llegar al diagnóstico122. A veces en algunos casos la PA inducida por HTG es difícil de diagnosticar, debido a que los valores disminuyen a los pocos días de ayuno, necesario como tratamiento de la PA.
Aspectos generales del manejo y tratamiento de la pancreatitis agudaCabe destacar que no existen guías obstétricas específicas del tratamiento de la PA secundaria a HTG en el embarazo. La presentación clínica de PA secundaria a HTG no difiere de otras etiologías y una vez que se logra el diagnóstico correcto, los algoritmos de manejo de las pacientes embarazadas son los mismos que para la población general96. Si la gestación se considera a término, habitualmente se decide finalizar la gestación. Es necesario que los valores plasmáticos de TG se normalicen cuanto antes. Sin embargo, hasta ahora existen restricciones en la prescripción de hipolipemiantes en el embarazo, debido a la falta de estudios consistentes realizados en humanos. Después del parto, se vuelven a utilizar los protocolos de la población general. Se tendrán que tener en cuenta: dieta específica muy baja en grasas, control de TG plasmáticos, habitualmente cada 1-2 semanas según la gravedad y sobre todo en el tercer trimestre115, y por supuesto un control obstétrico estricto. Se recomienda ingreso en caso de concentraciones de TG>1.500mg/dl. Por todo ello es importante la creación de unidades multidisciplinares para el adecuado manejo de estos casos123.
Dieta baja en grasas y suplementos nutricionalesTanto si existe embarazo como si no, el pilar fundamental del manejo de la HTG grave consiste en una dieta muy baja en grasas (<20% de la ingesta calórica total). A veces, esta restricción se traduce en pérdida importante de peso, lo que puede conllevar riesgos como bajo peso al nacer, prematuridad y complicaciones maternas. En algunos casos para controlar la HTG grave gestacional es necesario el ingreso hospitalario para administración de sueroterapia y a veces nutrición parenteral total, hasta que al menos los valores plasmáticos de TG desciendan en un 50%.
A su vez, las dietas bajas en grasa pueden inducir déficit de los ácidos grasos esenciales124; por ello, los TG de cadena media (TCM) o los ácidos grasos omega-3 son parte esencial del tratamiento. Además, los TCM son densamente calóricos (3,8kcal/g) y sus productos posteriores, como la acetil coenzima A, pueden desempeñar un papel en la mielinización cerebral del feto.
Hipolipemiantes para manejar la HTG en el embarazoLos hipolipemiantes son la primera línea terapéutica en la PA secundaria a HTG en no gestantes. Sin embargo, existen pocos estudios en embarazadas, por lo que disponemos de poca información sobre sus efectos teratogénicos.
Los ácidos grasos poliinsaturados omega-3 que contienen ácido eicosapentaenoico y ácido docosahexaenoico reducen los TG plasmáticos en un 25-30% por diversos mecanismos. Por una parte, pueden estimular directamente la LPL, mejorando la eliminación de las lipoproteínas ricas en TG, y también regulan los genes para la lipogénesis hepática y los que estimulan la oxidación de ácidos grasos en el hígado y el músculo esquelético. A pesar de considerarse según la FDA clase C, se consideran seguros y su uso está recomendado125.
Se limita el uso de fibratos durante el embarazo, porque hay pocos datos disponibles de estudios bien diseñados y se requieren más estudios para poder respaldar su uso en mujeres embarazadas126. Aunque se han descrito varios casos en los cuales se utilizaron fibratos durante el embarazo y no se observaron efectos teratogénicos115.
Las estatinas, como ya se ha comentado, no deben administrarse durante el embarazo126.
Insulina y heparinaLa insulina aumenta la actividad de la LPL y conduce a la degradación del quilomicrón, lo que reduce la HTG127, mientras que la heparina estimula la liberación de la LPL, que se adhiere a las células endoteliales y disminuye los niveles plasmáticos de los TG128. Se describió un caso de una embarazada, en la que el uso crónico de la heparina agotó la LPL en la superficie de las células endoteliales, lo que ocasionó un efecto hipertrigliceridemiante y por ello se desencadenó PA128. Se han descrito más casos de HTG secundaria al uso de heparina129, por lo que su uso no se recomienda115.
Recambio plasmáticoEstá indicado para disminuir los niveles plasmáticos de TG, además de reducir las citocinas inflamatorias y reemplazar el déficit de LPL o apolipoproteínas. En la PA secundaria a HTG, el recambio plasmático se puede utilizar según lo establecido por la guía de la American Society of Apheresis90. Existen varios estudios y algunos casos clínicos que evaluaron la seguridad y eficacia del recambio plasmático en pacientes embarazadas126,130–132. Los estudios que compararon el efecto de la plasmaféresis versus el tratamiento conservador sobre la morbimortalidad en los casos de PA inducida por HTG no encontraron diferencias estadísticamente significativas.
Como conclusión, podemos destacar que, aunque la hiperlipidemia es fisiológica en el embarazo, las gestantes con hipercolesterolemia monogénica y sobre todo las que padecen HTG grave suponen un reto en el manejo clínico que acaba finalmente involucrando a endocrinólogos, internistas, nutricionistas y ginecólogos. Esto implica la necesidad de crear algoritmos de manejo o guías de consenso. Además, al existir una clara contraindicación de los fármacos hipolipemiantes durante el embarazo, la dieta, el recambio plasmático o la nutrición parenteral total son opciones terapéuticas a tener en cuenta.
FinanciaciónLa redacción del artículo no se ha financiado.
Conflicto de interesesLas autoras no tienen conflicto de intereses.