Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) fueron incialmente desarrollados para el tratamiento de la diabetes por su actividad hipoglucemiante. Sin embargo, a la luz de los estudios clínicos más recientes, están revolucionando el abordaje de la enfermedad cardiovascular (CV) en el paciente diabético.
En el año 2015, el ensayo clínico EMPA-REG OUTCOME nos demuestra por primera vez que la empagliflozina –un fármaco considerado «antidiabético»– reduce la mortalidad CV y por cualquier causa, además de eventos CV mayores, hospitalización por IC y progresión de enfermedad renal. Posteriormente, otros estudios clínicos con agentes del mismo grupo farmacológico, CANVAS, con canagliflozina y DECLARE-TIMI-58 con dapagliflozina, corroboran la exitencia de los beneficios CV asociados a la inhibición del receptor SGLT2.
Los beneficios observados los sitúan más allá de simples agentes hipoglucemiantes, con un demostrado efecto cardionefroprotector en la enfermedad aterosclerótica, insuficiencia cardiaca, mortalidad total, mortalidad cardiovascular y progresión de insuficiencia renal. Actualmente ya son una realidad en pacientes diabéticos de alto y muy alto riesgo cardiovascular, mientras su evidencia en el paciente no diabético es cada vez mayor. Asistimos, por tanto, a un cambio de paradigma y posiblemente al nacimiento de una nueva especialidad, la cardio-endocrinología, con la implicación de nuevos tratamientos que deben ser considerados más que sólo fármacos antidiabéticos.
The sodium-glucose co-transporter 2 inhibitors (SGLT2i) were first conceived to treat type 2 diabetes due to their hypoglycaemic effect. However, due to an increasing number of studies, SGLT2i are changing the way we treat, and understand, diabetes, and cardiovascular risk, in general.
The EMPA-REG OUTCOME clinical trial, in 2015, showed for the first time that empagliflozine - a glucose lowering agent - lowers the risk of death from cardiovascular causes and death from any cause. Also, this SGLT2i lowered hospital admission for heart failure and delayed renal function worsening. From then on, other clinical trials with SGLT2i such as CANVAS (canagliflozin) and DECLARE-TIMI-58 (dapagliflozin) confirmed these positive effects.
With a proven and non-related glucose-lowering effect on heart failure, overall death, cardiovascular death, and renal function, SGLT2i stands out among the rest of anti-diabetic drugs. Since its role in treating patients with heart failure and type 2 diabetes has been undoubtedly established, new studies are paving the way for non-diabetic patients as well. A potential paradigm shift is being witnessed and, probably, the dawn of a new field, cardio-endocrinology, which involves new and far-reaching pharmacological agents.
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) fueron inicialmente desarrollados para el tratamiento de la diabetes por su actividad hipoglucemiante. Sin embargo, a la luz de los estudios clínicos más recientes, están revolucionando el abordaje de la enfermedad cardiovascular (CV) en el paciente diabético.
La diabetes mellitus tipo 2 (DMT2) actualmente es uno de los problemas de salud más prevalentes en el mundo occidental por su elevada incidencia y repercusión sobre la enfermedad cardiovascular. Se estima que para el 2050, uno de cada tres ciudadanos americanos será diabético. En España, las cifras son bastante similares con un 20% de diabetes entre los participantes del reciente estudio IBERICAN1. Las complicaciones cardiovasculares suponen la primera causa de muerte de los pacientes diabéticos, y por otra parte, hasta un 35% de pacientes con enfermedad CV establecida presentan además DMT22, con un riesgo de mortalidad al menos tres veces mayor que aquellos sin DMT23. Además, en torno al 40% de los pacientes con insuficiencia cardiaca (IC) tienen DMT24, lo que confiere significativamente más riesgo de hospitalización, muerte CV y muerte por cualquier causa.
Hasta ahora, las estrategias de reducción de morbimortalidad CV en pacientes con DM estaban centradas en un estricto control glucémico, así como en los factores de riesgo acompañantes (especialmente de la presión arterial y dislipemia). Los antidiabéticos orales clásicos y el tratamiento con insulina son capaces de controlar de una manera continua y efectiva los niveles elevados de glucosa, reduciendo de esta manera en torno a un 25% las complicaciones crónicas de la microcirculación (retinopatía, nefropatía y neuropatía). Sin embargo, no reducen de forma significativa las complicaciones crónicas de la macrocirculación (enfermedad CV e IC), tal como han demostrado los estudios ACCORD5, ADVANCE6 y VADT7.
En el año 2015, el ensayo clínico EMPA-REG OUTCOME nos demuestra por primera vez que la empagliflozina –un fármaco considerado «antidiabético»– reduce la mortalidad CV y por cualquier causa, además de eventos CV mayores, hospitalización por IC y progresión de enfermedad renal8. Posteriormente, otros estudios clínicos con agentes del mismo grupo farmacológico, CANVAS con canagliflozina9 y DECLARE-TIMI-5810 con dapagliflozina, corroboran la existencia de los beneficios CV asociados a la inhibición del receptor SGLT2. Dapagliflozina demostró además recientemente un beneficio robusto en pacientes con insuficiencia cardiaca y fracción de eyección del ventrículo izquierdo (FEVI) reducida, independientemente de la presencia o no de diabetes11. El beneficio cardiovascular asociado a distintos iSGLT2 sostiene la idea de un efecto mecanístico de clase más que un efecto propio de un fármaco en específico.
Receptores SGLTLos receptores SGLT conforman una familia de transportadores de membrana (tabla 1) para distintos sustratos (principalmente glucosa, pero también otros azúcares, inositol o urea). Para ello, aprovechan el gradiente electroquímico de sodio (Na+), generado por la bomba Na+/K+ para transportar glucosa al interior de las células en contra de su propio gradiente.
Receptores SGLT
| Características | SGLT1 | SGLT2 | SGLT3 |
|---|---|---|---|
| Función | Transportador de glucosa | Transportador de glucosa | Putative glucose sensor |
| Capacidad | Baja | Alta | - |
| Afinidad | Alta | Baja | - |
| Localización principal | Intestino delgadoCorazón | Riñón | Intestino delgadoMúsculo esquelético |
| Localización renal | Segmento S3 TCP | Segmentos S1 y S2 TCP | - |
| Reabsorción renal de glucosa | 10% | 90% | - |
| Gen codificante | SLC5a1 | SLC5a2 | SLC5a4 |
TCP: túbulo contorneado proximal.
El primero de estos transportadores en ser identificado y clonado fue el SGLT1, transportador de baja capacidad y alta afinidad. Su expresión tisular es bastante amplia, encontrándose en distintos órganos como pulmón, hígado, células alfa pancreáticas, músculo esquelético, corazón12, intestino y riñón (segmento S3 del túbulo contorneado proximal). Ejerce su función principal en el intestino, desempeñando en el riñón un papel más secundario (10% de la reabsorción urinaria de glucosa).
El receptor SGLT1 es el único subtipo de esta familia de receptores que se expresa en las células cardiacas. Distintos estudios preclínicos apuntan a que desempeña un papel clave en el suministro energético, especialmente en pacient es diabéticos o en condiciones de isquemia miocárdica, donde se ha observado un aumento de su expresión. Si su sobreexpresión se trata de un mecanismo defensivo o de una consecuencia del daño cardiaco, aún está por determinar.
El SGLT2, por su parte, tiene una localización casi exclusivamente renal, concretamente en el segmento S1 y S2 del túbulo contorneado proximal. Es un transportador de baja afinidad y gran capacidad y reabsorbe casi el 90% de la glucosa filtrada. Suele estar asociado a los transportadores de Na+ NHE3.
El efecto hipoglucemiante en diabéticos está condicionado por la eliminación del exceso de glucosa en orina, que ha sido calculada en torno a 80-100 mg al día. Su inhibición induce una glucosuria y natriuresis osmótica. Desde un punto de vista farmacológico, su efecto se podría considerar sistémico, ya que su actividad hipoglucémica depende directamente de la cantidad de glucosa en la orina. Este mecanismo de acción, además, le ofrece un perfil de seguridad alto: No guarda relación con la producción endógena de insulina y reduce el riesgo de hipoglucemia y de interacciones farmacológicas con la polifarmacia asociada con la población diabética.
Los tres iSGLT2, aprobados por la FDA, canagliflozina, dapagliflozina y empagliflozina, presentan a su vez cierta inhibición teórica sobre el receptor SGLT1. La mayor selectividad SGLT2:SGLT1 corresponde a empagliflozina (> 2.500), frente a canagliflozina o dapagliflozina (> 250, > 1.200, respectivamente). En cualquier caso, los niveles plasmáticos utilizados en clínica no parecen ser suficientes para alcanzar una inhibición real de SGLT1.
Dentro de este grupo de transportadores encontramos también el SGLT3, que en contraste con los anteriores, parece actuar más como un sensor bioquímico de glucosa que como un transportador propiamente dicho. En un primer momento, su expresión fue descrita en enterocitos, en el sistema nervioso entérico, neuronas hipotalámicas y riñón13. Sin embargo, la falta de anticuerpos específicos y de estudios in vivo hace difícil de confirmar su expresión tisular y función. Por último, completan la familia SGLT4, SGLT5 y SGLT6, aún en estudio, y cuya función se desconoce por el momento.
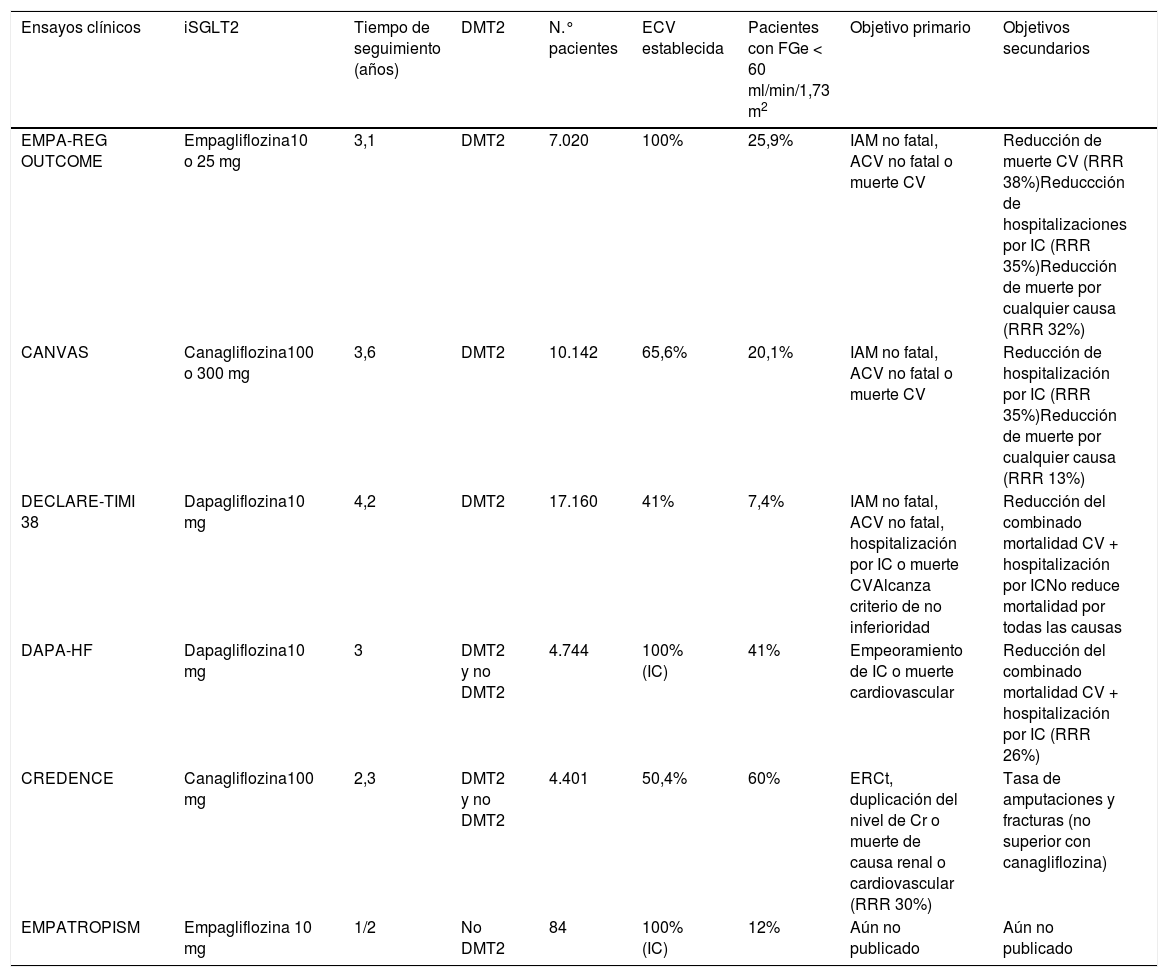
Beneficios cardiovascularesEstudios de seguridad cardiovascular con iSGLT2.El EMPA-REG OUTCOME (Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes)8 fue el primero de los estudios en evaluar la seguridad y efectividad de un iSGLT2 (tabla 2). Pacientes con DMT2 (n = 7.028) y enfermedad CV establecida (infarto de miocardio, enfermedad coronaria, angina inestable, accidente vascular cerebral o enfermedad arterial periférica) fueron asignados aleatoriamente a recibir empagliflozina o placebo por un período de seguimiento de tres años. El filtrado glomerular era de al menos 30 mL-min-1.73 m2 empagliflozina, añadida al tratamiento antidiabético estándar, redujo el riesgo del compuesto de muerte cardiovascular, infarto de miocardio no fatal e ictus no fatal (3 point MACE) en un 14% (hazard ratio 0,86; IC 95,02%, 0,74-0,99; p = 0,04 para superioridad), a expensas principalmente de una reducción en muerte cardiovascular de un 38%. Redujo también muerte por todas las causas un 32% y hospitalización por insuficiencia cardiaca un 35%, en comparación con placebo. Curiosamente, en el grupo con empagliflozina no hubo ningún efecto sobre la incidencia de los eventos aterotrombóticos (IAM o ACV no fatal). En cuanto a los efectos adversos, se menciona un incremento de infecciones genitales (6,4 frente a 1,8%) posiblemente relacionado con la glucosuria.
Principales ensayos clínicos con iSGLT2
| Ensayos clínicos | iSGLT2 | Tiempo de seguimiento (años) | DMT2 | N.° pacientes | ECV establecida | Pacientes con FGe < 60 ml/min/1,73 m2 | Objetivo primario | Objetivos secundarios |
|---|---|---|---|---|---|---|---|---|
| EMPA-REG OUTCOME | Empagliflozina10 o 25 mg | 3,1 | DMT2 | 7.020 | 100% | 25,9% | IAM no fatal, ACV no fatal o muerte CV | Reducción de muerte CV (RRR 38%)Reduccción de hospitalizaciones por IC (RRR 35%)Reducción de muerte por cualquier causa (RRR 32%) |
| CANVAS | Canagliflozina100 o 300 mg | 3,6 | DMT2 | 10.142 | 65,6% | 20,1% | IAM no fatal, ACV no fatal o muerte CV | Reducción de hospitalización por IC (RRR 35%)Reducción de muerte por cualquier causa (RRR 13%) |
| DECLARE-TIMI 38 | Dapagliflozina10 mg | 4,2 | DMT2 | 17.160 | 41% | 7,4% | IAM no fatal, ACV no fatal, hospitalización por IC o muerte CVAlcanza criterio de no inferioridad | Reducción del combinado mortalidad CV + hospitalización por ICNo reduce mortalidad por todas las causas |
| DAPA-HF | Dapagliflozina10 mg | 3 | DMT2 y no DMT2 | 4.744 | 100% (IC) | 41% | Empeoramiento de IC o muerte cardiovascular | Reducción del combinado mortalidad CV + hospitalización por IC (RRR 26%) |
| CREDENCE | Canagliflozina100 mg | 2,3 | DMT2 y no DMT2 | 4.401 | 50,4% | 60% | ERCt, duplicación del nivel de Cr o muerte de causa renal o cardiovascular (RRR 30%) | Tasa de amputaciones y fracturas (no superior con canagliflozina) |
| EMPATROPISM | Empagliflozina 10 mg | 1/2 | No DMT2 | 84 | 100% (IC) | 12% | Aún no publicado | Aún no publicado |
ECV: enfermedad cardiovascular; ERCt: enfermedad renal crónica terminal (diálisis, trasplante renal, o un FGe inferior a 15 ml/1,73 m2 durante 30 días); FGe: filtrado glomerular estimado.
El programa CANVAS (Canagliflozin Cardiovascular Assessment Study)9 integra los resultados de dos ensayos clínicos (CANVAS y CANVAS-R), en los que se compara canagliflozina vs. placebo en pacientes diabéticos de alto riesgo cardiovascular. Se incluyeron pacientes en prevención primaria (34,4%) sin antecedentes de ECV establecida.
Alcanzó el 3 point MACE, tanto para inferioridad como para superioridad, ocurriendo en 26,9 frente a 31,5 individuos del grupo placebo por 1.000 pacientes y año (hazard ratio, 0,86; IC 95%, 0,75 a 0,97; p<0,001 para no inferioridad; p = 0,02 para superioridad). Los objetivos individuales (IAM, AVC, y MCV) no alcanzaron la significación estadística por separado, pero mostraron una marcada tendencia favorable. También hubo beneficio en el objetivo secundario (rehospitalización por insuficiencia cardiaca, pérdida del filtrado glomerular de más del 40%, o desarrollo de insuficiencia renal terminal con necesidad de diálisis o muerte de causa renal). En cuanto a la seguridad, la frecuencia de infecciones genitales en hombres fue mayor con canagliflozina (3,5 vs. 1,1%) y de infecciones genitales micóticas en mujeres (6,9 vs. 1,8). En este estudio se observó un aumento del riesgo de amputaciones (0,6 frente a 0,3%). Aun así, no está claro si este último punto se trataría tan sólo de un efecto estadístico, puesto que no cuenta con una explicación mecanística clara y no fue confirmado posteriormente en el estudio CREDENCE ni con ningún otro iSGLT2.
El estudio DECLARE (Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes)10 evaluó el efecto de dapagliflozina frente a placebo. Incluyó más de 17.000 pacientes con DMT2, con factores de riesgo CV (59%) y enfermedad cardiovascular establecida. Dapagliflozina no alcanzó el criterio de superioridad frente a placebo (8.8% en el grupo dapagliflozina frente a 9.4 en el grupo placebo;
HR, 0,93; IC 95%, 0,84 a 1,03; p = 0,17). Sí alcanza, sin embargo, el criterio de no inferioridad. Se redujo el objetivo combinado de muerte cardiovascular u hospitalización por insuficiencia cardiaca (4,9 frente al 5,8), gracias principalmente a la reducción de ingresos por insuficiencia cardiaca. No hubo diferencias significativas en la mortalidad cardiovascular. Se observó un cierto aumento, significativo pero poco frecuente, de la cetoacidosis diabética (0,3 frente al 0,1%; p = 0,02) y de las infecciones genitales (0,9 frente al 0,1%; p<0,001).
Un reciente metaanálisis14 ha comparado los tres ensayos clínicos principales (EMPA-REG OUTCOME, CANVAS Y DECLARE), con un total de 34.322 pacientes diabéticos. El porcentaje de pacientes con enfermedad cardiovascular establecida (no sólo FRCV) difiere entre los tres: 100% EMPA-REG (prevención secundaria), más del 60% CANVAS y 41% DECLARE. Según estas diferencias, el beneficio CV parece hacerse más evidente cuanto mayor es la carga de enfermedad, de forma que en el estudio DECLARE los resultados sólo rozan la positividad y no alcanzan el criterio de superioridad, a diferencia del EMPA-REG. El porcentaje de pacientes diagnósticados con insuficiencia cardiaca, al principio del estudio, sí era similar, oscilando entre un 10 y un 15%. De forma consistente, el punto más llamativo de los iSGLT2 en conjunto es la reducción del riesgo de hospitalización por insuficiencia cardíaca (30%) y la prevención de nefropatía (45%).
Efecto a nivel metabólicoDesde un punto de vista farmacológico hay una serie de factores a destacar:
- 1.
Los beneficios CV se obtienen sin reducción en la tasa de eventos aterotrombóticos (SCA o ACV) normalmente incrementados en los pacientes diabéticos. Paralelamente, fármacos antidiabéticos que han demostrado reducir eventos aterotrombóticos (agonistas GLP1) no tienen efecto sobre la evolución de la insuficiencia cardiaca15.
- 2.
Las diferencias empiezan a ser significativas tras dos-tres meses de tratamiento con iSGLT2.
- 3.
El efecto hipoglucémico adicional de los iSGLT2 en los ensayos clinicos se sitúa en torno a un 0,3% de reducción adicional en los niveles de HbA1c. Efecto también obtenido en ensayos con los inhibidores del DPP4 (iDPP4), pero sin beneficios CV asociados.
- 4.
El efecto sobre los factores de riesgo CV como la reducción de peso corporal (1-2 kg), la presión arterial (3-5 mmHg), o perfil lipídico, no explicarían la magnitud ni la rapidez de los beneficios obtenidos, tal como se analiza en un reciente post-hoc analisis16.
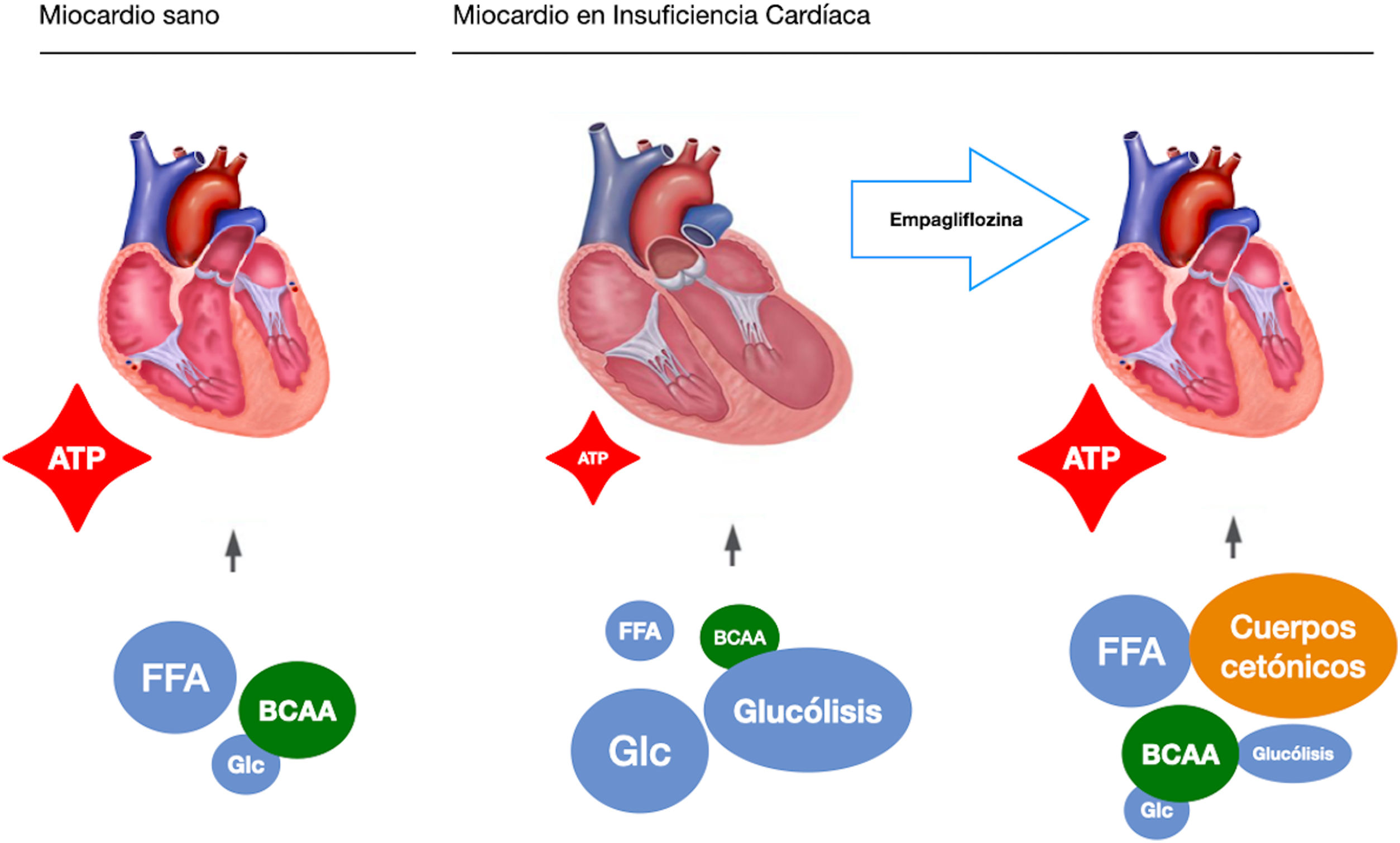
Estas observaciones subrayan un posible mecanismo de acción, independiente de su acción hipoglucemiante, siendo el punto de partida de investigaciones presentes y futuras. En este sentido, nuestro grupo de estudio plantea la posibilidad de un mecanismo independiente en un estudio pre-clínico basado en un modelo porcino de insuficiencia cardiaca de origen isquémico17. Para extraer el componente glucémico de la ecuación, todos los cerdos fueron no diábeticos. De forma similar al EMPA-REG OUTCOME, tras únicamente dos meses de tratamiento observamos una reducción significativa del remodelado adverso del ventrículo izquierdo, mejora en la función cardiaca y reducción del remodelado neuro-hormonal. Postulamos que el mecanismo de acción responsable de los beneficios observados era un cambio en la fuente de energía miocardio del corazón isquémico. En condiciones normales, el miocardio consume ácidos grasos y glucosa como fuente energética. En la insuficiencia cardiaca este pasa a consumir glucosa como recurso principal, lo cual requiere más moléculas de oxígeno y genera menos moléculas de ATP. Los cerdos tratados con empagliflozina utilizaban principalmente cuerpos cetónicos y aminoácidos de cadena ramificada (BBCA) como fuente de energía. Estas fuentes energéticas no solamente necesitaban menos oxígeno, sino que también generaban más moléculas energéticas de ATP (fig. 1). Por tanto, un posible switch metabólico desde la glucosa hacia los cuerpos cetónicos como nueva fuente energética podría explicar potencialmente una optimización de la eficiencia miocárdica inducida por los iSGLT2.
Empagliflozina induce un cambio de sustrato metabólico a nivel miocárdico, más eficiente desde el punto de vista energético. ATP: adenosín-trifosfato; BCAA: aminoácidos de cadena ramificada por sus siglas en inglés (Branched-Chain Amino Acids); FFA: ácidos grasos libres por sus siglas en inglés (Unesterified free fatty acid); Glc: glucosa.
Hasta el momento, la reducción del riesgo de hospitalización por IC observada en distintos ensayos clínicos parece independiente de la presencia de historia conocida de IC y es mayor cuanto peor es la función renal basal. En el estudio DECLARE-TIMI-58, la reducción de hospitalización por IC fue similar en pacientes con FE reducida y conservada. Ninguno de estos estudios, sin embargo, fue diseñado para evaluar eficacia en IC. La proporción de pacientes con IC, por tanto, era escasa.
El primer estudio que evalúa los efectos de un fármaco iSGLT2 en pacientes con IC es el DAPA-HF11. Incluyó pacientes diabéticos y no diabéticos, todos ellos con IC sintomática y FEVI menor a 40%. Se aleatorizaron a dapagliflozina o placebo, añadido a tratamiento médico estándar. El objetivo primario fue un compuesto de muerte CV, hospitalización por IC o visita urgente que precisara tratamiento intravenoso. Dapagliflozina redujo el objetivo primario un 26% con respecto al grupo placebo (HR 0,74; IC 95%, 0,65-0,85) El análisis independiente de los componentes del objetivo primario continuó siendo significativo. El beneficio de dapaglifozina fue positivo independientemente de la presencia o no de diabetes. En pacientes con insuficiencia cardiaca con fracción de eyección preservada (superior a 40%), encontramos el estudio DELIVER centrado en búsqueda de eventos cardiovasculares.Partiendo de la base de las observaciones de nuestro modelo preclinico de cerdos no-diabéticos, diseñamos el estudio clinico EMPA-TROPISM18 (Are the «Cardiac Benefits» of Empagliflozin Independent of Its Hypoglycemic Activity?; NC***T 03485222) dentro de la red de hospitales de Mount Sinai (EE. UU.). El EMPA-TROPISM es un estudio mecanístico de doble ciego, aleatorizado y controlado con placebo, con el objetivo de demostrar los beneficios cardiovasculares de la administración de empagliflozina sobre la función cardiaca, actividad cardiopulmonary, así como la calidad de vida en pacientes de IC con fracción de ejecución reducida. Como característica principal de este estudio, todos los pacientes son no diabéticos.
Otros ensayos clínicos en curso han empezado a incluir pacientes diabéticos y no diabéticos. Uno de los principales es el programa EMPEROR-HF (EMPEROR-REDUCED para fracción de eyección reducida y EMPEROR-PRESERVED para conservada), centrado en la detección de criterios de morbimortalidad a largo plazo en pacientes con IC. Concretamente, en espera de ser publicados, los resultados de EMPEROR-REDUCED han sido comunicados de forma preliminar. Empagliflozina cumpliría el criterio de valoración principal de reducir el riesgo de muerte cardiovascular u hospitalización por insuficiencia cardiaca en pacientes con y sin diabetes.
Otros posibles mecanismos de acción CVLos iSGLT2 mejoran moderadamente el control glucémico, el peso y ligeramente la tensión arterial. La reducción de HbA1c parece ser mayor cuanto peor es el control glucémico (en relación directa con la carga glucémica a filtrar), en torno a 0,79% en monoterapia y 0,61% añadidos a tratamiento antidiabético estándar11. Su efecto hipoglucemiante requiere una función renal relativamente conservada (aclaramiento por encima de 30 mL/min/1,73 m3). Por contra, el efecto sobre la tensión arterial, sin aumento de la frecuencia cardiaca, se mantiene incluso en pacientes con filtrado glomerular reducido, lo que podría traducir un posible efecto inhibidor sobre la activación del sistema nervioso simpático en la insuficiencia cardiaca. Se han reportado valores en torno a 2,46 mmHg de media para la presión sistólica y 1,46 para la diastólica19.
Un estudio prospectivo de 76 pacientes tratados con empagliflozina mostró reducciones no sólo de la tensión arterial, sino también en la presión aórtica central y en la presión de pulso en pacientes diabéticos20. Dapagliflozina mostró resultados similares en un estudio aleatorizado y controlado con placebo en DMT221. La presión aórtica central está principalmente determinada por la rigidez arterial en las grandes arterias y se considera una importante variable subrrogada de poscarga, ligada estrechamente con el pronóstico cardiovascular. La reducción de la rigidez aórtica alivia la poscarga cardiaca y reduce la demanda energética, lo que es beneficioso en IC.
Los iSGLT2 inhiben también los receptores NHE1, transportadores de Na+ e H+ localizados a nivel miocárdico22. Su expresión está aumentada en la insuficiencia cardiaca, incrementando los niveles intracitoplasmáticos de Na+ e indirectamente de Ca2+. Todo ello conduce finalmente a la apoptosis celular y al daño miocárdico. Su inhibición estaría relacionada, por tanto, con una mejora en el equilibrio iónico, la función mitocondrial, y consecuentemente, con el suministro energético del miocito21.
Resulta interesante también su prolongado efecto natriurético además de glucosúrico. Además, al reducir la absorción de glucosa en el segmento S1 del asa de Henle, generando una glucosuria osmótica, actúa también sobre los transportadores NHE3, responsables de gran parte de la reabsorción de Na+ a nivel tubular. Precisamente un perfil iónico diferente en comparación con otros agentes diuréticos ha sido señalado por algunos autores como responsable de una mayor afinidad por el líquido intersticial23, lo que podría explicar en parte los beneficios CV.
Las mejoras a nivel metabólico y el aumento en la reabsorción tubular de potasio y magnesio24 han sido propuestos también por algunos autores como responsables de un posible efecto antiarrítmico y de menores tasas de muerte súbita. Entre otros mecanismos de acción adicionales, se incluyen la disminución de adiposidad, del peso, aumento de la lipogénesis o la reducción específica del tejido adiposo epicárdico25.
Beneficio renalImplicación renal de los estudios de seguridad cardiovascularLos mismos ensayos de seguridad cardiovascular con iSGLT2 (estudio CANVAS, EMPA-REG OUTCOME y DECLARE-TIMI-58) sugerían por primera vez una mejora también del pronóstico renal en DMT2.
El metaanálisis mencionado previamente14 que engloba estos tres ensayos clínicos muestra un descenso del 45% del triple end-point de deterioro de función renal, enfermedad renal terminal y muerte de causa renal. Curiosamente, el efecto nefroprotector y el de reducción en el ingreso por insuficiencia cardiaca mostraban una distribución inversa. El primero es mayor cuanto mejor es la función renal, con reducciones en el objetivo compuesto del 33, 44 y 56% para FG de < 60 mL/ min, 60-90 mL/min y > 90 mL/min, respectivamente. La reducción en el ingreso por insuficiencia cardiaca es mayor por contra en pacientes con peor función renal: 40, 31 y 12% para FG < 60 mL/min, 60-90 mL/min y > 90 mL/min, respectivamente.
Sin embargo, estos ensayos clínicos no tenían objetivos primarios renales e incluían pocos pacientes con enfermedad renal avanzada (TFGe < 60 mL/min/1,73 m2): 26% en el estudio EMPA-REG OUTCOME, 20% en el estudio CANVAS y 9% en el estudio DECLARE-TIMI-58 (tabla 2). El primer ensayo clínico con iSGLT2 con un objetivo primario cardio-renal es el estudio CREDENCE26 (Canafliglozin and Renal Events in Diabetes With Established Nephropathy Clinical Evaluation). En él se incluyeron pacientes con DMT2 y enfermedad renal crónica con albuminuria, asignados a recibir canagliflozina (100 mg al día) o placebo.
La TFGe era de 30-90 mL/min/1,73 m2 (60% de ellos TFGe < 60), el cociente de albúmina/ creatinina en orina de 300-5.000 mg/g y el tratamiento incluía inhibidor del sistema renina-angiotensina-aldosterona. El objetivo primario estaba compuesto por enfermedad renal crónica en etapa terminal (diálisis, trasplante o una TFGe sostenida de < 15 mL/min/1,73 m2), la duplicación del nivel de creatinina sérica o muerte de causa renal o cardiovascular. Tuvo una media de seguimiento de 2,26 años y en el momento de su interrupción se habían reclutado 4.401 pacientes.
El riesgo relativo del objetivo primario fue un 30% más bajo en el grupo de canagliflozina, respecto al grupo placebo, con unas tasas de eventos del 43,2 y 61,2 por 1.000 pacientes-año (p = 0,00001). El riesgo relativo del objetivo compuesto de enfermedad renal crónica terminal, duplicación del nivel de creatinina y muerte de causa renal se redujo un 34% (p < 0,001) y el riesgo relativo de enfermedad renal crónica terminal se redujo un 32% (p = 0,002). También se objetivó un riesgo menor de muerte cardiovascular, infarto agudo de miocardio o ictus en el grupo de la canagliflozina (p = 0,001), así como una reducción de la hospitalización por insuficiencia cardíaca (HR 0,61; IC 95%: 0,47-0,80; p < 0,001). No hubo diferencias significativas en el riesgo de muerte cardiovascular o muerte por todas las causas. En términos de seguridad, no hubo una mayor tasa de eventos adversos en el grupo de la canagliflozina (exceptuando infecciones micóticas, principalmente en hombres) y un discreto aumento de cetoacidosis diabética. No se confirmó ningún aumento en la tasa de amputaciones o fracturas con canagliflozina.
Mecanismos de acciónAl igual que ocurre en el aspecto cardiovascular, el beneficio a nivel renal parece responder no sólo a la simple optimización del control glucémico. El feedback tubuloglomerular, la reducción de la presión arterial, la reducción de la isquemia renal, y el efecto antiinflamatorio y antifibrótico podrían desempeñar un papel fundamental en el beneficio observado con los iSGLT227.
La diabetes, la enfermedad renal crónica, y muy posiblemente la insuficiencia cardiaca, se asocian a un estado de hiperfiltración a nivel glomerular. La reducción de la hiperfiltración y la hipertensión intraglomerular ha sido precisamente señalada como potencial mecanismo de acción. Resultado de ello, en las primeras semanas de tratamiento con iSGLT2, la TFGe disminuye en un rango de 3-5 mL/min/1.73 m2 para después estabilizarse. Posteriormente además, se enlentece la progresión a estadios más avanzados o severos de enfermedad renal.
Recientemente Kidokoro et al.28, por primera vez, han visualizando directamente in vivo los cambios hemodinámicos a nivel glomerular inducidos por un iSGLT2. En un modelo murino, demuestran cómo la empagliflozina reduce la hiperfiltración glomerular por medio de un mecanismo dependiente de adenosina, independiente de la eliminación de glucosa y mediado por una vasoconstricción de la arteriola aferente. La vasoconstricción de la arteriola eferente y la reducción de la hiperfiltración eran ya detectadas pocas horas trás la administración de empagliflozina. Al subrayar la natriuresis sobre la glucosuria como mecanismo fundamental, sugieren que su efecto podría ser igualmente beneficioso en pacientes con enfermedad renal no diabética, un contexto donde la eliminación renal de glucosa no sería tan relevante.
ConclusiónLa investigación con iSGLT2 está ayudando no sólo a clarificar los mecanismos subyacentes a la insuficiencia cardiaca, la enfermedad renal y la diabetes mellitus, sino a situar este grupo farmacológico como nueva arma terapéutica dentro de la farmacopea cardiovascular.
Los beneficios observados los sitúan más allá de simples agentes hipoglucemiantes, con un demostrado efecto cardionefroprotector en la enfermedad aterosclerótica, insuficiencia cardiaca, mortalidad total, mortalidad cardiovascular y progresión de insuficiencia renal. Actualmente ya son una realidad en pacientes diabéticos de alto y muy alto riesgo cardiovascular, mientras su evidencia en el paciente no diabético es cada vez mayor.
Asistimos, por tanto, a un cambio de paradigma y posiblemente al nacimiento de una nueva especialidad, la cardio-endocrinología, con la implicación de nuevos tratamientos que deben ser considerados más que sólo fármacos antidiabéticos.
FinanciaciónJ.A. Requena Ibáñez cuenta con financiación de la Fundación Alfonso Martin Escudero (beca de investigación en universidades o centros en el extranjero 2019) para realizar investigación en la Unidad de Aterotrombosis de Mounti Sinai Heart.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.