El presente documento es una actualización de las recomendaciones de práctica clínica para el manejo de los factores de riesgo cardiovascular (FRCV) en la diabetes mellitus. Este consenso ha sido elaborado por los miembros del Grupo de Riesgo Cardiovascular de la Sociedad Española de Diabetes (SED). El trabajo es una actualización necesaria, ya que desde la última revisión hace tres años, son numerosos los ensayos clínicos que han estudiado los resultados cardiovasculares de distintos fármacos en la población diabética. La presente actualización de la guía creemos que puede ser interés para todos aquellos clínicos que tratan a pacientes con diabetes.
This document is an update to the clinical practice recommendations for the management of cardiovascular risk factors (CVRF) in diabetes mellitus. The consensus has been developed by a multidisciplinary team made up of members of the Cardiovascular Risk Group of the Spanish Diabetes Society (SED). The work is a necessary update as, since the last review three years ago, there have been many clinical trials that have studied the cardiovascular outcomes of numerous drugs in the diabetic population.
We believe that this guideline update may be of interest to all clinicians treating patients with diabetes.
La enfermedad cardiovascular (ECV) aterosclerótica incluye el síndrome coronario agudo (SCA), la cardiopatía isquémica crónica establecida (infarto de miocardio [IM], angina estable o inestable y revascularización coronaria), el accidente cerebrovascular (ACV) isquémico, accidente isquémico transitorio (AIT) y la enfermedad arterial periférica (EAP). La ECV es la principal causa de morbilidad y mortalidad en las personas con diabetes y la que más contribuye a los costes directos e indirectos de la diabetes1,2. Se entiende como factor de riesgo cardiovascular (FRCV) aquella característica biológica, condición y/o modificación del estilo de vida que aumenta la probabilidad de padecer o de fallecer por cualquier causa de una ECV en individuos que lo presentan a medio y largo plazo3. Para la evaluación de este riesgo, se han elaborado tablas/ecuaciones de probabilidades basadas en estudios prospectivos poblacionales. Se consideran como FRCV clásicos la edad, sexo, tabaquismo, diabetes, colesterol total, colesterol unido a las lipoproteínas de baja densidad (c-LDL), colesterol unido a las lipoproteínas de alta densidad (c-HDL) y la presión arterial (PA). Otros FRCV llamados no clásicos (historia familiar, obesidad, distribución de la grasa, nivel de triglicéridos, lipoproteína [a], estrés y nivel socioeconómico) pueden servir para modular el riesgo calculado. Los documentos de consenso/recomendaciones/guías clínicas en medicina son elementos importantes para orientar las estrategias de prevención, diagnóstico y tratamiento de diferentes enfermedades, que sirven de referencia para profesionales y sociedades médicas, y que deben actualizarse de forma periódica2,4,5. Las recomendaciones intentan proporcionar homogeneidad en la práctica diaria asistencial.
Para evaluar la calidad de la evidencia y la fuerza de las recomendaciones, hemos elegido el sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE)6. El sistema GRADE define la calidad de la evidencia como el grado de confianza que tenemos en que la estimación de un efecto sea la adecuada para realizar una recomendación. Para cada uno de los desenlaces o resultados clave se efectúa una evaluación; así, una misma comparación de una intervención terapéutica o preventiva puede recibir diferentes asignaciones de la calidad de la evidencia. En la clasificación del nivel de calidad de la evidencia, el sistema GRADE establece cuatro categorías: alta, moderada, baja y muy baja. La recomendación se identifica como alta (++++), si se considera poco probable que nuevos estudios cambien de modo apreciable el efecto del tratamiento en la población diabética. Moderada (+++) cuando posteriores estudios pueden tener un importante impacto en nuestra confianza en la estimación del efecto, y las recomendaciones bajas (++) y muy bajas (+) son aquellas en que se considera que el balance riesgo/beneficio está menos establecido y puede modificarse de modo apreciable con nuevos estudios. La recomendación GRADE puede ser fuerte1 o débil2. La recomendación fuerte o 1 significa que puede ser seguida por todos o casi todos los pacientes y la recomendación débil o 2 significa que, si bien la alternativa es apropiada para la mayoría de los pacientes, la decisión debe ser individualizada, mediante un enfoque compartido6,7.
En el presente documento de consenso revisamos los aspectos más relevantes de los últimos dos años en relación con los FRCV en la diabetes y, tal y como se venía haciendo regularmente2,8,9, actualizamos las recomendaciones del Grupo de Trabajo de Diabetes y Riesgo Cardiovascular de la Sociedad Española de Diabetes (SED), destacando fundamentalmente la nueva clasificación de riesgo cardiovascular (RCV) de la población con diabetes, así como la aparición de nuevos tratamientos que ayudan no solo a mejorar el control glucémico sino a tener un efecto protector cardiovascular (CV)5,8,9. También analizamos el papel del tratamiento hipolipemiante en la prevención CV con objetivos de c-LDL y triglicéridos. Se comentan los objetivos terapéuticos y las indicaciones de los fármacos según el RCV, destacando las recomendaciones, según las comorbilidades asociadas (tabla 1).
Recomendaciones generales del Grupo de Diabetes y Enfermedad Cardiovascular (SED, 2021)
| 1. Modificación del estilo de vida:-Dieta cardiosaludable: dieta mediterránea rica en frutas y verduras de temporada, fomentar el consumo moderado de grasas cardiosaludables, como el aceite de oliva virgen extra o los frutos secos. Tomar el sol 10/15 minutos diarios.- Ejercicio físico aeróbico regular: al menos 150 min/semana de actividad física aeróbica de intensidad moderada (50-70% de la frecuencia cardíaca máxima), repartidas en al menos tres días de la semana evitando estar más de dos días consecutivos sin ejercicio.- Abandono hábito tabáquico, incluyendo el cigarrillo electrónico.- Se aconsejan al menos siete horas de sueño. |
| 2. Obesidad:- Si sobrepeso/obesidad leve: se recomienda una pérdida ponderal entre 5-10%.- Fármacos de elección en pacientes con obesidad y DM2: metformina asociada a arGLP-1 y/o inhibidores de la SGLT2.- La cirugía bariátrica puede considerarse en adultos con DM2 e IMC ≥ 35 kg/m2, especialmente si la DM2 o las comorbilidades asociadas son difíciles de controlar con un estilo de vida cardiosaludable y/o tratamiento farmacológico. Se puede valorar en pacientes con IMC 30-35 kg/m2 con DM2 y mal control asociado. |
| 3. Control glucémico:- Un nivel de HbA1c de ≤ 6,5% se considera óptimo si se puede lograr de una manera segura y asequible.- HbA1c 7-8%, o incluso > 8%, si pacientes con ECV, especialmente los de edad avanzada, antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada.- Metformina como terapia de inicio, asociada o no a otros fármacos antidiabéticos según control glucémico.- Consensuar tratamiento y objetivos con el paciente. Favorecer la adherencia al tratamiento con policomprimido. |
| 4. Dislipemia:- Primera opción de tratamiento farmacológico: Estatinas. Si no se consiguen objetivos, se puede añadir ezetimiba.- En caso de intolerancia a estatinas y/o no alcanzar objetivos con estatinas a dosis máxima tolerada y ezetimiba, tratamiento con inhibidores PCSK9 personalizado según tabla 2. |
| 5. Hipertensión arterial:- Objetivos generales de TA < 140/90 mmHg. En caso de albuminuria considerar objetivos más exigentes TA < 130/80 mmHg.- Si existe nefropatía: IECA/ARA II primera elección. Valorar añadir como hipoglucemiante oral los inhibidores de la SGLT2. |
| 6. Antiagregación:- Prevención primaria: Ácido acetilsalicílico (AAS) a dosis bajas (100 mg/día) si RCV > 10% a los 10 años.- Prevención secundaria: Ácido acetilsalicílico (AAS) a dosis bajas (100 mg/día). |
| 7. Insuficiencia Cardiaca:- Se aconseja tratamiento farmacológico con metformina + iSGLT2. |
| 8. Enfermedad cardiovascular establecida:- Se aconseja tratamiento farmacológico con metformina + arGLP-1.- Valorar añadir iSGLT2. |
| 9. Insuficiencia renal:Si FG > 30 mL/min: metformina + iSGLT2.Si FG < 30 mL/min preferente la terapia con arGLP-1. |
| 10.Vitaminas:- Monitorizar vitamina B12, ácido fólico y Vitamina D, especialmente en pacientes en tratamiento con metformina.- Suplementación farmacológica solo cuando presente déficit. |
La mejora y adaptación del estilo de vida en los pacientes con diabetes es esencial para facilitar el control de la enfermedad y reducir su riesgo CV2. Sin embargo, tales esfuerzos no deben retrasar el tratamiento farmacológico, que debe iniciarse simultáneamente y ajustarse con base en la respuesta a la modificación del estilo de vida. Teniendo siempre presente que la intervención sobre este último aspecto es más coste-efectiva que los tratamientos farmacológicos. Uno de los estudios de mayor relevancia por su diseño, duración y población estudiada que preconizaba la importancia de intervenir sobre el estilo de vida fue el Look AHEAD10,11. La modificación del estilo de vida es importante, especialmente en aquellos individuos con mayor índice de masa corporal (IMC), circunferencia de cintura e índice cintura/cadera por su efecto beneficioso, entre otros factores, sobre la insulinoresistencia8. También es esencial la detección precoz de la desnutrición y/o riesgo de padecerla, especialmente en el paciente geriátrico con diabetes, por el mayor riesgo de presentar sarcopenia y fragilidad asociada12. Es fundamental conocer la ingesta calórica del paciente y recomendar una dieta que facilite una pérdida del 5 al 10% de peso corporal. La dieta mediterránea se debe considerar como el paradigma de dieta cardioprotectora y, por tanto, es la recomendada en especial en nuestro medio7,13. La dieta mediterránea se caracteriza por un alto consumo en frutas y verduras, cereales y legumbres, frutos secos (nueces) y aceite de oliva virgen, todos de óptima calidad, consumo moderado de pescado, aves y huevos y una baja ingesta de productos lácteos, carnes rojas, carnes procesadas y dulces, además del consumo moderado de vino en las comidas. Debemos valorar el consumo de fibra en la dieta (14 g/1.000 kcal) y alimentos con granos integrales (la mitad de la ingesta de granos), aportando fibra entre 30 y 45 g/día. Se recomienda reducir el consumo de bebidas azucaradas, de grasas saturadas a < 7% del total de las calorías ingeridas y evitar la ingesta de grasas trans14. Se debe sustituir parte de la grasa saturada por ácidos grasos poliinsaturados y monoinsaturados, especialmente la derivada del aceite de oliva virgen y nueces, destacando que lo importante no es la cantidad de grasa que se consume, siempre que no sea superior al 35% de las calorías totales, sino su calidad. La Sociedad Americana de Diabetes (ADA) recomienda la Dietary Approaches to Stop Hypertension (DASH) para disminuir el riesgo CV de la población con diabetes2.
Es necesaria una correcta hidratación, siendo el agua y las infusiones las mejores fuentes para conseguirlo. No se recomienda la suplementación sistemática de antioxidantes (vitaminas E, C, selenio, magnesio, cromo y carotenos, entre otros) debido a la falta de pruebas de su eficacia clínica y a la preocupación de su seguridad a largo plazo2. También debemos planificar las comidas (elección de alimentos y porciones/intercambios) para incluir la cantidad diaria recomendada de todos los macro-micronutrientes y evitar el sobrepeso/obesidad y la hiperglucemia postparandial.
Se debería tener en cuenta la carga glucémica y/o el índice glucémico de los hidratos de carbono de la dieta y evitar aquellos de alto índice glucémico15,16.
Cada día es más necesario valorar y conocer los diferentes productos dietéticos y los alimentos funcionales, así como el grado de procesamiento por su crecimiento exponencial en el mercado, el creciente interés de la población por su consumo y la presión comercial, dada su posible interacción con fármacos, así como su efecto en la concentración de colesterol y riesgo CV. Algunos de ellos como el arroz de levadura roja contienen monacolina K, es decir, lovastatina y, por tanto, pueden incrementar los efectos secundarios de las estatinas17.
Los fitoesteroles al utilizar el mismo transportador que la ezetimiba, el transportador de esterol (Niemann-Pick C1-Like 1, NPC1L1), interaccionan con la ezetimiba, disminuyendo, por tanto, su eficacia18.
Por último, recodar la determinación de vitamina B12, especialmente en pacientes en tratamiento con metformina para evitar la elevación de la homocisteína, secundaria al déficit de vitamina B122,19.
RecomendacionesRealizar una dieta mediterránea baja en hidratos de carbono suplementada con aceite de oliva extra y nueces (1/+++).
Fomentar consumo de aceite de oliva virgen extra y frutos secos (1/++++).
Vitamina B12 y ácido fólico si deficiencia (1/++).
Ejercicio físicoLa importancia del ejercicio físico ya fue señalada en 1992 por la Sociedad Americana del Corazón (American Heart Association, AHA) que incluyó a la inactividad física como un factor de RCV, asociándose también con un riesgo aumentado de diabetes mellitus tipo 2 (DM2)9,20,21. Hoy en día, el estilo de vida sedentario está considerado como uno de los principales FRCV. El ejercicio físico regular aumenta la captación de glucosa, disminuye el riesgo de DM2, previene la hipertensión arterial (HTA) y mejora el estado cognitivo. De hecho, el ejercicio físico se asocia a una disminución media de 6 a 7 mmHg en los pacientes hipertensos en la PA sistólica y diastólica. Otro de sus beneficios es el aumento del colesterol HDL.
Es importante valorar el tipo de actividad y ejercicio físico, la frecuencia, duración e intensidad del mismo, también en el anciano22,23. En adultos aparentemente sanos, el riesgo de complicaciones CV durante el ejercicio es extremadamente bajo (5 a 17 fallecimientos/millón/año, según la intensidad del mismo). Por ello, en los pacientes diabéticos de bajo riesgo no sería necesario un estudio cardiológico previo. Sería pertinente un estudio cardiológico y ergométrico previo en aquellos diabéticos con vida sedentaria que pretenden iniciar un plan de entrenamiento exigente. Se recomienda que los pacientes con diabetes realicen al menos 150 min/semana de actividad física aeróbica de intensidad moderada (50 a 70% de la frecuencia cardiaca máxima), repartidos en al menos tres días de la semana, evitando estar más de dos días consecutivos sin actividad22–25. Se debe advertir a los pacientes con diabetes y tratados con insulina/antidiabéticos orales del tipo sulfonilureas con antecedentes de hipoglucemias no reconocidas episodios previos de hipoglucemias graves, que controlen las glucemias capilares no solo antes y durante el ejercicio, sino también tras el mismo con la finalidad de evitar y reconocer las hipoglucemias tardías asociadas a la actividad física.
RecomendacionesRealizar ejercicio físico aeróbico regular (>150 min/sem) (1/+++).
Actividad física aeróbica moderada (50-70% de frecuencia cardiaca máxima repartidas en al menos 3 días a la semana (1/+++).
Evitar más de 2 días consecutivos sin ejercicio físico (2/++).
Estrés y factores psicosocialesRecientemente, se ha puesto de manifiesto la asociación de la diabetes con altas tasas de ansiedad y depresión, lo que puede afectar adversamente a la adherencia al tratamiento, así como favorecer el desarrollo de complicaciones secundarias a la enfermedad26. No solo es importante evaluar el estado de ánimo, salud mental y el bienestar psicológico del paciente sino también conocer el entorno sociocultural, cada día más importante en la valoración integral del diabético. Hoy se considera el nivel sociocultural como otro FRCV al que cada día se le concede más peso en el desarrollo de la diabetes y RCV.
Los factores psicosociales, así como el bajo nivel socioeconómico, el aislamiento social, la depresión u hostilidad y el estrés laboral o familiar, además de asociarse a un mayor RCV, empeoran el pronóstico de los pacientes con cardiopatía isquémica establecida y dificultan significativamente el control de los FRCV clásicos27–29. La falta de adherencia terapéutica representa una importante barrera en la prevención secundaria de la ECV. La consecuencia de la escasa adherencia terapéutica sería un incremento de las complicaciones CV graves, al no lograrse los objetivos terapéuticos con el consiguiente incremento de la mortalidad, la reducción de la calidad de vida de los pacientes supervivientes, una mayor carga asistencial y un incremento de los costes sanitarios derivados de las complicaciones y de los ingresos hospitalarios. La reducción del copago, los recordatorios automáticos, las farmacias de pedidos por correo, el asesoramiento de un profesional de la salud y las terapias de combinación de dosis fija son medidas que mejoran el cumplimiento terapéutico29. El policomprimido (del inglés, polypill) para la prevención secundaria de la ECV fue la primera terapia combinada en dosis fija aprobada en Europa como tratamiento de sustitución para pacientes adultos controlados adecuadamente con los monocomponentes administrados por separado a dosis terapéuticas equivalentes30,31.
RecomendacionesAnálisis de la capacidad para realizar las actividades de la vida diaria (1/+++).
Valoración del entorno sociocultural (1/+++).
Utilización del policomprimido una vez establecido el tratamiento (1/++++).
SueñoDentro de los hábitos y el estilo de vida, cada día es más importante analizar el papel de los ritmos circadianos, conocer el sueño del paciente, así como la valoración y/o análisis del sueño. En la actualidad, se aconseja dormir al menos 7 horas2,9. Debemos de descartar la existencia de patología del sueño como el síndrome de apnea del sueño y, en su caso, tratarlo con el fin de mejorar la calidad de vida del paciente y poder controlar los FRCV32,33.
RecomendacionesSe aconseja dormir al menos 7 horas diarias (1/+++).
TabaquismoEl tabaco es el FRCV modificable con más impacto en la prevención CV. Los pacientes con DM2 fumadores tienen un incremento significativo del RCV total, mortalidad, ACV e IAM comparado con los no fumadores34,35. En la práctica clínica, debemos aconsejar a todos los pacientes en cada visita que abandonen el hábito de fumar. Se recomienda evitar la exposición al humo del tabaco (fumador pasivo). Se debe recurrir, siempre con la aceptación del paciente para dejar de fumar, a unidades específicas de deshabituación tabáquica y/o prescribir tratamiento para ello como componente rutinario en la atención integral del individuo diabético5. Los productos de tabaco de riesgo modificado son una opción no libre de riesgo en esta estrategia36. Aunque en menor grado que el cigarrillo convencional, los vapores del cigarrillo electrónico contienen sustancias potencialmente tóxicas que son subproductos del disolvente (generados por el calor) liberados en el vapor y/o los constituyentes traza de los aditivos aromatizantes, existiendo ya estudios que señalan un efecto nocivo vascular37.
RecomendacionesAbandono hábito tabáquico (1/++++).
Se desaconseja cualquier tipo de cigarrillo convencional /electrónico (1/++).
Remitir unidades de deshabituación tabáquica en caso dificultad de abandono (1/+++).
ObesidadNumerosos estudios han demostrado que un incremento de grasa corporal conlleva un aumento del RCV9. El riesgo relativo de diabetes en los varones con un IMC de 35 kg/m2 es 40 veces superior al de aquellos con un IMC de 23 kg/m2. Pequeñas pérdidas de peso, entre el 5 y el 10%, se corresponden con un mejor control de parámetros clínicos y metabólicos, y también psicológicos, sin necesidad de tratamiento farmacológico, solo mediante cambios en el estilo de vida y modificaciones dietéticas38,39. Los pacientes con diabetes y complicaciones CV se benefician más si añadimos intervención farmacológica y cirugía9. El tratamiento farmacológico añadido a las modificaciones de estilo de vida induce mayor pérdida de peso que solo el estilo de vida. Además, la pérdida de peso es mayor a lo largo del tiempo en los pacientes tratados con fármacos40,41.
La cirugía bariátrica (CB) debe considerarse en adultos con DM2 e IMC ≥ 35 kg/m2, especialmente si la DM2 o las comorbilidades asociadas son difíciles de controlar con un estilo de vida cardiosaludable y/o tratamiento farmacológico. Es primordial tener en cuenta al valorar los costes, que los individuos con DM2 que se someten a CB necesitan adicionalmente modificaciones del «estilo de vida» para siempre y monitorización médica continuada y estricta42. La CB ha demostrado la normalización de la glucemia, remisión de DM2 en el 40 al 95% de los pacientes, dependiendo del tiempo de evolución de la diabetes, del procedimiento quirúrgico elegido, de los niveles de péptido C y de los criterios utilizados de remisión43,44. La CB mejora los FRCV y, a largo plazo, los episodios CV en la DM244,45. En pacientes con DM2 e IMC de 30 a 35 kg/m2, la CB sigue presentando beneficios glucémicos; así, la cirugía metabólica se debe considerar en los adultos con DM2 con un IMC entre 30,0 a 34,9 kg/m2 si la hiperglucemia no se controla de forma adecuada a pesar del tratamiento farmacológico adecuado con antidiabéticos orales o inyectables e insulina en monoterapia o en tratamiento combinado2,7.
En el paciente diabético con obesidad, los fármacos de primera línea serían la metformina, asociada a inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) y/o a los agonistas del receptor del péptido similar al glucagón tipo 1 (arGLP-1)2, si no estuviera en tratamiento con ninguno de ellos, siendo los arGLP-1 los que producen mayor pérdida de peso46,47. Hoy en día, en el paciente diabético obeso con RCV elevado/muy elevado, se debería considerar como fármacos de primera línea el tratamiento de iSGLT2 o arGLP-1, individualizando el grado de obesidad y factores CV asociados con o sin metformina. En caso de sobrepeso y bajo riesgo sería la metformina el fármaco de primera línea.
RecomendacionesEn caso de sobrepeso u obesidad grado 1, se recomienda dieta y ejercicio físico, para conseguir una pérdida ponderal de al menos 5 a 10% (1/+++).
Los fármacos recomendados en obesidad y diabetes tratada con metformina son los inhibidores de SGLT2 y/o arGLP-1 (1/+++).
La CB estaría indicada en adultos con DM2 e IMC >35 kg/m2 (1/+++).
Se debería valorar la CB en pacientes con obesidad tipo 1 y con sobrepeso grado 2 en DM2 con FRCV mal controlados asociados (2/++).
Control glucémico: hemoglobina glicosilada (HbA1c) y riesgo CVSe han establecido niveles de HbA1c ≥ 6,5% como criterio diagnóstico de DM, siempre y cuando se realice en un laboratorio que utilice un método estandarizado según el National Glycohemoglobin Standarization Program (NGSP), certificado y estandarizado para el Diabetes Control and Complications Trial (DCCT), International Diabetes Federation (IDF) y la European Association for the Study of Diabetes (EASD) y el paciente no tenga anemia o hemoglobinopatía, gestación (segundo y tercer trimestre), postparto, deficiencia de la 6-glucosa-fosfato-deshidrogenasa, síndrome de inmunodeficiencia adquirida (SIDA), hemodiálisis y terapia con eritropoyetina, en cuyo caso solo se utilizarán criterios glucémicos al estar alterados los resultados de la HbA1c48,49.
Diferentes estudios han confirmado la importancia del control glucémico en la DM2,9. Una disminución de la HbA1c del 0,9% reduce los episodios CV en torno al 10 al 15%4,48. El objetivo de HbA1c debe ser individualizado con base en factores como la edad, esperanza de vida, comorbilidad, duración de la diabetes, riesgo de hipoglucemia o consecuencias adversas de la hipoglucemia, motivación del paciente y adherencia al tratamiento. Un nivel de HbA1c de ≤ 6,5% se considera óptimo si se puede lograr de una manera segura y asequible; un objetivo razonable sería una HbA1c 7%. En el paciente joven sin otros FRCV y sin complicaciones se deben considerar unos objetivos de HbA1c más estrictos, utilizando fármacos más potentes para alcanzar niveles más bajos de HbA1c (∼6,5%), siempre que se consiga sin hipoglucemias significativas ni efectos adversos. En pacientes con ECV, especialmente los de edad avanzada, antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada o complicaciones macrovasculares, con diabetes de larga duración, el objetivo de la HbA1c se debe ser menos exigente, entre 7 y 8% o incluso superior2,50.
Los pacientes con DM tipo 1 (DM1) deben tratarse con insulinoterapia intensiva, bien con múltiples dosis de insulina (tres a cuatro dosis diarias) o bien con infusión subcutánea continua de insulina, fundamentalmente con análogos de insulina, que se asocian a un menor riesgo de hipoglucemia. En los diabéticos tipo 2 se debe valorar el coste-efectividad de estos tratamientos, teniendo en cuenta la edad y factores relacionados con el riesgo y severidad de la hipoglucemia. Los análogos de insulina de acción retardada recientemente introducidos como glargina U300 y degludec U100 y U200 poseen características farmacocinéticas y farmacodinámicas más prolongadas y estables que glargina U100 y detemir51. Los nuevos análogos de acción prolongada (U-300 glargina o degludec) presentan menor riesgo de hipoglucemia comparado con la glargina U-100 en pacientes con DM1, es importante tener presente que el gasto y/o intensificación del tratamiento es económicamente más elevado51–53. Entre los pacientes con DM2 con alto riesgo de eventos CV, degludec no fue inferior a la glargina con respecto a la incidencia de eventos CV mayores53.
Hay que tener presente que las insulinas premezcladas proporcionan menor flexibilidad de dosificación y se han asociado con una mayor frecuencia de eventos hipoglucémicos comparados con los regímenes basal y bolo-basal2. Es necesario optimizar el tratamiento hipoglucemiante en los pacientes con DM1 y DM2 de forma precoz para conseguir prevención CV a medio-largo plazo.
La metformina era el único fármaco hipoglucemiante utilizado que había demostrado un menor riesgo de ECV. Diferentes ensayos clínicos (SAVOR-TMI-53 [saxagliptina], EXAMINE [alogliptina], TECOS [sitagliptina] y CARMELINA [linagliptina]) han mostrado un efecto neutral de los inhibidores de la dipeptidil peptidasa tipo 4 (DPP4) sobre los eventos CV (referencias de cada ensayo clínico).
Desde 2015, cuatro ensayos de seguridad CV se han publicado de los iSGLT2 (EMPA-REG [empagliflozina], CANVAS [canagliflozina], DECLARE TIMI [dapagliflozina] y VERTIS CV [ertugliflozina]). Tanto EMPA-REG como CANVAS han confirmado superioridad de empagliflozina y canagliflozina para la combinación de mortalidad CV, miocardio no mortal infarto o ACV no fatal (denominado «MACE de tres puntos» eventos CV adversos mayores). El DECLARE-TIMI demostró una menor tasa de muerte CV y hospitalización por insuficiencia cardiaca (IC) en pacientes tratados con dapagliflozina pero no el MACE de tres puntos. Esta diferencia entre estudios probablemente refleja la cohorte de riesgo CV más bajo estudiada en DECLARE TIMI54–61 y en VERTIS CV donde sí demuestran menor hospitalización por IC54–62.
Los iSGLT2 se han convertido en fármacos de primera línea en pacientes con complicaciones macrovasculares establecidas junto a los arGLP-1; siendo de elección los iSGLT2 en el diabético con IC63. Si bien los iSGLT2 son fármacos referentes en pacientes con IC y DM2, todavía queda por esclarecer los mecanismos de este efecto cardioprotector y debemos controlar sus efectos secundarios especialmente el riesgo de cetoacidosis, infecciones genitourinarias y elevado coste. Es importante señalar que los iSGLT-2 deben suspenderse 3 a 4 días antes de la cirugía. Además, los iSGLT2 también han supuesto un verdadero cambio de paradigma en el tratamiento de la enfermedad renal diabética como se comentará posteriormente, siendo fundamentales en la diabetes por su papel reno-cardioprotector64.
Los arGLP-1 son fármacos de administración subcutánea, con la excepción de semaglutida que tiene también versión oral (aún no comercializada en España). Se clasifican en los de vida media corta y administración diaria (exenatida de liberación inmediata y lixisenatida) y de vida media larga y administración semanal (exenatida de liberación prolongada, liraglutida, dulaglutida y semaglutida).
El estudio Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results (LEADER) puso de manifiesto en los pacientes con DM2 y alto RCV un beneficio al añadir liraglutida a su tratamiento habitual65. Los resultados se asemejan a los aportados por la empagliflozina en el EMPA-REG OUTCOME, pero en este último los beneficios se mostraron desde del inicio del ensayo. Con base en los resultados CV de los estudios de los análogos de GLP1, liraglutida con el estudio LEADER, semaglutida con el estudio SUSTAIN-6, la albiglutida con el estudio HARMONY y el estudio REWIND con dulaglutida, han demostrado beneficio CV al reducir el desenlace CV combinado MACE de 3 puntos frente al placebo en la protección de episodios CV66–69.
Actualmente, se recomienda tanto los iSGLT2 como los arGLP-1 en los pacientes de alto/muy alto RCV, hoy en día las guías señalan a los iSGLT2 o los arGLP-1 como fármaco inicial de elección en los pacientes con DM2 y elevado FRCV, en monoterapia o asociados a metformina63. Debemos destacar que los beneficios CV de estos 2 grupos de fármacos no dependen solo de la reducción de la HbA1c, por lo que pueden ser considerados en pacientes DM2 con ECV independientemente del objetivo de HbA1c. Con la finalidad de mejorar el beneficio CV del tratamiento farmacológico sobre el riesgo CV es adecuado valorar asociar al tratamiento habitual el uso de iSGLT2 o arGLP-1, incluso introducir estos fármacos en los pacientes con ECV aunque tengan cifras de HbA1c en objetivo terapéutico para obtener un beneficio CV independiente de los niveles de HBA1c2,64. Por último, destacar que no todas guías tienen los mismos objetivos ni recomendaciones, así la guía del National Institute for Health and Care Excellence (NICE) más economicista y menos actualizada, no tiene la misma opinión70.
RecomendacionesSe debe intentar conseguir un nivel de HbA1c óptimo (≤ 6,5%) siempre que se pueda lograr de forma segura y asequible 1/+++.
Se pueden considerar cifras de HbA1c 7 a 8%, o incluso >8%, en pacientes con ECV, especialmente los de edad avanzada, antecedentes de hipoglucemia grave, esperanza de vida limitada, enfermedad microvascular avanzada o complicaciones macrovasculares, con diabetes de larga duración (1/+++).
La metformina constituye la primera opción farmacológica en el paciente con DM, si bien se podría valorar como primera opción terapéutica la utilización de los iSGLT2, así como los arGLP-1en individuos diabéticos con enfermedad CV establecida (1/++++).
Los iSGLT2 y arGLP-1 son los fármacos de elección en la asociación con la metformina en pacientes con FRCV (1/+++).
Los iSGLT2 deberían valorarse como primera opción en pacientes con DM2 e IC (1/+++).
Presión arterial: HTA y DMLas Guías Europeas de Prevención Cardiovascular2,9,71 siguen sin aportar ningún dato novedoso relevante. Se recomienda medir la PA del paciente diabético en cada visita. Si se detectan cifras elevadas presión arterial sistólica (PAS) >140 mmHg y/o presión arterial diastólica (PAD) > 90 mmHg en los pacientes con diabetes, se debe realizar el despistaje pertinente mediante la auto medida de la PA (AMPA) o la monitorización ambulatoria de la PA (MAPA). El objetivo de PA menor de 140/90 mmHg se basa en los resultados de encima convertidora de angiotensina (ECA) como el Action to Control Cardiovascular Risk in Diabetes- Blood Pressure (ACCORD-BP), del Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation Blood Pressure (ADVANCE BP), del Hypertension Optimal Treatment (HOT) e incluso del Systolic Blood Pressure Intervention Trial (SPRINT)72–74, aunque en este no incluyó pacientes con DM. El tratamiento intensivo (PAS < 120 mmHg) no reduce los eventos CV, pero disminuye el riesgo de enfermedad cerebrovascular (ACV) a expensas del incremento de los efectos adversos2,74. El objetivo de control debe individualizarse, aconsejando de forma global una PAS < 140 mmHg. Cifras más bajas de PAS, por debajo de 130 mmHg, pueden ser apropiadas en individuos más jóvenes y en pacientes con microalbuminuria. El objetivo de la PAD en los pacientes con diabetes es < 90 mmHg, si bien el límite no está bien establecido, aceptándose entre 80 a 90 mmHg según la edad y comorbilidades asociadas. Los pacientes con PA confirmada ≥ 140/90 mmHg, además de los cambios en el estilo de vida, pérdida de peso, cuando hay sobrepeso; se aconseja la DASH75 que recomienda la reducción del sodio a menos de 2,3 g/d (100 mmol/d) y el aumento de la ingesta de potasio (∼4,7 g/d [120 mmol/d]) siempre y cuando no presenta una excreción urinaria de potasio alterada, debiéndose disminuir la a ingesta de potasio a menos de 4,7 g/d (120 mmol/d) para evitar efectos cardiacos adversos (arritmias) por hiperpotasemia76. Es importante la reducción del consumo de alcohol y el aumento de la actividad física, debe iniciarse una terapia farmacológica si no se logran los objetivos de PA señalados por las guías. La guía de la American College of Endocrinologists recomienda en DM2 modificaciones del estilo de vida para todos los sujetos diabéticos para mantener la PA menor de 130/80 mmHg en la mayoría de sujetos y tratamiento farmacológico antihipertensivo para cifras ≥ 140/90 mmHg o niveles ≥ 130/80 mmHg si el RCV > 10% en 10 años. Cuando la PA es >160/100 mmHg debería iniciarse tratamiento con 2 fármacos antihipertensivos3,9. Los inhibidores de la enzima convertidora de la angiotensina (IECA), los betabloqueantes de los receptores de la angiotensina II (ARA II), los betabloqueantes, los antagonistas de los canales de calcio y los diuréticos tiazídicos son las opciones preferidas para el tratamiento de primera línea77. La selección de medicamentos debe basarse en factores como la presencia de albuminuria, ECV, IC o estado del infarto post-miocárdico, así como la raza/etnia del paciente, los posibles efectos secundarios metabólicos, la adherencia al tratamiento y el coste. Los pacientes con diabetes e HTA deben ser tratados farmacológicamente con un IECA o un ARA II, por su mayor efecto protector contra la aparición o la progresión de nefropatía. Los IECA y los ARA II pueden retardar la progresión de la nefropatía y la retinopatía diabéticas, por eso están especialmente indicados en los pacientes con DM9,78,79. Ante la intolerancia a uno de ellos, puede sustituirse uno por el otro. Para alcanzar los objetivos de la PA generalmente se requiere la combinación de dos o más fármacos, en su dosis máxima, aconsejándose iniciar tratamiento con 2 fármacos desde el inicio en caso de PA mayor de 160/1003, la necesidad de la utilización de 3 fármacos y mal control de la PA se debe valorar remitir para estudio de hipertensión arterial a la consulta monográfica80 de HTA hospitalaria3. Debemos considerar administrar uno o más antihipertensivos antes de acostarse, con el fin de evitar la HTA nocturna, ya que la PA nocturna es un predictor de episodio CV más potente que la PA diurna80. No se recomienda el uso de la terapia combinada de IECA con ARA II, en particular en pacientes con nefropatía diabética, por el riesgo de agravar la insuficiencia renal y facilitar la hiperpotasemia. La combinación de aliskiren con IECA o ARA II en pacientes con alteración de la función renal o diabetes está contraindicada. El candesartán y el valsartán se mantienen autorizados para el tratamiento de la IC en combinación con un IECA únicamente en aquellos pacientes que no pueden utilizar antagonistas de los mineralcorticoides. Si se utilizan IECA, ARA II o diuréticos, hay que monitorizar la función renal y el nivel de potasio sérico. Cuando la PA es > 140/90 mmHg podrá añadirse a los IECA o ARA II un diurético y, si persiste elevada, valorar un antagonista del calcio y, de seguir el mal control, valorar añadir un betabloqueante. El control de la PA y la prevención de la morbilidad y la mortalidad relacionada es claramente mejorable2,81. Sin embargo, el conocimiento, tratamiento y control de la HTA son persistentemente bajos en todo el mundo82. Se sigue aconsejando a todos los pacientes con DM2 e HTA controlar y monitorizar su PA mediante AMPA o MAPA con la intención de desenmascarar la HTA de bata blanca, HTA enmascarada y mejorar el diagnóstico, así como la adherencia a la medicación. Se debe evitar la inercia terapéutica (dejando a los pacientes diabéticos con valores de PA ≥ 140/90 mmHg), ya que esto daría lugar a una carga inaceptable en términos de vidas humanas, secuelas y costes socioeconómicos81. Recientemente la ADA señala que los objetivos de control deben individualizarse2,3. Para las personas con DM y HTA con alto RCV (ECV previa o riesgo de ECV a 10 años ≥ 15%), un objetivo de PA inferior a 130/80 mmHg puede ser apropiado si se consigue con seguridad2. Para las personas con DM y HTA con un bajo riesgo de ECV (riesgo de ECV a 10 años, < 15%), un objetivo de PA inferior a 140/90 mmHg es adecuado2,9.
Debemos valorar el añadir como hipoglucemiante oral los iSGLT2 en los pacientes con DM2, sobrepeso e hipertensión leve ya que no solo facilitan la pérdida de peso, sino que también disminuyen la PAS (3 a 5 mmHg).
En el caso de continuar con falta de control con 3 hipotensores, incluyendo un diurético, se podría considerar añadir un antagonista de receptor mineralcorticoide3. En caso de presentar un cociente albúmina/creatinina-CAC- ≥ 300 mg/g (A) o 30 a 299 mg/g (B) debe de utilizarse los inhibidores de la ECA o bloqueadores de los receptores de angiotensina como los fármaco de primera línea en HTA2,3. Se ha sugerido la suspensión de los inhibidores de la ECA o los ARAII en todos los pacientes con el objetivo de prevenir o limitar la difusión del virus SARS-CoV-2, sin embargo, no se basa en evidencia clínica83,84. Por el contrario, los estudios experimentales sugieren que los ARAII podrían ser útiles en estos pacientes para limitar el daño pulmonar mediante la inhibición de los receptores de angiotensina II tipo 185.
Los pacientes con IC podrían beneficiarse de betabloqueantes, así como los diabéticos con hipertrofia benigna de próstata de los alfabloqueantes y los diabéticos con cardiopatía isquémica los betabloqueantes9, sin olvidar que los iECA o los ARAII también se recomiendan como terapia de primera línea para la hipertensión en personas con diabetes y cardiopatía isquémica. Por último, recordar la posibilidad de la utilización del policomprimido para el control de la PA que facilita la adherencia y además parece ser más eficiente.
RecomendacionesLos objetivos de control de la PA deben individualizarse (1/++++).
El objetivo de PA en diabéticos hipertensos con bajo riesgo CV (riesgo de ECV a 10 años inferior a 15%) es inferior a 140/90 mmHg (1/++++).
El objetivo de PA en diabéticos hipertensos con alto riesgo CV (ECV previa o riesgo de ECV a 10 años superior o igual a 15%) es inferior a 130/80 mmHg (1/++).
Si existe nefropatía (microalbuminuria): IECA/ARA II primera elección (1/++++).
Los IECA o los ARAII se recomiendan como terapia de primera línea para la hipertensión en personas con diabetes y cardiopatía isquémica (1/+++).
Mejor elegir antihipertensivos juntos (policomprimido) si es posible (1/+++).
Hiperlipemia/dislipemiaLa DM2 es un reconocido factor de riesgo para la ECV, siendo esta la principal causa de muerte en la población diabética. La hipercolesterolemia es un factor patogénico clave en el desarrollo y en la progresión de la lesión vascular2. La población con DM tiene un elevado riesgo de ECV. Por tanto, es fundamental conocer el perfil lipídico de los pacientes con DM2 desde el diagnóstico y monitorizarlo de forma anual, con el fin de conseguir alcanzar los objetivos terapéuticos con mayor precisión86,87. Además, se sabe que el retraso en el control adecuado de los niveles de colesterol se asocia a un aumento del riesgo CV. Los diferentes fármacos hipolipemiantes disponibles en la actualidad como las estatinas, ezetimiba e inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (iPCSK9), permiten a priori alcanzar los exigentes objetivos terapéuticos de c-LDL9,88.
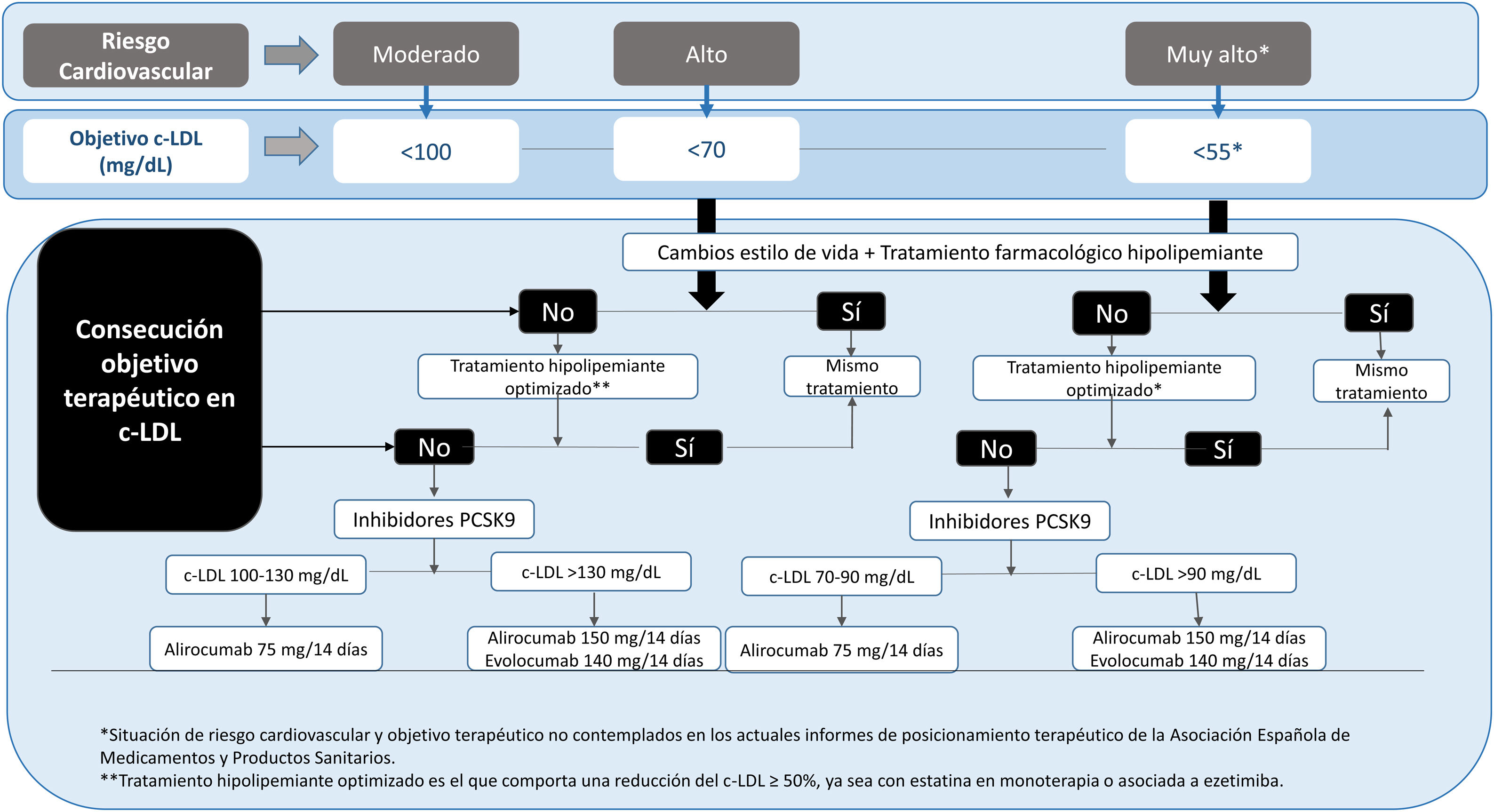
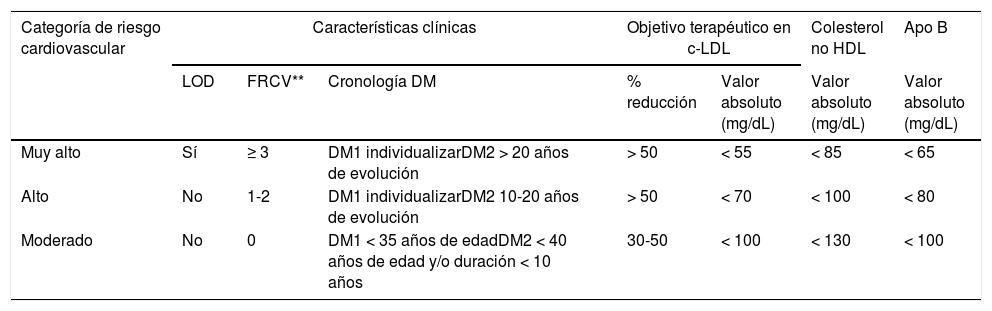
La recomendaciones de la American Association of Clinical Endocrinologists (AACE) y American College of Endocrinology (ACE) las recomendaciones del Grupo de Riesgo Cardiovascular de la SED de 20185, laEuropean Society of Cardiology (ESC)/European Atherosclerosis Society (EAS) 201987, la American College of Cardiology (ACC)/American Heart Association (AHA) en prevención primaria de la ECV 201987y la más reciente de la American Diabetes Association (ADA, 2021)3 ponen de relieve la sensibilización de las diferentes sociedades científicas en la necesidad de reducir el riesgo CV en la DM2 con el uso adecuado de los estrategias terapéuticas disponibles. En la tabla 2 se expone la estratificación del riesgo CV y los objetivos terapéuticos para la población diabética en función de la categoría de riesgo, cronología y tipo de DM. Es crucial destacar la importancia de la determinación de la lipoproteína (a) (Lp[a]) en los diabéticos, no solo nos ayuda a estratificar el riesgo, sino que nos permite valorar las opciones terapéuticas, favoreciendo la utilización de iPCKS9 al ser hoy en día el único fármaco que disminuye en torno a un 20% los niveles de Lp(a).
Estratificación del riesgo cardiovascular y objetivos terapéuticos en la población con diabetes*
| Categoría de riesgo cardiovascular | Características clínicas | Objetivo terapéutico en c-LDL | Colesterol no HDL | Apo B | |||
|---|---|---|---|---|---|---|---|
| LOD | FRCV** | Cronología DM | % reducción | Valor absoluto (mg/dL) | Valor absoluto (mg/dL) | Valor absoluto (mg/dL) | |
| Muy alto | Sí | ≥ 3 | DM1 individualizarDM2 > 20 años de evolución | > 50 | < 55 | < 85 | < 65 |
| Alto | No | 1-2 | DM1 individualizarDM2 10-20 años de evolución | > 50 | < 70 | < 100 | < 80 |
| Moderado | No | 0 | DM1 < 35 años de edadDM2 < 40 años de edad y/o duración < 10 años | 30-50 | < 100 | < 130 | < 100 |
Apo: aplipoproteína; c-LDL: colesterol unido a las lipoproteínas de baja densidad; DM: diabetes mellitus; FRCV: factores de riesgo cardiovascular; HDL: lipoproteínas de alta densidad; LOD: lesión de órgano diana.
FRCV: edad, sexo, historia familiar, hipertensión arterial, tabaquismo, hipercolesterolemia, sobrepeso/obesidad (particularmente la obesidad abdominal) y sedentarismo.
Adaptado de la guía ESC/EAS 20198. No se considera de bajo riesgo cardiovascular a ningún sujeto con diabetes.
Las estatinas siguen siendo la piedra angular de la terapia hipolipemiante en el paciente diabético para conseguir una reducción de episodios CV1,5,9,82,89,90. Su uso está contraindicado en el embarazo. Tras las estatinas a la máxima dosis tolerada, si no se alcanza el objetivo primario de LDL, puede considerarse ezetimiba. Aunque, estudios recientes señalan que las estatinas confieren un riesgo de desarrollar diabetes91, salvo la pitavastatina, el modesto incremento en el riesgo de DM2 no justifica su no utilización92. La terapia con dosis altas de estatinas puede asociarse a riesgos más elevados de DM que la terapia con dosis bajas o moderadas. El estudio JUPITER en prevención primaria, puso de manifiesto los beneficios CV con disminución de la mortalidad tras el tratamiento con estatinas, si bien la mayoría de las estatinas a dosis elevadas se asocian a mayor incidencia de DM y pueden empeorar mínimamente el control glucémico. Sin embargo, el efecto preventivo de episodios CV y de mortalidad CV fueron superiores al riesgo de desarrollar DM. Por otro lado, algunos estudios no han encontrado asociación entre el uso de estatinas y mayor riesgo de desarrollar diabetes93,94. Por otro lado, otros estudios no han encontrado un riesgo elevado de diabetes asociado al uso de estatinas95.
En todos los pacientes diabéticos con ECV, si no se alcanzan los objetivos de c-LDL debe asociarse la ezetimiba. Los resultados del estudio IMPROVE-IT respaldan la indicación de la ezetimiba en combinación con estatinas cuando estas no logran el objetivo de c-LDL96,97.
Ante niveles de c-LDL muy elevados bajo tratamiento con estatinas en los que pensemos que la adición de ezetimiba no va a conseguir un adecuado control lípidico, se puede valorar iniciar el tratamiento combinado con iPCSK9 para alcanzar los objetivos de c-LDL deseados. También se pueden utilizar en el caso de intolerancia a estatinas. Los iPCSK9 se administran por vía subcutánea cada 14 o 28 días, y en la actualidad tenemos disponibles dos: el evolocumab y el alirocumab98. Los inhibidores de la PCSK9 tienen una elevada capacidad de reducción de colesterol LDL, que puede situarse entre el 50 y más del 70%, independientemente de que se utilice en monoterapia o como tratamiento combinado con estatinas u otros hipolipemiantes99,100. Reducen los triglicéridos y los niveles de Lp (a), y elevan los niveles de colesterol HDL, con una muy baja incidencia de efectos adversos. Además de disminuir el RCV, revierten la placa de ateroma101,102. El estudio FOURIER muestra, asimismo, un beneficio adicional en la reducción absoluta de eventos CV en pacientes diabéticos (2,7 vs. 1,6% a tres años)101. No obstante, este beneficio se restringió a una menor necesidad de revascularizaciones, no existiendo diferencias en la variable combinada de IAM, ictus o muerte CV (reducción del riesgo absoluto [RRA] 2%). Asimismo, los resultados del estudio ODYSSEY102 muestran que el tratamiento con alirocumab en pacientes diabéticos aporta un mayor beneficio que en la población global, dado su mayor riesgo basal (RRA en diabéticos del 2,3 vs. 1,6% en el conjunto del estudio). En conjunto, ambos trabajos, junto con la evidencia acumulada del riesgo, apoyan un tratamiento más intensivo en los objetivos de c-LDL tanto en la población diabética tipo 1 como tipo 2.
En estos momentos, la utilización financiada de los iPCSK9 en pacientes con diabetes se contempla solo en personas con ECV (cardiopatía isquémica, AVC isquémica y EAP) establecida cuyo c-LDL sea superior a 100 mg/dL a pesar de dosis máximas toleradas de estatinas y ezetimiba, debiéndose actualizar e individualizar su indicación (fig. 1). A nuestro entender, la financiación debería ampliarse, ya que los pacientes con DM2 son de muy alto riesgo/extremo y, por tanto, niveles de c-LDL de más de 55 mg/dL presentan un riesgo CV muy elevado103.
El colesterol remanente (colesterol total – [colesterol HDL + colesterol LDL]) se considera como otro de los principales factores de riesgo de arterioesclerosis y episodios CV y un marcador indirecto de hipertrigliceridemia y se considera que el colesterol no HDL (no-HDL-c) es mejor predictor de RCV en dichos pacientes con triglicéridos elevados104. Los fibratos pueden ayudar a mejorar los niveles elevados de triglicéridos y se ha señalado un papel protector de la retinopatía diabética y de otras complicaciones microangiopáticas103. Sin embargo, no debemos olvidar que el objetivo primario de la prevención CV es el c-LDL, y que la evidencia de un potencial beneficio CV del tratamiento con fibratos tras estatinas proviene de análisis post-hoc de estudios randomizados105. Cuando el paciente con DM2 requiera tratamiento de combinación de una estatina asociada a un fibrato para reducir el riesgo residual atribuible a la dislipemia aterogénica, el único fibrato recomendable es el fenofibrato, estando contraindicado el gemfibrozilo106,107.
En pacientes con concentraciones de triglicéridos ≥ 200 mg/dL, con c-HDL < 40 mg/dL y cualquier concentración de c-LDL, aún si están en tratamiento con estatinas, deben recibir tratamiento destinado, no solo a reducir las concentraciones de triglicéridos, sino también a corregir las alteraciones potencialmente aterogénicas de las otras lipoproteínas, esto es con fibratos y omega-3.
Los omega-3 son los ésteres del ácido eicosapentanóico (EPA) y del ácido docosahexanóico (DHA). Actúan sobre los lípidos plasmáticos reduciendo el nivel de triglicéridos como resultado del descenso de la lipoproteína de muy baja densidad (colesterol VLDL) y también sobre la homeostasia y la PA. Reducen la síntesis de triglicéridos en el hígado y aumentan la beta-oxidación de los ácidos grasos, lo que contribuye también al descenso de los triglicéridos, Aunque continúa sin establecerse el beneficio real que los ácidos omega-3 aportan, tanto en el tratamiento de la hipertrigliceridemia como en la prevención secundaria tras IM, recientemente el estudio Reduction of Cardiovascular Events With Icosapent Ethyl-Intervention Trial (REDUCE-IT) ensayo clínico que señala que el éster etílico del EPA en dosis altas confería una reducción del riesgo relativo del 25% en eventos CV mayores en comparación con placebo, incluida la muerte CV, IM no fatal, ACV no fatal, revascularización coronaria y hospitalización por angina inestable108. El REDUCE-IT evidenció una reducción del riesgo relativo en los pacientes de alto riesgo con triglicéridos elevados y en tratamiento con estatinas, pero empleando 2 g dos veces al día. El beneficio sobre la morbimortalidad de un ácido omega-3 en pacientes con enfermedad CV o alto riesgo CV, son prometedores109, son necesarios más estudios contemporáneos con pacientes menos seleccionados y con tratamiento más optimizado para generalizar el uso de los omega-3, por tanto en pacientes con ECV aterosclerótica u otros FRCV que toman una estatina con c-LDL controlado pero triglicéridos elevados (135 a 499 mg/dL), se puede considerar la adición de etil de icosapento para reducir el riesgo CV2.
Por último, es importante señalar que la macroangiopatía es una complicación de todo paciente con DM 1 de larga evolución, aconsejándose objetivos estrictos del riesgo CV en la DM1 de larga evolución9 se debe individualizar en caso según la edad de diagnóstico de la enfermedad, edad, sexo y FRCV3.
Recomendaciones dislipemiaPrimera opción terapéutica: estatinas grado 1/+++En ausencia de control con estatinas añadir ezetimibe (1/++).
En caso de intolerancia a estatinas y/o incapacidad para alcanzar los objetivos terapéuticos con estatinas a dosis máxima tolerada y ezetimibe, iniciar tratamiento con iPCSK9 (1 /+++).
Objetivos de c-LDL menor de 100 mg/dL en todos los diabéticos (1/+++).
Objetivos DM c-LDL no menor de 30 grado (2/++).
En pacientes con DM objetivo c-LDL en prevención primaria entre 100 a 70 mg/dL según FRCV y en prevencia secundaria de < 55 Grado (1/+++).
Recomendaciones de estatinas en función de la edad o riesgo CV grado (2/+++).
En pacientes con enfermedad CV aterosclerótica u otros FRCV con c-LDL dentro de objetivos pero triglicéridos elevados (135 a 499 mg/dL), Se debe considerar el tratamiento de etil de icosapento para reducir el riesgo CV grado (1/+++).
Antiagregación y otros fármacos en patología CV: indicación de los antiagregantes plaquetarios, betabloqueante y cirugía en la ECV y diabetesTanto en la DM1 como en la DM2 con RCV elevado (>10% a 10 años), el beneficio del tratamiento con aspirina (75 a 162 mg/día) como estrategia de prevención primaria ha sido puesta en duda en la última década a raíz de la publicación de diversos ensayos con resultados neutros (ASCEND, ARRIVE y ASPREE) estos estudios han ponderado el beneficio (reducción de eventos CV) frente a los eventos adversos (fundamentalmente hemorrágicos) en diversos escenarios como son la población general con moderado riesgo CV, diabéticos y ancianos. Actualmente, la aspirina en prevención secundaria (pacientes con antecedente de enfermedad cerebro-cardiovascular) tiene un claro beneficio demostrado, superando los posibles riesgos, pero no ha sido así en el contexto de prevención primaria, en donde los estudios nos muestran que el riesgo de sangrado es más alto comparado con el beneficio no significativo que aporta108–111. Se recomienda en varones diabéticos > 50 años o mujeres > 60 años que tienen al menos un FRCV mayor como historia familiar de ECV, HTA, tabaquismo, dislipidemia o microalbuminuria. No se debe recomendar aspirina en prevención primaria de la ECV en los adultos con diabetes y riesgo bajo de ECV (riesgo a los 10 años < 5%) como varones < 50 años y las mujeres < 60 años sin otros FRCV, ya que los efectos potenciales de sangrado probablemente contrarresten el beneficio112,113. Se aconseja uso de aspirina en prevención secundaria (75 a 162 mg/día)2,5,9. Debemos señalar que metaanálisis recientes señalan la hipótesis de que la eficacia de la aspirina a dosis bajas se reduce en aquellos pacientes que pesan más de 70 kg114.
Para los pacientes con ECV y alergia documentada al ácido acetil salicílico (AAS), se debe utilizar el clopidogrel (75 mg/día). Las guías de práctica clínica establecen el tratamiento con doble antiagregación durante un período de un año para aquellos pacientes con SCA que han sufrido un IAM115. Una vez superado ese período de tiempo, el paciente sigue el tratamiento con un único antiagregante, habitualmente AAS. Hasta un año después de un SCA es razonable el tratamiento combinado de AAS (75-162 mg/día) y clopidogrel (75 mg/día). Se recomienda usar durante un año un inhibidor del receptor P2Y12 (definir) para pacientes con DM y SCA, y sometidos a intervención coronaria percutánea (ICP), la duración depende del tipo de stent. Para los pacientes con ICP por SCA, se debe administrar preferiblemente prasugrel o ticagrelor115–118. Se ha señalado que el beneficio clínico neto (beneficio isquémico frente al riesgo de sangrado) se mejoró con el tratamiento con ticagrelor en el gran subgrupo preespecificado de pacientes con antecedentes de ICP, mientras que no se observaron beneficios netos en pacientes sin ICP previa119.
En los pacientes con ECV conocida hay que tener en cuenta el tratamiento con IECA, estatinas (si no están contraindicadas) para reducir el riesgo de episodios CV y AAS. En los pacientes con un IM previo, los betabloqueantes se deben continuar por lo menos dos años después del episodio agudo. El uso de betabloqueantes en el postinfarto es muy importante para prevenir la muerte súbita119. Se recomienda el uso de IECA y el uso de betabloqueantes durante al menos tres años tras un IAM. En la actualidad, la cirugía cardiaca debe ser la opción terapéutica para la mayoría de DM2 con enfermedad multivaso conocida120,121.
RecomendacionesAAS en prevención primaria: dosis bajas (100 mg/día) si RCV >10% a los 10 años (1/++).
AAS en prevención secundaria: dosis bajas (100 mg/día) (1/++++).
AAS y clopidogrel tras IAM con colocación de un stent debe administrarse durante un año (1/+++).
Se recomienda el uso de IECA y de betabloqueantes durante al menos dos años tras un infarto agudo de miocadio (IAM) (1/+++).
Los iSGLT2/arGLP-1 por sus efectos beneficiosos sobre el RCV y sobre la mortalidad CV deben de emplearse conjuntamente con metformina, seleccionando según cada paciente qué fármaco sería el más indicado (1/++++).
Enfermedad cardiorrenalLa nefropatía diabética es la afectación renal que se produce como consecuencia del mal control crónico de la enfermedad y la microalbuminuria (cociente albumina/creatinina > 30 mg/g) es su manifestación clínica inicial (nefropatía incipiente). El estadio de la nefropatía no solo se relaciona con la progresión de la nefropatía sino con el riesgo CV de los pacientes. Por tanto, la detección precoz de los pacientes con microalbuminuria y su tratamiento es importante al disminuir la morbilidad CV y la velocidad de progresión de la enfermedad renal, disminuyendo los costes para el sistema sanitario122–124.
La metformina se considera razonablemente seguro en pacientes con filtrado glomerular (FG) mayor de 30 mL/min/1,73 m9,22,124. El uso en pacientes con FG < 30 mL/min sigue estando contraindicado su uso2. Debe evaluarse siempre el FG antes del inicio del tratamiento con metformina y al menos una vez al año si FG es mayor de 60 mL/min. Cuando se utilizan fármacos en combinación de dosis fija que contienen metformina en pacientes con función renal reducida, las restricciones y la eficacia con respecto a la otra sustancia activa utilizada en la combinación deben ser consideradas también, en general no se recomienda en pacientes con insuficiencia renal moderada (FG < 30 mL/min). Se debe informar al paciente que suspenda temporalmente la metformina en condiciones que se asocien a deshidratación o cuando se realicen estudios con contrastes yodados o cuando aumente el riesgo de fracaso renal agudo.
En relación con las glinidas, la repaglinida es el secretagogo indicado en enfermedad renal crónica (ERC) clásicamente, pudiéndose utilizar en diálisis. Los inhibidores de DPP-4 han demostrado efectos beneficiosos y seguros en el control glucémico para pacientes diabéticos con ERC sin causar ningún efecto adverso adicional, aunque requieren ajuste de dosis según el grado de ERC, salvo la linagliptina124,125. La pioglitazona también puede ser utilizada en pacientes con ERC que no tengan alguna contraindicación al fármaco y se debe prestar atención a la posible retención hidrosalina. Los arGLP-1 pueden usarse sin alteraciones de la dosis en la ERC de la categoría G2, G3a o G3b, especialmente en los pacientes diabéticos que tienen ECV o enfermedad renal establecida y obesidad, dado el beneficio demostrado en reducir el peso y disminuir ECV, pero están contraindicados en las categorías G4 y G5 (FG estimada inferior a 30 mL/minuto/1,73 my)2,66. Los iSGLT2 solo podían prescribirse si la tasa de FG era >60, actualmente están indicados iSGLT2 en los pacientes que tienen ECV o enfermedad renal establecida, con beneficio demostrado de ECV2. En los pacientes con ERC, hoy se pueden prescribir los iSGLT2 con un filtrado glomerular estimado (eFG) ≥ 30 mL/min, particularmente en aquellos con concentración albumina creatinina (CAC) superior a 300 mg/g para reducir la progresión de la ERC, enfermedad cardiovascular (ECV) o ambas2,124,126-128. Los iSGLT1 aunque su efecto hipoglucemiante se reduce con filtrados < 60 mL/min, su eficacia se mantiene hasta un filtrado de 30 mL/mn. La canagliflozina, dapagliflozina y empagliflozina han demostrado su capacidad para reducir la progresión de la enfermedad renal9). Debe elegirse la dosis de los iSGLT2 según el FG. Es importante destacar el papel cardio y renoprotector de los iSGLT2 mayor en aquellos pacientes con función renal preservada (reducciones en el objetivo combinado del 33, 44 y 56%, respectivamente para pacientes con FG de < 60 mL/min, 60 a 90 mL/min y > 90 mL/min). Por el contrario, la reducción de los ingresos hospitalarios por IC fue mayor en los pacientes con peor función renal basal (40, 31 y 12%, respectivamente para filtrados de < 60 mL/min, 60 a 90 mL/min y > 90 mL/min, respectivamente)127,128. Los estudios de seguridad CV en pacientes con función renal comprometida aún no se han completado, a excepción del CREDENCE con canagliflozina, que incluyó pacientes con tasa de FG ≥ 30 mL/min y que se detuvo prematuramente por los hallazgos a favor de canagliflozina. En este estudio, el riesgo de hospitalización por IC se redujo en un 39%. Hay dos estudios en curso: el EMPA-KIDNEY con empagliflozina, que incluye pacientes con tasa de FG ≥ 20 mL/min,y el DAPA-CKD con dapagliflozina, que incluye pacientes con tasa de FG ≥ 25 mL/min127,128.
En general, en prevención primaria se recomienda tratar a los pacientes con ERC (estadios G3-G5 no en diálisis) con estatinas o estatina más ezetimiba. Al haber sido demostrado que la disminución farmacológica de la hiperlipemia reduce de forma segura los episodios CV en la ERC2,5,9,129–131.Es importante recordar, con el fin de individualizar el tratamiento, que existen estatinas que no requieran ajuste como la atorvastatina en ningún estadio de la insuficiencia renal (IR). Se debe considerar el grado de IR 4 a 5 en la fluvastatina dosis a utilizar entre 20 a 40 mg, lovastataina 10 a 20 mg, pravastatina 10 a 20 mg, simvastatina 5 a 20 mg, pitavastatina 1 a 2 mg. La rosuvastatina en estadio 3 la dosis a utilizar es 5 a 20 mg día y en estadio 4 a 5 la dosis máxima de rosuvastina es de 10 mg/día7,129–131.
La ezetimiba no requiere ajuste de dosis y su eficacia terapéutica está demostrada. En caso de intolerancia a estatinas y/o no alcanzar objetivos con dosis máxima tolerada, los inhibidores de la PCKS9 no requieren ajuste en insuficiencia renal crónica (IRC) moderada-severa estando indicado su uso para alcanzar el objetivo terapéutico como hemos previamente señalado. Si se cambia de tacrolimus a ciclosporina, en pacientes con trasplante renal, la dosis de estatinas debe disminuirse.
El tratamiento de la hipertrigliceridemia en la ERC debe basarse en cambios en el estilo de vida. No se recomiendan fibratos para disminuir el RCV y se desaconseja su uso si el FG < 15 mL/min. Los fibratos y los ácidos grasos omega-3 podrían ser considerados en aquellos pacientes con niveles marcadamente elevados de los niveles de triglicéridos en ayunas (>500 mg/dL) para evitar el riesgo de pancreatitis132. Por lo que respecta a los ácidos grasos omega-3, hay evidencia de la reducción de los triglicéridos, pero no de los episodios CV y la mortalidad. Los ácidos omega-3, en general, son seguros, aunque pueden incrementar el sangrado en sujetos tratados con AAS/clopidogrel. Si los triglicéridos no se controlan con estatinas o fibratos, se puede añadir omega-3, una combinación segura y bien tolerada, pero con dosis elevada de omega-3 como señalamos previamente. Por último, recordar que la guía KDIGO aconseja el uso de antiagregantes en la ERC y mantener niveles de hemoglobina de 11 g/dL o mayores, utilizando eritropoyetina para controlar la anemia124,133.
Sugerimos iniciar en diabéticos con IR como primera línea de tratamiento metformina con los iSGLT2 no empezando terapia con SGLT2 si FG < 30, valorar ajuste de metformina si el FG es menor de 45 mL/min. En caso de FG menor de 30 mL/min valorar como fármaco de primera elección los arGLP-1 añadiendo para control metabólico tiazolidindionas (TZD), glinidas (SU) o insulina. En caso de contraindicación para los arGLP-1 se podrían utilizar inhibidor de la enzima DPP4 (iDPP4) como primera opción en la IR asociado a metformina124.
RecomendacionesLa metformina se considera razonablemente segura en pacientes con FG mayor de 30 mL/min/1,73 m2 (Grado 1/+++).
En general, en prevención primaria, se recomienda tratar a los pacientes con ERC (estadios G3-G5, no en diálisis) con estatinas o estatina más ezetimiba grado (1/+++).
La PA a cifras menores de 140/90 mmHg, se sugiere PA menor de 130/80 mmHg, cuando existe albuminuria (Grado 1/++).
No se recomiendan fibratos si el FG < 15 mL/min (Grado 1/+++).
Para los pacientes con DM2 que han establecido una enfermedad renal, se recomienda un iSGLT2 o un arGLP-1 con beneficios demostrados para enfermedades CV (1/+++).
En pacientes con DM2 y enfermedad renal diabética, se recomienda un iSGLT2 glucosa con beneficios CV demostrados para reducir el riesgo de eventos CV graves y/o hospitalización por IC (Grado 1/+++).
Diabetes e insuficiencia cardiacaLa DM y la cardiopatía isquémica son los factores de riesgo más importantes de IC. En el paciente con DM, los factores de riesgo independientes de desarrollar IC más comunes son la cardiopatía isquémica y la HTA. La incidencia de IC es 2,5 veces mayor en pacientes diabéticos que en la población general. La presencia de IC en la población diabética tiene peor pronóstico y duplica el riesgo de sufrir un ingreso o fallecimiento por IC en relación con la población general, pese a su importancia la IC es infradiagnosticada en los pacientes con DMT2 y aumenta la mortalidad133. Los pacientes diabéticos sin IC sintomática pueden tener anomalías subclínicas en la función y en la estructura cardiaca, tales como disfunción sistólica del ventrículo izquierdo, disfunción diastólica, aumento en la masa ventricular izquierda y engrosamiento relativo de la pared ventricular y del tamaño de la aurícula izquierda. Estas anormalidades se asocian con mayor riesgo de IC sintomática y muerte, lo cual implica que las recomendaciones para el tratamiento de los pacientes con DM2 e IC, también puedan ser útiles en aquellos diabéticos sin IC conocida y con factores de riesgo para desarrollarla en el futuro. Los arGLP1 liraglutida, semaglutida, albiglutida y dulaglutida66,67,134-137, han demostrado beneficio CV al reducir el desenlace CV combinado MACE de tres puntos (muerte CV, IM o ACV no fatal), pero no modifican la tasa de hospitalizaciones por IC. En el año 2019, se publicó el estudio Dapagliflozin Heart Failure (DAPA-HF), en el que la dapaglifozina redujo de forma significativa y clínicamente relevante la incidencia de empeoramiento de IC o muerte CV en pacientes estables con insuficiencia cardiaca con función sistólica reducida (ICFSr) en pacientes con DM138. El estudio EMPA-RESPONSE-AHF no redujo la mejoría en la escala visual de disnea, la estancia hospitalaria, propéptido natriurético cerebral N?-terminal (NT-proBNP) o la respuesta diurética a furosemida en mayor grado que placebo. Sin embargo, destaca la seguridad del fármaco en la IC aguda, sobre una población en la que solo 1/3 eran diabéticos y muestra además datos interesantes en relación con la reducción de eventos con empagliflozina en la fase vulnerable tras una hospitalización por IC. Sin embargo, existe cierta controversia sobre la seguridad de estos fármacos en la IC aguda.
Es cada día más evidente que los sistemas CV, renal y metabólico están interconectados y comparten muchos de los mismos factores de riesgo y vías patológicas a lo largo del continuo de la enfermedad. La disfunción en un sistema puede acelerar la aparición de otros, lo que resulta en la progresión de enfermedades interconectadas como DM2, ECV, insuficiencia cardiaca y enfermedad renal, que a su vez conduce a un mayor riesgo de muerte CV.
Se ha señalado que por cada reducción del 1% de la HbA1c, disminuye un 16% el riesgo de desarrollar IC y eventos CV. Se aconseja para prevenir y/o retrasar la IC, así como mejorar la supervivencia en los DM con IC, el tratamiento de la HTA, uso de estatinas en pacientes con alto riesgo de enfermedad coronaria, uso de IECA en pacientes con disfunción VI asintomática y de betabloqueantes en disfunción VI asintomática e historia de IM137 y actualmente los SLTG1. El tratamiento de la IC clásicamente ha consistido en modificar el estilo de vida y como tratamiento farmacológico de la IC con fracción de eyección reducida (IC-FER) se utilizan IECA o bien ARA-II. Si los primeros no se toleran, se pueden emplear los betabloqueantes y antagonistas del receptor mineralocorticoideo (ARM) siempre que no exista contraindicación. Si el paciente persiste sintomático se recomienda sustituir el IECA por sacubitril/valsartán137. Los diuréticos se usan para mejorar síntomas y mejorar la capacidad de ejercicio, así como si hay signos y/o síntomas de IC. Hoy día, los inhibidores de SLGT2 están siendo la primera clase de agentes para mejorar tanto la mortalidad CV y el pronóstico de la IC en individuos diabéticos con y sin IC establecida139, así como postulándose su uso en pacientes no diabéticos con IC. Los iSGLT2 han reducido el riesgo relativo de la hospitalización por IC del 30% tanto en prevención primaria como secundaria, independientemente de la existencia previa o no de IC. Los arGLP-1 se consideran eficaces en la reducción del objetivo CV combinado 3-P MACE, pero no se acompañan de reducción de hospitalizaciones por IC. El estudio EMPAREG-OUTCOME demostró que con empagliflozina a dosis de 10 y de 25 mg al día, redujo la tasa de hospitalizaciones por IC en un 35%, con una clara diferenciación de las curvas a favor del brazo de empagliflozina desde las primeras semanas de tratamiento. Los estudios del programa CANVAS mostraron también una reducción del 33% en la tasa de hospitalizaciones por IC en los pacientes que recibieron canagliflozina en comparación con placebo. Análisis posteriores del CANVAS sugieren que se obtienen mayores beneficios sobre la morbimortalidad en aquellos pacientes diabéticos con IC. El estudio DECLARE-TIMI 58, que incluyó un porcentaje mucho más alto de pacientes diabéticos de alto riesgo pero sin enfermedad CV establecida (59,4% en DECLARE vs. 34.4% en CANVAS vs. 0% en EMPAREG-OUTCOME), encontró que los pacientes tratados con dapagliflozina 10 mg/día tuvieron una reducción en la tasa de hospitalizaciones por IC del 27%. Zelniker et al. publicaron un metaanálisis y revisión sistemática de los estudios de desenlace CV de los inhibidores de SGLT2 en prevención primaria y secundaria139. En este metaanálisis, los inhibidores de SGLT2 se asociaron con una reducción del desenlace combinado de hospitalización por IC o muerte de causa CV mayor del 20%, en los pacientes diabéticos con o sin historia de IC. Los inhibidores SGLT2 son la primera clase de medicamentos antidiabéticos que han demostrado reducir el riesgo de hospitalización por IC en pacientes con DM2. Los análisis secundarios de los estudios de seguridad CV sugieren que los inhibidores de SGLT2 reducen el riesgo de hospitalización por IC tanto en los pacientes que ya tienen diagnóstico conocido de IC como en aquellos que no. Por lo tanto, los inhibidores de SGLT2 deben ser los medicamentos de primera línea en diabéticos con IC ya conocida y en diabéticos con alto riesgo de desarrollarla2,139–141. EL mismo autor en un metaanálisis comparando arGLPT y los SGLT2 realizados, encuentra que tanto el tratamiento con agonista del receptos de glucagon peptido 1 (GLP1-RA) y SGLT2i reducen el MACE aterosclerótico en un grado similar en pacientes con ECV aterosclerótica establecida, mientras que el inhibidor del contrapostador de glucosa renal 2 (SGLT2i) tiene un efecto más marcado en la prevención de la hospitalización por insuficiencia cardiaca y progresión de la enfermedad renal. Por tanto, los diferentes perfiles de beneficios clínicos deben tenerse en cuenta en el proceso de toma de decisiones al tratar a pacientes con DM2140.
Los resultados disponibles de los Cardiovascular Outcome Trials (CVOT) con SGLT2i o GLP-1RA, comparando los resultados CV en pacientes con DM2 con niveles de HbA1c bajos versus altos, llevó a la conclusión de que no hay razón para no agregar un agente hipoglucemiante con cardioprotección probada en pacientes de alto riesgo con DM2 a pesar de que están en el objetivo de HbA1c con metformina142.
La Food and Drug Administration (FDA) aprobó la empagliflozina y la dapagliflozina para el tratamiento de la insuficiencia cardiaca con fracción de eyección reducida. Publicaciones recientes muestran las evidencias de que empagliflozina y dapaglifloxina reducen la incidencia de episodios nuevos o recurrentes de fibrilación auricular y flutter auricular (AF/AFL), trastornos que están asociados con diabetes.
Los metaanálisis de los ensayos notificados hasta la fecha sugieren que los agonistas del receptor GLP-1 y los inhibidores de SGLT2 reducen el riesgo de eventos CV adversos importantes ateroscleróticos en un grado comparable en pacientes con DM 2 y Atherosclerotic Cardiovascular Disease (ASCVD) establecido143. Los inhibidores de SGLT2 también parecen reducir el riesgo de hospitalización por insuficiencia cardiaca y progresión de la enfermedad renal en pacientes con ASCVD establecido, múltiples factores de riesgo para el ASCVD o enfermedad renal diabética144. En pacientes con DM2 y ASCVD, múltiples factores de riesgo de ASCVD o enfermedad renal diabética, se recomienda un inhibidor de SGLT2 con beneficios CV demostrados para reducir el riesgo de eventos CV adversos importantes y/o hospitalización por insuficiencia cardiaca. En pacientes con DM2 y ASCVD establecido o múltiples factores de riesgo para ASCVD, se recomienda un agonista del receptor de péptido 1 similar al glucagón con beneficios CV demostrados para reducir el riesgo de eventos CV adversos importantes. Para muchos pacientes, el uso de un inhibidor SGLT2 o un agonista del receptor GLP-1 para reducir el riesgo CV es apropiado2.
RecomendacionesLos inhibidores de SGLT2 son buenos fármacos para para mejorar la mortalidad CV y de la IC en individuos diabéticos con y sin IC establecida (1/++).
En pacientes con DM2 e IC establecida con fracción de eyección reducida se recomienda un iSGLT2 con beneficio comprobado en esta población de pacientes para reducir el riesgo de empeoramiento de la insuficiencia cardiaca y la muerte CV (1/+++).
En pacientes con DM2 y ECV aterosclerótica establecida o múltiples factores de riesgo para la ECV aterosclerótica, se recomienda un arGLP-1 con beneficios CV demostrados para reducir el riesgo de eventos CV adversos importantes (1/+++).
ConclusionesEl control de los FRCV previene el desarrollo de la ECV y/o la retrasa en el tiempo. Sin embargo, los estudios epidemiológicos demuestran de forma contundente un deficiente control de los mismos en los pacientes con DM2. Es fundamental la visión global de los pacientes con un abordaje terapéutico integral, así como planificar la estrategia terapéutica de forma individualizada. La dieta mediterránea, en nuestro país, y el ejercicio aeróbico son beneficiosos en el diabético, facilitando el control de los FRCV y la consecución de los objetivos terapéuticos. Con base en las evidencias disponibles, no son necesarios los suplementos de antioxidantes ni vitaminas si no existen deficiencias, debiéndose determinar los niveles plasmáticos de B12 y fólico en los pacientes diabéticos especialmente si están en tratamiento con metformina140,145. La CB parece ser cada vez más eficiente, disminuyendo a corto y largo plazo las comorbilidades y complicaciones de la DM, así como revirtiendo la enfermedad en un número significativo de pacientes con DM2 y obesidad. Se debe intentar conseguir la mayor adherencia terapéutica de los pacientes, así como una mayor implicación y objetivos más realistas de las guías, individualizando el tratamiento y sus objetivos, y adaptándolos al entorno del paciente, así como decidiendo conjuntamente con él los objetivos y tratamiento a seguir. Un nivel de HbA1c en torno a 6,5%, individualizando según edad y riesgo de hipoglucemia pudiéndose aceptar niveles de HbA1c de hasta 8,5%. Hoy en día, todavía la metformina es el primer fármaco y debe valorarse conjuntamente la indicación de los iSGLT2 y los arGLP-1 como primera /segunda opción en pacientes con RCV, o conjuntamente con metformina. La PA debe ser menor de 140/90 mmHg, o incluso de 130/80 mmHg si no existe riesgo asociado, con niveles de colesterol LDL según el RCV utilizándose estatinas como primera opción, añadiendo ezetimiba para alcanzar objetivos de colesterol LDL según el RCV, y si no se alcanza por dosis máximas tolerada y/o intolerancia a las estatinas, utilizar los iPCKS9. Se aconseja el uso de AAS en prevención secundaria (75-162 mg/día). En el paciente diabético con riesgo de IC se hace hincapié en el uso del tratamiento con un iSGLT2 como primera opción de tratamiento. La edad no es contraindicación para el tratamiento de los FRCV, debiéndose individualizar en cada caso. En los pacientes con DM mayores de 65 años, debemos hacer un despistaje anual para la detección temprana de deterioro cognitivo leve o demencia y facilitar la adherencia al tratamiento. Es fundamental valorar la incorporación de un especialista en Endocrinología y Nutrición en las Unidades de Rehabilitación Cardiaca de la complejidad para una correcta valoración diagnóstica y terapéutica de las alteraciones metabólicas que constituyen la base patogénica de la ECV hacen que el papel de un profesional con avanzadas competencias en el manejo de tales alteraciones sea cada vez más necesario, para mejorar el control cardiometabólico de los pacientes con DM2 y alcanzar los objetivos terapéuticos del mayor número posible de FRCV y favorecer la visión integral del abordaje terapéutico146. La determinación de Lp (a) debería realizarse a todos diabéticos para valorar globalmente el riesgo RCV como pone de manifiesto la ecuación de riesgo CV del safeheart en la población con hipercolesterolemia congénita familiar147.