Introducción La cirugía bariátrica (CB) ha mostrado reducir la morbilidad y mortalidad cardiovascular en obesidad mórbida. La CB ha mejorado la dislipemia del paciente insulinorresistente (IR). El objetivo de nuestro trabajo fue evaluar si existe diferencia en el perfil lipídico entre la técnica de bypass gástrico laparoscópico en Y de Roux (BGYRL) vs. la técnica de la gastrectomía tubular laparoscópica (GTL) a 18 meses de seguimiento.
MétodosEstudio observacional, abierto, prospectivo, de pacientes con obesidad mórbida sometidos que realizaron a cirugía bariátrica a 18 meses seguimiento. Se realizaron análisis antropométricos, composición corporal, gasto energético de reposo, de glucosa, insulina, hemoglobina glucosilada (HbA1c), lipoproteínas de baja densidad (LDL), lipoproteínas de alta densidad (HDL), triglicéridos (TG) y colesterol total (CT).
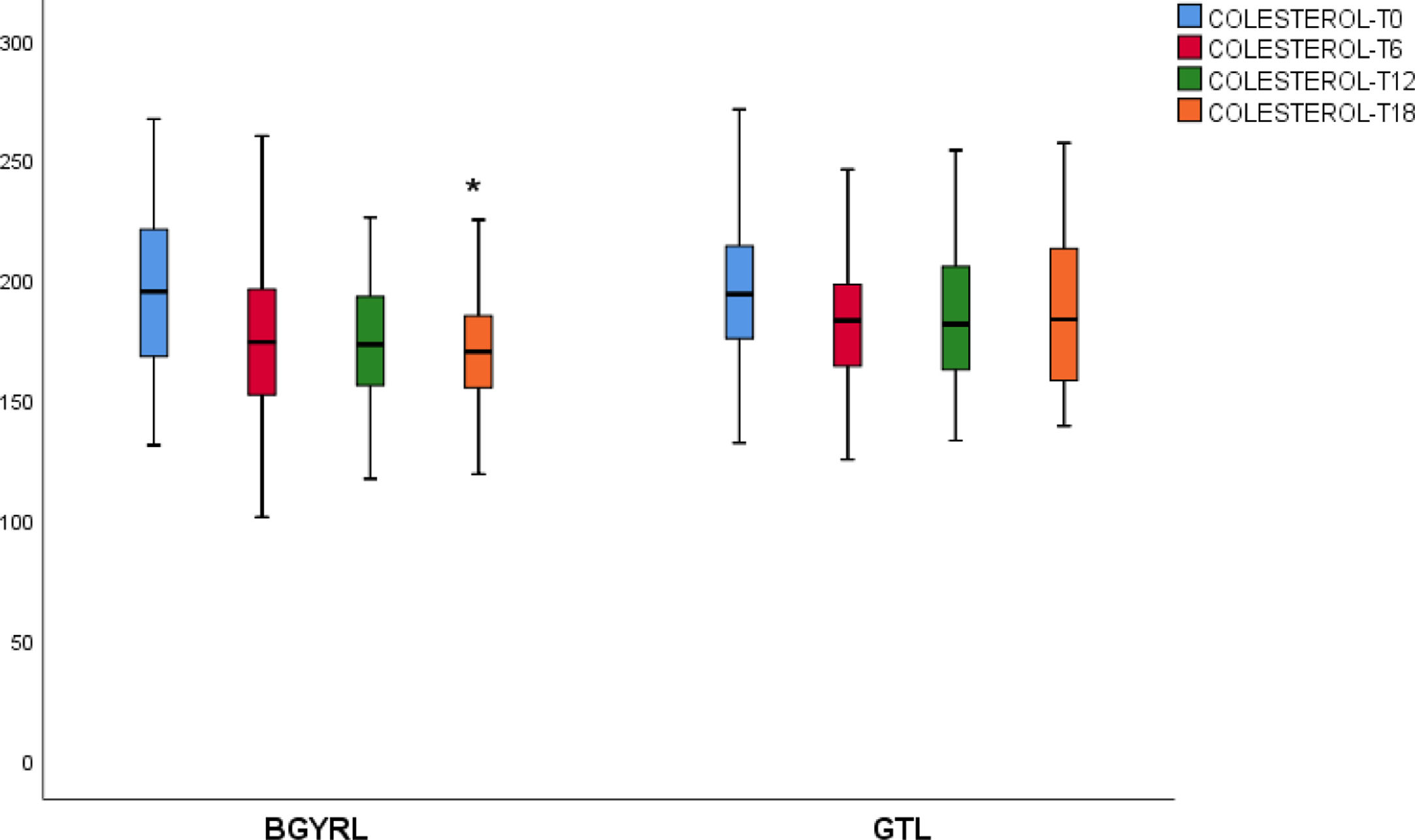
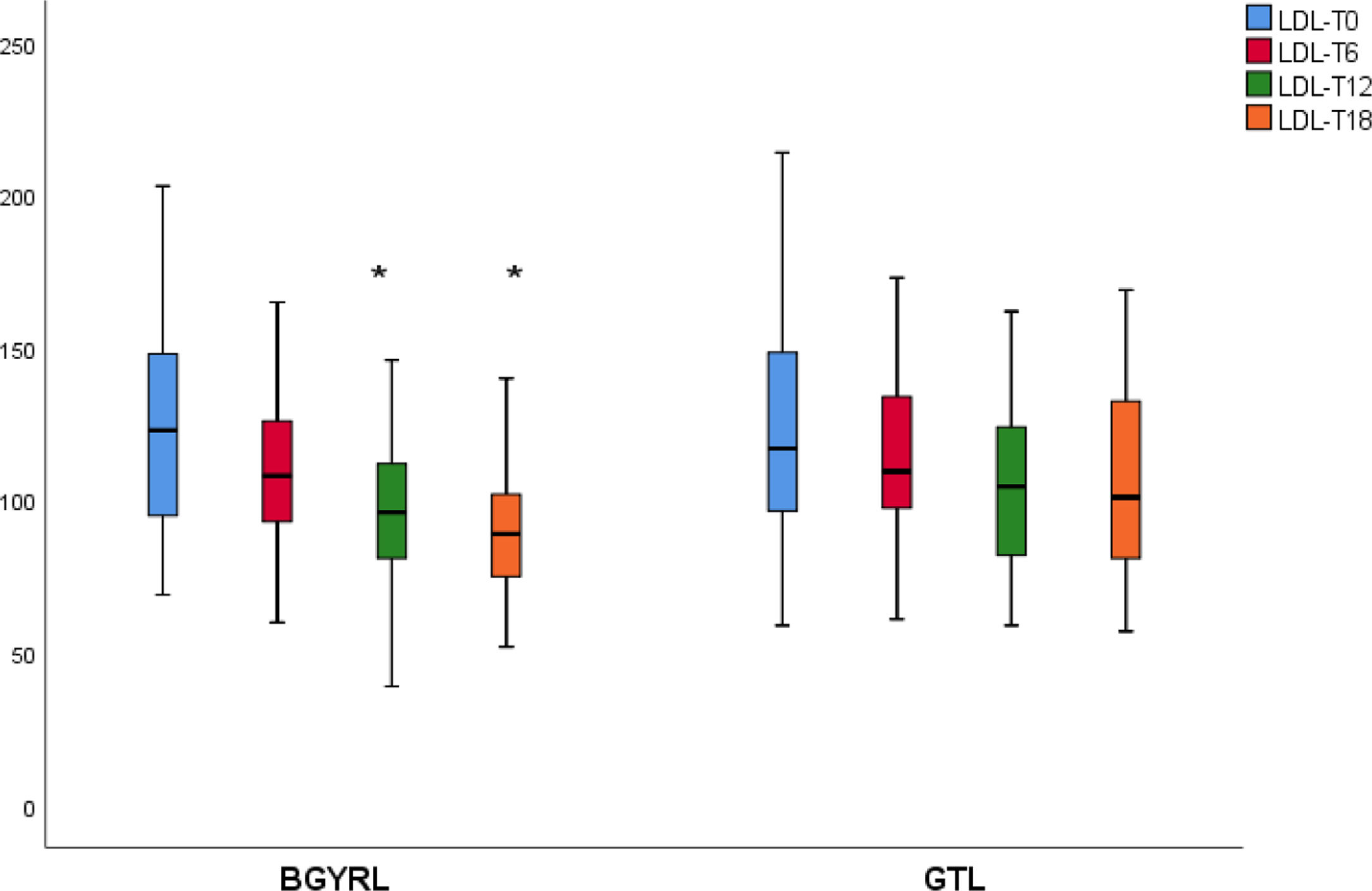
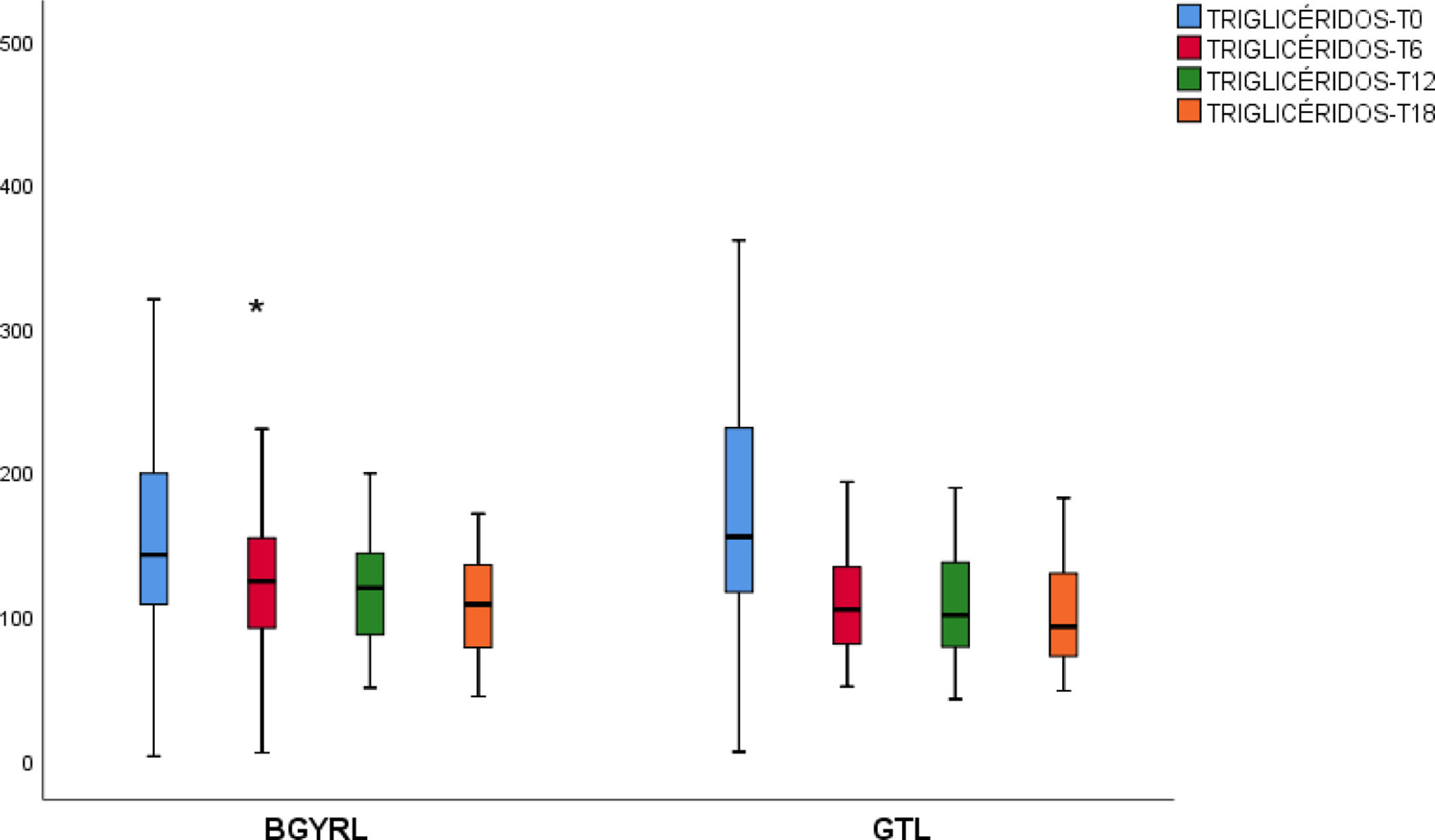
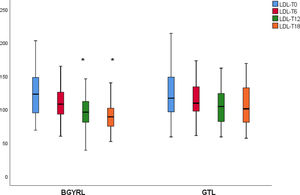
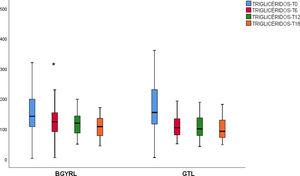
ResultadosNo se encontraron diferencias basales de la proporción de pacientes con hipertensión arterial, diabetes de tipo 2, esteatosis y de sexo entre los grupos de BGYRL (91) vs. GTL (77). Se observo reducción de TG a los seis meses a favor de BGYRL vs. GTL: 108,60± 34,86 vs. 124,59±44,58; p = 0,044), en cambio se encontró disminución tanto de niveles de LDL a los 12 y 18 meses a favor del grupo BGYRL vs. GTL: 96,23±24,33 vs. 107,83±28,88, p = 0,025; 90,98±20,62 vs. 106,22±31,48, p = 0,003; la disminución de CT se observó solo a los 18 meses a favor del grupo BGYRL vs. GTL: 171,39±25,058 vs. 186,89±31,81, p = 0,005.
ConclusiónEl BGYRL ha mostrado ser más eficaz para reducir LDL y CT en comparación con GTL, lo cual otorga un beneficio adicional del BGYRL en relación al perfil lipídico del paciente.
Bariatric surgery (BS) has shown to reduce cardiovascular morbidity and mortality in obesity. The BS has improved the dyslipidemia of the insulin resistant patient, our objective was to evaluate if there was a difference in the lipid profile between the laparoscopic roux-en-Y gastric bypass (RYGB) technique vs. the sleeve gastrectomy (SG) technique at 18 months of follow-up.
MethodsAn observational, open, prospective study of morbidly obese patients who underwent bariatric surgery at 18-month follow-up. Anthropometric analysis, body composition, energy expenditure at rest, glucose, insulin, HbA1c, LDL, HDL, TG and CT were performed.
ResultsAbsence baseline differences were found in the proportion of patients with hypertension, diabetes, steatosis, and sex between the RYGB vs SG groups. A reduction of TG was observed at 6 months in favor of RYGB vs SG: 108.60±34.86 vs. 124.59±44.58, P = 0.044), however, a decrease in both LDL levels was found at 12 and 18 months in favor of the RYGB vs. SG group: 96.23±24.33 vs. 107.83±28.88, P = 0.025; 90.98±20.62 vs 106.22±31.48, P = 0.003; the decrease in CT was observed only at 18 months in favor of the RYGB vs. SG group: 171.39±25.058 vs. 186.89±31.81, P = 0.005.
ConclusiónRYBG has shown to be more effective in reducing LDL and CT levels compared to SG, which provides an additional benefit of RYGB in relation to the lipid profile of the patient.
La obesidad es un problema de salud pública en todo el mundo, la cual se asocia a comorbilidades como: la diabetes mellitus tipo 2 (DM2) y las enfermedades cardiovasculares (ECV)1. La creciente prevalencia de obesidad se acompaña de una mayor prevalencia de DM2. La obesidad no solo aumenta el riesgo de desarrollar DM2, sino que también agrava sus riesgos para la salud y complica su manejo2.
La ECV es la principal causa de morbilidad y mortalidad en pacientes con obesidad y DM23. El colesterol plasmático elevado de lipoproteínas de baja densidad (C-LDL) es el principal factor de riesgo lipídico cardiovascular4, pero la dislipidemia aterogénica (DA) observada en estados de insulinorresistencia (IR), como la obesidad y la DM2, representa un factor determinante del riesgo cardiovascular. La DA se caracteriza principalmente por concentraciones plasmáticas elevadas de lipoproteínas ricas en triglicéridos (TRL) en ayunas y postprandiales, lipoproteínas de baja densidad (LDL) pequeñas y densas y niveles reducidos de colesterol unido a lipoproteínas de alta densidad (C-HDL)5.
La cirugía bariátrica (CB) es actualmente el tratamiento más eficaz para inducir la pérdida de peso en pacientes con obesidad, conduce a la remisión completa o parcial de la DM2 y mejora de los factores de riesgo cardiovascular como hipertensión arterial y alteraciones lipídicas en una proporción significativa de pacientes6.
A nivel mundial, los procedimientos de CB que se realizan con más frecuencia son: la gastrectomía tubular laparoscópica (GTL), que es una técnica restrictiva, y el bypass gástrico laparoscópico en Y de Roux (BGYRL), que es una combinación de técnica restrictiva y malabsortiva. No existe una recomendación estricta para realizar una GTL o un BGYRL, las diferencias en los resultados de los parámetros glucídicos y lipídicos, pueden ser mucha utilidad para seleccionar la mejor técnica quirúrgica para un paciente7.
Dentro de los factores de buen pronóstico, se ha demostrado que la reducción de TG y colesterol total en análisis multivariado han sido marcadores tempranos de reducción de eventos de cardiovasculares8.
Muchos de los ensayos clínicos controlados aleatorios publicados no evalúan los parámetros lipídicos en sus puntos finales primarios. En muchos estudios, no informan el porcentaje de pacientes sometidos a tratamientos hipolipemiantes previos y posteriores o la clase de fármacos hipolipemiantes utilizados o sus dosis.
En el presente estudio nosotros evaluamos los parámetros lipídicos a 18 meses de seguimiento en pacientes que operados de BGYRL vs. GTL.
Material y métodosUn total de 168 pacientes obesos evaluados en el departamento de nutrición y cirugía bariátrica del Centro de Nutrición, Endocrinología y Metabolismo (CIEN) Corrientes y del Instituto Modelo de Gastroenterología (IMG) Formosa fueron reclutados para este estudio.
Todos los pacientes han sido evaluados por un equipo multidisciplinario conformado por un endocrinólogo, un cirujano bariátrico, psiquiatra y nutricionista durante al menos seis meses antes de la cirugía. Todos los sujetos cumplieron los criterios de indicación para cirugía bariátrica9.
La técnica quirúrgica empleada incluye BGYRL y GTL. El seguimiento tras la cirugía se limitó a 18 meses. Se excluyeron pacientes con insuficiencia renal (filtrado glomerular ≤ 60 mL/min/1,73 m2), menores de edad o mayores de 65 años, mujeres embarazadas, y aquellos sujetos con una enfermedad grave que condicionara su supervivencia. Pacientes con seguimiento incompleto, con datos faltantes, o quienes se sometieron a una cirugía por reganancia de peso han sido excluido por el presente estudio. Los datos clínicos y analíticos de todos los pacientes se recogieron tras la revisión de la historia clínica informatizada. Este estudio se realizó de acuerdo con la Declaración de Helsinki, aprobado por el comité de bioética del IMG, todos los pacientes dieron por escrito su consentimiento informado.
Peso, parámetros bioquímicos en ayunas, composición corporal, y la ingesta energética (la dieta de cada sujeto fue evaluado por un nutricionista utilizando un diario de alimentos autoadministrado completado durante tres días) se midieron un mes antes cirugía (T0) y a los seis meses (T6), 12 meses (T12) y 18 meses (T18) después de la cirugía. Nuestro estudio no fue diseñado para comparar la efectividad de los dos procedimientos quirúrgicos, BGYRL vs. GTL.
Se recolectaron muestras de sangre después de un ayuno nocturno. El plasma se separó inmediatamente por centrifugación a 2000 rpm durante 15 minutos a 4 C. TG plasmáticos, colesterol total, HDL-C y LDL-C se midieron utilizando un método enzimático de kit colorimétrico (analizador cobas 6000 c 501; Roche Diagnostics, Mannheim, Alemania). Se analizó la glucosa plasmática utilizando el método de la hexoquinasa oxidasa (cobas 6000c, 501 analizador). Se determinaron las concentraciones plasmáticas de insulina, utilizando el método de electroquimioluminiscencia (cobas Analizador 6000 e 601). La resistencia a la insulina se estimó utilizando la evaluación del modelo de homeostasis como homeostasis modelo de evaluación de resistencia a la insulina (HOMA-IR): insulina en ayunas (mUI/L) x glucosa en ayunas (mmol /L) /22,510. HOMA-IR no se calculó para esos pacientes con diabetes para evitar el error de cálculo de HOMA-IR debido a los fármacos antidiabéticos que toman los pacientes.
Se determinaron las concentraciones plasmáticas de apoB y apoA-I, por inmunonefelometría (Roche Diagnostics) utilizando un analizador BN ProSpec (Siemens Healthineers, Erlangen, Alemania). El gasto energético de reposo (GER) se midió mediante calorimetría indirecta (Quark-RMR-Cosmed, Roma, Italia). La composición corporal se evaluó mediante absorciometría con rayos X de energía dual (DEXA) (Lunar iDXA y Software enCORE versión 2007, GE Healthcare, Chalfont St Giles, Reino Unido)
Análisis estadísticoLos datos se expresaron como media±desviación estándar para las variables continuas. Las variables categóricas se plasmaron en porcentaje. La distribución normal de las variables se confirmó mediante la prueba de Kolmogorov- Smirnov. Las comparaciones entre grupos se realizaron mediante la prueba de X2 para las variables categóricas, así como el test t de Student y ANOVA para las variables continuas. La relación entre las variables continuas se examinó mediante el análisis de regresión múltiple. Todos los análisis estadísticos se realizaron utilizando IBM SPSS Statistics 25.0 (IBM Inc, NY). Los test fueron bilaterales, una p<0,05 se consideró estadísticamente significativo.
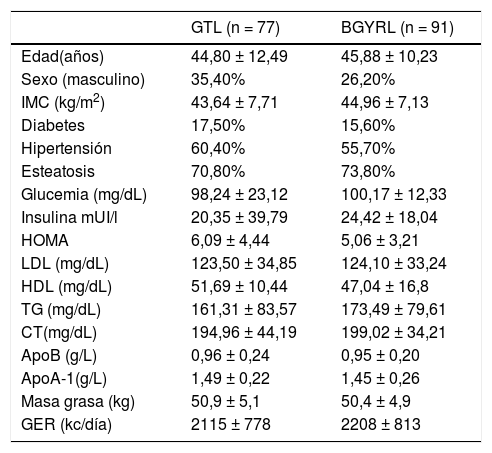
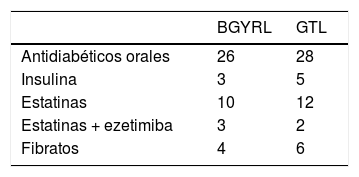
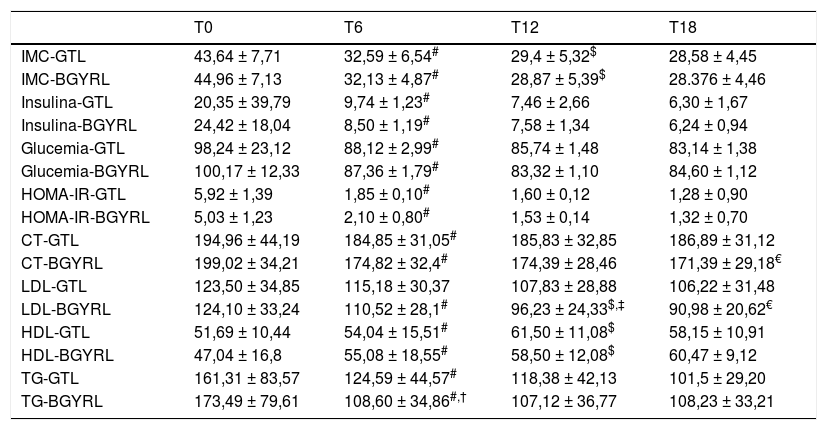
ResultadosLas características basales de los pacientes se encuentran en la tabla 1, sin diferencias significativas. El seguimiento medio fue de 1,5 años. El tratamiento previo a la CB se observa en la tabla 2. No encontramos diferencias significativas con relación al sexo, gasto calórico, masa grasa, glucosa, lípidos y apolipoproteínas entre los grupos de bypass gástrico laparoscópico en Y de Roux (BGYRL) y de gastrectomía tubular laparoscópica (GTL). La evolución de los parámetros antropométricos y metabólicos del seguimiento tras la cirugía a 18 meses se encuentran en la tabla 3. Nosotros encontramos una reducción de peso, índice de masa corporal (IMC), glucosa plasmática en ayunas, HOMA-IR, aporte energético y masa grasa, después de la cirugía en ambos grupos GBYRL y GTL a los meses del seguimiento.
Características clínicas y metabólicas basales de la población
| GTL (n = 77) | BGYRL (n = 91) | |
|---|---|---|
| Edad(años) | 44,80 ± 12,49 | 45,88 ± 10,23 |
| Sexo (masculino) | 35,40% | 26,20% |
| IMC (kg/m2) | 43,64 ± 7,71 | 44,96 ± 7,13 |
| Diabetes | 17,50% | 15,60% |
| Hipertensión | 60,40% | 55,70% |
| Esteatosis | 70,80% | 73,80% |
| Glucemia (mg/dL) | 98,24 ± 23,12 | 100,17 ± 12,33 |
| Insulina mUI/l | 20,35 ± 39,79 | 24,42 ± 18,04 |
| HOMA | 6,09 ± 4,44 | 5,06 ± 3,21 |
| LDL (mg/dL) | 123,50 ± 34,85 | 124,10 ± 33,24 |
| HDL (mg/dL) | 51,69 ± 10,44 | 47,04 ± 16,8 |
| TG (mg/dL) | 161,31 ± 83,57 | 173,49 ± 79,61 |
| CT(mg/dL) | 194,96 ± 44,19 | 199,02 ± 34,21 |
| ApoB (g/L) | 0,96 ± 0,24 | 0,95 ± 0,20 |
| ApoA-1(g/L) | 1,49 ± 0,22 | 1,45 ± 0,26 |
| Masa grasa (kg) | 50,9 ± 5,1 | 50,4 ± 4,9 |
| GER (kc/día) | 2115 ± 778 | 2208 ± 813 |
GER: Gasto Energético de Reposo.
Datos expresados mediante media ± desviación estándar o porcentaje.
Características clínicas y metabólicas a los seis, 12 y 18 meses de seguimiento
| T0 | T6 | T12 | T18 | |
|---|---|---|---|---|
| IMC-GTL | 43,64 ± 7,71 | 32,59 ± 6,54# | 29,4 ± 5,32$ | 28,58 ± 4,45 |
| IMC-BGYRL | 44,96 ± 7,13 | 32,13 ± 4,87# | 28,87 ± 5,39$ | 28.376 ± 4,46 |
| Insulina-GTL | 20,35 ± 39,79 | 9,74 ± 1,23# | 7,46 ± 2,66 | 6,30 ± 1,67 |
| Insulina-BGYRL | 24,42 ± 18,04 | 8,50 ± 1,19# | 7,58 ± 1,34 | 6,24 ± 0,94 |
| Glucemia-GTL | 98,24 ± 23,12 | 88,12 ± 2,99# | 85,74 ± 1,48 | 83,14 ± 1,38 |
| Glucemia-BGYRL | 100,17 ± 12,33 | 87,36 ± 1,79# | 83,32 ± 1,10 | 84,60 ± 1,12 |
| HOMA-IR-GTL | 5,92 ± 1,39 | 1,85 ± 0,10# | 1,60 ± 0,12 | 1,28 ± 0,90 |
| HOMA-IR-BGYRL | 5,03 ± 1,23 | 2,10 ± 0,80# | 1,53 ± 0,14 | 1,32 ± 0,70 |
| CT-GTL | 194,96 ± 44,19 | 184,85 ± 31,05# | 185,83 ± 32,85 | 186,89 ± 31,12 |
| CT-BGYRL | 199,02 ± 34,21 | 174,82 ± 32,4# | 174,39 ± 28,46 | 171,39 ± 29,18€ |
| LDL-GTL | 123,50 ± 34,85 | 115,18 ± 30,37 | 107,83 ± 28,88 | 106,22 ± 31,48 |
| LDL-BGYRL | 124,10 ± 33,24 | 110,52 ± 28,1# | 96,23 ± 24,33$,‡ | 90,98 ± 20,62€ |
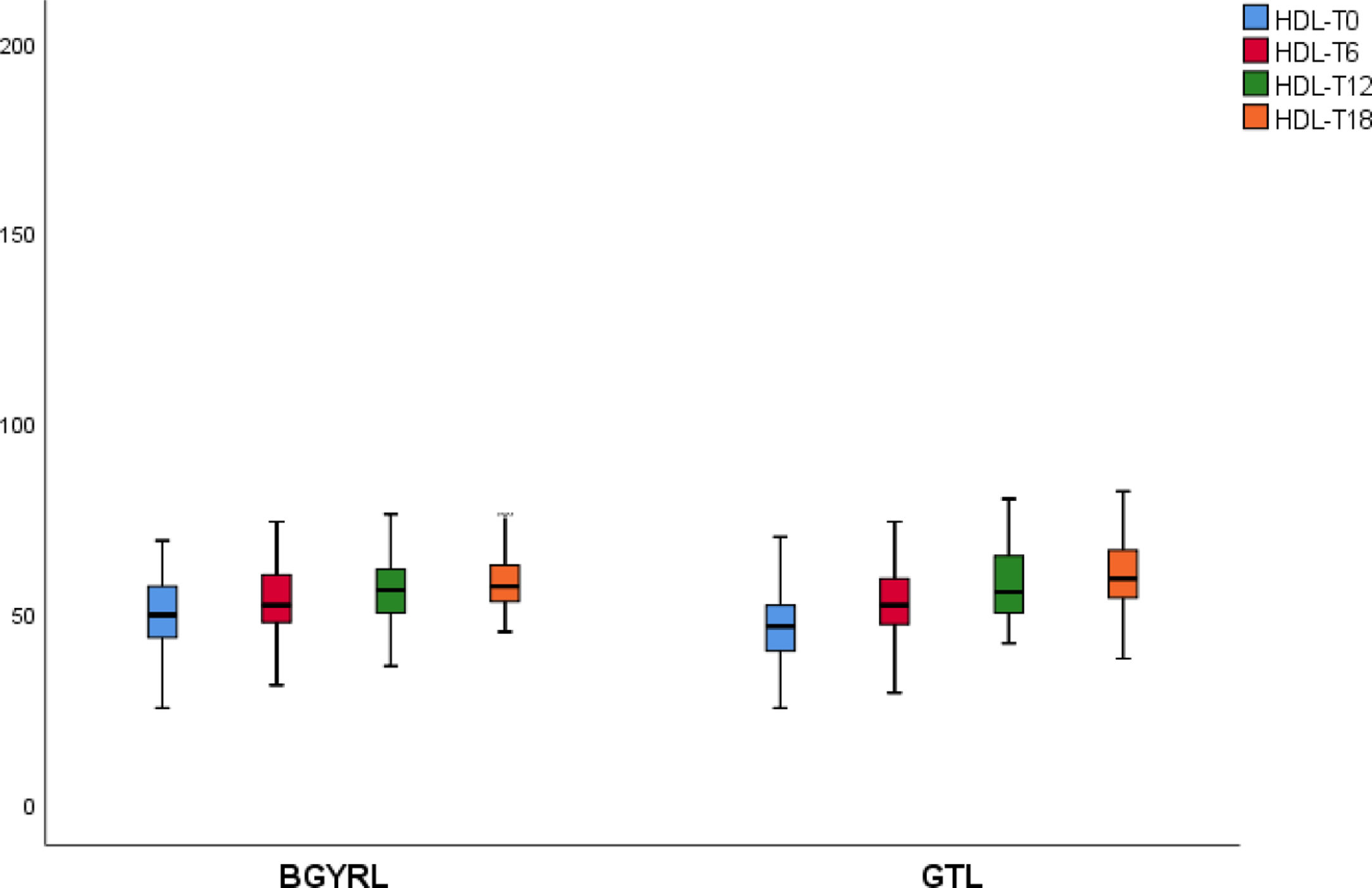
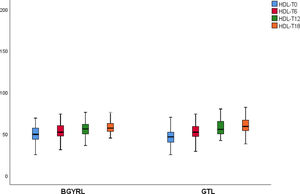
| HDL-GTL | 51,69 ± 10,44 | 54,04 ± 15,51# | 61,50 ± 11,08$ | 58,15 ± 10,91 |
| HDL-BGYRL | 47,04 ± 16,8 | 55,08 ± 18,55# | 58,50 ± 12,08$ | 60,47 ± 9,12 |
| TG-GTL | 161,31 ± 83,57 | 124,59 ± 44,57# | 118,38 ± 42,13 | 101,5 ± 29,20 |
| TG-BGYRL | 173,49 ± 79,61 | 108,60 ± 34,86#,† | 107,12 ± 36,77 | 108,23 ± 33,21 |
Datos expresados mediante media ± desviación estándar o porcentaje.
BGYRL: bypass gástrico laparoscópico en Y de Roux; GTL: gastrectomía tubular laparoscópica.
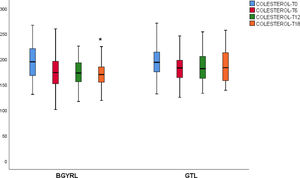
Se observó una disminución de apoB y aumento de apoA-1 a los seis meses, al igual que una reducción de TG y aumento de HDL ambos grupos (BGYRL y TGL) a partir de los seis meses, en cambio solo se detectó disminución de LDL y CT a partir de los 12 y 18 solo en el grupo BGYRL (figs. 1-4).
Finalmente, el análisis de regresión lineal múltiple por pasos mostró que la disminución del HOMA-IR predecía de forma independiente la reducción de LDL a los 18 meses explicando un 72% de esa reducción (R2 = 0,720) (tabla 4).
Modelos de regresión lineal múltiple que predicen la evolución de los LDL T18-T0 (modelo final después de selección paso a paso con un umbral de exclusión en p < 0,05)
| Coeficiente de regresión | Intervalo de confianza | p | |
|---|---|---|---|
| HOMA-IR | 0,69 | 0,12 a 0,40 | < 0,01 |
| Constante | 0,16 | 5 |
El modelo completo se calculó entre el total de sujetos obesos de la cohorte, T18-T0 de IMC, apoB, apoA-I, glucosa en ayunas, HOMA-IR (modelo final ajustado R2 = 0,72).
En el presente estudio hemos mostrado una superioridad del BGYRL en la reducción tanto de LDL como de CT a los 12 y 18 meses de seguimiento.
La CB, reduce la mortalidad cardiovascular11. Esta reducción se ha atribuido en parte a una reducción de los lípidos plasmáticos, a través de mecanismos desconocidos. Este estudio muestra que las mejoras clínicamente importantes en los lípidos plasmáticos después de la cirugía de BGYRL se producen en el último período postoperatorio con una pérdida de peso sustancial. Los posibles mecanismos subyacentes para la mejora/resolución de la dislipidemia después de la cirugía bariátrica puede estar relacionado a la pérdida de peso. Se espera que la pérdida de peso mejore la sensibilidad a la insulina, lo que a su vez puede reducir los niveles de TG y aumentar los niveles de HDL-C, esta curva es similar a la curva de pérdida de peso después de BGYRL y GTL12,13.
Los niveles de colesterol total y LDL-c se reducen en 12 y 18 meses, lo que respalda la afirmación de que estos cambios son una consecuencia directa de la cirugía y no de una pérdida de peso absoluta. El intestino es un actor crucial en el metabolismo del colesterol y participa en la absorción del colesterol (de los alimentos y la bilis) y la excreción de colesterol trans-intestinal. Se sabe desde hace mucho tiempo que el bypass ileal (obtenido por bypass ileal creando malabsorción, sin cerrar el estómago como en la cirugía bariátrica) disminuye los niveles de colesterol y las enfermedades cardiovasculares6. Curiosamente, todos los estudios que comparan los efectos diferenciales de la GTL y la BGYRL sobre las concentraciones plasmáticas de colesterol mostraron una disminución constante del colesterol del 20-30% después de la BGYRL, mantenida a los cinco años14.
Por el contrario, los niveles de colesterol no se modifican después de GTL15. La disminución del 20-30% en el colesterol después de BGYRL es equivalente a la obtenida con una dosis promedio de estatinas. La técnica de malabsorción de BGYRL altera significativamente el flujo de alimentos en el intestino y los cambios metabólicos observados después de esta técnica son en parte independientes de la pérdida de peso. Estos cambios son multifactoriales y complejos y constituyen un gran campo de exploración.
La caracterización de los factores responsables de la disminución constante del 20-30% en el colesterol después del BGYRL podría llevar a identificar nuevos actores involucrados en el metabolismo del colesterol intestinal y nuevos objetivos terapéuticos para reducir el colesterol. Los factores potenciales que pueden estar implicados en la reducción del LDL después del BGYRL son: (i) cambios en el metabolismo del colesterol (disminución de la absorción intestinal, aumento de la excreción intestinal, aumento del catabolismo hepático, disminución de la síntesis hepática) (ii) aumento de la conversión del colesterol intestinal en coprostanol (un forma inactiva de esterol que no se absorbe ni se elimina en las heces) (iii) cambios en el metabolismo de los ácidos biliares (actores críticos en el metabolismo del colesterol intestinal) (iii) cambios en las hormonas intestinales (iv) cambios en el ecosistema microbiano intestinal (microbiota)16,17.
Las estatinas pueden tener un impacto en este mecanismo, al inhibir la síntesis de colesterol en el hígado, lo que lleva a la activación de los receptores de LDL y al aumento de la captación hepática de HDL de la circulación. La disminución del 20-30% del colesterol después de BGYRL es equivalente a la obtenida con una dosis media de estatinas de baja intensidad18. La administración de estatinas de baja intensidad terapéutica se asocia con una reducción media del colesterol total, LDL-c y TG del 20, 28 y 13% con un aumento del HDL-c del 5%18,19. En estudios de cohortes a largo plazo de pacientes tratados con estatinas, por cada 1% de reducción en LDL-C, hay una reducción en el riesgo relativo de eventos cardiovasculares mayores en ∼ 1% en una relación lineal19.
En análisis multivariado encontramos una asociación negativa del 69% del índice HOMA-IR con los niveles de LDL, lo cual puede tener una explicación en el sentido que la insulina regula la expresión del receptor de LDL, de esa forma en un contexto de mayor insulinosensibilidad mejoraría el catabolismo de LDL20.
La reducción de los niveles de TG y el aumento de HDL con ambas técnicas de CB, puede estar relacionada a la disminución de peso y de la IR, en un reciente trabajo de cinética de lipoproteínas ricas en trigliceridos (LRT) de origen hepático e intestinal, la CB conducía a menor producción de apoproteínas (apo) B-100 provenientes del hígado y menor producción de apoB-48 proveniente del intestino21.Probablemente esta reducción de TG y aumento de HDL característicos, se deba no solo a una reducción del contenido plasmático de apoC-III sino también a un redistribución de la apo-CIII a los seis y 12 meses de la cirugía de la fracción LRT a la fracción HDL22.
La síntesis de colesterol aumenta en la obesidad, lo que se asocia con una reducción del c-HDL, la pérdida de peso reduce la síntesis de colesterol17. El aumento de c-HDL después del BGYRL es compatible con el beneficio secundario a la pérdida de peso, quizás a través de la absorción alterada del colesterol y la síntesis reducida.
ConclusiónLa CB ha mostrado reducir la mortalidad cardiovascular y mejorar la dislipemia, aterogénica con ambas técnicas de CB. Únicamente el BGYRL mejora los niveles de LDL, lo cual podría otorgar un beneficio extra al BGYRL a la hora de elegir la técnica quirúrgica para aquellos pacientes que cursen con hipercolesterolemia previa.
FinanciaciónLos autores declaran no presentar financiacion
Conflicto de interesesLos autores no presentan conflictos de interes.