La BCGitis es una complicación infrecuente del tratamiento intravesical con Bacillus Calmette-Guérin para el cáncer superficial de vejiga de alto grado y el carcinoma in situ. Puede causar afectación vascular.
Presentamos 2 casos y una revisión de la literatura de series de casos publicadas en los 10 años previos a la finalización de este trabajo en abril de 2022, que describiesen un caso de aneurisma micótico aortoilíaco tras recibir este tratamiento.
De los 51 casos incluidos (49 revisados y 2 originales), el 100% eran hombres, 82% tenían más de 65 años. La mediana del período de latencia fue de 15 meses (RIQ 18). La localización más frecuente fue la aorta abdominal, documentándose rotura en el 45,1%. El síntoma más frecuente fue dolor abdominal o lumbar (61%), seguido de síndrome general (49%). Asoció absceso retroperitoneal un 39,2%. La mortalidad atribuible fue de 13,6%.
La BCGitis debería incluirse como diagnóstico diferencial de pacientes que hayan recibido terapia con BCG y presenten afectación vascular, incluso años tras el tratamiento.
BCGitis is a rare complication after intravesical administration of Bacillus Calmette-Guérin for high-grade superficial bladder cancer and carcinoma in situ. May cause vascular involvement.
We present two cases and a review of the literature of the case reports published on the 10 years prior to April of 2022, when this project was finished, which described a case of aortoiliac mycotic aneurysm after receiving this treatment.
Of the 51 cases included (49 revised and 2 original), 100% were men, 82% were older than 65 years. The median latency period was 15 months (IQR 18). The most frequent location was the abdominal aorta, rupture occurred in 45.1% of patients. The most frequent symptom was abdominal or lumbar pain (61%), followed by general syndrome (49%). In 39.2% cases, it was associated with retroperitoneal abscesses. Attributable mortality was 13.6%.
BCGitis should be included in the differential diagnosis in patients who have received BCG therapy and present vascular involvement, even years after being treated.
La BCGitis, becegeítis o enfermedad diseminada por Bacillus Calmette-Guérin(BCG) es una entidad poco frecuente, causada por una variante atenuada del Mycobacterium bovis (M. bovis), con una incidencia estimada de entre 1-5%1,2. Resulta como complicación del tratamiento de la neoplasia superficial de vejiga con instilaciones intravesicales de BCG. La afectación más frecuente es la genitourinaria, seguida de la pulmonar, la hepática y, en cuarto lugar, la afectación vascular. Dependiendo del lugar de afectación, la presentación suele ser precoz (< 3 meses tras la administración de BCG) como tiende a ocurrir en la enfermedad hepática y pulmonar, o tardía (> 3 meses), como en la forma muscular y vascular1. A este nivel puede dar lugar a aneurismas micóticos en el eje aortoilíaco, que conforman el grupo con la mortalidad más elevada (hasta un 16%)3. Su presentación tardía y la clínica inespecífica dificulta el diagnóstico.
Presentamos dos casos con afectación vascular y realizamos una revisión sistemática de la literatura al respecto.
MétodoCaso AVarón de 77 años, exfumador, con antecedentes de hipertensión arterial, dislipemia y diabetes. Diagnosticado en otro centro de carcinoma urotelial en 2011, fue tratado con instilaciones de BCG hasta 2014. Al inicio del tratamiento presentó una lesión lítica esternal acompañada de adenopatías perihiliares hipercaptantes en PET (tomografía por emisión de positrones), no se obtuvo un diagnóstico etiológico de las mismas y el paciente recibió tratamiento con antiinflamatorios.
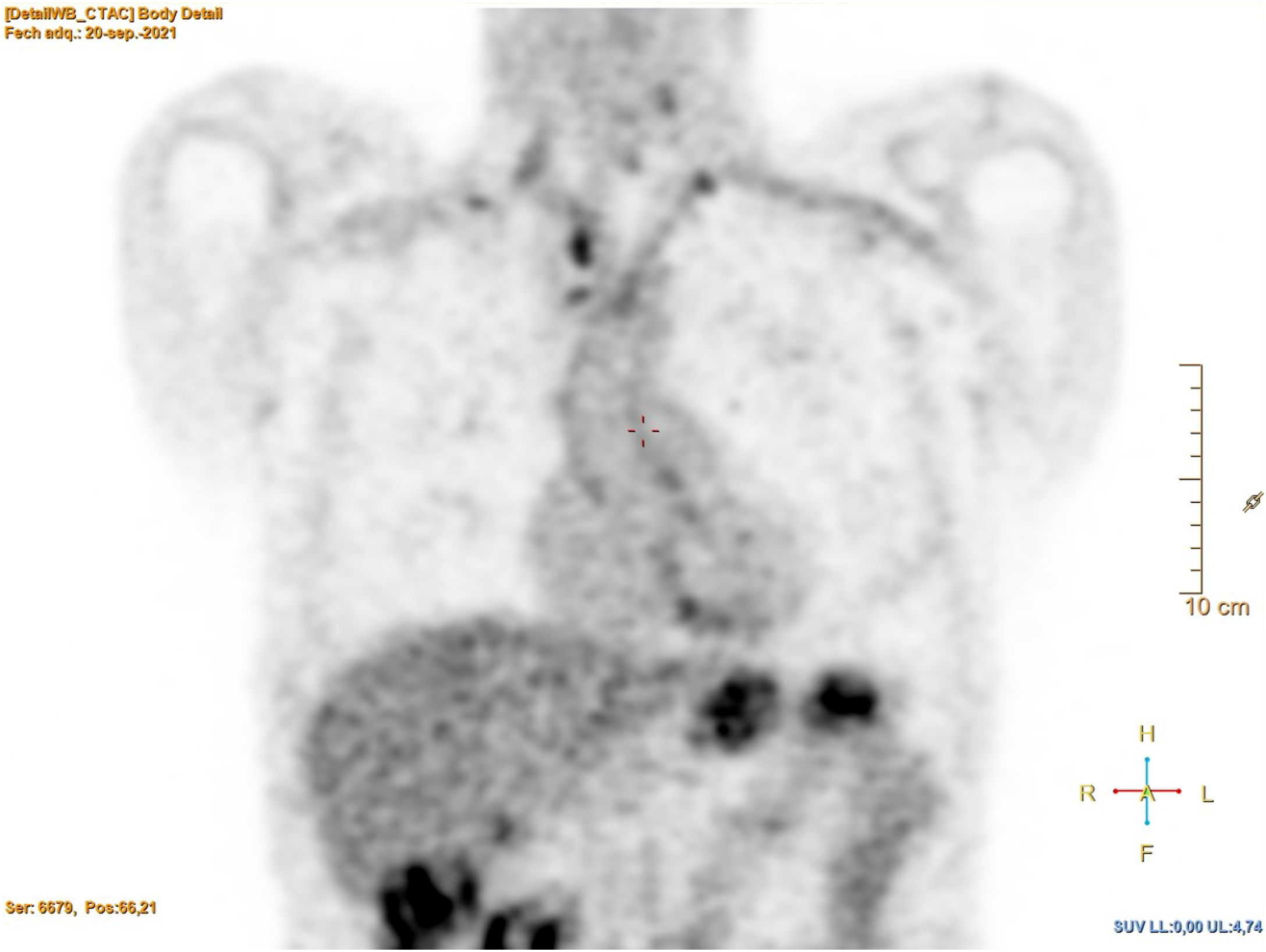
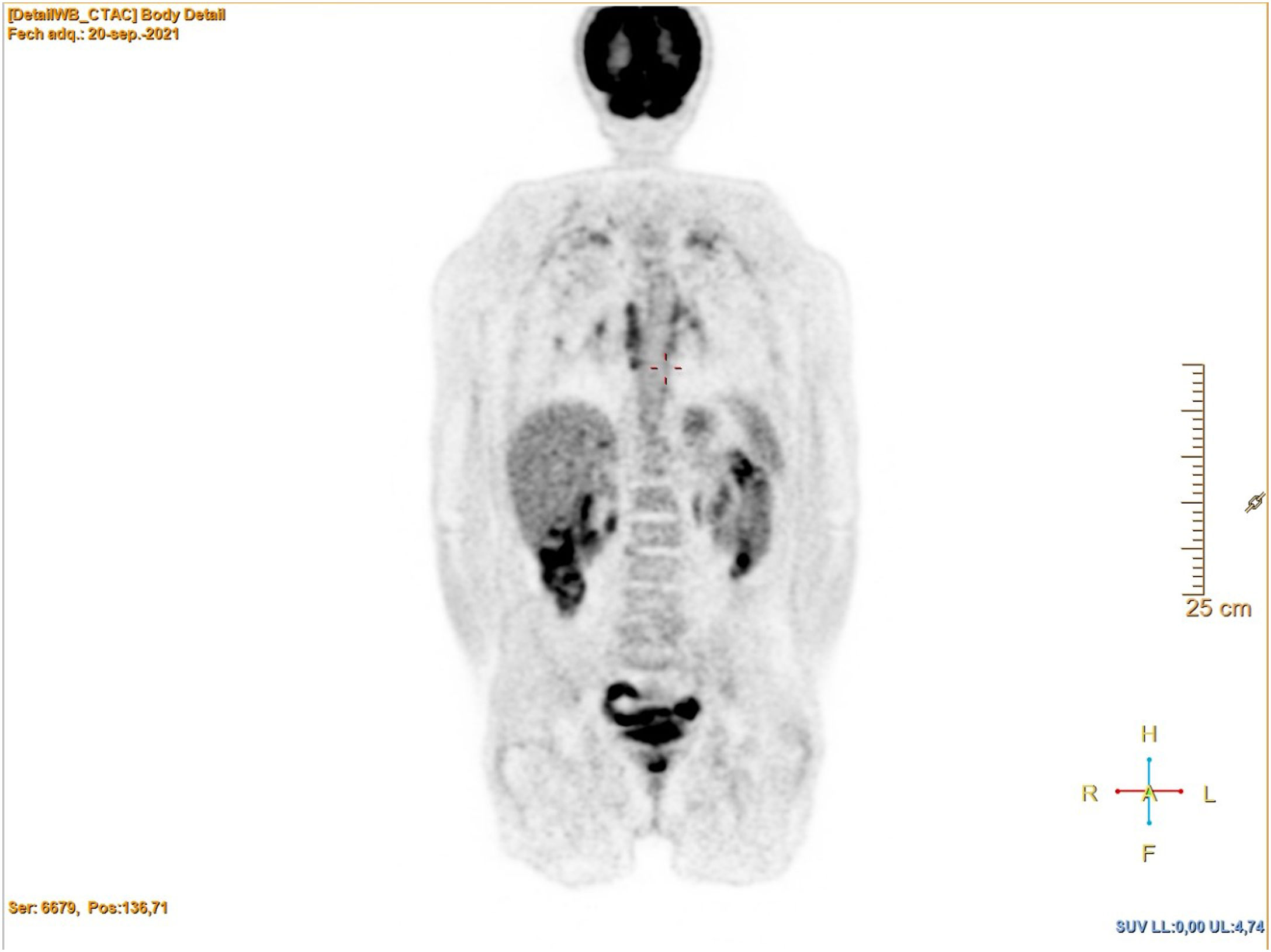
Consulta en 2021 por síndrome general de meses de evolución, con importante pérdida ponderal (20kg en 6 meses), sin otros síntomas. La exploración física fue normal. En la analítica únicamente destacaba anemia (Hb 10,4g/dl) y elevación de la proteína C-reactiva) (PCR 30,1mg/l). Se realizó una tomografía computarizada (TC) que demostró lesiones de aspecto cicatricial en ambos vértices pulmonares, ganglios mediastínicos e hiliares discretamente aumentados, de aspecto inespecífico, y un aneurisma abdominal de 33mm. En el PET se objetivó hipermetabolismo en la pared de los grandes vasos, en las adenopatías hiliomediastínicas y laterocervicales, además de múltiples focos en ambos campos pulmonares (figs. 1 y 2).
Se realizó broncoscopia con biopsia de las adenopatías mediastínicas, en la que se observó celularidad linfocitaria, sin presencia de granulomas ni de células malignas. Se realizó un urocultivo para micobacterias en el que se aisló M. bovis, cepa BCG. Se pautó tratamiento con isoniazida + rifampicina + etambutol los dos primeros meses, seguido de isoniazida + rifampicina los siguientes, con buena evolución. En la revisión en consulta a los 6 meses está asintomático, con aumento ponderal y normalización analítica.
Caso BVarón de 73 años, exfumador, con antecedentes de obesidad, hipertensión arterial, dislipemia, EPOC, ACV antiguo y aneurisma de aorta abdominal de 49mm. Diagnosticado de neoplasia vesical en 2016, fue tratado con 6 instilaciones intravesicales de BCG, que se suspendieron por mala tolerancia (última 20 meses antes de este episodio).
Consulta en 2018 por fiebre de una semana de duración, asociado a hiporexia, astenia, disnea de esfuerzo y dolor lumbar. Tanto la exploración como la analítica no revelaron ningún dato patológico. Se realizó una TC en la que se observaron imágenes sugestivas de aneurisma micótico, pero los hemocultivos y urocultivos no obtuvieron aislamientos.
Un mes después ingresa por presentar oclusión intestinal por bridas, siendo intervenido. En el postoperatorio presenta dolor abdominal, realizándose TC que demuestra rotura contenida del aneurisma, colocándose una prótesis endovascular. La evolución posterior es tórpida, con múltiples complicaciones: isquemia aguda de miembro inferior derecho, neumotórax, fibrilación auricular con respuesta ventricular rápida e insuficiencia cardíaca, y neumonía cavitada bilateral en relación con ventilación invasiva. Dentro del estudio etiológico se recogen cultivos para micobacterias, demostrándose bacilos ácido-alcohol resistentes en orina. Se modifica cobertura antibiótica (amikacina + meropenem + linezolid+ isoniacida + rifampicina), pero el paciente fallece 3 días después, 41 días después de la primera intervención quirúrgica. Tras el fallecimiento se recibe resultado de cultivo de orina, aislándose M. bovis cepa BCG.
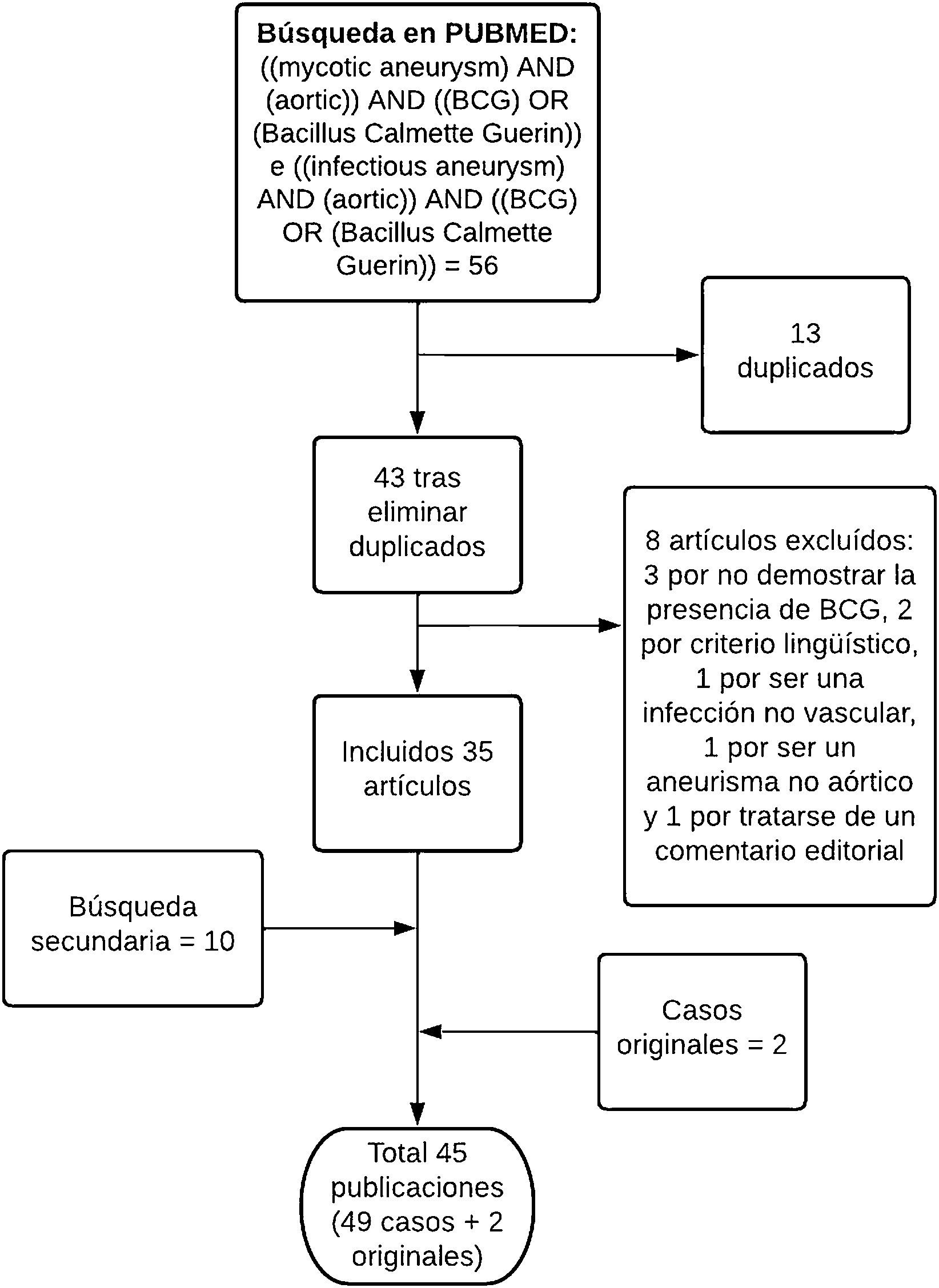
Revisión de la literaturaSe realizó una búsqueda bibliográfica en PubMed de artículos publicados, en inglés y castellano, entre 2012 y abril de 2022. Posteriormente, se realizó una búsqueda secundaria a partir de los artículos encontrados. Los términos de búsqueda y el resumen del proceso de selección se describen en la figura 3.4–48
Los datos obtenidos se incluyeron en una hoja de cálculo para su análisis. Las variables cuantitativas se expresaron como número y porcentaje. Las variables cuantitativas se expresaron como media (desviación estándar) o como mediana (rango intercuartílico).
ResultadosIncluimos nuestros dos casos y 49 procedentes de la literatura obtenidos a partir de series de casos publicados entre 2012 y abril de 2022. La totalidad de los 51casos incluidos eran varones. En cuanto a la distribución geográfica de los casos, 23 (45,1%) se presentaron en la región de Europa Centro-Occidental y 20 (39,2%) en Norteamérica. El 78,4% de los pacientes tenían más de 65 años de edad, con una edad media de 72,4 años (DS 7,6). Además del antecedente de carcinoma urotelial que comparten todos los pacientes, se han recogido los datos sobre otras comorbilidades, apareciendo reflejadas en 30 de los 51 casos. De ellos, 18 (60%) padecía hipertensión, 10 (33,3%) dislipemia, 7 (23,3%) cardiopatía isquémica, 6 (20,7%) EPOC y 5 (16,7%) diabetes. Habían presentado hábito tabáquico (actual o pasado) 15 (50%) de los 30 casos en que esta información estaba recogida. El periodo de latencia entre la última instilación con BCG y el diagnóstico de BCGitis fue recogido en 46 de los 51 casos expuestos, con un intervalo de entre 0 y 270 meses y una mediana de 15 meses (RIQ 18).
En cuanto a la lesión aneurismática, en 12 de los 51 pacientes (23,5%) se había detectado con anterioridad la presencia de una lesión vascular en el eje aortoilíaco. En 11 de ellos (91,7%) la infección vascular ocurrió sobre la lesión preexistente (ya fuese un aneurisma o el injerto usado en su reparación). De los 39 casos sin lesión vascular previa, 28 (71,8%) desarrollaron un aneurisma micótico en la aorta abdominal, 8 (20,5%) en la aorta torácica y 6 (15,4%) en la arteria ilíaca común. Un 7,8% de los pacientes desarrollaron aneurismas en más de una localización dentro de este eje. Se presentó la rotura masiva o contenida de las lesiones aneurismáticas en 23 (45,1%).
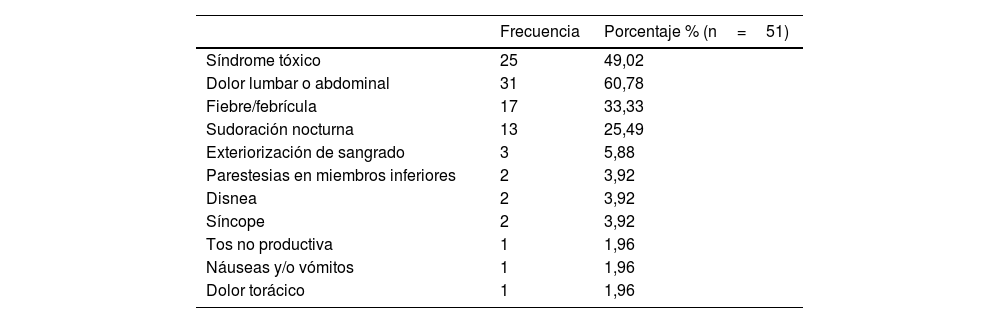
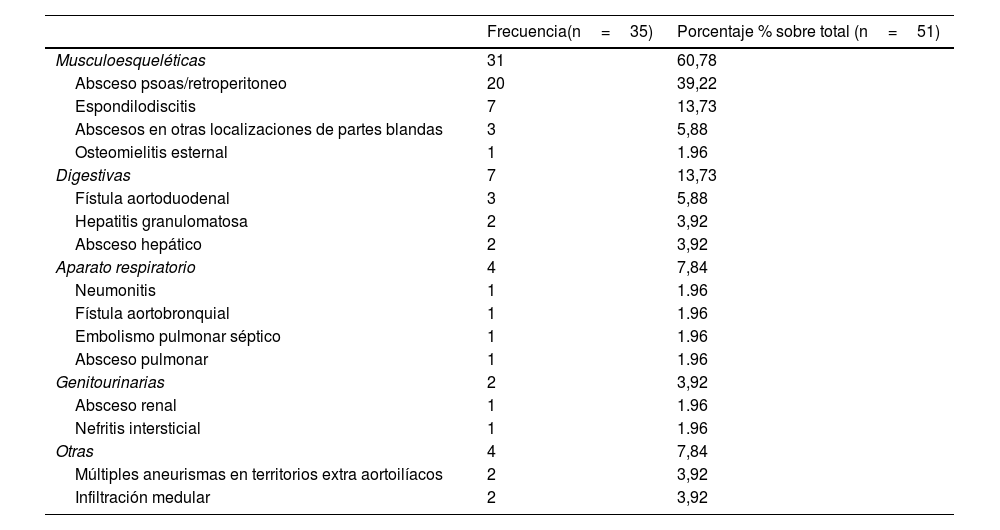
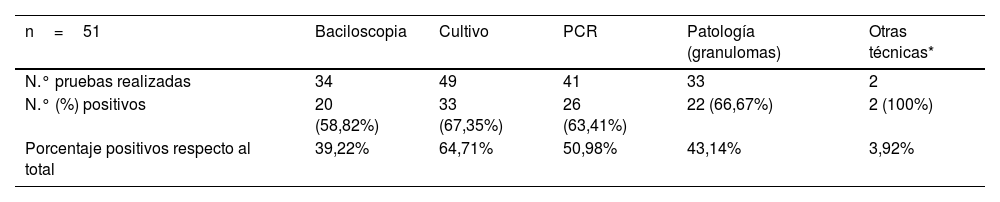
El cuadro clínico que presentaron los pacientes viene recogido en la tabla 1. De los casos expuestos, 16 (33,4%) no presentaron otro foco de infección aparte de la lesión vascular. La distribución de las localizaciones extravasculares en los 35 (68,6%) que sí las presentaron aparece detallada en la tabla 2. La distribución del método diagnóstico empleado se recoge en la tabla 3.
Síntomas presentes al diagnóstico
| Frecuencia | Porcentaje % (n=51) | |
|---|---|---|
| Síndrome tóxico | 25 | 49,02 |
| Dolor lumbar o abdominal | 31 | 60,78 |
| Fiebre/febrícula | 17 | 33,33 |
| Sudoración nocturna | 13 | 25,49 |
| Exteriorización de sangrado | 3 | 5,88 |
| Parestesias en miembros inferiores | 2 | 3,92 |
| Disnea | 2 | 3,92 |
| Síncope | 2 | 3,92 |
| Tos no productiva | 1 | 1,96 |
| Náuseas y/o vómitos | 1 | 1,96 |
| Dolor torácico | 1 | 1,96 |
Localizaciones de infección fuera del eje aortolíaco
| Frecuencia(n=35) | Porcentaje % sobre total (n=51) | |
|---|---|---|
| Musculoesqueléticas | 31 | 60,78 |
| Absceso psoas/retroperitoneo | 20 | 39,22 |
| Espondilodiscitis | 7 | 13,73 |
| Abscesos en otras localizaciones de partes blandas | 3 | 5,88 |
| Osteomielitis esternal | 1 | 1.96 |
| Digestivas | 7 | 13,73 |
| Fístula aortoduodenal | 3 | 5,88 |
| Hepatitis granulomatosa | 2 | 3,92 |
| Absceso hepático | 2 | 3,92 |
| Aparato respiratorio | 4 | 7,84 |
| Neumonitis | 1 | 1.96 |
| Fístula aortobronquial | 1 | 1.96 |
| Embolismo pulmonar séptico | 1 | 1.96 |
| Absceso pulmonar | 1 | 1.96 |
| Genitourinarias | 2 | 3,92 |
| Absceso renal | 1 | 1.96 |
| Nefritis intersticial | 1 | 1.96 |
| Otras | 4 | 7,84 |
| Múltiples aneurismas en territorios extra aortoilíacos | 2 | 3,92 |
| Infiltración medular | 2 | 3,92 |
Distribución de las pruebas diagnósticas realizadas y resultados de las mismas
| n=51 | Baciloscopia | Cultivo | PCR | Patología (granulomas) | Otras técnicas* |
|---|---|---|---|---|---|
| N.° pruebas realizadas | 34 | 49 | 41 | 33 | 2 |
| N.° (%) positivos | 20 (58,82%) | 33 (67,35%) | 26 (63,41%) | 22 (66,67%) | 2 (100%) |
| Porcentaje positivos respecto al total | 39,22% | 64,71% | 50,98% | 43,14% | 3,92% |
Se incluyó el seguimiento de los pacientes en 44 de los 51 artículos revisados. De ellos, 36 (81,8%) evolucionaron favorablemente con el tratamiento prescrito. Fallecieron debido a la BGGitis 6 pacientes (13,6%) mientras que otros 2 casos fallecieron de causas no relacionadas. Los datos recogidos aparecen detallados en el anexo 1, disponible en la versión online de esta publicación.
DiscusiónLa BCGitis en la mayoría de los casos ocurre como complicación del tratamiento intravesical con instilación de BCG para el carcinoma urotelial de vejiga. La afectación vascular tiene una incidencia entre 1-6,7%3,49. En nuestra revisión, los casos se concentraron en Europa Centro-Occidental y Norteamérica, lo cual podría deberse a la mayor incidencia de cáncer vesical en población caucásica50, aunque estudios recientes afirman que tras Europa Centro-Occidental (en concreto España51) y Norteamérica se encuentran África del Norte y Asia Occidental2, pudiendo haberse enmascarado los datos pertenecientes a las dos últimas por falta de publicaciones en estas regiones al respecto. La totalidad de los casos revisados y los dos casos expuestos pertenecientes a nuestro centro eran varones, tal y como está descrito52. Esta tendencia podría ser explicada por varias hipótesis: en primer lugar, el tabaco es el principal factor de riesgo para la neoplasia vesical (hasta un 50% de los casos)53. En nuestra revisión la mitad de los pacientes eran o habían sido fumadores. Aunque la frecuencia de tabaquismo en el sexo femenino se encuentra al alza, los varones han estado tradicionalmente más expuestos al tóxico, lo que podría justificar las diferencias halladas. Sin embargo, varios estudios han determinado que el riesgo de neoplasia vesical asociada al tabaquismo es la misma en ambos sexos53 y que ya se observa una tendencia ascendente en la incidencia de esta patología en el sexo femenino54, por lo que es posible que la prevalencia de BCGitis en mujeres se incremente en los próximos años. Otro factor que puede hacer más frecuente esta patología en los varones es la técnica de instilación del BCG. Se trata de una instilación más traumática en el sexo masculino debido a la morfología de su uretra54, lo que podría facilitar la bacteriemia y favorecer la afectación vascular52.
La edad de nuestros pacientes (73 y 77 años) fue cercana a la media de edad encontrada en la revisión bibliográfica (72,4 años), así como en otras revisiones (media de 71,8 años)1.
En nuestra serie, la mediana en el período de latencia tras la última instilación de BCG fue de 15 meses (RIQ 18), cercano a lo ya descrito, con series con medianas de 13 meses (RIQ 19)52. Debemos tener en cuenta que la afectación vascular presenta una clínica tardía, y que podemos encontrar revisiones de otras formas clínicas de BCGitis con medianas de 169,5 días desde la última instilación1. De los casos expuestos, el caso B presentó un período de latencia concordante con la serie, unos 12 meses; sin embargo, el caso A no fue diagnosticado hasta 84 meses después de su último tratamiento.
La aorta abdominal es la localización más frecuente de aneurismas no infecciosos en el eje aortoilíaco55. En el desarrollo de estas lesiones aneurismáticas entran en juego múltiples factores como el sexo masculino, la edad avanzada, la raza caucásica, el tabaquismo, la hipertensión y la dislipemia56–60 y su diagnóstico es incidental en la mayoría de los casos. En los casos revisados en la presente serie, la localización más frecuente es también el eje aortoilíaco (71,8%), seguida de la aorta torácica (20,5%) y el 91,6% de los pacientes con aneurismas conocidos presentaron la infección sobre la lesión preexistente, por lo que es probable que en alguno de los demás casos existiese también una lesión aneurismática previa no diagnosticada. Una característica fundamental que diferencia a los aneurismas micóticos del resto de aneurismas aórticos es su mayor riesgo de rotura61. Esto es debido a la acción que la inflamación local tiene sobre la activación de enzimas destructoras del colágeno y elastina, incrementando la fragilidad de la pared62. El porcentaje de pacientes en la serie recogida con rotura del aneurisma fue del 45,1%, así como en el caso B, el porcentaje de roturas encontrado en la bibliografía es del 35%63. En otra revisión realizada que incluyó a 74 casos de infecciones vasculares por BCG se describe una tasa de rotura del 42%; aunque debemos tener en cuenta que se incluían localizaciones fuera del eje aortoilíaco64.
Con respecto a la clínica, la más frecuente fue el síndrome tóxico, presente en el 49% de los pacientes revisados y en ambos casos expuestos; también fueron muy frecuentes la fiebre y la sudoración nocturna. Esta sintomatología también presenta una elevada incidencia en el estudio de cohortes revisado1. Este conjunto de síntomas y signos son los esperados en un paciente con una importante enfermedad sistémica, por lo que en muchos casos haría pensar en procesos neoplásicos, inflamatorios o infecciones de mayor prevalencia. Por ello, la ausencia de datos específicos que orienten la etiología del cuadro podría ser una causa para el retraso diagnóstico. La presencia de dolor lumbar o abdominal, también fueron síntomas descritos frecuentemente, característica que comparten con los aneurismas micóticos provocados por otros patógenos61. Una característica específica de las infecciones vasculares por BCG es la elevada frecuencia con la que se presenta asociada a afectación musculoesquelética o de partes blandas (hasta en un 60,8% del total en nuestra revisión). La forma de presentación más frecuente dentro de esta categoría fue el absceso en el músculo psoas (39,2% del total). En otras revisiones se describe afectación musculoesquelética en el 27% y en concreto del músculo psoas en el 22%1, el hecho de que en ellas se incluyeran otras aneurismas en otras localizaciones podría ser una de las razones por las que se obtienen frecuencias menores ya que en este caso, la diseminación local por contigüidad al espacio retroperitoneal parece ser la hipótesis más plausible.
La técnica que obtuvo mayor rentabilidad para demostrar la presencia del bacilo fue el cultivo de diversas muestras (en muchos casos intraoperatorias del material resecado o punciones del contenido de un absceso), aun así la sensibilidad de la misma fue de un 67,3%, frente al 63,41% obtenido al realizar la técnica de PCR. En otras revisiones, se describe que el cultivo es el método diagnóstico más frecuentemente utilizado49. Aunque el diagnóstico histológico está descrito como forma diagnóstica exclusiva en algunos casos64, en la mayoría de ellos se utilizó como apoyo a las pruebas microbiológicas anteriormente mencionadas. En los dos casos expuestos la muestra empleada fue la orina; no obstante, esta no fue especialmente utilizada en los otros pacientes (solo en 2 de los casos de nuestra revisión, y únicamente en 1 de ellos como muestra exclusiva). La falta de investigaciones relacionadas con el tipo de muestra y el método utilizado, impiden que podamos comparar estos hallazgos para conocer si el cultivo de orina (con el gran beneficio de lo inocuo de su recogida) podría ser considerada una buena opción frente a otras muestras más invasivas.
Finalmente, durante el seguimiento de los pacientes, el 81,8% evolucionó favorablemente recibiendo el tratamiento antibiótico empírico para tratar la infección por M. bovis, consistente en isoniazida, rifampicina y etambutol (este bacilo es intrínsecamente resistente a la pirazinamida, por lo que se excluye de la pauta convencional tuberculostática), acompañado, en los casos que precisase, de reparación quirúrgica del defecto vascular. Esta revisión encontró una mortalidad del 13,6%, cercana al resto de la literatura, entre un 10% y un 16%2,3.
En conclusión, los aneurismas micóticos de la BCGitis son una complicación infrecuente del tratamiento con instilaciones intravesicales de BCG para el cáncer superficial de vejiga. Debería ser incluida en el diagnóstico diferencial de pacientes con antecedentes de instilaciones de BCG en el pasado, especialmente aquellos con síndrome general y dolor lumbar o abdominal. La localización más frecuente es la aorta abdominal y puede asociar un absceso de psoas. Tiene un importante riesgo de rotura, pero con el tratamiento adecuado el pronóstico suele ser favorable.
Responsabilidades éticasEste proyecto ha sido elaborado sin financiación externa.
Los casos recogidos están incluidos en un registro específico autorizado por el Comité de Ética de la Investigación Santiago-Lugo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.