La bronquiolitis es una infección respiratoria grave en lactantes causada principalmente por el virus respiratorio sincitial (VRS). El objetivo de este estudio es evaluar si la codetección de VRS y otros virus respiratorios puede desencadenar un cuadro de mayor o menor gravedad que la presencia de VRS exclusivamente.
MétodosSe realizó un estudio prospectivo en menores de 2 años que acudieron a urgencias del Hospital Universitario Arnau de Vilanova de Lleida con diagnóstico de bronquiolitis aguda desde 2016 a 2019. A todos ellos se les realizó PCR de VRS y gripe en muestra nasofaríngea (GeneXpert®) y a los pacientes con detección de VRS se les realizó PCR múltiple de virus respiratorios. Se recogieron datos clínicos de los pacientes (tiempo de hospitalización, índice de BROSJOD, ingreso en UCI, necesidad de soporte respiratorio, traslado a un centro de tercer nivel) y se realizaron análisis bivariantes para comparar el grupo de bronquiolitis con detección exclusiva de VRS con el de codetección con otros virus respiratorios.
ResultadosDurante el período de estudio se diagnosticaron 437 bronquiolitis por VRS. En 199 de ellas (199/437; 45,5%) se detectó concomitantemente otro virus respiratorio. El análisis bivariante de los datos no mostró diferencias estadísticamente significativas en ninguna de las variables estudiadas.
ConclusionesLa codetección viral en lactantes con bronquiolitis por VRS se da con elevada frecuencia, aunque no parece afectar a la gravedad del cuadro clínico.
Respiratory syncytial virus (RSV) is the main cause of severe bronchiolitis, especially in infants. The aim of this study is to assess whether codetection of RSV and other respiratory viruses could affect the severity of this infection comparing with unique RSV detection.
MethodsA prospective study from 2016 to 2019 including children under 2 years who were admitted in the Emergency Service of the Hospital Universitari Arnau de Vilanova de Lleida (Spain) was performed. Nasopharyngeal samples from all patients were sent to the laboratory for RSV real-time PCR detection (GeneXpert®). A multiplex PCR that detects other respiratory viruses was done in all RSV-positive samples. Patients’ medical records were checked to collect clinical data (hospital length of stay, BROSJOD score, ICU admission, need for ventilatory support or transfer to a reference hospital). Patients were divided in 2 groups: infants with unique RSV detection and infants with viral codetection. Bivariant analyses were performed to analyze the data obtained.
ResultsDuring the period of study 437 RSV bronchiolitis were diagnosed. In 199 of them (177/437; 45.5%) another respiratory virus was detected concomitantly. Bivariant analyses do not show statistically significant differences between both groups.
ConclusionsViral codetection in infants with RSV bronchiolitis is frequent. However, it does not seems to affect the severity of this infection.
La bronquiolitis aguda es una infección viral propia de los lactantes que afecta a las vías respiratorias inferiores y que cursa con obstrucción e inflamación de los bronquiolos terminales1. Los signos y síntomas suelen empezar con rinitis y tos, que pueden evolucionar hasta taquipnea, sibilancias, estertores, uso de musculatura accesoria y/o aleteo nasal2,3. La mayoría de los lactantes presentan una enfermedad leve, pero en el 2,5% de los casos puede ser necesario el ingreso hospitalario, sobre todo a causa de la obstrucción de la vía aérea y del distrés respiratorio4, produciéndose unos 7.000-14.000 ingresos hospitalarios-año en España5. El principal virus implicado es el virus respiratorio sincitial (VRS), aunque otros virus respiratorios también pueden producir este cuadro2,4,6.
Las codetecciones virales en este tipo de infecciones son frecuentes, y su implicación en la gravedad del cuadro clínico es un hecho poco estudiado, más aún en las bronquiolitis por VRS. Se han propuesto varias hipótesis para explicar la asociación entre múltiples virus respiratorios y la gravedad de las infecciones respiratorias agudas, como la modificación de las respuestas inmunitarias después de la infección inicial, la susceptibilidad del huésped a múltiples agentes virales y las asociaciones de virus respiratorios específicos con bacterias colonizadoras del tracto respiratorio7. Además, cabe destacar que detectar un agente viral no implica necesariamente la participación en el proceso infeccioso actual8.
El objetivo del presente trabajo es evaluar si los casos con codetección viral en las bronquiolitis por VRS que acuden al servicio de urgencias presentan un mejor o peor pronóstico clínico que aquellos con detección exclusiva de VRS.
MétodosPacientes incluidos en el estudioEstudio prospectivo en el que se incluyeron todos los lactantes menores de 2 años que acudieron al servicio de urgencias del Hospital Universitario Arnau de Vilanova de Lleida con diagnóstico de bronquiolitis desde el 1 de noviembre de 2016 al 30 de abril de 2019, y con detección de VRS positiva en muestra nasofaríngea.
Se consideró como bronquiolitis aguda el primer episodio de dificultad respiratoria en un niño de menos de 24 meses de edad con sibilancias y/o crepitantes asociado con síntomas del tracto respiratorio superior durante el período epidémico9.
Detección de los virus respiratoriosSe tomó una muestra nasofaríngea a cada paciente con un escobillón en un medio estándar de transporte de virus (Universal Virus Transport®, Becton Dickinson, Franklin Lakes, EE. UU.) de 1 o 3ml. Las muestras fueron remitidas al Laboratorio de Microbiología para la realización de técnicas moleculares. La detección de virus de influenza A (Flu A), influenza B (Flu B) y VRS se realizó de forma urgente con una PCR múltiple en tiempo real (GeneXpert®, Xpert®Flu/RSV XC, Cepheid Inc., Sunnyvale, EE. UU.).
En todos los pacientes en los que se detectó VRS se amplió el estudio molecular de virus respiratorios. Para ello, se realizó una extracción con una elución de 60μL partiendo de 200μL de muestra (Virus Mini Kit v2.0, equipo EZ1® [Qiagen GmbH, Alemania] o DSP Virus/Pathogen Minikit, sistema QIAsymphony® [Qiagen GmbH, Alemania], según instrucciones del fabricante.
Desde 2016 hasta el primer semestre de 2018 la detección del resto de los virus respiratorios se realizó con Allplex® Respiratory Panel (Seegene, Seúl, Corea del Sur) en el termociclador CFX96® (Bio-Rad Laboratories, Hercules, EE. UU.). Esta técnica detecta adenovirus (Adv), enterovirus (EV), virus parainfluenza (PiV) 1, 2, 3 y 4, metaneumovirus (MPV), bocavirus (BoV), rhinovirus (HRV) y coronavirus (CoV) NL63, 229E y OC43. A partir del segundo semestre de 2018 y durante 2019 se realizó con el kit Light Mix® (TIB Molbiol, Berlín, Alemania) en el termociclador LightCycler® 480 II (Roche Diagnostics, Penzberg, Alemania), que incluye, además de los previamente citados, parechovirus (PeV) y CoV de forma genérica, diferenciando los subtipos HKU1 y MERS.
Recogida de datosSe revisaron las historias clínicas de los pacientes diagnosticados de bronquiolitis aguda por VRS y se recogieron los siguientes datos clínicos y microbiológicos: resultados de la detección del resto de los virus respiratorios, edad, índice Bronchiolitis Score of Sant Joan de Déu (BROSJOD)10, duración de la hospitalización (tiempo de estancia del paciente en el centro hospitalario, incluyendo la sala de urgencias, observación y planta), necesidad de oxigenoterapia, días de tratamiento con oxígeno, máxima concentración de fracción inspiratoria de oxígeno (FiO2) requerida, necesidad de soporte respiratorio o ventilación mecánica, admisión a unidad de cuidados intensivos (UCI) pediátricos, necesidad de alimentación por sonda nasogástrica (SNG), necesidad de traslado a un centro de tercer nivel y administración de palivizumab previa al ingreso. Este estudio fue aprobado por el comité ético del Hospital Universitari Arnau de Vilanova.
Análisis estadísticoEl análisis descriptivo incluyó la mediana y el intervalo intercuartílico para las variables cuantitativas, y las frecuencias absolutas y relativas para las cualitativas.
Se realizaron análisis bivariantes para comparar los 2 grupos de pacientes en función de la detección viral en las muestras nasofaríngeas (VRS únicamente o codetección viral) y 2 grupos de edad de los lactantes (menores y mayores de 3 meses). Para ello se utilizó la prueba de chi-cuadrado para variables categóricas y la U de Mann-Whitney para variables cuantitativas. Se estimó un modelo de regresión logística para estimar la asociación de la presencia de infecciones mixtas en relación con la edad, permitiendo relaciones no lineales. Para el análisis estadístico se utilizó el software R214, aplicando un nivel de significación de 0,05.
ResultadosDetección de virus respiratorios en lactantes con bronquiolitis por VRSDurante el período de estudio se diagnosticaron 437 episodios de bronquiolitis por VRS en 435 lactantes. En 199 de las 437 muestras (45,5%) se detectó otro agente viral además del VRS.
Los principales virus codetectados fueron HRV (83/199; 19%), BoV (75/199; 17,2%), Adv (41/199; 38%), CoV (23/199; 5,26%), PiV (10/199; 2,29%), EV (6/199; 1,37%), Flu A (5/199; 1,14%) (4 del subtipo H3 y uno del subtipo H1), Flu B (3/199; 0,69%) y MPV (4/199; 0,92%). La detección de PeV se realizó únicamente en el último año y se detectó en un solo episodio (1/199; 0,23%). Se detectaron 2 virus aparte del VRS en 47 episodios (10,75%) y 3 virus en 5 episodios (1,14%). El virus más frecuentemente detectado en estas detecciones múltiples fue el Adv (20/41), seguido del CoV (11/23) y del BoV (35/75).
Datos clínicos y epidemiológicosEl 52,9% de las bronquiolitis por VRS (231/437) se dieron en pacientes menores de 3 meses de edad. La duración media de la estancia en el hospital (tanto en la sala de urgencias como observación o planta) fue de 5 días y requirieron suplementación con oxígeno el 62,9% (275/437), con una duración media del aporte de un día. La FiO2 máxima requerida fue de 27% de media.
Requirieron SNG el 20,9% de los episodios (91/437), soporte respiratorio el 21,6% (94/437), ingreso en UCI neonatal el 29,5% (129/437) y traslado a un centro de tercer nivel el 5% (22/437).
En cuanto a la gravedad de las bronquiolitis, 72 episodios (16,5%) presentaron un BROSJOD leve, 320 (73,2%) moderado y 45 (10,3%) grave. No hubo ningún caso de exitus ni historial de haber recibido profilaxis con palivizumab.
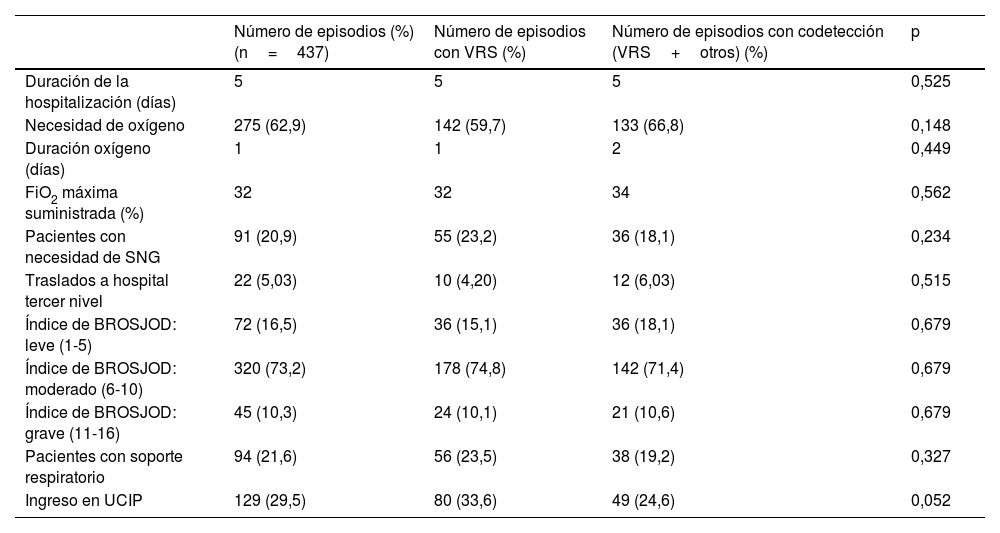
La tabla 1 muestra las características de los episodios de bronquiolitis con detección única de VRS y de los de codetección con otros virus respiratorios. No se encontraron diferencias estadísticamente significativas en ninguna de las variables estudiadas entre estos 2 grupos (p>0,05).
Características de los episodios de bronquiolitis por VRS
| Número de episodios (%) (n=437) | Número de episodios con VRS (%) | Número de episodios con codetección (VRS+otros) (%) | p | |
|---|---|---|---|---|
| Duración de la hospitalización (días) | 5 | 5 | 5 | 0,525 |
| Necesidad de oxígeno | 275 (62,9) | 142 (59,7) | 133 (66,8) | 0,148 |
| Duración oxígeno (días) | 1 | 1 | 2 | 0,449 |
| FiO2 máxima suministrada (%) | 32 | 32 | 34 | 0,562 |
| Pacientes con necesidad de SNG | 91 (20,9) | 55 (23,2) | 36 (18,1) | 0,234 |
| Traslados a hospital tercer nivel | 22 (5,03) | 10 (4,20) | 12 (6,03) | 0,515 |
| Índice de BROSJOD: leve (1-5) | 72 (16,5) | 36 (15,1) | 36 (18,1) | 0,679 |
| Índice de BROSJOD: moderado (6-10) | 320 (73,2) | 178 (74,8) | 142 (71,4) | 0,679 |
| Índice de BROSJOD: grave (11-16) | 45 (10,3) | 24 (10,1) | 21 (10,6) | 0,679 |
| Pacientes con soporte respiratorio | 94 (21,6) | 56 (23,5) | 38 (19,2) | 0,327 |
| Ingreso en UCIP | 129 (29,5) | 80 (33,6) | 49 (24,6) | 0,052 |
FiO2: fracción inspiratoria de oxígeno; SNG: sonda nasogástrica; UCIP: unidad de cuidados intensivos pediátricos; VRS: virus respiratorio sincitial.
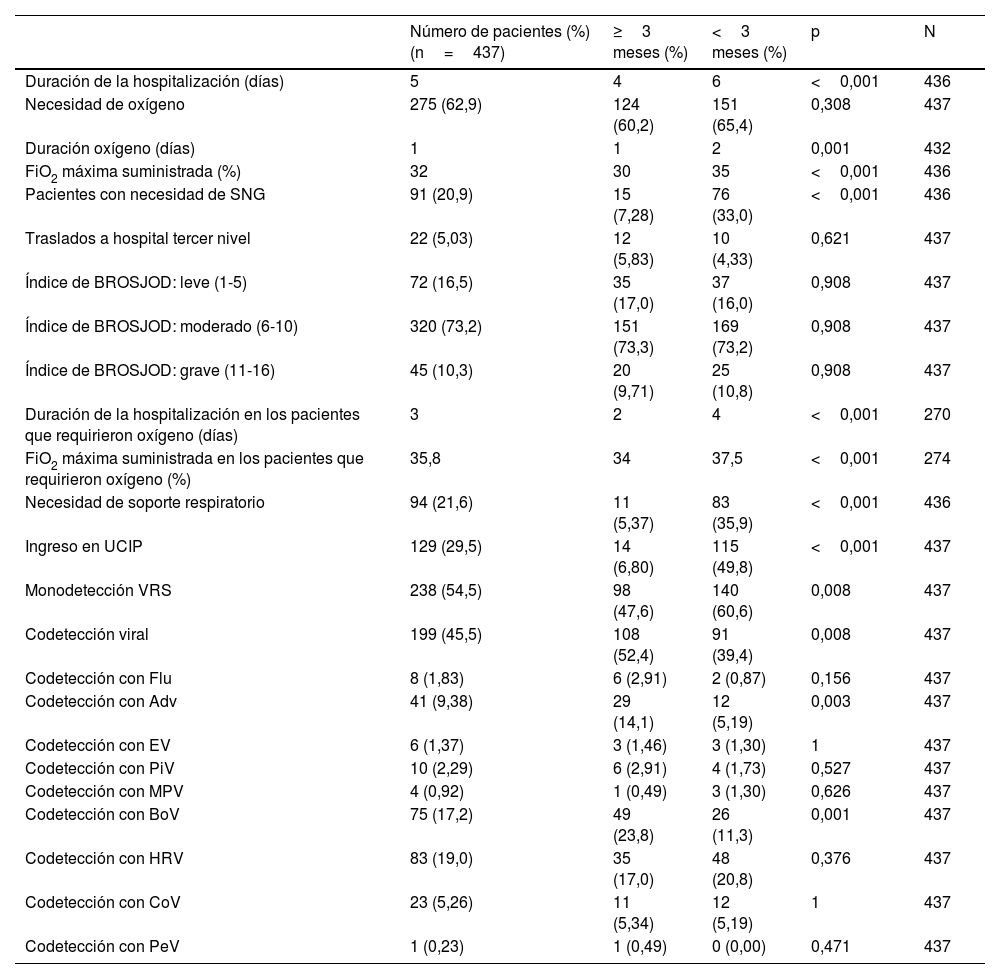
Al comparar las características de los lactantes menores y mayores de 3 meses, se encontraron diferencias estadísticamente significativas (tabla 2). Los lactantes con edad inferior a 3 meses tuvieron una estancia más prolongada en el hospital (6 vs. 4 días, p<0,001), más duración en la administración de oxígeno (2 vs. un día, p=0,001), un mayor requerimiento de FiO2 máxima (35 vs. 30%, p<0,001), mayor necesidad de SNG (33,0 vs. 7,3%, p≤0,001), mayor necesidad de soporte respiratorio (35,9 vs. 5,4%, p<0,001) y mayor ingreso en UCI pediátrica (49,8 vs. 6,8%, p<0,001).
Características de los pacientes con bronquiolitis por VRS menores de 3 meses comparados con los pacientes con 3 o más meses de edad
| Número de pacientes (%) (n=437) | ≥3 meses (%) | <3 meses (%) | p | N | |
|---|---|---|---|---|---|
| Duración de la hospitalización (días) | 5 | 4 | 6 | <0,001 | 436 |
| Necesidad de oxígeno | 275 (62,9) | 124 (60,2) | 151 (65,4) | 0,308 | 437 |
| Duración oxígeno (días) | 1 | 1 | 2 | 0,001 | 432 |
| FiO2 máxima suministrada (%) | 32 | 30 | 35 | <0,001 | 436 |
| Pacientes con necesidad de SNG | 91 (20,9) | 15 (7,28) | 76 (33,0) | <0,001 | 436 |
| Traslados a hospital tercer nivel | 22 (5,03) | 12 (5,83) | 10 (4,33) | 0,621 | 437 |
| Índice de BROSJOD: leve (1-5) | 72 (16,5) | 35 (17,0) | 37 (16,0) | 0,908 | 437 |
| Índice de BROSJOD: moderado (6-10) | 320 (73,2) | 151 (73,3) | 169 (73,2) | 0,908 | 437 |
| Índice de BROSJOD: grave (11-16) | 45 (10,3) | 20 (9,71) | 25 (10,8) | 0,908 | 437 |
| Duración de la hospitalización en los pacientes que requirieron oxígeno (días) | 3 | 2 | 4 | <0,001 | 270 |
| FiO2 máxima suministrada en los pacientes que requirieron oxígeno (%) | 35,8 | 34 | 37,5 | <0,001 | 274 |
| Necesidad de soporte respiratorio | 94 (21,6) | 11 (5,37) | 83 (35,9) | <0,001 | 436 |
| Ingreso en UCIP | 129 (29,5) | 14 (6,80) | 115 (49,8) | <0,001 | 437 |
| Monodetección VRS | 238 (54,5) | 98 (47,6) | 140 (60,6) | 0,008 | 437 |
| Codetección viral | 199 (45,5) | 108 (52,4) | 91 (39,4) | 0,008 | 437 |
| Codetección con Flu | 8 (1,83) | 6 (2,91) | 2 (0,87) | 0,156 | 437 |
| Codetección con Adv | 41 (9,38) | 29 (14,1) | 12 (5,19) | 0,003 | 437 |
| Codetección con EV | 6 (1,37) | 3 (1,46) | 3 (1,30) | 1 | 437 |
| Codetección con PiV | 10 (2,29) | 6 (2,91) | 4 (1,73) | 0,527 | 437 |
| Codetección con MPV | 4 (0,92) | 1 (0,49) | 3 (1,30) | 0,626 | 437 |
| Codetección con BoV | 75 (17,2) | 49 (23,8) | 26 (11,3) | 0,001 | 437 |
| Codetección con HRV | 83 (19,0) | 35 (17,0) | 48 (20,8) | 0,376 | 437 |
| Codetección con CoV | 23 (5,26) | 11 (5,34) | 12 (5,19) | 1 | 437 |
| Codetección con PeV | 1 (0,23) | 1 (0,49) | 0 (0,00) | 0,471 | 437 |
Adv: adenovirus; BoV: bocavirus; CoV: coronavirus; EV: enterovirus; FiO2: fracción inspiratoria de oxígeno; Flu: virus de la gripe; HRV: rinovirus; MPV: metaneumovirus; PeV: parechovirus; PiV: virus parainfluenza; SNG: sonda nasogástrica; UCIP: unidad de cuidados intensivos pediátricos; VRS: virus respiratorio sincitial.
En cuanto a la detección de otros virus, los lactantes menores de 3 meses globalmente presentaron menos codetecciones (39,4 vs. 52,4%, p=0,008). En función del agente viral, presentaron menos codetecciones por Adv (5,19 vs. 14,1%, p=0,003) y por BoV (11,3 vs. 23,8%, p=0,001) que el grupo de lactantes mayores. En este grupo se detectó la presencia de más de 2 virus en el 18,68% de los episodios (17/91) en comparación con el grupo de mayores de 3 meses, donde fue del 27,78% (30/108).
DiscusiónLa prevalencia de codetección viral en lactantes con bronquiolitis por VRS en este trabajo ha sido cercana al 50%. Este dato es mucho mayor que los descritos en otros estudios similares, que reportan valores entre el 11,33 y el 24,4%11–14, llegando hasta el 29,8% en bronquiolitis graves por VRS15. Un estudio realizado en nuestro país detectó un 35,8% de codetección viral en lactantes menores de 18 meses con bronquiolitis por VRS16, valor más cercano, aunque menor, al detectado en nuestro trabajo. Las grandes diferencias entre los resultados de estos trabajos podrían explicarse por la utilización de diferentes técnicas de PCR, diferentes poblaciones estudiadas y distintas zonas geográficas.
Los resultados obtenidos en nuestro estudio no muestran diferencias significativas entre el grupo de pacientes con bronquiolitis con monodetección de VRS y los pacientes con codetección de VRS y otro virus respiratorio en cuanto a los factores de gravedad evaluados, en concordancia con los obtenidos en trabajos similares11,17–19. Un estudio realizado por Nascimiento et al. en lactantes menores de 2 años que acudieron a urgencias con bronquiolitis concluyó que la presencia única de VRS se asociaba con un mayor riesgo de ingreso hospitalario, pero las codetecciones no se asociaban con una mayor gravedad clínica o ingreso en UCI20.
En esta línea, una revisión sistemática y metaanálisis realizada en 2016 sobre codetecciones virales en niños menores de 5 años hospitalizados con infección vírica respiratoria21 no mostró diferencias en la admisión en UCI, el uso de oxígeno, la ventilación mecánica ni las anormalidades radiológicas entre el grupo de niños con monodetección y el de codetección. En ese mismo año, otro metaanálisis concluyó que la coinfección viral no aumentaba el riesgo de ninguno de los factores evaluados en pacientes menores de 18 años con infección respiratoria aguda22. Una revisión sistemática publicada en 2013 tampoco relacionó un aumento de la gravedad en los casos de codetección viral en niños menores de 6 años23.
No obstante, Midulla et al. reportaron que los lactantes con codetección VRS y BoV tenían mayor gravedad y más días de estancia hospitalaria que los que presentaban monodetección por VRS, HRV o BoV24. Resch et al. analizaron 745 infecciones graves por VRS (bronquiolitis en el 70%) sobre una población mayoritaria de lactantes, concluyendo que los pacientes con codetección viral habían necesitado tasas más elevadas de oxígeno suplementario y soporte respiratorio25. Otros autores analizan bronquiolitis por cualquier agente viral, concluyendo que los pacientes con codetección viral presentaban 2,7 veces más riesgo de ingreso en UCI que aquellos con detección exclusiva de un único agente viral13.
Por otro lado, hay estudios que relacionan una mayor gravedad en las bronquiolitis por VRS exclusivamente comparadas con las bronquiolitis en las que además se detectan otros virus respiratorios. Marguet et al. observaron una mayor duración de la estancia hospitalaria en aquellos con monodetección de VRS frente a los que presentaban codetección VRS/HRV12. Otro trabajo, realizado en Italia, concluyó que la monodetección de VRS comportaba más tiempo de hospitalización y más hipoxia que la codetección MPV/VRS en lactantes hospitalizados por enfermedad respiratoria aguda26.
En cuanto al tiempo medio de hospitalización, no se encontraron diferencias estadísticamente significativas entre los lactantes en los que se detectó únicamente VRS y los que presentaron codetección viral en nuestro estudio. En cambio, se observa una menor duración de la estancia hospitalaria de los lactantes ingresados por bronquiolitis por VRS que en otros estudios publicados en España (5 vs. 5,9 días)27, y muy por debajo de otro estudio realizado en Austria en infecciones graves por VRS (6,7 días de media)25. Sin embargo, otros trabajos reflejan tiempos medios de hospitalización mucho menores (2-3 días en un estudio multicéntrico realizado en EE. UU.15). El tiempo medio de hospitalización es un parámetro subjetivo que depende del facultativo y el servicio en el que esté ingresado el paciente, así como del centro hospitalario y del criterio para considerar a un paciente como hospitalizado. En nuestro trabajo se ha considerado como estancia hospitalaria todo el tiempo que el paciente ha permanecido en el centro hospitalario, independientemente de si ha permanecido en urgencias, observación o planta. Por tanto, no es un parámetro consistente para comparar nuestros datos con otros centros o estudios realizados.
Entre las fortalezas de nuestro trabajo señalamos el diseño prospectivo, la duración del mismo y la considerable cantidad de pacientes incluidos, todos ellos lactantes con bronquiolitis por VRS.
Las principales limitaciones derivan de las propias técnicas de detección de virus respiratorios (PCR en tiempo real). El hecho de detectar más de un agente viral no implica necesariamente la participación de los patógenos en el proceso infeccioso, ya que la presencia de material genético puede detectarse hasta 5 o 6 semanas después en algunos casos8. Por otro lado, puede haber una baja recuperación de agentes virales y subestimar las muestras positivas por factores como la toma de muestra retardada, ya que la carga viral disminuye con el tiempo28,29. Cabe resaltar que existe una gran variabilidad metodológica (distintos grupos de edad, diferente localización geográfica, diferentes técnicas de PCR utilizadas, etc.) en los estudios publicados sobre la relevancia clínica de la codetección viral en pacientes con infección respiratoria, lo que dificulta la comparación de los resultados obtenidos.
Como conclusión, no parece haber mayor gravedad entre aquellos lactantes con bronquiolitis por VRS y aquellos con VRS más otro agente viral. No obstante, consideramos necesario realizar más estudios multicéntricos prospectivos con una metodología común para poder definir mejor la relevancia clínica de la codetección viral en este tipo de pacientes.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.