Las infecciones virales del sistema nervioso suponen un problema importante de salud. Se estima que la incidencia de meningitis viral en la población general oscila entre 5-17 casos por cada 100.000 habitantes y año en los países desarrollados. Se engloban bajo este epígrafe, cuadros clínicos muy variados que abarcan desde la meningitis hasta la encefalitis. Se efectúa una exposición de los agentes implicados en nuestro medio y se comenta su expresividad, cuyo curso en pacientes inmunocompetentes suele ser benigno. Las técnicas de amplificación de ácidos nucleicos son el método de referencia para su diagnóstico etiológico. La introducción de la reacción en cadena de la polimerasa y diagnóstico serológico de los principales arbovirus han aumentado las capacidades diagnósticas ante el ampliado espectro de estas entidades clínicas.
Viral infections of the nervous system represent a major health problem. It is estimated that the incidence of viral meningitis in the general population ranges from 5-17 cases per 100,000 inhabitants per year in developed countries. This heading encompasses highly varied clinical pictures, ranging from meningitis to encephalitis. This article presents the agents involved in our environment and discusses their expressiveness. In immunocompetent patients, the course of these infections is usually benign. Nucleic acid amplification techniques are the gold standard for their etiological diagnosis. The introduction of polymerase chain reaction and serological diagnosis of the main arboviruses has increased the diagnostic capabilities in a wide spectrum of these clinical entities.
De cara a establecer una aportación en el ámbito del diagnóstico “sindrómico” de las meningitis y encefalitis virales se aborda consecutivamente su etiología, epidemiología, manifestaciones clínicas y las posibilidades de diagnóstico virológico.
1Etiología y epidemiologíaLas infecciones virales del sistema nervioso (SN) suponen un problema importante de salud por su elevada incidencia y gravedad. Aun considerando que en la mayoría de los casos tienen un carácter benigno y limitado en el tiempo, por su condición de enfermedades transmisibles, capacidad de provocar brotes epidémicos y el posible desenlace fatal o secuelas que originan pueden alcanzar una gran repercusión social.
Resulta muy difícil hacer una estimación global de su verdadero protagonismo en el contexto de la patología infecciosa que se asiste. Se engloban bajo este epígrafe cuadros clínicos muy variados que abarcan desde la afectación pura de las meninges o meningitis hasta la afectación del parénquima cerebral o encefalitis, con o sin afectación meníngea o meningoencefalitis. Si lo que se afecta es la médula espinal se hace referencia a mielitis, y si la afectación es de las raíces de los nervios periféricos o los pares craneales, el término empleado para aludir a ella es el de radiculitis. En ocasiones hay afectación múltiple y es posible emplear el término de meningoencefalorradiculitis, con o sin mielitis asociada.
Se estima que la incidencia de meningitis viral en la población general es de entre 5-17 casos por cada 100.000 habitantes y año en los países ricos, y es, con diferencia, la principal causa de las denominadas meningitis asépticas. En poblaciones especiales, como los pacientes inmunodeprimidos, esta incidencia puede ser mucho mayor1,2. Por ser la población pediátrica la más afectada, la mayoría de los estudios se han realizado en este colectivo. Se estima que las meningitis virales son hasta 20 veces más frecuentes durante el primer año de vida y que disminuyen con la edad. También, y aunque depende del virus implicado, parece que la incidencia es algo mayor en varones que en mujeres. La lista de virus que pueden provocar infección del SN es muy amplia. En el caso de las meningitis, hay causas comunes en todo el mundo como los enterovirus no poliomielíticos y específicamente las causadas por los Coxackie B y ciertos serotipos de virus Echo, que llegan a provocar alrededor del 86% de las meningitis en la población general y hasta más del 60% en niños menores de 3 años2. Estas tienen un carácter estacional y son más frecuentes en los meses calurosos de verano y otoño, y pueden ocasionar brotes epidémicos3. Dentro de los enterovirus hay serotipos como el 68 y 71 que exhiben un marcado neurotropismo y provocan no solo casos de meningitis, con o sin cierto grado de afectación encefalítica, sino también cuadros similares a la poliomielitis y el síndrome de Guillain-Barré4.
En España, la situación no parece diferente a la del resto del mundo desarrollado, con los enterovirus no poliomielíticos a la cabeza en niños, seguidos de los virus herpes en jóvenes y adultos1,5–7. Los virus herpes simplex 1 (VHS-1) y sobre todo el herpes simplex 2 (VHS-2), junto al virus de la varicela zóster (VVZ), el virus de Epstein-Barr, el citomegalovirus (CMV), y el herpes humano tipo 6, causan aproximadamente el 4% de los casos de meningitis, sin que en este contexto se demuestre una estacionalidad. También se debe apuntar a la existencia de infecciones del SN que habían disminuido tras las campañas universales de vacunación y que, bien por fenómenos migratorios, fallos vacunales o bien por los movimientos antivacunas, están aflorando, como las provocadas por el virus de la parotiditis. Los varones entre 16 y 21 años son el grupo que más riesgo tiene de desarrollar meningitis por este agente que les afecta con mayor frecuencia que a las mujeres (ratio varón/mujer, 3:1) y que puede provocar brotes en colegios durante el invierno8. Por las razones antes expuestas, también se está observando un repunte a nivel mundial en los casos de meningitis provocada por el virus del sarampión. Las infecciones provocadas por el virus de la poliomielitis salvaje se han controlado en la mayor parte del mundo, pero desafortunadamente y, a pesar de la existencia de vacunas efectivas, se siguen produciendo casos favorecidos entre otros factores por el integrismo religioso y las guerras.
Existen virus emergentes en algunas áreas geográficas que llegan a provocar grandes brotes epidémicos o sociocultural-religiosos. Es el ejemplo de lo que sucedió en Estados Unidos de América con el virus del Nilo Occidental (VWN), que también está afectando actualmente a Centroeuropa9, o el caso del virus Zika en las Américas y Asia con sus graves consecuencias10.
Las infecciones del SN se pueden adquirir por vías muy diferentes. La más frecuente es la vía orofecal, como la seguida por los enterovirus. Los adenovirus, aunque no suelen provocar meningitis en el paciente inmunocompetente, se transmiten por vía aérea. Pero también existen otras vías de gran trascendencia como la sexual, que transmite el VIH (virus de la inmunodeficiencia humana). Este último causa meningitis aséptica durante la primo-infección y puede causar encefalitis subaguda-crónica en pacientes sin control inmunovirológico. Por vía sexual, también se puede adquirir el virus Zika, que puede desencadenar un síndrome de Guillain-Barré. Existen virus neurotropos que se pueden adquirir mediante mordeduras de mamíferos, como es el caso de la rabia, o por contacto con roedores y sus excretas, como ocurre con el virus de la coriomeningitis linfocitaria (VCML).
Las infecciones del SN provocadas por virus transmitidos por artrópodos vectores (arbovirus), pueden llegar a constituir un porcentaje elevado de los casos de las infecciones sintomáticas del SN en algunas partes del mundo. Al ser transmitidas por dípteros y garrapatas son más frecuentes cuando estos están activos, es decir en primavera, verano y otoño. Además acontece con frecuencia que la meningitis va acompañada de cierto grado de encefalitis y/o de radiculitis. El hecho de conocer la distribución geográfica de las diferentes arbovirosis y endemismos de virus que presentan tropismo por el SN puede ser trascendental, pero prácticamente imposible. Se estima actualmente que unos 5.000 virus pueden ser transmitidos por artrópodos vectores. A nivel internacional, el de mayor distribución geográfica es el virus de la encefalitis japonesa B. En Estados Unidos de América, la arbovirosis que con más frecuencia afecta al SN es la denominada encefalitis de San Luis. Está bien documentado el problema actual en una gran parte del mundo con los virus Zika y del Nilo Occidental9,10. Por estos motivos, ante un paciente que haya realizado viajes en las semanas/meses previos, se debe consultar un mapa de endemismos, ya que las posibilidades son muy variadas y el listado de potenciales agentes virales es creciente. En nuestro medio, las picaduras de diferentes especies de dípteros pueden transmitir el VWN y el virus Toscana. Este último se ha convertido en una de las causas más comunes de meningitis aséptica en algunas zonas de España1,11. Por otro lado, la existencia en nuestro medio de especies invasoras de mosquito, como el Aedes albopictus (mosquito tigre), aumenta el riesgo de que puedan observarse casos esporádicos o pequeños brotes de infección por el virus Zika12. Las garrapatas duras también pueden transmitir virus neurotropos como el agente TBE (tick-borne encephalitis), ampliamente distribuido en Europa, del que en España solo se han descrito casos importados, a pesar de que el vector (Ixodes ricinus) se encuentra ampliamente distribuido en nuestro entorno12. También se debe considerar la posible trasmisión vertical de virus neurotropos, el mejor ejemplo actual sería el del virus Zika, que provoca microcefalia con encefalitis muy grave en el feto y recién nacido10.
Los VHS-1 y VHS-2 son la principal causa de encefalitis no epidémica y de encefalitis con desenlace fatal en el mundo desarrollado. El VHS-2 es más frecuente en el neonato al infectarse en el canal del parto durante el alumbramiento y el VHS-1 en niños mayores de 3 meses y en adultos. Se afectan por igual ambos sexos y se han documentado dos picos de incidencia: uno en menores de 20 años que se achaca a la primoinfección y otro en mayores de 50 años por reactivación de una infección latente. Se estima que un tercio de los casos acontece en pacientes pediátricos13. Un capítulo aparte lo constituyen las denominadas mielopatías tropicales asociadas a las infecciones por retrovirus tales como el HTLV-1 (virus linfotrópico humano de células T tipo 1).
2Manifestaciones clínicasLas infecciones virales del SN ocasionan dos síndromes clínicos: las meningitis y las encefalitis14. Desde un punto de vista asistencial es importante distinguirlos, ya que su etiología y tratamiento suelen ser diferentes. No obstante, en ocasiones algunos agentes ocasionan cuadros de solapamiento con afectación simultánea de las meninges y del parénquima cerebral (meningoencefalitis). Tal y como se ha comentado en el apartado anterior, también se puede afectar la médula espinal y los nervios craneales y raíces de los nervios que salen de la médula, ocasionando meningorradiculitis, mielitis, encefalomielitis, etc.
En general, el curso clínico de la meningitis viral es benigno. El comienzo suele cursar de forma aguda con fiebre, cefalea frontal o retroorbitaria, fotofobia y rigidez de nuca. Estas manifestaciones clínicas son similares a las de las meningitis bacterianas, si bien con frecuencia los signos clínicos son menos prominentes y su curso autolimitado. En ocasiones existe alteración del estado mental, pero no suele ser profundo ni llegar al coma, como tampoco suelen producirse convulsiones, a no ser que exista también encefalitis. Otras veces, el curso es bifásico. También es frecuente la existencia de otros síntomas de afectación sistémica como mialgias, anorexia o malestar general. En el caso de coexistir manifestaciones digestivas, estas consisten en náuseas, vómitos, dolor abdominal o diarrea. Pueden acontecer otras manifestaciones acompañantes como pleurodinia, pericarditis o exantemas.
El análisis del líquido cefalorraquídeo (LCR) suele revelar un líquido claro con pleocitosis de predominio linfocitario (25-500 células/μl), aunque ocasionalmente en los primeros días puede existir incremento de leucocitos polimorfonucleares, discreta elevación de las proteínas (20-80mg/100ml) y valores de glucosa normales. Estas características son comunes a otras meningitis asépticas, como las provocadas por Borrelia burgdorferi, y en ocasiones también se pueden observar en las meningitis bacterianas truncadas1. Algunos virus con tropismo por el SN, ocasionalmente causan meningitis subagudas o crónicas (> 4 semanas de duración), como es el caso del virus de la parotiditis, VIH, echovirus, VHS o VCML.
La clínica de las encefalitis se diferencia de las meningitis virales por la existencia de alteraciones de las funciones cerebrales superiores. El cuadro clínico se caracteriza por una enfermedad febril aguda, acompañada de manifestaciones derivadas de la afectación encefálica: confusión, agitación, alucinaciones, alteraciones de la conducta, disminución del nivel de conciencia (incluso coma), convulsiones y signos neurológicos focales (debilidad, parálisis de pares craneales, ataxia, afasia, movimientos involuntarios, etc.). Pueden objetivarse hiponatremia por secreción inadecuada de ADH (hormona antidiurética), diabetes insípida y alteraciones de la termorregulación. Las convulsiones son más frecuentes que en las meningitis. Los signos de irritación meníngea no están presentes, a no ser que se trate de una meningoencefalitis. Los reflejos osteotendinosos pueden estar exaltados y aparecer reflejos patológicos. El examen del LCR se muestra similar al de las meningitis virales15.
El VHS-1 es la causa más frecuente de encefalitis viral grave en nuestro entorno. Su comienzo suele ser agudo, y la alteración de la función cerebral resulta de tal grado que habitualmente no se puede obtener una anamnesis detallada a partir del propio paciente. Se acompaña de fiebre, cefalea y síntomas focales característicos de afectación del lóbulo temporal. Otras manifestaciones neurológicas son las producidas por la afectación de las meninges, SN autónomo a nivel sacro, mielitis transversa, o el síndrome de Guillain-Barré y neuritis periférica craneal (p. ej., parálisis de Bell).
Las manifestaciones clínicas de las encefalitis por arbovirus, aunque dependen del virus causante, se caracterizan por una fase prodrómica con síntomas inespecíficos —fiebre con dolores musculares, artralgias, molestias digestivas o respiratorias— seguida de la fase de encefalitis, que en los casos más graves ocasionan paresias, convulsiones, signos de hipertensión intracraneal y coma.
Existen encefalitis de curso crónico como la leucoencefalopatía multifocal progresiva producida por el poliomavirus JC. Este virus exhibe tropismo por los oligodendrocitos y ocasiona lesiones desmielinizantes en la sustancia blanca cerebral. Afecta casi exclusivamente a pacientes con inmunodeficiencia (SIDA, neoplasias oncohematológicas, trasplante de órganos, etc.). Recientemente se están describiendo casos en sujetos tratados con diversos anticuerpos monoclonales (natalizumab, efalizumab, rituximab, etc.). Cursa con déficits visuales (hemianopsia homónima), deterioro cognitivo, déficits motores, convulsiones y ataxia. La resonancia magnética cerebral detecta lesiones múltiples de desmielinización en la sustancia blanca que no suelen captar contraste ni producir efecto masa16. La panencefalitis esclerosante subaguda es un síndrome desmielinizante fatal muy poco frecuente, que se presenta en niños o adultos jóvenes y acontece 7-10 años después de un sarampión. Parece ser consecuencia de la infección persistente de un virus mutante en el SN. Cursa con alteraciones del humor y de la personalidad, con progresión hasta deterioro cognitivo grave, convulsiones, ataxia y tetraparesia espástica17.
3Diagnóstico virológicoA diferencia del diagnóstico de las meningitis bacterianas, en el que el gold standard reside en el cultivo del LCR, en las infecciones virales del SN provocadas por virus, este presenta bajo rendimiento, y se ha sustituido por las técnicas de amplificación de ácidos nucleicos (TAAN), que en la actualidad son el método de referencia para el diagnóstico de estas infecciones18. La introducción de la reacción en cadena de la polimerasa (PCR) y diagnóstico serológico de los principales arbovirus han aumentado las capacidades diagnósticas ante el ampliado espectro de estas entidades clínicas.
El diagnóstico definitivo de las meningitis virales se establece demostrando la presencia del agente etiológico en el LCR. Esto no siempre es posible por métodos directos, por lo que en ocasiones cabe recurrir a métodos indirectos como la serología. Así, la detección de agentes etiológicos en localizaciones diferentes al LCR (obedeciendo a su patogenia y replicación, p. ej., en faringe, o a su eliminación a través de las heces) o la documentación de anticuerpos mediante determinaciones serológicas, orientan hacia un diagnóstico probable y no definitivo de este tipo de infecciones19.
La serología puede ser útil en el diagnóstico de algunas meningitis virales, como las originadas por el VVZ, virus Toscana, VWN y VCML a partir de suero o de LCR, ya sea por demostración de IgM específica en suero, por seroconversión de IgG entre suero de fase aguda y fase convaleciente o por producción de anticuerpos específicos a nivel intratecal19,20. En algunos casos, las pruebas serológicas pueden ser las únicas que permitan realizar un diagnóstico, ya que las TAAN tienen poca rentabilidad pasados los primeros días de la infección, como sucede en muchos arbovirosis20.
Las TAAN proporcionan mayor sensibilidad y rapidez que el cultivo, son más sencillas de realizar y representan actualmente el método de elección en el diagnóstico de las meningitis asépticas a partir de LCR. Disponer de esta metodología diagnóstica permite obtener resultados de manera precoz y fiable, lo que puede repercutir de manera importante en el abordaje del cuadro clínico, puesto que racionaliza en muchas ocasiones el ingreso hospitalario y reduce tratamientos antibióticos innecesarios19. Actualmente existen equipos comerciales con marcado de Conformidad Europea para los patógenos más relevantes como los enterovirus, VHS y VVZ. La mayoría están basados en PCR a tiempo real (PCR TR) y muchos de ellos se encuentran parcial o totalmente automatizados. Se dispone también de métodos múltiples que integran todo el proceso en sistemas cerrados, ofrecen resultados muy rápidos, presentan características operacionales intrínsecas adecuadas (alta especificidad y sensibilidad), son fáciles de realizar y pueden estar accesibles en hospitales de diferentes perfiles de actividad y complejidad21,22. Existen métodos comercializados, totalmente automatizados para detección de enterovirus, que amplifican regiones conservadas del genoma viral (pudiendo detectar cualquier serotipo descrito de enterovirus), como el sistema GeneXpert® EV (Cepheid, Sunnyvale, Estados Unidos), que integra extracción de ARN, transcripción reversa y PCR en un mismo cartucho de reacción23.
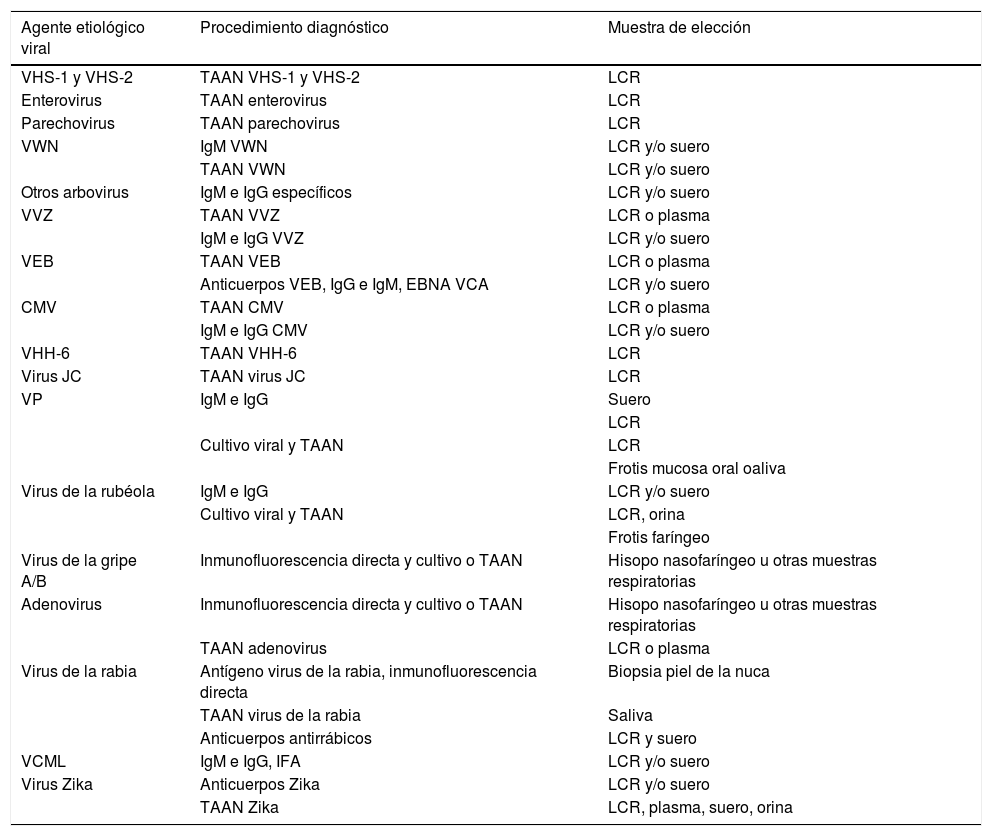
En ausencia de datos que apunten claramente hacia un determinado agente, en nuestro medio debe plantearse un cribado para enterovirus, VHS y VVZ, en las encefalitis y meningoencefalitis. Existen sistemas comerciales de PCR múltiple que detectan virus de la familia Herpesviridae en una misma reacción (VHS-1, VHS-2 y VVZ). En pacientes inmunodeprimidos procedería incluir el estudio de CMV y del virus de Epstein-Barr. Durante los meses cálidos en los que existe actividad del vector del virus Toscana, el estudio podría completarse con PCR para él. Si se sospecha una infección por el virus de la rabia, puede detectarse el virus por PCR TR en LCR, saliva y biopsia de la piel de la nuca. En los casos de leucoencefalopatía multifocal progresiva, la única técnica capaz de proporcionar un diagnóstico es la PCR para virus JC en el LCR, sin embargo, para la panencefalitis esclerosante subaguda no hay trabajos que muestren un buen rendimiento de la PCR TR en esta muestra. En la tabla 1 se representan los principales virus implicados en meningitis-encefalitis, las técnicas diagnósticas disponibles para su diagnóstico y las muestras más recomendadas12,24,25.
Diagnóstico microbiológico de meningitis-encefalitis virales
| Agente etiológico viral | Procedimiento diagnóstico | Muestra de elección |
|---|---|---|
| VHS-1 y VHS-2 | TAAN VHS-1 y VHS-2 | LCR |
| Enterovirus | TAAN enterovirus | LCR |
| Parechovirus | TAAN parechovirus | LCR |
| VWN | IgM VWN | LCR y/o suero |
| TAAN VWN | LCR y/o suero | |
| Otros arbovirus | IgM e IgG específicos | LCR y/o suero |
| VVZ | TAAN VVZ | LCR o plasma |
| IgM e IgG VVZ | LCR y/o suero | |
| VEB | TAAN VEB | LCR o plasma |
| Anticuerpos VEB, IgG e IgM, EBNA VCA | LCR y/o suero | |
| CMV | TAAN CMV | LCR o plasma |
| IgM e IgG CMV | LCR y/o suero | |
| VHH-6 | TAAN VHH-6 | LCR |
| Virus JC | TAAN virus JC | LCR |
| VP | IgM e IgG | Suero |
| LCR | ||
| Cultivo viral y TAAN | LCR | |
| Frotis mucosa oral oaliva | ||
| Virus de la rubéola | IgM e IgG | LCR y/o suero |
| Cultivo viral y TAAN | LCR, orina | |
| Frotis faríngeo | ||
| Virus de la gripe A/B | Inmunofluorescencia directa y cultivo o TAAN | Hisopo nasofaríngeo u otras muestras respiratorias |
| Adenovirus | Inmunofluorescencia directa y cultivo o TAAN | Hisopo nasofaríngeo u otras muestras respiratorias |
| TAAN adenovirus | LCR o plasma | |
| Virus de la rabia | Antígeno virus de la rabia, inmunofluorescencia directa | Biopsia piel de la nuca |
| TAAN virus de la rabia | Saliva | |
| Anticuerpos antirrábicos | LCR y suero | |
| VCML | IgM e IgG, IFA | LCR y/o suero |
| Virus Zika | Anticuerpos Zika | LCR y/o suero |
| TAAN Zika | LCR, plasma, suero, orina |
CMV: citomegalovirus; EBNA: antígeno nuclear del virus de Epstein-Barr; IFA: inmunofluorescencia indirecta; Ig: inmunoglobulinas; JC: John Cunningham; LCR: líquido cefalorraquídeo; TAAN: técnicas de amplificación de ácidos nucleicos; VCA: antígeno de la cápside viral; VCML: virus de la coriomeningitis linfocitaria; VEB: virus de Epstein-Barr; VHH-6: virus del herpes humano 6; VHS: virus del herpes simple; VP: virus de la parotiditis; VVZ: virus de la varicela zóster; VWN: virus del Nilo Occidental.
Adaptada de referencia 24.
En octubre del año 2015, la Food and Drug Administration autorizó el primer panel meningitis/encefalitis para la detección de 14 patógenos más comunes responsables de meningitis o encefalitis adquiridas en comunidad incluyendo virus, bacterias y levaduras del SN (FilmArray®)12. La técnica se realiza en 1h y los patógenos incluidos en el panel son: Escherichia coli K1,Haemophilus influenzae,Listeria monocytogenes,Neisseria meningitidis,Streptococcus agalactiae,Streptococcus pneumoniae, CMV, enterovirus, VHS-1, VHS-2, herpesvirus humano-6, parechovirus humano, VVZ y Cryptococcus neoformans/Cryptococcus gattii.
Las técnicas de secuenciación masiva permiten el análisis del viroma y, a medida que se profundice en su conocimiento, algunos de los conceptos patogénicos que actualmente se consideran establecidos sufrirán sin duda un replanteamiento26. Además, la dificultad de interpretación de datos y los costes asociados con esta metodología condicionan su empleo generalizado en el ámbito de la microbiología diagnóstica asistencial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.