La detección de eosinofilia periférica es un motivo relativamente frecuente para la remisión de un paciente a una Unidad/Servicio de Enfermedades Infecciosas. En general, se pretende descartar una enfermedad parasitaria, tanto en personas autóctonas como en viajeros o inmigrantes. Excepcionalmente la eosinofilia relacionada con parásitos corresponde a una protozoosis, siendo los helmintos los principales agentes causales de este hallazgo hematológico. La eosinofilia puede ser el único hallazgo anormal o formar parte del cuadro clínico-biológico del paciente. Por otro lado, no todas las helmintosis se asocian de forma sistemática a eosinofilia, y el grado de la misma difiere entre las fases de la infección y el tipo de helminto. El propósito de esta revisión es un estudio sistemático de la relación entre helmintosis y eosinofilia en la literatura española, distinguiendo los casos autóctonos e importados, así como la relación con situaciones de inmunodepresión.
The finding of blood eosinophilia in a patient is a relatively frequent reason to refer him/her to a Clinical Department of Infectious Diseases. The doctor usually intends to rule out a parasitic disease in the autochthonous population, travelers or immigrants. It is uncommon for an eosinophilia to be produced by protozoa infection, whereas helminth parasites are more frequently associated with an increase of eosinophil counts in the infected patient. Eosinophilia can be the only abnormal finding, or it could be part of more complex clinical manifestations suffered by the patient. Furthermore, many, but not all, helminth infections are associated with eosinophilia, and the eosinophil level (low, high) differs according to parasite stages, helminth species, and worm co-infections. The purpose of the present article is to carry out a systematic review of cases and case series on helminth infections and eosinophilia reported in Spain from 1990 to 2015, making a distinction between autochthonous and imported (immigrants and travelers) cases, and studying their relationship with immunodepression situations.
El término «eosinofilia» indica la elevación del número o del porcentaje de los leucocitos polimorfonucleares eosinófilos en cualquier tejido sólido o líquido1. Aunque no hay un límite establecido, se considera que existe eosinofilia si los valores sanguíneos superan las 450células/μl1. Su detección en sangre requiere una investigación de la causa responsable, ya que puede ser consecuencia de muy diversos motivos, desde situaciones leves (p.ej., rinitis alérgica) a procesos graves (p.ej., neoplasias hematológicas)1. Una de las principales condiciones que evoca la detección de eosinofilia es la presencia de una parasitosis. Además, y con escasas excepciones (Isospora belli, Dientamoeba fragilis, Sarcocystis spp.), los protozoos no son agentes causales relacionados con la aparición de eosinofilia, por lo que su presencia sugiere una helmintosis1.
En España existe una amplia bibliografía acerca de la asociación entre la infección por helmintos y la presencia de eosinofilia. El mapa global de esta asociación en nuestro país es complejo, ya que en algunos casos la parasitación se detecta en casos aislados, y en otros, en forma de brotes. Por otro lado, algunas parasitosis aparecen solo como enfermedad importada (viajeros o inmigrantes), mientras que otras tienen distribución cosmopolita2. En tercer lugar, la presencia de eosinofilia depende de la fase del ciclo biológico del parásito e incluso de la respuesta al tratamiento. Finalmente, diversos factores como la edad, el origen geográfico del paciente, su estado inmunológico y la presencia de poliparasitaciones influyen de forma notable en la detección de eosinofilia.
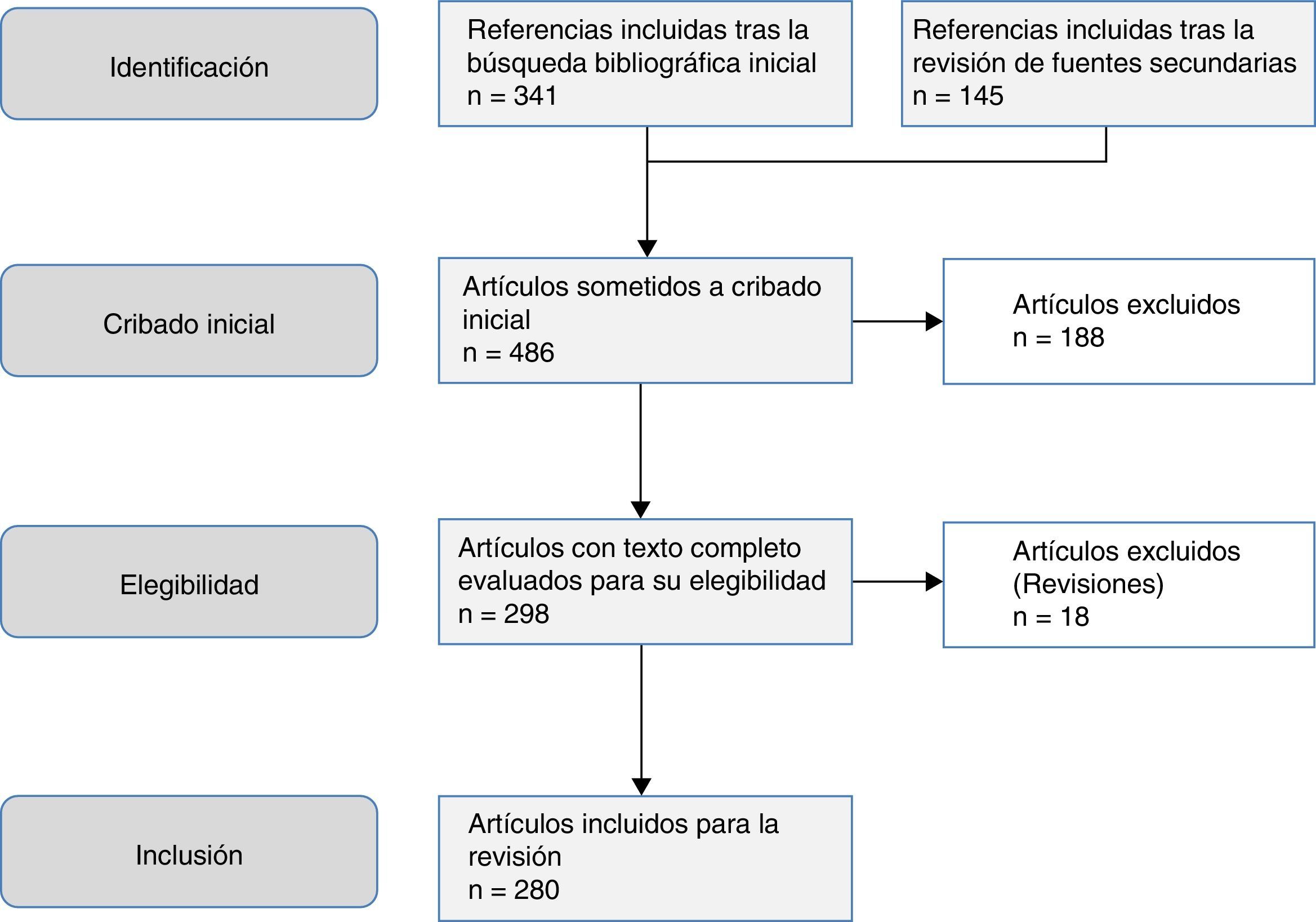
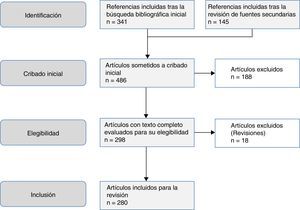
El objetivo de este trabajo es una revisión de las helmintosis asociadas a eosinofilia en España en los últimos 25años. Este trabajo se basa en una búsqueda sistemática en PubMed, que incluyó originales, originales breves, notas clínicas y cartas científicas (fig. 1). La estrategia de búsqueda electrónica fue la siguiente: país (Spain) AND enfermedad OR agente causal. Se consideraron los siguientes términos MESH en la inclusión de enfermedades: Helminthiasis, Taeniasis, Hymenolepiasis, Dipylidiasis, Cysticercosis, Echinococcosis, Sparganosis, Diphyllobothriasis, Schistosomiasis, Fascioliasis, Paragonimiasis Opisthorchiasis, Clonorchiasis, Dicrocoeliasis, Enterobiasis, Ancylostomiasis, Necatoriasis, Ascariasis, Trichuriasis, Strongyloidiasis, Dirofilariasis, Filariasis, Loiasis, Onchocerciasis, Mansonelliasis, Dracunculiasis, Trichinellosis, Anisakiasis, Toxocariasis, Gnathostomiasis. En lo que respecta a los agentes causales, se incluyeron los siguientes términos MESH: Helminth, Taenia, Hymenolepis, Dipylidium, Cysticercus, Echinococcus, Spirometra, Sparganum, Schistosoma, Fasciola, Paragonimus, Opisthorchis, Clonorchis, Heterophyes, Metagonimus, Dicrocoelium, Ancylostoma, Necator, Hookworm, Ascaris, Trichuris, Strongyloides, Capillaria, Dirofilaria, Wuchereria, Brugia, Loa, Onchocerca, Mansonella, Dracunculus, Trichinella, Anisakis, Toxocara, Gnathostoma. Se limitaron los resultados a estudios realizados en humanos. El periodo de tiempo de la búsqueda fue desde el 1 de enero de 1990 al 31 de agosto del 2015.
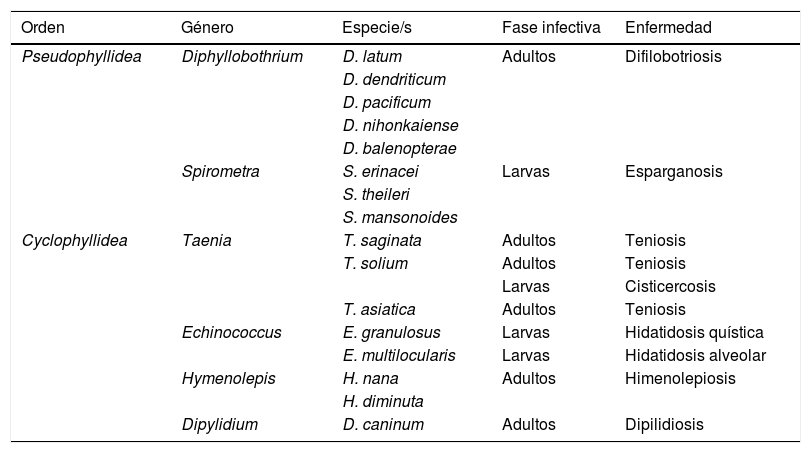
CestodosisLas cestodosis son enfermedades producidas por gusanos planos (phylum Plathelminthes) con cuerpo segmentado (clase Cestoda). Los principales agentes causales de enfermedad en humanos se incluyen en 2 órdenes, Pseudophyllidea y Cyclophyllidea, y pueden ocasionar enfermedad bien por la forma adulta del parásito, por la fase larvaria o por ambas. En la tabla 1 se indican las principales cestodosis. De forma general, podemos indicar que la eosinofilia asociada a las cestodosis es leve o moderada, siendo frecuente que no aparezca en el curso de la enfermedad. También, habitualmente, la eosinofilia es más frecuente en las cestodosis larvarias (con afectación tisular) que en las producidas por vermes adultos (con afectación intestinal aislada). Finalmente, la rotura o manipulación quirúrgica de formas larvarias (especialmente en hidatidosis quística y en menor medida en hidatidosis alveolar) se asocia a una elevación notable del número de eosinófilos sanguíneos.
Principales cestodosis
| Orden | Género | Especie/s | Fase infectiva | Enfermedad |
|---|---|---|---|---|
| Pseudophyllidea | Diphyllobothrium | D. latum | Adultos | Difilobotriosis |
| D. dendriticum | ||||
| D. pacificum | ||||
| D. nihonkaiense | ||||
| D. balenopterae | ||||
| Spirometra | S. erinacei | Larvas | Esparganosis | |
| S. theileri | ||||
| S. mansonoides | ||||
| Cyclophyllidea | Taenia | T. saginata | Adultos | Teniosis |
| T. solium | Adultos | Teniosis | ||
| Larvas | Cisticercosis | |||
| T. asiatica | Adultos | Teniosis | ||
| Echinococcus | E. granulosus | Larvas | Hidatidosis quística | |
| E. multilocularis | Larvas | Hidatidosis alveolar | ||
| Hymenolepis | H. nana | Adultos | Himenolepiosis | |
| H. diminuta | ||||
| Dipylidium | D. caninum | Adultos | Dipilidiosis |
Sin lugar a dudas, las cestodosis diagnosticadas con mayor frecuencia en España corresponden a infecciones por parásitos del orden Cyclophyllidea. Dentro de ellas, el menor número de referencias corresponde a las formas intestinales. Así, la infección intestinal por Taenia sp., aunque relativamente frecuente por datos indirectos (casos personales en el Hospital Universitario Insular de Gran Canaria) y muestras remitidas al Instituto de Salud CarlosIII, ha sido objeto de un mínimo número de publicaciones3. La infección por Hymenolepis nana en España se describe, en la mayoría de los casos, en niños saharauis procedentes de Tindouf en estancia veraniega en nuestro país, con una prevalencia del 6,5-7,5% y una frecuente coparasitación por protozoos intestinales (Giardia intestinalis)4,5. También se ha descrito anecdóticamente la infección por este helminto en una niña procedente de Ecuador6. Solo hemos encontrado un caso publicado de la afectación por Hymenolepis diminuta en una niña de 5años en la provincia de Guadalajara7. En la revisión realizada no hemos localizado casos de infección en humanos por Dipylidium caninum. Sin embargo, la detección de huevos del parásito en las heces de perros, en varias regiones españolas8-11, sugiere que esta parasitosis puede estar siendo infradiagnosticada.
Por el contrario, las formas larvarias de cestodosis son frecuentes, tanto como parasitosis autóctonas o como importadas. Las 2 más importantes son la hidatidosis quística y la cisticercosis, particularmente su forma de afectación neurológica (neurocisticercosis).
La hidatidosis quística producida por Echinococcus granulosus es una zoonosis autóctona, endémica en la península Ibérica, con una importante repercusión socioeconómica hasta finales del sigloxx12-15. Históricamente las regiones más afectadas han sido las comunidades del norte (País Vasco, Navarra, Aragón, La Rioja, Cantabria) y del centro (Castilla y León, Extremadura, Castilla-La Mancha)15-22. Además, en los últimos años se ha comunicado un número importante de casos en la Comunidad Valenciana23. Sin embargo, no hemos encontrado casos publicados de hidatidosis quística en la Comunidad Canaria ni en la comunidad de las Islas Baleares. La hidatidosis llegó a reducirse de forma significativa gracias a los programas de control introducidos en los años ochenta y noventa, aunque existen datos directos e indirectos, como la presencia de nuevos casos infantiles o el mantenimiento de tasas elevadas de infección en jóvenes en los últimos años, que sugieren una reemergencia de la enfermedad12,13. En España, como en otras partes del mundo, las manifestaciones clínicas más frecuentes de esta enfermedad derivan de la afectación hepática24–27 y de la vía biliar28,29 y, en segundo lugar, de la lesión del aparato respiratorio18,30-33. Además, varios grupos españoles han aportado casos o series de formas «atípicas» de hidatidosis quística tanto intraabdominales (esplénicas34-36, pancreáticas20, renales37, ováricas38 y otras menos habituales17,39-41) como en otros órganos (corazón42-45, músculo esquelético21,46,47, hueso48,49 o piel y tejidos blandos50). También se han descrito algunos casos de hidatidosis quística importada, aunque son escasos y no bien caracterizados51-53. La presencia de eosinofilia es muy poco frecuente en la hidatidosis quística clásica, aunque se ha publicado una elevada incidencia en algunas formas extrapulmonares, especialmente renales37, o tras rotura (espontánea o quirúrgica) de los quistes54-56.
La hidatidosis alveolar, ocasionada por Echinococcus multilocularis, es excepcional en nuestro país, tanto la forma autóctona como la importada. Únicamente existen 2 referencias bibliográficas en los últimos 25años; estos casos se manifestaron, como es usual, con un cuadro similar a una neoplasia hepática primaria57,58.
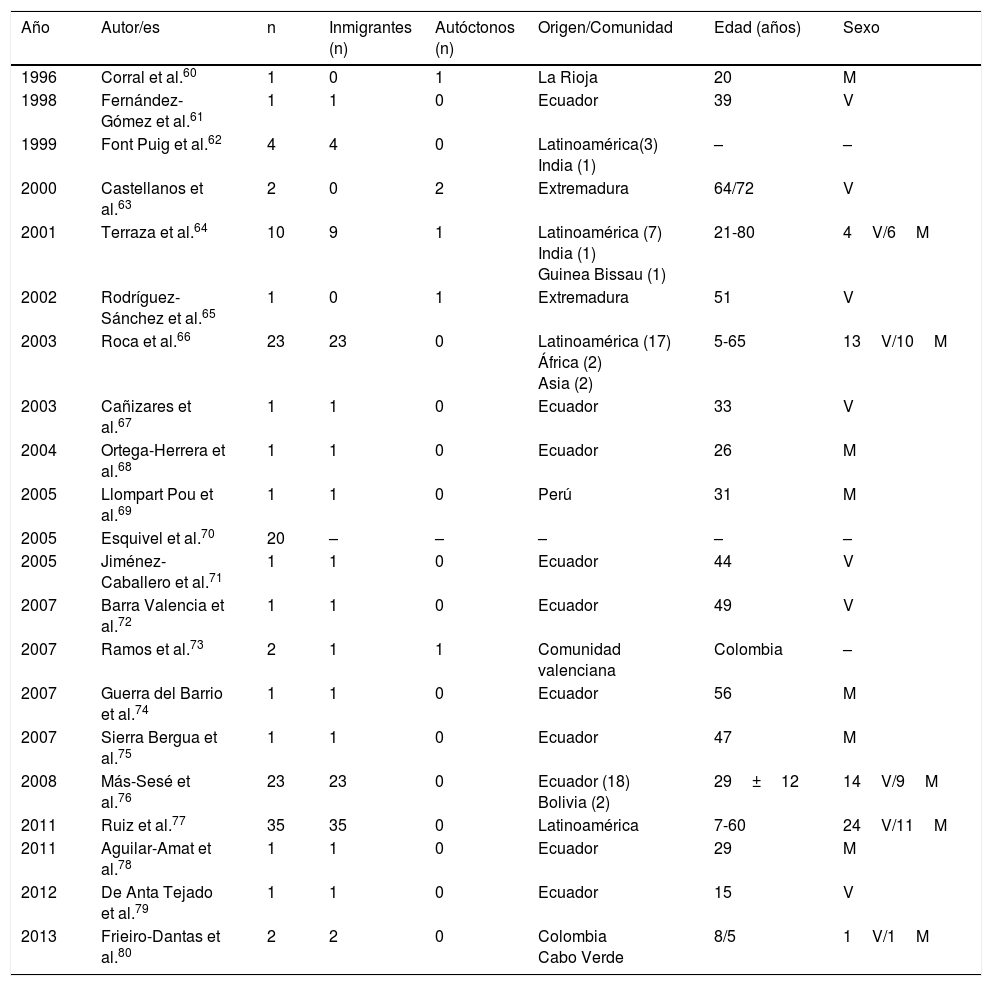
La cisticercosis es una enfermedad ocasionada por larvas de Taenia solium (Cysticercus cellulosae). Las 3 principales localizaciones de las formas larvarias son las cutáneas, oculares y neurológicas. Los casos más graves, lógicamente, son los que afectan al sistema nervioso central, y son los que han sido publicados en España, con formas mixtas en algún caso59. En la tabla 2 se recogen los datos epidemiológicos de los casos y las series de neurocisticercosis publicados en España60-80. Como puede observarse, y así se ha señalado en otras referencias60-82, existen 2 patrones diferentes de la enfermedad: a)importado, que incluye a la mayor parte de los casos detectados en los últimos años, especialmente observado en inmigrantes con un espectro de edad que abarca desde la infancia hasta la edad media de la vida, y b)autóctono, con casos poco frecuentes y descrito en españoles de mayor edad. El origen principal de los casos importados es Latinoamérica (principalmente Ecuador, Perú, Colombia y Bolivia), aunque también hay un número escaso de pacientes procedentes de África (Guinea Bissau, Cabo Verde, Costa de Marfil) y Asia (India y China)64,66-69,74-80. La mayor parte de los casos autóctonos se han descrito en Extremadura, La Rioja, Madrid y la Comunidad Valenciana. En los casos importados existe un número similar de varones y mujeres, mientras que en los autóctonos predominan claramente los varones. En general, la neurocisticercosis aparece en personas inmunocompetentes aunque en España se han descrito algunos casos en personas infectadas por VIH73 y en trasplantados72. Desde el punto de vista clínico, las manifestaciones más frecuentes de la neurocisticercosis son las crisis epilépticas (de diferentes tipos) y la cefalea. Sin embargo, en España se han referido otras manifestaciones peculiares, como el blefarospasmo83, el síndrome de Bruns (cefalea brusca asociada a síndrome vestibular agudo en relación con movimientos bruscos de la cabeza)71,78, lesiones medulares60, alteraciones psiquiátricas79 y muerte súbita69. La presencia de eosinofilia en pacientes con neurocisticercosis es excepcional y, en la mayor parte de casos, mal documentada84-86.
Neurocisticercosis en España
| Año | Autor/es | n | Inmigrantes (n) | Autóctonos (n) | Origen/Comunidad | Edad (años) | Sexo |
|---|---|---|---|---|---|---|---|
| 1996 | Corral et al.60 | 1 | 0 | 1 | La Rioja | 20 | M |
| 1998 | Fernández-Gómez et al.61 | 1 | 1 | 0 | Ecuador | 39 | V |
| 1999 | Font Puig et al.62 | 4 | 4 | 0 | Latinoamérica(3) India (1) | – | – |
| 2000 | Castellanos et al.63 | 2 | 0 | 2 | Extremadura | 64/72 | V |
| 2001 | Terraza et al.64 | 10 | 9 | 1 | Latinoamérica (7) India (1) Guinea Bissau (1) | 21-80 | 4V/6M |
| 2002 | Rodríguez-Sánchez et al.65 | 1 | 0 | 1 | Extremadura | 51 | V |
| 2003 | Roca et al.66 | 23 | 23 | 0 | Latinoamérica (17) África (2) Asia (2) | 5-65 | 13V/10M |
| 2003 | Cañizares et al.67 | 1 | 1 | 0 | Ecuador | 33 | V |
| 2004 | Ortega-Herrera et al.68 | 1 | 1 | 0 | Ecuador | 26 | M |
| 2005 | Llompart Pou et al.69 | 1 | 1 | 0 | Perú | 31 | M |
| 2005 | Esquivel et al.70 | 20 | – | – | – | – | – |
| 2005 | Jiménez-Caballero et al.71 | 1 | 1 | 0 | Ecuador | 44 | V |
| 2007 | Barra Valencia et al.72 | 1 | 1 | 0 | Ecuador | 49 | V |
| 2007 | Ramos et al.73 | 2 | 1 | 1 | Comunidad valenciana | Colombia | – |
| 2007 | Guerra del Barrio et al.74 | 1 | 1 | 0 | Ecuador | 56 | M |
| 2007 | Sierra Bergua et al.75 | 1 | 1 | 0 | Ecuador | 47 | M |
| 2008 | Más-Sesé et al.76 | 23 | 23 | 0 | Ecuador (18) Bolivia (2) | 29±12 | 14V/9M |
| 2011 | Ruiz et al.77 | 35 | 35 | 0 | Latinoamérica | 7-60 | 24V/11M |
| 2011 | Aguilar-Amat et al.78 | 1 | 1 | 0 | Ecuador | 29 | M |
| 2012 | De Anta Tejado et al.79 | 1 | 1 | 0 | Ecuador | 15 | V |
| 2013 | Frieiro-Dantas et al.80 | 2 | 2 | 0 | Colombia Cabo Verde | 8/5 | 1V/1M |
M: mujer; V: varón; –: no datos.
Las infecciones por parásitos del orden Pseudophyllidea son poco frecuentes en España. Dentro de ellas, la mayor parte de las referencias corresponden a casos de difilobotriosis87-91. Solamente hay un caso publicado, recientemente, de esparganosis (infección por diferentes especies de Spirometra). Se trata de una esparganosis importada, en un varón de 29años procedente de Bolivia, con una clínica de convulsiones y lesión cerebral multiquística y diagnóstico de sospecha de tumor disembrioplástico neuroepitelial (DNET)92. Con respecto a la difilobotriosis, es una enfermedad cuyas manifestaciones clínicas pueden ser nulas o presentar molestias abdominales inespecíficas, asociadas o no a las de una anemia megaloblástica. De los casos publicados en España, la mayor parte son autóctonos, siendo diagnosticados en un amplio abanico de edades (3-71años). La especie más frecuentemente detectada es Diphyllobothrium latum, aunque también se han comunicado casos ocasionados por Diphyllobothrium pacificum y Diplogonoporus balaenopterae90, posiblemente relacionados con consumo de pescado importado o estancias en el extranjero. La eosinofilia es excepcional en los casos publicados en España.
TrematodosisLas trematodosis son enfermedades producidas por gusanos planos (phylum Plathelminthes) con cuerpo foliáceo, no segmentado (clase Trematoda). La mayor parte son hermafroditas, con la excepción de las especies del género Schistosoma, que presentan dimorfismo sexual y una morfología característica.
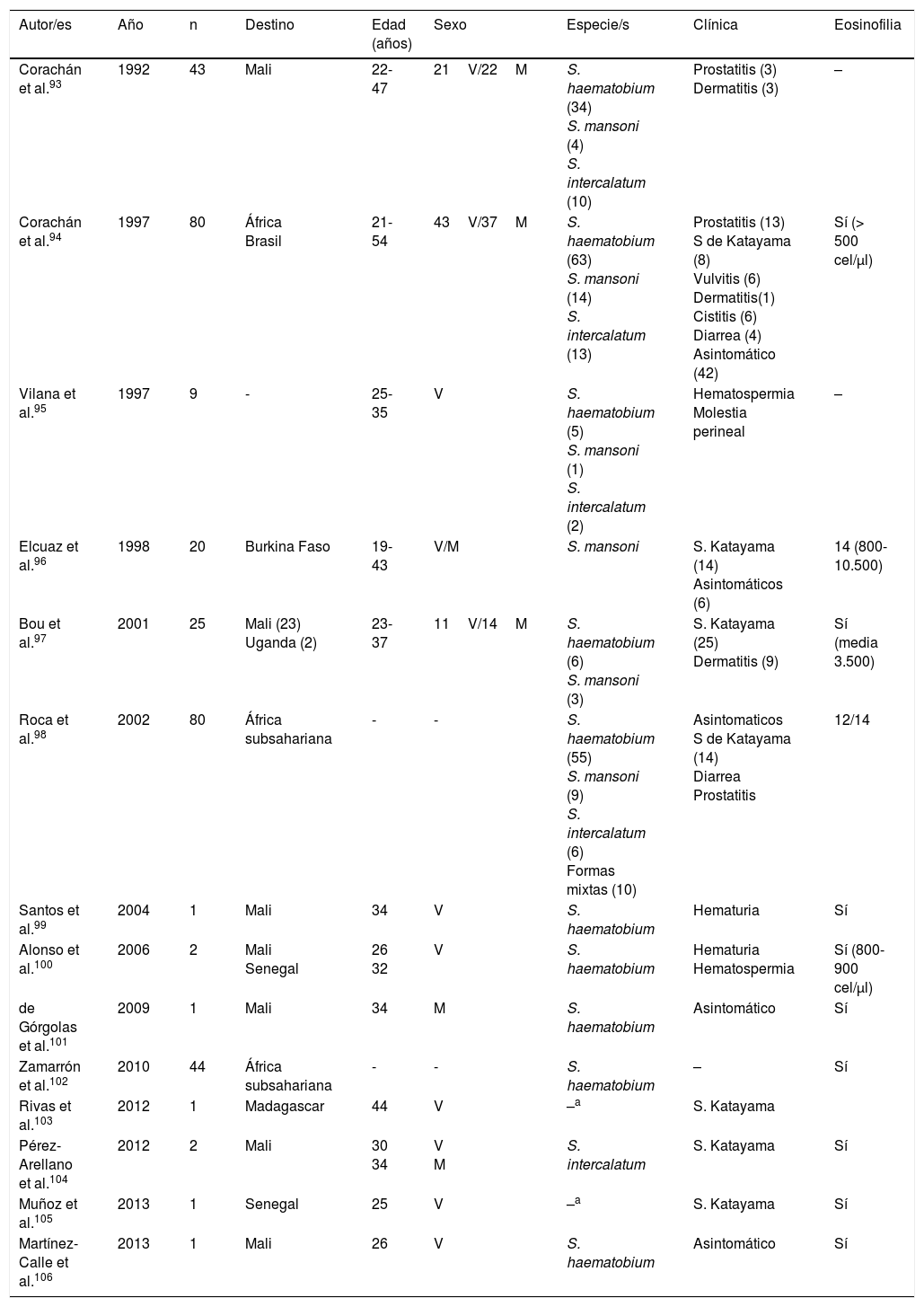
EsquistosomosisTodos los casos publicados en España acerca de esta enfermedad corresponden a formas importadas. Sin embargo, las manifestaciones clínicas y biológicas difieren notablemente entre las infecciones detectadas en viajeros y las diagnosticadas en inmigrantes (tablas 3-5).
Esquistosomosis importada en viajeros (casos y series)
| Autor/es | Año | n | Destino | Edad (años) | Sexo | Especie/s | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Corachán et al.93 | 1992 | 43 | Mali | 22-47 | 21V/22M | S. haematobium (34) S. mansoni (4) S. intercalatum (10) | Prostatitis (3) Dermatitis (3) | – |
| Corachán et al.94 | 1997 | 80 | África Brasil | 21-54 | 43V/37M | S. haematobium (63) S. mansoni (14) S. intercalatum (13) | Prostatitis (13) S de Katayama (8) Vulvitis (6) Dermatitis(1) Cistitis (6) Diarrea (4) Asintomático (42) | Sí (> 500 cel/μl) |
| Vilana et al.95 | 1997 | 9 | - | 25-35 | V | S. haematobium (5) S. mansoni (1) S. intercalatum (2) | Hematospermia Molestia perineal | – |
| Elcuaz et al.96 | 1998 | 20 | Burkina Faso | 19-43 | V/M | S. mansoni | S. Katayama (14) Asintomáticos (6) | 14 (800-10.500) |
| Bou et al.97 | 2001 | 25 | Mali (23) Uganda (2) | 23-37 | 11V/14M | S. haematobium (6) S. mansoni (3) | S. Katayama (25) Dermatitis (9) | Sí (media 3.500) |
| Roca et al.98 | 2002 | 80 | África subsahariana | - | - | S. haematobium (55) S. mansoni (9) S. intercalatum (6) Formas mixtas (10) | Asintomaticos S de Katayama (14) Diarrea Prostatitis | 12/14 |
| Santos et al.99 | 2004 | 1 | Mali | 34 | V | S. haematobium | Hematuria | Sí |
| Alonso et al.100 | 2006 | 2 | Mali Senegal | 26 32 | V | S. haematobium | Hematuria Hematospermia | Sí (800-900 cel/μl) |
| de Górgolas et al.101 | 2009 | 1 | Mali | 34 | M | S. haematobium | Asintomático | Sí |
| Zamarrón et al.102 | 2010 | 44 | África subsahariana | - | - | S. haematobium | – | Sí |
| Rivas et al.103 | 2012 | 1 | Madagascar | 44 | V | –a | S. Katayama | |
| Pérez-Arellano et al.104 | 2012 | 2 | Mali | 30 34 | V M | S. intercalatum | S. Katayama | Sí |
| Muñoz et al.105 | 2013 | 1 | Senegal | 25 | V | –a | S. Katayama | Sí |
| Martínez-Calle et al.106 | 2013 | 1 | Mali | 26 | V | S. haematobium | Asintomático | Sí |
M: mujer; V: varón; –: no datos.
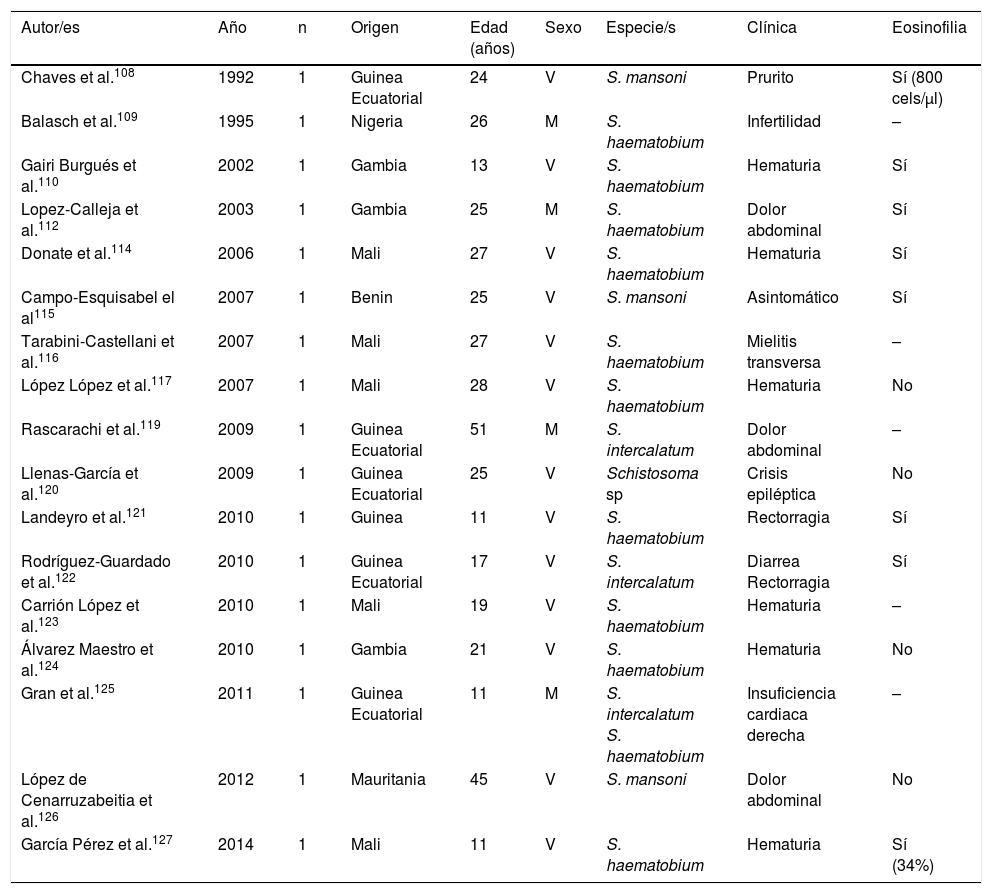
Esquistosomosis importada en inmigrantes (casos aislados)
| Autor/es | Año | n | Origen | Edad (años) | Sexo | Especie/s | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Chaves et al.108 | 1992 | 1 | Guinea Ecuatorial | 24 | V | S. mansoni | Prurito | Sí (800 cels/μl) |
| Balasch et al.109 | 1995 | 1 | Nigeria | 26 | M | S. haematobium | Infertilidad | – |
| Gairi Burgués et al.110 | 2002 | 1 | Gambia | 13 | V | S. haematobium | Hematuria | Sí |
| Lopez-Calleja et al.112 | 2003 | 1 | Gambia | 25 | M | S. haematobium | Dolor abdominal | Sí |
| Donate et al.114 | 2006 | 1 | Mali | 27 | V | S. haematobium | Hematuria | Sí |
| Campo-Esquisabel el al115 | 2007 | 1 | Benin | 25 | V | S. mansoni | Asintomático | Sí |
| Tarabini-Castellani et al.116 | 2007 | 1 | Mali | 27 | V | S. haematobium | Mielitis transversa | – |
| López López et al.117 | 2007 | 1 | Mali | 28 | V | S. haematobium | Hematuria | No |
| Rascarachi et al.119 | 2009 | 1 | Guinea Ecuatorial | 51 | M | S. intercalatum | Dolor abdominal | – |
| Llenas-García et al.120 | 2009 | 1 | Guinea Ecuatorial | 25 | V | Schistosoma sp | Crisis epiléptica | No |
| Landeyro et al.121 | 2010 | 1 | Guinea | 11 | V | S. haematobium | Rectorragia | Sí |
| Rodríguez-Guardado et al.122 | 2010 | 1 | Guinea Ecuatorial | 17 | V | S. intercalatum | Diarrea Rectorragia | Sí |
| Carrión López et al.123 | 2010 | 1 | Mali | 19 | V | S. haematobium | Hematuria | – |
| Álvarez Maestro et al.124 | 2010 | 1 | Gambia | 21 | V | S. haematobium | Hematuria | No |
| Gran et al.125 | 2011 | 1 | Guinea Ecuatorial | 11 | M | S. intercalatum S. haematobium | Insuficiencia cardiaca derecha | – |
| López de Cenarruzabeitia et al.126 | 2012 | 1 | Mauritania | 45 | V | S. mansoni | Dolor abdominal | No |
| García Pérez et al.127 | 2014 | 1 | Mali | 11 | V | S. haematobium | Hematuria | Sí (34%) |
M: mujer; V: varón; –: no datos.
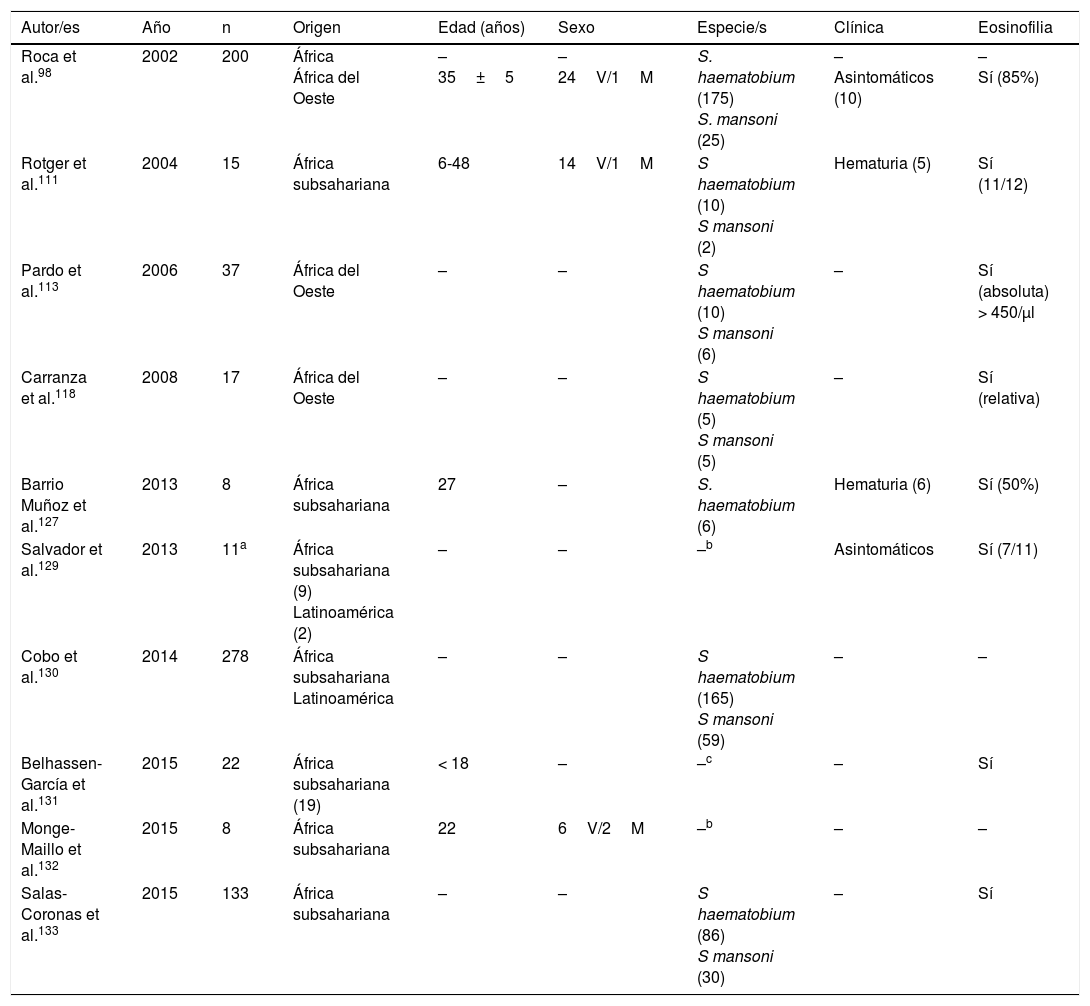
Esquistosomosis importada en inmigrantes (series)
| Autor/es | Año | n | Origen | Edad (años) | Sexo | Especie/s | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Roca et al.98 | 2002 | 200 | África África del Oeste | – 35±5 | – 24V/1M | S. haematobium (175) S. mansoni (25) | – Asintomáticos (10) | – Sí (85%) |
| Rotger et al.111 | 2004 | 15 | África subsahariana | 6-48 | 14V/1M | S haematobium (10) S mansoni (2) | Hematuria (5) | Sí (11/12) |
| Pardo et al.113 | 2006 | 37 | África del Oeste | – | – | S haematobium (10) S mansoni (6) | – | Sí (absoluta) > 450/μl |
| Carranza et al.118 | 2008 | 17 | África del Oeste | – | – | S haematobium (5) S mansoni (5) | – | Sí (relativa) |
| Barrio Muñoz et al.127 | 2013 | 8 | África subsahariana | 27 | – | S. haematobium (6) | Hematuria (6) | Sí (50%) |
| Salvador et al.129 | 2013 | 11a | África subsahariana (9) Latinoamérica (2) | – | – | –b | Asintomáticos | Sí (7/11) |
| Cobo et al.130 | 2014 | 278 | África subsahariana Latinoamérica | – | – | S haematobium (165) S mansoni (59) | – | – |
| Belhassen-García et al.131 | 2015 | 22 | África subsahariana (19) | < 18 | – | –c | – | Sí |
| Monge-Maillo et al.132 | 2015 | 8 | África subsahariana | 22 | 6V/2M | –b | – | – |
| Salas-Coronas et al.133 | 2015 | 133 | África subsahariana | – | – | S haematobium (86) S mansoni (30) | – | Sí |
M: mujer; V: varón; –: no datos.
Con respecto a la población viajera, se han comunicado casos aislados y series en varias regiones españolas93-106. Prácticamente todos los pacientes habían viajado a África, siendo los países más visitados Mali (especialmente el país Dogón), Burkina Fasso, Uganda (isla de Sesé), Malawi, Senegal y Madagascar. En general, la enfermedad es más frecuente en varones y afecta a personas en la edad media de la vida (lo que es congruente con el perfil habitual del viajero internacional). La principal especie responsable es Schistosoma haematobium, seguida por Schistosoma mansoni y Schistosoma intercalatum. También son habituales las formas mixtas de parasitación. Las manifestaciones clínicas corresponden a cuadros agudos de esquistosomosis, con el síndrome de Katayama98,103-105 y la dermatitis del bañista97 como las manifestaciones más frecuentes. Otras alteraciones importantes de la enfermedad son las genitourinarias (hematuria, prostatitis, hematospermia)93-95,98,99. Debemos destacar que la primera descripción de hematospermia como manifestación de esquistosomosis la llevaron a cabo autores españoles107. Un aspecto de interés es la detección de sujetos asintomáticos, lo que, unido al intervalo diferente entre la exposición y la aparición de síntomas en personas de un mismo brote, sugiere la presencia de factores del hospedador que modulan la expresión de la enfermedad. En lo que respecta a la eosinofilia, es la regla en las formas agudas, siendo en general elevada, aunque variable, entre las personas de un mismo brote.
La esquistosomosis en inmigrantes presenta similitudes pero también importantes diferencias con respecto a las formas descritas en viajeros101,108-133. Así, la mayor parte de los casos proceden de África subsahariana, especialmente África del Oeste y concretamente los países de Mali, Guinea Ecuatorial y Mauritania. También en inmigrantes, la esquistosomosis predomina en varones, aunque el intervalo de edades es mayor, con casos en niños y adultos mayores. S.haematobium es el agente causal más frecuente, seguido de S.mansoni y S.intercalatum. Las manifestaciones clínicas son muy variables; la hematuria (micro o macroscópica) es el dato más frecuente, lo que se relaciona con la infección por S.haematobium y, en segundo lugar, el dolor abdominal en infecciones por S.mansoni y S.intercalatum. Además, en España se han observado varios casos de manifestaciones atípicas y complicaciones de la enfermedad. Específicamente, se han comunicado algunas de las formas graves de la parasitosis (neuroesquistosomosis)134, en concreto mielitis transversa115,116 y una lesión focal hemisférica, con hemiparesia y convulsiones125. Otras complicaciones descritas en inmigrantes en España son la infertilidad femenina109, la hipertensión pulmonar125 y la apendicitis aguda126. Además, en la población en estudio un número importante de casos de esquistosomosis son asintomáticos. La eosinofilia en la esquistosomosis importada en inmigrantes es muy variable; así, se ha detectado eosinofilia absoluta (leve-moderada) en algunos casos, eosinofilia relativa en otros, y sin objetivarse esta alteración en los restantes. Por ello, y teniendo en cuenta la relevancia de las complicaciones a largo plazo (p.ej., hipertensión portal, carcinoma escamoso vesical), parece razonable un cribado de esta enfermedad en inmigrantes procedentes de áreas de riesgo.
Un problema importante en las esquistosomosis es la dificultad diagnóstica. Así, en los cuadros agudos es muy frecuente que no se observen huevos en orina o heces y, además, en los casos crónicos la eliminación de huevos es intermitente. Los estudios radiológicos135 y la cistoscopia123 pueden ayudar en la sospecha diagnóstica, particularmente en los casos de infección por S.haematobium. La serología ha sido una prueba clásica para detectar algunos casos agudos y otros parasitológicamente negativos, aunque presenta muchas limitaciones136,137. Tampoco la aplicación de técnicas de biología molecular clásica (PCR) en muestras clínicas ha mostrado una utilidad en la práctica clínica138,139. En la actualidad se están desarrollando nuevos procedimientos diagnósticos (LAMP), con resultados prometedores140.
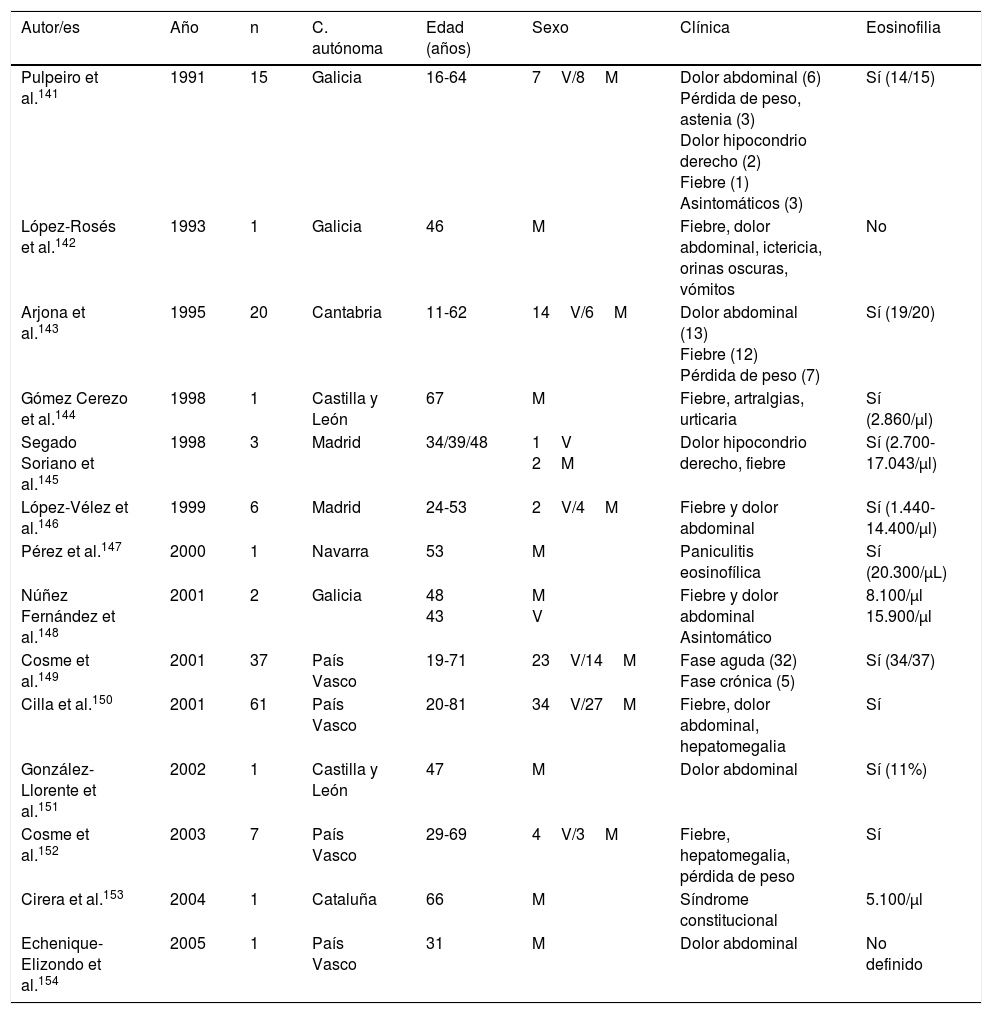
Trematodosis por especies hermafroditasLa trematodosis autóctona más frecuente en España es la fasciolosis, enfermedad ocasionada en nuestro país por Fasciola hepatica y relacionada con la ingesta de metacercarias presentes en verduras (principalmente berros)141-154. Con escasas excepciones, los casos descritos son autóctonos, y su análisis en los últimos 25años (tabla 6) permite realizar algunas generalizaciones: 1)La mayor parte de los casos publicados corresponden a pacientes de la mitad norte de la península Ibérica (País Vasco, Galicia, Cantabria, Navarra y Castilla León). 2)En el periodo revisado se observa una disminución notable de casos, perfectamente documentada en Guipúzcoa150. De hecho, no conocemos casos publicados en España desde 2005, lo que no excluye la presencia de casos aislados diagnosticados en hospitales y centros de referencia. 3)La mayor parte de los casos se describen en adultos, con una afectación similar en varones y mujeres. 4)Las manifestaciones clínicas más frecuentes corresponden a la fase aguda de la enfermedad con un síndrome constitucional asociado a dolor en hipocondrio derecho, siendo las alteraciones crónicas (afectación de la vía biliar) menos habituales. 5)No son infrecuentes las manifestaciones atípicas (nódulos subcutáneos, paniculitis eosinofílica, infiltrados pulmonares, pleuropericarditis, meningitis o adenopatías)141,143,147 y las complicaciones locales (p.ej., pancreatitis) o absceso subcapsular hepático151,154. 6)La eosinofilia es constante en la enfermedad, habitualmente con cifras muy elevadas, y constituye el principal dato de sospecha de la misma.
Fasciolosis en España
| Autor/es | Año | n | C. autónoma | Edad (años) | Sexo | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|
| Pulpeiro et al.141 | 1991 | 15 | Galicia | 16-64 | 7V/8M | Dolor abdominal (6) Pérdida de peso, astenia (3) Dolor hipocondrio derecho (2) Fiebre (1) Asintomáticos (3) | Sí (14/15) |
| López-Rosés et al.142 | 1993 | 1 | Galicia | 46 | M | Fiebre, dolor abdominal, ictericia, orinas oscuras, vómitos | No |
| Arjona et al.143 | 1995 | 20 | Cantabria | 11-62 | 14V/6M | Dolor abdominal (13) Fiebre (12) Pérdida de peso (7) | Sí (19/20) |
| Gómez Cerezo et al.144 | 1998 | 1 | Castilla y León | 67 | M | Fiebre, artralgias, urticaria | Sí (2.860/μl) |
| Segado Soriano et al.145 | 1998 | 3 | Madrid | 34/39/48 | 1V 2M | Dolor hipocondrio derecho, fiebre | Sí (2.700-17.043/μl) |
| López-Vélez et al.146 | 1999 | 6 | Madrid | 24-53 | 2V/4M | Fiebre y dolor abdominal | Sí (1.440-14.400/μl) |
| Pérez et al.147 | 2000 | 1 | Navarra | 53 | M | Paniculitis eosinofílica | Sí (20.300/μL) |
| Núñez Fernández et al.148 | 2001 | 2 | Galicia | 48 43 | M V | Fiebre y dolor abdominal Asintomático | 8.100/μl 15.900/μl |
| Cosme et al.149 | 2001 | 37 | País Vasco | 19-71 | 23V/14M | Fase aguda (32) Fase crónica (5) | Sí (34/37) |
| Cilla et al.150 | 2001 | 61 | País Vasco | 20-81 | 34V/27M | Fiebre, dolor abdominal, hepatomegalia | Sí |
| González-Llorente et al.151 | 2002 | 1 | Castilla y León | 47 | M | Dolor abdominal | Sí (11%) |
| Cosme et al.152 | 2003 | 7 | País Vasco | 29-69 | 4V/3M | Fiebre, hepatomegalia, pérdida de peso | Sí |
| Cirera et al.153 | 2004 | 1 | Cataluña | 66 | M | Síndrome constitucional | 5.100/μl |
| Echenique-Elizondo et al.154 | 2005 | 1 | País Vasco | 31 | M | Dolor abdominal | No definido |
La paragonimosis, producida por diferentes especies de Paragonimus, es una trematodosis poco frecuente en España y siempre ha sido diagnosticada como enfermedad importada (2 pacientes de Guinea Ecuatorial y uno de Ecuador)155-157. Las manifestaciones clínicas más usuales son las respiratorias, que simulan una tuberculosis, enfermedad con la que también se asocia con frecuencia. Es muy habitual encontrar eosinofilia en los pacientes con paragonimosis.
Las infecciones por duelas orientales (Opisthorchis spp., Clonorchis spp., Metagonimus spp. o Heterophyes spp.) son excepcionales en España, con la descripción de un único caso en un inmigrante del sudeste asiático158.
Para finalizar este apartado debemos señalar la presencia de falsas parasitaciones por Dicrocoelium dendriticum en inmigrantes (eliminación de huevos en las heces sin ocasionar enfermedad). Este trematodo que parasita las vías biliares de herbívoros puede ocasionar enfermedad en humanos, aunque lo más frecuente es la expulsión de huevos por las heces tras la ingesta de hígado crudo de animales infectados. Los casos descritos en España corresponden principalmente a personas de origen subsahariano y, de forma más infrecuente, a magrebíes159-161.
NematodosisLas nematodosis son helmintosis producidas por parásitos del phylum Nematoda, caracterizados por la forma cilíndrica de los vermes y la presencia de dimorfismo sexual. Desde un punto de vista clínico, pueden clasificarse en 3 grandes grupos: intestinales, hemático/dermo/oculares (filariosis) y tisulares (tabla 7).
Principales nematodosis en España
| Tipo | Género | Especie/s principal/es | Patrón epidemiológico | Enfermedad |
|---|---|---|---|---|
| Intestinales | Enterobius | E vermicularis | Cosmopolita | Enterobiosis |
| Trichuris | T. trichiura | Importada | Tricurosis | |
| Ascaris | A. lumbricoides | Importada | Ascariosis | |
| Ancylostoma | A. duodenale | Importada | Uncinariosis | |
| Necator | N. americanus | Importada | ||
| Strongyloides | S. stercoralis | Cosmopolita | Estrongiloidosis | |
| Capillaria | C. philipinensis | Importada | Capilariosis | |
| Filariosis | Loa | L. loa | Importada | Loaosis |
| Onchocerca | O. volvulus | Importada | Oncocercosis | |
| Mansonella | M. perstans | Importada | Mansonelosis | |
| Dirofilaria | D. immitis | Autóctona | Dirofilariosis | |
| Trichinella | T. spiralis T. britovi | Cosmopolita | Triquinelosis | |
| Anisakis | A. simplex | Cosmopolita | Anisakidosis | |
| Tisulares | Trichinella | |||
| Toxocara | T. canis T. cati | Cosmopolita | Toxocarosis | |
| Gnathostoma | G. spinigerum | Importada | Gnatostomosis |
La parasitación por Enterobius vermicularis es una de las helmintosis más frecuentes. Sin embargo, las referencias en la literatura española, sobre todo la reciente, son escasas y a menudo discrepantes3,4,131,132,162-167. Los primeros aspectos a considerar en las diferencias de prevalencia descritas son el diseño del estudio y el ámbito del mismo. Así, en Gran Canaria, en un trabajo basado en los datos parasitológicos de todos los centros sanitarios durante un año, la enterobiosis suponía aproximadamente un tercio de los casos (31,5%; 301/957)3. Por otro lado, la prevalencia de esta parasitación depende de si el estudio se realiza en personas asintomáticas162-164 o en presencia de síntomas165. Un segundo aspecto de interés es el claro predominio de infectados en la edad pediátrica, dato que puede ser variable en función de la región geográfica (31,5% en Gran Canaria, 20,4% en el valle del Guadalquivir, 10,8% en Valencia y 1,34% en Cuenca)3,162,163. En todas las series descritas es habitual la coparasitación con otros nematodos y/o protozoos intestinales. Existen pocos datos de esta infección en inmigrantes, siendo más frecuente en niños inmigrantes magrebíes3,4 y excepcional en niños130,131,166 y adultos subsaharianos167. Además de las razones patogénicas, la baja detección de casos puede estar relacionada con la ausencia de empleo del «test de Graham» de manera sistemática165. En general, la enterobiosis es una enfermedad de escasa importancia, caracterizada por prurito anal y/o genital. Sin embargo, se han descrito algunas complicaciones como la colitis eosinofílica (relacionada con las larvas del parásito) o la disminución de la concentración sérica de metales (cobre, cinc y magnesio)168. Finalmente, la eosinofilia es leve o no existe en la mayor parte de los casos, con excepción de las formas invasivas.
Las nematodosis intestinales clásicas están producidas por uncinarias (Ancylostoma duodenale, Necator americanus), Ascaris lumbricoides y Trichuris spp. (principalmente Trichuris trichiura y excepcionalmente Trichuris vulpis)169. Estas enfermedades estuvieron bien representadas en toda la geografía española en otra época, pero en la actualidad su incidencia ha disminuido significativamente gracias a las mejoras higienicosanitarias logradas170. Por ello, excepto casos aislados, habitualmente en personas de edad avanzada, estas enfermedades aparecen en inmigrantes. El análisis de los casos publicados en los últimos 25años en España171-183 permite realizar algunas generalizaciones: 1)En las series en las que se ha estudiado este tipo de parasitosis en adultos, la mayor parte de los casos corresponden a uncinarias, seguidos de Trichuris spp. y A.lumbricoides3,113,118,133,167, invirtiéndose este patrón en las series infantiles166. 2)La mayor parte de los casos corresponden a inmigrantes procedentes de África subsahariana, aunque también se han descrito en pacientes originarios de Latinoamérica130,172,176,181,182 y Asia179. 3)Es muy frecuente la coparasitación entre los nematodos intestinales clásicos173, así como con otros helmintos y protozoos108,115,121. 4)Las manifestaciones clínicas son muy variables e incluyen un número importante de casos asintomáticos2,178, asociados o no a eosinofilia absoluta113,133 o relativa118, molestias abdominales inespecíficas178 o datos «clásicos» de la enfermedad. Estos últimos constituyen la forma menos frecuente de infección por nematodos intestinales, aunque se encuentran sobrerrepresentados en la literatura. En este sentido se ha publicado un caso de infección por Trichuris spp. con un pólipo rectal121, varios casos de anemia ferropénica en las infecciones por uncinarias172,175,178-180,184 y complicaciones locales o sistémicas en la infección por A.lumbricoides (p.ej., obstrucción intestinal182, obstrucción biliar/masa pancreática174,181,183,185, síndrome de Löffler176 o eliminación del gusano adulto177). 5)La detección de eosinofilia y el grado de la misma es muy variable, aunque, como regla general, se detecta en aproximadamente la mitad de los casos y, en estos, es leve o moderada.
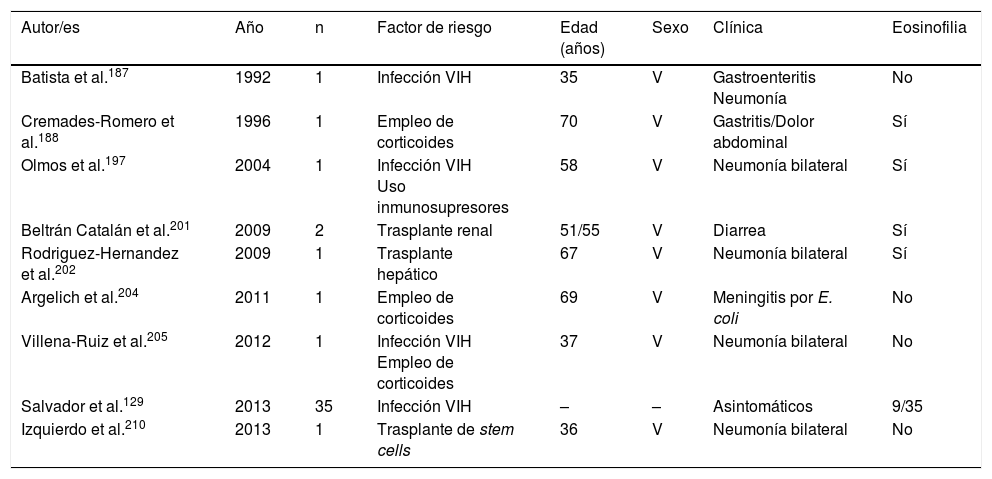
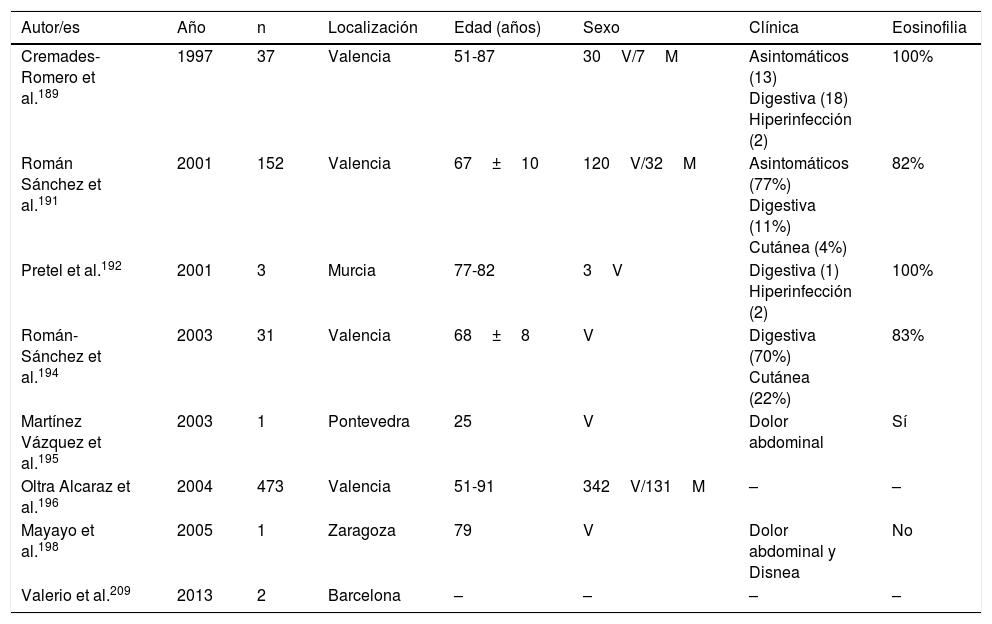
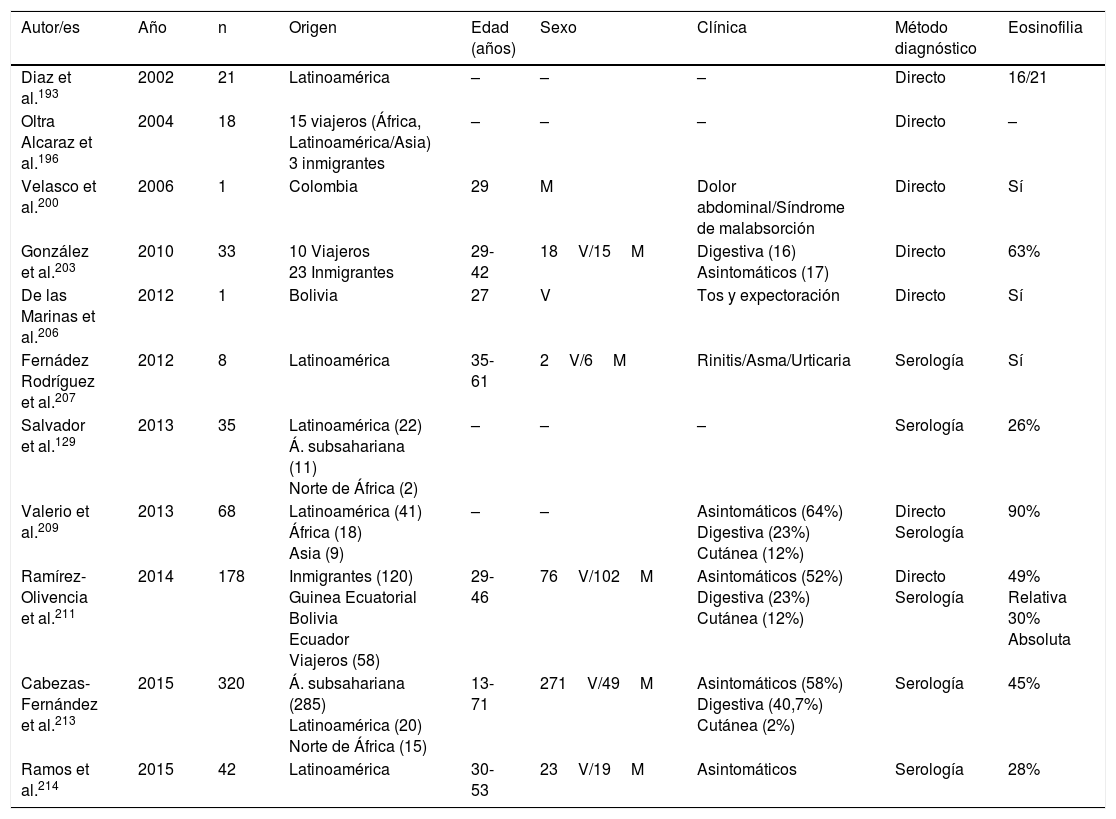
La estrongiloidosis es una enfermedad parasitaria muy importante en España. El análisis de los casos aislados y series de pacientes presenta varias características de interés129,186-205,207-213. La primera consideración a realizar es la dificultad de llevar a cabo el diagnóstico exacto de la nematodosis. En este sentido, el estudio coproparasitológico clásico detecta una mínima proporción de los casos3,132,167, cifra que se incrementa al emplear técnicas más específicas (p.ej., la prueba de concentración de Baermann, la técnica de Harada-Mori y el cultivo en placa de agar de Koga). Sin embargo, en varias series españolas de estrongiloidosis se basan en el diagnóstico serológico, con las limitaciones inherentes a esta técnica133,211. La estrongiloidosis en España es una enfermedad que afecta principalmente a adultos, aunque existen casos aislados en niños199. Un aspecto esencial en la estrongiloidosis es la diferenciación de las manifestaciones clínicas entre los pacientes inmunocompetentes e inmunodeprimidos. En la persona inmunocompetente, esta nematodosis es habitualmente asintomática o cursa con uno o varios de los datos de la triada eosinofilia-diarrea-lesión cutánea. Sin embargo, en el paciente inmunodeprimido desaparece la eosinofilia y pueden presentarse manifestaciones sistémicas graves, como la infección sistémica por microorganismos intestinales vehiculados por Strongyloides. Tiene interés señalar que las principales formas de inmunodepresión asociadas a síndrome de hiperinfección corresponden al uso de corticosteroides y otros inmunodepresores, mientras que la asociación con infección por VIH es poco frecuente y en muchas ocasiones ligada a otros factores de riesgo (p.ej., corticoides o infección por HTLV-I)208 (tabla 8). Desde un punto de vista epidemiológico, en España existen 2 patrones de estrongiloidosis: las formas autóctonas y las importadas. En la actualidad, la estrongiloidosis sigue siendo una enfermedad autóctona, por lo que debe incluirse en el diagnóstico diferencial de cualquier paciente con manifestaciones digestivas o «alérgicas» (tabla 9). Sin embargo, la mayor parte de casos son esporádicos195,198,209, con la excepción de una zona concreta de Valencia (Gandía y Oliva), en la que se produce una acumulación de pacientes con un perfil bien definido: varones adultos con historia profesional compatible189,191,194,215. Sin embargo, la estrongiloidosis importada es una enfermedad descrita principalmente en inmigrantes, y excepcionalmente en viajeros203,212 (tabla 10). A diferencia de otras helmintosis importadas, en las que predomina el origen subsahariano, un número importante de casos de estrongiloidosis proceden de Latinoamérica129,193,196,200,206,208,212–214. La mayor parte de los casos son asintomáticos, por lo que parece razonable incluir esta enfermedad en el cribado de los inmigrantes de las zonas geográficas mencionadas. En el resto de casos, las manifestaciones habituales son digestivas y, en menor medida, cutáneas. Cabe señalar la detección de algunos casos en pacientes con manifestaciones alérgicas206,207, sobre todo de origen latinoamericano, ya que el empleo de corticoides en este contexto podría dar lugar a un síndrome de hiperinfección. La eosinofilia en los pacientes inmunocompetentes (autóctonos o inmigrantes) es muy variable (tablas 9 y 10).
Estrongiloidosis y factores de riesgo
| Autor/es | Año | n | Factor de riesgo | Edad (años) | Sexo | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|
| Batista et al.187 | 1992 | 1 | Infección VIH | 35 | V | Gastroenteritis Neumonía | No |
| Cremades-Romero et al.188 | 1996 | 1 | Empleo de corticoides | 70 | V | Gastritis/Dolor abdominal | Sí |
| Olmos et al.197 | 2004 | 1 | Infección VIH Uso inmunosupresores | 58 | V | Neumonía bilateral | Sí |
| Beltrán Catalán et al.201 | 2009 | 2 | Trasplante renal | 51/55 | V | Diarrea | Sí |
| Rodriguez-Hernandez et al.202 | 2009 | 1 | Trasplante hepático | 67 | V | Neumonía bilateral | Sí |
| Argelich et al.204 | 2011 | 1 | Empleo de corticoides | 69 | V | Meningitis por E. coli | No |
| Villena-Ruiz et al.205 | 2012 | 1 | Infección VIH Empleo de corticoides | 37 | V | Neumonía bilateral | No |
| Salvador et al.129 | 2013 | 35 | Infección VIH | – | – | Asintomáticos | 9/35 |
| Izquierdo et al.210 | 2013 | 1 | Trasplante de stem cells | 36 | V | Neumonía bilateral | No |
M: mujer; V: varón; –: no datos.
Estrongiloidosis autóctona en España
| Autor/es | Año | n | Localización | Edad (años) | Sexo | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|
| Cremades-Romero et al.189 | 1997 | 37 | Valencia | 51-87 | 30V/7M | Asintomáticos (13) Digestiva (18) Hiperinfección (2) | 100% |
| Román Sánchez et al.191 | 2001 | 152 | Valencia | 67±10 | 120V/32M | Asintomáticos (77%) Digestiva (11%) Cutánea (4%) | 82% |
| Pretel et al.192 | 2001 | 3 | Murcia | 77-82 | 3V | Digestiva (1) Hiperinfección (2) | 100% |
| Román-Sánchez et al.194 | 2003 | 31 | Valencia | 68±8 | V | Digestiva (70%) Cutánea (22%) | 83% |
| Martínez Vázquez et al.195 | 2003 | 1 | Pontevedra | 25 | V | Dolor abdominal | Sí |
| Oltra Alcaraz et al.196 | 2004 | 473 | Valencia | 51-91 | 342V/131M | – | – |
| Mayayo et al.198 | 2005 | 1 | Zaragoza | 79 | V | Dolor abdominal y Disnea | No |
| Valerio et al.209 | 2013 | 2 | Barcelona | – | – | – | – |
M: mujer; V: varón; –: no datos.
Estrongiloidosis importada en España
| Autor/es | Año | n | Origen | Edad (años) | Sexo | Clínica | Método diagnóstico | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Diaz et al.193 | 2002 | 21 | Latinoamérica | – | – | – | Directo | 16/21 |
| Oltra Alcaraz et al.196 | 2004 | 18 | 15 viajeros (África, Latinoamérica/Asia) 3 inmigrantes | – | – | – | Directo | – |
| Velasco et al.200 | 2006 | 1 | Colombia | 29 | M | Dolor abdominal/Síndrome de malabsorción | Directo | Sí |
| González et al.203 | 2010 | 33 | 10 Viajeros 23 Inmigrantes | 29-42 | 18V/15M | Digestiva (16) Asintomáticos (17) | Directo | 63% |
| De las Marinas et al.206 | 2012 | 1 | Bolivia | 27 | V | Tos y expectoración | Directo | Sí |
| Fernádez Rodríguez et al.207 | 2012 | 8 | Latinoamérica | 35-61 | 2V/6M | Rinitis/Asma/Urticaria | Serología | Sí |
| Salvador et al.129 | 2013 | 35 | Latinoamérica (22) Á. subsahariana (11) Norte de África (2) | – | – | – | Serología | 26% |
| Valerio et al.209 | 2013 | 68 | Latinoamérica (41) África (18) Asia (9) | – | – | Asintomáticos (64%) Digestiva (23%) Cutánea (12%) | Directo Serología | 90% |
| Ramírez-Olivencia et al.211 | 2014 | 178 | Inmigrantes (120) Guinea Ecuatorial Bolivia Ecuador Viajeros (58) | 29-46 | 76V/102M | Asintomáticos (52%) Digestiva (23%) Cutánea (12%) | Directo Serología | 49% Relativa 30% Absoluta |
| Cabezas-Fernández et al.213 | 2015 | 320 | Á. subsahariana (285) Latinoamérica (20) Norte de África (15) | 13-71 | 271V/49M | Asintomáticos (58%) Digestiva (40,7%) Cutánea (2%) | Serología | 45% |
| Ramos et al.214 | 2015 | 42 | Latinoamérica | 30-53 | 23V/19M | Asintomáticos | Serología | 28% |
M: mujer; V: varón; –: no datos.
Únicamente hemos encontrado una referencia bibliográfica en la literatura española acerca de la infección por Capillaria philipinensis216. Esta enfermedad no está limitada a Filipinas, sino que también aparece en países de Extremo Oriente, Oriente Medio o Sudamérica, por lo que es posible la detección de casos importados. La capilarosis cursa, en general, como un proceso diarreico con vómitos, aunque en pacientes enfermos sin tratamiento durante varios meses puede conducir a la muerte debido a la pérdida de electrólitos, o por la sepsis asociada a infección bacteriana secundaria (procesos de autoinfección).
FilariosisLas filariosis en España presentan 2 patrones diferentes: las formas autóctonas (de distribución cosmopolita), en las que no aparecen microfilarias, y las formas importadas, caracterizadas por la presencia de microfilarias en sangre, piel o globo ocular.
Las formas cosmopolitas están ocasionadas principalmente por 2 especies de Dirofilaria (Dirofilaria immitis y Dirofilaria repens)217-220. En España, las 2 zonas geográficas en las que se han descrito esta parasitosis son Salamanca y Gran Canaria. La forma más frecuente de infección es la transmisión vectorial por diferentes especies de mosquitos (Aedes spp., Anopheles spp. y Culex spp.) desde mamíferos infectados (principalmente perros). La infección tiene lugar por vermes inmaduros, en general es asintomática y ocasionalmente se presentan nódulos subcutáneos, pulmonares (persistentes o transitorios) y oculares. La eosinofilia es excepcional en estos casos.
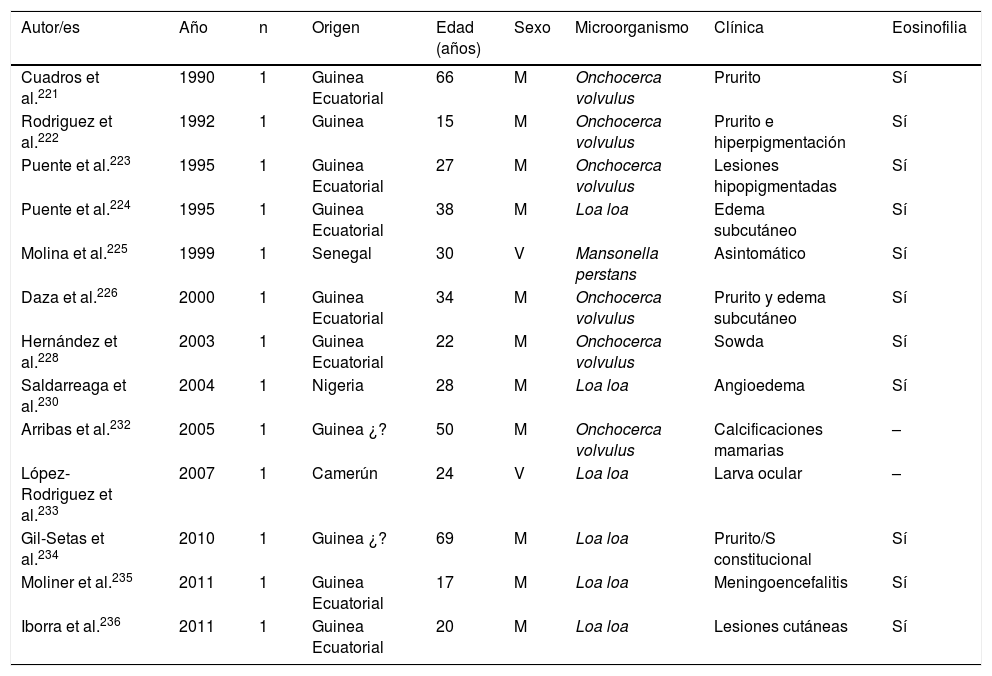
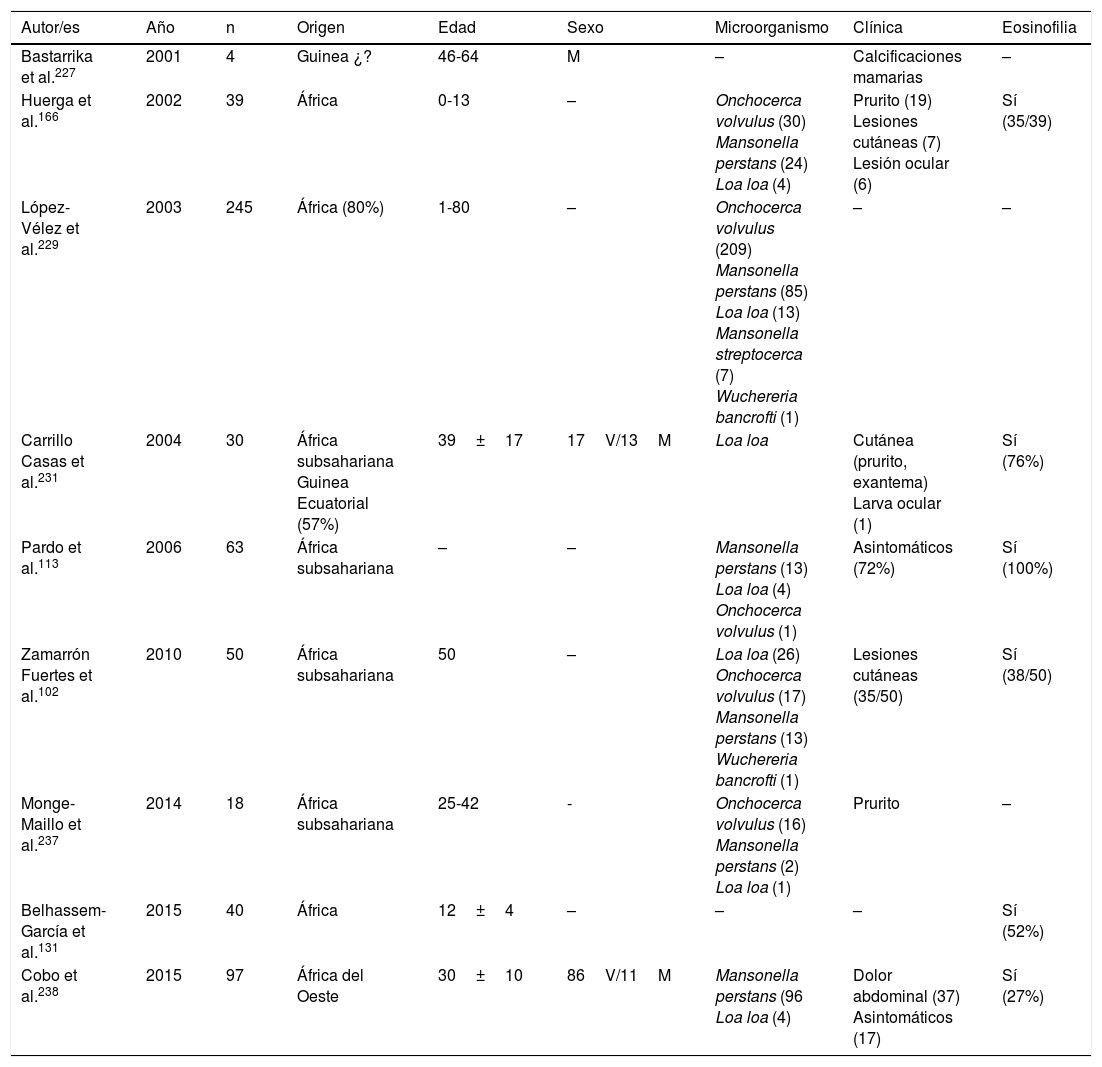
Las filariosis asociadas con la presencia de microfilarias en sangre o tejidos son en todos los casos enfermedades importadas en España102,113,131,166,221–238. Prácticamente todos ellos se describen en pacientes africanos, especialmente subsaharianos y con un claro predominio en África del Oeste (principalmente Guinea Ecuatorial). Los casos importados corresponden en su mayoría a inmigrantes, aunque también se han descrito en viajeros102,237. El análisis de los casos publicados (tablas 11 y 12) no demuestra diferencias significativas en la edad de detección (1-80años) ni en el sexo de los pacientes. Las 3 filariosis importadas principales son la mansonelosis por Mansonella perstans, la loaosis por Loa loa y la oncocercosis por Onchocerca volvulus. La detección de Wuchereria bancrofti y Mansonella streptocerca es anecdótica229, y no existen casos publicados de infecciones por Brugia malayi, Brugia timori o Mansonella ozzardi. Estos datos deben ser matizados por las dificultades en el diagnóstico de estas nematodosis. Así, los estudios parasitológicos directos (frotis sanguíneo y/o test de Knott para la detección de microfilaremia, o «pellizcos cutáneos» en la infección por O.volvulus y M.streptocerca) son muy específicos, pero presentan una limitada sensibilidad. Por otro lado, las técnicas serológicas son muy sensibles pero tienen las limitaciones inherentes a ellas (p.ej., reacciones cruzadas con otros helmintos, no diferenciar infecciones activas/pasadas, etc.). De hecho, el empleo de técnicas de biología molecular permite la detección de un número importante de casos de loaosis no diagnosticados por técnicas clásicas239,240. Por otro lado, la evolución temporal de las filariosis importadas presenta un patrón claro, con un número progresivamente menor de casos de oncocercosis (muy posiblemente relacionado por las medidas de control en países endémicos, como Guinea Ecuatorial) y un número progresivamente mayor de casos de mansonelosis (posiblemente ligado al cribado de estas entidades en inmigrantes). Las manifestaciones clínicas son muy variables, con un número importante de casos asintomáticos. En los casos sintomáticos, las manifestaciones son las habituales de estas nematodosis: cutáneas (p.ej., prurito, exantema, nódulos) y oculares. En este sentido, tiene interés señalar la presencia de manifestaciones atípicas, como las calcificaciones mamarias227,232. La presencia de eosinofilia es muy frecuente, aunque su ausencia no excluye el diagnóstico.
Filariosis importada en España (casos)
| Autor/es | Año | n | Origen | Edad (años) | Sexo | Microorganismo | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Cuadros et al.221 | 1990 | 1 | Guinea Ecuatorial | 66 | M | Onchocerca volvulus | Prurito | Sí |
| Rodriguez et al.222 | 1992 | 1 | Guinea | 15 | M | Onchocerca volvulus | Prurito e hiperpigmentación | Sí |
| Puente et al.223 | 1995 | 1 | Guinea Ecuatorial | 27 | M | Onchocerca volvulus | Lesiones hipopigmentadas | Sí |
| Puente et al.224 | 1995 | 1 | Guinea Ecuatorial | 38 | M | Loa loa | Edema subcutáneo | Sí |
| Molina et al.225 | 1999 | 1 | Senegal | 30 | V | Mansonella perstans | Asintomático | Sí |
| Daza et al.226 | 2000 | 1 | Guinea Ecuatorial | 34 | M | Onchocerca volvulus | Prurito y edema subcutáneo | Sí |
| Hernández et al.228 | 2003 | 1 | Guinea Ecuatorial | 22 | M | Onchocerca volvulus | Sowda | Sí |
| Saldarreaga et al.230 | 2004 | 1 | Nigeria | 28 | M | Loa loa | Angioedema | Sí |
| Arribas et al.232 | 2005 | 1 | Guinea ¿? | 50 | M | Onchocerca volvulus | Calcificaciones mamarias | – |
| López-Rodriguez et al.233 | 2007 | 1 | Camerún | 24 | V | Loa loa | Larva ocular | – |
| Gil-Setas et al.234 | 2010 | 1 | Guinea ¿? | 69 | M | Loa loa | Prurito/S constitucional | Sí |
| Moliner et al.235 | 2011 | 1 | Guinea Ecuatorial | 17 | M | Loa loa | Meningoencefalitis | Sí |
| Iborra et al.236 | 2011 | 1 | Guinea Ecuatorial | 20 | M | Loa loa | Lesiones cutáneas | Sí |
M: mujer; V: varón; –: no datos.
Filariosis importada en España (series)
| Autor/es | Año | n | Origen | Edad | Sexo | Microorganismo | Clínica | Eosinofilia |
|---|---|---|---|---|---|---|---|---|
| Bastarrika et al.227 | 2001 | 4 | Guinea ¿? | 46-64 | M | – | Calcificaciones mamarias | – |
| Huerga et al.166 | 2002 | 39 | África | 0-13 | – | Onchocerca volvulus (30) Mansonella perstans (24) Loa loa (4) | Prurito (19) Lesiones cutáneas (7) Lesión ocular (6) | Sí (35/39) |
| López-Vélez et al.229 | 2003 | 245 | África (80%) | 1-80 | – | Onchocerca volvulus (209) Mansonella perstans (85) Loa loa (13) Mansonella streptocerca (7) Wuchereria bancrofti (1) | – | – |
| Carrillo Casas et al.231 | 2004 | 30 | África subsahariana Guinea Ecuatorial (57%) | 39±17 | 17V/13M | Loa loa | Cutánea (prurito, exantema) Larva ocular (1) | Sí (76%) |
| Pardo et al.113 | 2006 | 63 | África subsahariana | – | – | Mansonella perstans (13) Loa loa (4) Onchocerca volvulus (1) | Asintomáticos (72%) | Sí (100%) |
| Zamarrón Fuertes et al.102 | 2010 | 50 | África subsahariana | 50 | – | Loa loa (26) Onchocerca volvulus (17) Mansonella perstans (13) Wuchereria bancrofti (1) | Lesiones cutáneas (35/50) | Sí (38/50) |
| Monge-Maillo et al.237 | 2014 | 18 | África subsahariana | 25-42 | - | Onchocerca volvulus (16) Mansonella perstans (2) Loa loa (1) | Prurito | – |
| Belhassem-García et al.131 | 2015 | 40 | África | 12±4 | – | – | – | Sí (52%) |
| Cobo et al.238 | 2015 | 97 | África del Oeste | 30±10 | 86V/11M | Mansonella perstans (96 Loa loa (4) | Dolor abdominal (37) Asintomáticos (17) | Sí (27%) |
M: mujer; V: varón; –: no datos.
Las 4 nematodosis tisulares principales descritas en España son: la triquinelosis, la anisakidosis, la toxocarosis y la gnatostomosis.
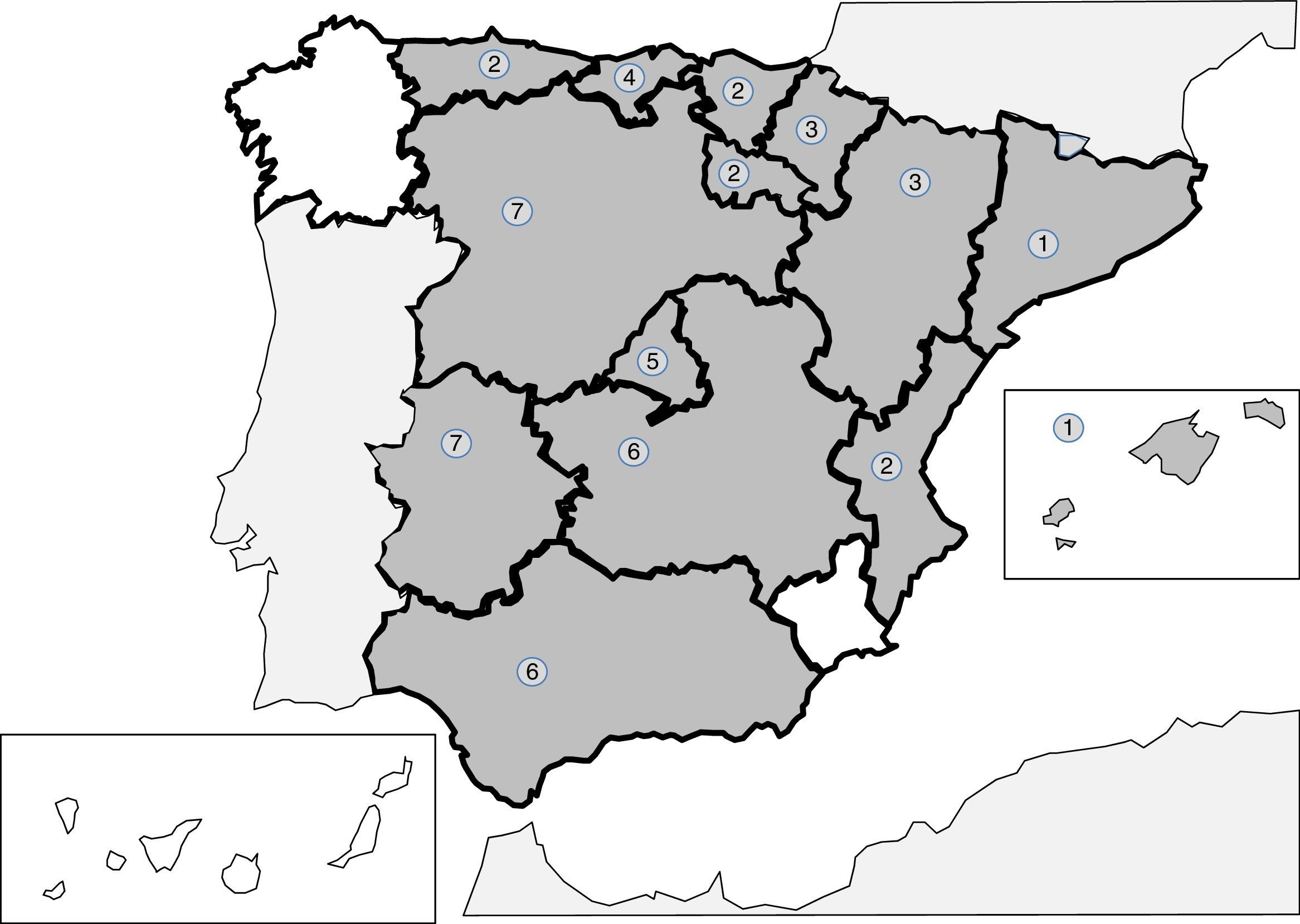
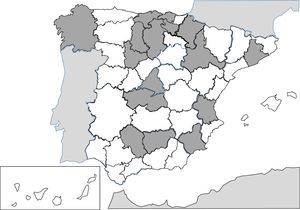
Las infecciones producidas por nematodos tisulares del género Trichinella son parasitosis autóctonas, bien referidas en la literatura española, y resulta excepcional su descripción como patología importada241-256. Las 2 especies principales implicadas en los casos clínicos descritos en España son Trichinella spiralis y Trichinella britovi. La forma habitual de contagio es la ingesta de carne cruda o poco cocinada de cerdos y jabalíes infectados, lo que implica que los casos publicados se agrupen en forma de brotes. Tras el control del ciclo doméstico en nuestro territorio (cerdos), los animales salvajes, como jabalíes, han sido el origen de la mayor parte de los brotes recientes. De cualquier forma, la incidencia de casos de esta parasitosis es cada vez menor, probablemente por la vigilancia veterinaria previa al consumo de carne de caza. Los principales brotes (indicados en la fig. 2) se concentran en 5 áreas montañosas: 1)cordillera Cantábrica y área pirenaica; 2)cordillera Ibérica; 3)cordillera Central; 4)Montes de Toledo, y 5)cordillera Bética. En los últimos 25años no hay casos autóctonos descritos en Galicia, Murcia o la Comunidad Canaria. Las manifestaciones clínicas de la enfermedad se deben a la invasión tisular por el parásito y a la respuesta inmunológica que se desencadena. Las formas agudas incluyen, en proporción variable en cada brote, los siguientes datos: mialgias, fiebre, exantema, diarrea y edema palpebral. También se han descrito casos de formas atípicas, como la calcificación de la musculatura torácica254. La eosinofilia y la elevación de creatinina quinasa son datos de laboratorio habituales en los casos descritos.
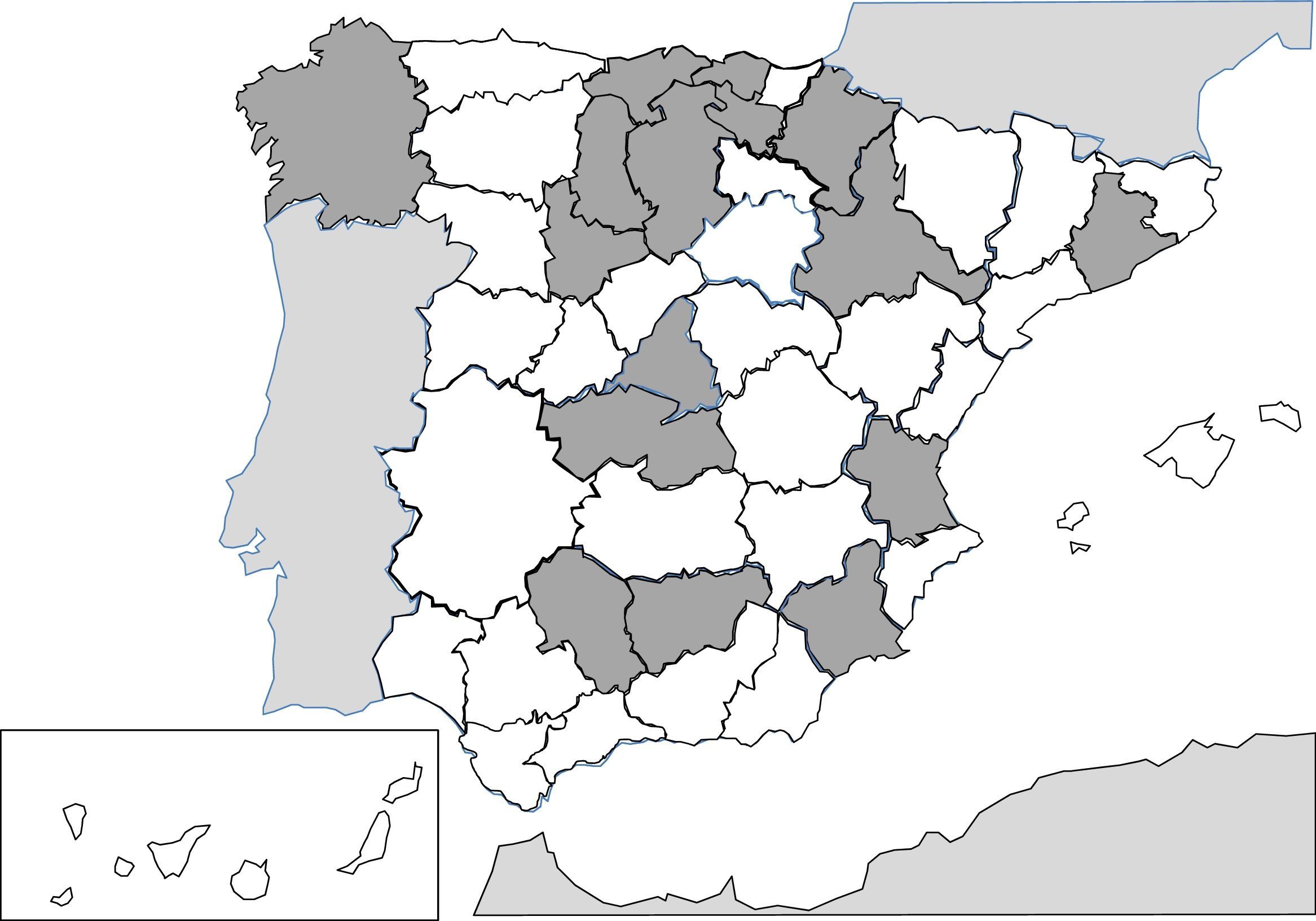
Desde 1991, la descripción de casos aislados y series clínicas de anisakidosis es constante en nuestro país257-287. La afectación del ser humano se produce por la ingesta de pescado fresco, crudo o poco cocinado (p.ej., microondas268), siendo el antecedente epidemiológico más frecuente el consumo de boquerones y, en algunos casos, de cebiche284. La práctica totalidad de casos corresponden a infecciones adquiridas de forma autóctona y se describen en la mayor parte de las comunidades autónomas, principalmente en la franja central de la Península (fig. 3). Los agentes causales más frecuentes son nematodos del género Anisakis (especialmente Anisakis simplex) y en menor medida Pseudoterranova decipiens258. Las consecuencias patológicas de la infección por estos nematodos se manifiestan por 3 patrones diferentes: digestivos, alérgicos o mixtos. Las formas digestivas pueden afectar a varios tramos del mismo, destacando la afección de la región gastroduodenal y la región ileal, ciego y colon. Las manifestaciones clínicas dependen de 2 mecanismos complementarios: la agresión directa por el nematodo y la respuesta de hipersensibilidad local al mismo. En la afectación del tracto digestivo superior las manifestaciones clínicas habituales son un dolor epigástrico agudo tras la ingesta de pescado, frecuentemente asociado a manifestaciones alérgicas. Sin embargo, cuando está involucrado el tracto digestivo bajo se presentan cuadros de dolor abdominal con características indistinguibles de una apendicitis aguda o una obstrucción intestinal. También se han descrito otras manifestaciones atípicas, como la rotura esplénica286 o la aparición de masa abdominal271. Las manifestaciones alérgicas son muy variables, tanto en su asociación con la clínica intestinal, como en su gravedad (desde formas cutáneas simples a anafilaxia)260,261,284. Otras manifestaciones inhabituales de hipersensibilidad a estos nematodos, descritas en nuestro país, son la aparición de un síndrome nefrótico281 y la gingivoestomatitis277. La eosinofilia es un hallazgo inconstante en esta parasitosis (4-41%), y depende de las formas clínicas mencionadas.
Los datos acerca de la toxocarosis, producida por Toxocara spp., en España son escasos y complejos de interpretar287-295. Así, los estudios de seroprevalencia de esta infección, realizados en la década de los noventa en algunas zonas del país, demuestran una elevada tasa de positividad, con cifras de hasta el 66% en niños de clases económicas bajas en Guipúzcoa, el 3,4% en la población general en la Comunidad Canaria y entre el 17 y el 32% en Galicia288,292. Estos datos deben ser matizados, ya que el diagnóstico etiológico de toxocarosis se basa en la serología, metodología que muestra reactividad cruzada con otros nematodos como Anisakis spp.294. Los escasos casos clínicos de toxocarosis descritos se corresponden tanto a formas importadas295 como autóctonas y, dentro de estas últimas, a toxocarosis ocular290 y a larva migrans visceral289. En los casos con manifestaciones viscerales es usual la presencia de eosinofilia291.
Finalmente, la gnatostomosis, producida principalmente por Gnathostoma spinigerum, es una nematodosis tisular poco frecuente, aunque descrita ocasionalmente en España296-300. Esta helmintosis aparece como consecuencia del consumo de alimentos (p.ej., pescado crudo, ranas, serpientes) y se manifiesta, de forma habitual, por lesiones cutáneas (similares a la larva cutánea migrans) y, en casos graves, por una mielorradiculitis o una radiculomielo-meningoencefalitis298,299. En general, es una enfermedad importada tras viajes a Latinoamérica297,298 y Asia (Sudeste Asiático y China)297,298,300, aunque también se han diagnosticado 2 casos autóctonos en mujeres de Granada que no habían realizado viajes a los trópicos296.
ConclusionesEn resumen, las helmintosis (autóctonas o importadas, en viajeros o inmigrantes, con o sin inmunosupresión) es un problema importante en la población española tanto en lo que respecta a su prevalencia como a las consecuencias médicas. La asociación con eosinofilia (absoluta o relativa) presenta una gran variabilidad dependiendo de múltiples factores. Por ello, el conocimiento de la situación actual puede facilitar el diagnóstico etiológico de las helmintosis, lo que conlleva una actitud terapéutica adecuada, evitando actitudes «empíricas» que puede ser insuficientes, inadecuadas e incluso perjudiciales301.
FinanciaciónLos autores declaran no haber recibido financiación para la redacción de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.