La encefalitis es una urgencia que causa déficits neurológicos, neuropsiquiátricos, discapacidad y muerte. Las etiologías más comunes son infecciosas, postinfecciosas, autoinmunes y paraneoplásicas1. La incidencia es 5-8/100.000 personas. Produce cambios en nivel de conciencia y comportamentales, fiebre, convulsiones, trastornos del movimiento o focalizaciones1.
En 2020 comenzó la pandemia por COVID-19, en 2021 se desarrollaron vacunas para disminuir su mortalidad y gravedad. Los ensayos informaron tasas de eficacia del 94-95% después de 2 dosis, con pocos efectos secundarios2. Según la Agencia Europea de Medicamentos, las complicaciones neurológicas graves son raras (<0,1%). Se han informado casos de trombosis de senos venosos, parálisis facial, síndrome de Guillain-Barré, encefalitis y mielitis transversa después de la vacuna2.
Un estudio prospectivo realizado en Alemania documentó trombosis de senos venosos asociada a trombocitopenia trombótica inmune (n=3), enfermedades desmielinizantes (n=8), polineuropatía inflamatoria (n=4), miositis (n=3), asociados a vacunación SARS-CoV-2 en un tiempo menor a 6 semanas y sin otro desencadenante. Los pacientes eran predominantemente mujeres (proporción 3,2:1) y la mediana de edad fue 50 años3.
Se presenta el caso de una mujer con alteraciones comportamentales, cognitivas rápidamente progresivas y estatus epiléptico convulsivo después de la segunda dosis de vacuna Moderna (mRNA-1273).
Paciente de 36 años, con hipotiroidismo, recibió segunda dosis de vacunación Moderna. Al día 3 posvacunación presentó astenia, fiebre, cefalea; al día 7 confusión, desorientación temporoespacial, vómito y convulsiones tónico-clónicas generalizadas.
Al ingreso, confusa, sin focalización neurológica, se sospechó neuroinfección, se realizaron estudios y se inició cubrimiento con ceftriaxona, vancomicina y aciclovir; en urgencias desarrolló status epiléptico convulsivo manejado con ácido valproico y levetiracetam, se realizó intubación orotraqueal y se trasladó a unidad de cuidados intensivos.
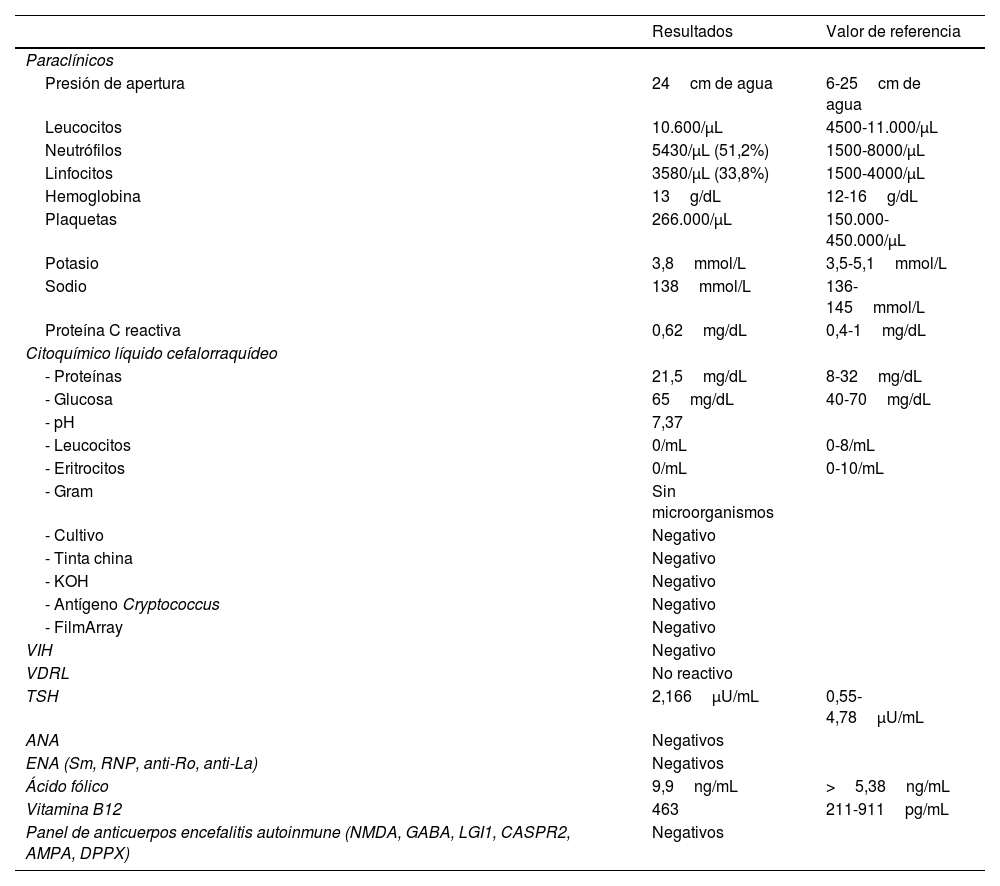
Los paraclínicos iniciales no tuvieron alteraciones relevantes (tabla 1), tomografía de cráneo con hipodensidad en polo temporal izquierdo.
Paraclínicos y estudios iniciales en suero y líquido cefalorraquídeo
| Resultados | Valor de referencia | |
|---|---|---|
| Paraclínicos | ||
| Presión de apertura | 24cm de agua | 6-25cm de agua |
| Leucocitos | 10.600/μL | 4500-11.000/μL |
| Neutrófilos | 5430/μL (51,2%) | 1500-8000/μL |
| Linfocitos | 3580/μL (33,8%) | 1500-4000/μL |
| Hemoglobina | 13g/dL | 12-16g/dL |
| Plaquetas | 266.000/μL | 150.000-450.000/μL |
| Potasio | 3,8mmol/L | 3,5-5,1mmol/L |
| Sodio | 138mmol/L | 136-145mmol/L |
| Proteína C reactiva | 0,62mg/dL | 0,4-1mg/dL |
| Citoquímico líquido cefalorraquídeo | ||
| - Proteínas | 21,5mg/dL | 8-32mg/dL |
| - Glucosa | 65mg/dL | 40-70mg/dL |
| - pH | 7,37 | |
| - Leucocitos | 0/mL | 0-8/mL |
| - Eritrocitos | 0/mL | 0-10/mL |
| - Gram | Sin microorganismos | |
| - Cultivo | Negativo | |
| - Tinta china | Negativo | |
| - KOH | Negativo | |
| - Antígeno Cryptococcus | Negativo | |
| - FilmArray | Negativo | |
| VIH | Negativo | |
| VDRL | No reactivo | |
| TSH | 2,166μU/mL | 0,55-4,78μU/mL |
| ANA | Negativos | |
| ENA (Sm, RNP, anti-Ro, anti-La) | Negativos | |
| Ácido fólico | 9,9ng/mL | >5,38ng/mL |
| Vitamina B12 | 463 | 211-911pg/mL |
| Panel de anticuerpos encefalitis autoinmune (NMDA, GABA, LGI1, CASPR2, AMPA, DPPX) | Negativos |
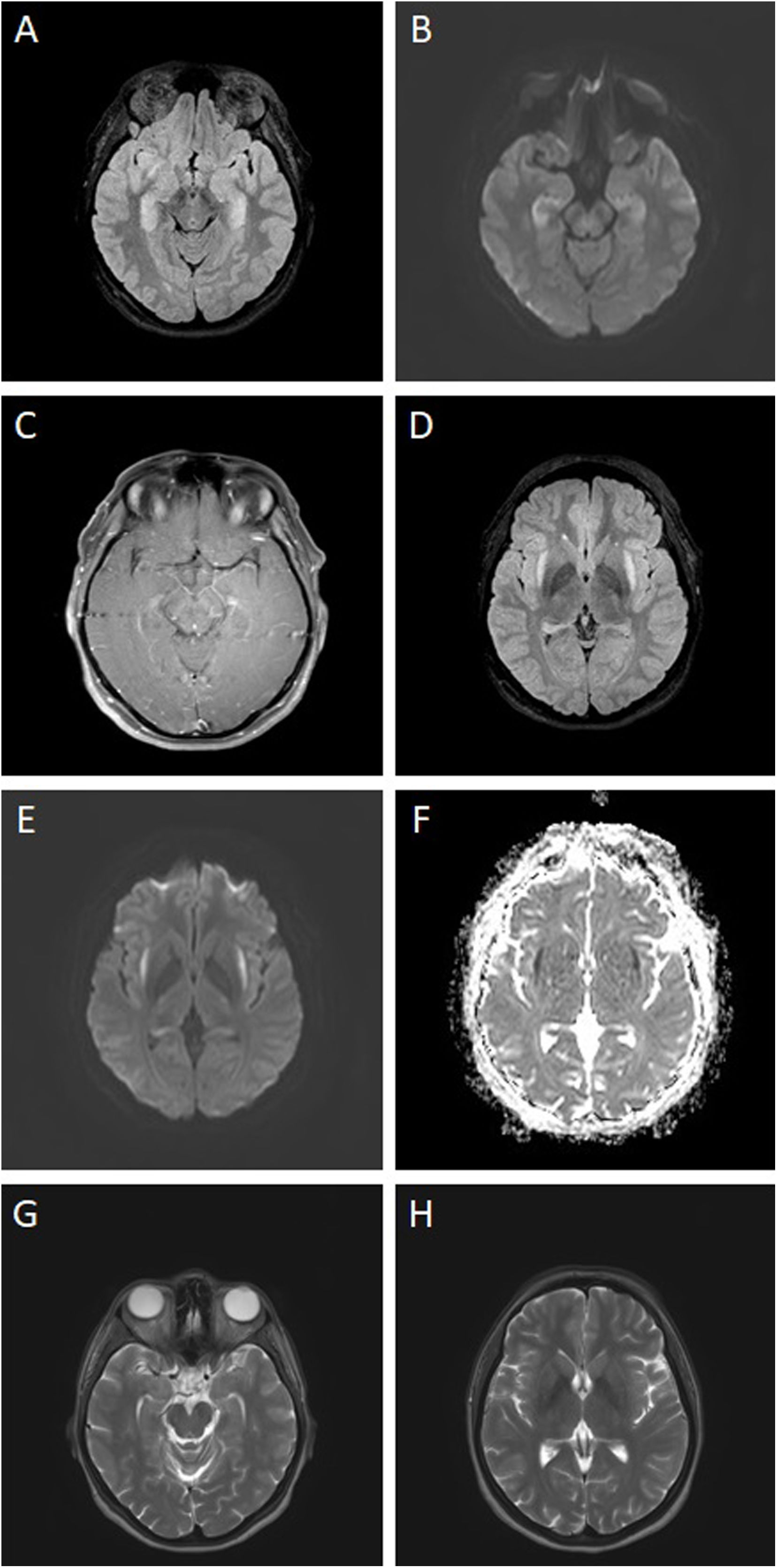
Al día 13 presentó agresividad, alucinaciones visuales, ideas de persecución y nueva crisis, se sospechó encefalomielitis aguda diseminada vs. encefalitis posvacunal y se suspendieron antimicrobianos. Resonancia contrastada con hallazgos no compatibles con encefalomielitis aguda diseminada y que sugieren encefalitis autoinmune (fig. 1). Se ajustaron anticonvulsivantes, se iniciaron pulsos de metilprednisolona 1000mg/día durante 5 días y debido a escasa mejoría se realizaron 5 sesiones de recambios plasmáticos en días alternos; posteriormente, las crisis y síntomas neuropsiquiátricos mejoraron. Los estudios de autoinmunidad y anticuerpos para encefalitis autoinmune (NMDA, GABA, LGI1, CASPR2, AMPA, DPPX) fueron negativos. Se concluyó que se trató de una encefalitis inducida por vacunación SARS-CoV-2. Continuó manejo con prednisolona oral durante un mes e indicación de rituximab 1000mg al día 0, 14 y cada 6 meses.
Resonancia cerebral contrastada al inicio de enfermedad: hiperintensidad en ambos hipocampos en T2/FLAIR (A) con restricción a difusión (B) y sin realce con medio de contraste (C). Hiperintensidad en cápsulas externas en T2/FLAIR (D) con restricción a la difusión (hiperintensidad en DWI (E) e hipointensidad en ADC (F)). Resonancia cerebral contrastada a los 8 meses de seguimiento: Resolución de hiperintensidades en T2 en hipocampos (G) y cápsulas externas (H).
La resonancia contrastada en 6 meses demostró resolución de las alteraciones iniciales (fig. 1). En el seguimiento se evidenció epilepsia focal de lóbulo temporal izquierdo, secuelas cognitivas amnésicas, del lenguaje, trastorno depresivo y crisis no epilépticas.
Describimos el caso de una mujer con criterios para encefalitis autoinmune: 1) progresión menor a 3 meses de síntomas neuropsiquiátricos y alteración del estado mental, 2) crisis epilépticas de novo y resonancia sugestiva de encefalitis4. La evolución y relación temporal con la vacunación sugieren encefalitis asociada a vacunación COVID-19. El tratamiento con esteroides sistémicos y recambios plasmáticos fue efectivo y logró control agudo de los síntomas, con secuelas cognitivas y epilepsia a largo plazo.
Cefalea, mareos o espasmos musculares son efectos adversos descritos y autolimitados posterior a la vacuna5, pero hay efectos más graves como parálisis facial, síndrome de Guillain-Barré, epilepsia focal6, ataques cerebrovasculares, encefalomielitis aguda diseminada, encefalitis posvacunal7,8 y encefalopatía aguda9.
La hipótesis respecto a la encefalitis posvacunal asociada a vacunas ARNm se basa en que los antígenos se reconocen como patógenos potenciales, lo que resulta en la síntesis y liberación de interleucinas (IL-1, IL-6), factor de necrosis tumoral alfa y prostaglandina-E2, imitando la respuesta a la infección natural. Después de la estimulación, comienzan eventos como fagocitosis, liberación de mediadores inflamatorios, activación del complemento y reclutamiento celular, lo que puede causar neuroinflamación por activación de la microglía, según el trasfondo inmunogénico y la memoria inmunitaria innata8,10.
La historia natural previamente documentada y la respuesta al tratamiento coincide con otros casos publicados de encefalitis posvacunal COVID-19 en los que no se documentó infección ni autoinmunidad, la mayoría de los pacientes tienen buenos desenlaces, no obstante, la paciente en cuestión quedó con las secuelas descritas.
Aunque el nexo temporal con la vacunación estuvo presente, no es un criterio inequívoco de causalidad. Este tipo de reacción adversa es infrecuente y los beneficios de la vacunación masiva superan sus riesgos. Para determinar si la vacuna podría causar trastornos neurológicos, es necesario un seguimiento más prolongado.
Consideraciones éticasSe obtuvo el consentimiento informado por escrito de la paciente para la publicación de imágenes o datos potencialmente identificables incluidos en este artículo.
Conflicto de interesesLos autores no comunican conflicto de intereses en la elaboración de la investigación.