La transformación hemorrágica es una complicación importante del ictus isquémico agudo (IIA). El propósito del trabajo es analizar el impacto clínico y los factores predictores de las hemorragias intracraneales (HIC) tras terapia revascularizadora.
MétodosAnálisis retrospectivo monocéntrico de 235 pacientes con IIA tratados mediante trombólisis intravenosa (TIV) o tratamiento endovascular (TE). Se ha realizado un modelo de regresión logística binaria para determinar los factores asociados con las HIC, las hemorragias parenquimatosas (HP), la escala mRS y la mortalidad.
ResultadosDe los 183 pacientes incluidos, 57 tuvieron HIC (30 HP). El TE mecánico (OR 3,3 [1,42-7,63], p = 0,005) y la TIV junto con TE mecánico (OR 3,39 [1,52-7,56], p = 0,003) se han asociado a mayor riesgo de HIC, mientras que valores altos de ASPECTS (OR 0,71 [0,55-0,91], p = 0,007) se han asociado a menor riesgo. Mayor edad (OR 1,07 [1,02-1,13], p = 0,006) y la oclusión de la carótida interna terminal (OR 4,03 [1,35-11,99], p = 0,012) han sido factores predictores de HP, mientras que haber recibido TIV exclusivamente (OR 0,24 [0,08-0,68], p = 0,008) se ha asociado con menor riesgo. Solo las HP se han asociado a valores invalidantes de mRS (OR = 3,2 [1,17-8,76], p = 0,02) y mayor mortalidad (OR 5,06 [1,65-15,5], p = 0,005).
ConclusionesUna mejor comprensión de los factores predictores de HIC, mRS y mortalidad puede permitir una mejor selección de pacientes y tratamientos.
Haemorrhagic transformation is a major complication of acute ischaemic stroke (AIS). We sought to determine the predictors and clinical impact of intracranial haemorrhage (ICH) after revascularisation therapy.
MethodsWe conducted a retrospective, single-centre study including 235 patients with AIS who underwent intravenous recombinant tissue plasminogen activator (IV-rtPA) therapy and/or endovascular treatment. A binary logistic regression model was used to determine the variables associated with ICH, parenchymal haematomas (PH), modified Rankin Scale (mRS) scores, and mortality.
ResultsICH was detected in 57 (30 with PH) of 183 patients included. Mechanical thrombectomy, either alone (OR 3.3 [1.42-7.63], P=.005) or in combination with IV-rtPA (OR 3.39 [1,52-7.56], P=.003), was associated with higher risk of ICH, while higher Alberta Stroke Program Early CT scores (OR 0.71 [0.55-0.91], P=.007) were associated with lower risk. Patients with older age (OR 1.07 [1.02-1.13], P=.006) and occlusion of the terminal branch of the internal carotid artery (OR 4.03 [1.35-11.99], P = .012) had a higher risk of PH, while the use of IV-rtPA alone (OR 0.24 [0.08-0.68], P=.008) was associated with lower risk of PH. Only PH was associated with disability as measured by the mRS (OR 3.2 [1.17-8.76], P=.02) and higher mortality (OR 5.06 [1.65-15.5], P=.005).
ConclusionsGreater understanding about the predictors of ICH, mRS scores, and mortality could enable better selection of patients and treatments.
Los accidentes cerebrovasculares (ACV) son la segunda causa de muerte en todo el mundo; en 2015 supusieron 6,24 millones de muertes1. La European Stroke Organization y la American Heart Association/American Stroke Association recomienda actualmente el tratamiento de los ictus isquémicos con trombólisis intravenosa (TIV) en las 3 primeras horas con un nivel de evidencia máximo2,3, y hasta 4,5 h en pacientes seleccionados4. En cuanto al tratamiento endovascular, se postula que la trombectomía mecánica, sumada a un esquema de TIV bien indicado y que se haya iniciado en las primeras 4,5 h es recomendable en aquellos pacientes con ictus de circulación anterior secundario a oclusión de gran arteria hasta 6 h después del comienzo de la clínica5. Igualmente, la trombectomía mecánica logra altas tasas de recanalización y de independencia funcional en pacientes con ictus de circulación posterior. La hemorragia intracraneal (HIC) es de las complicaciones hiperagudas más temidas tras el tratamiento revascularizador6 y el temor al desarrollo de la misma es una de las principales razones para denegar la terapia, lo que puede empeorar el pronóstico de los pacientes7. Las tasas de HIC oscilan considerablemente entre estudios (del 2 al 30%), lo que se debe a la variabilidad de criterios para definirla en los distintos estudios8,9.
Teniendo presente el cambio tan importante que supone en el pronóstico la transformación hemorrágica y la inconsistencia existente en la actualidad para definirla, los objetivos de este trabajo son analizar la incidencia y el pronóstico de las HIC en pacientes con ACV isquémico agudo tratados mediante TIV o TE mecánico o farmacológico en nuestro centro, así como estudiar si con las variables disponibles en el momento de realizar el tratamiento revascularizador se puede predecir qué pacientes que tendrán transformación hemorrágica posteriormente.
Pacientes y métodosPacientes: se ha realizado un estudio observacional retrospectivo. Se llevó a cabo un muestreo consecutivo entre el 1 de enero del 2014 y el 30 de septiembre del 2016, reclutando a 235 pacientes.
Fueron incluidos en el estudio aquellos pacientes mayores de 18 años que tuvieron un ictus isquémico agudo y fueron tratados mediante tratamiento revascularizador según el Manual de actuación en la fase aguda del infarto cerebral del Hospital Universitario Reina Sofía de Córdoba10. Se excluyó a pacientes con ictus de circulación posterior (34), disecciones (17) o ictus secundario a émbolos sépticos (1). Se han excluido a estos pacientes con el objetivo de homogeneizar la muestra y poder compararla con la literatura existente. En el caso particular de los ictus de circulación posterior, está ampliamente aceptado que el manejo difiere de los ictus carotídeos o de arteria cerebral media (ACM), de ahí que no se hayan incluido en este trabajo. A todos los pacientes se les realizó una TC de cráneo de control entre las primeras 22 y 36 h tras el tratamiento o antes en caso de deterioro neurológico4. La muestra final analizada fue de 183 pacientes.
Registro de datos: se han recogido variables demográficas (edad y sexo) y factores de riesgo cerebrovasculares (diabetes mellitus, hipertensión arterial, fibrilación auricular, hiperlipidemia, coronariopatía previa, ictus previo, enfermedad vascular periférica, consumo de fármacos anticoagulantes o antiagregantes, hábito enólico y hábito tabáquico). Se determinó el deterioro neurológico a la llegada a Urgencias mediante la escala National Institutes of Health Stroke Scale (NIHSS) por parte de un facultativo especialista en neurología o en urgencias4. Un radiólogo con más de 15 años de experiencia en neurorradiología determinó la escala Alberta Stroke Program Early CT Score (ASPECTS) en la TC de cráneo sin contraste basal11 y la localización del trombo mediante la angio-TC de troncos supraaórticos y arterias intracraneales (pudiendo ser el estudio normal, estar localizado en la arteria carótida interna (ACI) extracraneal, en la ACI terminal, en el segmento M1 de la ACM, en el segmento M2 de la ACM, en el segmento M3 de la ACM o ser una oclusión en tándem). También se ha recogido el tiempo transcurrido desde el comienzo de los síntomas hasta el inicio del tratamiento. En cuanto al tratamiento/procedimiento efectuado, se ha clasificado en TIV (rt-PA, 0,9mg/kg hasta un máximo de 90mg), TE mecánico, TE farmacológico (urocinasa intraarterial, bolo inicial de 250.000 UI en 10 min y a partir de ahí 1.000 UI/min, con un máximo de 1.000.000 de UI de urocinasa), TE mecánico y farmacológico conjuntamente, TIV y TE mecánico conjuntamente, TIV y TE farmacológico conjuntamente, TIV junto a TE mecánico y farmacológico (en las 2últimas combinaciones de tratamientos el límite de urocinasa utilizado fue de 500.000 UI), TIV y arteriografía sin tratamiento o arteriografía diagnóstica sin tratamiento. También se evaluó el grado de discapacidad al alta mediante la modified Rankin Scale (escala mRS) por un neurólogo, considerándose invalidante si es igual o mayor a 3 puntos4,12.
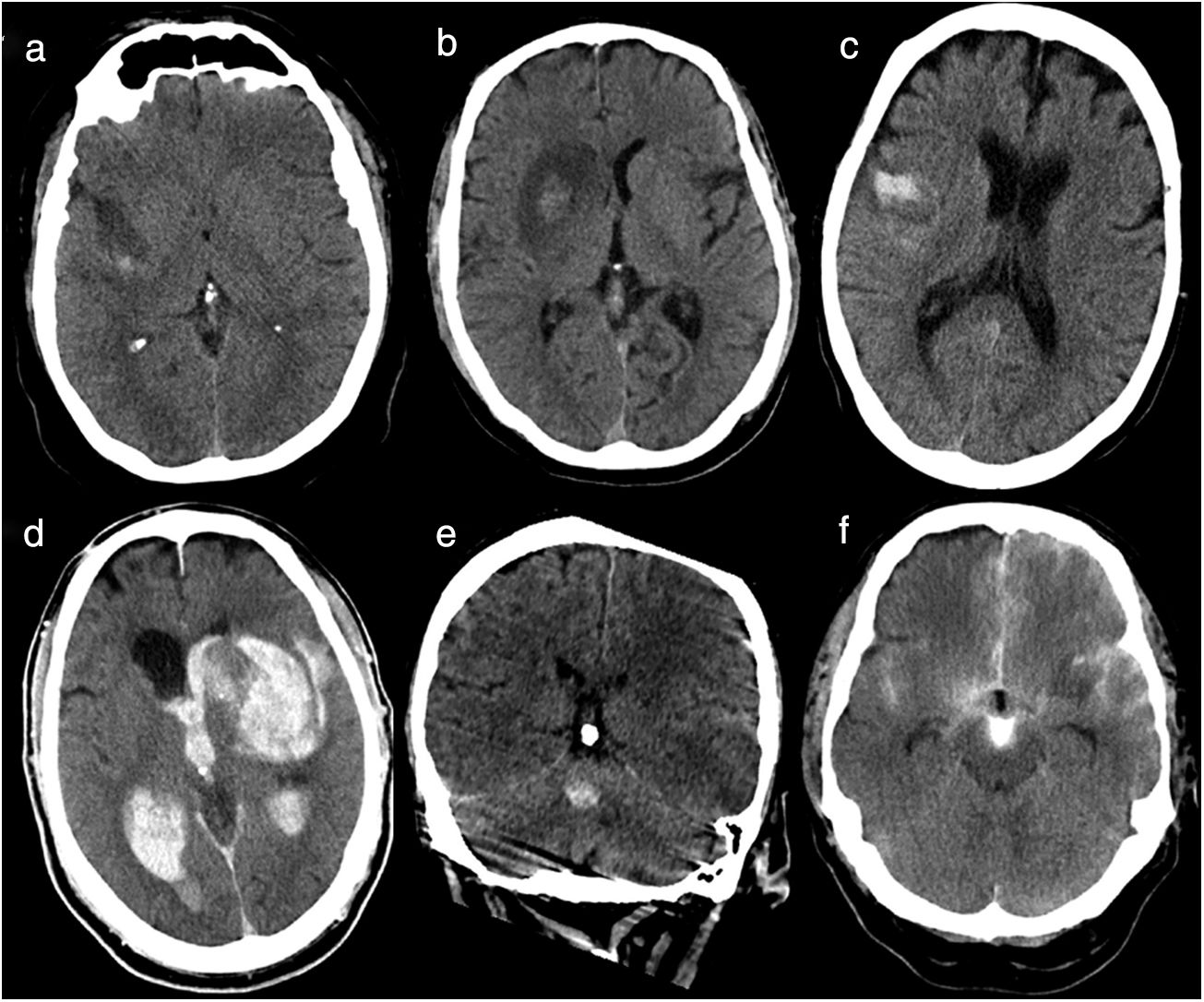
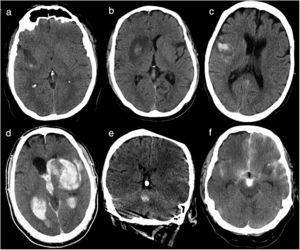
Para definir las transformaciones hemorrágicas se consideraron aquellos casos encuadrables en cualquiera de los 6 tipos de HIC propuestos por Fiorelli et al.13 (tabla 1) (fig. 1), considerando hemorragia parenquimatosa (HP) las hemorragias parenquimatosas tipo 1 (PH1), las hemorragias parenquimatosas tipo 2 (PH2), las hemorragias parenquimatosas tipo 1 (PH1), las hemorragias parenquimatosas a distancia tipo 1 (RPH1) y las hemorragias parenquimatosas a distancia tipo 2 (RPH2). Se han considerado también casos aquellos pacientes con hemorragia subaracnoidea (HSA) y se han tenido en cuenta a los pacientes que han presentado extravasación de contraste, definida como una hiperdensidad mayor de 90 Unidades Hounsfield en la TC de control14, ya que es el principal diagnóstico diferencial de las HIC después de trombectomía mecánica15. En algunos casos se observaron varios tipos de hemorragia, considerándose ambos tipos para catalogarlos, por lo que un paciente puede tener diferentes tipos de hemorragia. Las imágenes de TC de control han sido analizadas por 2radiólogos de 5 y 3 años de experiencia de forma independiente y en caso de discrepancias se han revisado junto a un tercer radiólogo con más de 15 años de experiencia en neurorradiología.
Tipos de hemorragias según Fiorelli et al. Representación de los tipos de hemorragias atendiendo a si presenta petequias o sangre y si se localiza en el área infartada o fuera de la misma
| Petequias | Sangre | ||
|---|---|---|---|
| En área infartada | PequeñasHI1ConfluentesHI2 | < 30% ↓ masaPH1 | 30% ↑ masaPH2 |
| Fuera del área infartada | Pequeña o mediana↓ masaRPH1 | Grande↑ masaRPH2 |
HI1: pequeñas petequias en la periferia del infarto. HI2: petequias confluentes en el área del infarto sin efecto masa. PH1: sangre en menos del 30% del área de infarto y puede tener ligero efecto masa. PH2: sangre en más del 30% del área infartada con efecto masa evidente. RPH1: hemorragia de volumen pequeño-mediano sin relación con el infarto y puede tener ligero efecto masa. RPH2: hemorragia extensa confluente sin relación con el infarto y con efecto masa evidente.
HI1: infarto hemorrágico tipo 1; HI2: infarto hemorrágico tipo 2; PH1: hemorragia parenquimatosa tipo 1; PH2: hemorragia parenquimatosa tipo 2; RPH1: hemorragia parenquimatosa a distancia tipo 1; RPH2: hemorragia parenquimatosa a distancia tipo 2.
Imágenes de TC de cráneo basales realizadas en las primeras 36 h tras tratamiento revascularizador. a) Infarto hemorrágico tipo 1: pequeñas petequias en la periferia del infarto. b) Infarto hemorrágico tipo 2: petequias confluentes en el área del infarto que no ejercen efecto masa. c) Hemorragia parenquimatosa tipo 1: sangre en < 30% del área de infarto, que no ejerce efecto masa. d) Hemorragia parenquimatosa tipo 2: hemorragia parenquimatosa abierta al sistema ventricular con sangre en más del 30% del área infartada y evidente efecto masa. e) Hemorragia parenquimatosa a distancia tipo 1: hemorragia de volumen pequeño sin relación con el área infartada (territorio arteria cerebral media izquierda). f) Infarto hemorrágico tipo 1 + hemorragia subaracnoidea + contraste: pequeñas petequias en la periferia del infarto, sangre en espacios subaracnoideos y contraste.
Método estadístico: para identificar los predictores de HIC y de HP se ha realizado un análisis univariante utilizando el test de la chi al cuadrado y el test exacto de Fisher para las variables cualitativas y el test de la t de Student para variables cuantitativas. Junto con este primer análisis se han modelado las 2variables dependientes (HIC y HP) mediante una recta de regresión logística binaria. Para llegar a esta recta de regresión se han analizado las variables independientes que forman parte de la recta, para que formasen parte debían tener relación con las variables dependientes. Esto se ha estudiado mediante tablas de contingencia junto con el test de la chi al cuadrado, tomando como nivel crítico 0,1. Una vez obtenido el conjunto de variables independientes que están relacionadas con las variables dependientes, se ha realizado el análisis de regresión logística binaria con el método introductivo, del cual hemos obtenido la recta de regresión; para validar esta recta de regresión hemos realizado los coeficientes de R2 de Cox y Snell y R2 de Nagelkerke, junto con el porcentaje de acierto del modelo, siendo este último el valor más importante para validar el modelo, teniendo presente que se desaconseja tomar aquellas rectas que tenga un porcentaje menor del 50%.
Del mismo modo que se ha descrito, se han diseñado otros modelos de regresión logística binaria para determinar el pronóstico y la mortalidad de la HIC y de la HP.
Para efectuar este análisis se ha utilizado el paquete SPSS 23 para Windows.
ResultadosUn total de 183 pacientes cumplieron los criterios de inclusión de este estudio. La edad media de la muestra fue de 67 ± 12 años, siendo el 63% hombres. La media de la escala NIHSS a su llegada fue de 14 ± 5 puntos y la media de la escala ASPECTS fue de 8,4 ± 1,4 puntos.
Respecto a la angio-TC de troncos supraaórticos y arterias intracraneales, el 22% de los estudios fueron normales, en el 12% el trombo estaba localizado en la ACI extracraneal, en el 12% en la ACI terminal, en el 31% en el segmento M1 de la ACM, en el 8% en el segmento M2 de la ACM, en el 2% en el segmento M3 de la ACM y en el 14% puso de manifiesto una oclusión en tándem.
En cuanto al tratamiento/procedimiento efectuado, al 35% se le realizó TIV, al 23% TE mecánico, al 1% TE farmacológico, al 3% TE mecánico y farmacológico conjunto, al 27% TIV y TE mecánico conjuntamente, al 3% TIV y TE farmacológico conjuntamente, al 4% TIV junto con TE mecánico y farmacológico, al 4% se le administró TIV y se le realizó arteriografía sin ningún procedimiento terapéutico endovascular, y al 1% se le realizó únicamente arteriografía sin ningún procedimiento endovascular. El tiempo medio transcurrido desde el comienzo de la sintomatología hasta la aplicación del tratamiento fue de 174,2 ± 81,8 min.
El 31,1% de los pacientes sufrieron transformación hemorrágica, siendo el 16,4% HP y el 14,2% PH2. En cuanto a los infartos hemorrágicos predominaron los infartos hemorrágicos tipo 2, suponiendo el 8,7%. Si utilizamos el concepto de HIC sintomática, entendiendo por tal la HIC que se acompaña de deterioro neurológico (al menos 4 puntos en la escala NIHSS), la tasa es del 10,9%, siendo el 80% de estos casos PH2. En cuanto al tratamiento, el 14% de los pacientes que recibieron TIV, tuvieron HIC (6% HIC sintomática); y el 41% de los que recibieron TE con/sin TIV también presentaron HIC (13% HIC sintomática). La presencia de HSA se dio en el 3,2% y siempre asociada a un infarto hemorrágico. En el 1,6% de los pacientes se observó extravasación de contraste, también asociada en todos los casos a infartos hemorrágicos.
El 45,9% de los pacientes fueron dados de alta con un valor de la escala mRS invalidante. De los pacientes que recibieron TIV, 16 (25%) fueron dados de alta con un valor de mRS invalidante, habiendo tenido HIC 4 (6%). De los pacientes tratados mediante TE con/sin TIV, 68 (58%) fueron dados de alta con un valor de la escala mRS invalidante, habiendo tenido HIC 33 (28%). La tasa de mortalidad global ha sido del 16,9%. De los pacientes que recibieron TIV, 4 (6%) fallecieron, 2 (3%) tuvieron HIC. De los pacientes tratados mediante TE con/sin TIV, 27 (23%) fallecieron y 16 (14%) tuvieron HIC.
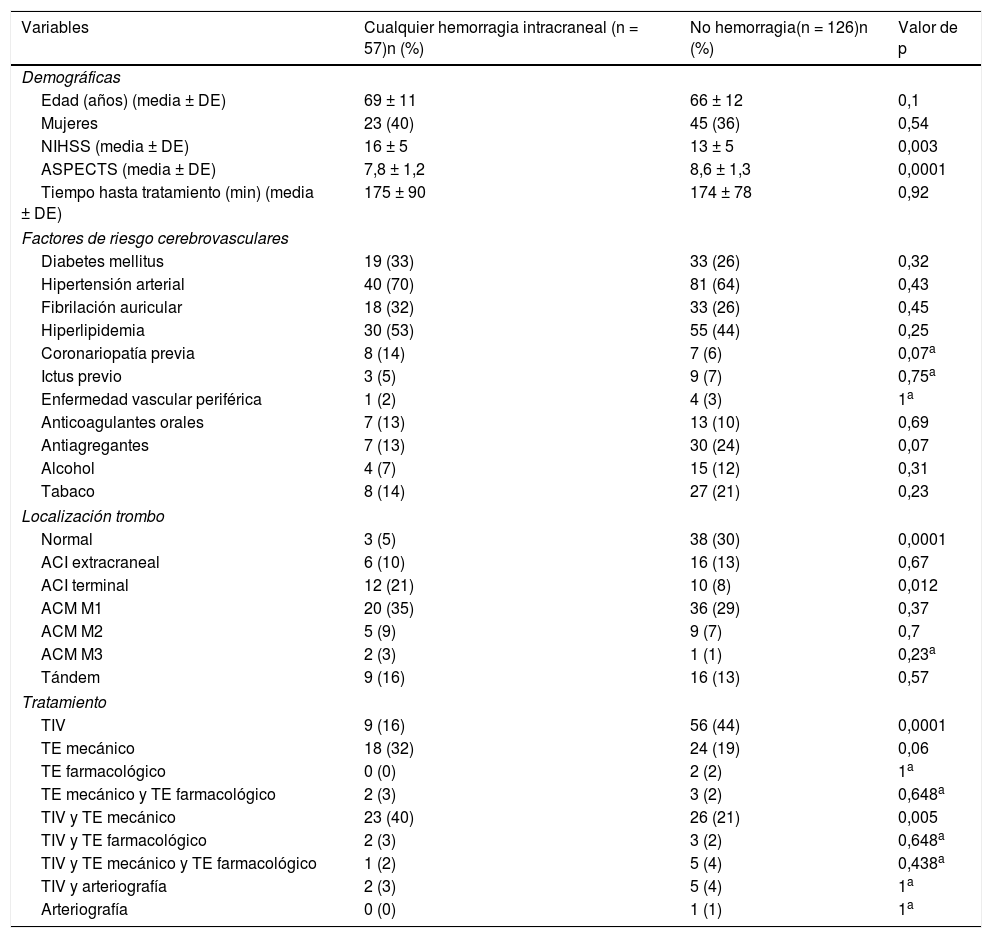
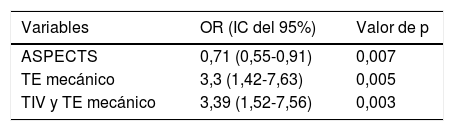
La tabla 2 resume el análisis univariante de los factores predictores de cualquier HIC. En el modelo de regresión logística binaria (tabla 3), el TE mecánico (OR 3,3 [1,42-7,63], p = 0,005) y la TIV junto con TE mecánico (OR 3,39 [1,52-7,56], p = 0,003) han sido factores predictores independientes de HIC, mientras que la escala ASPECTS (OR 0,71 [0,55-0,91], p = 0,007) se ha asociado independientemente con menor riesgo de HIC. El modelo creado para predecir HIC tiene un porcentaje de acierto del 72,4%.
Análisis univariante de factores predictores de cualquier hemorragia intracraneal tras tratamiento revascularizador
| Variables | Cualquier hemorragia intracraneal (n = 57)n (%) | No hemorragia(n = 126)n (%) | Valor de p |
|---|---|---|---|
| Demográficas | |||
| Edad (años) (media ± DE) | 69 ± 11 | 66 ± 12 | 0,1 |
| Mujeres | 23 (40) | 45 (36) | 0,54 |
| NIHSS (media ± DE) | 16 ± 5 | 13 ± 5 | 0,003 |
| ASPECTS (media ± DE) | 7,8 ± 1,2 | 8,6 ± 1,3 | 0,0001 |
| Tiempo hasta tratamiento (min) (media ± DE) | 175 ± 90 | 174 ± 78 | 0,92 |
| Factores de riesgo cerebrovasculares | |||
| Diabetes mellitus | 19 (33) | 33 (26) | 0,32 |
| Hipertensión arterial | 40 (70) | 81 (64) | 0,43 |
| Fibrilación auricular | 18 (32) | 33 (26) | 0,45 |
| Hiperlipidemia | 30 (53) | 55 (44) | 0,25 |
| Coronariopatía previa | 8 (14) | 7 (6) | 0,07a |
| Ictus previo | 3 (5) | 9 (7) | 0,75a |
| Enfermedad vascular periférica | 1 (2) | 4 (3) | 1a |
| Anticoagulantes orales | 7 (13) | 13 (10) | 0,69 |
| Antiagregantes | 7 (13) | 30 (24) | 0,07 |
| Alcohol | 4 (7) | 15 (12) | 0,31 |
| Tabaco | 8 (14) | 27 (21) | 0,23 |
| Localización trombo | |||
| Normal | 3 (5) | 38 (30) | 0,0001 |
| ACI extracraneal | 6 (10) | 16 (13) | 0,67 |
| ACI terminal | 12 (21) | 10 (8) | 0,012 |
| ACM M1 | 20 (35) | 36 (29) | 0,37 |
| ACM M2 | 5 (9) | 9 (7) | 0,7 |
| ACM M3 | 2 (3) | 1 (1) | 0,23a |
| Tándem | 9 (16) | 16 (13) | 0,57 |
| Tratamiento | |||
| TIV | 9 (16) | 56 (44) | 0,0001 |
| TE mecánico | 18 (32) | 24 (19) | 0,06 |
| TE farmacológico | 0 (0) | 2 (2) | 1a |
| TE mecánico y TE farmacológico | 2 (3) | 3 (2) | 0,648a |
| TIV y TE mecánico | 23 (40) | 26 (21) | 0,005 |
| TIV y TE farmacológico | 2 (3) | 3 (2) | 0,648a |
| TIV y TE mecánico y TE farmacológico | 1 (2) | 5 (4) | 0,438a |
| TIV y arteriografía | 2 (3) | 5 (4) | 1a |
| Arteriografía | 0 (0) | 1 (1) | 1a |
ACI: arteria carótida interna; ACM; arteria cerebral media; ASPECTS: Alberta Stroke Program Early CT Score; DE: desviación estándar; n: número de pacientes; NIHSS: National Institutes of Health Stroke Scale; TE: tratamiento endovascular; TIV: trombólisis intravenosa.
Predictores independientes de desarrollo de cualquier hemorragia intracraneal tras tratamiento revascularizador
| Variables | OR (IC del 95%) | Valor de p |
|---|---|---|
| ASPECTS | 0,71 (0,55-0,91) | 0,007 |
| TE mecánico | 3,3 (1,42-7,63) | 0,005 |
| TIV y TE mecánico | 3,39 (1,52-7,56) | 0,003 |
ASPECTS: Alberta Stroke Program Early CT Score; IC: intervalo de confianza; OR: odds ratio; TE: tratamiento endovascular; TIV: trombólisis intravenosa.
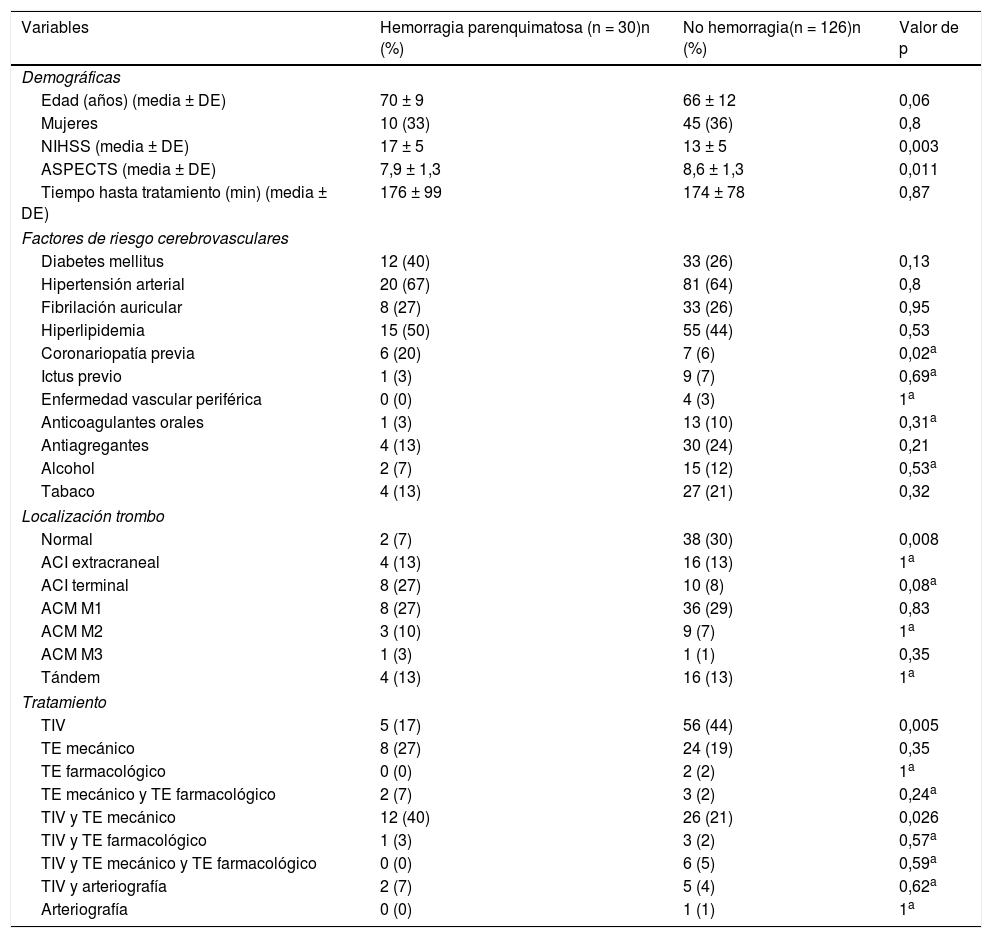
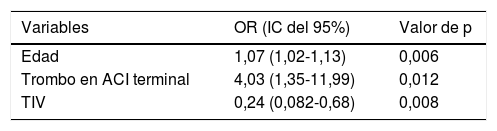
En la tabla 4 se muestran los resultados del análisis univariante de los factores predictores de las HP. En el modelo de regresión logística binaria (tabla 5), la edad (OR 1,07 [1,02-1,13], p = 0,006) y la localización del trombo en la ACI terminal (OR 4,03 [1,35-11,99], p = 0,012) han sido factores predictores independientes de HP, mientras que haber recibido TIV (OR 0,24 [0,08-0,68], p = 0,008) se ha asociado independientemente con menor riesgo de HP en nuestro modelo. El modelo creado para predecir HP tiene un porcentaje de acierto del 80,1%.
Análisis univariante de factores predictores de hemorragia parenquimatosa tras tratamiento revascularizador
| Variables | Hemorragia parenquimatosa (n = 30)n (%) | No hemorragia(n = 126)n (%) | Valor de p |
|---|---|---|---|
| Demográficas | |||
| Edad (años) (media ± DE) | 70 ± 9 | 66 ± 12 | 0,06 |
| Mujeres | 10 (33) | 45 (36) | 0,8 |
| NIHSS (media ± DE) | 17 ± 5 | 13 ± 5 | 0,003 |
| ASPECTS (media ± DE) | 7,9 ± 1,3 | 8,6 ± 1,3 | 0,011 |
| Tiempo hasta tratamiento (min) (media ± DE) | 176 ± 99 | 174 ± 78 | 0,87 |
| Factores de riesgo cerebrovasculares | |||
| Diabetes mellitus | 12 (40) | 33 (26) | 0,13 |
| Hipertensión arterial | 20 (67) | 81 (64) | 0,8 |
| Fibrilación auricular | 8 (27) | 33 (26) | 0,95 |
| Hiperlipidemia | 15 (50) | 55 (44) | 0,53 |
| Coronariopatía previa | 6 (20) | 7 (6) | 0,02a |
| Ictus previo | 1 (3) | 9 (7) | 0,69a |
| Enfermedad vascular periférica | 0 (0) | 4 (3) | 1a |
| Anticoagulantes orales | 1 (3) | 13 (10) | 0,31a |
| Antiagregantes | 4 (13) | 30 (24) | 0,21 |
| Alcohol | 2 (7) | 15 (12) | 0,53a |
| Tabaco | 4 (13) | 27 (21) | 0,32 |
| Localización trombo | |||
| Normal | 2 (7) | 38 (30) | 0,008 |
| ACI extracraneal | 4 (13) | 16 (13) | 1a |
| ACI terminal | 8 (27) | 10 (8) | 0,08a |
| ACM M1 | 8 (27) | 36 (29) | 0,83 |
| ACM M2 | 3 (10) | 9 (7) | 1a |
| ACM M3 | 1 (3) | 1 (1) | 0,35 |
| Tándem | 4 (13) | 16 (13) | 1a |
| Tratamiento | |||
| TIV | 5 (17) | 56 (44) | 0,005 |
| TE mecánico | 8 (27) | 24 (19) | 0,35 |
| TE farmacológico | 0 (0) | 2 (2) | 1a |
| TE mecánico y TE farmacológico | 2 (7) | 3 (2) | 0,24a |
| TIV y TE mecánico | 12 (40) | 26 (21) | 0,026 |
| TIV y TE farmacológico | 1 (3) | 3 (2) | 0,57a |
| TIV y TE mecánico y TE farmacológico | 0 (0) | 6 (5) | 0,59a |
| TIV y arteriografía | 2 (7) | 5 (4) | 0,62a |
| Arteriografía | 0 (0) | 1 (1) | 1a |
ACI: arteria carótida interna; ACM: arteria cerebral media; ASPECTS: Alberta Stroke Program Early CT Score; DE: desviación estándar; n: número de pacientes; NIHSS: National Institutes of Health Stroke Scale; TE: tratamiento endovascular; TIV: trombólisis intravenosa.
Predictores independientes de desarrollo de hemorragia parenquimatosa tras tratamiento revascularizador
| Variables | OR (IC del 95%) | Valor de p |
|---|---|---|
| Edad | 1,07 (1,02-1,13) | 0,006 |
| Trombo en ACI terminal | 4,03 (1,35-11,99) | 0,012 |
| TIV | 0,24 (0,082-0,68) | 0,008 |
ACI: arteria carótida interna; IC: intervalo de confianza; OR: odds ratio; TIV: trombólisis intravenosa.
Tras controlar por todas las variables recogidas, las HIC no se han asociado con valores invalidantes de la escala mRS al alta ni a mayor mortalidad. Tras ajustar por todas las variables recogidas, las HP sí se han asociado con valores invalidantes de la escala mRS (OR 3,2 [1,17-8,76], p = 0,02) y a mayor mortalidad (OR 5,06 [1,65-15,5], p = 0,005).
DiscusiónLa diferente metodología de los trabajos publicados tanto al definir la transformación hemorrágica como al seleccionar los pacientes dificulta el análisis y extrapolación de los resultados obtenidos.
Tasa de transformación hemorrágicaLa definición de HIC posreperfusión aún no ha sido estandarizada y ninguna de las diferentes definiciones existentes permite predecir con certeza la mortalidad y el resultado16. Además, muchos pacientes con ACV severos, y en particular los que se someten a TE, pueden requerir sedación, lo que dificulta la correcta valoración neurológica12. Estos 2argumentos han motivado que se haya utilizado un concepto de transformación hemorrágica puramente radiológico, al igual que en el estudio ECASS I13, en lugar de una definición clínico-radiológica, con pleno conocimiento de que ello implica tasas de HIC mayores aunque no necesariamente peor pronóstico. La tasa de transformación hemorrágica de la muestra ha sido del 31,1%, en caso de que se considere el deterioro neurológico la tasa es del 10,9%; esto coincide con lo referido por Seet y Rabinstein8 cuando concluyen que la variación existente en la literatura sobre las tasas de transformación hemorrágica podría estar justificada por los distintos criterios utilizados para definirla. Atendiendo al tipo de tratamiento, el 14% de los pacientes que recibieron TIV tuvieron cualquier tipo de HIC y el 41% de los pacientes que recibieron TE con/sin TIV presentaron HIC. Estas tasas son similares a las publicadas recientemente en un metaanálisis en el que se comparó a 1.320 pacientes que recibieron tratamiento médico (tasa de HIC 19%) y 1.499 pacientes tratados mediante TE (tasa de HIC 35%)17.
Factores asociados con la transformación hemorrágicaIdentificar pacientes con alto riesgo de HIC podría permitir adoptar medidas precoces para prevenirla12, habiéndose propuesto algunas estrategias, como controlar estrechamente la presión arterial18. En este sentido, el principal objetivo de este trabajo ha sido tratar de determinar factores predictores de HIC y HP.
En nuestro trabajo, el TE mecánico y la TIV previa al TE mecánico han sido factores predictores independientes de HIC, mientras que la escala ASPECTS se ha asociado independientemente a menor riesgo de HIC. Nogueira et al.12 encontraron como predictores independientes de HIC en 1.122 pacientes tratados mediante TE la diabetes mellitus, el TE mecánico y la escala NIHSS. Existen diferencias entre las distintas investigaciones publicadas que han tratado de determinar factores predictores de HIC sintomática tras TIV19,20 y nuestro estudio, fundamentalmente por la potencia estadística y porque nosotros hemos incluido a pacientes tratados mediante tratamiento médico y TE. Un valor elevado en la escala ASPECTS se ha asociado a menor probabilidad de transformación hemorrágica, lo cual es razonable, ya que a mayor ASPECTS se presupone menor probabilidad de complicaciones21. Dada la controversia existente en la actualidad sobre si la TIV previa al TE mecánico incrementa o no la probabilidad de HIC22, es interesante reseñar que ha resultado ser el factor independiente predictor de HIC más importante del modelo.
Factores asociados a las hemorragias parenquimatosasAlgunos autores consideran la transformación hemorrágica tan solo si la hemorragia documentada por TC es una HP9, de ahí la relevancia de analizar individualmente a los pacientes con HP. Al analizar las HP, la edad y la localización del trombo en la ACI terminal han sido factores predictores independientes de HP; mientras que haber recibido TIV exclusivamente se ha asociado independientemente con menor riesgo de HP. Existe una fuerte evidencia sobre las variables que implican mayor riesgo de HP tras TIV (mayor edad, valores altos en la escala NIHSS, cifras de presión arterial sistólica elevada, género masculino, largo período transcurrido entre el comienzo de los síntomas y la implementación del tratamiento, y el consumo de aspirina)20,23. Sin embargo, aún no hay suficiente evidencia sobre la HP tras TE12,22. Para Nogueira et al.12 son factores predictores independientes de HP tras TE: el TE farmacológico, la FA y la escala NIHSS, mientras que para Kaesmacher et al.22 son el tiempo transcurrido desde que comienza la sintomatología hasta que se aplica el tratamiento, la escala ASPECTS y el ictus del despertar. Es evidente la variabilidad existente, por lo que serían útiles nuevos trabajos prospectivos que analicen factores asociados y predictores de HIC tras TE.
Pronóstico y mortalidadTras controlar por todas las variables recogidas, las HIC en general no se han asociado a valores invalidantes de la escala mRS al alta ni a mayores tasas de mortalidad, lo cual sí ha ocurrido con las HP. Estos resultados ponen de manifiesto la relevancia clínica de las HP, en concordancia con lo referido anteriormente, y hacen que nos decantemos por una definición de HIC con criterios más restrictivos. No obstante, hay trabajos que cuestionan la naturaleza «benigna» de los infartos hemorrágicos tanto tras TIV24 como tras TE12,22. Futuros trabajos en esta línea podrían permitir estandarizar el concepto de HIC, ya que en la actualidad no está claro si se debe utilizar una definición conservadora que incluya los infartos hemorrágicos y las HIC asintomáticas o si, por el contrario, se deben utilizar criterios más restrictivos.
LimitacionesEste trabajo es un estudio observacional retrospectivo y presenta limitaciones. En primer lugar, hemos incluido a pacientes tratados mediante tratamiento médico, TE y tratamiento combinado, mientras que numerosos trabajos se centran exclusivamente en un tipo de tratamiento en concreto. En segundo lugar, el hecho de incluir a pacientes tratados mediante tratamiento médico no ha permitido valorar la revascularización, por ejemplo, mediante la escala modified Thrombolysis In Cerebral Infarction (mTICI)25. En tercer lugar, puede existir un sesgo de selección, ya que algunos pacientes tratados mediante TE o tratamiento combinado fueron pacientes que o estaban fuera del período recomendado para recibir TIV o que tras la TIV no mostraron mejoría, por lo que a priori podrían ser considerados ictus más severos y con peor pronóstico. No obstante, consideramos que, a pesar de estas limitaciones, la muestra es lo suficientemente representativa y amplia como para responder a los objetivos planteados.
ConclusionesConocer los factores predictores y las consecuencias de las HIC tras el tratamiento revascularizador en el ictus isquémico agudo es esencial para identificar precozmente a los pacientes que las pueden presentar e implementar estrategias de prevención. Los datos de este trabajo indican que las HIC en general no se asocian a peor pronóstico ni a mayor mortalidad, lo que sí ocurre con las HP. Por otro lado, el TE mecánico y la TIV previa al TE mecánico han sido factores predictores independientes de HIC, mientras que valores altos de la escala ASPECTS se han asociado independientemente con menor riesgo de HIC. En el caso de las HP, la edad y la localización del trombo en la ACI terminal han sido factores predictores independientes de HP, mientras que haber recibido TIV exclusivamente se ha asociado independientemente a menor riesgo de presentarla.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.