Los diseños para determinar la respuesta nociceptiva en roedores son de gran utilidad en neurología y en neurociencias experimentales. El paradigma de inmersión de la cola de ratón en agua temperada es uno de los más empleados para evaluar dicha respuesta; sin embargo, existe amplia variación en la temperatura utilizada en las diversas investigaciones. Resulta sumamente útil determinar la temperatura que produce una mejor respuesta nociceptiva sobre la cola de ratones de la cepa Balb/c.
MétodosSe emplearon 8 ratones machos Balb/c de 2 meses de edad. Un beaker de 14cm de alto se llenó de agua hasta 13cm. Partiendo desde los 36°C se empezó a sumergir la cola del animal dentro del recipiente. Se comenzó a elevar en 1°C el agua hasta encontrar las temperaturas que produzcan las respuestas nociceptivas. Dicha respuesta se determinó contabilizando el tiempo que el ratón tardó en sacudir su cola retirándola del agua.
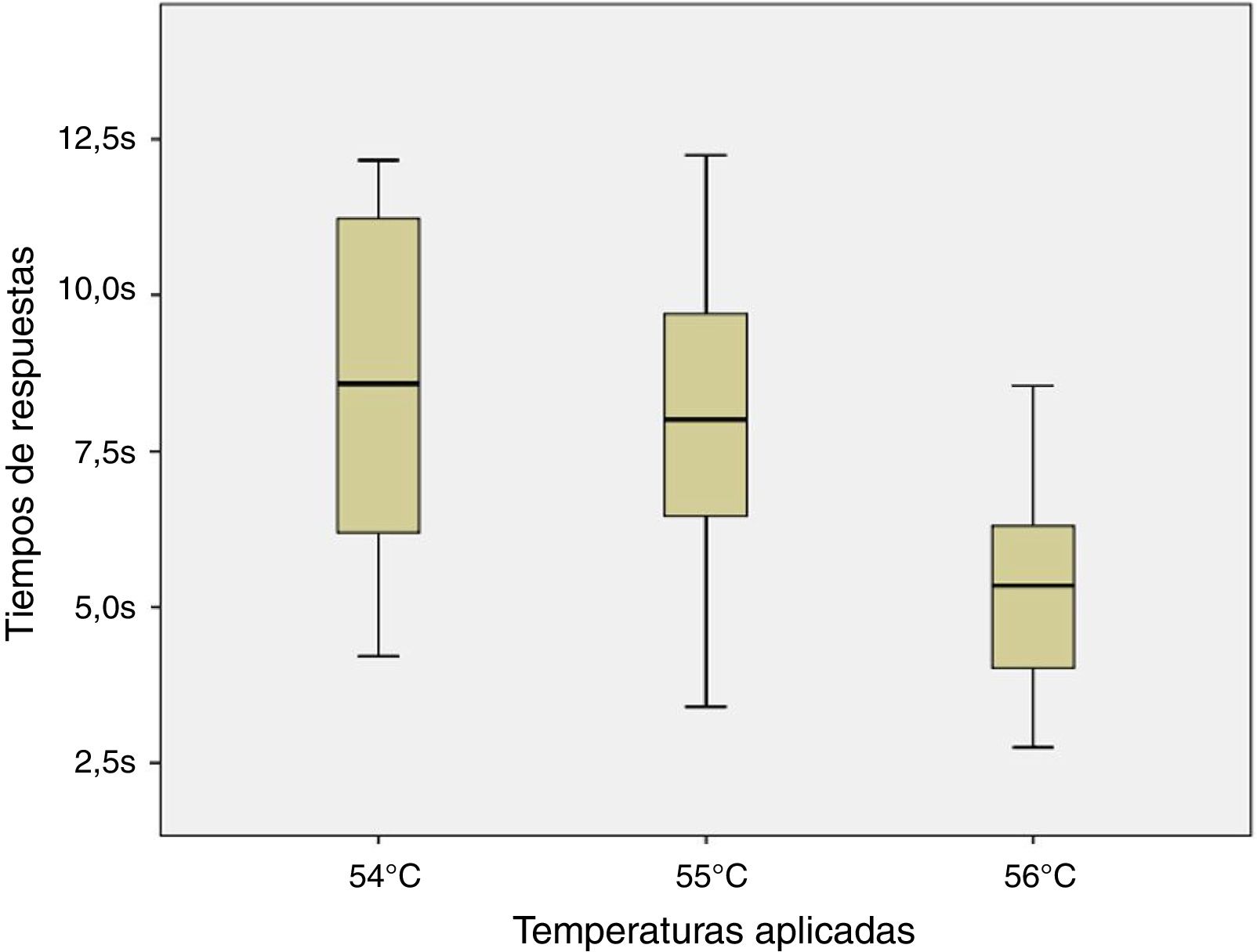
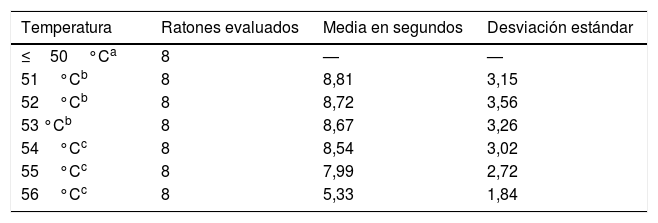
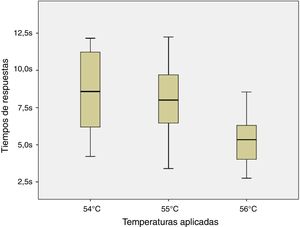
ResultadosLos ratones empezaron a sacudir su cola a los 51°C (6 de los 8 roedores). El total de la muestra retiró su cola del agua a los 54, 55 y 56°C en el tiempo promedio de 8,54, 7,99 y 5,33s, respectivamente. Al aplicar ANOVA a los tiempos de las 3 temperaturas señaladas se obtuvo el valor F=2,8 y p=0,123.
ConclusionesEl tiempo de respuesta fue similar estadísticamente ante las temperaturas de 54, 55 y 56°C; sin embargo se encontró menor dispersión de los datos ante esta última.
Designs for determining nociceptive response in rodents are of great use in neurology and experimental neuroscience. Immersing mice's tails in warm water is one of the most widely used procedures to evaluate this response; however, a wide range of temperatures are used in different studies. Knowing the temperature that produces a powerful nociceptive response in the tail of BALB/c mice is extremely useful.
MethodsEight 2-month-old male BALB/c mice were used. A 14-cm high beaker was filled with water up to 13 cm. The animals’ tails were immersed in the container with a starting temperature of 36°C. The water temperature was raised in 1°C increments until we identified the temperatures that produced nociceptive responses. That response was determined by counting the time taken before the mouse shook its tail to remove it from the water.
ResultsSix of the 8 mice began shaking their tails at the temperature of 51°C. All animals removed their tails from the water at the temperatures of 54°C, 55°C, and 56°C, taking a mean time of 8.54, 7.99, and 5.33seconds, respectively. ANOVA applied to the response times for each of the 3 temperatures indicated revealed a value of F=2.8 (P=.123).
ConclusionsThe response time was statistically similar for the temperatures of 54°C, 55°C, and 56°C; however, the data were less dispersed for the latter temperature.
La experiencia dolorosa es multifacética y altamente subjetiva, además es influenciada por procesos psicológicos y emocionales1. Los modelos experimentales en roedores, para determinar el proceso nociceptivo, son de cardinal importancia en las diferentes disciplinas en ciencias de la salud2–4. Ello es debido a que el estudio del dolor ocupa un lugar especial en la investigación biomédica5–8, dado que el dolor es una manifestación general de innumerables condiciones en todos los organismos vivos9–11.
El paradigma del tiempo de retirada de la cola de ratón ante un estímulo térmico es uno de los más empleados en investigación experimental. Encontrándose diferentes fuentes de estímulo térmico como la incidencia de un rayo de luz sobre la cola del ratón o la respuesta de la misma ante el agua temperada5,12,13. Debido a la gran variabilidad existente en la temperatura del agua empleada en el paradigma de inmersión de la cola de ratón14–19, este estudio tuvo como objetivo determinar la temperatura que produce una mejor respuesta nociceptiva sobre la cola de ratones albinos machos de la cepa Balb/c.
Materiales métodosAnimalesSe emplearon 8 ratones albinos machos de la cepa Balb/c de 30 a 35g de peso, adquiridos de la granja de producción de material biológico del Instituto Nacional de Salud del distrito de Chorrilos en la ciudad de Lima, Perú. Luego de su adquisición los animales se ambientaron durante una semana en el Bioterio de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos, donde recibieron alimentos y agua ad libitum con ciclos de luz y oscuridad de 12h alternadas y con humedad y temperatura controlada (22±2oC), de acuerdo a la Guide for the Care and Use of Laboratory Animals20.
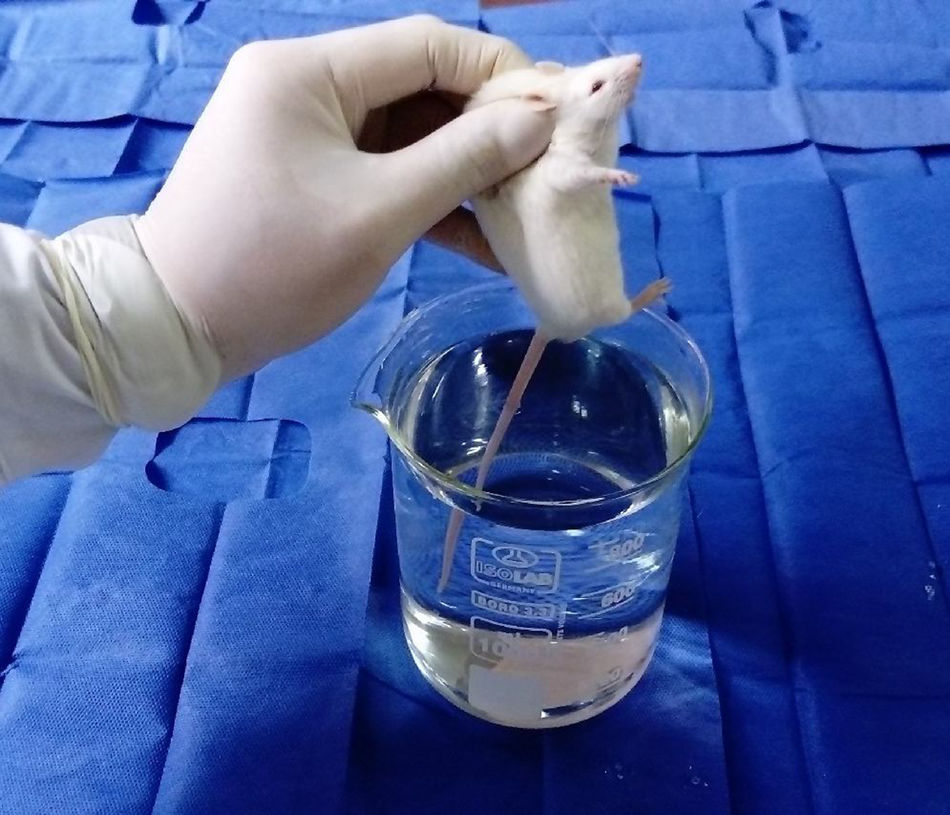
ProcedimientosEl protocolo fue aprobado por el Comité de Ética de Investigación de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos. Los 8 ratones fueron evaluados en un solo día entre las 08:00 y las 12:00h, para lo cual se empleó un beaker marca Isolab® que presentaba una altura de 14cm y un diámetro de 11cm, y un termómetro digital marca Mastrad® (fig. 1). El beaker se llenó de agua temperada a 36°C hasta 13cm de altura, para dicho propósito se valió de un hervidor eléctrico marca Thomas®. Se partió desde dicha temperatura y, temperando cuidadosamente el agua se ascendió en 1°C hasta encontrar la respuesta del roedor ante el estímulo nociceptivo, para ello se realizó un ensayo en cada animal. Dicho ensayo consistió en la rápida inmersión de los dos tercios de la cola de cada uno de los 8 ratones hasta el momento en que los animales la retiraran mediante una violenta sacudida (figs. 2 y 3). El tiempo máximo de inmersión de la cola fue de 15s, si hasta dicho tiempo el ratón no retiraba su cola se consideró que no manifestó respuesta ante el estímulo térmico. Todos los ensayos fueron filmados mediante una cámara Sony Handycam® modelo CX330® y grabados en una memoria microSD®. Los videos fueron proyectados posteriormente en un ordenador Lenovo® modelo Yoga 2®, de donde se obtuvieron los tiempos de retirada de la cola para cada ensayo mediante un cronómetro digital.
Análisis de los datosPara el análisis estadístico se emplearon medidas de tendencia central como la media y la desviación estándar. Para la estadística inferencial se utilizó el análisis de varianza (ANOVA) con un factor para medidas repetidas valiéndose del programa SPSS® versión 23 para Windows®.
ResultadosSe empezó a evaluar a los animales partiendo desde los 36°C, solo se encontró respuesta ante el estímulo término recién al a los 51°C. Sin embargo, fue a partir de los 54°C en que la totalidad de la muestra respondió con la retirada de su cola ante la fuente nociceptiva (tabla 1).
Debido a la distribución normal de los datos de acuerdo a los resultados de la prueba de Shapiro-Wilk (54°C, p=0,296; 55°C, p=0,947 y 56°C, p=0,892) y a la homocedasticidad de los mismos se aplicó la prueba de ANOVA de un factor para muestra repetidas entre los tiempos de respuesta para los estímulos nociceptivos de las 3 temperaturas indicadas. No se halló diferencia significativa entre las comparaciones realizadas (F=2,8; p=0,123) como se puede apreciar en la figura 4.
DiscusiónEn la presente investigación se empleó 8 ratones albinos machos de la cepa Balb/c de la misma camada. Al determinar el tiempo de retirada de la cola ante el estímulo término de la fuente de agua temperada, se hallaron que a las temperaturas de 54, 55 y 56°C, la totalidad de la muestra tuvo respuesta ante el estímulo nociceptivo.
En diversos estudios experimentales en ratones emplean el tiempo de retirada de la cola en temperaturas que van desde los 48 hasta los 55°C15,16,19,21. En el presente estudio se encontró respuesta a partir de los 51°C, una temperatura varios grados por encima a la empleada por De Prá et al.12 y Bhalla et al.15 quienes evaluaron respuestas nociceptivas en los animales a la temperatura de 48°C, aunque valiéndose de ratones genéticamente modificados a diferencia a los utilizados en el presente trabajo. Sin embargo, Desroches et al.16 y Brown et al.17 refieren haber empleado la temperatura de 52°C habiendo ellos utilizado también animales genéticamente modificados. Lo cual permite observar que hay variabilidad en la temperatura empleada en dichos modelos animales.
En animales no modificados genéticamente Melo et al.19 refieren haber empleado la temperatura de 51°C en ratones hembras para evaluar la retirada de la cola, similar a la temperatura en la que en el presente estudio se empezó a encontrar respuesta ante el estímulo térmico, aunque no de manera uniforme por cuanto 2 de los animales de la muestra no manifestaron respuesta a esa temperatura. Por otra parte, Yemitan y Adeyemi14 emplearon ratones adultos de ambos sexos sometidos a 55°C, además Griseb et al.13 y Garcia et al.21 refieren haber empleado la misma temperatura para el paradigma de inmersión de la cola, pero a diferencia de Yemitan y Adeyemi14 ellos emplearon solo ratones machos similar a los empleados en el presente trabajo.
Finalmente, al no observarse diferencia significativa en las 3 temperaturas contrastadas se podría emplear cualquiera de ellas entendiéndose que se obtendrían resultados similares. Sin embargo, a pesar que en las 3 temperaturas que se evaluaron no existen diferencias estadísticas, se encuentra una menor dispersión de los datos en los resultados de la temperatura de 56°C sobre la de 55 y 54°C (DE=1,84; 2,72 y 3,02; respectivamente) lo cual podría ser considerado a la hora de elegir la temperatura a emplear.
FinanciaciónEl presente estudio fue financiando por el Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses en el presente trabajo.