El infarto cerebral embólico de origen no determinado (ESUS por sus siglas en inglés) representa el 25% de todos los infartos cerebrales y solo el 30% se asocia con fibrilación auricular (FA) paroxística. Existen diferentes hallazgos bioquímicos, electro y ecocardiográficos que sugieren daño auricular izquierdo y aumento del riesgo de embolismo en ausencia de FA o flutter auricular clínicamente documentados. En la presente revisión analizamos la evidencia disponible sobre cardiopatía atrial o enfermedad auricular, su implicación en el ESUS y su identificación mediante marcadores electrocardiográficos, ecocardiográficos y séricos y sus posibles implicaciones terapéuticas.
DesarrolloSe realizó una búsqueda sistematizada a través de la fuente de información MEDLINE (PubMed), utilizando una estrategia diseñada con términos MeSH [ESUS]+[atrial cardiopathy]+[atrial fibrillation]+[interatrial block]+[treatment]. Se seleccionaron las publicaciones originales de estudios prospectivos, retrospectivos y de revisión consideradas como las más útiles. Se procedió a la lectura del texto completo y la bibliografía aportada en cada artículo.
Se incluyeron los factores epidemiológicos y demográficos de los pacientes ESUS, así como la evidencia reciente relacionada con su forma de presentación, pronóstico y factores asociados con recurrencia y mortalidad. Se revisó la contribución de la presencia de cardiopatía auricular previo a la documentación de FA y las variables clínicas, electro y ecocardiográficas, así como los marcadores bioquímicos asociados con su desarrollo y su contribución como fuente potencial de embolismo cerebral.
ConclusionesLa búsqueda sistemática de alteraciones bioquímicas, electro y ecocardiográficas pueden ser de utilidad para identificar pacientes ESUS con mayor riesgo de recurrencia.
Embolic stroke of undetermined source (ESUS) accounts for 25% of all cerebral infarcts; only 30% are associated with paroxysmal atrial fibrillation (AF). Various biochemical, electrocardiographic, and echocardiographic findings may suggest left atrial damage and increased risk of embolism in the absence of clinically documented AF or atrial flutter. In this review, we analyse the available evidence on atrial cardiopathy or atrial disease, its involvement in ESUS, and its identification through electrocardiographic, echocardiographic, and serum markers and its possible therapeutic implications.
DevelopmentA systematic search was conducted on MEDLINE (PubMed) using the following MeSH terms: MeSH [ESUS]+[atrial cardiopathy]+[atrial fibrillation]+[interatrial block]+[treatment]. We selected what we considered to be the most useful original prospective or retrospective studies and systematic reviews. We then read the full texts of the articles and checked the references cited in each article.
We analyse epidemiological and demographic variables of patients with ESUS, as well as recent evidence related to presentation and prognosis and factors associated with recurrence and mortality. We review the contribution of atrial cardiopathy diagnosis prior to the detection of AF and the clinical, electrocardiographic, and echocardiographic variables and the biochemical markers associated with its development and its potential contribution to cerebral embolism.
ConclusionsThe systematic search of biochemical and electrocardiographic, and echocardiographic alterations can be useful to identify ESUS patients at higher risk of recurrence.
Hasta el 25% de los infartos cerebrales (IC) se consideran de etiología no conocida o criptogénicos. La mayoría de ellos pueden obedecer a un origen embólico, aunque no se logre objetivar su fuente. El constructo clínico de infarto embólico de origen no determinado (ESUS por sus siglas en inglés), comprende a los IC no lacunares, con características clínicas y radiológicas sugestivas de embolismo, pero sin una fuente cardioembólica evidente1 (tablas 1 y 2). Hasta un 30% de ESUS pueden asociarse con fibrilación auricular (FA) paroxística, pero en los casos restantes, no se logra documentar la causa o su asociación con FA2,3.
Criterios diagnósticos de ESUS
| 1. Infarto cerebral no lacunar detectado por TC o IRMa |
| 2. Ausencia de aterosclerosis extracraneal o intracraneal causando estenosis luminal≥50% en las arterias que irrigan al área de isquemia |
| 3. Sin fuente de embolismo cardioembólico de alto riesgob |
| 4. No se identificó otra causa específica de infarto cerebral (p. ej. arteritis, disección, migraña/vasoespasmo, uso indebido de drogas) |
IRM: imagen de resonancia magnética; TC: tomografía computarizada.
Lacunar, definido como un infarto subcortical menor o igual a 1,5cm (≤2,0cm en difusión por IRM) en la dimensión más grande, incluso en imágenes de IRM ponderadas por difusión, y en la distribución de las arterias cerebrales pequeñas y penetrantes de los hemisferios cerebrales y puente; la visualización por TC usualmente requiere imágenes tardías mayores de 24-48h después del inicio del accidente cerebrovascular.
Fibrilación auricular permanente o paroxística, flutter auricular sostenido, trombo intracardíaco, válvula cardíaca protésica, mixoma auricular u otros tumores cardíacos, estenosis mitral, infarto de miocardio reciente (<4semanas), fracción de eyección del ventrículo izquierdo inferior al 30%, vegetaciones valvulares o endocarditis infecciosa.
Evaluación diagnóstica de ESUS
| TC o IRM cerebral |
| ECG de 12 derivaciones |
| Ecocardiograma transtorácico o transesofágico |
| Monitorización cardíaca≥24horas |
| Imagen de las arterias extracraneales e intracraneales que irrigan el área de isquemia cerebral (angiografía, angio-IRM, angio-TC o ultrasonido Doppler cervical y transcraneal) |
A partir de su descripción en 2014 diferentes series muestran una frecuencia de ESUS que va del 9% al 25% (media de 17%) de todos los IC; con edad promedio de presentación de 65 años, predominio en hombres (60%) y con menor frecuencia de factores de riesgo vascular tradicionales. Otras características de importancia son la menor gravedad de los déficits (mediana de NIHSS de 5) y la tasa de recurrencia es cercana al 4,5% en el seguimiento de 2 a 3 años. La mayoría de estos casos son tratados con antiagregantes plaquetarios4. tabla 2
Lo anterior sugiere que en los pacientes ESUS existen mecanismos posiblemente cardioembólicos, y que la ausencia de detección clínica de FA implicaría la necesidad de buscar otros predictores de riesgo o modificar las formas en que la FA pudiera ser detectada5. Así mismo, las estrategias de prevención secundaria al ser pacientes más jóvenes y con IC de menor severidad debieran ser reforzadas tratando de reducir su recurrencia. En la presente revisión analizamos la evidencia disponible sobre cardiopatía atrial o enfermedad auricular, su implicación en el ESUS y sus posibles consecuencias terapéuticas, así como su identificación mediante marcadores electrocardiográficos, ecocardiográficos y séricos.
Infarto embólico de origen no determinado. Características clínicas y de neuroimagenLas características clínicas y radiológicas en los pacientes con ESUS parecen ser similares a las de los pacientes con IC cardioembólico. En una serie de 275 pacientes con ESUS el 74% presentó déficit neurológico máximo al inicio, y la imagen mostró lesiones isquémicas predominantemente corticales o múltiples córtico-subcorticales en diferentes territorios arteriales, con recanalización temprana y transformación hemorrágica6. Las tasas de recurrencia también son similares en pacientes ESUS e IC cardioembólico, aunque la mortalidad a largo plazo es menor, probablemente por la menor gravedad de los IC6-8.
La edad y la puntuación en las escalas de CHADS2 y CHA2DS2-VASc parecen ser los mejores factores de predicción en pacientes ESUS. El riesgo de recurrencia se incrementa 3 veces, y el de mortalidad 8 veces en mayores de 80 años comparados con los menores de 60 años9,10. El grupo de pacientes con alto riesgo evaluados por CHA2DS2-VASc tiene aproximadamente 3 veces más riesgo de recurrencia y 13 veces más riesgo de muerte comparados con pacientes de bajo riesgo11.
Infarto embólico de origen no determinado y fibrilación auricularLa búsqueda sistemática de FA tiene un impacto terapéutico importante; en ausencia de FA o de una fuente cardioembólica clara la recomendación actual de las diferentes guías de tratamiento es el uso de antiagregantes plaquetarios, mientras que si se documenta FA u otra fuente potencial de embolismo cardíaco se recomienda el uso de anticoagulantes orales12-14.
Existe una clara relación entre la duración de la monitorización cardíaca y la detección de FA15; en el electrocardiograma de admisión la frecuencia de detección es del 3%, en la telemetría hospitalaria de 5% a 8%; en la monitorización Holter de 24 a 48horas de 3% a 6%; con telemetría ambulatoria del 16% y con dispositivos cardíacos implantables (DCI) su detección se incrementa hasta el 30%2,3,16.
En el estudio CRYSTAL-AF la detección de FA en pacientes con IC criptogénico reutilizando los registros endocavitarios almacenados en el DCI permitió la detección de FA en 8,9% vs. 1,4% en pacientes con electrocardiograma convencional (HR: 6,4; IC 95%: 1,9-21,7; p<0,001). La tasa de detección se incrementó a 12,4% en el grupo DCI cuando la monitorización se prolongó a 12 meses (HR: 7,3; IC 95%: 2,6-20,8; p<0,001)2. En el estudio EMBRACE 572 pacientes con IC criptogénico o ataque isquémico transitorio (AIT) en los 6 meses previos, sin FA conocida, fueron aleatorizados a monitorización cardíaca no invasiva durante 30 días (grupo intervención) vs. monitorización convencional durante 24horas (grupo control). Se detectó FA≥30segundos en 16,1% vs. 3,2% respectivamente (p<0,001). El número necesario a estudiar fue de 8, para detectar un nuevo caso de FA. En el análisis secundario se detectó FA≥2,5minutos en el 9,9% en el grupo intervención vs. 2,5% en el grupo control (p<0,001)3.
Cardiopatía auricularLa falta de una asociación temporal entre FA y ESUS, aun después de múltiples estudios de monitorización cardíaca17, ha llevado a una reevaluación de la naturaleza de esta relación y al planteamiento del tromboembolismo originado de la aurícula izquierda (AI) en ausencia de FA18,19. La cardiopatía auricular (CA) indica mayor riesgo de presentar FA e IC en pacientes donde la FA no ha sido demostrada y todos los elementos utilizados para determinar el ritmo cardíaco (ECG, Holter, monitor de eventos, tiras de registro del monitor, etc.) han indicado ritmo sinusal. La CA supone marcadores de anormalidad anatómica y funcional de la AI, que se engloban en 3 grupos: electrocardiográficos (fuerza terminal de la onda P en V1, episodios de taquiarritmia auricular subclínica, extrasístoles auriculares y bloqueo interauricular)19-24; ecocardiográficos (tamaño, volumen y/o función de la AI)25-27 y biomarcadores (troponina cardíaca, NT-proBNP y factor de Von Willebrand)28-31.
Es posible que la CA pueda producir tromboembolismo antes de que se traduzca en FA, por lo que en lugar de considerar a la FA como la causa necesaria y suficiente del riesgo, parece más útil considerar la FA y el tromboembolismo como manifestaciones comunes de una cardiopatía auricular subyacente. Por lo anterior, el concepto de CA podría proveer una mejor comprensión de los mecanismos del infarto tipo ESUS y mejorar las estrategias de prevención secundaria18,32,34.
Marcadores electrocardiográficos de cardiopatía auricularFuerza terminal de la onda P en V1La fuerza terminal de la onda P en V1 (FTPV1) mide la conducción eléctrica a través de las aurículas. Fue descrita por Morris et al. como un signo electrocardiográfico de afectación de la AI21. Su prolongación refleja cambios en la AI que alteran su conducción eléctrica debido a fibrosis, hipertrofia o presiones elevadas de llenado35. Se sugiere como un marcador predictor de FA22. La prolongación de FTPV1 refleja cardiopatía auricular subyacente que puede predisponer a eventos embólicos, incluso en ausencia de FA19,23,33,36.
Episodios de taquiarritmia auricular subclínicaUn subanálisis del estudio ASymptomatic atrial fibrillation and Stroke Evaluation in pacemaker patients and the atrial fibrillation Reduction atrial pacing Trial (ASSERT) investigó la relevancia de los episodios de taquiarritmia auricular subclínica (ETASC) detectada por un DCI, definidas como episodios de frecuencia auricular>190latidos/minuto y duración>6minutos; los cuales se asociaron con un incremento del riesgo de FA clínica (HR: 5,56; IC 95%: 3,78-8,17; p<0,001) y de IC o embolismo sistémico cuando se detectaron durante los 3 primeros meses de monitorización en comparación con los que no presentaron ETASC (HR: 2,49; IC 95%: 1,28-4,85; p=0,007). Así mismo, en el análisis dependiente de tiempo que incluyó todos los ETASC>6minutos, en comparación con la ausencia de ETASC, se asoció con un incremento del riesgo de IC o embolismo sistémico (HR: 1,76; IC 95%: 0,99-3,11; p=0,05)20.
Ziegler et al. incluyeron 1.368 pacientes del estudio The Relationship Between Daily Atrial Tachyarrhytmia Burden From Implantable Device Diagnostics and Stroke Risk, con DCI sin antecedente de FA, IC o AIT, el cual mostró un 30% de incidencia de FA (registro de TA/FA>5min en un día) en un seguimiento de 1,1±0,7 años, independientemente de los factores de riesgo para IC medidos por CHADS2, cuando se analizaron factores de riesgo en relación con la carga TA/FA>6horas se encontró aumento significativo de FA (12%, 15% y 18% con CHA2DS2-VASc intermedio, alto y muy alto riesgo, respectivamente, p=0,04)37,38. Daoud et al. en un análisis de un subgrupo de The Relationship Between Daily Atrial Tachyarrhytmia Burden From Implantable Device Diagnostics and Stroke Risk, concluyeron que la relación temporal de IC o embolismo sistémico en pacientes con DCI podría involucrar otros mecanismos de cardioembolismo diferentes a TA39.
En pacientes ESUS los ETASC conllevan un riesgo elevado de tromboembolismo. Sin embargo, hasta ahora no se ha determinado el riesgo de recurrencia de IC en relación con los ETASC, ni se ha establecido una indicación precisa de anticoagulación en estos casos.
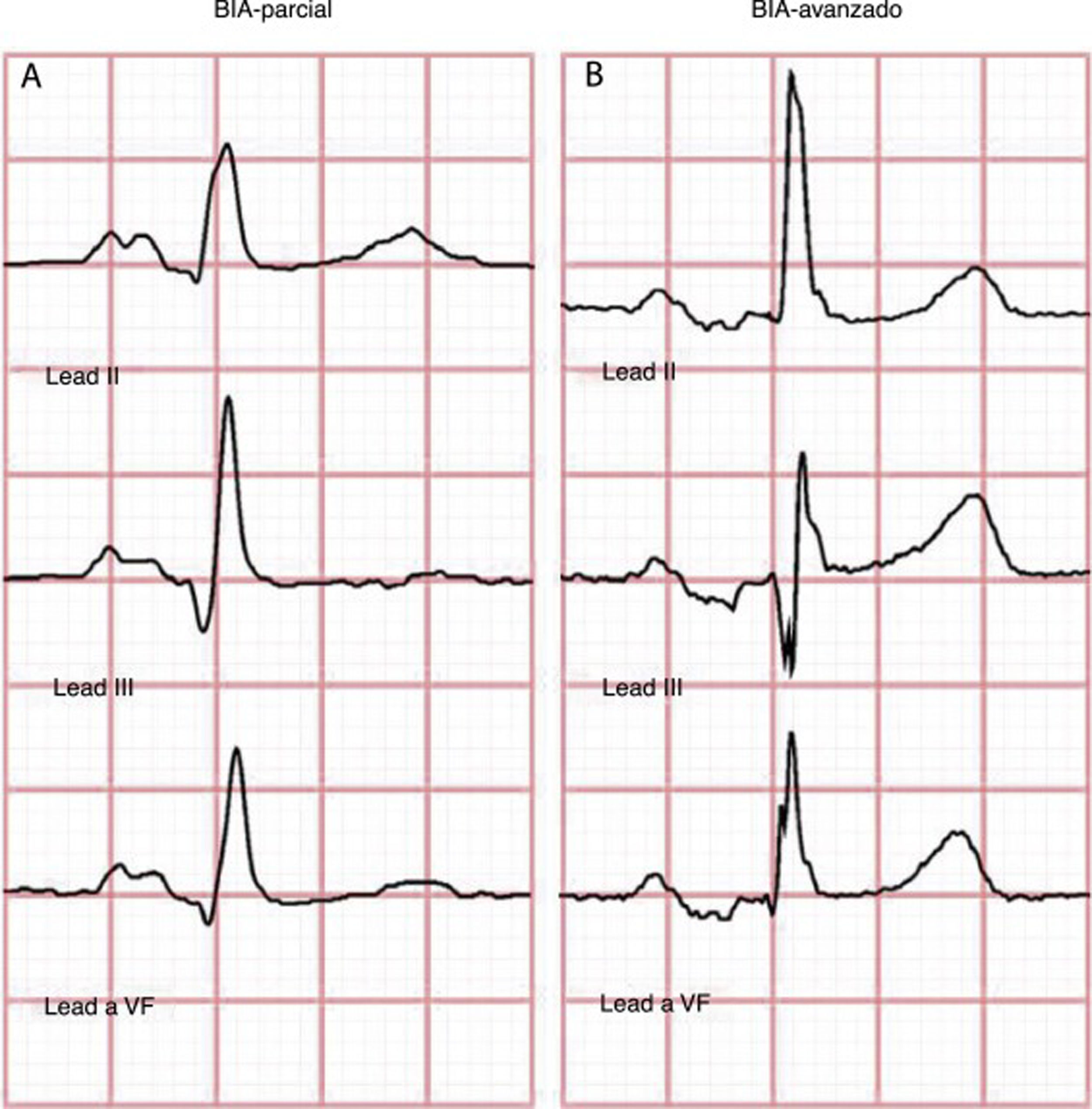
Síndrome de BayésEl síndrome de Bayés se refiere a la asociación de arritmias supraventriculares, particularmente FA, con bloqueo interauricular (BIA). Bayés et al. clasificaron al BIA como parcial cuando la duración de la onda P es≥120ms, con una morfología mellada y avanzado (BIAa) cuando la onda P es≥120ms y tiene un patrón bifásico en las derivaciones ii, iii y aVF, resultado de una activación retrógrada caudocraneal de la AI24 (fig 1.). Yogesh et al. siguieron por 16±23 meses a 308 pacientes que desarrollaron FA y 308 pacientes que se mantuvieron con ritmo sinusal, encontrando una frecuencia de BIA de 52% vs. 18% respectivamente40.
Bayés et al. encontraron también, en una muestra de 32 pacientes con BIAa, que en aquellos que recibían antiarrítmicos (50%) por un periodo de 18 meses la incidencia de arritmias supraventriculares disminuyó significativamente (93,7% vs. 25%)41. El BIAa se asocia con recurrencia en pacientes tratados por FA a un año posterior a la cardioversión farmacológica (OR: 18,4; independientemente del fármaco utilizado)42; y la presencia de BIAa previo a la ablación de venas pulmonares se asocia a riesgo elevado de recurrencia de FA postratamiento43.
Así mismo, el BIAa es un predictor de alto riesgo para FA de reciente inicio posterior a la ablación exitosa del istmo cavotricuspídeo en pacientes con flutter auricular típico44 y un predictor independiente de FA de reciente inicio en pacientes con insuficiencia cardíaca congestiva avanzada posterior a resincronización cardíaca45. Existen diferentes escenarios clínicos en los que el BIAa puede ser encontrado, como en dilatación auricular y edad avanzada, ya que es considerado un fenómeno degenerativo (prevalencia 5,4% en<20 años vs. 60% en>50 años)43,44,46,47; diabetes, síndrome de apnea obstructiva del sueño y síndrome metabólico48.
La presencia de BIAa fortalece la hipótesis sobre la enfermedad auricular izquierda como un factor independiente de IC49, por lo que el diagnóstico temprano y apropiado del síndrome de Bayés es necesario, ya que estos pacientes posiblemente requieran terapia antiarrítmica y antitrombótica preventiva47.
Marcadores ecocardiográficosMorfología de orejuela izquierdaLa orejuela izquierda (OI) es un remanente embriológico primordial de la AI que funciona como depósito durante condiciones de sobrecarga de fluido25. Es la principal fuente de trombos cardíacos en la FA, debido a la estasis sanguínea que condiciona su morfología50. Manning et al. reportaron que hasta el 98% de los trombos auriculares producidos durante la FA derivan de la OI51. Anselmino et al., en un estudio retrospectivo multicéntrico de 359 pacientes con FA, estudiados con imagen por resonancia magnética cerebral y cardíaca, categorizaron la morfología de la OI en 4 tipos: ala de pollo, coliflor, cactus y manga de viento. Se detectó lesión isquémica cerebral silente en 295 (84,8%) pacientes, con una mediana de 23 lesiones. La población estudiada fue estratificada en cuartiles de acuerdo al número de lesiones: ≤6, de 7 a 23, de 24 a 43 y ≥44. La carga de lesiones cerebrales isquémicas silentes se relacionó con la morfología de la OI50. La morfología tipo coliflor se relacionó con un mayor número de lesiones cerebrales26,50. De forma similar, Di Biase etal. encontraron que la morfología de ala de pollo tiene un 79% menos probabilidad de un IC o AIT (OR: 0,21, IC 95%: 0,05-0,91, p=0,036)25.
Los hallazgos de los estudios previos sugieren que en pacientes ESUS la morfología de OI no-ala de pollo podría incrementar el riesgo de eventos embólicos, y podría ser un marcador ecocardiográfico que permita identificar pacientes con mayor riesgo de recurrencia25,26.
Tamaño de la aurícula izquierdaEl crecimiento de la AI se asocia con eventos embólicos, independientemente de la presencia de FA. Radwan et al., en un estudio de 64 pacientes con FA estudiados con ecocardiograma transtorácico y transesofágico, encontraron que el diámetro anteroposterior auricular indexado con corte de 3cm/m2 (OR: 7,5, IC 95%: 1,24-45,2, p=0,02) y el volumen elipsoide de AI con corte de 42cm3/m2 (OR: 6,5, IC 95%: 1,32-32,07, p=0,02) son los parámetros más precisos para predecir eventos tromboembólicos27. Además del tamaño, la fibrosis de la AI se ha asociado también con mayor riesgo de tromboembolismo e IC52.
Biomarcadores séricosLos biomarcadores de cardioembolismo buscan enfatizar un sustrato sistémico y auricular. Cada uno de ellos ha mostrado asociación con el riesgo de IC de tipo embólico, independiente de la presencia de FA. A continuación se detalla la evidencia disponible para cada uno de los biomarcadores de cardiopatía auricular.
Troponina cardíacaSe eleva en lesiones miocárdicas clínicas y subclínicas y en cardiopatía estructural53. Entre el 5% y 34% de pacientes con IC presentan niveles elevados de troponina cardíaca (cTnT) de alta sensibilidad, sin presentar síntomas típicos ni evidencia electrocardiográfica de isquemia coronaria aguda54,55. El estudio TRoponin ELevation in Acute ischemic Stroke encontró que el 24% de los pacientes con IC y elevación de troponina tenían una lesión coronaria causante, tanto de la isquemia miocárdica como del cardioembolismo, sugiriendo mecanismos alternativos de elevación de la cTnT en IC56. Se ha observado también que la elevación de la cTnT está más fuertemente asociada con IC cardioembólico y ESUS28,29.
Pro-péptido natriurético cerebral N-terminal (NT-proBNP)El NT-proBNP es otro biomarcador sérico de enfermedad cardíaca57. Su valor elevado está asociado a la posibilidad de detectar FA en el seguimiento en pacientes con IC criptogénico30 y cardioembólico58-60. En el estudio The Atherosclerosis Risk in Communities la combinación de niveles elevados de cTnT y NT-proBNP triplicó el riesgo de IC cardioembólico, siendo más fuerte la asociación para NT-proBNP61.
Factor de Von WillebrandEl factor Von Willebrand (FvW) desempeña un rol importante en los pasos iniciales de la formación de un trombo. En pacientes con enfermedad coronaria se ha establecido la relación entre niveles plasmáticos elevados de FvW y predisposición para ateroesclerosis o trombosis, por lo que es considerado un marcador de disfunción endotelial62. Algunos estudios han demostrado su asociación con mayor riesgo de IC, especialmente con el de etiología cardioembólica y criptogénico63-65, lo que sugiere que los efectos protrombóticos de FvW son independientes de ateroesclerosis-inflamación o daño endotelial31. Sin embargo, la evidencia es escasa y el mecanismo parece ser diferente al de la cardiopatía auricular.
Horizontes terapéuticosEl manejo óptimo de los pacientes ESUS es incierto, y hasta ahora la mayoría de ellos reciben antiagregantes plaquetarios. El beneficio de la anticoagulación, sin demostración de FA es incierto y ha sido sujeto de ensayos clínicos controlados. Mientras que en pacientes con recurrencia de ESUS el uso empírico de anticoagulantes parece ser razonable, en el resto de los casos la prevención secundaria incluye control de la presión arterial, estatinas, modificación de estilo de vida y antiagregantes plaquetarios20,66.
Dos ensayos clínicos han sido concluidos y otro más se encuentra en marcha, intentando definir si los anticoagulantes orales directos (AOD) reducen el riesgo de recurrencia. El estudio NAVIGATE ESUS comparó 15mg de rivaroxabán contra 100mg de Aspirina67; y el estudio RE-SPECT ESUS comparó 2 dosis de dabigatrán (110 y 150mg 2 veces por día) contra Aspirina68. Ambos fallaron en reducir la recurrencia en este grupo de pacientes, y el rivaroxabán se asoció con mayor riesgo de hemorragia67. Sin embargo, en NAVIGATE ESUS ambos grupos de tratamiento mostraron una tasa de recurrencia del 5% por año, lo que confirma la necesidad de una mejor selección de pacientes y de mejores opciones terapéuticas67, por lo que algunos de los marcadores electrocardiográficos, ecocardiográficos o bioquímicos, referidos en esta revisión, podrían ser de utilidad para identificar a pacientes ESUS y alto riesgo de recurrencia. El estudio AtRial Cardiopathy and Antithrombotic Drugs In Prevention After Cryptogenic Stroke, que actualmente se encuentra en curso, compara apixabán 5mg contra Aspirina 81mg/día, en pacientes ≥45 años con ESUS y evidencia de cardiopatía auricular. Busca demostrar la eficacia y seguridad en prevención secundaria de IC a 4 años de seguimiento y se prevé tener resultados en 202269. Por lo pronto, parece conveniente preguntarnos si debemos anticoagular a pacientes ESUS y con alto riesgo de fibrilación auricular y de recurrencia.
ConclusionesLa evidencia actual sugiere una emergente conceptualización del papel de la aurícula izquierda en el riesgo de infarto cerebral y de su prevención. Es posible que debamos tener una visión más amplia en el momento de considerar la enfermedad auricular en la etiología ictus, y no limitarnos a la fibrilación auricular, que muy probablemente sea el resultado de una enfermedad cardiaca más compleja.
La búsqueda sistemática de factores de riesgo, especialmente la morfología y duración de la onda P en el ECG, extrasístoles auriculares, la morfología de la OI en el ecocardiograma y marcadores bioquímicos, como el NT-proBNP, podrían ser de utilidad en la identificación de pacientes con ESUS y alto riesgo de recurrencia.