La descripción de la teoría de la compuerta del dolor fue el punto de partida para el desarrollo de la estimulación de la médula espinal (EME). El presente artículo describe las indicaciones para el tratamiento del dolor y otros usos no relacionados con este.
DesarrolloEn la actualidad existen diversos paradigmas de EME: tónica, de alta frecuencia en ráfaga o simplemente de alta frecuencia. Estas se distinguen por la presencia de parestesias. La EME ha mostrado beneficio sobre todo en dolor de tipo neuropático. El síndrome de cirugía espinal fallida muestra las mejores tasas de respuesta, aunque en casos de síndrome doloroso regional complejo y neuropatía diabética, así como de radiculopatía y lumbago sin cirugía espinal previa, también se logra una reducción importante del dolor. Aunque su aplicación en el dolor de tipo fantasma y en el asociado a enfermedad vascular periférica o cardiovascular parece útil, no existe una evidencia sólida para generalizar su empleo. Por otra parte, la EME también reduce el dolor neuropático secundario a tumor, a pesar de que esta línea ha sido poco explorada. Otras indicaciones no relacionadas con el dolor son trastornos de movimiento, espasticidad y secuelas de trauma medular. Sin embargo, el uso de la EME se ve limitado por dos factores principales: las complicaciones mecánicas y el costo de la terapia.
ConclusiónDurante los 50 años de aplicación, la EME ha mostrado grandes avances. Asimismo, a medida que se perfeccione el hardware y el software relacionados con esta, se podrá mejorar la efectividad y reducir el rango de complicaciones. La indicación para la EME se podría extender a otras enfermedades y su uso se expandiría si, además, se lograra diseñar una tecnología asequible.
The gate control theory of pain was the starting point of the development of spinal cord stimulation (SCS). We describe the indications for the treatment in pain management and other uses not related to pain.
DevelopmentThere are currently several paradigms for SCS: tonic, burst, and high frequency. The main difference lies in the presence of paraesthesias. SCS is most beneficial for treating neuropathic pain. Patients with failed back surgery syndrome show the best response rates, although a considerable reduction in pain is also observed in patients with complex regional pain syndrome, diabetic neuropathy, radiculopathy, and low back pain without previous surgery. Phantom pain or pain related to cardiovascular or peripheral vascular disease may improve, although there is a lack of robust evidence supporting generalisation of its use. SCS also improves cancer-related pain, although research on this issue is scarce. Non-pain-related indications for SCS are movement disorders, spasticity, and sequelae of spinal cord injury. The main limiting factors for the use of SCS are mechanical complications and the cost of the treatment.
ConclusionIn its 50-year history, SCS has progressed enormously. The perfection of hardware and software may improve its effectiveness and reduce the rate of complications. Indications for SCS could include other diseases, and its use could be expanded, if the costs of the technology are reduced.
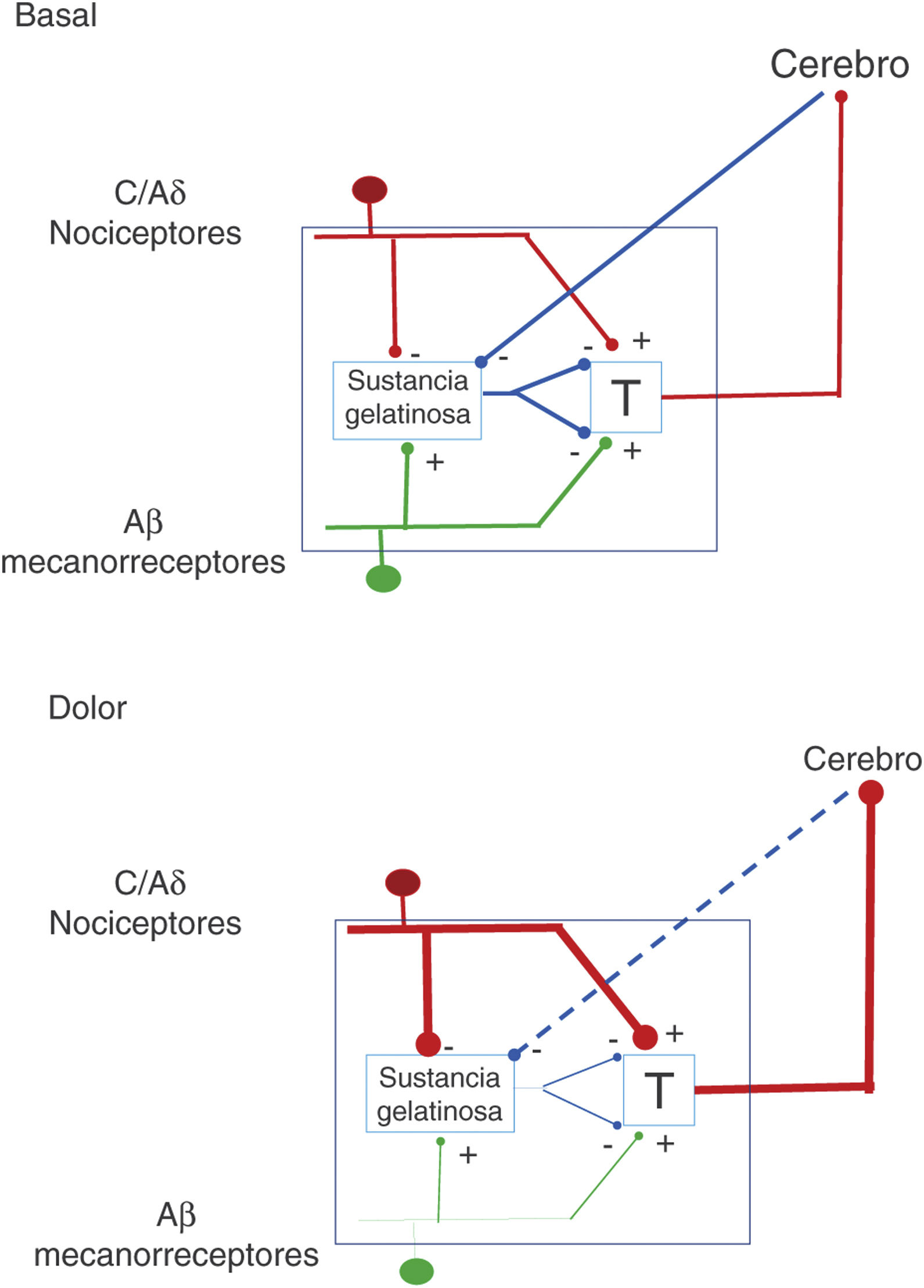
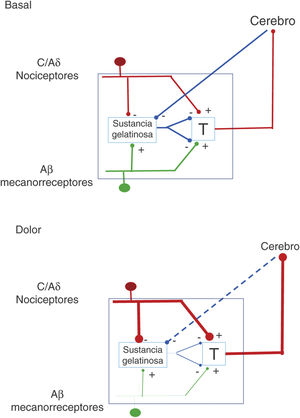
La descripción, en el año 1959, de la existencia de dos tipos de fibras para la transferencia de estímulos sensoriales abrió la puerta a un nuevo entendimiento de los mecanismos de percepción del dolor. Así es como la interacción entre fibras de gran calibre, que transportan señales de tacto, presión y vibración, con fibras de menor calibre, asociadas a dolor, se fusionó en la teoría de la «compuerta del dolor» (fig. 1). En esta teoría, desarrollada por Melzack y Wall, se postula que la estimulación de las fibras de gran calibre inhibe la respuesta a estímulos dolorosos llevados por fibras de menor calibre de las neuronas de la columna dorsal medular1. Basado en este principio, el primer aparato para estimulación de la médula espinal (EME) se introdujo en 19682. En 1984 se introdujeron los generadores de impulsos implantables (Itrel Medtronic®) y electrodos percutáneos programables. Desde 2004 se dispone de aparatos con baterías recargables (p.ej., Restore Medtronic®). En las últimas dos décadas se ha extendido el uso de EME, y se estima cada año se implantan alrededor de 30.000 sistemas3.
Mecanismos de acción y paradigmas de estimulaciónEl primer paradigma de estimulación disponible fue el hoy denominado convencional o tónico. Los electrodos colocados epiduralmente se usan con frecuencias de 35-80Hz, amplitudes de 200-450μs y amplitudes promedio de 5-6mA. Este modo de estimulación genera parestesias en el área a tratar4. La forma de actuar de la EME depende de la distribución de los campos eléctricos en las estructuras espinales (duramadre, líquido cefalorraquídeo), así como del efecto relativo de la posición y la distancia de los cátodos y los ánodos en la activación de las columnas dorsales5,6. La anisotropía de las fibras en la sustancia blanca expone también diferentes grados de conductividad que influyen el efecto de la estimulación eléctrica7. En los años moventa Barolat8 proporcionó mapas de respuestas sensoriales y añadió información a la correlación de las propiedades anatómicas y eléctricas con el efecto clínico.
Desde una perspectiva simplista, se había considerado que el efecto de la estimulación se limitaba a las columnas posteriores9. Sin embargo, existen claras diferencias en el umbral de estimulación de las fibras aferentes de las raíces nerviosas que entran en la médula espinal y las fibras nerviosas de las columnas posteriores10. Un efecto segmental se sostiene también por el hecho de ser más efectiva la estimulación a un nivel más rostral respecto a una zona lesionada11. Del mismo modo, la EME activa zonas cerebrales que envían estímulos inhibidores de dolor en segmentos inferiores12.
A nivel molecular, el efecto se explica por la modulación de los aminoácidos asociados con el sistema de inhibición local del neurotransmisor GABA (ácido gamma amino butírico)13,14. Especialmente, el receptor tipoB del sistema gabaérgico parece ser influido por la estimulación eléctrica15. No obstante, otras sustancias participan también, como la sustanciaP (SP) y la serotonina (5-HT), que tienen un efecto inhibitorio en la transmisión de señales de dolor16. Así mismo, existen datos sobre la participación de un sistema noradrenérgico descendente. Los neurotransmisores excitatorios, glutamato y aspartato tienen más bien una función amortiguadora, dado que estos disminuyen con la EME17. Mientras que la adenosina y la acetilcolina influyen en el efecto de la EME, el sistema de endorfinas endógenas no parece contribuir18-20.
La estimulación de alta frecuencia en ráfaga (high-frequency burst), o simplemente alta frecuencia, son dos nuevas variantes disponibles. La estimulación en forma de ráfaga supone una señal más parecida a la existente en la propagación de la actividad del sistema nervioso central21. De tal forma que el estímulo se da a bajas frecuencias (40Hz) con 5 pulsos estrechamente espaciados (1ms) a 500Hz por ráfaga o bien 3pulsos de 100Hz, los cuales van seguidos de una fase de repolarización. Este tipo de estimulación también es llamado libre de parestesias. En comparación con las formas tónicas, esta variante proporciona una carga menor por pulso y, al mismo tiempo, una mayor carga por segundo4. Esta carga elevada por segundo supone una modulación de las neuronas implicadas en la transmisión del dolor. La estimulación en ráfaga activa también áreas cerebrales, como el cíngulo dorsal anterior y la corteza dorsolateral central22. La estimulación a altas frecuencias implica el uso de dimensiones de 10.000Hz con un ancho de pulso de 30ms y baja amplitud (alrededor de 2-3A). Las ventajas sobre la estimulación tónica son aún controvertidas, aunque es evidente que la ausencia de parestesia podría resultar más confortable23,24.
Indicaciones para el manejo del dolorSíndrome de cirugía espinal fallida, radiculopatía y lumbagoEl síndrome de cirugía espinal fallida (failed back surgery syndrome) es una entidad clínica reconocida que se define por la persistencia del dolor a pesar de haber tenido una cirugía espinal exitosa o como dolor que reaparece después de una operación que primariamente se dirigía contra el propio dolor25. En estudios iniciales la EME mostró una eficacia a largo plazo del 50% en la reducción del dolor y del 41-84% en la reducción del uso de analgésicos26-28. Esta reducción del dolor fue confirmada más recientemente por dos estudios clínicos controlados, los cuales se compararon con operación de revisión29 o manejo médico convencional (PROCESS-Trial)30. El manejo convencional se refiere a analgésicos, bloqueo neural, esteroides epidurales, terapia física y psicológica. Los resultados de mejoría solo han sido documentados en casos de dolor radicular29,30. Un metaanálisis que incluye 74 estudios reportó un nivel promedio de mejora del 58% tras un seguimiento de 24meses31. Los resultados del estudio PROMISE (NCT01697358), que se completó en junio de 2017, sugieren un efecto aditivo del uso de EME y manejo convencional32,33. Nuevas modalidades de EME, como la estimulación de alta frecuencia, no parecen ofrecer ventajas en el manejo34. Sin embargo, la aplicación de electrodos multicolumna podría ser más efectiva en el control del dolor radicular y axial35.
Existe un equivalente de este síndrome que implica la región cervical (failed neck surgery syndrome). La evidencia del uso de EME para su manejo es escasa. En una serie de 15 pacientes, Hunter et al.36 demostraron la utilidad de esta forma de terapia tras un seguimiento de 12meses. Otro estudio ha sugerido la mejora de la calidad de vida37.
Aunque el dolor lumbar y/o radicular crónico se puede manejar con EME, es poco claro el impacto en pacientes sin cirugía espinal previa, dado que la vasta mayoría de estudios incluyen toda clase de pacientes con dolor crónico. Por ejemplo, en el estudio de Kapural et al.38 solo el 13% de los pacientes en ambos grupos de comparación no habían sido operados previamente. En el estudio SCS-LUMINA, alrededor del 36% fueron considerados como síndromes de cirugía espinal fallida39. En este estudio se analizó un subgrupo robusto de pacientes que exclusivamente tuvieron dolor lumbar sin componente radicular. Si bien el dolor radicular suele responder mejor que el dolor lumbar, la introducción de nuevas tecnologías parece ser capaz de superar este problema (p.ej., 3D neural targeting)39. Otro factor que influye en el resultado de la EME es la coexistencia de otras patologías, como neuropatía periférica, reemplazo articular y fracturas. Granville et al.40 sugieren en su estudio que la EME puede ser útil para el control del dolor incluso cuando coexisten causas múltiples del dolor.
Síndrome doloroso regional complejoEl síndrome doloroso regional complejo (complex regional pain syndrome [CRPS]) se caracteriza por la presencia de dolor persistente y desproporcionado acompañado de anormalidades sensoriales, vasomotoras y sudorativas, así como de cambios motores y tróficos del área involucrada41. La EME puede resultar efectiva en pacientes seleccionados con una fase de prueba exitosa41,42. En una revisión sistemática, que incluyó 30 estudios, se pudo concluir que la EME es efectiva para reducir la percepción del dolor y aumentar la calidad de vida43. No obstante, el efecto sobre la funcionalidad, la calidad del sueño y la resolución de los signos del síndrome es poco claro.
Neuropatía diabética y otras neuropatíasLa neuropatía diabética es una complicación común de la enfermedad que frecuentemente es difícil de tratar farmacológicamente. En los casos en que la terapia convencional no alcanza una reducción sustancial de dolor, la EME puede ser útil. En un estudio clínico aleatorizado que incluyó 60 pacientes se pudo demostrar la efectividad de la EME al reducir la intensidad del dolor en más del 50% y al mejorar la calidad de vida después de 6meses de terapia44. Otro estudio reportó una mejora de hasta el 77% en la fase de prueba y del 59% con estimulación permanente durante 6meses45. En un análisis del efecto después de 5años se observó una respuesta del 55% y una suspensión de la estimulación en el 20% de los casos. La severidad de la neuropatía impacta directamente la probabilidad de éxito de la EME a largo plazo46.
El uso en otras neuropatías ha sido reportado exitosamente, por ejemplo, en neuropatía asociada al virus de inmunodeficiencia humana (VIH) o posquimioterapia47,48. Un caso de neuropatía de fibras pequeñas respondió favorablemente a la EME toracolumbar49. Asimismo, existen experiencias sobre la aplicación de EME en casos de neuropatía del nervio trigémino y neuropatía asociada al virus herpes zoster50,51.
Dolor de tipo fantasmaExisten reportes sobre el uso exitoso de la EME para tratar el dolor de tipo fantasma52-54. Sin embargo, no existe una evidencia sólida que pueda sustentar su uso generalizado55,56.
Angina pectoris y enfermedad vascular periféricaEn pacientes con enfermedad coronaria que desarrollan un cuadro anginoso crónico se ha aplicado la EME con éxito. Un metaanálisis que incluyó 12 estudios con un total de 476 pacientes con angina refractaria demostró que tras aplicar la EME se lograba tanto una reducción de los ataques anginosos como del consumo de nitroglicerina57. Otro estudio similar con 518 participantes de 14 estudios llegó a una conclusión semejante58. No obstante, en comparación con otros métodos, como injerto tipo derivación coronaria o revascularización láser miocárdica percutánea, no existen diferencias sustanciales59.
Para el manejo de la enfermedad vascular periférica, la EME ofrece algunas ventajas. La EME puede inducir una activación celular que redunda en la liberación de sustancias vasodilatadoras, la disminución de las resistencias vasculares y la relajación del músculo liso, además de suprimir la vasoconstricción simpática60. Especialmente es de considerar este procedimiento en pacientes en los que no es posible una reconstrucción vascular49. En un metaanálisis de 6 estudios (n=450 pacientes) se pudo demostrar una probabilidad más alta de evitar amputación (riesgo relativo: 0,71) al aplicar EME, además de reducir el dolor y mejorar el grado de severidad61.
Dolor neuropático secundario a tumorCon el incremento de la supervivencia en los pacientes oncológicos se observa al mismo tiempo un aumento del dolor crónico como consecuencia del tumor o secuela de la terapia del mismo. Se estima que existen alrededor de 7 millones de pacientes con dolor crónico asociado a cáncer, y el 15% de esta población podría no alcanzar una reducción suficiente del dolor62,63. Las terapias quirúrgicas ablativas han sido populares en el tratamiento, pero con sus claras desventajas64. La EME en pacientes con dolor neuropático secundario a tumor ha sido poco explorada62,65. Una revisión de la literatura encontró diversas series, pero ningún estudio clínico aleatorizado. En total, 92 pacientes con dolor neuropático secundario a tumor fueron analizados y se mostró una clara reducción del dolor66. Evidentemente, se requieren más estudios antes de poder recomendar su uso rutinariamente.
Otras indicaciones emergentes no relacionadas con el manejo del dolorSíndrome de Parkinson y otros trastornos del movimientoEl síndrome de Parkinson es la segunda enfermedad neurodegenerativa más frecuente y se caracteriza por una discapacidad progresiva e irreversible generada por la rigidez, la bradicinesia y los trastornos cognitivos y vegetativos. Los síntomas aparecen como consecuencia de la reducción de las neuronas dopaminérgicas en la sustancia nigra pars compacta (SNpc)67. La terapia farmacológica es a menudo insuficiente para el control de los síntomas axiales motores (trastornos de la marcha y postura, congelación de la marcha y disfagia). La estimulación cerebral profunda del núcleo subtalámico (STN) o del globo pálido interno (GPi) se ha convertido en una opción real de tratamiento68-70. Sin embargo, para pacientes con síntomas predominantemente axiales suele ser poco efectiva.
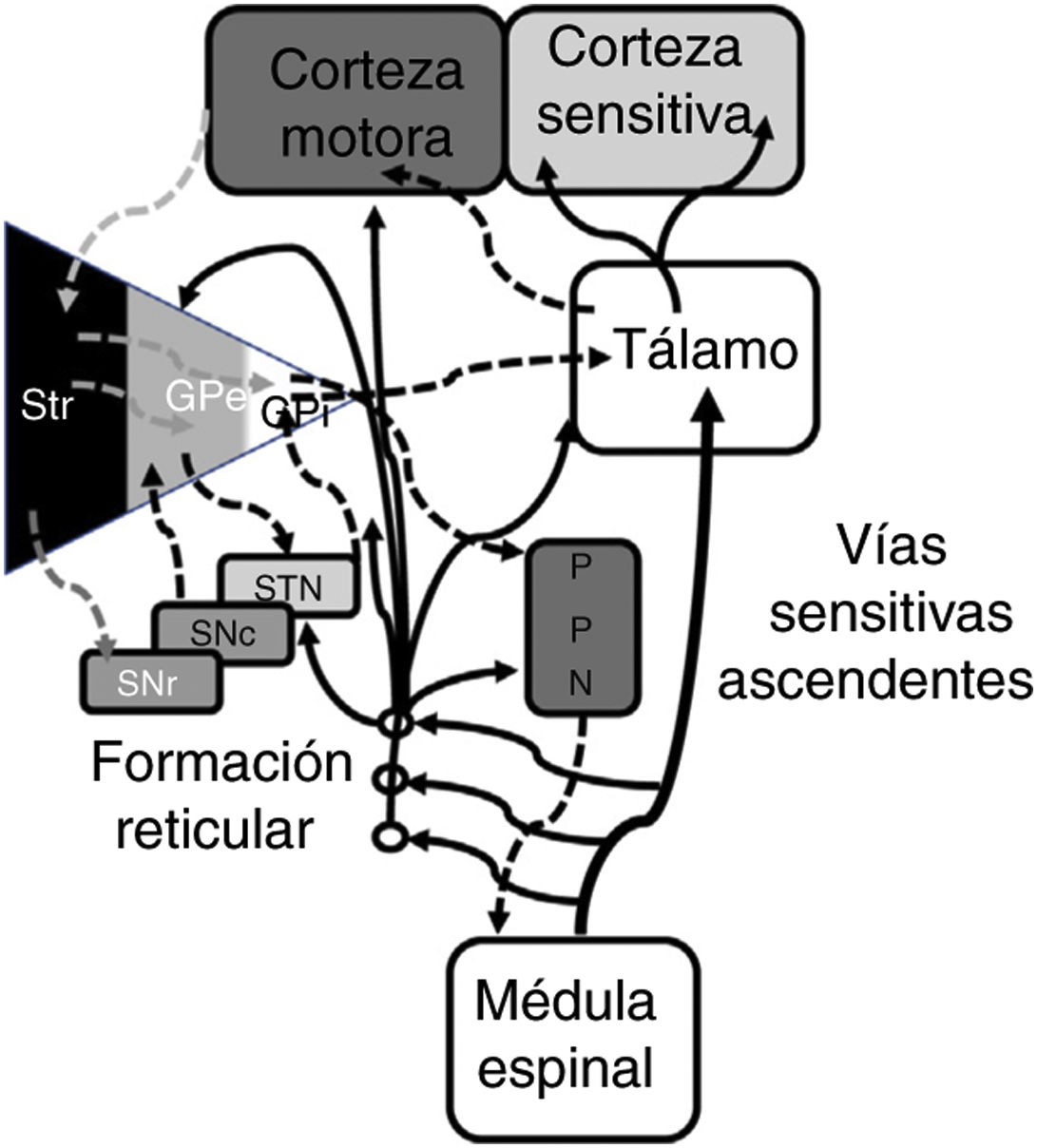
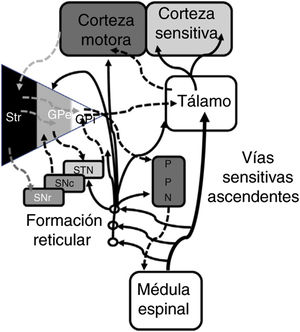
En 1978, Gildenberg71 aplicó por primera vez una sonda de EME en pacientes con tortícolis. En 2009, Fuentes et al.72 mostraron en un modelo animal el efecto benéfico de la EME torácica. En una revisión sistemática de la literatura, el grupo de De Andrade73 analizó 24 pacientes de 8 estudios diferentes. Se constató una mejoría de los síntomas centrales (marcha y postura) en el 75% de los pacientes. Desde un punto de vista electrofisiológico, la actividad beta patológica oscilatoria de las neuronas corticobasales es responsable de la bradicinesia y del temblor74. El complejo STN-globo pálido externo (GPe) funciona a modo de marcapasos dentro de un sistema cerrado que en última instancia genera potenciales en ráfaga de bajas frecuencias. Las señales generadas en el núcleo pálido modulan el sistema al inhibir la actividad neuronal del GPe73. Experimentalmente se ha visto que la EME reduce la actividad patológica corticoestriatal beta, además de actuar lejanamente en estructuras como la región locomotora mesencefálica72. Esta región locomotora mesencefálica incluye núcleos tales como el núcleo pedunculopontino (PPN) y el cuneiforme 75. El PPN se proyecta con fibras colinérgicas y glutamatérgicas en las neuronas de la corteza, núcleos de la base, tálamo, tallo cerebral y médula espinal76 (fig. 2). En la actualidad, el uso rutinario de la EME en trastornos del movimiento no se puede justificar; se necesitan más estudios básicos y estudios clínicos de fase temprana.
Representación sistemática de las redes motoras directas e indirectas entre los núcleos de la base, el tálamo y la corteza, así como de las vías para el control de la marcha y postura proyectadas desde de los núcleos de la base al PPN y médula espinal. Las fibras ascendentes sensitivas dan información sobre los componentes musculoesqueléticos y activan la formación reticular del tallo cerebral.
GPe: globo pálido externo; GPi: globo pálido interno; PPN: núcleo pedunculopontino; SNc: substantca nigra pars compacta; SNr: substancia nigra pars reticulada; STN: núcleo subtalámico; Str: estriado.
Modificado de De Andrade et al.73.
La espasticidad resulta de un desacoplamiento del sistema nervioso central y periférico. Los pacientes con espasticidad desarrollan dolor y contracturas que afectan las actividades cotidianas y limitan la recuperación neurológica. El tratamiento con medicamentos o medidas quirúrgicas puede disminuir los síntomas, pero no es curativo ni restaurativo ni mucho menos selectivo. En este sentido, la EME ofrece la oportunidad de reactivar los circuitos neuronales77.
En humanos, el reflejo de estiramiento es regulado por el tracto reticuloespinal dorsal (inhibición) y medial (excitación). El tracto vestibuloespinal también es un facilitador, aunque su función es más bien reguladora, de tal forma que una visión simplificada supone que la hiperactividad de las motoneuronas gamma contribuye al desarrollo de un reflejo de estiramiento exagerado78. Sin embargo, la fisiopatología es mucho más compleja, dado que las descargas espinales dependen no solo de aferentes corticales sino también de un sistema neuromodulador propio regulado por aferentes metabolotrópicos del tallo cerebral originados como fibras noradrenérgicas (NA) y serotoninérgicas del locus coeruleus y del rafe magno79,80. La disfunción de los sistemas extrapiramidales contribuye a la hiperexcitabilidad de las interneuronas que median los reflejos polisinápticos80. También se ha visto que la disrupción de los sistemas neuromoduladores descendentes altera el patrón de señales sensitivas que alcanzan las neuronas del asta medular ventral81. De esta forma se pierde la inhibición recíproca que enfoca hacia una articulación dada. Tras una lesión medular se reajustan gradualmente los receptores de NA y 5-HT a un estado constitutivo de activación incluso en ausencia de estos neurotransmisores82.
Además, las entradas periféricas, incluyendo aferentes monosinápticos sensoriales y señales polisinápticas, son capaces de inducir despolarizaciones potentes en las motoneuronas espinales. Así, los músculos inervados por estos grupos neurales pueden activarse inapropiadamente y exacerbar la espasticidad. Otros fenómenos moleculares, como la reducción del transportador de potasio cloro (potassium-chloride co-transporter [KCC2]), contribuyen al mantenimiento de la espasticidad83. Después de una lesión medular, las señales generadas en la corteza o en los núcleos de la base son irreconocibles, incompletas o incluso no son recibidas. Con el tiempo, la excitabilidad de las motoneuronas regresa con áreas de receptividad ampliadas, lo cual aumenta la activación aberrante y puede explicar la extensión de la espasticidad a un miembro completo84.
Existen diversos informes de casos y series, así como algunos estudios piloto y prospectivos que sugieren el uso de EME en más de 25 enfermedades neurodegenerativas y traumáticas77,85. Existen múltiples criterios que deben considerarse para aplicar EME en el manejo de la espasticidad. La médula espinal en el área debajo de la lesión debe estar anatómicamente y fisiológicamente intacta, además de que debe existir cierto grado de comunicación con señales supraespinales. En general, el uso rutinario de EME en pacientes con espasticidad no está afianzado aún.
Trauma medular: rehabilitaciónUna lesión traumática de la médula espinal genera trastornos neurológicos graves, y aunque la mortalidad ha disminuido, la recuperación funcional continúa siendo un reto86,87. Los diversos cambios celulares que ocurren durante un proceso traumático, desde la lesión misma hasta la fase de recuperación, han sido ampliamente estudiados88. El uso de medidas neuroprotectivas no ha arrojado el resultado deseado y múltiples terapias, incluyendo las basadas en el uso de células madre, continúan siendo investigadas88. La descompresión quirúrgica temprana se ha establecido como una medida que contribuye a la recuperación89. El concepto de manejo actual se dirige principalmente a la prevención y el manejo de las complicaciones86.
La correlación entre los segmentos medulares y la EME ha sido descrita tempranamente durante el desarrollo de esta tecnología90. Si bien las interneuronas o las motoneuronas no se estimulan directamente, se puede lograr un efecto trans-sináptico91. Las redes neuronales de la médula lumbar son capaces de llevar descargas coordinadas a los músculos de las extremidades inferiores independientemente del efecto supraespinal90. La EME a frecuencias bajas (2Hz) puede generar reflejos monosinápticos91. Al aumentar la frecuencia se pueden reducir las descargas motoras, aunque simultáneamente se pueden activar circuitos interneuronales que redundan en la generación de un patrón de descarga estable92. La EME a frecuencias de 22-50Hz induce cambios electromiográficos parecidos a los generados por la actividad locomotora e incluso puede producir movimientos de flexión o extensión93,94. Existe clara evidencia de la presencia de sustancia blanca residual funcional incluso en pacientes que clínicamente muestran lesión medular completa95. También es claro que la influencia de estructuras supraespinales puede preservarse96.
Existen experiencias clínicas con EME que sugieren la mejoría de la función motora en presencia de una lesión medular, incluyendo informes de pacientes con paraparálisis87-105. Actualmente existe un gran interés en desarrollar estrategias de implantación que puedan facilitar el uso de la EME para restablecer la función motora106. El uso de la EME podría incluso ir más allá de la recuperación de la función motora y del manejo del dolor; de esta manera los circuitos implicados en la regulación de la función vesical, intestinal y sexual también pueden ser reactivados, contribuyendo a la mejoría de la calidad de vida107,108.
Perspectivas para el futuroDos disyuntivas dificultan actualmente el uso generalizado de la EME. Por un lado, las complicaciones derivadas de su uso y, por otro, el costo de la terapia109-113. Además de las complicaciones quirúrgicas clásicas, como infección, especialmente existen en esta forma de terapia las complicaciones mecánicas, como migración o rotura de los electrodos, así como las molestias que puede ocasionar el generador de impulsos (alrededor del 6%) y la necesidad de recambio por desgaste de la batería112,114, aunque esta problemática de recambio regular del generador de impulsos ha mejorado tras la introducción de sistemas recargables. También es de destacar que la mejora tecnológica y el perfeccionamiento de las técnicas de implantación han contribuido a que el rango de complicaciones disminuya115.
En cuanto al costo, se puede decir que, aunque es alto, la relación costo-beneficio en cuadros de dolor por CRPS o síndrome de cirugía espinal fallida justifica su aplicación109,116. En términos temporales, si bien el primer año de terapia implica un costo alto, este es compensado por un decremento anual constante si comparamos la EME con una terapia convencional117. La Sociedad Británica del Dolor recomienda textualmente que la EME debe ser considerada tempranamente en el manejo cuando las terapias de primera línea han fallado118. Aunado a esta recomendación está el hecho de que el tiempo entre el diagnóstico de dolor crónico y la implantación de una EME resulta directamente en un aumento de gastos médicos totales, de prescripciones y de pago de opiáceos, así como del número de visitas médicas119. En general, se puede decir que la EME parece tener una clara ventaja de costo-beneficio en el 80-85% de los casos, aunque la demora de la implantación de una EME genera una mayor utilización de recursos del sistema de salud120. Finalmente, la estimulación de alta frecuencia podría ser incluso aún mejor en cuestión de costo-efectividad en casos de cirugía espinal fallida121.
La ley de Moore, introducida en el mundo tecnológico en 1965, designa que el número de transistores en un circuito densamente integrado se dobla a intervalos regulares (aproximadamente 2años). Según esta ley, se puede prever claramente que los generadores para EME disminuirán aún más en tamaño y aumentarán en potencia. Paralelamente a la mejora del hardware habrá mejoras del software, lo que conllevará a la aparición de nuevos paradigmas de estimulación o generadores de impulsos actualizables122. Existen cuatro corrientes principales en el desarrollo de paradigmas: en ráfaga pseudo-aleatorizada en tiempo o espacio, estimulación placentera, ruidosa y de reconocimiento122. ÿntimamente aunado al último concepto de estimulación de reconocimiento está la estimulación de asa cerrada, es decir, la que se modula o se adapta según los cambios fisiológicos123. Un ejemplo de esta tecnología la exhibe el sistema RestoreSensor®, que utiliza un acelerómetro de tres ejes y detecta la posición del paciente. Los parámetros de la estimulación se ajustan automáticamente en tiempo real124.
Razonablemente, los avances se darán no solo en el generador de impulsos, sino también en los electrodos que se utilizan. Las llamadas interfaces suaves podrían colocarse subduralmente, lo que permitiría una mayor selectividad con menores umbrales de estimulación e incluso una estimulación química. Estas interfaces han sido evaluadas in silico e in vivo125. Otro ejemplo de estas interfaces suaves es la denominada e-dura (duramadre electrónica)126.
Es evidente el problema que en la actualidad representan los trastornos del sistema nervioso central, incluido el dolor crónico. En Estados Unidos y en Europa se estima un desembolso de dos quintillones de dólares anuales con este tipo de pacientes127. La problemática que existe actualmente en el desarrollo de fármacos en neurociencias radica en que un fármaco en investigación tiene pocas posibilidades de llegar a comercializarse, y de base exhibe un costo de desarrollo y de venta mayores, por ejemplo, en comparación con un medicamento cardiológico (30% mayor), de tal forma que la industria farmacéutica podría dejar de estar interesada en el desarrollo de nuevos fármacos para enfermedades del sistema nervioso central127. En este punto crítico es donde se especula sobre la aparición de la denominada electrocéutica, que implicaría un tratamiento basado en la entrega de impulsos eléctricos a través de transportadores en forma de nanopartículas127.
ConclusiónDespués de 50 años de la introducción de la EME se han producido diversos cambios tecnológicos, y los más relevantes han tenido lugar durante los últimos años. A medida que se perfeccione el hardware y el software se podrá mejorar la efectividad y reducir el rango de complicaciones. Es también de esperar que la indicación para la EME se extienda a otras enfermedades. Y si, además, se logra desarrollar una tecnología asequible, su aplicación podría expandirse a regiones con sistemas de salud menos favorecidos.
Conflicto de interesesEl autor ha presentado para la firma Medtronic™ un simposio en la reunión anual de la Sociedad Alemana de Neurocirugía 2018 en Münster.