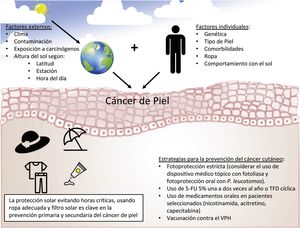
El cáncer cutáneo no melanoma (CCNM) es la neoplasia más prevalente en el ser humano; incluye al carcinoma basocelular (CBC) y al carcinoma epidermoide cutáneo (CEC), y su prevalencia ha aumentado en los últimos años1. En la etiopatogenia del CEC intervienen numerosos factores como alteraciones genéticas, daño crónico por la radiación ultravioleta, infecciones por el virus del papiloma humano (VPH) y la inmunosupresión, entre otros2. El CEC frecuentemente se origina de lesiones precursoras como las queratosis actínicas (QA) y el campo de cancerización3. El tratamiento del CCNM es fundamentalmente quirúrgico, y puede ocasionar importante morbilidad y elevados costes sanitarios4. La tasa de mortalidad específica del CCNM es baja. Sin embargo, la supervivencia es de tan solo 2 años en aquellos pacientes con CEC metastásico5. Además, el CCNM, especialmente el CEC, pareciera asociarse a una mayor mortalidad global (tabla 1)6.
El cáncer cutáneo no melanoma como problema de salud pública
| Es la neoplasia más frecuente en la especie humana |
| Puede producir significativa morbilidad y afectación de la calidad de vida |
| Su tratamiento puede ser uno de los más costosos para el sistema sanitario (dada su alta prevalencia) |
| Su mortalidad específica es baja. Sin embargo, podría aumentar la mortalidad global |
En las últimas décadas se han instaurado campañas de fotoprotección, y el tratamiento del campo de cancerización ha cobrado especial relevancia7,8. A continuación presentamos una revisión de la literatura identificando estrategias farmacológicas y no farmacológicas para la prevención del cáncer cutáneo.
Patogenia del carcinoma epidermoide cutáneoEl CCNM contiene las mayores cargas mutacionales detectadas en neoplasias9. Las mutaciones genéticas inducidas por la exposición crónica y de alta intensidad a la radiación ultravioleta son claves para el desarrollo del CEC. Las mutaciones más comunes incluyen las del gen codificante de p5310. Otras mutaciones drivers son las de NOTCH y MAPK, pero múltiples mutaciones han sido detectadas en CDKN2A, HRAS, FAT1, MMP1, CASP8, RIPK4 y KMT2C11. La subsecuente exposición sostenida a dosis bajas de radiación ultravioleta llevaría a la expansión clonal de células con mutaciones de p53 y a la formación de lesiones precancerosas como QA12, y de CEC.
Lesiones precursoras de carcinoma epidermoide cutáneoEl CEC puede desarrollarse a partir de QA y del campo de cancerización. El campo de cancerización es una zona expuesta crónicamente a radiación ultravioleta, con atipia clínica multifocal, caracterizada por QA y/o CEC in situ, con o sin la presencia de CEC invasivos13,14. La tasa de progresión de las QA a CEC aumenta significativamente a mayor número de QA15, y puede ser aún mayor en aquellos pacientes con campo de cancerización13. El manejo adecuado de estas lesiones es clave, y podría disminuir el desarrollo de CEC y mejorar la calidad de vida16.
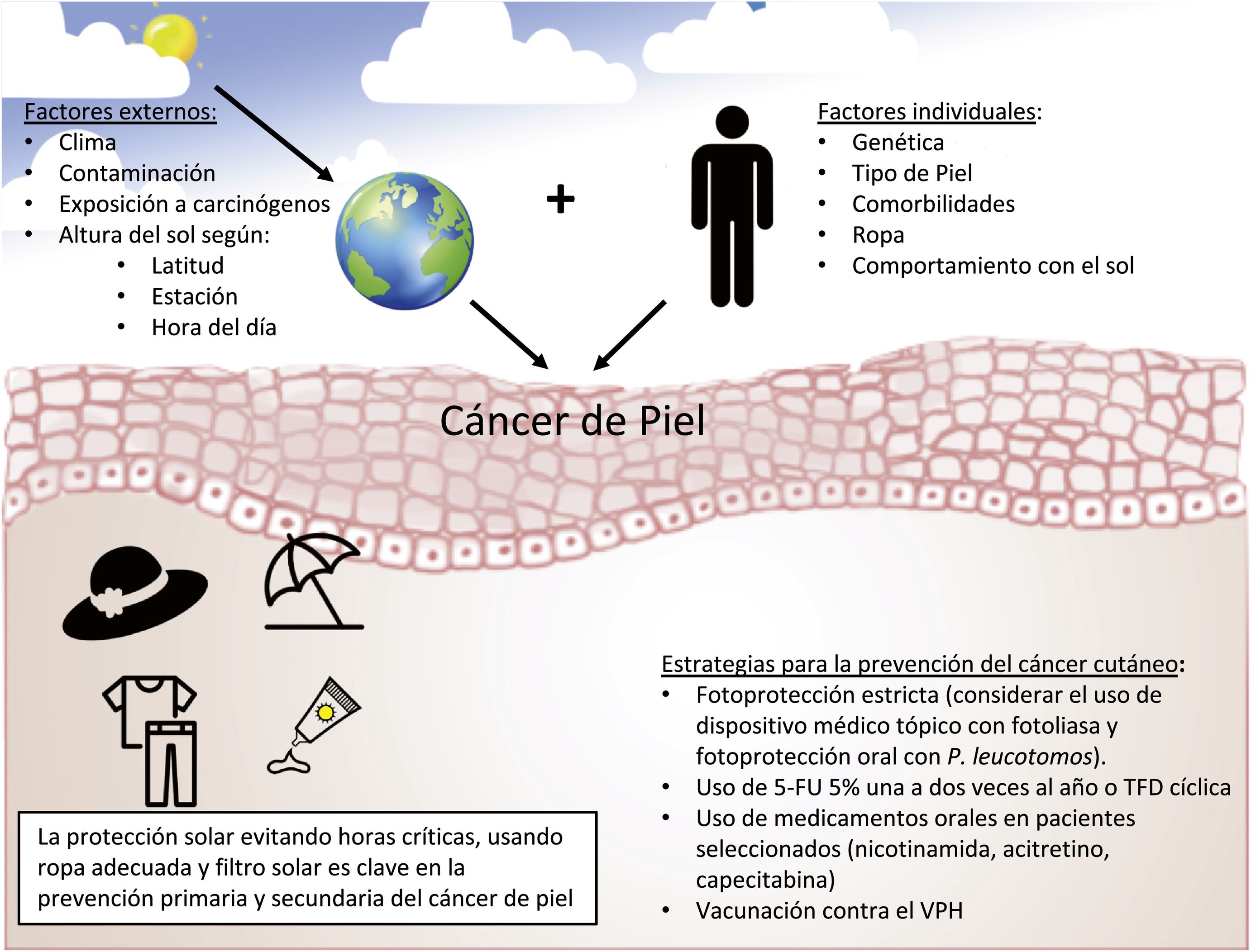
Prevención del carcinoma cutáneoPrevención primariaSu objetivo es disminuir los factores de riesgo asociados con el desarrollo del CCNM y de sus lesiones precursoras, en especial, disminuir la exposición a la radiación ultravioleta. Incluye evitar la exposición solar durante las horas más críticas del día, el uso de ropa adecuada, evitar las cabinas de bronceado y el uso de fotoprotectores tópicos y/u orales, entre otros. Pese a que la evidencia sobre la utilidad de la fotoprotección tópica en la prevención del CCNM es limitada17, el uso de fotoprotectores tópicos es ampliamente recomendado18.
Prevención secundariaIncluye un conjunto de estrategias y terapias farmacológicas y no farmacológicas en los pacientes con alto de riesgo de desarrollar CCNM (tabla 2)19.
Pacientes de alto riesgo en quienes considerar realizar prevención secundaria de cáncer cutáneo
| Inmunosuprimidos | Trasplantados de órgano sólido |
| Pacientes con VIH | |
| Individuos con neoplasias hematológicas (leucemia linfocítica crónica, linfoma no hodgkiniano) | |
| Pacientes bajo agentes inmunosupresores | |
| Síndromes genéticos | Xeroderma pigmentoso |
| Epidermólisis ampollosa distrófica recesiva | |
| Síndrome de Gorlin | |
| Epidermodisplasia verruciforme | |
| Albinismo | |
| Síndrome de Bazex | |
| Síndrome de Rombo | |
| Síndrome de Rothmund-Thomson | |
| Historia previa de cáncer cutáneo | Múltiples CCNM |
| CCNM en zonas de alto riesgo | |
| CCNM metastásico | |
| Queratoacantomas eruptivos | |
| Fotodaño grave | Numerosas QA o campo de cancerización extenso |
CCNM: carcinoma cutáneo no melanoma; QA: queratosis actínicas.
Fuente: Nemer et al.19.
Existe importante evidencia sobre la efectividad de diversos agentes en el tratamiento de las QA y del campo de cancerización. Los tratamientos más efectivos serían el 5-fluorouracilo 5% (5-FU), la terapia fotodinámica (TFD) y el imiquimod20. Otras alternativas de menor efectividad son el ingenol mebutato, el diclofenaco y otros antiinflamatorios tópicos21, y los peelings, entre otros14. Sin embargo, la evidencia sobre la efectividad de estas terapias en la prevención del desarrollo de nuevos CCNM es limitada, y solo un puñado de fármacos tópicos y sistémicos han demostrado su eficacia. A continuación, expondremos las diversas alternativas disponibles (tabla 3).
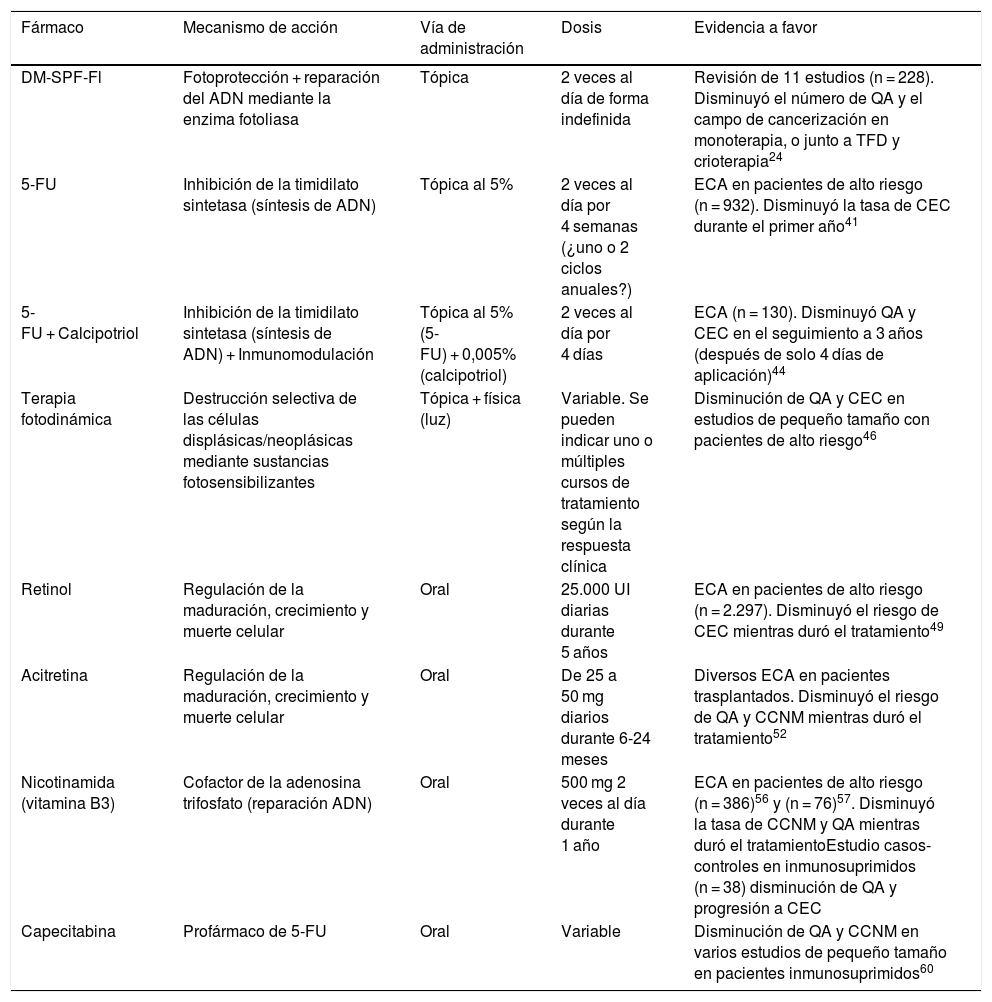
Alternativas farmacológicas y no farmacológicas disponibles para la prevención del cáncer cutáneo no melanoma
| Fármaco | Mecanismo de acción | Vía de administración | Dosis | Evidencia a favor |
|---|---|---|---|---|
| DM-SPF-Fl | Fotoprotección + reparación del ADN mediante la enzima fotoliasa | Tópica | 2 veces al día de forma indefinida | Revisión de 11 estudios (n = 228). Disminuyó el número de QA y el campo de cancerización en monoterapia, o junto a TFD y crioterapia24 |
| 5-FU | Inhibición de la timidilato sintetasa (síntesis de ADN) | Tópica al 5% | 2 veces al día por 4 semanas (¿uno o 2 ciclos anuales?) | ECA en pacientes de alto riesgo (n = 932). Disminuyó la tasa de CEC durante el primer año41 |
| 5-FU + Calcipotriol | Inhibición de la timidilato sintetasa (síntesis de ADN) + Inmunomodulación | Tópica al 5% (5-FU) + 0,005% (calcipotriol) | 2 veces al día por 4 días | ECA (n = 130). Disminuyó QA y CEC en el seguimiento a 3 años (después de solo 4 días de aplicación)44 |
| Terapia fotodinámica | Destrucción selectiva de las células displásicas/neoplásicas mediante sustancias fotosensibilizantes | Tópica + física (luz) | Variable. Se pueden indicar uno o múltiples cursos de tratamiento según la respuesta clínica | Disminución de QA y CEC en estudios de pequeño tamaño con pacientes de alto riesgo46 |
| Retinol | Regulación de la maduración, crecimiento y muerte celular | Oral | 25.000 UI diarias durante 5 años | ECA en pacientes de alto riesgo (n = 2.297). Disminuyó el riesgo de CEC mientras duró el tratamiento49 |
| Acitretina | Regulación de la maduración, crecimiento y muerte celular | Oral | De 25 a 50 mg diarios durante 6-24 meses | Diversos ECA en pacientes trasplantados. Disminuyó el riesgo de QA y CCNM mientras duró el tratamiento52 |
| Nicotinamida (vitamina B3) | Cofactor de la adenosina trifosfato (reparación ADN) | Oral | 500 mg 2 veces al día durante 1 año | ECA en pacientes de alto riesgo (n = 386)56 y (n = 76)57. Disminuyó la tasa de CCNM y QA mientras duró el tratamientoEstudio casos-controles en inmunosuprimidos (n = 38) disminución de QA y progresión a CEC |
| Capecitabina | Profármaco de 5-FU | Oral | Variable | Disminución de QA y CCNM en varios estudios de pequeño tamaño en pacientes inmunosuprimidos60 |
5-FU: 5-fluoracilo; DM-SPF-Fl: dispositivo médico con fotoprotector de amplio espectro y fotoliasa; ECA: ensayo clínico aleatorizado; EOR: especies de oxígeno reactivo; FPS: fotoprotección solar; QA: queratosis actínica; TFD: terapia fotodinámica.
Según los resultados de un ensayo clínico aleatorizado (n = 1.621) el uso diario de fotoprotector tópico podría disminuir la incidencia de CEC22. En un estudio prospectivo el uso diario de un fotoprotector SPF 50+ se asoció a un menor número de QA, CEC y CBC en trasplantados de órgano sólido (TOS) durante los 24 meses de duración del estudio23.
Fotoprotección activaLa fotoliasa es una enzima capaz de reparar los daños del ADN inducidos por la radiación ultravioleta. Una reciente revisión encontró 11 estudios con un total de 228 pacientes que demostraron la efectividad de un dispositivo médico con fotoprotector de amplio espectro y fotoliasa (DM-SPF-Fl) (Eryfotona AK-NMSC®) en los pacientes con QA24. Múltiples estudios demostraron que DM-SPF-Fl disminuye la formación de dímeros de ciclobutano pirimidina, la apoptosis celular25 y mejora el campo de cancerización26–30. En diversos estudios aleatorizados el uso del DM-SPF-Fl disminuyó significativamente el número de QA y el campo de cancerización en la evaluación a los 6 meses desde el inicio del estudio31,32, y redujo la aparición de nuevas lesiones. Esta reducción fue significativamente mayor que la conseguida con fotoprotectores tradicionales32. Un ensayo clínico aleatorizado y ciego que incluyó 30 individuos con QA comparó la eficacia de DM-SPF-Fl vs un fotoprotector estándar (SPF 50+) en reducir el riesgo de desarrollar nuevas QA después de realizar TFD. A los 9 meses de tratamiento, el grupo con DM-SPF-Fl presentaba una reducción marcada de las QA. Ningún paciente con DM-SPF-Fl requirió un nuevo tratamiento de campo, a diferencia del 66% de los individuos con fotoprotección estándar33. En un estudio retrospectivo con 8 pacientes con xeroderma pigmentoso, la utilización de DM-SPF-Fl redujo un 65% la incidencia de nuevas QA, un 56%, la de CBC y un 100%, la de CEC34. Consideramos que el uso de DM-SPF-Fl puede ser una alternativa valiosa en la prevención secundaria en individuos de alto riesgo.
Fotoprotección oralExisten disponibles presentaciones orales de extracto del Polypodium leucotomos (PL). El PL inhibe el estrés oxidativo inducido por la radiación ultravioleta y puede incrementar la expresión de p53. Estudios en modelos animales han demostrado que el PL puede disminuir el desarrollo de tumores cutáneos después de la exposición crónica a radiación ultravioleta35. Un estudio prospectivo aleatorizado con 34 pacientes con QA evaluó la efectividad de TFD y PL o TFD en monoterapia. El grupo con TFD + PL presentó un mayor aclaramiento de las QA y una menor tasa de recurrencia a los 6 meses de seguimiento36. El PL también se ha asociado a extracto de té verde. Los polifenoles del té verde tienen propiedades antiinflamatorias, antioxidantes y anticarcinogénicas, disminuyen el daño del ADN producido por la radiación ultravioleta, mediante la inducción de la interleucina 12, y se ha observado en modelos animales que disminuyen la incidencia y el tamaño del CCNM37.
Dado los mínimos efectos adversos del PL, este podría ser una opción en la prevención secundaria en los pacientes de alto riesgo o como prevención primaria en aquellos individuos con intensa exposición solar38.
5-fluorouraciloEl 5-FU inhibe a la timidilato sintetasa, enzima clave en la síntesis del ADN, induciendo apoptosis en las células con alto índice mitótico. El 5-FU 5% sería el agente más efectivo en el tratamiento de las QA y del campo de cancerización20,39,40. En cuanto a la prevención de CCNM, en un ensayo clínico que incluyó 932 individuos de alto riesgo, un ciclo de 5-FU 5% aplicado 2 veces al día por 2 a 4 semanas disminuyó en un 75% la incidencia de CEC que requería cirugía durante el primer año postratamiento41. La incidencia de CEC no disminuyó al cabo de 4 años de seguimiento. Probablemente se deban indicar cursos anuales de 5-FU para mantener su efecto protector. El análisis económico demostró que el tratamiento preventivo con 5-FU podría disminuir los costes sanitarios42.
En nuestra opinión el 5-FU 5% es la alternativa de elección en la prevención del CEC. En países donde no está disponible comercialmente, como en España, se puede formular en vaselina (más económico) o en base Beeler, e indicar una vez por la noche por uno o 2 meses para incrementar su tolerabilidad. En los pacientes de alto riesgo solemos indicar uno o 2 cursos anuales de tratamiento preventivo.
5-fluorouracilo en combinación con calcipotriolEl calcipotriol es un análogo de la vitamina D con un marcado efecto inmunomodulador. Un reciente ensayo clínico aleatorizado (n = 130) encontró una disminución significativa de las QA (87,8%) en el grupo tratado con calcipotriol 0,005% en combinación con 5-FU 2 veces al día durante solo 4 días, vs. el grupo tratado con 5-FU43. En el seguimiento a 3 años se detectó una reducción significativa de desarrollo de CEC en la cara y el cuero cabelludo en el grupo tratado con 5-FU + calcipotriol vs 5-FU en monoterapia (7% vs. 28%, respectivamente)44. Se requieren de más estudios para avalar esta nueva forma de inmunoterapia tópica.
Terapia fotodinámicaExisten diversas modalidades de TFD: TFD convencional, TFD con luz de día, TFD posláser ablativo fraccionado para incrementar la penetración del fotosensibilizante, entre otras. Un estudio abierto aleatorizado intrapaciente que incluyó 27 trasplantados renales con múltiples QA mostró que la TFD con ácido metilaminolevulinato incrementó el tiempo libre de desarrollo de nuevas lesiones cutáneas (no se diferenciaron entre QA, CCNM u otros tumores). A los 12 meses de seguimiento el 62% de las zonas tratadas no habían desarrollado un CCNM vs. el 35% de las zonas no tratadas45. Un estudio prospectivo no controlado con 12 trasplantados de órgano sólido evaluó la respuesta a TFD cada 4 a 8 semanas durante 2 años. Se objetivó una reducción del 79% de nuevos CEC a los 12 meses de seguimiento y del 95% a los 24 meses46.
La administración cíclica de TFD, especialmente posláser fraccionado, puede ser una opción a considerar en los pacientes de alto riesgo. El coste y accesibilidad a la TFD pueden ser un factor limitante.
Retinoides oralesPese a que la evidencia con retinol e isotretinoína puede ser contradictoria47–50, existe consenso en que la acitretina puede ser una buena alternativa en la prevención del desarrollo de CEC en población de alto riesgo, fundamentalmente en inmunosuprimidos51. Una reciente revisión sistemática describió una reducción del 60% en el desarrollo de nuevos CEC en trasplantados renales en tratamiento preventivo con acitretina52. En un ensayo clínico aleatorizado 23 trasplantados renales recibieron 25 a 50 mg de acitretina durante 12 meses, se observó una significativa reducción del desarrollo de CEC mientras recibieron el fármaco. Nueve de los 23 pacientes suspendieron el tratamiento por efectos adversos53. Otro ensayo clínico aleatorizado y controlado con placebo (44 trasplantados renales con > 10 QA) evaluó la administración de 30 mg/día de acitretina durante 6 meses. Se encontró una reducción significativa de nuevos CEC durante este periodo54. En otro ensayo clínico, 26 trasplantados renales fueron aleatorizados a recibir diversas dosis de acitretina por un año. Se describió una reducción del 50% de las QA, sin disminución del número de nuevos CEC, y 7 de los 26 individuos debieron suspender temporalmente el fármaco55.
Es importante recordar que en TOS la acitretina no interacciona con la medicación inmunosupresora ni se ha observado deterioro de la función renal, pero es conveniente decidir su iniciación junto al equipo de trasplante. Generalmente se inicia a dosis de 10 mg/día vía oral para aumentar progresivamente hasta 20-30 mg7. El tiempo de tratamiento es prolongado, dado que al suspender el fármaco se pierde el efecto protector y puede haber un rebrote de las lesiones. Los efectos adversos incluyen cefalea, alopecia, xerosis cutánea, artromialgias, hipertrigliceridemia, alteraciones del perfil hepático, entre otros.
NicotinamidaLa nicotinamida es la forma activa de la vitamina B3 y tiene un papel clave en la reparación del ADN. En un ensayo clínico aleatorizado que incluyó 386 pacientes de alto riesgo, la administración oral de 500 mg de nicotinamida vía oral 2 veces al día por 12 meses disminuyó significativamente el riesgo de presentar QA y CCNM (reducción del riesgo del 23% [IC 95%: 4-38%. P = 0,02]). A los 6 meses postratamiento ya no se observaba este efecto protector56. Los efectos adversos fueron mínimos y bien tolerados. Similares resultados se observaron en otro ensayo clínico en 76 inmunocompetentes57.
La evidencia sobre el uso de nicotinamida en inmunodeficientes es limitada. En un ensayo clínico con 22 trasplantados renales no se encontró una disminución del número de QA o de nuevos CEC durante los 6 meses en los que recibieron nicotinamida58. En un estudio de casos y controles se incluyeron a 38 TOS (8 hepáticos y 30 renales). En el grupo tratado con nicotinamida 500 mg/día durante 6 meses se observó una reducción del número y el tamaño de las QA y no se detectó ningún CEC en el periodo de estudio. En el grupo control el 91% presentó un aumento de las QA y 7 lesiones progresaron a CEC59.
La nicotinamida es de bajo coste y bien tolerada. Se debería considerar en primera línea en prevención secundaria de nuevos CCNM en los pacientes de alto riesgo.
CapecitabinaLa capecitabina es una prodroga del 5-FU administrada vía oral. Una reciente revisión sistemática de la literatura60 encontró 3 reportes de casos aislados61 y 3 series de casos62–64 que sugieren que la capecitabina podría ser una alternativa preventiva en los pacientes de alto riesgo. En un estudio en 10 TOS la administración de capecitabina disminuyó significativamente la incidencia de CEC (reducción media de 68 ± 30%, p < 0,005). Los efectos adversos incluyeron astenia, síndrome mano-pie, gota y deterioro de la función renal62. En un estudio retrospectivo con 15 TOS se observó una significativa reducción de la tasa de nuevos CEC, CBC y de QA. La tasa de suspensión del fármaco fue de 33% al año63.
La capecitabina puede ser una alternativa en el manejo de los pacientes refractarios a otras medidas de prevención secundaria. Su tolerabilidad variable hace necesaria la realización de estudios más amplios60.
Otros agentesVacunación contra el virus del papiloma humano (VPH)Existe evidencia sobre el rol del VPH en el desarrollo del CCNM, especialmente en inmunosuprimidos65,66. Recientemente, algunos reportes de casos han mostrado resultados prometedores en el tratamiento y/o prevención de CCNM en los pacientes de alto riesgo67. Dos individuos con antecedentes de múltiples CBC y CEC recibieron la vacuna tetravalente contra el VPH. Tras 16 meses de seguimiento se observó una reducción > 60% de nuevos CEC y del 100% de nuevos CBC68. En otro reporte, un paciente con 3 CEC basaloides inoperables en las piernas recibió intramuscularmente la vacuna nonavalente contra el VPH, y luego de 3 semanas, se le administró en forma intratumoral. Se observó una resolución completa después de 11 meses, sin recidivas ni nuevos CCNM durante 24 meses de seguimiento69. Similares resultados se observaron en un trasplantado con un CEC in situ en la palma y el dorso de la mano65.
Dado el buen perfil de seguridad de la vacuna contra el VPH y los potenciales beneficios añadidos (reducción de las verrugas víricas cutáneas y genitales, y de las displasias/neoplasias genitales)67 se podría considerar su uso en los pacientes de alto riesgo, especialmente en inmunodeficientes. El coste de la vacuna puede limitar su uso.
CelecoxibEn un ensayo clínico 240 individuos con > 10 QA fueron aleatorizados a recibir celecoxib 200 mg 2 veces al día vía oral por 9 meses vs. placebo. El grupo con celecoxib tuvo un menor número de CCNM (tanto CEC como CBC) a los 11 meses posaleatorización (RR = 0,41, 95% IC = 0,23 - 0,72, P = 0,002). No hubo diferencias en los eventos cardiovasculares entre ambos grupos70.
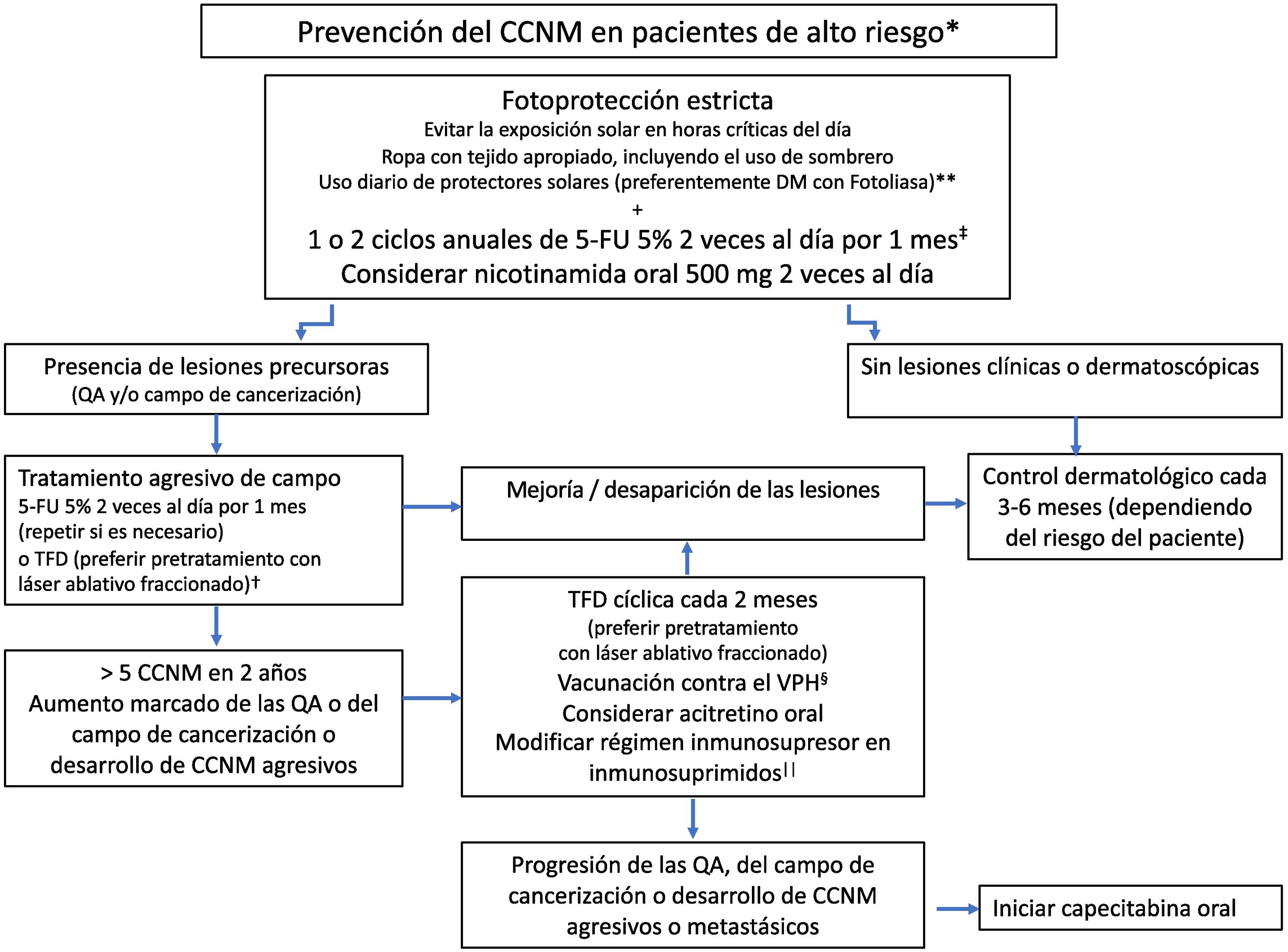
En resumen, en la prevención secundaria del CCNM en los pacientes de alto riesgo es fundamental la fotoprotección estricta, indicando fotoprotectores tópicos de amplio espectro (considerando el uso de dispositivos con fotoliasa). El 5-FU 5% tópico sería de elección como quimioprevención tópica, con uno o 2 ciclos anuales de tratamiento. Dado el buen perfil de seguridad, se podría indicar la utilización de nicotinamida oral por tiempo indefinido. En casos refractarios, la TFD cíclica (especialmente posláser fraccionado) puede ser útil. En los individuos con progresión de las lesiones se podría considerar la acitretina oral o la vacunación contra el VPH (fig. 1).
Algoritmo de prevención del cáncer cutáneo en los pacientes de alto riesgo. *Ver tabla 2. **Considerar fotoprotección oral con Polypodium leucotomos en los meses de mayor incidencia solar o en individuos con exposición solar intensa (ocupacional o recreativa). †Otras alternativas son el imiquimod y la combinación de diversas técnicas como láser ablativo, raspado, electrodisecación, crioterapia, peelings químicos y cirugía, entre otros. ‡Para incrementar la tolerancia se puede indicar 5-FU 5% una vez por la noche por 2 meses. §Pese a que la evidencia es muy limitada, se debería preferir la vacuna nonavalente del VPH. Administración de 2 dosis intramusculares separadas por 6 semanas. Dos semanas después se puede administrar en forma intratumoral (en caso de existir CCNM refractarios o inoperables) y repetir al cabo de 2 semanas65. ||Se debería considerar disminuir la dosis de los inmunosupresores, el cambio de azatioprina por micofenolato mofetil o iniciar sirolimus y suspender la ciclosporina. Estas modificaciones deben ser discutidas en un comité multidisciplinario, evaluando los riesgos y beneficios. QA: queratosis actínicas; CCNM: cáncer cutáneo no melanoma; DM: dispositivo médico; 5-FU: 5-fluorouracilo; TFD: terapia fotodinámica.
Los pacientes TOS o con neoplasias hematológicas como la leucemia linfocítica crónica tienen un riesgo muy elevado de desarrollar QA, campo de cancerización y CCNM, especialmente CEC13. Presentan tumores más agresivos, de rápido crecimiento, con mayor recurrencia, metástasis y mortalidad71. Un alto número de QA y la presencia de campo de cancerización aumentan el riesgo de desarrollar CEC en estos pacientes72,73. Otros factores de riesgo incluyen historia de CCNM previo al trasplante, sexo masculino, raza blanca, trasplante de órgano torácico y ser trasplantado después de los 49 años, entre otros74. El manejo de individuos inmunosuprimidos con historia de múltiples CCNM o QA y/o campo de cancerización extenso puede ser extraordinariamente complejo y requiere un enfoque multidisciplinario. No existen guías estrictas de prevención de CCNM en estos casos. Siempre se debería recomendar fotoprotección estricta, considerando la utilización de fotoprotectores con fotoliasa24, y seguimientos habituales con el dermatólogo (cada 3 a 6 meses en individuos con historia de CCNM o múltiples QA o campo de cancerización)71. El seguimiento regular de estos pacientes puede reducir la incidencia de CCNM avanzado75. Se deberían tratar agresivamente las QA y el campo de cancerización7, y en los pacientes de mayor riesgo, considerar terapia preventiva con uno o 2 cursos anuales de 5-FU 5% o TFD cíclica, uso de nicotinamida oral, y acitretina en casos seleccionados, y recomendar la vacunación contra el VPH (fig. 1). En los casos de más alto riesgo se podría plantear disminuir la dosis de los medicamentos inmunosupresores (si es posible), o modificar el régimen terapéutico: el micofenolato mofetil se ha asociado a una menor incidencia de CEC en TOS al compararlo con azatioprina71. En 2 meta-análisis se ha evidenciado que el uso de sirolimus como inmunosupresor reduce significativamente el riesgo (alrededor de un 50%) de desarrollar CCNM al compararlo con otros inmunosupresores, como la ciclosporina76,77. Tanto la reducción o el cambio del régimen inmunosupresor puede tener efectos no deseados, por lo que esta decisión debe ser multidisciplinaria.
ConclusionesLa prevalencia del CCNM y de sus lesiones precursoras ha aumentado en los últimos años, y puede ocasionar importante morbilidad y altos costes sanitarios. La prevención primaria con exposición protegida y responsable a la radiación ultravioleta es fundamental (fig. 2). En aquellos individuos de alto riesgo la prevención secundaria puede jugar un rol primordial. Diversas alternativas como la protección solar estricta con fotoprotectores con fotoliasa, 5-FU tópico, nicotinamida, acitretina y vacunación contra el VPH pueden ser alternativas a considerar.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
- •
El carcinoma cutáneo no melanoma incluye al carcinoma basocelular y al carcinoma epidermoide cutáneo, y es la neoplasia más frecuente en la especie humana.
- •
La mortalidad del cáncer cutáneo no melanoma es baja, pero puede ocasionar importante morbilidad, disminución de la calidad de vida y altos costes sanitarios.
- •
El adecuado manejo de las lesiones precursoras del carcinoma epidermoide cutáneo (queratosis actínica y campo de cancerización) puede disminuir el desarrollo de nuevos tumores.
- •
Existen estrategias primarias y secundarias de prevención del cáncer cutáneo no melanoma.
- •
La prevención primaria se basa en disminuir el riesgo limitando la exposición ultravioleta y otros carcinógenos.
- •
La prevención secundaria incluye diversas estrategias para disminuir la probabilidad de desarrollar un cáncer cutáneo no melanoma en los pacientes de alto riesgo (tabla 2).
- •
El uso de fotoprotectores tópicos de amplio espectro y elevado SPF se debería considerar tanto en prevención primaria como secundaria. Los fotoprotectores que incluyen fotoliasa son una novedosa alternativa y serían más efectivos.
- •
Solo un pequeño número de intervenciones han demostrado disminuir el desarrollo de cáncer cutáneo no melanoma: 5-FU 5%, terapia fotodinámica, nicotinamida y retinoides orales.
- •
Inmunosuprimidos como los trasplantados de órgano sólido presentan un alto riesgo de desarrollar cáncer cutáneo no melanoma, su manejo puede ser muy complejo y requiere un enfoque multidisciplinario.