Las células mesenquimales estromales son células madre no hematopoyéticas pluripotenciales con alta capacidad de derivación a diferentes linajes celulares, dependiendo tanto del microambiente en el que se encuentren, como de la interacción y señalización que establezcan con la matriz extracelular del entorno, esto ha permitido describir un potencial proangiogénico, antifibrótico e inmunomodulador, que ha sido blanco de investigación en enfermedades autoinmunes como la esclerosis sistémica cutánea. Considerando que la esclerosis sistémica cutánea es una enfermedad inflamatoria crónica, con una prevalencia estimada de 35,6 casos por cada 100.000 habitantes en Norte América y de 0,02% en nuestro país para el 2018, se caracteriza por presentar dos variables clínicas principalmente; una variante limitada y una variante difusa, presentando en ambas un compromiso extenso de piel y órganos que puede ser rápidamente progresivo y deteriorar el pronóstico de los pacientes que la padecen aumentando su mortalidad. Debido a que las opciones terapéuticas en esta entidad son limitadas y buscan únicamente el control de síntomas, pero con poco impacto en progresión y mortalidad, terapias celulares avanzadas han surgido como nuevas opciones terapéuticas incluyendo el trasplante de células madre hematopoyéticas y las células mesenquimales estromales. A continuación, se revisará acerca de la utilidad y evidencia de células mesenquimales estromales en pacientes con esta enfermedad.
The mesenchymal stromal cells are hematopoietic stem cells with high capacity of differentiation to other cellular lineages, depending on the microenvironment in which they live as well as on the interaction and signaling pathways they establish with the extracellular matrix. Several properties have been described in these cells: proangiogenic, antifibrotic and immunomodulatory. These properties are being studied as a therapeutic approach for autoimmune diseases such as cutaneous systemic sclerosis. Cutaneous systemic sclerosis is a systemic chronic disease, with an approximate prevalence of 35.6 cases per 100,000 inhabitants in North America and of 0.02% in Colombia in 2018. There are two different clinical variants, diffuse and localized. In both variants an important skin involvement and a rapidly deterioration of organs is present, which can overshadow the clinical prognosis and increase the mortality. Options for the treatment of advanced diffuse SSc are scarce mainly targeting symptomatic control with little impact on the progression and mortality. Therefore, there is an increasing interest in new therapies like advanced cellular therapy with hematopoietic stem cells and stromal mesenchymal cells. This article reviews the information related to the use of stromal mesenchymal cells in patients with this disease.
La esclerosis sistémica cutánea (SSc) es una enfermedad autoinmune crónica que afecta al tejido conectivo; su etiología es desconocida y se caracteriza por presentar fenómenos vasculopáticos, compromiso fibrótico con aumento de los depósitos de matriz extracelular e inflamación de la piel y de órganos tales como los pulmones, el tracto digestivo, el corazón, los vasos sanguíneos y los riñones. Esta enfermedad afecta principalmente a las mujeres (relación 8:1), con una prevalencia estimada de 39,9 casos por 100.000 adultos en los Estados Unidos1 y del 0,02% de la población mayor de 18 años en Colombia2. La edad promedio de presentación varía entre los 35 y los 55 años3.
Tradicionalmente se han descrito dos variantes de la enfermedad: la SSc limitada, que presenta compromiso de la piel en las regiones distales de las extremidades, acompañado de esclerodactilia, calcinosis, fenómeno de Raynaud y compromiso de los órganos internos, es decir, de los pulmones y los riñones. El anticuerpo anticentrómero es su marcador serológico característico hasta en el 70% de los casos4; la SSc es la segunda variante, en la que el compromiso de la piel de las extremidades es proximal e incluye el tronco y la espalda. El compromiso renal, cardíaco y pulmonar es frecuente y puede volverse rápidamente progresivo. Los anticuerpos antitopoisomerasa I o anti-SCL70 son los marcadores serológicos para la SSc difusa hasta en el 30% de los casos y los anti-RNA polimerasa III en el 20% de los casos, otro biomarcador son los anticuerpos antinucleares, que son positivos hasta en el 90% de los casos con diferentes patrones nucleares y centroméricos. La enfermedad afecta significativamente la calidad de vida (QoL) y la clase funcional de los pacientes que la padecen5.
Su causa sigue siendo desconocida; sin embargo, se sabe que existen factores genéticos, hormonales y ambientales asociados con su presentación. Las consecuencias de la enfermedad pueden ser fatales, con una tasa de supervivencia a 10 años del 33% en los pacientes con compromiso pulmonar y una tasa de supervivencia a 3 años del 45% en los pacientes con hipertensión pulmonar (HP)6.
Dada su etiología multifactorial, se considera una enfermedad heterogénea; en la actualidad está clasificada como una enfermedad huérfana por el Ministerio de Salud de Colombia, lo que significa que existen pocas opciones terapéuticas efectivas para las formas de presentación severas4. Alrededor del 20% de los pacientes llegan a ser refractarios a la terapia convencional, formando así parte del mal pronóstico ya descrito. El tratamiento de la enfermedad se enfoca actualmente en la detección temprana, el seguimiento y el manejo de las complicaciones dependiendo del órgano afectado: crisis renal, enfermedad pulmonar intersticial y HP. Además, el tratamiento implica el control de los síntomas relacionados con los otros órganos afectados, tales como la enfermedad por reflujo gastroesofágico y el fenómeno de Raynaud6,7.
Pocas opciones terapéuticas se centran en el control de los mecanismos fisiopatológicos que favorecen la progresión de la enfermedad8,9. Se han estudiado algunas terapias dirigidas a los mecanismos fisiopatológicos que desencadenan esta enfermedad, tales como algunas terapias biológicas y antifibróticas y los trasplantes de células madre, para modificar la patogénesis e identificar las opciones que pueden modular su progresión. En cuanto a la terapia celular, la experiencia relacionada con el trasplante de células madre (TCMH) ha sido extremadamente promisoria, dando lugar a una mejoría significativa de los síntomas y la progresión de la enfermedad10–13.
Otra experiencia ha involucrado el uso de las células estromales mesenquimales (MSC), las cuales tienen un efecto antiinflamatorio, antifibrótico y antiproliferativo que parece haber tenido un gran impacto en el manejo de las manifestaciones cutáneas y de las úlceras acrales y en la reducción de la progresión del compromiso pulmonar14,15. Las MSC se han utilizado en diferentes escenarios; ensayos clínicos han respaldado su uso en enfermedades autoinmunes tales como la enfermedad de Crohn16, el lupus eritematoso sistémico y la artritis reumatoidea (AR), conduciendo a resultados francamente positivos en relación con el control de la actividad y la remisión de la enfermedad, con un margen de seguridad significativo y una baja tasa de eventos adversos (EA) asociados con su uso17,18. Sin embargo, ningún ensayo clínico controlado respalda y/o recomienda formalmente su uso en la terapia de la SSc debido a las regulaciones relacionadas con su uso y a sus costos.
Por lo tanto, esta revisión discute el uso de las MSC como parte del tratamiento de los pacientes con SSc.
MetodologíaLos artículos originales fueron seleccionados mediante la lectura de cada reporte identificado en la búsqueda utilizando términos como: «diffuse scleroderma», «systemic scleroderma», «refractory scleroderma», «stem cell», «Wharton's jelly stem cell» y «diffuse and limited scleroderma treatment». Se incluyeron los artículos que eran reportes y/o series de casos relacionados con pacientes adultos mayores de 18 años, ensayos aleatorizados, revisiones de temas y revisiones narrativas que investigan el origen/fuente, los mecanismos inmunológicos y los efectos terapéuticos del uso de las células madre mesenquimales derivadas de la gelatina de Wharton para la SSc.
La búsqueda mediante el uso de los términos seleccionados llevó a acumular alrededor de 55 artículos, de los cuales 7 fueron reportes y series de casos y 48 fueron revisiones sistemáticas y narrativas y ensayos experimentales en modelos animales. Se seleccionó la evidencia de la experiencia con adultos mayores de 18 años que presentaban esclerosis sistémica progresiva o esclerodermia difusa, más 43 artículos para una revisión de la literatura (es decir, 49 artículos). Se agregaron 8 artículos adicionales a la búsqueda de información acerca de la terapia convencional para los pacientes con esclerosis sistémica que incluyeron guías internacionales (europeas y americanas) y ensayos clínicos controlados sobre terapia biológica e inmunomoduladores relacionados con la SSc (obteniendo 56 artículos en la selección final).
Células madre mesenquimalesLas MSC son células madre no hematopoyéticas que pueden derivarse de diferentes líneas celulares, dependiendo del microambiente en el que se encuentran y de su señalización e interacción con la matriz extracelular del medio ambiente19. Estas células tienen características comunes en cuanto al fenotipo y el potencial pero pueden diferir en términos de algunos receptores que estimulan su actividad y su mecanismo de acción (MOA), creando de ese modo subgrupos de MSC20.
La Sociedad Internacional de Terapia Celular (ISCT) ha establecido criterios para verificar las características de estas células que se observan en cultivos in vitro. La ISCT ha descrito características tales como su capacidad de unión plástica durante el cultivo, teniendo un inmunofenotipo específico mediante la expresión de moléculas de superficie de CD105, CD73 y CD90 y negatividad para CD45, CD34, CD14 (o CD11b), CD79α (o CD19) o isotipos de moléculas del antígeno leucocitario humano (HLA)-DR. Estas deben diferenciarse in vitro en osteoblastos, adipocitos y condroblastos21,22.
Otras subpoblaciones de MSC se producen en respuesta a un aumento de los niveles de citoquinas en el medio ambiente, por ejemplo, las MSC1 (perfil proinflamatorio) se pueden producir cuando las MSC tienen niveles bajos de IFN-γ y TNF-α, lo que no conduciría a estimular un aumento de los niveles de IL6 y a desencadenar una respuesta de monocitos tipo-1. Se ha sugerido que la activación del TLR4 sería la clave para una respuesta proinflamatoria mediada por las MSC23,24. Las MSC2 (perfil antiinflamatorio) serían la otra subpoblación, que se produce cuando las MSC identifican un ambiente inflamatorio local con niveles elevados de IFN-γ y TNF-α. Esto daría lugar a la estimulación de la secreción de IL-6, IDO, PGE2 y TGF-β, produciendo por lo tanto una respuesta de monocitos tipo-2 (IL-10 secretante, antiinflamatoria). Un estudio ha demostrado que la activación del TLR3ha dado lugar a una respuesta antiinflamatoria inmunosupresora25,26.
Las MSC pueden derivarse de varias fuentes (es decir, líquido amniótico), anexos fetales o neonatales (es decir, placenta y/o membrana amniótica), gelatina de Wharton del cordón umbilical (GW), sangre del cordón umbilical (UCB), numerosos tejidos adultos (es decir, médula ósea), tejido adiposo, periostio, pericondrio, sinovia, pulpa dental, tejidos linfoides y/o menstruación23,27.
Independientemente de la fuente, se debe llevar a cabo investigación básica, preclínica y clínica relacionada con las MSC de diferentes fuentes de modo que estas puedan ser comparadas en términos de su potencial terapéutico. Las MSC derivadas de diferentes fuentes tienen ventajas y desventajas en cuanto a la apropiación del conocimiento, las implicaciones éticas, el método de obtención, la accesibilidad, la duplicación de la población, los marcadores de pluripotencialidad, la actividad de senescencia, el potencial de inmunomodulación y el potencial de diferenciación28.
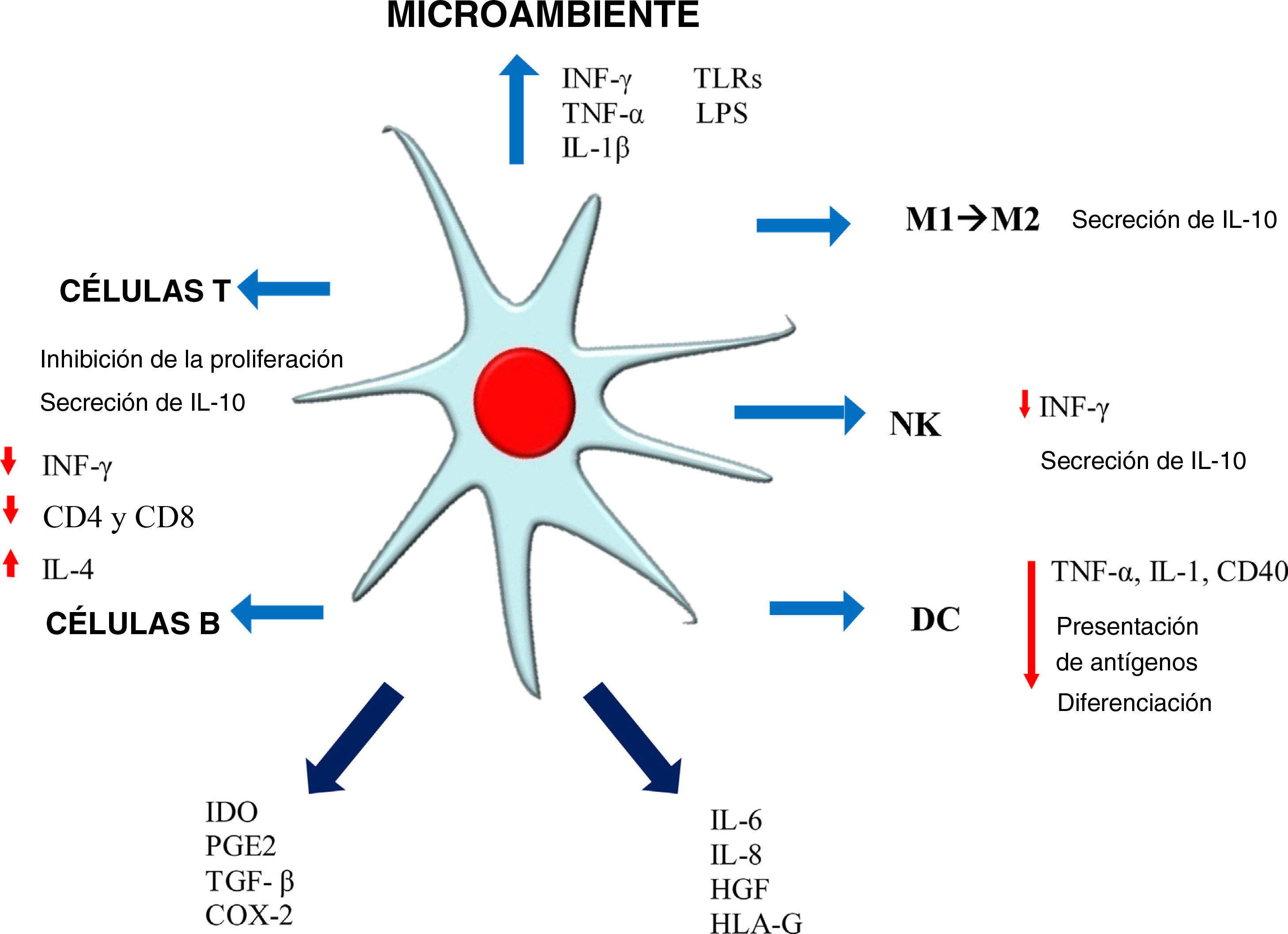
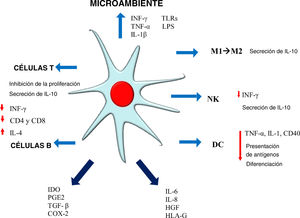
Mecanismos de inmunomodulaciónEl MOA inmunomodulador de las MSC funciona de manera paracrina, induciendo la secreción de factores de crecimiento, citoquinas y moléculas de adhesión que pueden reducir la proliferación de células inmunes en cultivo, afectando así tanto la inmunidad innata como la adaptativa. Estas propiedades permiten que las MSC escapen del reconocimiento por el sistema inmunitario, modulando/mediando las funciones de las células T, de las células B, de las células NK, de las células dendríticas (CD) y de los macrófagos21,26,28 (fig. 1).
Dicha modulación es mediada por mecanismos que dependen del contacto celular y del exosoma secretado en respuesta al medio ambiente. Los mecanismos dependientes del contacto celular funcionan a través de proteínas como el ligando de muerte programada-1 (PDL-1) TSG-6, ICAM-1, VCAM-1, COX-1, y de factores solubles como IL-10, IL-6, TGF-β1, óxido nítrico (NO), indolamina 2,3-dioxigenasa (IDO), PGE2 y HLA-G5, EGF, FGF, PDGF, TGF-β, VEGF, HGF y angiopoyetina-120,23,29.
Las MSC activadas adquieren propiedades inmunomoduladoras que pueden variar dependiendo del estimulante de la citoquina proinflamatoria; por ejemplo, el IFN-γ confiere propiedades de células presentadoras de antígenos (APC), secreción de IDO y expresión de PD-L130. El TNF-α o la IL-1β inducen la expresión del HLA de clase I y aumentan la expresión de ICAM-1 y VCAM-1. Si la activación es promovida simultáneamente por el IFN-γ, el TNF-α produce quimioquinas y receptores de quimioquinas tales como CCR5, CCR10, CXCR3, CXCL9 y CXCL10 y hay un aumento de la expresión de IL-6, IL-8, HGF, PGE-2 y COX-231. Se ha demostrado que las GW-MSC tienen el potencial de mejorar el reclutamiento de los linfocitos utilizando quimioquinas como CCL2, CCL5, CCL20, CXCL2 y CXCL1025.
Células estromales mesenquimales y respuesta de los linfocitos TLas MSC inhiben la proliferación de los linfocitos T estimulados al obstaculizar la división celular mediante su detención durante la fase G0/G1, impidiendo de este modo su entrada durante la fase S (síntesis) del ciclo celular31. Los linfocitos T se acumulan durante la fase G0/G1 después de 24h de exposición a las MSC, observándose un aumento de la expresión de p16, p21, p27 y una reducción de las ciclinas A, D2, E y B, que da lugar a una detención del ciclo celular21. Interesantemente, se ha demostrado que los linfocitos T no forman parte del fenómeno de apoptosis asociada a la IL-632. Vale la pena destacar que las MSC no solo suprimen la activación de los linfocitos T CD4 sino que también escapan de la lisis de los linfocitos T CD8 citotóxicos y las células asesinas naturales (en inglés natural killer [NK]). Se ha visto que las MSC inducen la detención de la división de las células T en ensayos in vitro que involucran la reacción linfocítica mixta en cultivos y la inhibición de dichas células T ha parecido ser antígeno-específica32. Es muy probable que las MSC puedan inhibir la proliferación de células T en entornos alogénicos y xenogénicos33.
Se ha demostrado que los linfocitos T activados con MSC en cocultivo aumentan la positividad de FOXP3, lo que sugiere un aumento de la población inmunomoduladora de células T reguladoras (Treg) a expensas de las demás poblaciones de linfocitos T21. La inmunomodulación mediada por MSC depende en gran medida del medio inflamatorio local para activar la expresión de IDO, induciendo así la diferenciación de las células T en CD4+ CD25+ y FOXP3+.22 Las MSC expuestas a la interleucina-1β han inducido significativamente la regulación de la vía de las Treg para aumentar la señalización del ICOSL; la señalización de ICOSL-ICOS ha desempeñado un papel importante en la regulación dependiente del contacto de la diferenciación de las Treg mediante la activación de la vía fosfoinositido 3-quinasa-Akt. Un estudio in vitro ha demostrado que la expresión y la sobreexpresión del ICOSL coincidieron con la inducción de Tregs en el cocultivo de MSC con células T CD4+. Se ha visto que la neutralización o la caída de los niveles de ICOSL reducen significativamente las Tregs y la secreción de IL-1031. Las MSC les proporcionan energía a las células efectoras, acompañada de una reducción de las citosinas proinflamatorias IFN-γ, factor de necrosis tumoral (TNF)-α, IL-17 y un aumento de la IL-10 e IL-4 (cambio a Th2 y/o fenotipo regulador)26,34.
Células estromales mesenquimales y respuesta de los linfocitos BLa detención del ciclo celular afecta a las células B del mismo modo, haciendo que las MSC reduzcan la expresión de los receptores de quimioquinas y la producción de inmunoglobulinas. Sin embargo, esto no altera la expresión de TNF-α, IFN-γ, IL-4 e IL-10 ni la expresión de estimuladores de moléculas tales como HLA-DR, CD40 y la familia B735.
Las MSC activadas por IFN-γ- o TNF-α inhiben la proliferación y la diferenciación de las células B ya que pueden regular a B7-H1 y PD-1 y a los linfocitos B secretores de IgG e IgM36. Las vesículas de membrana (MV) IDO, CCL2, B7-H1, VEGF, C3 y GAL-9 son factores solubles relacionados con la inmunorregulación de las células B y son antiinflamatorios, mientras que BAFF, PGE2 y APRIL son proinflamatorios34. Se ha afirmado que las MSC secretan CCL2, que es un quimioatrayente de los monocitos y macrófagos en las zonas inflamadas y participa en la inhibición de las células B. Su sobreexpresión suprime los niveles de autoanticuerpos circulantes35.
Células estromales mesenquimales y respuesta de la línea monocíticaLos macrófagos y monocitos reclutados migran al sitio de una lesión en respuesta a señales ambientales proinflamatorias; las MSC no estimuladas secretan de manera constitutiva IL6 y expresan el HLA-G5, que es fundamental en la regulación inmunológica mediada por MSC; la inmunomodulación mediada por MSC secreta IL-6 y PGE2 dirigiendo a la línea de monocitos hacia la formación de poblaciones de células derivadas de monocitos que expresan IL-10 (MDC). La IL-10 activa las MSC para regular positivamente la expresión del HLA-G (soluble y ligado a la membrana), que está relacionada con efectos inmunomoduladores respecto a las células NK y células de inmunidad adaptativa. Las MSC se activan a través del contacto célula-célula, IL-10, IL-6 o de otros factores secretados después de la interacción monocito-MSC para regular positivamente su expresión de PGE2, reforzando así aún más la predisposición de los monocitos hacia las MDC25.
Potencial tróficoEl papel trófico de las MSC se puede destacar actualmente por sus múltiples aplicaciones que cubren una amplia gama de enfermedades. Esto se debe a que las MSC secretan moléculas bioactivas que son capaces de mediar actividades inmunomoduladoras y tróficas22 ya que expresan factores de crecimiento tales como el factor neurotrófico derivado del cerebro, el factor neurotrófico derivado de la línea de células gliales y el factor de crecimiento nervioso (FCN), factores antiapoptóticos y factores proliferativos y angiogénicos. Otros reportes han destacado las propiedades tróficas de las GW-MSC20. Se ha demostrado que las GW-MSC expresan en forma endógena mRNA para neurotrofinas y aumentan la remielinización después de los trasplantes en los ratones con encefalomielitis autoinmune experimental, indicando así su potencial para proporcionar soporte trófico al sistema nervioso central (SNC). Las terapias basadas en células pueden aumentar de ese modo la remielinización, así como sus propiedades antiinflamatorias que, conjuntamente, pueden promover la regeneración endógena de los tejidos, que es crucial para suprimir la progresión de la esclerosis múltiple37.
El efecto trófico de las GW-MSC ha inducido una mejor formación de microvasculatura y migración celular en las células endoteliales cocultivadas29. Por lo tanto, las GW-MSC poseen características proangiogénicas, antiapoptóticas y antioxidantes. Varios estudios han buscado estandarizar las metodologías de modo que aunque la morbilidad es baja29,38, al mismo tiempo las células CD34 pueden presentarse y desaparecer ex vivo cuando proliferan las células31.
Las microvesículas son liberadas en respuesta a aumentos del calcio intracelular. Las integrinas, las proteínas de la matriz extracelular (ECM), lecitinas, proteoglicanos o glicolípidos de las vesículas extracelulares permiten el acoplamiento a las células que expresan los receptores apropiados en sus superficies33,34, dando lugar a la remodelación de la membrana plasmática y al desprendimiento de las vesículas39. También pueden actuar como moduladores de transcripción e influir en los fenotipos celulares, ya que permiten intercambiar la información genética entre las células a medida que las vesículas encapsulan y protegen al DNA, al RNA mensajero (mRNA), al RNA largo no codificante (ncRNA) y al micro-RNA (miRNA) de las enzimas degradadoras40. Ratajczak et al.41, demostraron que las microvesículas obtenidas de células madre embrionarias murinas mejoraron la supervivencia y la expansión de las células progenitoras Sca-1-positivas de linaje negativo al mejorar la expresión de Oct-4, Rex-1, HoxB4, Scl y GATA 2.
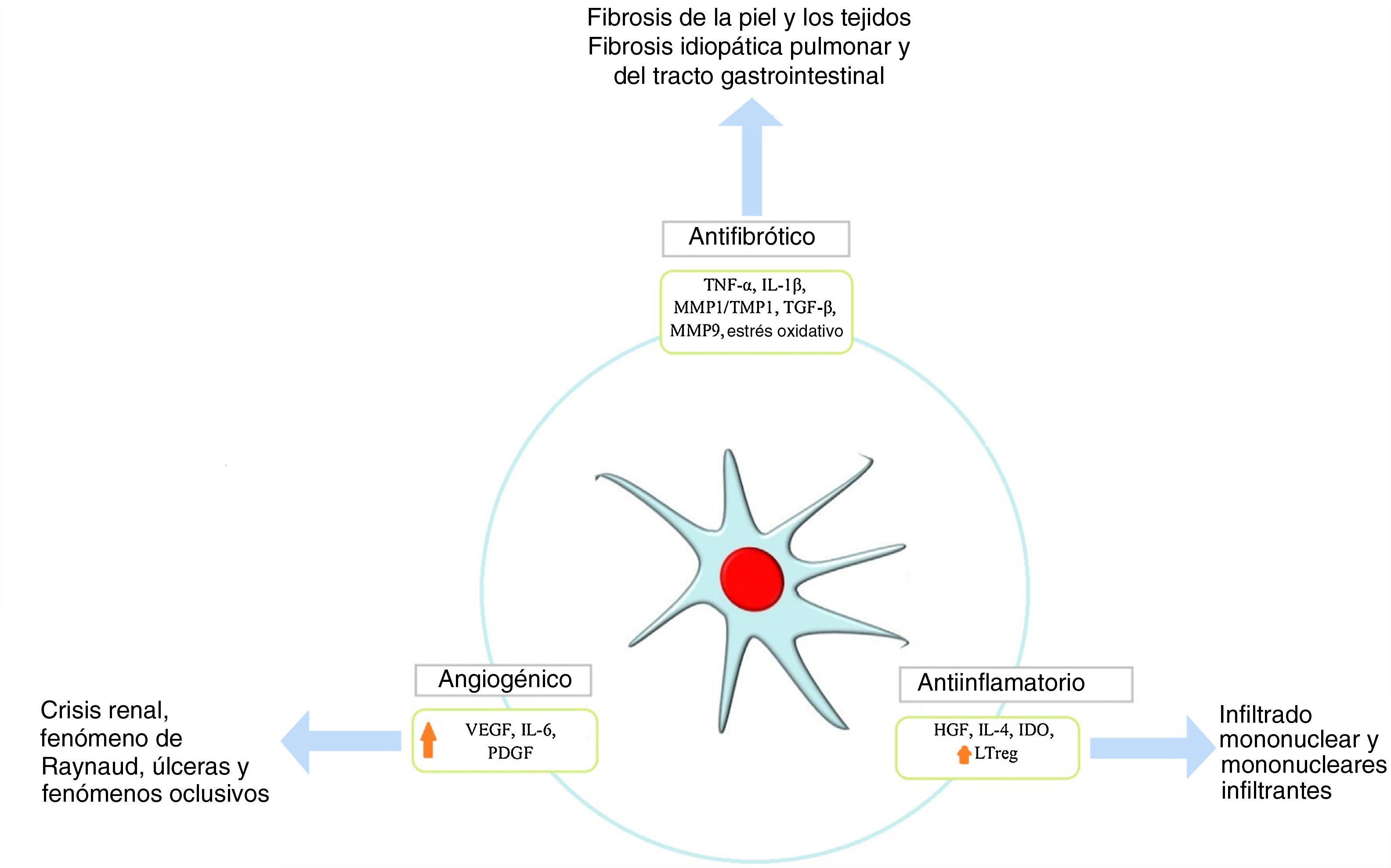
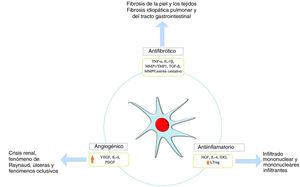
Efecto proangiogénicoLa SSc se caracteriza por una vasculopatía secundaria a disfunción endotelial, la cual desencadena una hipoxia tisular que no es compensada con la respuesta fisiológica, lo que permite la activación de las células progenitoras endoteliales y el desarrollo de neovascularización. El papel de las MSC en este mecanismo está relacionado con la liberación de factores de crecimiento, como el factor de crecimiento hepático (en inglés, HGF), el receptor del factor de crecimiento vascular endotelial tipos 1 y 2 (en inglés, VEGFR1,2), y moléculas de adhesión, tales como la VCAM-1 que promueve la angiogénesis20; también pueden revertir la expresión de proteínas contráctiles, es decir, proteínas de actina del músculo liso SMAα y SM22α42. Se ha informado que el uso de MSC mediante infusión IV es efectivo en los pacientes con SSc que sufren de isquemia crítica de las extremidades debido a una mayor secreción de VEGF acompañada por una reducción de la isquemia y a una angiografía que reveló una menor revascularización de los miembros inferiores a pesar de que la biopsia de piel mostró un aumento de los factores angiogénicos43.
Las GW-MSC parecen ser más angiogénicas que las AD-MSC. Por ejemplo, la expresión de IL-8 y PDGF-AA fue mucho mayor en las WJ-MSC según la literatura pertinente. La IL-8 actúa directamente sobre las células endoteliales que participan en la proliferación, migración y supervivencia celular, mientras que el PDGF-AA es un factor angiogénico mesenquimatoso que no se expresa en los linajes de células epiteliales, actuando como un factor migratorio importante en la angiogénesis y la cicatrización de las heridas. El PDFG-AA puede estimular la expresión del VEGF-A; este ha sido el factor más estudiado en relación con la angiogénesis42.
Efecto antifibróticoLa fibrosis es una característica principal de la fisiopatología de esta enfermedad; que se produce por una producción excesiva de colágeno y/o engrosamiento de la piel y los órganos internos afectando así su arquitectura y función, siendo un mecanismo irreversible y difícil de controlar en los pacientes con SSc. Se desencadena en respuesta a la hipoxia tisular y al estrés oxidativo en el que los fibroblastos y los linfocitos TH2 producen una cantidad exagerada de factor de crecimiento transformante beta (en inglés transforming growth factor beta [TGF-β]) y de factor de crecimiento derivado de plaquetas (en inglés platelet derived growth factor [PDGF]). Las MSC ejercen un efecto antifibrótico a través de dos mecanismos descritos inicialmente en modelos animales; uno de ellos es el resultado de la capacidad de las MSC para reducir los niveles de TGF-β1 y aumentar los niveles de VEGF44. El segundo mecanismo les permite estimular la sobreexpresión del sistema de tiorredoxina (Trx), inhibir la apoptosis inducida por hipoxia y por lo tanto, la fibrosis acompañada por una reducción de la expresión de colágeno 1α, colágeno 3α y de otros componentes de la matriz extracelular45,46. Además, se ha observado una reducción de los niveles de citoquinas (es decir, factor de necrosis tumoral α e IL-1β) en modelos humanos tratados con MSC derivadas del tejido adiposo47 (fig. 2).
InmunogenicidadSe considera que las MSC son inmunogénicas debido a su baja expresión de moléculas MHC de clase I; sin embargo, carecen de expresión de MHC de clase II, lo mismo que el HLA-DR32,47. No obstante, las MSC regulan positivamente a las moléculas coestimuladoras (CD80, CD86) en respuesta al IFN-γ. La baja expresión de MHC I es importante para proteger a las MSC de la citotoxicidad mediada por células asesinas naturales y detener a las células T en la fase G0 del ciclo celular, lo que también podría ayudar a las MSC a escapar del reconocimiento inmunológico23. Por lo tanto, las células alogénicas no son rechazadas por el sistema inmunológico de un receptor en ausencia de inmunosupresión, lo que significa que pueden ser utilizadas con fines terapéuticos en diferentes enfermedades48.
Células estromales mesenquimales como terapia relacionada con la esclerosis sistémica cutáneaPrincipio fisiopatológicoLa SSc se caracteriza por una tríada clásica que consiste en fibrosis, daño vascular y una respuesta inflamatoria incontrolada,3 que de ese modo altera la arquitectura y la función tisular debido a un aumento de la actividad de los miofibroblastos que da lugar a una producción excesiva de componentes de la matriz extracelular tales como el colágeno y otras glicoproteínas. Esto aumenta la contracción tisular y la infiltración irreversible de los órganos, que está asociada con fenómenos microvasculares que promueven la hipoxia, la liberación de especies reactivas de oxígeno (ROS) y citoquinas que estimulan una respuesta TH2 con IL4 e IL13 estimulando la síntesis de IgE. A su vez, esto aumenta la diferenciación de los fibroblastos y la fibrogénesis creando de ese modo un círculo vicioso relacionado con este mecanismo, que contribuye a la fibrosis, disfunción y falla de los órganos vitales (es decir, los pulmones, los riñones y el corazón)44.
Se han estudiado diferentes terapias inmunosupresoras basándose en lo anterior y teniendo en cuenta el modelo proinflamatorio de la entidad. Una de estas es el trasplante autógeno de células (madre) hematopoyéticas (TCMH) que requiere un régimen inmunosupresor mieloablativo para depletar el sistema inmunológico (células T y células B), restableciendo de ese modo la tolerancia inmunológica32,35; en ensayos clínicos aleatorizados se ha demostrado una mejoría clínica significativa relacionada con el TCMH. Sin embargo, la literatura pertinente establece que puede surgir una alta tasa de complicaciones de los regímenes citotóxicos requeridos que implican la exposición a infecciones durante los primeros meses de seguimiento, lo que en algunas ocasiones da lugar a desenlaces fatales y tasas de recaída 5 años después de la intervención12,13. Las MSC podrían por lo tanto ser extremadamente útiles porque no es necesario que sean mieloablativas, reduciendo de ese modo el riesgo de infección y la toxicidad asociada (tabla 1)30,31.
Reportes en la literatura pertinente sobre el uso de MSC en la SSc
| Compromiso clínico | N°. de pacientes | Fuente de las MSC | Vía de administración | Resultados | Referencia |
|---|---|---|---|---|---|
| SSc | 5 | Alogénico de médula ósea | Infusión IV | Mejoría de las úlceras cutáneas y del síndrome de Raynaud | 52 |
| Úlceras digitales (llagas que afectan los dedos de las manos y de los pies) | 2 | Autógeno de médula ósea | Local | Mejoría de las úlceras, fenómeno de Raynaud, QoL | 55 |
| Isquemia de miembros inferiores | 1 | Autógeno de médula ósea | Infusión IV | Reducción de las áreas de necrosis y revascularización | 56 |
| Microstomía | 4 | Autógeno de tejido adiposo | Local | Mejoría | 57 |
| Esclerodermia que afecta los dedos | 12 | Autógeno de tejido adiposo | Local | Mejoría significativa | 58 |
| Pulmones y piel | 2 | Autógeno de cordón umbilical | Infusión IV | Mejoría de la función pulmonar y de la piel | 14 |
IV: administración intravenosa; MSC: células madre estromales; SSc: esclerosis sistémica cutánea.
Fuente: Coopman et al.50.
La utilidad terapéutica de las MSC se relacionó inicialmente con los pacientes con trasplante de médula ósea para reducir los rechazos del trasplante: esto se asoció con su capacidad de secretar factores endógenos que regulan la actividad celular21,27. Posteriormente se describieron las propiedades de las MSC como antiproliferativas, antiinflamatorias e inmunomoduladoras. Esto se debió a su capacidad para adaptarse al microambiente en el que se encontraban, a su interacción con las células en su entorno inmediato y a su respuesta a la afluencia de las citoquinas para mantener la homeostasis48. Debido a tales propiedades, las MSC comenzaron a ser utilizadas durante los últimos 10 años en diferentes escenarios; inicialmente se usaron en modelos murinos de piel y en el lupus eritematoso sistémico (LES)17 debido a los desenlaces favorables y seguros derivados del inicio de la terapia en seres humanos en los casos de enfermedades autoinmunes49,50, rechazo de injerto-trasplante51, sepsis, enfermedad vascular oclusiva44 y enfermedades degenerativas como la osteoartrosis49, considerando su facilidad de administración y la baja tasa de EA en los pacientes estudiados.
Actualmente se están estudiando los beneficios inmunológicos del uso de MSC en los pacientes con SSc. Se han publicado varios reportes de casos que registran resultados prometedores; el primero de estos, publicado en el año 2008, tuvo como objetivo evaluar la respuesta de un paciente con compromiso cutáneo derivado de una úlcera acral. En este paciente se utilizó una dosis de 1×106células MSC/kg de peso y se observó una mejoría significativa en cuanto a los cambios en la piel y las lesiones ulcerosas19. Estos resultados llevaron a la publicación de series de casos relacionados con pacientes con compromiso cutáneo (engrosamiento y fibrosis), vasculopatía y fenómeno de Raynaud.
Una publicación (2011) se ocupó de 5 pacientes con SSc difusa que presentaban un compromiso cutáneo severo debido a úlceras acrales, miositis, y principalmente compromiso pulmonar intersticial, quienes habían recibido tratamiento previo con ciclofosfamida, metotrexato y azatioprina. Los pacientes recibieron una dosis de MSC igual a la del primer caso, administrada por vía intravenosa; hubo una mejoría significativa de la piel, las úlceras desaparecieron y algunos pacientes experimentaron una mejoría en cuanto a los índices de clase funcional, las pruebas de función pulmonar y la QoL y no se reportaron EA en ninguno de estos 5 casos52. En el año 2016 se publicó una serie de casos de 2 pacientes con HP e insuficiencia pulmonar refractaria al tratamiento convencional; los pacientes fueron tratados con terapia con células madre asociadas a rituximab, administrando la dosis descrita en los casos anteriores por vía intravenosa. Esto implicó la administración de la dosis en dos ocasiones, con 30 días de diferencia, sin complicaciones ni EA asociados con su aplicación. Se documentó una mejoría significativa durante los 12 meses de seguimiento en cuanto a la actividad y a los índices de QoL, acompañada de cambios en la piel y normalización de la presión pulmonar en el seguimiento ecocardiográfico14.
Dosis de células estromales mesenquimales/seguridad de la terapia y eventos adversosLas MSC deben ser sometidas a pruebas de detección de marcadores de superficie celular, potencial de diferenciación, cultivos microbiológicos, análisis de cariotipo y pruebas de tumorigenicidad para garantizar la seguridad de los pacientes que se someten a este tipo de terapia. Dicha identificación garantiza el bajo riesgo que implica el uso de MSC como terapia de acuerdo con las recomendaciones del ISCT y la estabilidad celular, evitando así una pérdida de capacidad inmunomoduladora o multipotencial debida a alteraciones durante la expansión y el cultivo celular53,54.
Las MSC se han administrado mediante inyección local y por vía intravenosa para las enfermedades autoinmunes, particularmente para la SSc. Estos hechos son relevantes ya que podrían influir en la capacidad de migración y la eliminación de MSC. La inyección local se ha utilizado con mayor frecuencia en los pacientes que presentan compromiso cutáneo o vascular, a diferencia de la vía intravenosa, que ha sido elegida para los pacientes con compromiso multisistémico o de órganos. Sin embargo, esto no ha afectado la seguridad de las MSC o los resultados con respecto a esta terapia en los ensayos y en los informes de casos publicados hasta la fecha53.
En cuanto a los EA, las células madre se han caracterizado por tener un buen perfil de seguridad y una baja tasa de EA. Esto se ha descrito en un análisis de seguridad relacionado con los pacientes que sufren de enfermedades autoinmunes (es decir, LES, SSc y artritis reumatoide) quienes han recibido una infusión de MSC de diferentes fuentes (cordón umbilical y médula ósea). El estudio buscó establecer el perfil de seguridad de las MSC y el seguimiento a largo plazo49,53 mediante el análisis de diferentes casos publicados hasta la fecha relacionados con pacientes que sufren de enfermedades autoinmunes, incluyendo LES, AR, SSc. La dosis sugerida fue de 1×106 células por kg de peso administrados por vía IV durante un tiempo estimado de 30min y un seguimiento promedio de 12–24h. Los EA que ocurrieron con mayor frecuencia, relacionados con manifestaciones hiperagudas (aquellas que se presentan durante las primeras 48h después de la infusión) fueron fiebre, cefalea, palpitaciones, enrojecimiento/rubor facial e insomnio hasta en 11,9% de las aplicaciones.
La fiebre ha sido considerada el EA reportado con mayor frecuencia en las series y en los ensayos clínicos publicados hasta el momento (se presenta hasta en el 5,9% de los casos); la fiebre siguió siendo el principal evento reportado ya que no se asoció con eventos infecciosos en el seguimiento durante los primeros 30 días. En cuanto a la infección, se han descrito casos de compromiso del tracto respiratorio, el tracto urinario y de herpes zóster (culebrilla); sin embargo, no se han establecido asociaciones con la aplicación de terapia relacionada con las MSC, ya que se sabe que las células madre tienen un potencial inmunogénico/antimicrobiano debido a su capacidad de promover la fagocitosis, así como de liberar algunos péptidos antimicrobianos que son producidos naturalmente por estas células.
Además, no se han descrito casos de neoplasia asociada con la terapia con MSC y se sabe que las tasas de supervivencia a 5 años son de alrededor del 90,35%, lo que la hace una terapia más segura que los tratamientos que involucran trasplantes de células madre, en los que se ha registrado una tasa de supervivencia de alrededor del 70%53.
ConclusionesEl interés por las células madre estromales ha venido aumentando desde hace más de 15 años, ahora en el escenario de las enfermedades autoinmunes debido a sus propiedades inmunomoduladoras y precursoras, habiéndose utilizado en patologías como la SSc desde el año 2008. La experiencia desde entonces en diferentes centros de todo el mundo con respecto a los pacientes con alternativas terapéuticas limitadas y aquellos que sufren de enfermedades autoinmunes refractarias al tratamiento convencional ha dado lugar a resultados exitosos en términos de calidad de vida y funcionalidad, representando una esperanza para quienes sufren de esta enfermedad y un desafío clínico para los reumatólogos.
Sin embargo, se requieren ensayos clínicos controlados para respaldar el uso de dicha terapia para estos tipos de enfermedad, que de ese modo permitan recomendar este tipo de terapia como parte del enfoque de manejo de los pacientes con SSc.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.