El alcance de este estudio fue evaluar los niveles de osteoprotegerina (OPG) salival y sérica en la osteoartritis de rodilla (OA).
MétodosLos niveles de OPG en suero y saliva de 30 OA y 30 controles sanos emparejados en este estudio transversal se evaluaron mediante ELISA. El dolor de rodilla fue evaluado por The Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC). Los datos se analizaron mediante la prueba t de Student, la prueba de correlación de Spearman y receiver operating characteristic (ROC).
ResultadosEl nivel medio de OPG en suero, pero no en saliva fue menor en la artrosis de rodilla que en el grupo sano. WOMAC se correlacionó negativamente con la OPG sérica (r = −0,501; p = 0,000). El valor de corte de OPG sérico fue de 237,5 pg/mL para el diagnóstico de OA de rodilla.
ConclusionesComo la OPG sérica fue más baja en la artrosis de rodilla y se correlacionó negativamente con WOMAC, parece que la detección de OPG en suero, pero no en la saliva puede ser un marcador probable para el diagnóstico de artrosis de rodilla.
Mensajes claveLa osteoprotegerina disminuye en la osteoartritis de rodilla.
The scope of this study was to assess salivary and serum osteoprotegerin (OPG) levels in knee osteoarthritis (OA).
MethodsSerum and saliva OPG levels of 30 knee OA and 30 matched healthy controls in this cross-sectional study was assessed by ELISA. Knee pain was assessed by WOMAC. Data were analyzed by Student's t-test, Spearman correlation test and ROC.
ResultsThe mean serum but not saliva OPG level was lower in knee OA than that of the healthy group. WOMAC negatively correlated with serum OPG (r = −0.501; P = 0.000). The serum OPG cutoff value was 237.5 pg/ml for the diagnosis of knee OA.
ConclusionsAs serum OPG was lower in knee OA and negatively correlated with WOMAC, it seems that detection of OPG in serum but not in saliva may be a probable marker to the diagnosis of knee OA.
Key messagesOsteoprotegerin decreases in knee osteoarthritis.
La osteoartritis (OA), o enfermedad articular degenerativa, es una de las enfermedades degenerativas crónicas más comunes, y una de las causas importantes de dolor e incapacidad a nivel mundial, estando asociada al incremento de los costes de tratamiento, la reducción de la productividad, y al absentismo laboral1–3. La prevalencia de la OA de rodilla es superior entre los pacientes con OA4. La incidencia de OA es creciente, dado el envejecimiento y el sobrepeso de la población5, habiéndose comprobado que el 10% de los varones y el 18% de las mujeres mayores de 60 años de edad padecen OA6. Por tanto, la OA tiene un impacto negativo notable en la calidad de vida de los mayores, siendo elevados los presupuestos ocultos, por lo que esto supone una carga sustancial para el sistema sanitario6.
La osteoprotegerina (OPG), como controlador de la función y diferenciación de los osteoclastos, es un receptor del factor de crecimiento y depende de la familia del receptor del factor de necrosis tumoral, que contacta con el activador del receptor del ligando del factor nuclear kB (RANKL) que inhibe a continuación la conexión de RANKL con el activador del receptor del factor nuclear kB (RANK), y tiene por tanto un efecto protector frente a la demolición del hueso7. Al igual que los osteoblastos, los condrocitos producen OPG y RANKL. Se ha observado que los cambios de los niveles de RANK, RANKL y OPG están vinculados a las anomalías básicas del cartílago articular en OA8. También se ha observado una sobreexpresión de RANKL en la OA9.
La OA se reconoce actualmente sobre la base de normas radiográficas y signos clínicos10. La imagen de resonancia magnética (IRM) es una técnica no invasiva que puede aportar imágenes de los cambios estructurales en todas las construcciones articulares11. Sin embargo, esta técnica es un procedimiento que requiere tiempo y es costoso. Los estudios previos han recomendado el uso de ciertos biomarcadores para el diagnóstico de OA, o controlar su progresión. El bioindicador que se ha delimitado de manera precisa para OA puede asociarse a los metabolismos óseo, cartilaginoso y sinovial, o a la irritación sistémica12.
Se ha demostrado que la saliva, como indicador de la salud oral y sistémica, puede aportar una evidencia fiable acerca de la enfermedad. Dado que se trata de una técnica no invasiva, más fácil de obtener y más rentable, equiparada al líquido sinovial (LS) y al suero, los investigadores se han visto impulsados a estudiar la saliva13,14. Se ha descrito que los niveles séricos de OPG se incrementan en los pacientes con OA15,16. Por tanto, en este estudio se evaluó la OPG en muestras séricas y salivales de pacientes con OA de rodilla, para evaluar el potencial de este marcador en el diagnóstico y supervisión de la enfermedad.
MétodosEn este estudio transversal, sobre la base de los criterios radiológicos y clínicos para OA de rodilla del American College of Rheumatology17, se incluyó a 30 pacientes con OA de rodilla grado 2 o 3 de la clasificación de Kellgren et al.18 (19 varones/11 mujeres; de 55,3±3,4 años de edad), candidatos a terapia celular de la articulación de la rodilla en el Hospital Firoozgar, sin antecedentes de gota, cirugía de rodilla, traumatismo articular, o enfermedad reumática, y sin tratamiento que pudiera interferir en los metabolismos óseos, y se emparejaron por sexo y edad con 30 individuos sanos (19 varones/11 mujeres; de 54,5±3,2 de edad). Los participantes sanos no tenían signos sintomáticos o radiológicos de osteoartritis, tras la evaluación mediante exploración clínica de las rodillas por parte de un traumatólogo experimentado. Todos los participantes eran sanos, no padecían enfermedad alguna ni seguían ningún tratamiento que pudiera afectar al metabolismo óseo o articular, incluyendo terapia de reemplazo hormonal en las mujeres postmenopáusicas.
Este estudio fue aprobado por el Comité de Revisión del Instituto Nacional de Desarrollo de Investigación Médica (IR.NIMAD.REC.1396.206), y se obtuvo consentimiento informado de todos los participantes.
Los síntomas y discapacidades físicas de los pacientes fueron evaluados mediante el índice Western Ontario and McMaster Universities Osteoarthritis (WOMAC)19, dividiéndose cada uno de ellos en una escala de Likert de 5 puntos (ninguno, leve, moderado, grave y excesivo). La puntuación WOMAC fluctuó entre 0 y 96. Los pacientes completaron los cuestionarios WOMAC en lengua persa antes de someterse a la terapia celular.
Se obtuvieron suero y saliva de cada participante por la mañana, recogiéndose según se ha descrito anteriormente13. Se centrifugaron dichas muestras a 5000 g durante 10 min; los sobrenadantes séricos y salivales se almacenaron a −80°C para medir posteriormente la OPG. Dicha evaluación se realizó mediante el método ELISA tipo sándwich, de acuerdo con el protocolo del fabricante (BioAssay Technology Laboratory, Shanghai, China). La sensibilidad del kit ELISA para OPG fue de 23 pg/mL (0,023 ng/mL).
Los datos fueron reflejados como media±EEM. La evaluación de las medias entre los grupos se realizó con una prueba t de Student bilateral. Se utilizó la prueba de correlación de Spearman para confirmar la asociación entre los parámetros. Se utilizó el análisis Receiver operating characteristic (ROC) para detectar el punto de corte para OPG sérica y salival entre los grupos de OA y de sujetos sanos. Los análisis fueron realizados utilizando el software SPSS versión 16.
ResultadosNo existió diferencia significativa en términos de sexo y edad entre los grupos de sujetos sanos y de OA (p < 0,05). La puntuación WOMAC media (± DE) del grupo OA fue de 37,7±4,9. No existió diferencia significativa alguna con relación al IMC (media±EEM, kg/m2) entre los sujetos sanos (28,1±0,5) y los sujetos con OA de rodilla (28,4±0,7) (p = 0,636).
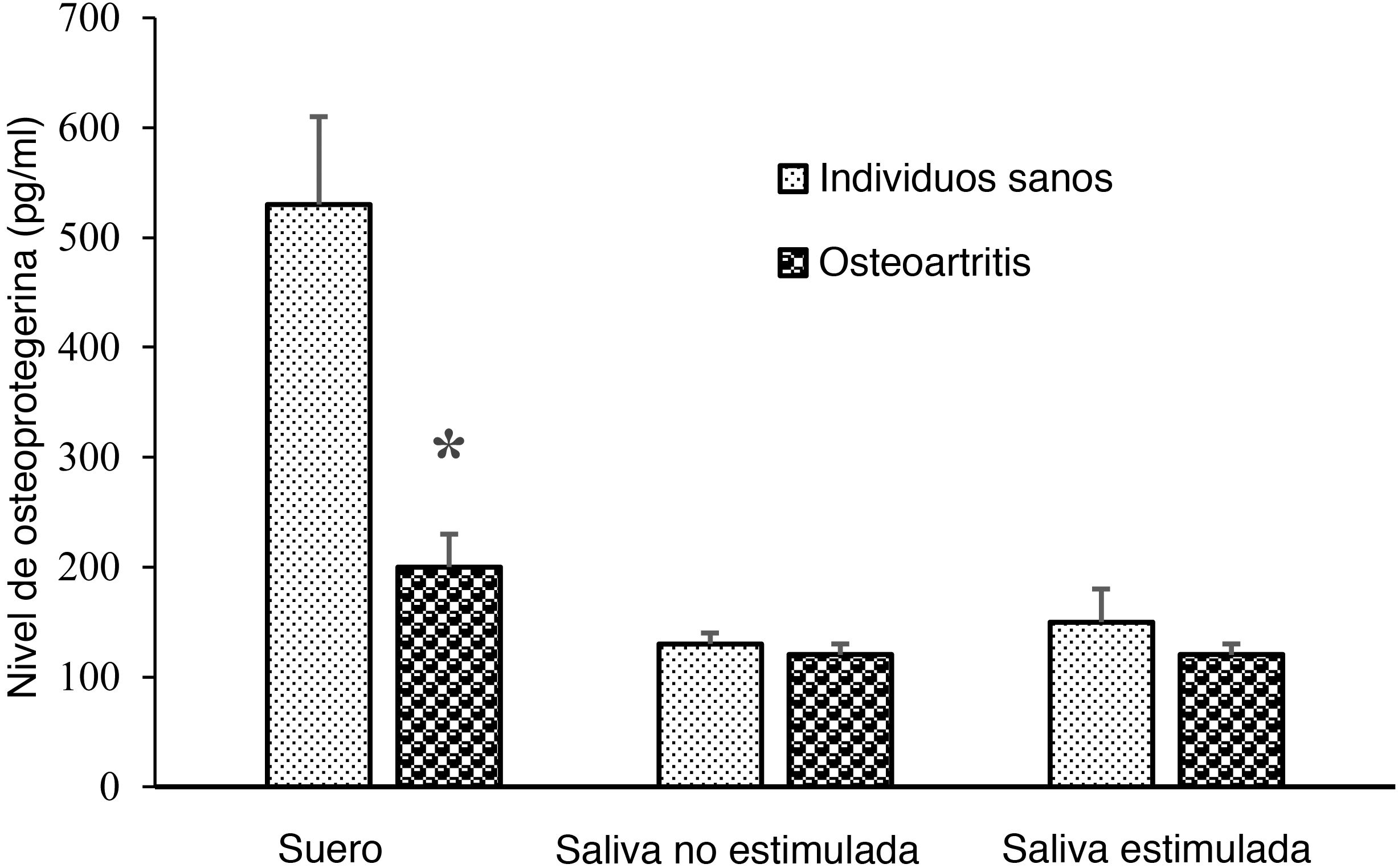
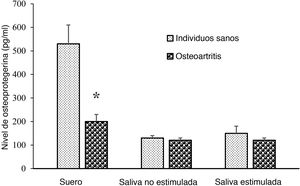
La concentración media de OPG sérica fue menor en el grupo OA que en el grupo de sujetos sanos (p = 0,001) (fig. 1). Sin embargo, las concentraciones salivales estimuladas y no estimuladas de OPG no fueron significativamente diferentes entre los grupos OA y control (p = 0,317, p = 0,712, respectivamente).
La puntuación WOMAC se correlacionó negativamente con el nivel sérico de OPG (r = −0,501; p = 0,000). Sin embargo, no existió correlación significativa entre la puntuación WOMAC y el nivel de OPG con estimulación de saliva (r = −0,097; p = 0,361) o sin estimulación salival (r = −0,102; p = 0,470).
El nivel sérico de OPG no se correlacionó significativamente con los niveles de OPG en saliva no estimulada (r = 0,186; p = 0,188) y estimulada (r = 0,134; p = 0,366).
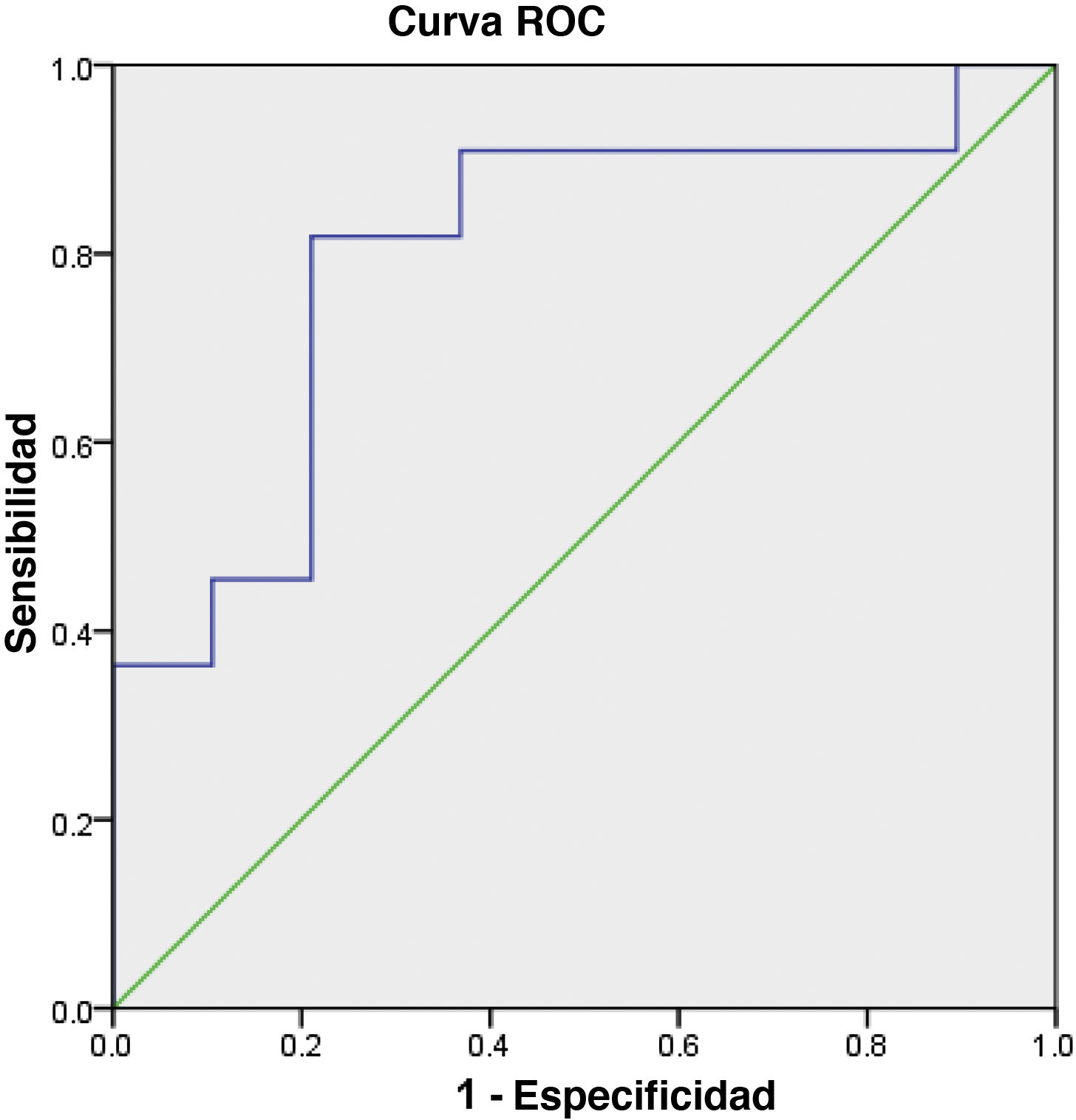
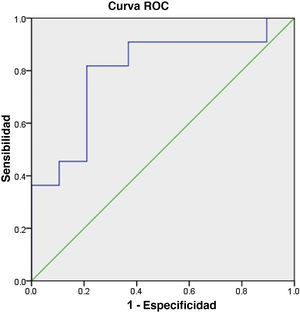
Los resultados del análisis ROC revelaron que el valor del punto de corte de OPG sérica para el diagnóstico de OA fue de 237,5 pg/mL (área bajo la curva ROC = 0,799). Con este punto de corte, la sensibilidad fue del 82% y la especificidad del 79% (fig. 2).
DiscusiónActualmente, los biomarcadores que se aplican para evaluar la actividad de la enfermedad o cribar la efectividad del tratamiento de la OA dependen de los resultados de la IRM. La invasividad relativa que producen la obtención de muestras de sangre o LS es otra causa que fundamenta la necesidad de nuevos biomarcadores simples, rentables y no invasivos. La saliva puede recogerse de manera no invasiva, con fácil acceso, y posibilidad de repetir la muestra. Por tanto, la saliva representa un líquido diagnóstico atractivo para distinguir los biomarcadores de diversas situaciones patológicas20–28. En los pacientes de OA se han estudiado poco los marcadores en otros biofluidos que no sean el plasma y el LS. De igual modo, la posibilidad de medir estos en la saliva aporta técnicas no invasivas, y por tanto más cumplimiento por parte de los pacientes. El objetivo de este estudio fue analizar la OPG en muestras de suero y saliva de los pacientes con OA. Nuestros resultados reflejaron un valor de OPG sérica menor en OA de rodilla, que se correlaciona negativamente con WOMAC. Sin embargo, la OPG en saliva estimulada y no estimulada no difirió entre los dos grupos, y no se correlacionó con WOMAC.
La OA es una enfermedad articular degenerativa que se caracteriza por la destrucción lenta de la matriz del cartílago y los cambios óseos29. Se ha observado que la carencia en ratones de ambos alelos de OPG produce la forma de degeneración articular más grave, y que la administración de OPG en ratones con OA protege la destrucción del cartílago articular30,31. De igual modo, se ha reportado que los ratones con déficit de OPG muestran capas finas de cartílago articular31, gran destrucción del cartílago de crecimiento y cierto grado de destrucción del cartílago con la edad30,31. Concuerdan con nuestros resultados en cuanto a que el nivel sérico de OPG fue menor en los pacientes con OA que en los sujetos sanos, y que la concentración de OPG sérica se correlacionó negativamente con WOMAC, como indicador de la gravedad de la OA de rodilla en este estudio. Sin embargo, nuestro resultado es contrario a los informes de Min et al.15 y Pilichou et al.16, quienes reflejaron que el nivel sérico de OPG es mayor en los sujetos con OA con relación a los sujetos sanos. La mayoría de los participantes en los estudios mencionados eran mujeres (mujer/varón≈4), y la mayoría de los sujetos de nuestro estudio eran varones (mujer/varón≈0,6). Quizás esta paradoja relacionada con el sexo necesita ser probada mediante estudios futuros.
Los OPG son receptores solubles que se unen a RANKL e inhiben la unión de este a RANK que se produce en la membrana del preosteoclasto32, e inhibe por tanto la osteoclastogénesis33. Se ha observado que la expresión de ARNm de RANKL se incrementa en el cartílago de los pacientes con OA de grado 234. RANKL incrementa también la expresión de MMP-13 en dichos pacientes. Los estudios han reflejado que la sobreexpresión de MMP-13 juega un papel esencial en la destrucción del cartílago articular, y que se producen cambios morfológicos en el tejido óseo en OA35. En la región profunda del cartílago RANKL puede distribuirse desde la capa fina del cartílago calcificado al hueso, donde puede unirse a RANK en los precursores osteoclásticos en el hueso subcondral. De igual modo, se ha reportado que RANKL se incrementa en el suero de los pacientes con OA de rodilla16. Parece ser que la producción de OPG se reduce, y se incrementa la producción de RANKL en la OA de rodilla, y de ahí que la sobreexpresión de MMP-13 cause la destrucción de cartílago y hueso en las articulaciones de estos pacientes. Además, se ha observado que el nivel de cortisol es mayor en los pacientes de OA y está asociado a WOMAC, y que los glucocorticoides reducen la OPG sérica36,37. Esto puede explicar la reducción de OPG sérica en los pacientes de OA.
En este estudio WOMAC se correlacionó negativamente con la OPG sérica. El análisis ROC indicó un valor de corte de 237,5 pg/mL para suero en el diagnóstico diferencial de OA y los sujetos normales. Dichos resultados sugieren que OPG puede tener relación con la patogenia de OA y es un biomarcador potencial para esta situación.
No se observaron diferencias significativas en términos de OPG salival entre los sujetos con OA de rodilla y los individuos sanos. A nuestro mejor entender, este es el primer estudio que aborda la detección de OPG en la saliva de los pacientes de OA. Parece que la detección de OPG en saliva no es un biomarcador potencial para OA.
El presente estudio ha tenido ciertas limitaciones. Al incluir pacientes con OA de rodilla de grados 2 y 3, no podemos evaluar la asociación de OPG con el grado radiológico de OA de rodilla. Además, para calcular con precisión el punto de corte de la OPG sérica, el tamaño de la muestra fue pequeño.
ConclusiónNuestros resultados reflejaron que como el valor de la OPG sérica fue menor en los casos de OA de rodilla y se correlacionó negativamente con WOMAC, parece que la detección de OPG en suero, pero no en saliva, puede ser un marcador probable para el diagnóstico de la OA de rodilla.
Nivel de evidencia II.
Responsabilidades éticasEste estudio fue aprobado por el Comité de Ética del Instituto Nacional para el Desarrollo de Investigación Médica (NIMAD) con código de aprobación IR.NIMAD.REC.1396.206.
FinanciaciónLa investigación reportada en esta publicación fue respaldada por Elite Research Grant Committee bajo el número 963466 del Instituto Nacional para el Desarrollo de Investigación Médica (NIMAD), Dirección de Investigación y Tecnología, Ministerio de Salud y Formación Médica de Irán.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.