Evaluar in vivo la actividad bactericida antiestafilocócica del farnesol sobre superficies de Ti6Al4V.
Material y métodosSe desarrolló un modelo experimental de infecciones en biomateriales inoculando Staphylococcus aureus ATCC 29213 en los fémures de 15 ratas wistar. Seguidamente se insertó una aguja de Ti6Al4V impregnada con farnesol 30mM en el fémur estudio y una aguja control en el fémur control. Para valorar la eficacia bactericida se compararon las medianas de unidades formadoras de colonias recuperadas después de la inoculación en el grupo estudio y en el grupo control, para diferentes tiempos de eutanasia y tamaño de inóculos.
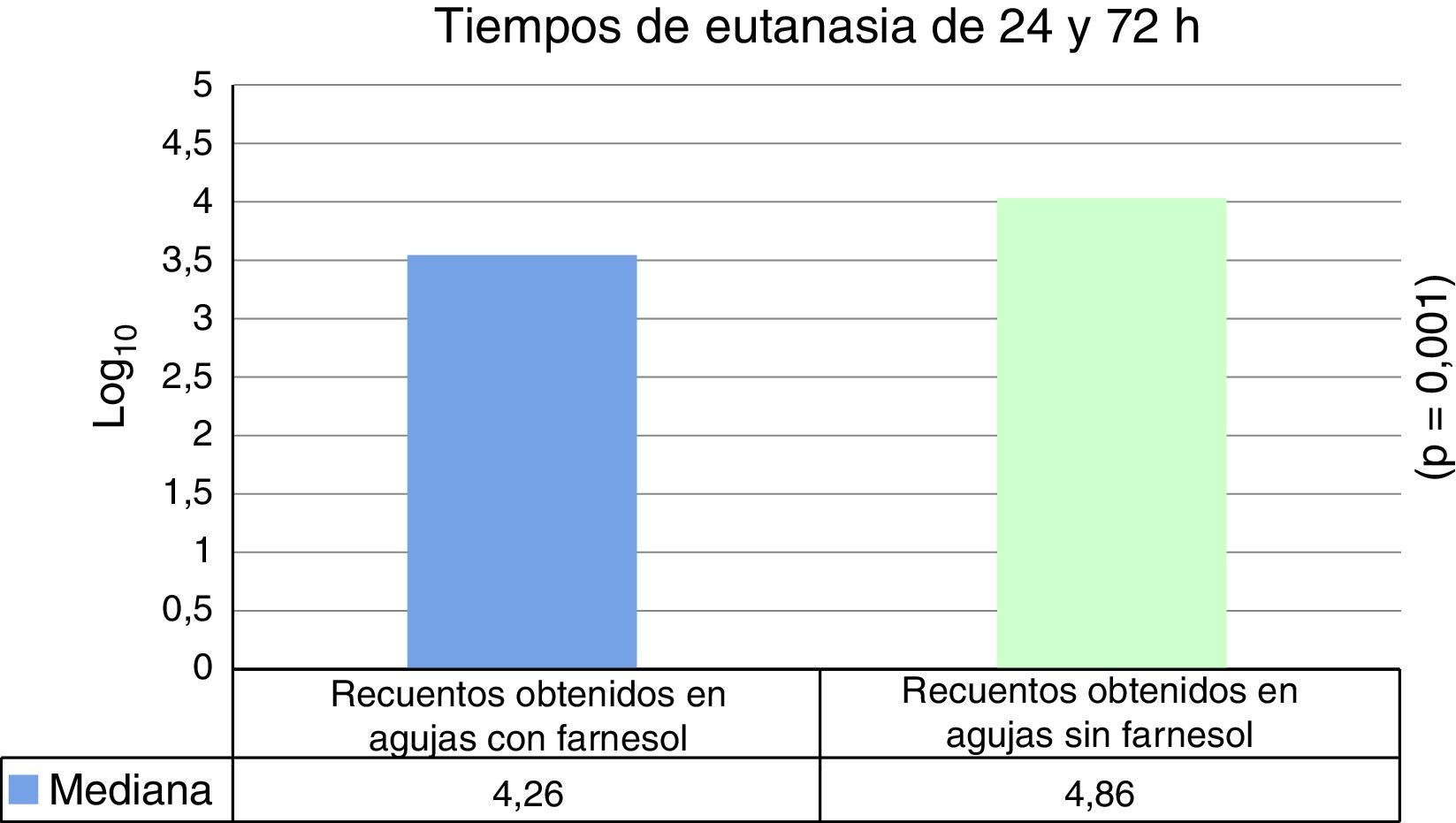
ResultadosLa mediana expresada en Log10 de los recuentos de UFC obtenidos en agujas de titanio con farnesol fue de 4,26 y en agujas sin farnesol, controles, fue de 4,86. Esta diferencia, al aplicar la prueba de t de Student para muestras relacionadas, resultó ser estadísticamente significativa (p=0,001). La reducción mediana obtenida en las agujas con farnesol respecto a las agujas control fue del 74%.
ConclusionesEl tratamiento con farnesol de agujas de Ti6Al4V, a una concentración de 30mM, parece disminuir la tasa de colonización por Staphylococcus aureus en dichas agujas.
To evaluate the in vivo anti-staphylococcal bactericidal activity of farnesol on Ti6Al4V surfaces.
Material and methodsAn experimental model of infection in biomaterials was developed by inoculation of Staphylococcus aureus ATCC 29213 into the canal of both femurs of 15 Wistar rats. A Ti6Al4V pin impregnated with 30mM of farnesol was inserted into study femur, and a Ti6Al4V control was inserted into the control femur. To evaluate the bactericidal efficacy, a comparison was made between the median of the colony forming units recovered after inoculation in the study group and the control group for different times of euthanasia and inoculum size.
ResultsThe median expressed as Log10 CFU counts obtained with farnesol titanium pin was 4.26, and in control group, it was 4.86, which was statistically significant (P=.001) on applying the Student t test for related samples.
The median reduction obtained in farnesol pins relative to the control was 74%.
ConclusionsTreatment with farnesol 30mM on Ti6Al4V pins appears to decrease the rate of colonisation by Staphylococcus aureus.
Las infecciones en biomateriales implantados en seres vivos, normalmente, están asociadas a la formación de una biocapa que es difícil de erradicar. En la mayoría de los casos, es necesaria la retirada del implante infectado. Todo esto conlleva un aumento considerable de morbilidad, mortalidad y costes en la sanidad.
Las bacterias patógenas han desarrollado numerosos mecanismos de defensa contra agentes antibacterianos, por lo que la resistencia a viejos y nuevos productos farmacéuticos está incrementándose.
Debido al incremento progresivo en las resistencias de estas bacterias a antibióticos, los investigadores han estudiado diferentes moléculas orgánicas con capacidad antibacteriana. En este contexto, los productos naturales, compuestos derivados de plantas como los aceites esenciales, han atraído considerablemente la atención.
El farnesol (C15H26O) es un compuesto orgánico natural, un alcohol sesquiterpeno acíclico que se encuentra ampliamente distribuido en muchos aceites esenciales, como citronela1. Interviene en el quorum sensing de Candida, bloqueando la formación de biocapa, así como la producción de otros factores de virulencia por este hongo2. El farnesol afecta al crecimiento de un número importante de bacterias y hongos, tales como Staphylococcus aureus (S. aureus)2,3, Streptococcus mutans4, Fusarium graminearum5, lo que señala su potencial uso como agente antimicrobiano6.
Bhattacharyya et al. han señalado que el farnesol penetra en la biocapa, se acumula en la membrana celular y a través de su mecanismo de acción aumenta la porosidad de la membrana celular7. Este aumento de la permeabilidad de la membrana celular bacteriana a distintas sustancias podría incrementar la captación de antibióticos si se usaran en asociación con el farnesol, haría que la dosis de antibióticos necesaria fuera menor y esto disminuiría la posible aparición de resistencias. Es decir, el farnesol incrementaría la susceptibilidad de las bacterias a antibióticos y otros compuestos antimicrobianos8.
En un reciente artículo, Unnuntana et al. demostraron in vitro la capacidad del farnesol para inhibir la formación de biocapas de S. aureus meticilino sensible a concentraciones de 30mM sobre discos de titanio9.
El objetivo del presente trabajo es analizar si el tratamiento con farnesol de la superficie de agujas de Ti6Al4V previa a su implantación en el fémur de ratas disminuye la tasa de colonización por S. aureus en dichas agujas y en el fémur que las contiene.
Material y métodosMaterial de osteosíntesis: Ti6Al4VLa aleación de Ti6Al4V fue suministrada por Kirschner Maschinenbau GmbH (Unterschneidheim, Alemania) en forma de alambre de dimensión 1,2×150mm, que se cortó mediante un cortafrío en porciones de 1,2×20mm.
El protocolo de limpieza de las agujas previa a su implantación fue el siguiente: Derquim DSF al 2%, sonicación, inmersión en agua destilada a 60°C durante 15 min, 10 min en acetona al 70% y finalmente horno Pasteur durante 30 min a 40°C.
Las agujas se dividieron en 2 grupos:
- a)
Las que iban a ser empleadas como agujas control, que no fueron tratadas mediante ningún otro proceso.
- b)
Las agujas que iban a ser utilizadas para estudiar el efecto bactericida del farnesol sobre la aleación de Ti6Al4V, las cuales fueron sometidas, además de al proceso anterior, a:
- 1.
Inmersión en piraña con 5ml de H2SO4 concentrado a 5ml y H2O2 del 30% durante una hora.
- 2.
Lavados con agua y etanol en un baño de ultrasonidos durante 10 min en cada uno de ellos.
- 3.
Inmersión de las agujas en una disolución de farnesol (30mM) durante 24 h.
- 4.
Por último, se dejaron secar en un papel absorbente estéril 2-3 h en el horno Pasteur a 50°C.
- 1.
El patógeno utilizado fue S. aureus, la cepa ATCC 29213 (American Type Culture Collection). Se dejó crecer la bacteria durante 18-24 h en una estufa a 37°C en caldo de soja tripticasa (tryptic soy broth o TSB) (BBL, Becton Dickinson and Company, Sparks, EE. UU.). Posteriormente se realizaron las diluciones oportunas hasta conseguir la concentración final deseada de bacterias.
Animal de experimentaciónTodos los ensayos in vivo que se realizaron en este trabajo fueron previamente aprobados por el Comité de Ética de la Universidad de Extremadura (número de expediente: 161/2009).
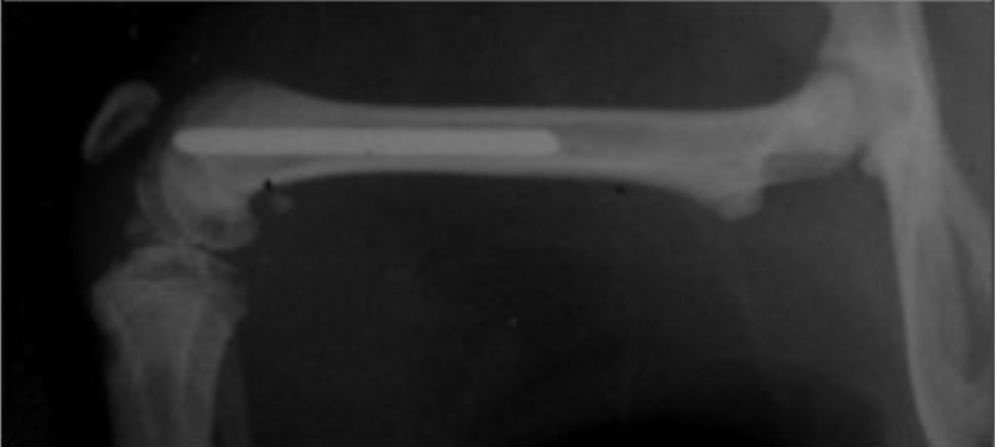
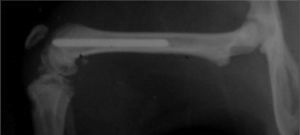
Se planificó en este estudio intervenir a 15 ratas wistar de sexo masculino de peso similar (300-350g). Sin profilaxis antibiótica preoperatoria, se realizó la implantación aleatoria de una aguja de titanio Ti6Al4V de 1,2×20mm en cada fémur de las ratas (fig. 1), una aguja tratada con farnesol y otra sin dicho tratamiento, de modo que una pata actuaba como pata estudio, la que contenía la aguja con farnesol, y la otra pata como control, la que albergaba la aguja sin farnesol.
La eutanasia de las ratas fue planificada en 2 tiempos, a las 24 h (7 ratas) y a las 72 h postintervención (8 ratas).
Técnica quirúrgica, eutanasia, recogida y procesamiento de muestrasLa solución anestésica estaba compuesta por: 50% quetamina, 40% diacepam y 10% atropina y la dosis que se administró fue de 0,004ml/kg peso por vía intraperitoneal. Se realizó un abordaje pararrotuliano interno de 1cm con luxación externa de la rótula. Se practicó un orificio en la región intercondílea mediante punción manual con la aguja de un catéter Abbocath del número 20, avanzando en profundidad desde la zona metafisaria hasta llegar a 3,5cm en la diáfisis femoral, creando así un canal intramedular y respetando siempre las corticales. Se amplió posteriormente el diámetro de dicho canal usando agujas de Abbocath de calibres progresivamente mayores (números 18 y 16). Seguidamente con ayuda de una microjeringa introducida en la profundidad del canal, se inoculó lentamente en cada pata 10μL de diferentes inóculos de S. aureus ATCC 29213 con un número aproximado de bacterias entre 300 y 1.300. Siempre se inoculaba el mismo número de bacterias en la pata estudio y en la pata control. Finalmente, previa aleatorización, se introdujo en las cavidades creadas las agujas de titanio Ti6Al4V de 1,2×20mm, con farnesol en la pata estudio y sin farnesol en la pata control.
Una vez terminada la intervención, las ratas fueron estabuladas en jaulas independientes durante el tiempo requerido hasta su eutanasia con alimentación y mantenimiento rutinario.
Siguiendo la planificación del estudio, en el momento adecuado (24-72h de la intervención) se sacrificaron las ratas. La eutanasia se realizó mediante inyección intracardiaca de 0,5ml de ClK/100g de peso corporal, previa sedación del animal con la misma solución anestésica descrita anteriormente. Al mismo tiempo se tomó una muestra de sangre por punción cardiaca para realizar hemocultivo y valorar la existencia de posible bacteriemia.
Inmediatamente después y bajo estrictas condiciones de asepsia en quirófano, se realizó la extirpación seriada de ambos fémures, desarticulándolos de las rodillas y de las caderas con la mínima cantidad posible de tejido muscular. Siempre se tuvo la precaución de utilizar un material quirúrgico estéril para cada pata. Una vez extraídos los fémures, eran fracturados con una pinza gubia para obtener la aguja intramedular. Tanto los fémures como las agujas intramedulares se recogieron en tubos separados con PBS estéril que eran rotulados para identificar si procedían de la pata izquierda o derecha y el número de bacterias que se habían inoculado.
Para el análisis microbiológico, las muestras óseas fueron fragmentadas para facilitar la realización de las diluciones bacterianas, mientras que las agujas no requirieron ningún proceso previo.
Las diluciones bacterianas se llevaron a cabo mediante sonicación durante 15 min en un baño de ultrasonidos (Ultrasons P Selecta, Madrid, España), para despegar las bacterias adheridas fuertemente a las muestras. Una vez resuspendidas las bacterias en el medio, se llevaron a cabo las diluciones seriadas y la posterior siembra en placas de agar común. Estas placas se incubaron durante 18-24 h a 37°C en la estufa. Pasado este tiempo, se procedió a la realización del recuento, usando una lupa, y se recogieron los datos de las unidades formadoras de colonias (UFC) que habían crecido de las diferentes diluciones de cada muestra. Para conseguir un número de UFC por muestra más exacto, se calculó la media de las crecidas en la serie de diluciones de cada muestra.
Análisis estadísticoEl análisis estadístico fue realizado usando el programa SPSS 20 para Mac (SPSS, Chicago, IL, EE. UU.). Todos los resultados fueron expresados con medidas de tendencia central, tales como la media y la mediana, y medidas de dispersión como la varianza. Las diferencias en recuento de colonias recuperadas después de la inoculación entre los distintos grupos de estudio fueron valoradas utilizando el test paramétrico de la t de Student y el no paramétrico de Wilcoxon de los rangos con signos para muestras relacionadas. Valores de probabilidad menores de 0,05 fueron considerados estadísticamente significativos.
ResultadosEn primer lugar, se realizaron las pruebas de normalidad de Kolmogorov-Smirnov y Shapiro-Wilk sobre las distintas variables objeto de estudio, obteniéndose un resultado no estadísticamente significativo en todas las variables excepto en la variable Log de recuento de la pata control. Es decir, todas las variables seguían una distribución normal excepto la referida, por lo que se utilizaron tanto pruebas paramétricas como no paramétricas para el análisis estadístico.
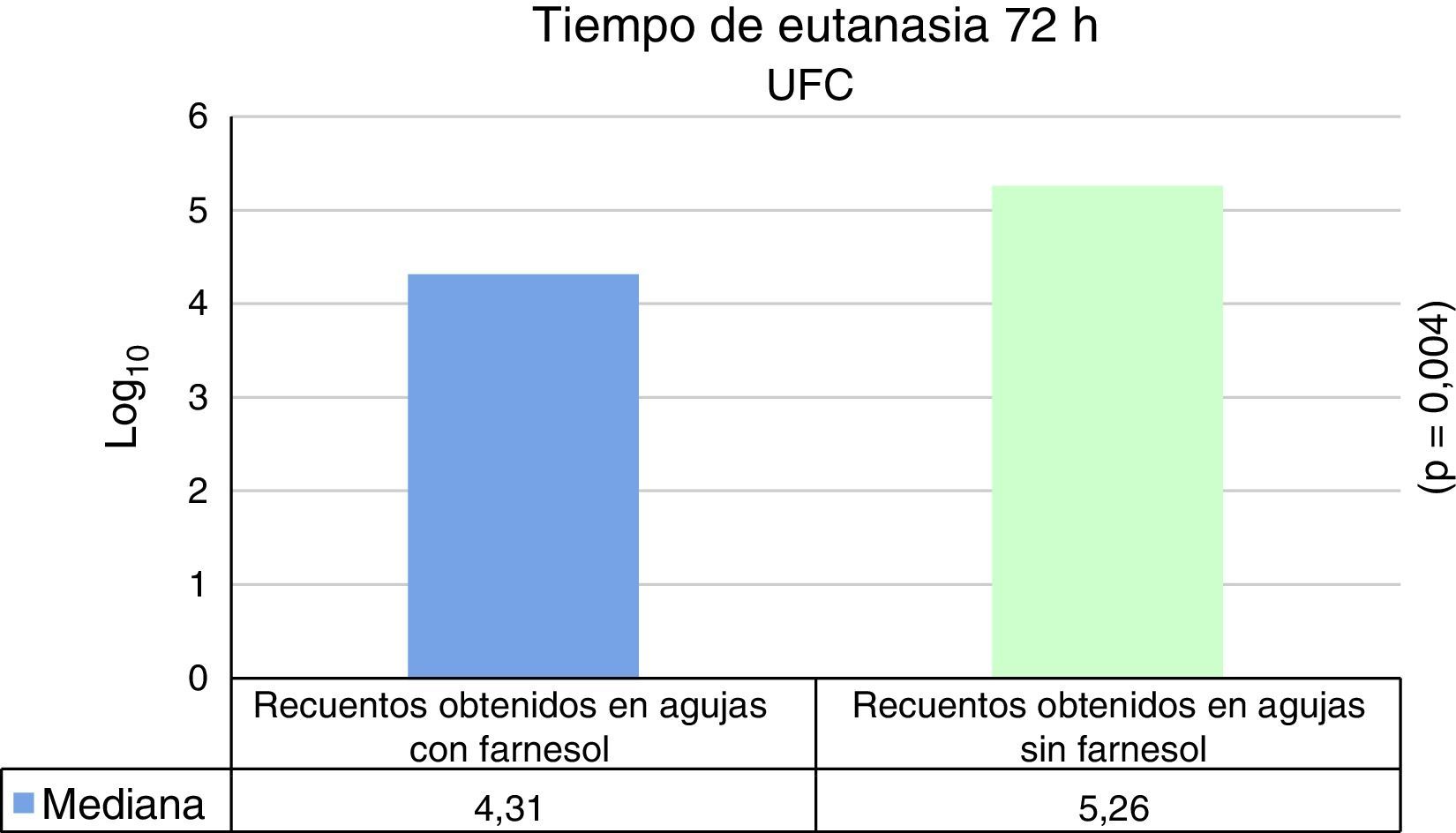
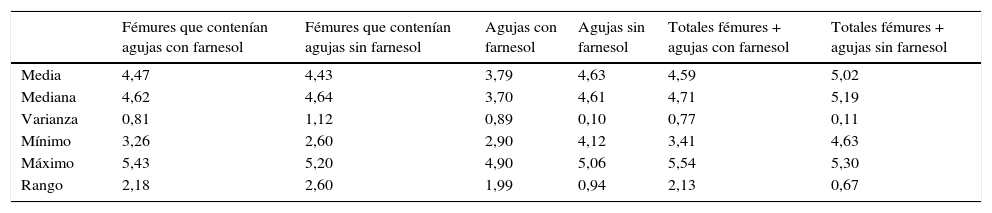
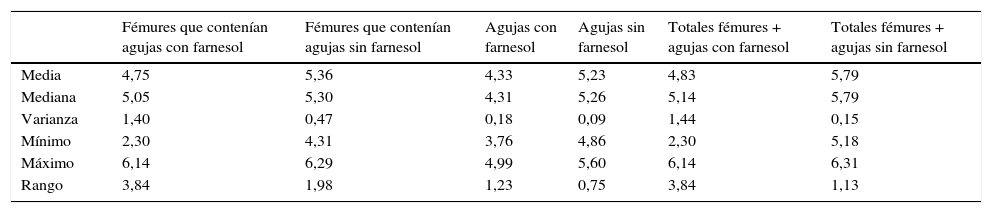
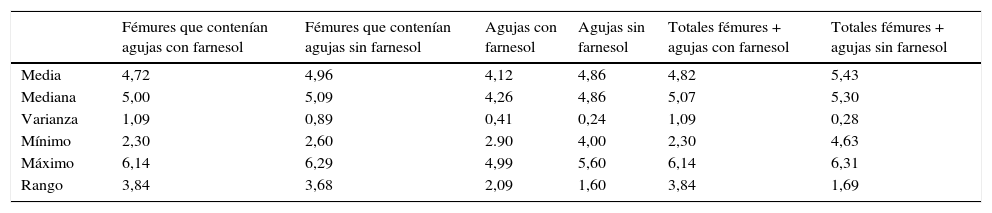
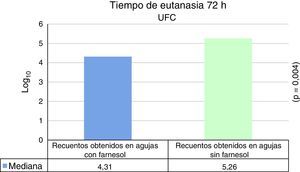
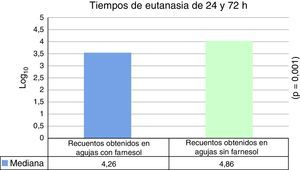
Para tiempos de eutanasia de 24 h no se han encontrado diferencias estadísticamente significativas en los recuentos recuperados en agujas impregnadas en farnesol respecto a las agujas control, ni en los recuentos recuperados de fémures que contenían agujas con farnesol respecto a los fémures que contenían agujas control (tabla 1). Para tiempos de eutanasia de 72h únicamente se ha encontrado una diferencia estadísticamente significativas (t de Student) (p=0,004) en la mediana expresada en Log10 de los recuentos de UFC recuperados en agujas de titanio impregandas con farnesol (4,31) respecto a los recuperados de agujas sin farnesol o controles (5,26). La reducción obtenida en las agujas tratadas con farnesol respecto a las agujas controles fue del 88% (fig. 2) (tabla 2). Al analizar los resultados en global sin tener en cuenta el tiempo de eutanasia, la mediana expresada en Log10 de los recuentos de UFC obtenidos en agujas de titanio con farnesol fue de 4,26 y en agujas sin farnesol, controles, fue de 4,86. Esta diferencia, al aplicar la prueba de t de Student para muestras relacionadas, resultó ser estadísticamente significativa (p=0,001). La reducción mediana obtenida en agujas con farnesol respecto a las agujas control fue del 74% (fig. 3) (tabla 3).
Resumen de los estadísticos descriptivos obtenidos de los recuentos recuperados de agujas y fémures expresado en Log10 UFC para tiempos de eutanasia de 24h
| Fémures que contenían agujas con farnesol | Fémures que contenían agujas sin farnesol | Agujas con farnesol | Agujas sin farnesol | Totales fémures + agujas con farnesol | Totales fémures + agujas sin farnesol | |
|---|---|---|---|---|---|---|
| Media | 4,47 | 4,43 | 3,79 | 4,63 | 4,59 | 5,02 |
| Mediana | 4,62 | 4,64 | 3,70 | 4,61 | 4,71 | 5,19 |
| Varianza | 0,81 | 1,12 | 0,89 | 0,10 | 0,77 | 0,11 |
| Mínimo | 3,26 | 2,60 | 2,90 | 4,12 | 3,41 | 4,63 |
| Máximo | 5,43 | 5,20 | 4,90 | 5,06 | 5,54 | 5,30 |
| Rango | 2,18 | 2,60 | 1,99 | 0,94 | 2,13 | 0,67 |
Resumen de los estadísticos descriptivos obtenidos de los recuentos recuperados de agujas y fémures expresado en Log UFC para tiempos de eutanasia de 72h
| Fémures que contenían agujas con farnesol | Fémures que contenían agujas sin farnesol | Agujas con farnesol | Agujas sin farnesol | Totales fémures + agujas con farnesol | Totales fémures + agujas sin farnesol | |
|---|---|---|---|---|---|---|
| Media | 4,75 | 5,36 | 4,33 | 5,23 | 4,83 | 5,79 |
| Mediana | 5,05 | 5,30 | 4,31 | 5,26 | 5,14 | 5,79 |
| Varianza | 1,40 | 0,47 | 0,18 | 0,09 | 1,44 | 0,15 |
| Mínimo | 2,30 | 4,31 | 3,76 | 4,86 | 2,30 | 5,18 |
| Máximo | 6,14 | 6,29 | 4,99 | 5,60 | 6,14 | 6,31 |
| Rango | 3,84 | 1,98 | 1,23 | 0,75 | 3,84 | 1,13 |
Resumen de los estadísticos descriptivos obtenidos de los recuentos recuperados de agujas y fémures expresado en log UFC para tiempos de eutanasia de 48h y 72h
| Fémures que contenían agujas con farnesol | Fémures que contenían agujas sin farnesol | Agujas con farnesol | Agujas sin farnesol | Totales fémures + agujas con farnesol | Totales fémures + agujas sin farnesol | |
|---|---|---|---|---|---|---|
| Media | 4,72 | 4,96 | 4,12 | 4,86 | 4,82 | 5,43 |
| Mediana | 5,00 | 5,09 | 4,26 | 4,86 | 5,07 | 5,30 |
| Varianza | 1,09 | 0,89 | 0,41 | 0,24 | 1,09 | 0,28 |
| Mínimo | 2,30 | 2,60 | 2.90 | 4,00 | 2,30 | 4,63 |
| Máximo | 6,14 | 6,29 | 4,99 | 5,60 | 6,14 | 6,31 |
| Rango | 3,84 | 3,68 | 2,09 | 1,60 | 3,84 | 1,69 |
Nuevos biomateriales recubiertos de antibióticos están siendo investigados; sin embargo, su uso para la prevención de infecciones en biomateriales es controvertido, ya que la concentración de agentes bactericidas cargados en esos biomateriales podrían producir toxicidad local o sistémica y la prolongada liberación de antibióticos en cantidades subinhibitorias podría generar la aparición de nuevas cepas de microorganismos resistentes10. Por lo tanto, hay una necesidad crítica de desarrollar nuevos compuestos antimicrobianos con capacidad inhibitoria sin aumentar las resistencias. En este contexto las sustancias naturales empleadas en terapéutica tradicionalmente pueden jugar un importante papel.
El farnesol es un alcohol sesquiterpeno que se encuentra en los aceites esenciales de determinados frutos cítricos con actividad antimicótica y antibacteriana. Inicialmente se descubrió que el farnesol inhibía la comunicación intercelular en el hongo Candida albicans11. También se ha demostrado que inhibe el proceso de filamentación y el sistema quorum sensing de hongos y ciertas bacterias2,7. El farnesol parece no tener efectos tóxicos sistémicos o mutágenos ni in vitro ni in vivo2.
Debido a todas estas propiedades, grupos de investigación han examinado su efecto en biocapas de S. aureus in vitro. Unnuntana et al. demostraron la capacidad del farnesol para inhibir la formación de biocapas de S. aureus meticilino sensible a concentraciones de 30mM en discos de titanio9. Los grupos de Jabra-Rizk y Gomes demostraron que concentraciones menores, de rango 200-300μM, aún tenían efecto antibacteriano sobre las biocapas de S. aureus y atribuían este efecto a la disrupción de la membrana celular del S. aureus3,11.
En la literatura no hemos encontrado estudios in vivo que investiguen la influencia del farnesol en la prevención de la colonización de implantes de titanio por S. aureus. Basados en el artículo de Unnuntana et al., diseñamos este trabajo en ratas utilizando agujas de Ti6Al4V impregnadas en una disolución de farnesol (30mM).
Varios modelos experimentales de osteomielitis han sido desarrollados utilizando diferentes animales, tales como ratas12–14, conejos15, perros16, cerdos17, etc. En la mayoría de los modelos de osteomielitis, incluidos modelos en ratas, se utilizan distintos agentes y estrategias para facilitar la infección ósea: agentes esclerosantes, como el morruato de sodio13 o su derivado el ácido araquidónico18; la necrosis ósea térmica creada por electrocauterización19 o por el uso de broca para abrir el canal intramedular en el hueso. En nuestro modelo experimental no hemos utilizado ningún agente esclerosante, ni utilizado broca para perforar el fémur, ni cera ósea para taponar el agujero del canal, para intentar aislar el efecto del titanio como cuerpo extraño favorecedor de osteomielitis.
Al analizar los resultados obtenidos, no hemos observado que existan diferencias estadísticamente significativas en la mediana de recuentos bacterianos obtenidos de fémures que contenían las agujas con farnesol frente a los fémures que albergaban las agujas control (fémures control). En cambio, sí hemos encontrado unas diferencias estadísticamente significativas en los recuentos bacterianos obtenidos en agujas con farnesol respecto a sus controles a las 72 h del inóculo.
Para tiempos de eutanasia de 24 h no observamos una disminución estadísticamente significativa de los recuentos bacterianos obtenidos en agujas con farnesol respecto a las agujas controles. Ello puede ser debido al pequeño tamaño de la muestra de los subgrupos, de hecho, cuando se analizan en conjunto ambos subgrupos (24 y 48 h), sí se obtienen diferencias estadísticamente significativas.
El mecanismo íntimo de acción por el cual el farnesol tiene efecto antibacteriano se desconoce, aunque existen diferentes teorías aceptadas. El mecanismo de acción principal de esta sustancia parece ser que es la disrupción de la membrana celular del S. aureus. Dado el carácter lipídico de esta pequeña molécula, es relativamente fácil para el farnesol acumularse en la membrana celular provocando su rotura, evidenciándose esta por el aumento de la liberación de iones de potasio de las células de la membrana2,3. Este aumento de iones potasio ocurre a los 10 s de la adición del farnesol, lo que indica que el farnesol es capaz de dañar la membrana de S. aureus muy rápidamente3. El farnesol también reduce la formación de matriz de fibrina por S. aureus mediante inhibición de la coagulasa2,7,13,20 e inhibe la vía de mevalonato, dificultando la apropiada producción y reparación de la membrana celular8,20. El farnesol, por tanto, incrementa la permeabilidad de la membrana de las células bacterianas, de forma inespecífica, a componentes químicos exógenos, incluidos antibióticos. Esto permitiría mejorar la eficacia de los antimicrobianos sobre las bacterias y en la biocapa de S. aureus. Algunos estudios in vitro han demostrado la capacidad del farnesol para incrementar la susceptibilidad de microorganismos a antimicrobianos, indicando su posible uso como fármaco adyuvante5. Brehm-Stecher et al.8 han publicado un incremento de susceptibilidad de S. aureus a ciprofloxacino, clindamicina, eritromicina, gentamicina, tetraciclina y vancomicina, así como de E. coli a polimixina B, cuando estos fármacos son combinados con farnesol.
La toxicidad local y sus posibles efectos nocivos sobre la osteointegración es siempre una preocupación cuando se utiliza cualquier agente nuevo directamente sobre el hueso. Unnuntana et al.9 investigaron in vitro los efectos del farnesol sobre los osteoblastos en discos de titanio. Estos autores demostraron que concentraciones de farnesol entre 3 y 30mM tenían efectos negativos irreversibles sobre los preosteoblastos, de manera que estos se unían entre sí, formando conglomerados, pero no se extendían sobre la superficie del titanio. Estos hallazgos son consistentes con otros estudios que muestran que el farnesol causa desorganización citoesquelética y apoptosis en otro tipos de células como son las tumorales21,22. Actualmente no hay estudios in vivo que analicen a largo plazo la posible toxicidad local o general de esta sustancia. Sería necesario realizar estudios in vivo que valoraran histológica y radiográficamente a largo plazo el posible efecto negativo del farnesol sobre la osteointegración del titanio.
La principal limitación de este trabajo es el tamaño muestral, que nos impide tener una población mínima suficiente en los distintos subgrupos para valorar otras variables, como por ejemplo la influencia del tamaño del inóculo bacteriano en el efecto bactericida del farnesol sobre las agujas de Ti6Al4V.
Otra importante limitación es la utilización en este estudio de una cepa atenuada de S. aureus (ATCC 29213). Los resultados obtenidos con esta cepa podrían no corresponder con los obtenidos de cepas clínicas, cuyos factores de patogenicidad están intactos. Por lo tanto, serán necesarios más estudios en distintas cepas clínicas para confirmar que los resultados obtenidos pueden tener importancia clínica y que sean extrapolables a la práctica asistencial.
Hemos observado en este trabajo que existe una gran variabilidad en los recuentos bacterianos obtenidos tanto en fémures como en agujas, independientemente de que estuvieran impregnadas en farnesol o no. Tal variabilidad en el número de bacterias refleja, por un lado, las particularidades intrínsecas de un modelo in vivo (variaciones anatómicas del fémur, en el sangrado del canal, sistema inmunitario de la rata, etc.) y, por otro lado, los posibles errores que se hayan podido cometer en las técnicas del estudio (diferencias en el fresado del hueso, en la colocación del implante, en la preparación de los inóculos, en el procesamiento de las muestras, etc.). Por esto, creemos que resulta muy difícil reproducir in vivo los resultados obtenidos en un estudio in vitro, ya que existe un grupo de variables que influyen en el resultado, pero sobre las cuales no podemos tener ningún tipo de control.
Así mismo, sería conveniente realizar un estudio in vitro que permitiera establecer la cinética de liberación del farnesol en las agujas de titanio, ya que si esta no es homogénea, podría explicar parte de la variablidad observada en los resultados.
A raíz de los resultados obtenidos al realizar este estudio, y a pesar de la variabilidad intrínseca de los modelos in vivo, podemos concluir que el tratamiento con farnesol de agujas de Ti6Al4V, a una concentración de 30mM, parece disminuir la tasa de colonización por S. aureus ATCC 29213 en dichas agujas implantadas en el fémur de una rata.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido llevado a cabo gracias a todos los miembros del Grupo de Investigación sobre Adhesión Microbiana de la Universidad de Extremadura (AM-UEX) del centro de Investigación Biomédica en Red Bioingeniería, Biomateriales y Nanomedicina (CIBERBBN).