La impresión 3D (I3D) es una tecnología de fabricación aditiva con un creciente interés en medicina y, sobre todo, en la especialidad de cirugía ortopédica y traumatología. Hay numerosas aplicaciones que aportan un valor añadido al tratamiento personalizado de los pacientes: planificación preoperatoria avanzada, cirugías con herramientas específicas para cada paciente, tratamientos ortésicos a medida, implantes o prótesis personalizadas y un desarrollo innovador en el campo de la ingeniería de tejidos óseos y cartilaginosos.
En el presente trabajo se realiza una actualización sobre el papel que el cirujano ortopédico y traumatólogo desempeña como usuario y como médico prescriptor de esta tecnología y se hace un repaso a las etapas necesarias para una correcta integración de la I3D en el flujo asistencial hospitalario, desde los recursos necesarios hasta las recomendaciones legales actuales.
3D printing (I3D) is an additive manufacturing technology with a growing interest in medicine and especially in the specialty of orthopaedic surgery and traumatology. There are numerous applications that add value to the personalised treatment of patients: advanced preoperative planning, surgeries with specific tools for each patient, customised orthotic treatments, personalised implants or prostheses and innovative development in the field of bone and cartilage tissue engineering.
This paper provides an update on the role that the orthopaedic surgeon and traumatologist plays as a user and prescriber of this technology and a review of the stages required for the correct integration of I3D into the hospital care flow, from the necessary resources to the current legal recommendations.
La impresión 3D (I3D) agrupa una serie de tecnologías de fabricación que, aplicadas al sector médico, aportan numerosas ventajas y supone un cambio de paradigma en salud. Si bien la I3D no es una tecnología nueva (data de 1983), sí se ha popularizado en los últimos 10 años. Esto es debido, por un lado, a la liberación de patentes de las principales tecnologías de fabricación: estereolitografía (SLA) y modelado por deposición fundida (FDM) y, por otro, a la llegada de nuevos materiales y técnicas de I3D. Otros sectores en los que la I3D es una tecnología en auge y se utiliza en numerosas aplicaciones son el industrial, aeronáutico, en la automoción o en la arquitectura.
La I3D es un tipo de manufactura aditiva que permite transformar un modelo digital en un objeto tridimensional real y tangible. Los modelos tridimensionales se obtienen mediante procesado de los estudios radiológicos digitales de los pacientes, técnicas de escaneado tridimensional externo, diseño asistido por computadora (CAD) o técnicas de ingeniería inversa. Una vez obtenido el modelo virtual, este se puede imprimir. Los objetos se construyen capa a capa, empleando diferentes tecnologías y materiales según la aplicación final a la que vaya destinado. Esta adición de material capa a capa es lo que diferencia la I3D de otras tecnologías clásicas de manufacturado como el mecanizado, la fundición, el moldeado o el conformado.
Gracias a que la I3D permite fabricar añadiendo sucesivamente el material del objeto, se crean estructuras complejas que no podrían ser obtenidas con otras tecnologías. Esta característica es precisamente la que, unida al concepto de medicina personalizada, ha supuesto el éxito de la I3D en medicina1. La posibilidad de obtener series cortas en un tiempo y con un coste menores a los de otras técnicas de fabricación industrial y evitar la generación de residuos son otras de las ventajas.
Por el contrario, existen varias desventajas de la tecnología como son: 1) la necesidad de utilizar material extra a modo de soporte para evitar la caída de determinadas capas, 2) la baja resistencia mecánica en tracción de la pieza en el sentido de las capas superpuestas (eje Z) y 3) el tiempo necesario para imprimir con determinadas tecnologías2.
Existen numerosas tecnologías de I3D y, por ello, en 2015, la Sociedad Americana para Pruebas y Materiales (ASTM por sus siglas en inglés) desarrolló la normativa del estándar internacional ISO/ASTM 52900-2015 que las clasifica en 7 procesos que han dado lugar a 11tecnologías diferentes3. Cada tecnología tiene sus ventajas, inconvenientes y potenciales aplicaciones, por lo que en medicina se van a utilizar diversas técnicas en función de la utilidad prevista4.
En todo caso, como cualquier tecnología de reciente introducción en el sector médico, es fundamental la cautela, ya que ni la normativa ni la regulación legal del uso médico de la I3D están totalmente desarrolladas y aún existen numerosos desafíos legales que obligan a continuar investigando y desarrollando normativa médica específica.
En este artículo se revisa el estado actual de la I3D en medicina, sus diferentes utilidades prácticas en la especialidad de cirugía ortopédica y traumatología (COT), el proceso de trabajo desde la adquisición de la imagen hasta la fabricación mediante I3D y, finalmente, los detalles más relevantes, técnicos y legales, para una exitosa implementación en un departamento de COT hospitalario.
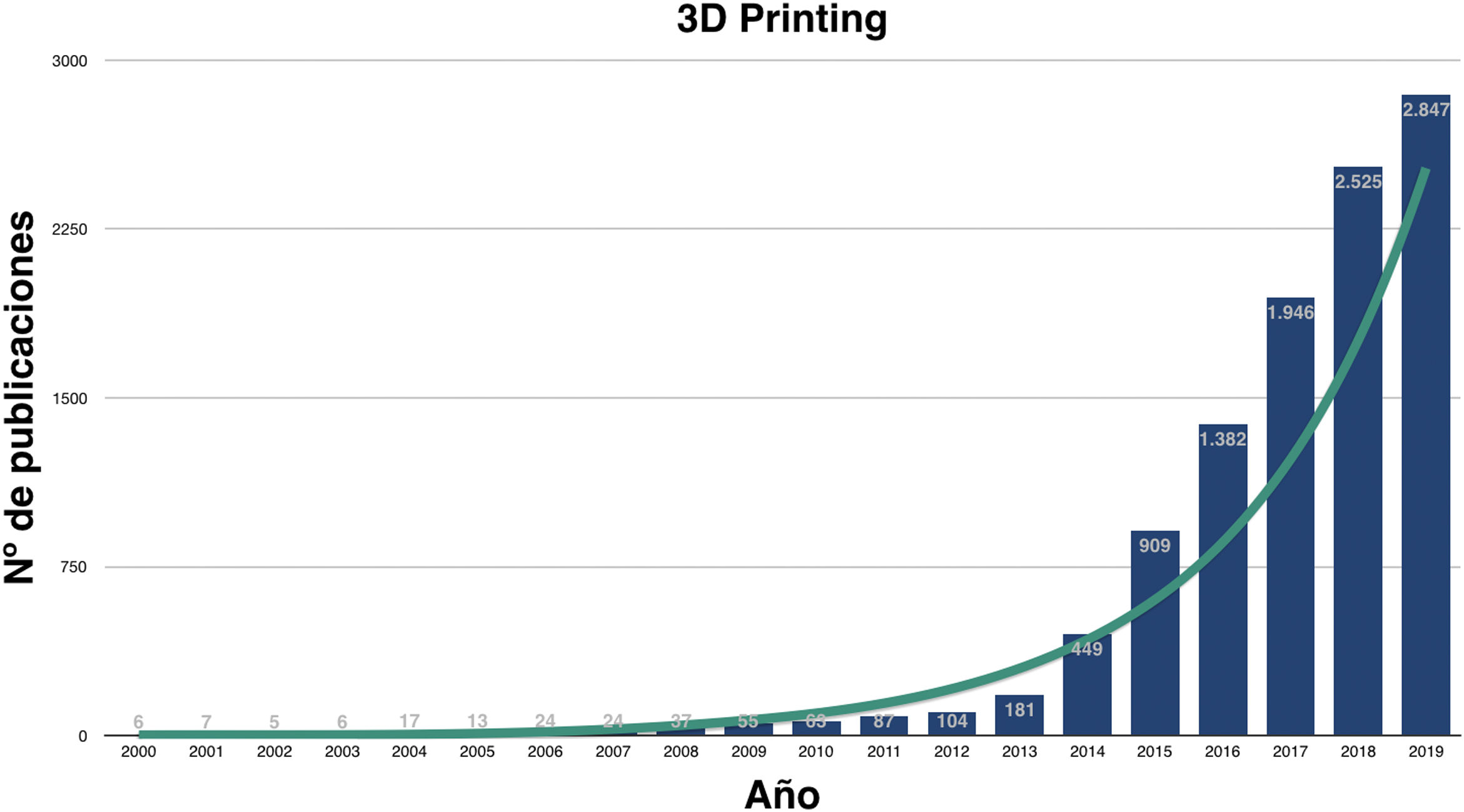
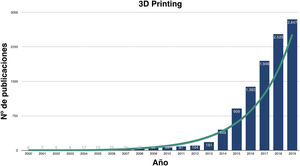
Impresión 3D en medicinaEn los últimos años ha crecido exponencialmente la investigación sobre las utilidades de la I3D médica (fig. 1) y, aunque son numerosas, podemos agruparlas en la fabricación: 1) de biomodelos o biorréplicas, 2) de herramientas a medida, 3) de implantes personalizados custom-made, 4) de fármacos y 5) de tejidos biocompatibles, también conocida como bioimpresión.
Las numerosas utilidades de la I3D se encuentran en la actualidad en diferentes estados de madurez. El hype cycle de tecnologías emergentes de la empresa global de consultoría Gartner es una representación gráfica de la madurez, adopción y aplicación comercial de tecnologías específicas. Se publica anualmente y establece las fases clave del ciclo de vida de una tecnología, que son 1) el lanzamiento, 2) el pico de expectativas sobredimensionadas, 3) el abismo de desilusión, 4) la rampa de consolidación y, por último, 5) la meseta de productividad5.
El análisis del estado de madurez de cada aplicación es necesario para utilizar de forma eficiente la I3D médica. A modo de ejemplo, el hype cycle de tecnologías emergentes de Gartner de 2018 destaca que las herramientas 3D (donde se engloban las guías quirúrgicas paciente-específicas) se encuentran en la rampa de consolidación mientras que los modelos anatómicos 3D están a punto de comenzarla. En cambio, los implantes personalizados y el tejido humano obtenido por bioimpresión están en pleno abismo de desilusión, por lo que aconsejan invertir en su investigación para establecer la utilidad real y comenzar su consolidación en el mercado.
El uso de esta tecnología en el sector médico presenta todavía algunas desventajas que es necesario conocer. En función de la utilidad, hay que tener en cuenta el tiempo adicional necesario para la fabricación, el sobrecoste que conlleva, la necesidad de personal técnico, las propiedades mecánicas o la precisión de algunas tecnologías2.
Biomodelos 3DLos biomodelos o biorréplicas 3D son reproducciones físicas de un órgano o región anatómica concreta del paciente. Por medio de la I3D se puede fabricar cualquier región anatómica visualizada en una prueba de imagen médica, a escala real, en diversos materiales, y con una exactitud milimétrica en función de la calidad de la imagen y la tecnología elegida. Si bien es posible obtener los datos de cualquier prueba de imagen convencional, las más usadas son la tomografía computarizada (TC), la resonancia magnética e incluso la ecografía6.
Gracias a los biomodelos 3D, es posible la planificación avanzada de determinados procedimientos médicos, como las intervenciones quirúrgicas7. Esto permite al cirujano tomar decisiones o simular la cirugía con anterioridad al acto quirúrgico, además, facilita la comunicación con los pacientes y la docencia entre profesionales8.
El uso de biomodelos 3D permite innovar y mejorar la educación médica. Además de la fabricación de modelos anatómicos de gran detalle y realismo, es posible fabricar, a un coste muy reducido, simuladores de técnicas médicas como intubaciones orotraqueales9, suturas10, endoscopias11, intervenciones endovasculares12 o quirúrgicas, entre otras13–15. Además, es una alternativa al uso de cadáveres para la enseñanza universitaria de asignaturas médicas, como anatomía16–18.
Herramientas a medidaUnas de las principales ventajas de la I3D es la creación de productos a medida y en pequeñas cantidades, lo que facilita la aplicación de la medicina personalizada, esto es, la adaptación del tratamiento a las características individuales de cada paciente.
Las guías paciente-específicas son unas de las herramientas fabricadas mediante I3D más utilizadas en la actualidad. Al adaptarse de forma exacta a la localización concreta del paciente, se puede aplicar a un determinado tratamiento médico o quirúrgico como una osteotomía, para colocar un implante, obtener injertos, administrar fármacos o utilizar dispositivos de radioterapia con control exacto de dosis19. Estas guías se fabrican con material biocompatible en el propio hospital, por lo que el proceso completo tiene una supervisión permanente del cirujano o médico prescriptor.
El instrumental quirúrgico fabricado mediante I3D se adapta no solo al tamaño del paciente, sino también al cirujano y a una técnica quirúrgica concreta20. La mayoría del instrumental quirúrgico que se utiliza hoy en día en las intervenciones ha permanecido inalterado desde hace muchos años, y posee unas características estructurales que no están adaptadas de manera óptima a los nuevos materiales y técnicas de fabricación. La I3D permite el prototipado rápido avanzado, reduce los tiempos de verificación y validación, mejorando la forma, peso y resistencia del instrumental médico, y lo dota de propiedades únicas, como la radiotransparencia21.
Implantes personalizadosLa I3D como técnica de fabricación de dispositivos médicos presenta numerosas ventajas respecto a otras técnicas de fabricación tradicionales. Permite la creación de implantes personalizados utilizando la imagen médica del propio paciente. Estos implantes se fabrican con geometrías externas e internas que seguramente no serían posibles con métodos tradicionales22.
Además, con la I3D es posible fabricar implantes personalizados a un coste significativamente menor que con otras técnicas tradicionales23. Las tecnologías de fabricación mediante sinterizado selectivo láser facilitan la creación de implantes metálicos de manera segura y muy costo-efectiva24. Esto ha supuesto la utilización de estos implantes personalizados en cada vez más hospitales y se ha ampliado su uso a más técnicas quirúrgicas25.
Los dispositivos médicos no implantables, como férulas o corsés, también se fabrican mediante I3D, lo que proporciona numerosas ventajas terapéuticas ya que, en función de la región anatómica, es posible fabricarlos con características y propiedades mejoradas respecto a los materiales y técnicas tradicionales.
FármacosPor medio de la I3D es posible fabricar fármacos personalizados, de elevada complejidad y con propiedades farmacéuticas optimizadas. Existen en la actualidad diversos fármacos comercializados aprobados por la Food and Drug Administration (FDA) y producidos mediante técnicas de fabricación aditiva farmacéutica26. La propia FDA destaca el gran potencial de la I3D para crear nuevas terapias y mejorar la adherencia, seguridad y eficacia de las existentes. Por ello, la I3D de fármacos es una utilidad que la industria farmacéutica seguirá desarrollando en los próximos años27,28.
BioimpresiónLa bioimpresión es la fabricación de tejidos biológicos mediante la impresión capa a capa de estructuras o scaffolds fabricados de un material biocompatible y recubierto de células vivas del propio paciente obtenidas mediante técnicas de ingeniería tisular29,30. El recubrimiento celular se hace a posteriori, con el uso de un biorreactor, o de forma simultánea a la fabricación del andamiaje, con el uso de tintas celulares31.
Las posibilidades de esta tecnología han abierto un amplio abanico de investigación con innumerables potenciales aplicaciones. La fabricación de tejidos humanos, utilizando células vivas del propio paciente y que puedan sustituir otros dañados, es una utilidad que se encuentra todavía en fases iniciales de investigación, pero con un rápido avance.
Impresión 3D en cirugía ortopédica y traumatologíaLa COT es, posiblemente, la especialidad médica que más puede beneficiarse de las ventajas de la I3D32,33. Casi todas las utilidades de la I3D son aplicables a los diversos aspectos de la especialidad, desde la planificación preoperatoria de intervenciones ortopédicas utilizando biomodelos 3D al desarrollo de instrumental, guías quirúrgicas paciente-específicas o implantes ortopédicos personalizados, entre otras34.
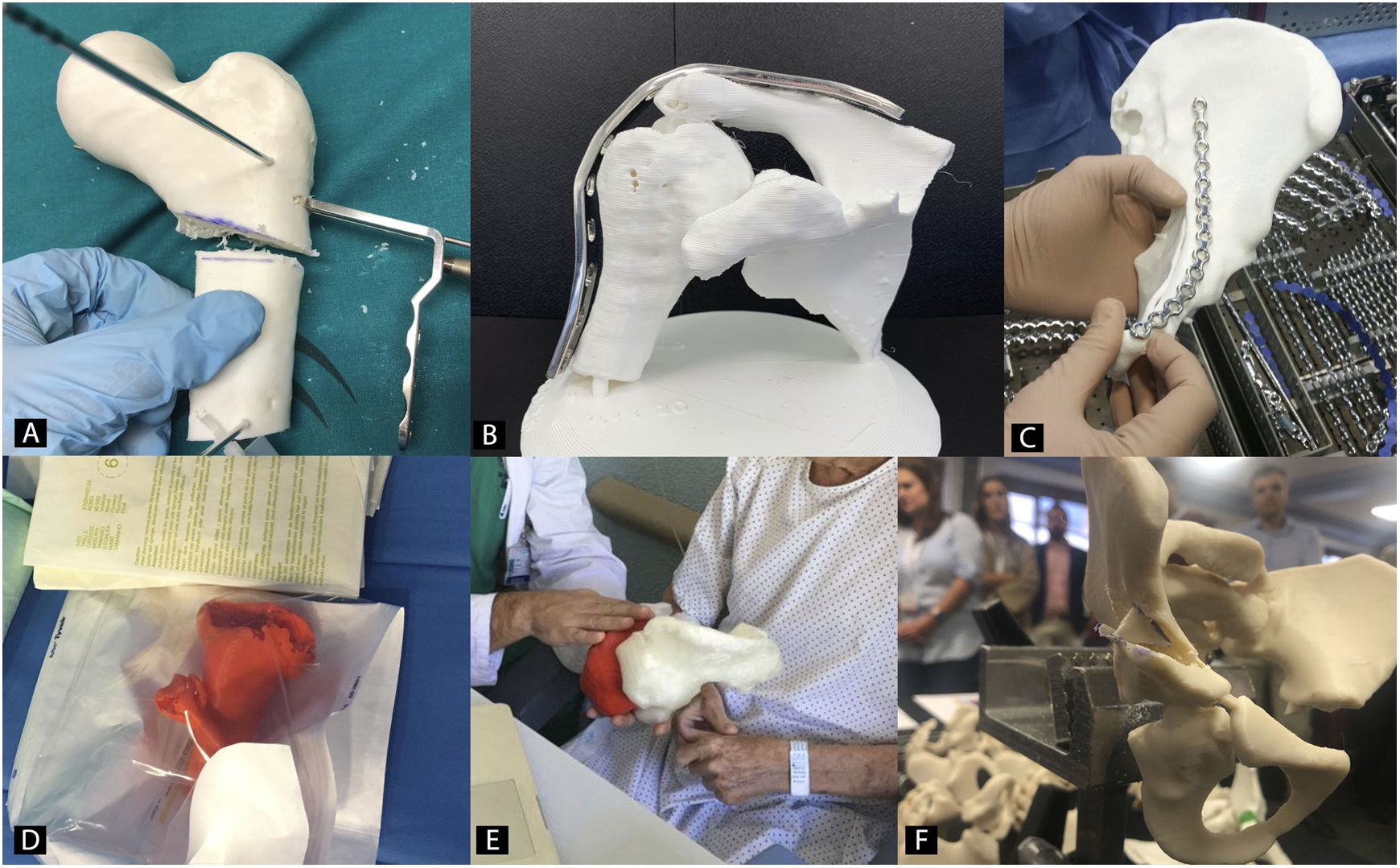
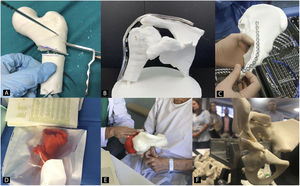
Planificación preoperatoria en cirugía ortopédica y traumatología con biomodelos 3DEl uso de biomodelos 3D para planificación preoperatoria en COT es una de las utilidades que más interés ha despertado en los últimos años, ya que todas las subespecialidades van a poder utilizarlo (fig. 2)35. El grupo de trabajo sobre I3D en Medicina de la Sociedad Americana de Radiología (3D Special Interest Group RSNA) ha revisado y clasificado los casos clínicos en los cuales es más eficiente utilizar biomodelos 3D en COT y ha llegado a la conclusión de que en fracturas simples, el papel de la I3D no es tan útil (1/10) como en fracturas complejas, displasias de cadera o en tumores óseos con afectación articular (8/10)36.
Recientemente se ha demostrado cómo el uso de biomodelos 3D disminuye el tiempo quirúrgico en determinadas intervenciones, con un ahorro de los costes de la intervención de más de 3.700 $37. También se ha demostrado que puede ser menor, tanto la dosis intraoperatoria de radiación utilizando biomodelos 3D como apoyo durante la cirugía38, como las complicaciones derivadas de la intervención quirúrgica39.
La comunicación con los pacientes es otra de las ventajas que se han estudiado y cuya mejoría gracias al uso de biomodelos 3D se ha cuantificado. Diferentes trabajos han establecido que los pacientes tienen una mejor comprensión de su lesión y la operación planeada cuando el cirujano les informa utilizando biomodelos 3D40,41.
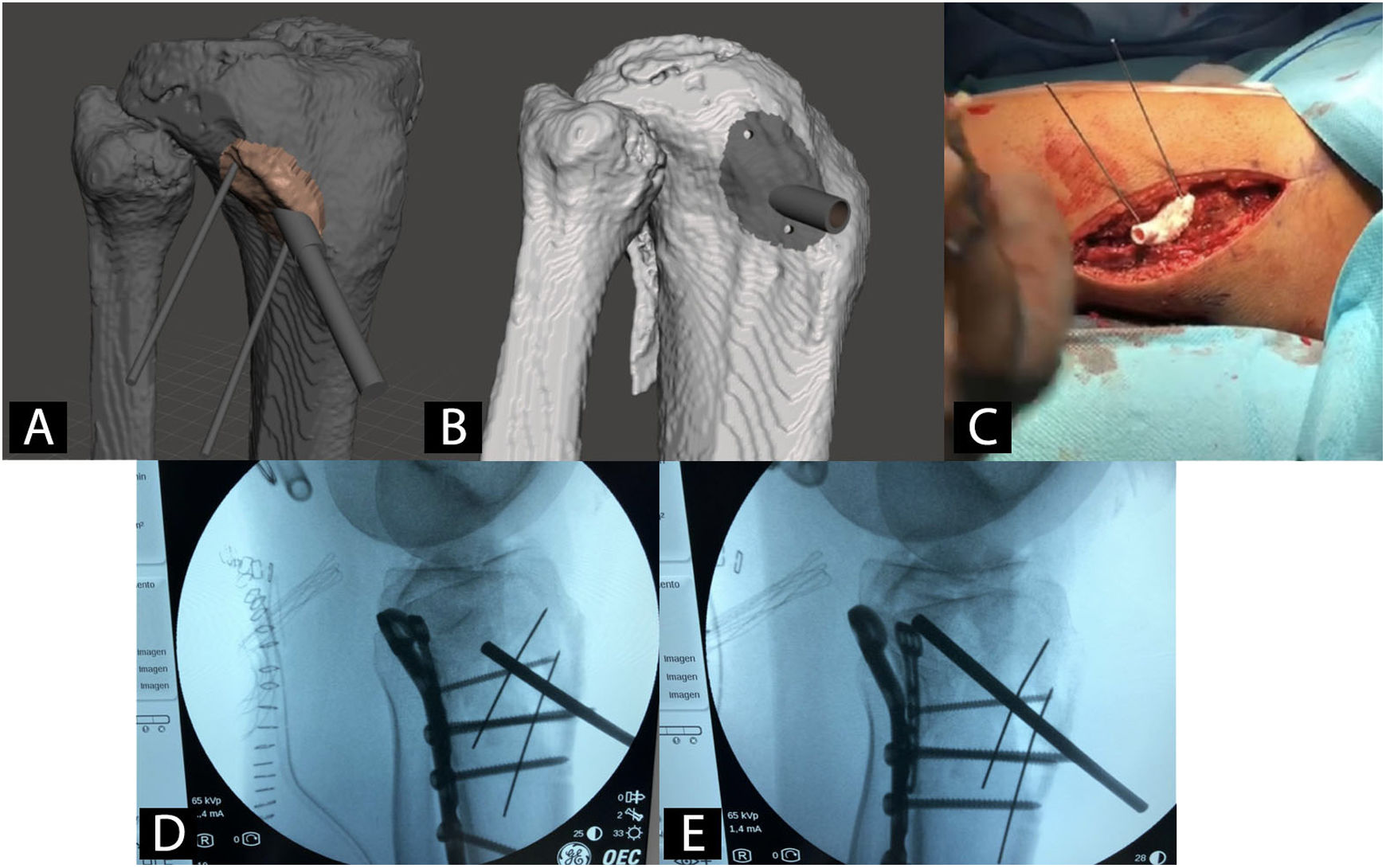
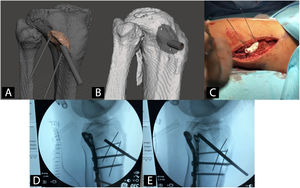
Guías quirúrgicas paciente-específicas en ortopedia y traumatologíaCon el uso de guías quirúrgicas paciente-específicas fabricadas mediante I3D es posible hacer, con una precisión mayor que mediante instrumental genérico, osteotomías de pelvis42, cadera43,44 o rodilla45, resección de tumores46, corrección de deformidades47, inserción de tornillos pediculares48, cirugía traumatológica percutánea49 o colocación de artroplastias50 (fig. 3).
Ejemplo de guía quirúrgica paciente-específica para la elevación de fragmento articular hundido en fractura de meseta tibial. A) Modelo CAD y planificación virtual de la guía. B) Modelo CAD de la guía quirúrgica. C) Intervención con guía quirúrgica paciente-específica. D) Radioescopia previa a elevación de fragmento articular. E) Radioescopia durante elevación de fragmento articular.
Numerosos trabajos destacan que gracias al uso de guías quirúrgicas paciente-específicas se reduce la radiación y el tiempo quirúrgico e incluso algunos estudios establecen un ahorro de los costes globales de la intervención en 3.500 $37.
La fabricación de instrumental quirúrgico personalizado para intervenciones en COT facilita la hibridación con otras tecnologías como la navegación quirúrgica o la realidad aumentada51,52.
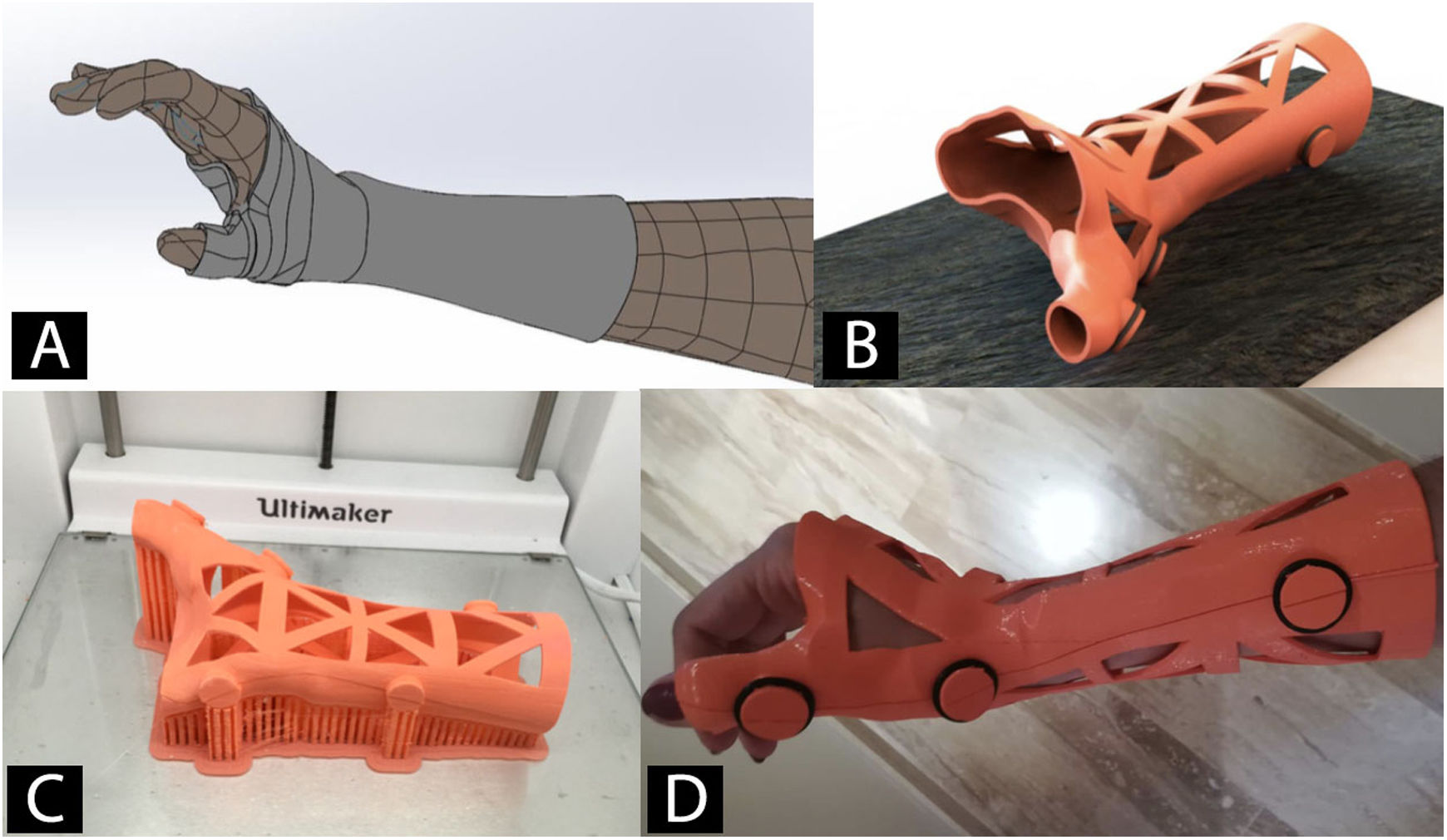
Órtesis y férulas fabricadas mediante impresión 3DCon la tecnología de escaneado 3D se fabrican órtesis y férulas utilizando la I3D (fig. 4)53. La principal ventaja es la mejoría en la adaptación a la anatomía del paciente54. Esto unido al uso de las diferentes tecnologías de I3D y a los nuevos materiales ha facilitado el diseño y validación de órtesis y férulas para tratamiento de enfermedades de miembro inferior55,56, miembro superior57,58 e incluso de deformidades de columna, como escoliosis59.
Las órtesis fabricadas mediante tecnología 3D son una alternativa válida a las tradicionales fabricadas mediante conformación de materiales termoplásticos. Aunque su uso no está todavía muy generalizado, aporta numerosas ventajas, como una reducción en los tiempos de fabricación, a menor coste y con una mayor satisfacción de los pacientes56. Trabajos recientes han validado su comportamiento biomecánico y han establecido que son comparables a las órtesis tradicionales60.
Implantes personalizados en cirugía ortopédica y traumatologíaLos implantes personalizados fabricados mediante I3D permiten la reconstrucción de defectos óseos tras intervenciones de resección tumoral61–66 o cirugías complejas de revisión protésica (especialmente cuando no es posible utilizar implantes modulares)67,68. La fijación y estabilidad de los implantes personalizados es excelente, por lo que los resultados clínicos, todavía a corto plazo, son muy favorables69.
Pese a las numerosas ventajas de los implantes personalizados, la mayoría de los trabajos publicados hacen referencia a casos clínicos aislados o series de casos, sin la posibilidad de un análisis comparativo con los implantes tradicionales70.
La mayoría de las empresas del sector médico utilizan tecnología de sinterización directa por láser de metal (DMLS) para la fabricación de implantes ortopédicos personalizados. Esto unido a que su diseño conlleva un proceso más complejo que el de los biomodelos 3D y guías quirúrgicas, hace que esta utilidad no esté muy extendida todavía en el ámbito hospitalario y que sea fundamental la participación de la industria médica.
Impresión 3D e ingeniería tisular en cartílago y huesoLa bioimpresión en COT ha supuesto una revolución en el campo de la ingeniería tisular cartilaginosa y ósea71. Respecto al cartílago, se ha hecho in vivo la bioimpresión de células madre mesenquimales en varias capas junto a una matriz extracelular formada por un hidrogel de atelocolágeno y ácido hialurónico. La posterior diferenciación celular a condrocitos maduros permite la creación de autoinjertos cartilaginosos personalizados para la reconstrucción de defectos condrales72.
Respecto a la fabricación aditiva de tejido óseo, gracias a la bioimpresión se han desarrollado prototipos funcionales de tejido óseo con relevancia clínica, mecánicamente resistentes y con una médula ósea funcional73. En el ámbito experimental, se han empleado con éxito hidrogeles de polímeros sintéticos para la creación de una matriz extracelular a la que añadir las células madre mesenquimales. Estas se diferencian a tejido óseo maduro cuando son estimuladas por cerámicas, como la hidroxiapatita o cristales bioactivos71. El principal desafío actual es la vascularización de los tejidos óseos bioimpresos74.
La unión e integración de las pruebas de imagen junto con la bioimpresión de tejidos cartilaginosos y óseos hará que en un futuro sea posible la bioimpresión de autoinjertos paciente-específicos para el tratamiento de defectos condrales y óseos. Gracias a estos autoinjertos bioimpresos, se evitarán tanto los problemas de los autoinjertos (disponibilidad y morbilidad) como los de los aloinjertos (compatibilidad y capacidad osteogénica)75.
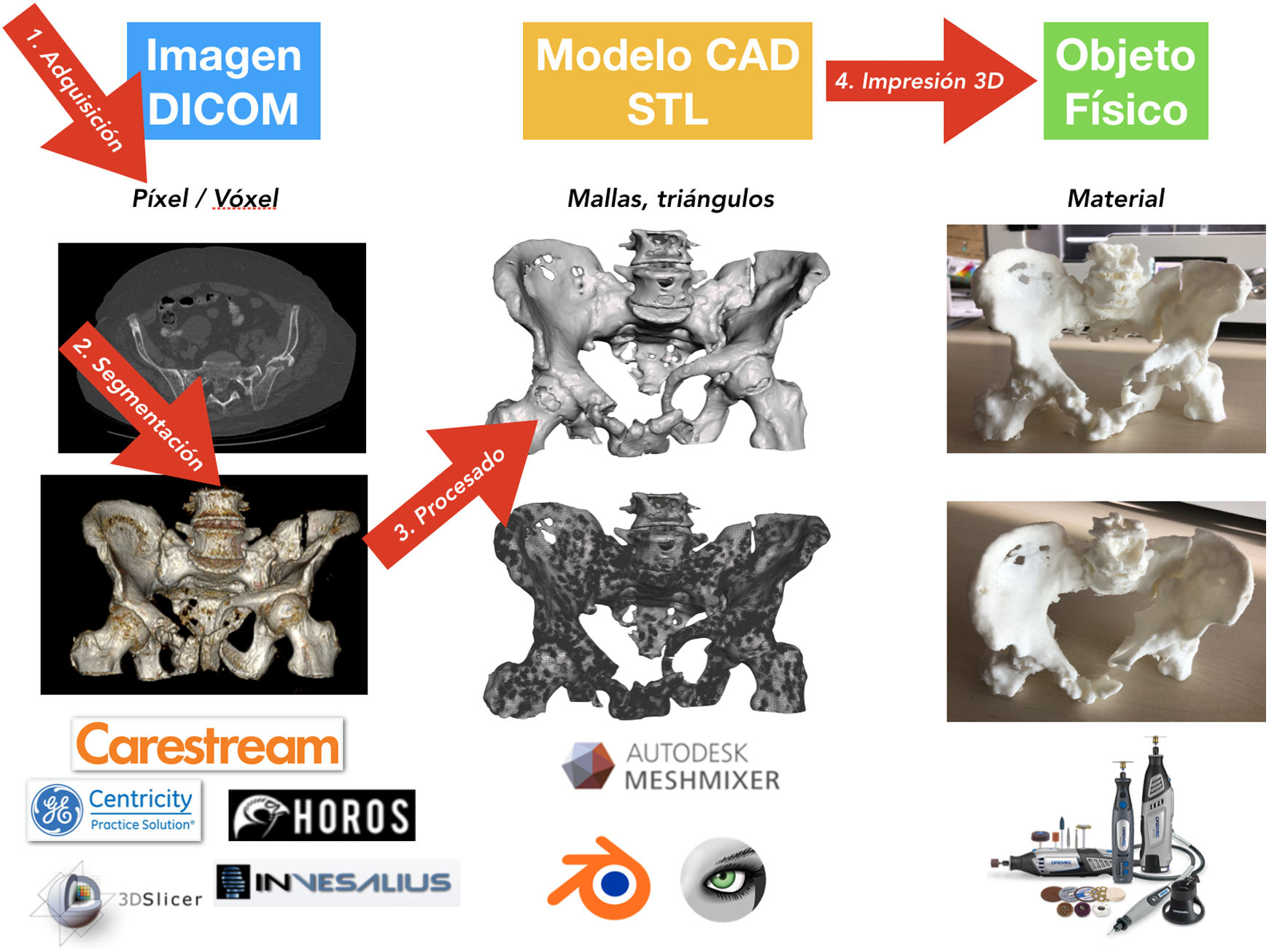
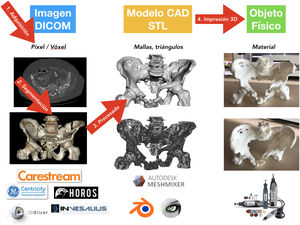
Proceso de impresión 3D médicaHay 4fases bien diferencidas en el proceso de I3D médica: 1) adquisición, 2) segmentación, 3) procesado y 4) fabricación por I3D (fig. 5)76.
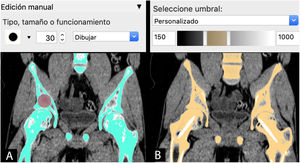
AdquisiciónEl proceso de la I3D médica comienza antes del tratamiento de la imagen médica. Es fundamental una correcta adquisición y optimización de los estudios de imagen para la creación del objeto CAD que luego va a imprimirse. Es posible utilizar los estudios de TC o resonancia magnética de la práctica clínica habitual, pero hay que tener en cuenta que quizá no se hayan realizado con protocolos optimizados para la segmentación ósea (fig. 6).
El mejor estudio para la I3D de estructuras óseas es una TC77. Existen determinadas características técnicas modificables en el momento del estudio que facilitarán la segmentación de fracturas o deformidades ortopédicas: 1) cortes: espesor de 1mm (o incluso menos) con incrementos de 0,625-0,75mm (menores a 1mm); 2) filtro Kernel: partes blandas o moderado y 3) colimación: 1,25-1,50mm78.
Si la región anatómica presenta elementos metálicos, son necesarios los protocolos de reducción de artefactos metálicos. Los nuevos tomógrafos de energía dual facilitan, a igual dosis, la reducción de los brillos que se producen alrededor del hueso y que impiden la correcta segmentación de las estructuras anatómicas79.
La imagen médica se almacena en formato DICOM (Digital Imaging and Communication On Medicine) para su posterior procesado.
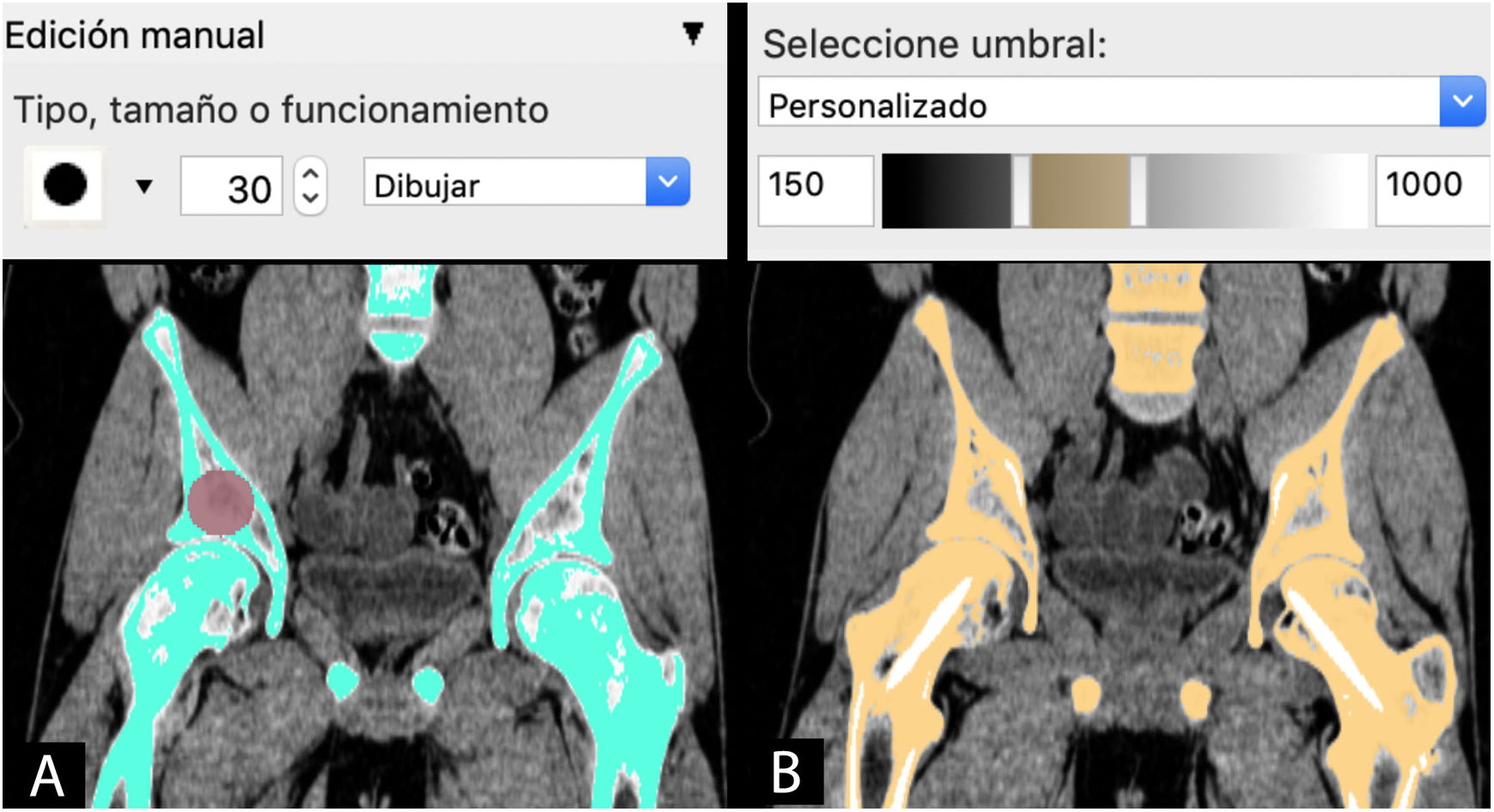
SegmentaciónLa siguiente etapa es el procesado de la imagen médica mediante la selección de aquellas regiones o zonas de la anatomía que van a reconstruirse en el modelo CAD, proceso conocido como segmentación.
Gracias al desarrollo de herramientas informáticas comerciales como Mimics (Materialise NV, Leuven, Bélgica) y de libre disposición como Horos (Horos Project, Annapolis, MD, EE. UU.). Invesalius (Centro de Tecnologia da Informação Renato Archer, Campinas, SP, Brasil) o 3D-Slicer (BWH, Cambridge, MA, EE. UU.), el proceso de segmentación se ha simplificado y, en determinadas situaciones, incluso se ha automatizado.
La segmentación puede hacerse mediante 3métodos:
- 1.
Manual: seleccionando o pintando píxel a píxel las regiones de interés (ROI) en cada capa del estudio de imagen.
- 2.
Automática: utilizando herramientas con algoritmos de selección de las regiones de interés de características similares para la segmentación automática en todas las capas del estudio.
- 3.
Semiautomática: combinación de herramientas manuales y automáticas. Una de las más utilizadas es la combinación de la herramienta automática de segmentación por umbral de intensidades de grises de la escala Hounsfield junto con la herramienta de edición manual. Esta escala abarca los diferentes grises (desde el blanco hasta el negro) que se encuentran en cada píxel de una imagen de TC y que van desde −1.000 unidades Hounsfield (UH), lo que equivale a densidad aire, a >1.000 UH, que representan la densidad metal.
El siguiente paso, una vez hecha la segmentación e independientemente del método seleccionado, es el renderizado para obtener un modelo 3D virtual. La visualización y análisis del modelo virtual son necesarios para ajustar aquellos detalles de la segmentación que hayan podido pasar desapercibidos, como zonas de poco contraste, artefactos o superficies internas que no precisen segmentación y que puedan comprometer, como se verá más adelante, el resultado de la I3D.
Tras la segmentación y renderizado del modelo virtual, se realiza la exportación del modelo a un fichero digital CAD. Este fichero está formado por una malla tridimensional de triángulos cuyo formato más extendido es el .STL (stereolithography), formato que, pese al ser el más utilizado y soportado por la mayoría de las aplicaciones informáticas, no aporta información sobre el color, texturas ni propiedades físicas, aunque sí lo hace sobre el tamaño o la situación espacial. Es posible que en los próximos años el formato evolucione y permita incluir más información, lo que dotará a los modelos de más características clínicas útiles.
ProcesadoEn función de cada caso y dependiendo de la utilidad prevista, el modelo CAD suele precisar un procesado posterior. El procesado puede abarcar desde un ligero suavizado de las irregularidades de la superficie hasta la creación de elementos añadidos, como guías quirúrgicas. En todo caso, es fundamental no variar la información clínica que proporciona el modelo.
Existen numerosas aplicaciones informáticas para el procesado de los modelos CAD; algunas de las más usadas para modelos médicos son aplicaciones de libre distribución como Meshmixer (Autodesk Inc, San Rafael, CA, EE. UU.) o MeshLab (ISTI-CNR, Pisa, TO, Italia).
Las 5 fases claves del procesado son:
- 1.
Corrección de la malla. Habitualmente la conversión del modelo virtual al fichero STL suele provocar la aparición de pequeños defectos (como agujeros o falta de triángulos en determinadas zonas de la malla) que requieren corrección. Para ello hay herramientas de corrección automáticas en la mayoría de las aplicaciones.
- 2.
Cerrar extremos del modelo. Es conveniente cerrar los extremos abiertos, como la cavidad medular, para facilitar la impresión.
- 3.
Optimizar estructuras internas. Si el interior del modelo no va a aportar información clínica es conveniente eliminar aquellas capas o regiones internas para mejorar la fase de impresión. Un modelo limpio sin estructuras internas se fabricará más rápido y con menor posibilidad de errores.
- 4.
Suavizar artefactos. La TC suele producir diversos artefactos que conviene suavizar, como los escalones entre capas, los brillos por artefactos metálicos o las irregularidades en la superficie.
- 5.
Modificaciones del modelo. En ocasiones, es necesario unir elementos que se encuentran separados (por ejemplo, las articulaciones), para ello, es posible crear conexiones para darle estabilidad al modelo. También es recomendable añadir etiquetas para clasificarlos, destacar determinados detalles anatómicos, dividir el modelo para mejorar la visualización e incluso añadir colores. En todo caso, es fundamental no hacer cambios significativos en la anatomía original.
La planificación digital 3D es un paso más en el proceso de planificación preoperatoria. Proporciona al cirujano una visión tridimensional de aquellas fases de la intervención fundamentales, ya que permite simular de forma virtual aquellos gestos que después van a efectuarse en la cirugía. Es de especial utilidad para la planificación preoperatoria de cirugía sobre deformidades, tumores o en localizaciones complejas, como la pelvis o determinadas articulaciones.
Una vez reconstruido y reparado el modelo CAD y de forma previa a su fase de fabricación, se planifica la intervención quirúrgica. Las diversas herramientas de las aplicaciones informáticas permiten rotar, cortar, medir o seleccionar y mover fragmentos, entre otras utilidades. Además, durante esta fase de planificación es posible el diseño de guías, instrumental o implantes, con la consecuente obtención de modelos CAD paciente-específicos.
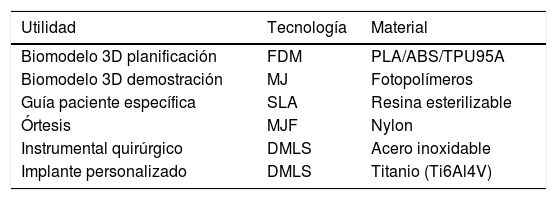
Fabricación por impresión 3DEl paso final en el proceso de la I3D es la fabricación. Para ello, en función de la utilidad prevista, es fundamental la selección de la tecnología de I3D adecuada, así como el material más apropiado (tabla 1).
Tecnologías y materiales más frecuentemente utilizados para impresión 3D en COT
| Utilidad | Tecnología | Material |
|---|---|---|
| Biomodelo 3D planificación | FDM | PLA/ABS/TPU95A |
| Biomodelo 3D demostración | MJ | Fotopolímeros |
| Guía paciente específica | SLA | Resina esterilizable |
| Órtesis | MJF | Nylon |
| Instrumental quirúrgico | DMLS | Acero inoxidable |
| Implante personalizado | DMLS | Titanio (Ti6Al4V) |
ABS: acrilonitrilo butadieno estireno; DMLS: sinterización directa por láser de metal; FDM: deposición de plástico fundido; MJ: material jetting o polyjet; MJF: multijet fusion; PLA: ácido poliláctico; SLA: estereolitografía; TPU95A: poliuretano termoplástico.
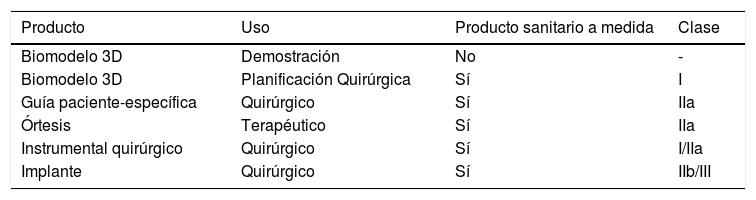
Independientemente de la tecnología utilizada, el proceso de fabricación será similar. El modelo CAD en formato STL se importará a un software de laminación que lo convertirá en órdenes que van a ser interpretadas por la impresora, que fabricará capa a capa el producto (tabla 2).
Clasificación de los productos sanitarios a medida en función de su uso y clase
| Producto | Uso | Producto sanitario a medida | Clase |
|---|---|---|---|
| Biomodelo 3D | Demostración | No | - |
| Biomodelo 3D | Planificación Quirúrgica | Sí | I |
| Guía paciente-específica | Quirúrgico | Sí | IIa |
| Órtesis | Terapéutico | Sí | IIa |
| Instrumental quirúrgico | Quirúrgico | Sí | I/IIa |
| Implante | Quirúrgico | Sí | IIb/III |
Instrumental quirúrgico: reutilizable (clase I), no reutilizable (clase IIa).
Implantes: material de ostesíntesis: IIb.
Prótesis articulares totales o parciales III.
Fuente: elaboración propia.
Los ajustes técnicos de impresión dependerán de la tecnología empleada: velocidad, resolución, rellenos o soportes son algunas de las características básicas que se deberán ajustar antes de comenzar la fabricación. Además, conviene simular el proceso mediante las diferentes aplicaciones de laminado con el fin de detectar posibles errores y determinar aquellas zonas que requieran soportes o aquellos elementos que puedan optimizarse (como rellenos) para disminuir el tiempo y la cantidad de material necesario.
Una vez fabricado, será necesario un posprocesado más o menos complejo en función de la tecnología, material y producto. Un biomodelo 3D simple fabricado mediante FDM solo precisará la retirada de los soportes, pero un implante o instrumental quirúrgico fabricado mediante DMLS podrá requerir de diversos tratamientos complejos para mejorar su acabado superficial y sus características mecánicas.
Implementación de la impresión 3D: unidades hospitalarias de impresión 3DCreación de un taller de fabricación digital hospitalarioExiste actualmente un interés creciente en la creación de talleres o laboratorios de fabricación digital en el propio hospital. La impresión 3D supone la aparición de nuevas formas de producción, como la fabricación en el punto de atención (POC: point of care), lo que permite a los hospitales la obtención de biomodelos, guías quirúrgicas paciente-específicas, implantes personalizados y otras aplicaciones impresas en 3D en el lugar de atención del paciente. Así, los hospitales más grandes con casuísticas de mayor complejidad pueden tener sus propias unidades hospitalarias de impresión 3D (UH-I3D), mientras que los centros más pequeños quizán funcionen en red con aquellos y con la industria contratada, según las necesidades80,81.
Numerosos centros hospitalarios por todo el mundo ya cuentan con UH-I3D, en las que la especialidad de COT es una de las que más se beneficia. Incluso algunos centros como el Hospital for Special Surgery de Nueva York disponen de un taller de fabricación de implantes personalizados en el propio hospital gracias a la colaboración con los fabricantes tradicionales de implantes ortopédicos (https://trends.directindustry.es/project-190325.html).
Los fabricantes tradicionales, que a menudo complementan los proyectos de POC en los hospitales, son entidades de gran valor cuando se integran en el flujo asistencial trabajando en estrecha colaboración con los profesionales de los centros hospitalarios. La creación de las UH-I3D, el fortalecimiento del trabajo colaborativo entre los diferentes actores implicados, los estudios clínicos adicionales y la orientación regulatoria ayudarán a fomentar la innovación y a garantizar que la fabricación en el hospital se convierta en el estándar de atención.
Elementos necesarios para comenzar una unidad hospitalaria de impresión 3DLa creación de una UH-I3D comienza con la determinación de las utilidades previstas y la coordinación de los servicios implicados. Hay una serie de recursos humanos, tecnológicos y materiales necesarios para comenzar con esta actividad:
Capital humano- •
Coordinador clínico de la unidad: médico con visión global del proceso, que implica la fabricación en el punto de atención, desde la adquisición del modelo virtual a partir de los estudios digitales o diseño computacional hasta la fabricación de biomodelos, guías, instrumental o implantes paciente-específicos.
- •
Médicos especialistas en radiodiagnóstico: expertos en la obtención y procesado de la imagen médica. En el proceso de impresión 3D adquiere especial relevancia su papel tanto en la validación del modelo digital previo a la fabricación como del biomodelo.
- •
Técnicos especialistas de radiodiagnóstico: facilitan la adquisición y segmentación de las pruebas de imagen. Al estar ya presentes en la mayoría de los hospitales, es un perfil que tener en cuenta para facilitar la creación de la UH-I3D.
- •
Bioingenieros: las aplicaciones de la I3D en áreas de conocimiento específicas, como la medicina, exigen la creación de nuevos modelos competenciales. Ingenieros con conocimientos anatómicos, formación en imagen médica, experiencia en diseño CAD y en tecnologías de fabricación aditiva, son perfiles que tener en cuenta en la dotación de una UH-I3D.
- •
Especialistas médicos: fundamentales en los casos en los que la utilidad sea la planificación quirúrgica y la necesidad de fabricación de guías, instrumental o implantes paciente-específicos, a los que la legislación identifica como médicos prescriptores responsables del diseño.
- •
Impresoras 3D. En fases iniciales, puede ser suficiente comenzar con una impresora 3D semiprofesional de tecnología FDM que imprima a tamaño adecuado (volumen de impresión aconsejable de 300×300×200mm), con doble cabezal y que tenga una fiabilidad y mantenimiento mínimo. La siguiente tecnología de entrada puede ser la impresión 3D mediante SLA, lo que va a permitir crear, para su posterior esterilización, guías quirúrgicas biocompatibles en el propio hospital, lo que facilitará la accesibilidad y disminuirá el tiempo y los costes de producción. Otras tecnologías como MJF o DMLS posiblemente necesiten instalaciones más complejas, así como técnicos especializados de fabricación, por lo que su uso no podrá generalizarse en la mayoría de los centros hospitalarios.
- •
Equipos informáticos. Es fundamental disponer de un equipo informático de potencia adecuada para procesar la imagen médica con fluidez. Este equipo debe estar conectado a la red informática y al PACS hospitalario para importar los estudios DICOM del paciente.
- •
Software. En función del presupuesto se optará por utilizar aplicaciones de libre distribución (Invesalius, Horos, Meshmixer, MeshLab) o comerciales (Mimics).
- •
Instalación. La ubicación de la UH-I3D es importante para que los profesionales se acerquen para las tareas de supervisión y comunicación con el personal encargado. Además, precisa estar ventilado y con puestos de trabajo para el personal.
- •
Materiales de fabricación. Los materiales necesarios para la impresora dependen de la tecnología elegida. Resulta de utilidad su gestión a través de la red de compras de material fungible del propio hospital.
- •
Herramientas de posprocesado. Es necesario disponer de herramientas básicas de trabajo como alicates, pinzas, limas y sierras con los que trabajar y procesar las piezas fabricadas. También resulta de interés dotar al taller de instrumental quirúrgico básico reutilizado con el que simular las técnicas, como atornilladores, tornillos o placas de osteosíntesis. Algunas tecnologías requieren herramientas avanzadas e incluso maquinaria especial de posprocesado.
La I3D es una herramienta al alcance de cualquier médico. El rápido crecimiento que esta tecnología ha experimentado ha permitido que nuevas utilidades hayan llegado a los servicios de salud. Aunque su uso se va regulando de forma progresiva, existen en la actualidad determinados aspectos que no están legislados por completo y suponen una barrera para la implementación definitiva en la práctica clínica habitual82,83.
Conviene revisar la normativa específica en función de la utilidad concreta del producto fabricado mediante I3D en un centro hospitalario, ya que este puede ser considerado un producto sanitario y, por lo tanto, precisará de una regulación específica.
La regulación de los productos sanitarios en el ámbito europeo requiere un elevado nivel de control sobre las fases del ciclo de producto con el fin de garantizar la seguridad del paciente y de los usuarios. Todos los aspectos relacionados con el diseño y desarrollo, producción, comercialización, distribución e instalación, entre otros, están regulados por el Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, de 5 de abril de 2017.
Producto sanitarioUn producto sanitario es aquel instrumento o dispositivo destinado a ser utilizado en las personas y que, sin ejercer su acción principal por mecanismos farmacológicos, inmunológicos ni metabólicos, se utiliza para:
- •
Diagnóstico, prevención, seguimiento, predicción, pronóstico, tratamiento o alivio de una enfermedad.
- •
Diagnóstico, seguimiento, tratamiento, alivio o compensación de una lesión o de una discapacidad.
- •
Investigación, sustitución o modificación de la anatomía o de un proceso o estado fisiológico o patológico.
- •
Obtención de información mediante el examen in vitro de muestras procedentes del cuerpo humano, incluyendo donaciones de órganos, sangre y tejidos.
Los productos sanitarios se clasifican en 4 clases en función de su finalidad y riesgos inherentes: clase i, clase iia, clase iib y clase iii; el de menor riesgo es el de la clase i y el máximo el de clase iii.
Producto sanitario a medidaEn lo que respecta a los productos fabricados destinados a un paciente específico, como un biomodelo 3D de apoyo a la planificación, una guía quirúrgica paciente-específica o un implante personalizado, hay que considerar el concepto de producto sanitario a medida.
Un producto sanitario a medida se define como todo producto fabricado especialmente según la prescripción médica de cualquier persona autorizada por la legislación nacional en virtud de su cualificación profesional, en la que constan, bajo la responsabilidad de dicha persona, las características específicas de diseño, y que está destinado a ser utilizado únicamente por un paciente determinado con el fin exclusivo de atender a su estado y necesidades particulares.
Hospital fabricanteEn lo referente a la fabricación aditiva intrahospitalaria, la normativa destaca que los centros sanitarios deben tener la posibilidad de fabricar, modificar y utilizar productos en régimen interno y atender así, a escala no industrial, las necesidades específicas de los grupos de pacientes destinatarios que no puedan satisfacerse con el mismo nivel de funcionamiento adecuado mediante otro producto equivalente disponible en el mercado.
Recomendaciones legales en una unidad hospitalaria de impresión 3DPara que el centro sanitario fabrique es fundamental que en la documentación se especifique que las necesidades específicas del grupo de pacientes al que se destinan los productos no pueden ser satisfechas, o que no pueden ser satisfechas con el nivel de funcionamiento adecuado, mediante otro producto equivalente comercializado.
El hospital fabricante de cualquier producto sanitario debe cumplir los siguientes requisitos:
- -
Elaborar una declaración en la que figure la siguiente información:
- ∘
Nombre y la dirección del fabricante y de todos los lugares de fabricación.
- ∘
Si procede, el nombre y la dirección del representante autorizado.
- ∘
Datos que permitan identificar el producto en cuestión.
- ∘
Declaración de que el producto se destina a ser utilizado exclusivamente por un paciente o usuario determinado, identificado por un nombre, un acrónimo o un código numérico.
- ∘
Nombre de la persona que haya extendido la prescripción y que está autorizada para hacerlo por la legislación nacional en virtud de su cualificación profesional y, si procede, el nombre del centro sanitario de que se trate.
- ∘
Características específicas del producto indicadas por la prescripción.
- ∘
Declaración de que el producto es conforme con los requisitos generales de seguridad y funcionamiento del anexo 1 y, si ha lugar, indicación de los requisitos generales de seguridad y funcionamiento que no cumple totalmente, con mención de los motivos.
- ∘
Si procede, indicación de que el producto contiene o lleva incorporada una sustancia medicinal, incluido un derivado de sangre o de plasma humano, o células o tejidos de origen humano o de origen animal contemplados en el Reglamento (UE) n.° 722/2012.
- ∘
- -
Tener a disposición de las autoridades nacionales competentes la documentación que indique el lugar o lugares de fabricación y permita adquirir una comprensión del diseño, la fabricación y el funcionamiento del producto, incluido el funcionamiento esperado.
- -
Adoptar las medidas necesarias para que el procedimiento de fabricación garantice la conformidad de los productos fabricados.
Por tanto, teniendo en cuenta la legislación vigente, para la fabricación aditiva intrahospitalaria es aconsejable contar con la siguiente documentación:
- ∘
Documentación técnica de cada producto sanitario.
- ∘
Licencia de fabricante de productos sanitarios.
- ∘
Sistema de calidad ISO 13485:2016.
La fabricación POC permitirá, en los casos en los que así se requiera, el trabajo en red con otros centros sanitarios o empresas fabricantes que estén en posesión de dicha documentación.
ConclusionesLa I3D médica en la especialidad de COT es una tecnología innovadora, en auge y con numerosas aplicaciones prácticas. El uso de biomodelos 3D para planificación preoperatoria, las cirugías asistidas por guías quirúrgicas paciente-específicas, las férulas o implantes personalizados y la aplicación de técnicas de bioingenería son algunas de las utilidades que van a reducir los costes y tiempos quirúrgicos, y van a aumentar la seguridad de las intervenciones y la satisfacción de pacientes y médicos.
El desarrollo tecnológico actual permite la integración de todo el proceso de diseño, validación y fabricación de productos sanitarios en el propio centro hospitalario. Es necesario para ello establecer flujos de trabajo y aplicar la legislación vigente.
El conocimiento de esta tecnología y de sus utilidades por parte del cirujano, como especialista médico responsable de la prescripción y ejecución del tratamiento, es fundamental para una correcta implementación de la medicina personalizada.
Nivel de evidenciaNivel de evidencia IV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.