Las infecciones fúngicas invasivas han aumentado en las últimas décadas y las opciones terapéuticas para combatirlas son limitadas. Los agentes antifúngicos empleados son útiles y tienen óptima actividad in vitro, pero pierden eficacia debido al desarrollo de resistencias por parte de los hongos. El incremento de especies con resistencia primaria o secundaria a algunos fármacos antifúngicos ha generado la necesidad de desarrollar nuevas formulaciones o recurrir a alternativas como la combinación de fármacos. En este artículo se revisará el espectro de actividad de las principales familias de antifúngicos, polienos, azoles, equinocandinas, 5-fluorocitosina y nuevos fármacos antifúngicos, así como los mecanismos de resistencia descritos contra los mismos.
Invasive fungal infections have increased over the last decades and the therapeutic choices to treat them are limited. The antifungal agents currently available are useful and have optimal in vitro activity; however, their activity can be lowered due to the development of fungal resistance. The increase in primary or secondary resistance to some antifungal drugs has led to the search of alternatives such as the combination of drugs or the development of new antifungals. In this paper, the activity of the main families of antifungal drugs, polyenes, azoles, echinocandins, 5-fluorocytosine and other new antifungal drugs, are reviewed. The main resistance mechanisms developed by fungi are also described.
Las infecciones fúngicas invasivas suponen un reto en el ámbito sanitario. En España, se calcula que cada año hay más de ocho millones de casos de infección fúngica. De estos, más de 10.000 episodios serían infecciones fúngicas invasivas33. En el ámbito mundial se estima que las infecciones fúngicas invasivas están asociadas a 1,5 millones de muertes cada año30 y están relacionadas con pacientes que tienen alterado su sistema inmunitario por tratamientos con quimioterapia, uso de corticoides, recepción de un trasplante o infección por el virus de la inmunodeficiencia humana (VIH). La mayoría de las micosis invasivas están causadas por hongos de los géneros Candida y Aspergillus. Sin embargo, debido a la ubicuidad y al oportunismo de los múltiples géneros y especies, pueden producir patología en el ser humano los mucorales, Fusarium, Scedosporium, Cutaneotrichosporon y Apiotrichum (miembros del antiguo género Trichosporon), además de otros géneros menos frecuentes cuya sensibilidad a los fármacos antifúngicos es heterogénea.
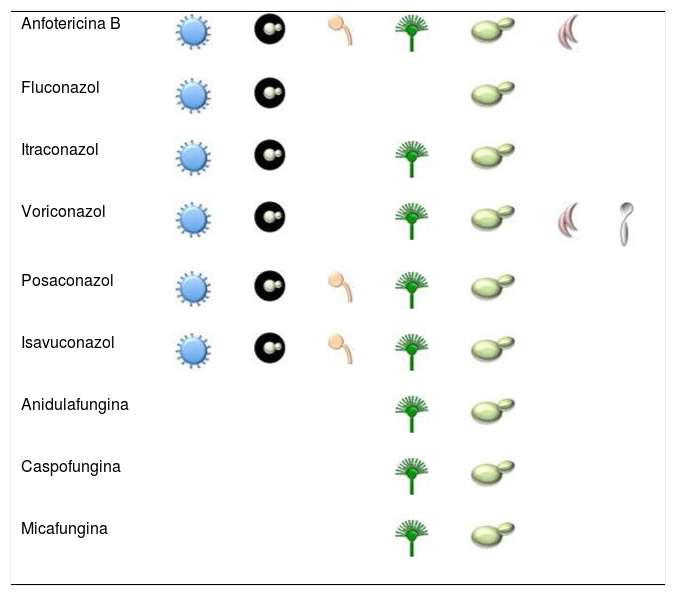
El arsenal terapéutico contra estas micosis es bastante limitado, fundamentalmente por el restringido número de alternativas terapéuticas disponibles. Solo existen cuatro familias de fármacos antifúngicos utilizados en el tratamiento de las infecciones sistémicas que pueden ser administrados por vía oral o intravenosa: polienos, azoles, equinocandinas y los análogos de la pirimidina. La seguridad de estos medicamentos, su espectro de actividad y las resistencias que se han ido describiendo en los últimos años hacen necesario un esfuerzo para el desarrollo de nuevos fármacos con otros mecanismos de acción u otras dianas. La actividad de los antifúngicos contra los diferentes hongos se resume en la tabla 1. A continuación, se revisan los fármacos antifúngicos disponibles para el tratamiento de las micosis profundas e invasivas y se describen algunos de los nuevos medicamentos desarrollados.
Los polienos son macrólidos con cadenas insaturadas con baja biodisponibilidad por vía digestiva y con baja solubilidad en agua, debido a su estructura anfifílica. Su principal mecanismo de acción se ejerce mediante la unión a los esteroles de la membrana fúngica, fundamentalmente al ergosterol. Esta unión genera la formación de canales por los que la célula fúngica pierde contenido citoplasmático, lo que conlleva un daño oxidativo y la muerte celular. Recientemente, se ha descrito un nuevo mecanismo de acción mediante el cual la anfotericina B (AmB) actúa como una esponja que extrae el ergosterol de la membrana, lo que provoca la inestabilidad de esta32. Estos fármacos fungicidas presentan uno de los espectros de actividad más amplios en comparación con otras formulaciones antifúngicas y fueron los primeros en el uso clínico. Solo tres moléculas existentes se emplean en el tratamiento de las micosis: la nistatina, la natamicina y la AmB. En el caso de las micosis sistémicas solo se utiliza AmB. Esta presenta una amplia actividad contra un gran número de levaduras y hongos filamentosos, y son pocas las especies fúngicas que muestran resistencia intrínseca o desarrollan resistencia secundaria.
La AmB es muy activa contra los géneros Cryptococcus y Candida. En diferentes estudios multicéntricos se observan bajas tasas de resistencia a este fármaco25,37 y la mayoría de las especies relevantes tienen porcentajes de sensibilidad del 100%. Sin embargo, algunos autores han señalado que Nakaesomyces glabrata (antigua Candida glabrata)6, Candida lusitaniae, Pichia kudriavzevii (antigua Candida krusei) y Candida tropicalis pueden tener disminuida su sensibilidad a AmB. Algunos patógenos emergentes, como Candida auris, presentan tasas de resistencia entre el 10 y el 30%, y Candida haemulonii posee un alto grado de resistencia que apunta a que esta es de tipo intrínseco4,8,9. Además, otras levaduras menos frecuentes, como el antiguo género Trichosporon, tienen porcentajes de resistencia adquirida que llegan a alcanzar el 50%22.
La AmB es un fármaco antifúngico que presenta buena actividad contra los hongos dimorfos y filamentosos del género Aspergillus y mucorales. En el caso de Aspergillus, el European Committee on Antimicrobial Susceptibility Testing – Subcommittee on Antifungal Susceptibility Testing (EUCAST-AFST) ha desarrollado nuevos puntos de corte clínicos y epidemiológicos (ECOFF) para AmB. Estos valores se han reducido en Aspergillus fumigatus y Aspergillus niger de 2 mg/L a 1 mg/L. Al considerar los valores altos de concentración mínima inhibitoria (CMI) observados contra Aspergillus flavus, Aspergillus nidulans y Aspergillus terreus, EUCAST-AFST no recomienda la AmB para el tratamiento de las infecciones causadas por estas especies2. La actividad contra otros hongos filamentosos como Fusarium y Scedosporium es muy heterogénea y varía según la especie y la cepa. Scedosporium apiospermum y Lomentospora prolificans son especies intrínsecamente resistentes a la AmB. Por otra parte, existen estudios de sensibilidad in vitro contra Fusarium, en los que este fármaco antifúngico ha presentado la mejor actividad de aquellos evaluados con valores medios de CMI de 0,7 mg/L5.
A pesar de su uso generalizado durante tantos años, pocas especies muestran resistencia intrínseca y/o adquirida. La resistencia intrínseca o primaria se ha observado en algunos hongos como A. flavus, Aspergillus lentulus, Aspergillus ustus y A. terreus. Esta parece deberse a un incremento en la producción y actividad de sus enzimas catalasa y superóxido dismutasa, que reducen el daño oxidativo que genera la AmB en la célula41. El mecanismo de resistencia más comúnmente descrito es el atribuido a la alteración en la síntesis del ergosterol de la membrana fúngica, debido a varias mutaciones en los genes que codifican enzimas relacionados con su síntesis, denominados ERG. Este mecanismo se ha descrito en levaduras y es menos común en hongos filamentosos. En Candida albicans la resistencia se debe a la doble pérdida de los genes ERG3 y ERG11 (que codifican las enzimas esterol desaturasa C-5 y 14 α- desmetilasa, respectivamente)36. En otras especies de Candida, la resistencia es debida a mutaciones en ERG2 y ERG6, en el caso de C. haemulunii o C. auris las mutaciones se producen en múltiples genes como ERG2, ERG3, ERG6 y ERG11. Las mutaciones en ERG3 y ERG11 confieren, además, resistencia cruzada a los azoles, lo que da lugar a aislamientos multirresistentes3,38.
Análogos de pirimidinaLa 5-fluorocitosina es un análogo fluorado del nucleósido citosina que interfiere con la síntesis de ADN y ARN del hongo. Debido a sus efectos adversos y a altas tasas de desarrollo de resistencias, su actividad y su uso en la práctica clínica se ha ido limitando. Se recomienda especialmente asociada a AmB para el tratamiento de la criptococosis meníngea.
AzolesLos azoles son moléculas sintéticas con un anillo heterocíclico unido a una cadena alifática con un grupo fenilo. Según los átomos de nitrógeno que contiene el anillo azólico, existen dos familias: los imidazoles que poseen dos átomos de nitrógeno (clotrimazol, ketoconazol y miconazol) y los triazoles, con tres átomos (fluconazol, itraconazol, voriconazol, posaconazol e isavuconazol). Estos fármacos antifúngicos bloquean la síntesis del ergosterol al inhibir la enzima C14-α esterol desmetilasa. La inhibición de la vía de síntesis de ergosterol produce una acumulación de esteroles tóxicos que, junto a la reducción del ergosterol, rompen la integridad de la membrana celular e inhiben el crecimiento de la célula fúngica.
Los imidazoles tienen buena actividad contra levaduras, dermatofitos y hongos dimorfos endémicos. Presentan más toxicidad cuando son administrados por vía sistémica debido a su afinidad por algunas enzimas humanas, por lo que su uso queda restringido a la administración tópica en el tratamiento de la candidiasis vaginal o de la infección cutánea fúngica.
Los triazoles presentan más afinidad por las membranas de las células fúngicas y menos toxicidad. El fluconazol muestra muy buena actividad contra Cryptococcus neoformans, levaduras del género Candida y hongos patógenos primarios; sin embargo, es inactivo contra la mayor parte de hongos filamentosos. Hay que destacar que algunas levaduras como N. glabrata y Meyerozyma guilliermondii (antigua Candida guilliermondii) presentan valores de CMI elevados y que el fluconazol no tiene actividad contra P. kudriavzevii y C. auris3,4,9, lo que supone un problema terapéutico de primer orden.
El itraconazol fue el primer azol disponible con actividad no solo contra levaduras, sino también contra Aspergillus, especialmente A. fumigatus. Sin embargo, algunas levaduras del género Candida resistentes a fluconazol presentan resistencia cruzada a itraconazol29. El itraconazol tiene una actividad mínima contra Fusarium y los hongos mucorales, y se han descrito en los últimos años cepas de Aspergillus resistentes39. Este hecho, junto a su baja biodisponibilidad, ha limitado su uso a pesar de la aparición reciente de un formato en tabletas gástricas que han mejorado su absorción.
Tanto el voriconazol como el posaconazol tienen un espectro de acción ampliado respecto a los dos triazoles anteriores. No obstante, aquellas levaduras resistentes al fluconazol, como N. glabrata o P. kudriavzevii, presentan valores altos de CMI de estos fármacos antifúngicos34. Tanto uno como otro presentan actividad contra Aspergillus, incluidas aquellas especies resistentes a AmB, como A. terreus. Al igual que ha sucedido con AmB, EUCAST-AFST ha revisado recientemente los puntos de corte y ECOFF para los azoles y ha incluido una nueva categoría denominada área de incertidumbre técnica (ATU) que establece un intervalo de incertidumbre en el resultado del antifungigrama. Las CMI que están incluidas en ATU deben notificarse como de resistencia a voriconazol (ATU 2 mg/L para A. fumigatus y A. nidulans) y deben revisarse en el caso del posaconazol (ATU 0,25 mg/L para A. fumigatus y A. terreus)2.
Con hongos como Fusarium y Scedosporium, la actividad de los triazoles depende de cada aislamiento clínico. En el caso del voriconazol, los valores CMI para especies de Scedosporium son más bajos que los de otros triazoles19 y, además, tiene muy baja actividad contra los mucorales. En algunos estudios su utilización se ha relacionado con un incremento de casos de mucormicosis18. Por el contrario, el posaconazol presenta una mayor actividad contra los mucorales, con valores CMI bajos10.
El isavuconazol es el último triazol comercializado hasta la fecha. Es activo contra la mayoría de las especies de Candida, así como contra P. kudriavzevii y N. glabrata15, y Cryptococcus11. Sin embargo, su actividad es variable contra C. auris24. Muestra buena actividad contra los hongos filamentosos, según estudios con diferentes cepas de Aspergillus, con valores de CMI que estaban en torno a 1 mg/L11,15, similares a los observados para el voriconazol. En el caso de los mucorales, el isavuconazol es menos activo que el posaconazol28.
El aumento del uso de los azoles ha llevado a una mayor frecuencia de aislamiento de especies intrínsecamente resistentes, como las crípticas de Aspergillus (A. lentulus y A. ustus) y especies de Candida como C. auris. Por otra parte, se han descrito mecanismos de resistencia adquirida por diferentes mutaciones en los genes que codifican la enzima sobre la que actúan los azoles (ERG11 en levaduras y cyp51 en hongos filamentosos). Una de las mutaciones más conocidas es TR34/L98H, que confiere resistencia a más de un azol26. Otro mecanismo de resistencia que se ha descrito para las levaduras y, en menor medida, los hongos filamentosos, es el asociado con bombas de expulsión, basado en la sobreexpresión de genes que las regulan4.
EquinocandinasLas equinocandinas son una clase de lipopéptidos semisintéticos cuyo mecanismo de acción es la inhibición de la enzima 1,3-β-D-glucano sintasa, responsable de la síntesis de 1,3-β-D-glucano, polisacárido esencial de la pared celular de muchos hongos. Esta inhibición debilita la pared celular, provoca una inestabilidad osmótica en la célula y su posterior muerte. Estos fármacos antifúngicos son fungicidas contra Candida; sin embargo, actúan como fungistáticos contra hongos filamentosos al inhibir el crecimiento en la terminación de las hifas14. En la actualidad, existen tres equinocandinas aprobadas para uso clínico: la caspofungina, la micafungina y la anidulafungina.
Las tres equinocandinas tienen un patrón similar de actividad antifúngica y son activas contra Candida, N. glabrata y P. kudriavzevii. Contra Candida parapsilosis y M. guilliermondii tienen una menor actividad in vitro (los valores de CMI son más elevados), aunque esta circunstancia no contraindica su uso terapéutico4. El espectro de las equinocandinas no incluye a los hongos basidiomicetos como Cryptococcus, los hongos dimorfos endémicos, ni los mucorales debido a que su pared está compuesta por 1,6-β-D-glucano. Tampoco tienen actividad contra Fusarium o Scedosporium, por lo que no se recomienda su utilización en las infecciones por hongos de estos géneros13.
El desarrollo de resistencias se ha asociado con exposiciones a estos fármacos antifúngicos y se originan por mutaciones puntuales dentro de regiones conservadas de los genes FKS1 y FKS2, que codifican subunidades de la enzima glucano sintasa. En general, las tasas de resistencia de C. albicans y otras especies siguen siendo bajas (1 a 3%). Sin embargo, en algunos estudios se han observado porcentajes de resistencia más elevados en C. tropicalis, C. auris y N. glabrata, llegando al 15% en esta última especie e incluso describiéndose cepas multirresistentes con resistencia a azoles, candinas y, en algunos casos, a polienos4. Los aislamientos de C. parapsilosis, resistentes de manera intrínseca, tienen valores de CMI más altos debido a un polimorfismo en el gen FKS121. La resistencia adquirida a las equinocandinas en Aspergillus es rara al no estar generalizado el uso de estos fármacos antifúngicos para tratar las micosis causadas por este género. No obstante, el aumento de aislamientos de Aspergillus resistentes a los azoles ha hecho que las equinocandinas se utilicen más frecuentemente como terapia alternativa y ya se han descrito mutaciones en el gen FKS1 en A. fumigatus16.
Estudios in vitro de sinergiaLa respuesta al tratamiento antifúngico puede verse afectada por los mecanismos de resistencia ya mencionados. Por ello se han planteado nuevas estrategias entre las que se encuentra la combinación de distintos fármacos antifúngicos, que puede proporcionar una mejora potencial en la actividad de los fármacos y en los resultados clínicos.
En el momento actual las guías clínicas solo recomiendan la combinación de AmB y 5-fluorocitosina para el tratamiento de la meningitis por C. neoformans27. Sin embargo, diferentes publicaciones indican que puede existir sinergia in vitro entre azoles y equinocandinas, como voriconazol y anidulafungina, contra A. fumigatus7 o cepas resistentes de N. glabrata12. Se han descrito resultados similares en la asociación del posaconazol o el itraconazol con la anidulafungina. Algunos estudios han confirmado que el isavuconazol muestra sinergia in vitro con la micafungina contra A. flavus, A. terreus o Cunninghamella bertholletiae17, y con la anidulafungina contra los aislamientos de A. fumigatus sensibles o resistentes a azoles. La combinación de AmB con equinocandinas también ha mostrado sinergia, incluso contra cepas de S. apiospermum43. Sin embargo, se ha descrito indiferencia en la asociación, e incluso antagonismo, contra distintos tipos de hongos, con la combinación in vitro de AmB y azoles17.
Si bien existen múltiples trabajos con estudios in vitro que podrían avalar la combinación de fármacos antifúngicos, la heterogeneidad de los resultados y la falta de grandes ensayos clínicos con claros efectos beneficiosos impiden emitir recomendaciones sobre su uso.
Nuevos fármacos antifúngicosOtra estrategia para el tratamiento de especies resistentes se basa en el desarrollo de nuevos fármacos antifúngicos. Entre los mejor posicionados hasta el momento se encuentran aquellos que utilizan como diana la pared fúngica, como es el caso de la rezafungina, una nueva equinocandina con el mismo mecanismo de acción que estas. La rezafungina muestra in vitro una potencia mejorada, con valores de CMI más bajos contra diferentes especies de Aspergillus y una gran actividad contra C. auris35. Sin embargo, su mayor ventaja radica en su farmacocinética, con una vida media muy prolongada que permite su utilización en intervalos de dosificación semanales20. Esta característica hace que su indicación vaya especialmente dirigida a la profilaxis de las micosis por Candida, Aspergillus y Pneumocystis jirovecii en pacientes receptores de trasplante de médula ósea.
Otro fármaco en desarrollo es ibrexafungerp, que también actúa sobre la síntesis del 1,3-β-D-glucano de la pared celular a través de la inhibición de la glucano sintasa, aunque extiende su espectro a los hongos resistentes a las equinocandinas. Algunos estudios in vitro han descrito actividad fungistática contra Aspergillus, incluidas cepas resistentes a azoles23. Es un compuesto altamente biodisponible y puede administrarse de forma oral o intravenosa.
El fosmanogepix, por el contrario, inaugura una nueva familia de fármacos antifúngicos. Actúa sobre el crecimiento de la célula fúngica y presenta una mínima afinidad por las proteínas humanas. Inhibe la enzima Gwt1, responsable de la síntesis del glicosilfosfatidilinositol que sirve de anclaje de muchas manoproteínas a la pared celular. Estas manoproteínas tienen diversas funciones como la señalización, la adhesión celular, el metabolismo de la pared celular y la respuesta inmunitaria. Tiene actividad contra levaduras y hongos miceliares incluidos Aspergillus, Fusarium y hongos dematiáceos. Diversos estudios muestran que este nuevo fármaco antifúngico tiene una gran actividad contra aislamientos de Aspergillus resistentes a triazoles y polienos, exhibiendo valores de CMI inferiores a 0,006 mg/L. En comparación con los fármacos antifúngicos habituales de uso clínico, ha mostrado una mayor eficacia y tasa de supervivencia en modelos murinos con aspergilosis pulmonar. También tiene actividad contra levaduras del género Candida resistentes a azoles y equinocandinas, excepto P. kudriavzevii1,42.
Por último, olorofim es otra molécula con una nueva diana. Pertenece a la familia de las orotomidas, que inhiben la síntesis de dihidroorotato deshidrogenasa, enzima de la ruta de la síntesis de pirimidinas, cruciales para la síntesis de ADN y ARN. Aunque esta enzima está presente en mamíferos, este fármaco es mucho más potente contra las células fúngicas. Olorofim ha mostrado gran actividad in vitro contra Aspergillus, con valores de CMI de 0,002 a 0,063 mg/L, incluyendo A. fumigatus (resistentes y sensibles a azoles), A. terreus y A. nidulans. Un aspecto interesante es su actividad contra hongos filamentosos multirresistentes como L. prolificans, con valores de CMI de 0,032 a 0,5 mg/L. Sin embargo, es inactivo contra los mucorales y Candida. La Food and Drug Administration (FDA) de EE. UU. ha aprobado su uso para el tratamiento de la aspergilosis e infecciones por L. prolificans31,40.
ConclusiónExisten pocas familias de fármacos antifúngicos disponibles y cada vez se describen más mecanismos de resistencia entre los hongos, tanto primaria como adquirida. Sin embargo, están en desarrollo nuevos medicamentos que mejoran el espectro y la farmacocinética. Los fármacos antifúngicos con un espectro más amplio son la AmB y, probablemente, el isavuconazol.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesInmaculada Quiles-Melero ha recibido ayudas de Gilead y Pfizer para asistencia a congresos. Julio García-Rodríguez ha recibido ayudas de Gilead para asistencia a congresos y ha participado como ponente en diferentes webinars organizados por Gilead, MSD y Pfizer.