La obesidad es un problema grave que representa una alta carga para la salud de las personas y sus familias: genera una mayor discapacidad, pérdida de productividad, aumento de enfermedades y muerte prematura. Tradicionalmente, se ha considerado que la patogénesis de la obesidad es el resultado de un desbalance entre la ingesta y el gasto de energía que favorece el aumento de peso. Sin embargo, corresponde a una interacción más compleja entre factores genéticos, ambientales y conductuales.
Varios estudios se han centrado en los principios de la termodinámica aplicados a los sensores de energía del cuerpo humano, como activadores de la respuesta metabólica frente a períodos de ayuno y sobrealimentación, para determinar fenotipos metabólicos o individuos que son más susceptibles a variaciones en el peso corporal. La identificación de fenotipos metabólicos permitiría establecer estrategias preventivas o terapias personalizadas para controlar el exceso de peso, favorecer la recuperación de un peso saludable y evitar o controlar los problemas de salud asociados.
El objetivo de esta revisión es analizar las características del fenotipo metabólico ahorrador, y los mecanismos fisiológicos involucrados, que permitan proyectar futuras estrategias individualizadas para la prevención y/o tratamiento de pacientes con sobrepeso u obesidad.
Obesity is a serious problem that represents a sizeable burden on the health of individuals and their families: it generates greater disability, reduces productivity, increases disease and premature death. Traditionally, the pathogenesis of obesity has been thought to be the result of an imbalance between energy intake and expenditure that favors weight gain. However, it corresponds to a more complex interaction between genetic, environmental, and behavioral factors.
Several studies have focused on thermodynamic principles applied to energy sensors in humans that trigger different metabolic responses when exposed to periods of both fasting and overfeeding. Such studies help determine the metabolic phenotypes of individuals who are more susceptible to variations in body weight. The identification of metabolic phenotypes may aid in the development of preventive strategies, such as personalized therapies to control excess weight, favor the recovery of a healthy weight and avoid or control associated health problems.
The aim of this review is to analyze the characteristics of the thrifty metabolic phenotype, and the physiological mechanisms involved, that will allow the design of future individualized strategies for the prevention and/or treatment of patients with overweight or obesity.
La obesidad es definida por la Organización Mundial de la Salud (OMS) como una “acumulación anormal y excesiva de grasa que puede ser perjudicial para la salud”1. Chile, lidera la lista de países de la OCDE en la prevalencia de exceso de peso, con un 74,2% en mayores de 15 años, según la última Encuesta Nacional de Salud 2016-20172. El aumento en los depósitos de grasa se asocia a complicaciones metabólicas e inflamatorias, disfunción del tejido adiposo (TA) y liberación de citoquinas y adipoquinas3, como también con enfermedades por la carga excesiva de peso (osteoartritis), problemas psicológicos asociados al estigma de la enfermedad, mala calidad de vida, alta carga de enfermedades crónicas no transmisibles, discapacidad, baja productividad y muerte prematura4,5.
El principio del equilibrio o balance energético aplicado a humanos establece que la ingesta de alimentos (IA) y el gasto energético (GE) son los factores que determinan los cambios en el peso corporal. Es decir, que un estado de balance energético positivo se producirá cuando la ingesta de alimentos supere el gasto energético generando el aumento de peso y el desarrollo de obesidad. Sin embargo, varios estudios han mostrado que los cambios en el peso corporal responden a una interacción más compleja entre factores genéticos, ambientales y conductuales6,7. La alta variabilidad interindividual en los cambios del peso corporal está determinada, en parte, por la presencia de diferentes fenotipos metabólicos, los que determinarían mayor o menor susceptibilidad al aumento/pérdida de peso frente a condiciones de ayuno y sobrealimentación, como también, a la capacidad que presenten los sujetos de adaptarse a los cambios en la ingesta de un determinado sustrato energético.
Para establecer estrategias preventivas o terapias personalizadas para controlar el exceso de peso, es importante identificar a los individuos con mayor susceptibilidad al aumento de peso, para evitar en ellos, la ganancia de peso o favorecer la recuperación de un peso saludable y evitar o controlar los problemas de salud asociados.
El objetivo de esta revisión es analizar las características del fenotipo metabólico ahorrador, y los mecanismos fisiológicos involucrados, que permitan proyectar futuras estrategias individualizadas para la prevención y/o tratamiento de pacientes con sobrepeso u obesidad.
2MetodologíaEste manuscrito corresponde a una revisión bibliográfica narrativa. Se realizó una búsqueda bibliográfica de artículos publicados en Pubmed y Sciencedirect entre los años 2012-2022. Los conceptos claves utilizados fueron: obesity, thrifty phenotype, energy expenditure, respiratory quotient.
Los criterios de búsqueda consideraron: estudios observacionales, ensayos clínicos y revisiones (review) realizados en adultos y publicados en revistas categorizadas según el Journal Citation Reports (JCR) en el cuartil 1 y 2 (Q1-Q2). Adicionalmente, se incluyeron artículos publicados con anterioridad al año 2012 que aportaran al entendimiento de la regulación del metabolismo energético en humanos.
3DesarrolloLas factores que determinan la ingesta alimentaria y la homeostasis energética pueden ser definidos en base a dos escalas temporales: el marco evolutivo, responsable de la selección de rangos conductuales y metabólicos integrados en el genoma y, el marco temporal del curso de la vida, responsable del fenotipo8,9.
En contraste con la variabilidad genética que surge a largo plazo, el fenotipo representa una respuesta a la variabilidad ecológica en el corto plazo10.
Los diferentes fenotipos de personas con obesidad podrían estar influenciados por variantes genéticas, etnia, migración y el ambiente11,12. La obesidad es considerada principalmente un trastorno poligénico, con una heredabilidad del 40-80%, revelada por estudios en que se han encontrado variaciones en la grasa corporal, atribuido a diferencias genéticas entre individuos13–15. Aproximadamente un 5% se ha atribuido a un origen monogénico, por mutaciones en los genes LEP, MC4R y BDNF que generan un cuadro de obesidad severa y rara15. Los estudios GWAS (Genome Wide Association Studies) han logrado asociar directamente algunas variantes genéticas al aumento de peso16, índice de masa corporal (IMC)17 y circunferencia abdominal18,19. Se han asociado al menos 75 loci susceptibles para el desarrollo de obesidad en todo el genoma20, sin embargo, FTO (fat mass and obesity associated gene) parece tener un mayor efecto a partir de estudios realizados en diferentes etapas del ciclo vital y de etnia21–23. Adultos portadores de la variante rs9939609 del gen FTO, presentan alteraciones en la saciedad postprandial24 y mayor sensación de hambre25; en cambio, en niños y adolescentes se ha observado una mayor autoselección de alimentos de mayor densidad energética frente a una comida de prueba8,26.
La investigación desarrollada en las últimas décadas, ha mostrado que la variabilidad en los cambios en el peso corporal entre distintos individuos no puede ser explicada simplemente por diferencias entre la ingesta de energía y el gasto energético asociado a la actividad física, ya que los cambios de peso varían entre las personas a pesar de presentar rasgos familiares y una exposición ambiental similar. Algunas características metabólicas individuales pueden detectarse con la medición del gasto energético y del patrón de oxidación de sustratos energéticos (grasas versus carbohidratos), las que pueden objetivarse a través de la medición del consumo de oxígeno y de su relación con la producción de CO2 (cociente respiratorio), mediante calorimetría indirecta27. Esta medición del GE puede realizarse en 24 horas en una pieza calorimétrica, método reservado para fines de investigación, o bien efectuando una determinación de 15 a 30 minutos de duración en condiciones de reposo y ayuno de 12 horas, procedimiento utilizado en la práctica clínica. Con estas mediciones de GE se han identificado 2 fenotipos que se asocian a un mayor riesgo de ganancia de peso en estudios con seguimiento a largo plazo: bajo GE de reposo y baja tasa de oxidación de lípidos en ayuno y en 24 horas (o un elevado cociente respiratorio)28. En un estudio en población chilena con mediciones de calorimetría indirecta en reposo se observó que, entre las mujeres sanas con peso normal, un 47% presentaba un GE menor al 90% de valor estimado por ecuaciones de predicción y un 27% presentaba un cociente respiratorio mayor de 0,87 (oxidación de grasas en ayuno menor del 50%), reflejando una alta proporción de personas sanas con una mayor predisposición a ganar peso29.
4Influencia del gasto energético en la variación del peso corporal: fenotipos metabólicosEl equilibrio energético es un proceso dinámico, en que los cambios de uno de sus componentes (IA o GE) pueden provocar adaptaciones en el otro.
Los factores fisiológicos que determinan el GE son la masa libre de grasa, la masa grasa, la edad, el sexo, la etnia y la tolerancia a la glucosa30,31, los que explican más del 80% de la varianza interindividual del peso corporal31.
Según los principios de la homeostasis energética, un GE bajo en un entorno de ingesta energética normal puede conducir al aumento de peso6. Varios estudios se han centrado en los principios de la termodinámica aplicados a los sensores de energía del cuerpo humano, como activadores de la respuesta metabólica frente a períodos de ayuno, de restricción energética y de sobrealimentación para determinar que individuos son más susceptibles a variaciones en el peso corporal. Es así como intervenciones dietéticas de corta duración generan respuestas metabólicas que podrían revelar un determinado fenotipo metabólico32.
En 2001 se propuso la existencia de un fenotipo ahorrador (thrifty),
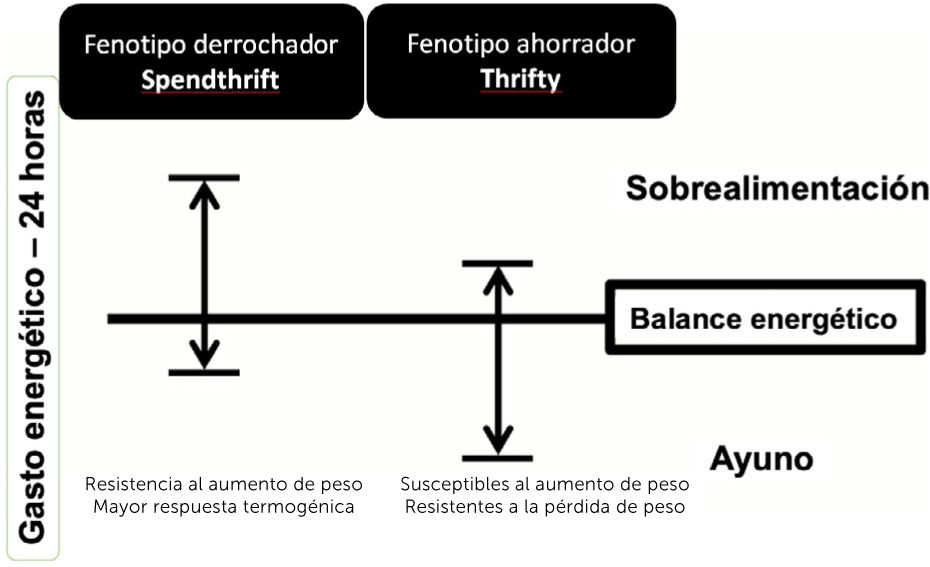
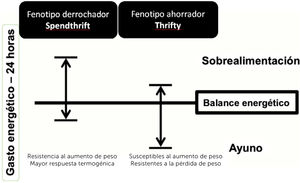
definido como aquellas personas que presentaban un menor aumento del GE frente a una sobrealimentación, a través de la medición del GE de 24 horas en un calorímetro de sala completa33. En cambio, los fenotipos derrochadores (spendthrift), fueron definidos como aquellos que aumentaban más el GE en la misma condición34. Se cree que los individuos con fenotipo derrochador son capaces de mantener períodos de exceso de ingesta de energía y resistir al aumento de peso activando una mayor respuesta termogénica, es decir, disipando el exceso de energía en forma de calor, en vez de almacenarla como grasa corporal (Fig. 1)34,35.
Características de los fenotipos metabólicos: derrochador (Spendthrift) y ahorrador (Thrifty). Adaptado de Hollstein, et al.34.
Los individuos con fenotipo ahorrador serían más resistentes a la pérdida de peso en condiciones de restricción calórica durante 8 semanas36, y más susceptibles al aumento de peso frente a una sobrealimentación baja en proteínas37, cuando se les evalúa en un seguimiento de 6 meses en condiciones de vida libre38. Además, tendrían mayores depósitos de grasa total y abdominal medidos por absorciometría dual de rayos X (DXA, por sus siglas en inglés)39. Sin embargo, los resultados siguen siendo contradictorios y pueden explicarse por la variabilidad en factores genéticos y ambientales, además de las diferencias en los tiempos de seguimiento entre los diferentes estudios publicados.
Una hipótesis es que el fenotipo ahorrador humano, en tiempos de la prehistoria, al favorecer un menor GE, permitió una mejor preservación de la masa corporal durante períodos de hambruna, favoreciendo la supervivencia. En el contexto actual de un ambiente obesogénico, con períodos sostenidos de abundancia de alimentos o disminución del GE relacionado con la actividad física, este fenotipo conduciría a una mayor acumulación de grasa corporal, mayor adiposidad y desregulación metabólica que estaría relacionada con el desarrollo de obesidad y enfermedades crónicas40.
Además del grado de adaptación metabólica al ayuno y a la sobrealimentación, se ha observado que otra característica que podría identificar al fenotipo metabólico ahorrador es la capacidad de regular la oxidación de sustratos energéticos (lípidos y carbohidratos) en respuesta a cambios agudos en la disponibilidad y demanda de los mismos, concepto conocido como flexibilidad metabólica41. Una menor capacidad de aumentar la oxidación de lípidos en respuesta a una sobreingesta de grasas se ha asociado a mayor ganancia de peso, y a mayor acumulación de grasa intramuscular y, como consecuencia, a resistencia a la insulina42.
El grado de inflexibilidad metabólica durante una dieta de sobrealimentación con alto contenido de grasas (60%) se asoció con el aumento de peso en condiciones de vida libre, luego de 1 año de seguimiento43. Otro estudio mostró que una menor tasa de oxidación nocturna de grasas luego de una sobrealimentación de 3 días, se asoció con un mayor aumento de peso a 5 años plazo44.
En síntesis, una característica de los individuos con fenotipo ahorrador podría ser esta inflexibilidad metabólica, ya que no serían capaces de aumentar el GE o la oxidación de las grasas en condiciones de sobrealimentación lo que conduciría a un mayor aumento de peso en condiciones de vida libre. Se cree que habría mecanismos biológicos y fisiológicos que estarían involucrados en estas diferencias metabólicas:
4.1Función del tejido adiposo (TA)El tejido adiposo blanco (TAB), es el tejido más abundante del cuerpo humano. En personas con obesidad comparadas con aquellas con estado nutricional normal, este tejido puede variar entre un 10-50% del peso corporal total.
Frente al aumento de peso, para aumentar la capacidad de almacenamiento de grasa, los adipocitos del TAB pueden crecer en tamaño (hipertrofia) o en número (hiperplasia)45. La hipertrofia de los adipocitos se ha asociado a la obesidad metabólicamente enferma, relacionada con el desarrollo de enfermedades crónicas, mientras que la hiperplasia se ha relacionado a la obesidad metabólicamente sana o de mayor sensibilidad a la insulina46.
Si bien, se pensaba que las diferencias estructurales del TAB podrían determinar las variaciones del peso corporal, no se han encontrado asociaciones47,48. Actualmente se cree que estas variaciones morfológicas responderían a patrones individuales, con posible determinación genética, que se manifiestan como consecuencia del aumento de peso, y que la posible causa de la variabilidad en la ganancia de peso estaría más relacionada con los cambios en la función de los adipocitos.
4.2Actividad del tejido adiposo marrón (TAM)El tejido adiposo marrón, se ha asociado a una mayor termogénesis debido a una mayor cantidad de mitocondrias, en comparación al TAB. Es un tejido que está presente en bajos volúmenes en humanos adultos (0-600g) y se ubica predominantemente en la zona cervical y supraclavicular. El volumen del TAM depende del sexo, etnia y tamaño corporal y se activa mediante la exposición al frío49.
Un mayor volumen del TAM se ha asociado a mayor gasto energético50, sin embargo, se discute si el aumento del GE atenúa por sí solo el aumento de peso o, si podría desencadenar respuestas de contrarregulación en la ingesta alimentaria para restablecer el equilibrio energético lo que podría impedir la pérdida de peso o incluso, favorecer el aumento de peso si los mecanismos son excesivamente compensatorios6.
4.3Actividad del sistema nervioso simpático (SNS)El SNS se divide en dos ramas: la central que libera norepinefrina (NE) y la simpato-adrenal que libera epinefrina (E). En humanos, la secreción de NE modula la termogénesis y la ingesta de alimentos51. En sujetos con peso normal, la actividad del SNS se asocia directamente con el GE en reposo, el efecto térmico de los alimentos y actividad física espontánea52, y con la tasa de oxidación de grasas en 24 horas53. Una menor actividad del SNS se ha asociado con una menor pérdida de peso en sujetos con obesidad sometidos a dieta hipocalórica54 y con mayor ganancia de peso a largo plazo en sujetos con peso normal55.
En individuos con obesidad, los estudios transversales han mostrado una asociación positiva entre la secreción de NE y adiposidad56,57, aunque otros, han mostrado una asociación inversa58. La sobreactividad del SNS en personas con obesidad sería una consecuencia de la sobrealimentación, de la expansión del tejido adiposo y de la resistencia a la insulina, efecto mediado principalmente por la hiperinsulinemia y el aumento en la producción de leptina. Sin embargo, la sobreactividad crónica del SNS puede inducir una disminución progresiva de la sensibilidad de los receptores β-adrenérgicos, generando una disminución progresiva de la termogénesis y favorecer así el aumento del peso corporal44.
4.4Secreción de hepatoquinasEl hígado es uno de los tejidos más metabólicamente activos. El FGF21 (fibroblast growth factor-21) es una hepatoquina que se ha relacionado con el GE. Estudios en humanos han mostrado que el FGF21 aumenta el GE y modula la preferencia por la comida59. Sus efectos sobre el GE estarían regulados por la activación de la proteína desacoplante de la fosforilación oxidativa mitocondrial UCP-1 en el TAB y TAM60, aunque la evidencia sigue siendo controversial.
Se ha observado que las concentraciones de FGF21 están elevadas en malnutrición por exceso61, en sobrealimentación a corto plazo con dietas ricas en fructosa62, y en sobrealimentación con dietas de bajo aporte de proteínas a corto y largo plazo63. Al respecto, un menor incremento en FGF21 en plasma después de 24 horas de sobrealimentación con una dieta baja en proteínas en humanos (200% del GE total), con un menor aumento en el GE, se ha asociado a una mayor ganancia de peso después de 6 meses en condiciones de vida libre, identificándose como otra posible característica del fenotipo ahorrador64.
4.5Secreción de ghrelinaLa ghrelina es una hormona secretada por el estómago, principalmente previo a las comidas y sus concentraciones disminuyen luego del consumo de alimentos.
Las concentraciones más elevadas de ghrelina se asocian a una menor tasa metabólica en reposo65 y a una menor termogénesis postprandial66.
Debido a que esta hormona tiene la particularidad de tener efectos en el metabolismo energético y, además, estimular la ingesta de alimentos, es importante estudiar en el futuro su rol en la susceptibilidad al aumento de peso en algunos individuos y si puede relacionarse con rasgos del fenotipo ahorrador.
Si bien, los estudios sobre el GE muestran grandes limitaciones debido a que su medición durante el equilibrio energético es difícil que se alcance en condiciones de vida libre producto de las fluctuaciones de la ingesta de alimentos que se producen diariamente, los investigadores han comenzado a estudiar el GE en el contexto de un desbalance energético, bajo la hipótesis de que los cambios adaptativos que se producen en el GE en un entorno de balance positivo o negativo pueden permitir identificar a los sujetos más propensos al aumento o pérdida de peso, respectivamente. Aun así, la fuerza de asociación entre el GE durante el equilibrio energético y el cambio de peso futuro es pequeña ya que solo explica menos del 5% de la varianza en el cambio de peso (R2<5%), lo que implicaría que la ingesta de alimentos podría ser un importante determinante en el balance energético diario, influyendo fuertemente en los cambios del peso corporal6.
En la Tabla 1 se resumen algunas de las características metabólicas que se han identificado en humanos como posibles componentes del fenotipo ahorrador67–73.
Factores metabólicos asociados a mayor riesgo de ganancia de peso en humanos: hallazgos de un fenotipo ahorrador
| Factor metabólico | Hallazgos en estudios en humanos |
|---|---|
| Bajo gasto energético de reposo | Menor tercil de GE de reposo ajustado por masa libre de grasa (MLG), masa grasa (MG), edad y sexo: 5 veces mayor riesgo de ganar más de 10kg en 4 años que tercil superior27; GE de reposo (ajustado por MLG): correlación negativa con cambio de peso y MG después de 10-12 años en adultos67. |
| Menor tasa de oxidación de lípidos o mayor cociente respiratorio (CR) | Indios Pima con peso normal en percentil 90 de CR: 2,5 veces mayor riesgo de ganar más de 5kg que aquellos en el percentil 10, después de 25 meses de seguimiento68; Hombres caucásicos normopeso: cuartil superior de CR de ayuno con riesgo 2,4 veces mayor de ganar más de 5kg a los 10 años35. |
| Menor actividad de sistema simpático | Excreción urinaria basal de norepinefrina (índice de actividad del SNS) se asoció de manera inversa con la ganancia de peso en indios Pima de sexo masculino69. |
| Baja flexibilidad metabólica | Menor oxidación nocturna de grasas y GE nocturno después de 3 días de sobrealimentación explican 41% del aumento de peso a 5 años70; Disminución en oxidación de lípidos de 24 horas, post sobrealimentación alta en grasas, se asocia a mayor aumento de peso al año de seguimiento en adultos sanos43. |
| Adaptación metabólica al ayuno | Mayor disminución en GE durante ayuno de 24h: mayor aumento de peso a los 6 meses de condiciones de vida libre38 o a las 6 semanas de dieta hipercalórica baja en proteínas37. |
| Lipólisis disminuida en adipocitos | Mayor lipólisis basal: menor aumento de peso a los 8 años de seguimiento71; Mujeres con baja lipólisis estimulada con isoprenalina: 7,4 veces mayor ganancia de peso a 13 años48. |
| Menor actividad del tejido adiposo marrón (TAM) | Menor actividad de TAM después de 2 horas de frío moderado (16°C) asociado a mayor incremento en masa grasa después de 6 meses72,73. |
| Respuesta de FGF21 (fibroblast growth factor) a la sobrealimentación | Bloqueo en incremento de FGF21 en plasma después de 24h de sobrealimentación (200% de GE total; baja en proteínas) se asocia a mayor aumento de peso a los 6 meses de seguimiento en condiciones de vida libre64. |
Algunos estudios han mostrado que un aumento del GE puede generar como respuesta compensatoria una mayor ingesta de alimentos, favoreciendo el aumento de peso. Esto implica que algunos factores endocrinos-metabólicos podrían generar una mayor demanda de energía en diferentes contextos de actividad física, frente a la exposición al frío, o por disminución de las horas de sueño.
Si bien, un aumento del GE por actividad física favorece la pérdida de peso74, el aumento del GE por la exposición al frío o por disminución en las horas de sueño podrían contribuir a una sobrecompensación de la IA, especialmente en individuos con fenotipo ahorrador.
La exposición al frío da lugar a una mayor tasa metabólica para satisfacer la demanda termogénica. Existe una relación inversa entre la temperatura ambiente y la ingesta de alimentos que se encuentra relacionada con los niveles de norepinefrina75. En el caso de la restricción del sueño, esta provocaría un leve aumento del GE de aproximadamente un 5%, sin embargo, este efecto se vería debilitado por la reducción de la actividad física espontánea y mayor sedentarismo76. Además, la disminución en las horas de sueño se asocia con la disminución de leptina y aumento de ghrelina plasmáticas, lo que favorecería una mayor ingesta de alimentos. Sin embargo, la relación de estas hormonas no explicaría en su totalidad este mecanismo ya que la mayor ingesta de alimentos se produciría a pesar del aumento de los niveles de leptina y de la disminución de ghrelina. Posiblemente esta relación podría explicarse por los efectos hedónicos de algunos alimentos y no como una respuesta hormonal77.
6Proyecciones para la investigación y la práctica clínicaLos hallazgos de las distintas investigaciones expuestas previamente nos permiten plantear la necesidad de evaluar la efectividad de protocolos individualizados de intervención nutricional y de ejercicio físico, considerando las características metabólicas evaluables en seres humanos, con técnicas disponibles en nuestro medio, tales como la medición de GE, en reposo o después del ejercicio incremental, la evaluación de la tasa de oxidación de grasas en ayuno, o la respuesta metabólica al ayuno o a la sobrealimentación, entre otras. Investigaciones que intentan explicar la alta variabilidad en la pérdida de peso corporal en respuesta a las intervenciones en estilos de vida han mostrado que la subestimación de la ingesta calórica, la sobreestimación del gasto energético por actividad física, y la baja adherencia a las sesiones de manejo conductual, consejería nutricional y de ejercicio supervisado, explican en gran parte la mala respuesta a los tratamientos para controlar el peso corporal78. Sin embargo, aún después de controlar por adherencia y otros factores que predicen la reducción de peso persiste una diferencia de hasta el doble en el peso reducido por los sujetos después de 6 semanas de intervención con una dieta hipocalórica79.
Con el objetivo de mejorar los resultados de las intervenciones nutricionales y de ejercicio en pacientes con obesidad más “resistentes” a la pérdida de peso se pueden plantear tratamientos individualizados para el control del exceso de peso. En relación con las intervenciones dietéticas, en pacientes con hipometabolismo, se debiera programar un plan de alimentación para aportar un déficit de energía personalizado, basado en el GE de reposo medido (ej. 10-20% bajo el GE medido), en vez de una dieta estándar o basada en el cálculo del GE diario teórico, y asociarla a ejercicio físico supervisado para evitar la posible adaptación metabólica que puede generarse en respuesta al déficit energético. En aquellos sujetos con baja tasa de oxidación de grasas evaluada con calorimetría indirecta después de 12 horas de ayuno, la manipulación del tiempo de ayuno nocturno aumentándolo a 14 o 16 horas (una modalidad de ayuno intermitente), podría generar un escenario más favorable para la movilización y utilización de grasas durante la noche y primeras horas de la mañana. Al respecto, los estudios de Begaye, et al.43 muestran que la máxima utilización de grasas se logra en promedio después de alrededor de 18 horas de ayuno, con una gran variabilidad interindividual. Además, de acuerdo con la disponibilidad para realizar calorimetría en ejercicio en centros especializados, se puede definir mejor el volumen, intensidad y tipo de ejercicio necesario tanto para incrementar el gasto energético como para mejorar la capacidad de oxidar grasas durante el ejercicio y en 24 horas. Finalmente, respecto de la inflexibilidad metabólica, se requieren más estudios para determinar si su detección es útil sólo para predecir ganancia de peso a mediano y largo plazo, o puede ser un factor metabólico modificable con las intervenciones en los estilos de vida.
7ConclusionesLa caracterización de individuos con mayor susceptibilidad o resistencia al aumento de peso ha permitido obtener hallazgos sobre el comportamiento de los diferentes fenotipos metabólicos. Si bien, los mecanismos fisiológicos que determinan las características de cada fenotipo no se han dilucidado del todo, nos han permitido generar nuevos enfoques de tratamiento que nos permitirán lograr resultados favorables en la reducción del sobrepeso y la obesidad.