Las Enfermedades Raras son un problema prioritario y creciente en salud pública. Su diagnóstico es un desafío y para su manejo es fundamental el diagnóstico de precisión.
La medicina de precisión, junto con apoyar al equipo médico y la familia en concluir con la denominada odisea diagnóstica, genera una serie de cuestionamientos en relación con la equidad al acceso a las nuevas metodologías diagnósticas y terapéuticas.
En el presente artículo se revisa la epidemiología de las Enfermedades Raras, la importancia del diagnóstico temprano y certero, los beneficios de la medicina de precisión y algunos de los dilemas éticos involucrados.
Rare Diseases are a priority and increasing problem for public health. Their diagnosis is a challenge and for their management precision diagnosis is fundamental.
Precision medicine helps the medical team and the family to end the “diagnostic odyssey”, but also generates many questions related with equity in the access of patients to new diagnostic and therapeutic methodologies.
In this article we reviewed the epidemiology of Rare Diseases, the importance of a precise early diagnosis, the benefits of precision medicine and some of the ethical dilemmas involved.
Las Enfermedades Raras son un problema prioritario y creciente en salud pública. Se estima que existen más de 7000 enfermedades raras diferentes, las que en forma combinada afectan a 6-8% de la población. Con estos números es posible considerar que afectan a más 400 millones de personas a nivel global1 y que en Chile afectarían a una población estimada de 1.300.000 personas2. Debido al gran número de afecciones diferentes involucradas y a la gran heterogeneidad de sus manifestaciones, incluyendo variabilidad intrafamiliar, es posible entender la gran dificultad que se enfrenta al tratar de establecer un diagnóstico definitivo.
Estas enfermedades representan afecciones graves y debilitantes para el 65% de los afectados. Sus manifestaciones comienzan tempranamente en la vida, estimándose que hasta en dos tercios de los pacientes los síntomas comienzan antes de los dos años de edad, aunque pueden hacerse evidentes a lo largo de toda la vida. Más de la mitad de los pacientes afectados presentan durante su vida deficiencia motora, sensorial o intelectual, con dolor crónico reconocible hasta en el 20% de los afectados. Muchas de ellas son afecciones graves estimándose que 30% de los afectados por enfermedades raras fallecen antes de los 5 años de vida3.
Más del 70% de las enfermedades raras son de origen genético, producto de mutaciones patogénicas, heredadas o de novo, y la gran mayoría no tiene tratamiento específico. Sin embargo, el diagnóstico de precisión, especialmente realizado en forma temprana, permite la intervención precoz y con frecuencia permite también modificar la evolución de la enfermedad4.
Otro elemento muy importante a considerar en estas enfermedades es que su baja prevalencia individual determina mayor desconocimiento por parte del equipo médico, lo que produce diagnósticos más tardíos y poco específicos. Esto se asocia a mayores costos lo que perjudica aún más la calidad de vida de los pacientes y sus familias, quienes habitualmente deben consultar varias opiniones de especialistas antes de llegar a un diagnóstico preciso. Estudios realizados en Estados Unidos reportan que pacientes con estas afecciones pueden visitar entre 6 y 13 médicos antes de lograr un diagnóstico definitivo y la demora en su diagnóstico frecuentemente es mayor a 5 años desde el inicio de los síntomas; esto es lo que se ha dado en denominar la “odisea diagnóstica” de los pacientes afectados por Enfermedades Raras5.
Por otra parte se reconoce que el diagnóstico de precisión y la identificación de una enfermedad rara es un desafío diario, que requiere del manejo de profesionales expertos y especializados los que habitualmente no se encuentran en los centros primarios de salud; es así que se ha determinado que el tiempo que se demore en obtener un diagnóstico certero es inversamente proporcional a la distancia que se encuentre el paciente de un centro terciario de salud6. Además, debido a la baja frecuencia individual de estas afecciones, su origen y características clínicas con frecuencia no se conocen, lo que implica aún mayores desafíos tanto para su diagnóstico como para su tratamiento7.
El diagnóstico, temprano y certero, es fundamental para el manejo adecuado, para la prevención de complicaciones y para el asesoramiento preconcepcional de las familias en riesgo. Para este diagnóstico temprano el aporte de la medicina de precisión ha sido fundamental.
La medicina personalizada se ha transformado en una realidad en los últimos años, el advenimiento de las tecnologías “omicas” y de “big data” han revolucionado definitivamente la medicina y han permitido generar el concepto de medicina de precisión. Estas nuevas tecnologías han permitido una mejor caracterización molecular de las enfermedades y una mejor comprensión de su complejidad. El enfoque de medicina personalizada se aplica con muy buenos resultados en diferentes áreas de salud como oncología, cardiología, nutrición y, por supuesto, en las enfermedades raras las que son consideradas un paradigma en esta área. A diferencia de la medicina basada en evidencia, la que por definición pretende que las decisiones en la práctica médica se basen en la información científica más confiable, combinado con la experiencia individual del profesional y con las preferencias del paciente, la medicina de precisión se basa en el conocimiento de la alteración molecular subyacente a cada patología, asumiendo además la respuesta individual de cada afectado, a todo lo cual deben adaptarse las alternativas terapéuticas8.
2DefinicionesEnfermedad Rara: existen múltiples definiciones, pero la más frecuentemente utilizada es la de la Unión Europea (UE) que define como enfermedad rara a aquella, de origen genético o adquirido, con peligro de muerte o invalidez crónica y cuya prevalencia en la población general sea inferior a 1 en 2.000 individuos. Se excluyen de esta definición enfermedades que son estadísticamente raras, pero que no producen compromiso vital ni son crónicas o debilitantes9.
Medicina de precisión: El Instituto Nacional de Salud (NIH) de Estados Unidos la define como una forma de acercamiento a la prevención, diagnóstico y tratamiento de las enfermedades que considera la variabilidad individual incluyendo la genética, el ambiente, la metabolómica, la proteómica y el estilo de vida10. La capacidad de recolectar, integrar y analizar grandes cantidades de datos relevantes es el core para desarrollar un “Ecosistema de Medicina de Precisión” en el cual los recursos, genéticos, bioquímicos y clínicos son compartidos entre los investigadores, los clínicos y los pacientes11,12.
3Medicina de precisión y enfermedades rarasLa reducción del costo de los estudios genéticos y los avances en el uso clínico de la secuenciación genómica, data science y en imágenes avanzadas están, convergiendo para entregar un entendimiento más preciso de la triada “persona-tiempo-lugar”. Esto es: quien está afectado (persona), cuando está ocurriendo la enfermedad (tiempo) y donde está ocurriendo la enfermedad (lugar), para con todo ello además del diagnóstico de precisión, avanzar desde la nebulosa diagnóstica hacia la medicina personalizada13.
Como se señaló, solo un número muy minoritario de las enfermedades raras cuenta con tratamiento específico14,sin embargo los avances en terapia génica usando vectores virales y especialmente aquellos relacionados con edición génica con la técnica de CRISP/Cas9 han abierto grandes expectativas para tratamientos futuros15,16.
De ahí la importancia del diagnóstico preciso y temprano.
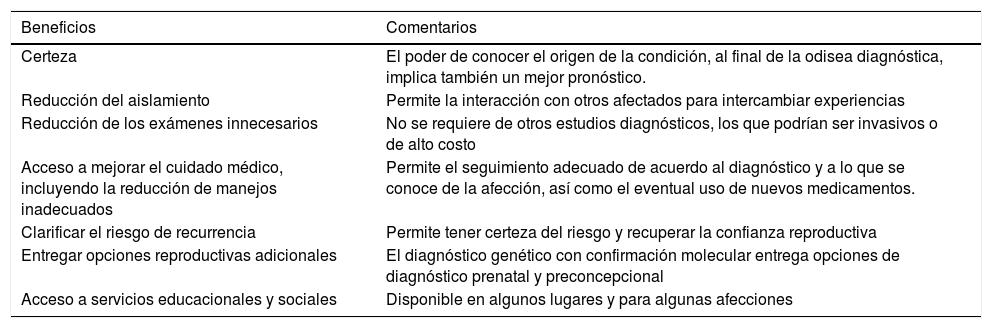
El contar con un diagnóstico adecuado no solo tiene importancia desde el punto de vista del manejo médico sino que también en una serie de otras áreas que no siempre se consideran y a la que algunos autores han denominado “el poder del diagnóstico”1.Un resumen de este “poder del diagnóstico” se muestra en la tabla 1.
El poder del diagnóstico
| Beneficios | Comentarios |
|---|---|
| Certeza | El poder de conocer el origen de la condición, al final de la odisea diagnóstica, implica también un mejor pronóstico. |
| Reducción del aislamiento | Permite la interacción con otros afectados para intercambiar experiencias |
| Reducción de los exámenes innecesarios | No se requiere de otros estudios diagnósticos, los que podrían ser invasivos o de alto costo |
| Acceso a mejorar el cuidado médico, incluyendo la reducción de manejos inadecuados | Permite el seguimiento adecuado de acuerdo al diagnóstico y a lo que se conoce de la afección, así como el eventual uso de nuevos medicamentos. |
| Clarificar el riesgo de recurrencia | Permite tener certeza del riesgo y recuperar la confianza reproductiva |
| Entregar opciones reproductivas adicionales | El diagnóstico genético con confirmación molecular entrega opciones de diagnóstico prenatal y preconcepcional |
| Acceso a servicios educacionales y sociales | Disponible en algunos lugares y para algunas afecciones |
*Adaptado de Baynam G, et al. Adv Exp Med Biol. 2017;1031:55-941.
Medicina de precisión y medicina personalizada no son sinónimos, sin embargo, se reconoce una gran interacción entre ambos conceptos. El diagnóstico de precisión es el que permite la medicina personalizada. La medicina personalizada o el diseño de intervenciones terapéuticas para un paciente único en su perfil genético, bioquímico, fisiológico y conductual solo ha sido posible gracias a las nuevas tecnologías biomédicas que incluyen las nuevas plataformas de secuenciación genómica además de los estudios con células troncales inducidas, descubrimiento y protocolos de uso de biomarcadores, nuevas tecnologías de obtención y manejo de imágenes, así como el desarrollo de dispositivos inalámbricos de monitoreo a distancia17. La investigación en enfermedades raras ha permitido avances pioneros en la medicina personalizada, contribuyendo en gran medida al entendimiento de la bioquímica humana, la biología celular y del desarrollo y obviamente de la fisiología19. A partir de dicha investigación se sientan las bases de la generación de las denominadas drogas huérfanas, utilizadas en el tratamiento de algunas enfermedades raras, hasta el desarrollo de nuevas alternativas de tratamiento para afecciones más frecuentes18,19.
La medicina de precisión ha permitido también grandes avances en el área de farmacogenómica. La variabilidad interindividual en el metabolismo de drogas y la toxicidad de las drogas continúa siendo un problema mayor para el desarrollo de medicamentos. La capacidad aumentada o disminuida de eliminación o de acción de un medicamento puede reducir su eficacia. El permitir elegir el medicamento, la dosis y el paciente adecuados para un determinado tratamiento es también un aporte fundamental de la medicina de precisión, ya que la identificación de diferentes variantes genéticaspermite muchas veces definir cuál es la alternativa terapéutica más indicada para un paciente en particular20.Esta área de farmacogenómica ha sido de especial importancia en el desarrollo de terapias personalizadas en pacientes con epilepsia y enfermedades metabólicas21.
El advenimiento de nuevas tecnologías, como la secuenciación rápida del exoma completo y la reducción progresiva de sus costos ha facilitado la medicina de precisión y finalmente ha permitido reducir el impacto económico en los servicios de salud y en las familias. Esto es especialmente evidente en los pacientes pediátricos pues se sabe que las enfermedades genéticas y las malformaciones congénitas son la principal causa de hospitalizaciones prolongadas y mortalidad en la edad pediátrica. El diagnóstico preciso y temprano permite en algunos casos modificar y mejorar el curso de la enfermedad y por otra parte, dado que las enfermedades genéticas pueden progresar rápidamente, un diagnóstico genético es crítico para reducir la morbilidad y la mortalidad especialmente en situaciones clínicas agudas, así como para adecuar los esfuerzos terapéuticos cuando se estime necesario22.
4Aspectos éticosEn la relación entre medicina de precisión y enfermedades raras, se han identificado algunos puntos importantes a tener en cuenta por los investigadores, los clínicos y los salubristas en relación a que a medida que la medicina de precisión madura y evoluciona, impacta a un mayor número de individuos. En relación a esto se han identificado tres situaciones a considerar23:
4.1La medicina de precisión puede terminar con una odisea e iniciar otraComo se señaló, un número muy importante de pacientes con enfermedades raras llegan a tener un diagnóstico certero, a través de estudios genómicos, luego de una larga odisea diagnóstica, que implica múltiples consultas médicas y estudios diagnósticos, muchas veces por varios años, siempre con la esperanza de tener un diagnóstico etiológico definitivo. Muchas veces la finalización de esta odisea diagnóstica, al tener un diagnóstico preciso, determina el inicio de una nueva odisea, la odisea terapéutica. El conocer la causa genética subyacente, muchas veces permite también conocer los riesgos reproductivos para el paciente y para su familia y puede eliminar la incerteza del pronóstico, pero con mucha frecuencia no entrega una clara alternativa terapéutica o preventiva. Este es un escenario especialmente desafiante, sobre todo si se considera que en la actualidad más del 90% de las enfermedades raras no tienen un tratamiento aprobado24. El gran desafío actual de la medicina de precisión es avanzar desde la identificación de genes asociados a enfermedad hacia la prevención y tratamiento específico. Indudablemente esto se ha visto frenado por el bajo número de pacientes afectados, lo que hace que el desarrollo de las denominadas “drogas huérfanas” sea muy poco atractivo para la industria farmacéutica25.
4.2Las intervenciones de precisión pueden exacerbar las inequidades en salud y producir dilemas éticosAun cuando se cumplan las expectativas de que la medicina de precisión descubra tratamientos efectivos para grupos específicos de afecciones, no terminarán los desafíos para los pacientes, sus familias, las autoridades de salud y las instituciones previsionales. El alto costo de estos tratamientos determina una inequidad en el acceso a ellos. Un ejemplo de esto es el nusinersen, fármaco aprobado para el tratamiento de la atrofia muscular espinal y que ha mostrado efectos “milagrosos” al detener la progresión de la enfermedad en varios de los subtipos de la afección, y prevenir la muerte cuando su administración se inicia en forma temprana17,26 pero cuyo desorbitante costo, US$ 750.000 el primer año y luego US$ 375.000 por año de por vida, lo hace inalcanzable para la gran mayoría de las familias ya que incluso la cobertura de los seguros no está garantizada. Lo mismo ocurre con onasemnogene abeparvovec, terapia génica disponible para pacientes con atrofia muscular espinal que se usa en una sola dosis, pero cuyo costo es de US$2.100.00028. El tratamiento de la atrofia muscular espinal es solo uno de los nuevos tratamientos disponibles basados en diagnósticos genéticos de precisión cuyo uso tiene implicancias que van mucho más allá de su efectividad. La evolución de la medicina de precisión significará un gran desafío para los investigadores, los clínicos y los políticos, quienes deberán desarrollar estrategias que les permitan enfrentar los desafíos éticos involucrados en la medicina traslacional asociada a nuevas terapias.
4.3La democratización de los datos transformará la investigación y la traslaciónEn general la información genética ha estado disponible solo para un grupo minoritario de pacientes que son aquellos que son referidos a un genetista clínico para estudio molecular y que reciben de vuelta información solo de resultados positivos confirmados, clínicamente procesables o con significado reproductivo. Sin embargo, el paciente es “dueño” de toda su información genética y debe tener acceso a ella si desea investigar información que el examen inicial no le entregó, buscando por ejemplo información en relación con las variantes inicialmente catalogadas como de significado incierto (VUS por sus siglas en inglés). Existen casos emblemáticos de pacientes, quienes a través de redes sociales han logrado contactar a otros con las mismas variantes, formar agrupaciones, delinear fenotipos y finalmente establecer diagnóstico29,30.
El próximo horizonte para el médico clínico en relación con la medicina traslacional será el almacenamiento seguro de los datos clínicos y genómicos de los pacientes y la generación de herramientas que permitan una transferencia más fácil de la información desde los servicios de diagnóstico genómico hacia el equipo médico y hacia las familias31,32.
5ConclusionesEn resumen, la medicina de precisión es un enfrentamiento innovador que integra la investigación y la práctica clínica, de forma tal que permite construir una base de conocimiento que posibilita guiar mejor el cuidado individualizado de los pacientes. Esto es de especial importancia en las enfermedades raras de base genética en las que solo el diagnóstico certero logrado a través de la determinación de la alteración molecular subyacente permitirá el manejo adecuado de los afectados y de sus familias.
Las enfermedades raras globalmente no son infrecuentes, sin embargo, debido a su diversidad y complejidad en sus bases genéticas son a menudo subdiagnosticadas o pasadas por alto. Con el fin de lograr un mejor entendimiento acerca de las enfermedades raras es importante desarrollar metodologías tendientes al diagnóstico de precisión. Teniendo en cuenta las características clínicas y genómicas específicas de cada paciente, así como las características celulares in vitro, la medicina de precisión permitirá modular decisiones en relación al diagnóstico, tratamiento y prevención de las enfermedades.
Declaración de conflicto de interésLa autora declara no tener conflictos de intereses.
Referencia no citada[27].