En la actualidad, el término “medicina de precisión” es ampliamente utilizado, sin embargo, la comprensión sobre sus implicancias aún no está masificada entre los profesionales de la salud. Esta revisión narrativa simple pretende describir conceptos asociados a la medicina de precisión y dar una pincelada sobre las diferentes áreas de aplicación en medicina clínica y las proyecciones que se plantean para su desarrollo en los próximos años.
The term “precision medicine” is currently widely used, however, the understanding of its implications is not yet widespread among health professionals. This simple narrative review aims to describe concepts associated with precision medicine and to give a brushstroke on the different areas of application in clinical medicine and the foreseen projections about their development for the coming years.
El término “medicina de precisión” se ha vuelto muy popular en los últimos años, y aunque algunos médicos e investigadores lo utilizan indistintamente como “medicina personalizada”, ambos tienen matices diferentes. Actualmente se prefiere utilizar “medicina de precisión” para describir el uso de datos y genómica que permiten adaptar los tratamientos a grupos específicos. De hecho, el Consejo Nacional de Investigación (NRC, por sus siglas en inglés) ha expresado su preocupación por que la “medicina personalizada” pueda malinterpretarse en el sentido de que se entienda que los tratamientos y las prevenciones se están desarrollando de forma única para cada individuo, lo que es un error1.
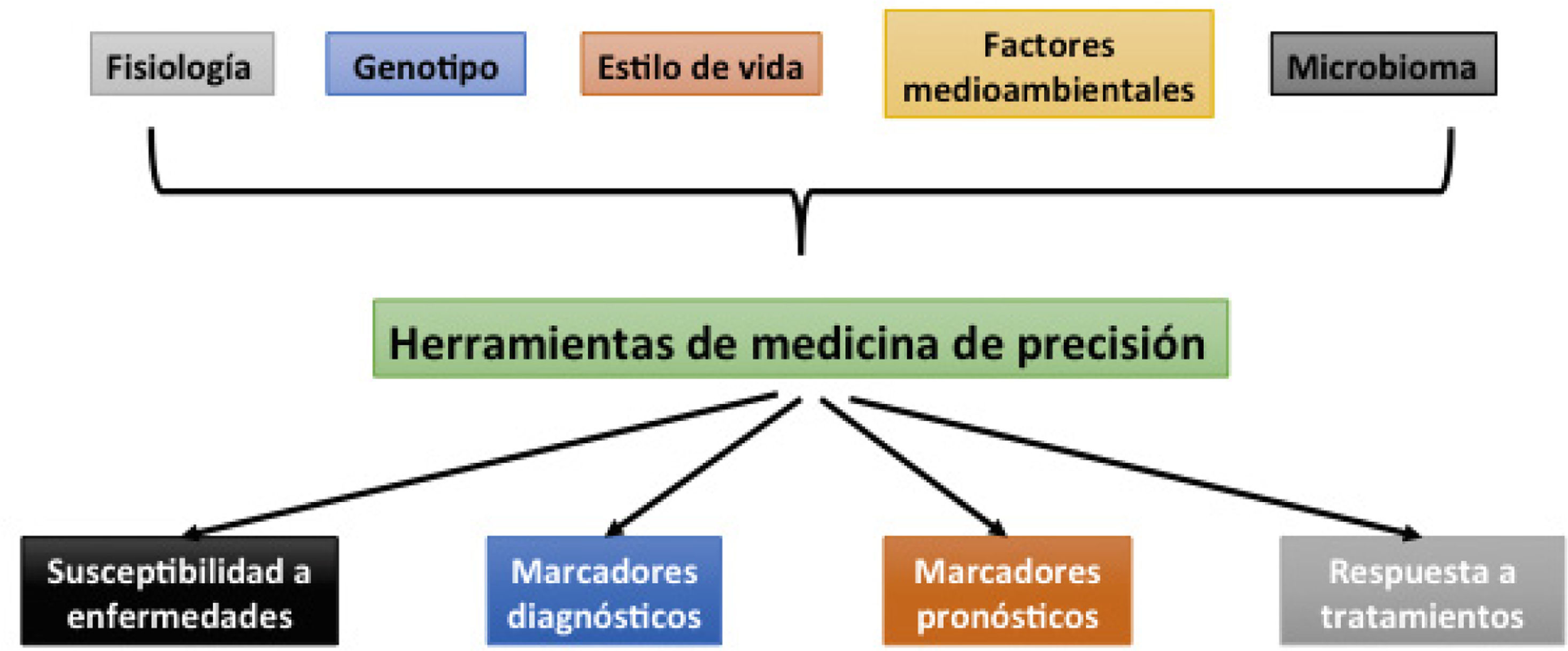
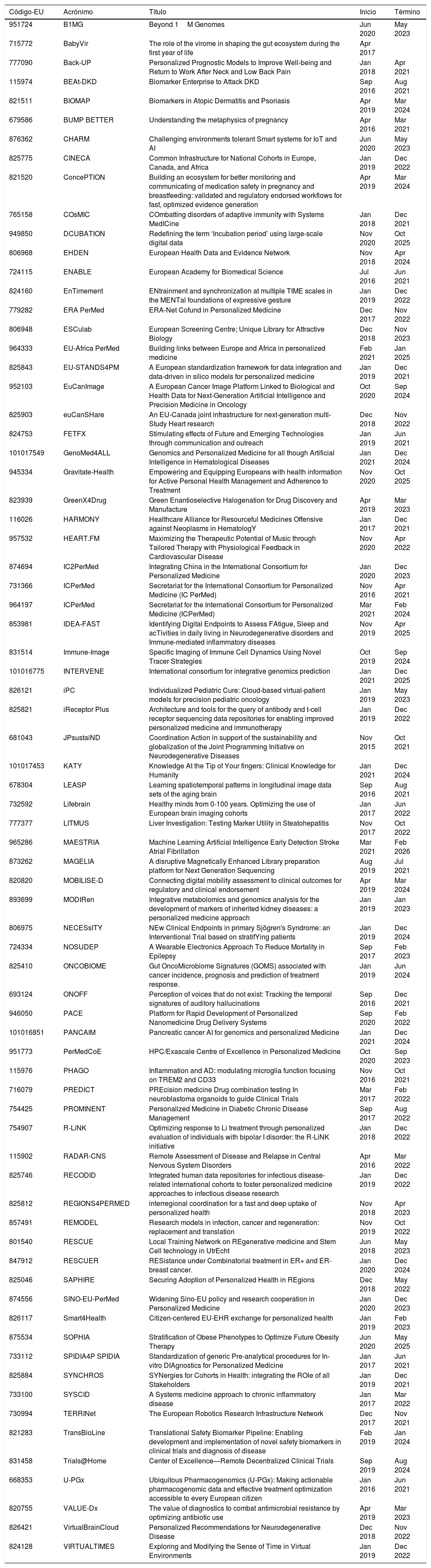
Es por ello que, si bien existen diversas definiciones de “medicina de precisión”, la más citada es: “La medicina de precisión es el concepto de adaptar el tratamiento y la prevención de enfermedades considerando las diferencias en factores genéticos, ambientales o incluso de estilo de vida, específicos de grupos de personas”. Esta definición fue utilizada en el anuncio que realizó el expresidente de EE.UU., Barack Obama para una nueva iniciativa en investigación1,2. En esta definición se entiende que la medicina de precisión utiliza la información genética y molecular de un grupo de pacientes y la emplea para desarrollar medicamentos o tratamientos más específicos y optimizados; siendo su objetivo final garantizar que cada medicamento o tratamiento sea el más adecuado para tratar a un individuo, traduciéndose, en particular, en una disminución de los efectos secundarios y una mayor eficacia. Es más, otros científicos como König et al.3, amplían la definición incluyendo que la medicina de precisión debe verse como un proceso altamente sofisticado y complejo. Como tal, la medicina estratificada y la terapia personalizada pueden ser salidas transitorias del proceso, cuyos resultados deben volver a retroalimentarse para adquirir más conocimientos y, por lo tanto, aumentar aún más la precisión. En otras palabras, es un proceso dinámico (Fig. 1).4
Dado que la medicina de precisión se basa en gran medida en la información genética, su gran avance se dio con la masificación de la secuenciación del genoma humano.
2Definiendo conceptos de genética y nuevas tecnologías2.1Genética y genómicaLa genética implica el estudio de los genes, sus efectos y su relación con la herencia. Los ejemplos de trastornos genéticos y/o hereditarios dados por genes específicos incluyen la fibrosis quística, la enfermedad de Huntington, cáncer hereditario de mama o de colon, sólo por mencionar algunos.
Por su parte, la genómica se refiere al estudio de todos los genes de una persona (el genoma), eso incluye las interacciones de esos genes entre sí y con el entorno o medioambiente en que vive la persona. La genómica permite estudiar enfermedades monogénicas y enfermedades complejas como cardiopatías, asma, diabetes y el cáncer en general, porque estas enfermedades suelen ser causadas más por una combinación de factores genéticos y ambientales que por genes únicos. De esta forma, con el estudio de la genómica se pueden diseñar nuevas terapias y tratamientos, así como nuevos métodos de diagnóstico para estas enfermedades complejas.
En el año 2001, en las revistas Nature y Science, se publicó el primer borrador del genoma humano5,6; y en el 2003 la versión terminada7. En el 2020 el Consorcio T2T (o “de telómero a telómero”) publicó el ensamblaje completo (de extremo a extremo) de un cromosoma X humano8, y más recientemente, anunció la secuenciación de los cromosomas 8 en la especie humana, en chimpancé, orangután y macaco9. A la fecha, este consorcio ha conseguido secuenciar de extremo a extremo 23 cromosomas humanos y ha obtenido la secuencia más completa de un genoma humano (aproximadamente 6,11 mil millones de pares de bases considerando los 46 cromosomas más el DNA mitocondrial)10.
Las tecnologías actuales como la secuenciación masiva o de siguiente generación, permiten secuenciar muchos fragmentos de DNA al mismo tiempo, lo que sumado a programas bioinformáticos que están constantemente recopilando información y generando grandes bases de datos que ayudan a interpretar el significado de las variantes genéticas, permiten que día a día se identifiquen nuevos genes responsables de enfermedad o cuyas alteraciones determinen susceptibilidad a enfermedades específicas11.
Para comprender el concepto de genoma de referencia, podemos decir que es un conjunto de datos cuya finalidad es organizar y representar la secuencia de DNA del genoma de una especie. Los genomas de referencia son ensamblados por investigadores y sirven como secuencias de DNA representativas para distintas especies. Comúnmente, un genoma de referencia cambia pares de bases de posición de una variante localizada, con cada versión del genoma de referencia. Estos cambios se van dando, conforme las técnicas de secuenciación y ensamblado de genomas van mejorando, haciéndose más específico y completo. Por ejemplo, la última referencia del genoma humano (GRCh38/hg38) fue ensamblada por el Genome Reference Consortium en diciembre del 2013. En estudios genómicos, es crucial considerar la versión del genoma de referencia ya que ésta delimita si se está hablando de la misma posición en el genoma. Por ejemplo, en el genoma humano el polimorfismo de nucleótido único (SNP, por sus siglas en inglés) rs80359554 que corresponde a la variante patogénica c.6024dupG en el gen BRCA2 y que se encuentra en el cromosoma 13, está en la posición g.32340379dup en la referencia GRCh38 mientras que en la GRCh37 se encuentra en la posición g.32914516dup12,13. Es decir, cada vez surgen nuevas versiones que actualizan y precisan más la información.
Además, es importante considerar que los genomas de dos personas son aproximadamente un 99,9% idénticos. Sin embargo, una pequeña variación del 0,1% implica cambios en una gran cantidad de nucleótidos14.
Es por esto que es fundamental saber localizar, identificar e interpretar las variantes genéticas, ya que muchas de ellas pueden ser sólo polimorfismos (definidos como cambios que están en más del 1% de la población) y que son consideradas variantes sin significado patológico.
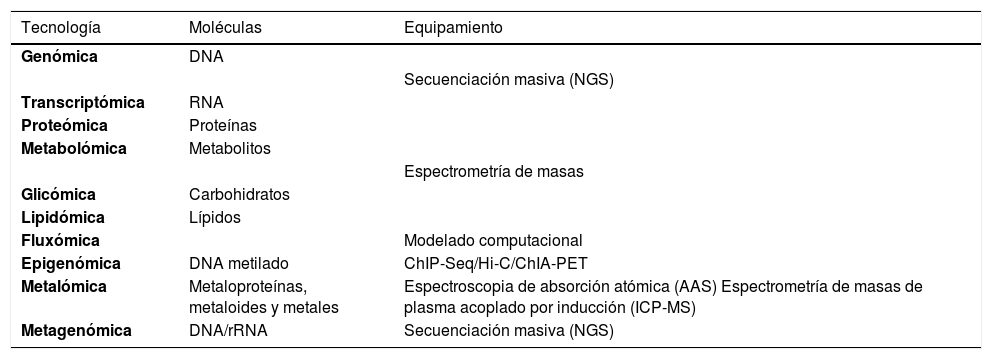
3Otras tecnologías fundamentales para el desarrollo de la medicina de precisiónEl sufijo “-oma” proviene del griego que significa conjunto o masa. En un inicio se usó en el término “genoma”, que se refiere a todos los genes de un organismo, como se mencionó previamente. Sin embargo, en la actualidad se está aplicando su uso a otras áreas de investigación (Tabla 1).
Distintas ciencias “ómicas” ampliamente utilizadas hoy en día
| Tecnología | Moléculas | Equipamiento |
|---|---|---|
| Genómica | DNA | |
| Secuenciación masiva (NGS) | ||
| Transcriptómica | RNA | |
| Proteómica | Proteínas | |
| Metabolómica | Metabolitos | |
| Espectrometría de masas | ||
| Glicómica | Carbohidratos | |
| Lipidómica | Lípidos | |
| Fluxómica | Modelado computacional | |
| Epigenómica | DNA metilado | ChIP-Seq/Hi-C/ChIA-PET |
| Metalómica | Metaloproteínas, metaloides y metales | Espectroscopia de absorción atómica (AAS) Espectrometría de masas de plasma acoplado por inducción (ICP-MS) |
| Metagenómica | DNA/rRNA | Secuenciación masiva (NGS) |
Considerando que la secuencia de DNA de los genes lleva las instrucciones, o el código, para sintetizar proteínas y que este DNA se transcribe en RNA, que luego se traduce en proteínas se han desarrollado ciencias “ómicas” que son complementarias entre sí, como las que se describen a continuación.
3.1TranscriptómicaLa transcriptómica se define como el estudio del transcriptoma, que es la cantidad y las actividades de todos los RNA (codificantes y no codificantes) en un determinado tiempo y lugar. Permite estudiar los niveles de expresión de los mRNA en una población celular o tejido determinado. Para el desarrollo de esta tecnología se utilizan principalmente dos plataformas: microarreglos (microarrays) que cuantifican un conjunto de secuencias predeterminadas; y secuenciación de RNA (RNA-Seq), que utiliza secuenciación masiva o de alto rendimiento para capturar todas las secuencias, y se combinan con modelos computacionales avanzados15.
3.2ProteómicaLa proteómica es un análisis similar a la genómica ya que también se hace a gran escala para analizar todas las proteínas en un organismo, tipo de tejido o célula (proteoma). Esta tecnología puede usarse para identificar proteínas específicas anormales que explican ciertas enfermedades. Entre otras cosas, permite conocer la estructura y funciones de una proteína en particular y así detectar marcadores de diagnóstico y comprender mecanismos de patogenicidad. Para la detección de proteínas se utiliza la espectrometría de masas de desorción/ionización láser asistida por matriz con tiempo de vuelo (MALDI/TOF/MS) y la cromatografía líquida asociada a espectrómetros de masa en tándem (LC/MS/MS)16.
3.3MetabolómicaLa metabolómica es el estudio a gran escala de moléculas pequeñas, generalmente conocidas como metabolitos, dentro de tejidos, biofluídos o células. En conjunto, estas pequeñas moléculas y sus interacciones dentro de un sistema biológico se conocen como metaboloma. Dentro de las ciencias “ómicas”, se destaca por tener un enfoque poderoso ya que los metabolitos y sus concentraciones reflejan directamente la actividad bioquímica subyacente y el estado de las células o tejidos, representando de mejor manera el fenotipo molecular. Como la composición de los metabolitos es variada, es decir son una diversidad de moléculas con propiedades físicas diferentes, se requiere diseñar varios protocolos de separación y luego de detección y cuantificación, mediante cromatografía líquida o cromatografía de gases asociado a espectrometría de masas o mediante resonancia nuclear magnética17.
3.4FluxómicaLa fluxómica o flujómica describe las variadas aristas que buscan determinar las tasas de reacciones metabólicas dentro de un organismo. Si bien es similar en cierto sentido a la metabolómica, la fluxómica determina el dinamismo de los flujos metabólicos, advirtiendo sobre fenotipos celulares. Por lo tanto, implica una evaluación más completa de las complejas redes metabólicas relacionadas con las enfermedades humanas. Esto se realiza mediante un modelado computacional que se integra con una plataforma analítica que comprende optimización lineal, análisis continuos y dinámicos y control metabólico18.
3.5MetalómicaLa metalómica es el estudio de las metaloproteínas y todas las demás moléculas que contienen metales, así como del conjunto de metales y metaloides dentro de una célula o tejido. De esta forma, la metalómica puede ser considerada una rama de la metabolómica, aunque los metales no son normalmente considerados como metabolitos. Por otra parte, dado que existen numerosas interacciones y conexiones funcionales entre los iones metálicos y las distintas especies químicas derivadas de éstos con un gran número de genes y proteínas, la metalómica es un área de investigación transdisciplinaria ya que está relacionada con la genómica y la proteómica. La espectroscopia de absorción atómica (AAS) y la espectrometría de masas de plasma acoplado por inducción (ICP-MS) son los métodos de análisis para la determinación de elementos químicos19.
3.6EpigenómicaLa epigenética se define como cambios heredables en la estructura y función del DNA que no involucran cambios en la secuencia nucleotídica y que regulan la expresión génica. Implica los cambios realizados por compuestos químicos (como por ejemplo grupos metilos en ciertas bases nucleotídicas “citosina”) o proteínas (como acetilación de histonas), y de esta forma habitualmente regulan la expresión de los genes. Por lo tanto, la epigenómica es el estudio del conjunto completo de las modificaciones epigenéticas en el material genético de una célula, conocido como epigenoma. El estudio de la epigenómica se realiza mediante el análisis de perfiles de secuenciación genética a partir de las técnicas ChIP-Seq (inmunoprecipitación de cromatina seguida de secuenciación), modificación previa con bisulfito y posterior secuenciación (el bisulfito convierte la citosina en uracilo, pero no puede cambiar las citosinas metiladas, por lo que permite así diferenciar durante la secuenciación que citosinas estaban metiladas y cuales no), y otras más nuevas como técnicas de captura de la conformación de los cromosomas (3C) entre ellas Hi-C y ChIA-PET que proporcionan un buen equilibrio de resolución y cobertura razonable en el genoma eucariota para mapear interacciones de largo alcance20.
3.7MetagenómicaLa metagenómica es el estudio de los genomas de una comunidad microbiana. En el área de la salud humana, por ejemplo, se sabe que el microbioma juega un rol fundamental en la homeostasis, por lo que el estudio de los microrganismos que forman parte de nuestro cuerpo es fundamental que sea realizada. Esto se logra mediante los avances en las técnicas de secuenciación masiva y plataformas bioinformáticas que permiten, según los resultados, tipificar los microorganismos y determinar la presencia de patógenos21.
3.8Farmacogenética y farmacogenómicaTambién es usual que se usen indistintamente los términos “farmacogenética” y “farmacogenómica” pero, tienen significados distintos. La farmacogénetica estudia la variabilidad genética de ciertas proteínas hepáticas de un individuo, prediciendo su respuesta a determinados fármacos. En esta área se estudian los genes que codifican para proteínas que transportan y metabolizan fármacos y los receptores específicos de fármacos, y de esta manera es posible establecer la mejor elección y dosis de medicamentos de acuerdo con la caracterización de los genotipos de cada paciente. Un ejemplo de estos exámenes se describe en el trabajo de Moreno et al.22. La farmagenómica en cambio,
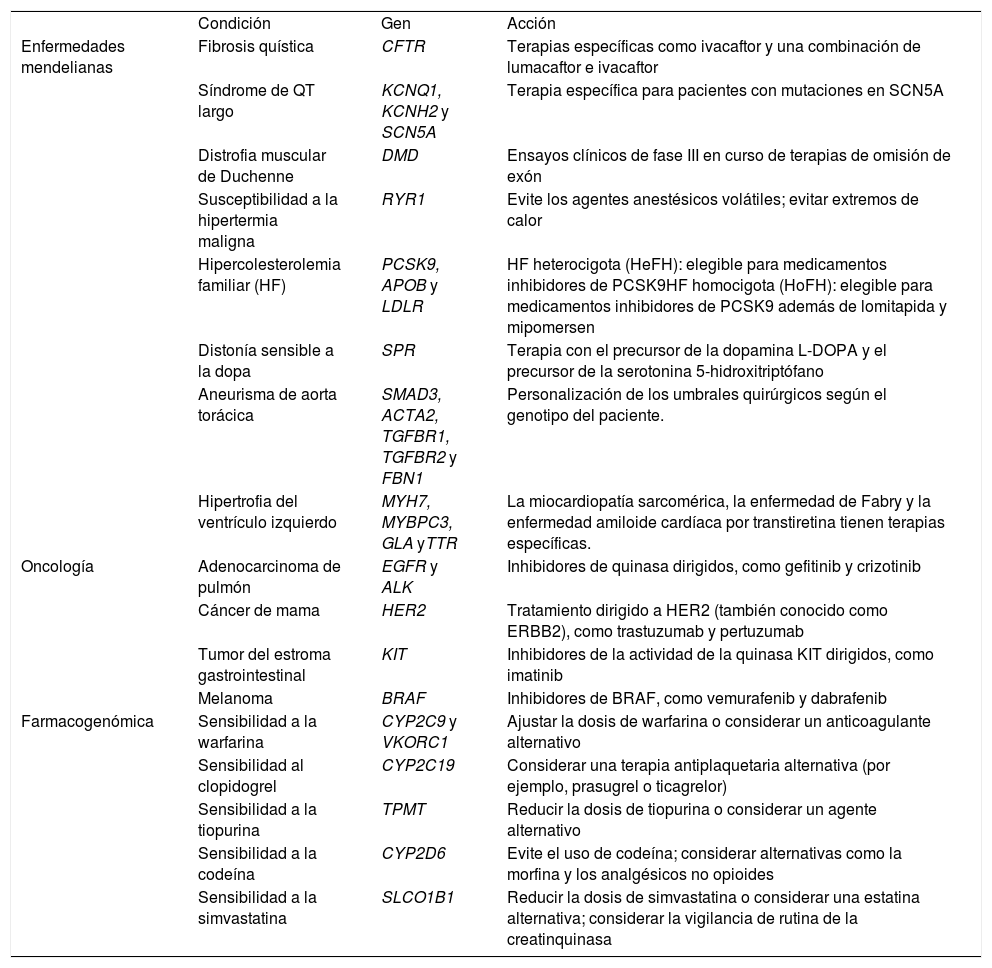
Las principales enfermedades donde la medicina de precisión está teniendo una gran relevancia es en el cáncer, las enfermedades mendelianas y en la farmacogenómica como se detalla en la Tabla 2.23
Algunos ejemplos donde se aplica la medicina de precisión
| Condición | Gen | Acción | |
| Enfermedades mendelianas | Fibrosis quística | CFTR | Terapias específicas como ivacaftor y una combinación de lumacaftor e ivacaftor |
| Síndrome de QT largo | KCNQ1, KCNH2 y SCN5A | Terapia específica para pacientes con mutaciones en SCN5A | |
| Distrofia muscular de Duchenne | DMD | Ensayos clínicos de fase III en curso de terapias de omisión de exón | |
| Susceptibilidad a la hipertermia maligna | RYR1 | Evite los agentes anestésicos volátiles; evitar extremos de calor | |
| Hipercolesterolemia familiar (HF) | PCSK9, APOB y LDLR | HF heterocigota (HeFH): elegible para medicamentos inhibidores de PCSK9HF homocigota (HoFH): elegible para medicamentos inhibidores de PCSK9 además de lomitapida y mipomersen | |
| Distonía sensible a la dopa | SPR | Terapia con el precursor de la dopamina L-DOPA y el precursor de la serotonina 5-hidroxitriptófano | |
| Aneurisma de aorta torácica | SMAD3, ACTA2, TGFBR1, TGFBR2 y FBN1 | Personalización de los umbrales quirúrgicos según el genotipo del paciente. | |
| Hipertrofia del ventrículo izquierdo | MYH7, MYBPC3, GLA yTTR | La miocardiopatía sarcomérica, la enfermedad de Fabry y la enfermedad amiloide cardíaca por transtiretina tienen terapias específicas. | |
| Oncología | Adenocarcinoma de pulmón | EGFR y ALK | Inhibidores de quinasa dirigidos, como gefitinib y crizotinib |
| Cáncer de mama | HER2 | Tratamiento dirigido a HER2 (también conocido como ERBB2), como trastuzumab y pertuzumab | |
| Tumor del estroma gastrointestinal | KIT | Inhibidores de la actividad de la quinasa KIT dirigidos, como imatinib | |
| Melanoma | BRAF | Inhibidores de BRAF, como vemurafenib y dabrafenib | |
| Farmacogenómica | Sensibilidad a la warfarina | CYP2C9 y VKORC1 | Ajustar la dosis de warfarina o considerar un anticoagulante alternativo |
| Sensibilidad al clopidogrel | CYP2C19 | Considerar una terapia antiplaquetaria alternativa (por ejemplo, prasugrel o ticagrelor) | |
| Sensibilidad a la tiopurina | TPMT | Reducir la dosis de tiopurina o considerar un agente alternativo | |
| Sensibilidad a la codeína | CYP2D6 | Evite el uso de codeína; considerar alternativas como la morfina y los analgésicos no opioides | |
| Sensibilidad a la simvastatina | SLCO1B1 | Reducir la dosis de simvastatina o considerar una estatina alternativa; considerar la vigilancia de rutina de la creatinquinasa |
Los avances en tecnologías y la adquisición de nuevos conocimientos durante las últimas décadas han permitido a investigadores y médicos acceder a una gran cantidad de datos sobre diferentes tipos de cáncer. El enfoque histórico ha sido agrupar los tipos de cáncer y tratar a todas las personas con un tipo dado de cáncer con el mismo esquema terapéutico. Sin embargo, la respuesta de los pacientes puede variar aún cuando la patología sea idéntica. Ahora sabemos que hay factores moleculares que permiten reclasificar y generar subgrupos de tumores según características moleculares que entregan tanto un valor pronóstico (información prospectiva de la evolución del paciente y que permite guiar decisiones terapéuticas), como un valor predictivo (información de la probabilidad de respuesta tumoral a un agente terapéutico o a una combinación de ellos) (Fig. 1).
Esto se debe a que los fármacos están diseñados para bloquear una vía metabólica específica que la célula tumoral normalmente utiliza para seguir proliferando; sin embargo, la célula tumoral puede encontrar otras vías para lograr sobrevivir y escapa a la acción terapéutica del fármaco. Para la identificación de marcadores y de nuevos fármacos, la medicina de precisión se apoya fuertemente en el campo de la oncología computacional que emplea la experiencia de investigadores, estadísticos, matemáticos, físicos, informáticos, biólogos del cáncer, expertos en fisiología y médicos, entre otros, para crear programas y modelos de datos que incluyan perfiles genéticos y enfoques terapéuticos para diferentes tipos de cáncer.
La epigenética por ejemplo también es ampliamente utilizada en oncología ya que el análisis de metilación del DNA y en consecuencia el patrón de expresión génica, ha permitido direccionar el manejo de pacientes con tumores de origen colorrectal, prostático, pancreático y con tumores primarios de origen desconocido24.
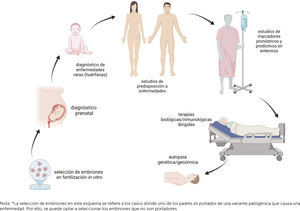
Actualmente se están desarrollando diversas investigaciones en medicina de precisión en distintas áreas clínicas. De Maria Marchiano et al. (2021)25 resumen los distintos proyectos vigentes que implican una gran diversidad de áreas y enfermedades (Tabla 3).
Listado de iniciativas apoyadas por la Unión Europea
| Código-EU | Acrónimo | Título | Inicio | Término |
|---|---|---|---|---|
| 951724 | B1MG | Beyond 1M Genomes | Jun 2020 | May 2023 |
| 715772 | BabyVir | The role of the virome in shaping the gut ecosystem during the first year of life | Apr 2017 | |
| 777090 | Back-UP | Personalized Prognostic Models to Improve Well-being and Return to Work After Neck and Low Back Pain | Jan 2018 | Apr 2021 |
| 115974 | BEAt-DKD | Biomarker Enterprise to Attack DKD | Sep 2016 | Aug 2021 |
| 821511 | BIOMAP | Biomarkers in Atopic Dermatitis and Psoriasis | Apr 2019 | Mar 2024 |
| 679586 | BUMP BETTER | Understanding the metaphysics of pregnancy | Apr 2016 | Mar 2021 |
| 876362 | CHARM | Challenging environments tolerant Smart systems for IoT and AI | Jun 2020 | May 2023 |
| 825775 | CINECA | Common Infrastructure for National Cohorts in Europe, Canada, and Africa | Jan 2019 | Dec 2022 |
| 821520 | ConcePTION | Building an ecosystem for better monitoring and communicating of medication safety in pregnancy and breastfeeding: validated and regulatory endorsed workflows for fast, optimized evidence generation | Apr 2019 | Mar 2024 |
| 765158 | COsMIC | COmbatting disorders of adaptive immunity with Systems MedICine | Jan 2018 | Dec 2021 |
| 949850 | DCUBATION | Redefining the term ‘Incubation period’ using large-scale digital data | Nov 2020 | Oct 2025 |
| 806968 | EHDEN | European Health Data and Evidence Network | Nov 2018 | Apr 2024 |
| 724115 | ENABLE | European Academy for Biomedical Science | Jul 2016 | Jun 2021 |
| 824160 | EnTimement | ENtrainment and synchronization at multiple TIME scales in the MENTal foundations of expressive gesture | Jan 2019 | Dec 2022 |
| 779282 | ERA PerMed | ERA-Net Cofund in Personalized Medicine | Dec 2017 | Nov 2022 |
| 806948 | ESCulab | European Screening Centre; Unique Library for Attractive Biology | Dec 2018 | Nov 2023 |
| 964333 | EU-Africa PerMed | Building links between Europe and Africa in personalized medicine | Feb 2021 | Jan 2025 |
| 825843 | EU-STANDS4PM | A European standardization framework for data integration and data-driven in silico models for personalized medicine | Jan 2019 | Dec 2021 |
| 952103 | EuCanImage | A European Cancer Image Platform Linked to Biological and Health Data for Next-Generation Artificial Intelligence and Precision Medicine in Oncology | Oct 2020 | Sep 2024 |
| 825903 | euCanSHare | An EU-Canada joint infrastructure for next-generation multi-Study Heart research | Dec 2018 | Nov 2022 |
| 824753 | FETFX | Stimulating effects of Future and Emerging Technologies through communication and outreach | Jan 2019 | Jun 2021 |
| 101017549 | GenoMed4ALL | Genomics and Personalized Medicine for all though Artificial Intelligence in Hematological Diseases | Jan 2021 | Dec 2024 |
| 945334 | Gravitate-Health | Empowering and Equipping Europeans with health information for Active Personal Health Management and Adherence to Treatment | Nov 2020 | Oct 2025 |
| 823939 | GreenX4Drug | Green Enantioselective Halogenation for Drug Discovery and Manufacture | Apr 2019 | Mar 2023 |
| 116026 | HARMONY | Healthcare Alliance for Resourceful Medicines Offensive against Neoplasms in HematologY | Jan 2017 | Dec 2021 |
| 957532 | HEART.FM | Maximizing the Therapeutic Potential of Music through Tailored Therapy with Physiological Feedback in Cardiovascular Disease | Nov 2020 | Apr 2022 |
| 874694 | IC2PerMed | Integrating China in the International Consortium for Personalized Medicine | Jan 2020 | Dec 2023 |
| 731366 | ICPerMed | Secretariat for the International Consortium for Personalized Medicine (IC PerMed) | Nov 2016 | Apr 2021 |
| 964197 | ICPerMed | Secretariat for the International Consortium for Personalized Medicine (ICPerMed) | Mar 2021 | Feb 2024 |
| 853981 | IDEA-FAST | Identifying Digital Endpoints to Assess FAtigue, Sleep and acTivities in daily living in Neurodegenerative disorders and Immune-mediated inflammatory diseases | Nov 2019 | Apr 2025 |
| 831514 | Immune-Image | Specific Imaging of Immune Cell Dynamics Using Novel Tracer Strategies | Oct 2019 | Sep 2024 |
| 101016775 | INTERVENE | International consortium for integrative genomics prediction | Jan 2021 | Dec 2025 |
| 826121 | iPC | Individualized Pediatric Cure: Cloud-based virtual-patient models for precision pediatric oncology | Jan 2019 | May 2023 |
| 825821 | iReceptor Plus | Architecture and tools for the query of antibody and t-cell receptor sequencing data repositories for enabling improved personalized medicine and immunotherapy | Jan 2019 | Dec 2022 |
| 681043 | JPsustaiND | Coordination Action in support of the sustainability and globalization of the Joint Programming Initiative on Neurodegenerative Diseases | Nov 2015 | Oct 2021 |
| 101017453 | KATY | Knowledge At the Tip of Your fingers: Clinical Knowledge for Humanity | Jan 2021 | Dec 2024 |
| 678304 | LEASP | Learning spatiotemporal patterns in longitudinal image data sets of the aging brain | Sep 2016 | Aug 2021 |
| 732592 | Lifebrain | Healthy minds from 0-100 years. Optimizing the use of European brain imaging cohorts | Jan 2017 | Jun 2022 |
| 777377 | LITMUS | Liver Investigation: Testing Marker Utility in Steatohepatitis | Nov 2017 | Oct 2022 |
| 965286 | MAESTRIA | Machine Learning Artificial Intelligence Early Detection Stroke Atrial Fibrillation | Mar 2021 | Feb 2026 |
| 873262 | MAGELIA | A disruptive Magnetically Enhanced Library preparation platform for Next Generation Sequencing | Aug 2019 | Jul 2021 |
| 820820 | MOBILISE-D | Connecting digital mobility assessment to clinical outcomes for regulatory and clinical endorsement | Apr 2019 | Mar 2024 |
| 893699 | MODIRen | Integrative metabolomics and genomics analysis for the development of markers of inherited kidney diseases: a personalized medicine approach | Jan 2019 | Jan 2023 |
| 806975 | NECESsITY | NEw Clinical Endpoints in primary Sjögren's Syndrome: an Interventional Trial based on stratifYing patients | Jan 2019 | Dec 2024 |
| 724334 | NOSUDEP | A Wearable Electronics Approach To Reduce Mortality in Epilepsy | Sep 2017 | Feb 2023 |
| 825410 | ONCOBIOME | Gut OncoMicrobiome Signatures (GOMS) associated with cancer incidence, prognosis and prediction of treatment response. | Jan 2019 | Jun 2024 |
| 693124 | ONOFF | Perception of voices that do not exist: Tracking the temporal signatures of auditory hallucinations | Sep 2016 | Dec 2021 |
| 946050 | PACE | Platform for Rapid Development of Personalized Nanomedicine Drug Delivery Systems | Sep 2020 | Feb 2022 |
| 101016851 | PANCAIM | Pancreatic cancer AI for genomics and personalized Medicine | Jan 2021 | Dec 2024 |
| 951773 | PerMedCoE | HPC/Exascale Centre of Excellence in Personalized Medicine | Oct 2020 | Sep 2023 |
| 115976 | PHAGO | Inflammation and AD: modulating microglia function focusing on TREM2 and CD33 | Nov 2016 | Oct 2021 |
| 716079 | PREDICT | PREcision medicine Drug combination testing In neuroblastoma organoids to guide Clinical Trials | Mar 2017 | Feb 2022 |
| 754425 | PROMINENT | Personalized Medicine in Diabetic Chronic Disease Management | Sep 2017 | Aug 2022 |
| 754907 | R-LiNK | Optimizing response to Li treatment through personalized evaluation of individuals with bipolar I disorder: the R-LiNK initiative | Jan 2018 | Dec 2022 |
| 115902 | RADAR-CNS | Remote Assessment of Disease and Relapse in Central Nervous System Disorders | Apr 2016 | Mar 2022 |
| 825746 | RECODID | Integrated human data repositories for infectious disease-related international cohorts to foster personalized medicine approaches to infectious disease research | Jan 2019 | Dec 2022 |
| 825812 | REGIONS4PERMED | interregional coordination for a fast and deep uptake of personalized health | Nov 2018 | Apr 2023 |
| 857491 | REMODEL | Research models in infection, cancer and regeneration: replacement and translation | Nov 2019 | Oct 2022 |
| 801540 | RESCUE | Local Training Network on REgenerative medicine and Stem Cell technology in UtrEcht | Jun 2018 | May 2023 |
| 847912 | RESCUER | RESistance under Combinatorial treatment in ER+ and ER-breast cancer. | Jan 2020 | Dec 2024 |
| 825046 | SAPHIRE | Securing Adoption of Personalized Health in REgions | Dec 2018 | May 2022 |
| 874556 | SINO-EU-PerMed | Widening Sino-EU policy and research cooperation in Personalized Medicine | Jan 2020 | Dec 2023 |
| 826117 | Smart4Health | Citizen-centered EU-EHR exchange for personalized health | Jan 2019 | Feb 2023 |
| 875534 | SOPHIA | Stratification of Obese Phenotypes to Optimize Future Obesity Therapy | Jun 2020 | May 2025 |
| 733112 | SPIDIA4P SPIDIA | Standardization of generic Pre-analytical procedures for In-vitro DIAgnostics for Personalized Medicine | Jan 2017 | Jun 2021 |
| 825884 | SYNCHROS | SYNergies for Cohorts in Health: integrating the ROle of all Stakeholders | Jan 2019 | Dec 2021 |
| 733100 | SYSCID | A Systems medicine approach to chronic inflammatory disease | Jan 2017 | Mar 2022 |
| 730994 | TERRINet | The European Robotics Research Infrastructure Network | Dec 2017 | Nov 2021 |
| 821283 | TransBioLine | Translational Safety Biomarker Pipeline: Enabling development and implementation of novel safety biomarkers in clinical trials and diagnosis of disease | Feb 2019 | Jan 2024 |
| 831458 | Trials@Home | Center of Excellence—Remote Decentralized Clinical Trials | Sep 2019 | Aug 2024 |
| 668353 | U-PGx | Ubiquitous Pharmacogenomics (U-PGx): Making actionable pharmacogenomic data and effective treatment optimization accessible to every European citizen | Jan 2016 | Jun 2021 |
| 820755 | VALUE-Dx | The value of diagnostics to combat antimicrobial resistance by optimizing antibiotic use | Apr 2019 | Mar 2023 |
| 826421 | VirtualBrainCloud | Personalized Recommendations for Neurodegenerative Disease | Dec 2018 | Nov 2022 |
| 824128 | VIRTUALTIMES | Exploring and Modifying the Sense of Time in Virtual Environments | Jan 2019 | Dec 2022 |
Fuente: CORDIS, https://cordis.europa.eu/es (consultado en marzo de 2021). Como palabras clave se buscó que el tipo de contenido=“medicina personalizada” e “iniciativas” y “en curso”.
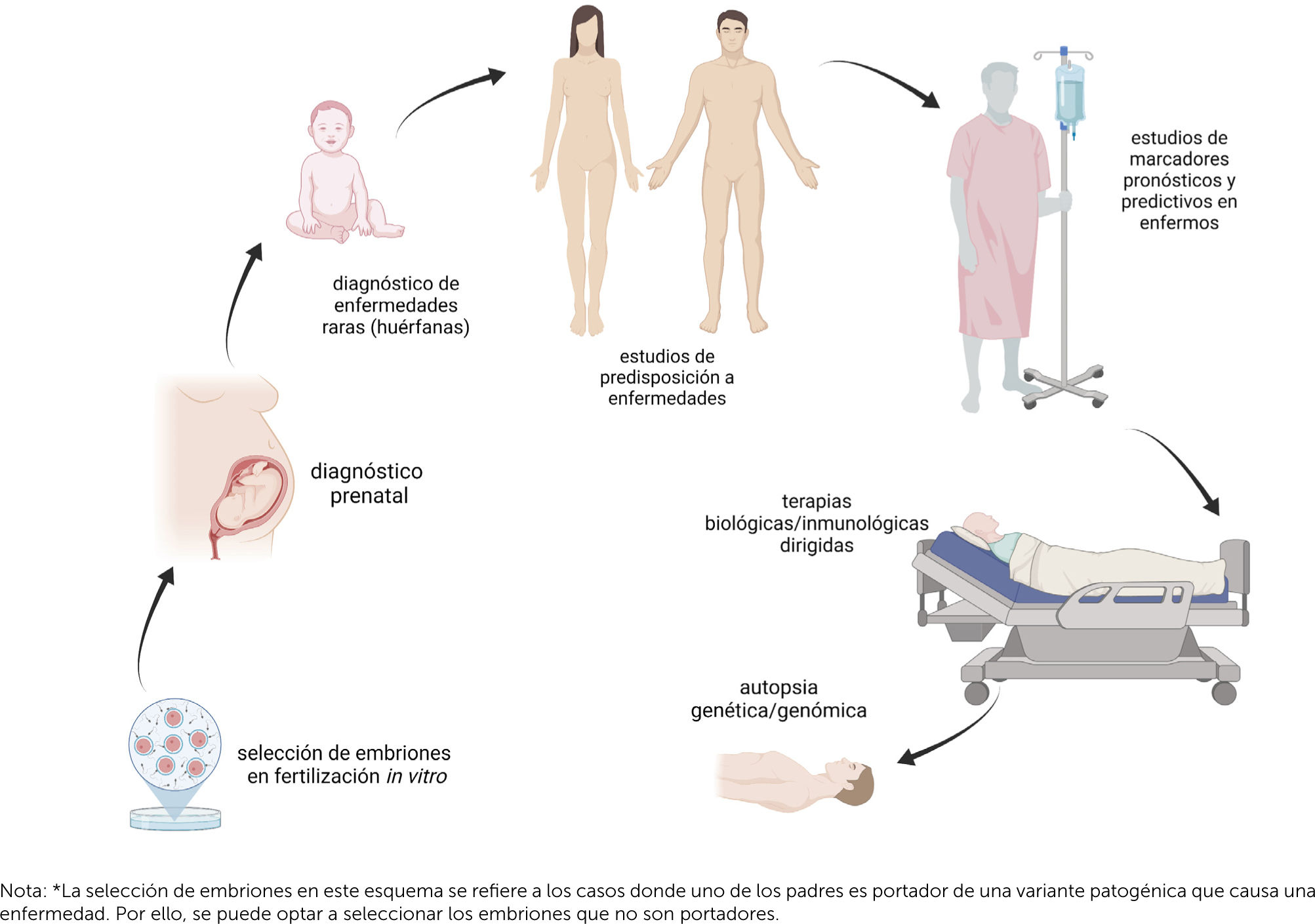
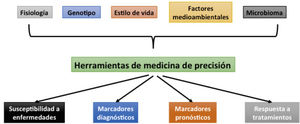
La medicina de precisión actualmente puede estar presente en distintas etapas de la vida de una persona (Fig. 2) y aun así diariamente se desarrollan nuevas herramientas para distintas necesidades en salud.
Uso de la medicina de precisión en las distintas etapas de de la vida de una persona. Nota: *La selección de embriones en este esquema se refiere a los casos donde uno de los padres es portador de una variante patogénica que causa una enfermedad. Por ello, se puede optar a seleccionar los embriones que no son portadores.
Una interesante revisión realizada por Love-Koh et al., en el 20184, señala que se espera que en la próxima década tres áreas de la medicina de precisión se expandan en la práctica clínica: 1) algoritmos complejos basados en inteligencia artificial; 2) aplicaciones de salud digital y; 3) pruebas o biomarcadores basados en “ómicas”. Por su parte, Green et al. (2020), resueltamente consideran 10 predicciones para la genómica humana para el año 2030.
- 1.
“Analizar una secuencia completa del genoma humano será una rutina para cualquier laboratorio de investigación, siendo tan sencillo como realizar una purificación de DNA”.
- 2.
“Se conocerán las funciones biológicas de cada gen humano; incluyendo también los elementos no codificantes del genoma humano”.
- 3.
“Los modelos predictivos del impacto del genotipo en el fenotipo incorporarán de forma rutinaria la panorámica de la epigenética y la producción transcripcional”.
- 4.
“La investigación en genómica humana habrá ido más allá de los descriptores de población basados en construcciones sociales históricas como la raza”.
- 5.
“Los estudios que involucran análisis de secuencias del genoma e información fenotípica asociada para millones de participantes humanos se presentarán regularmente en exhibiciones de ciencias escolares”.
- 6.
“El uso regular de la información genómica será habitual en todos los entornos clínicos, haciendo que las pruebas genómicas sean tan rutinarias como los hemogramas completos”.
- 7.
“La relevancia clínica de todas las variantes genómicas encontradas será fácilmente predecible, dejando obsoleta la designación diagnóstica de “variante de significado incierto (VUS)”.
- 8.
“La secuencia completa del genoma de una persona junto con los datos informativos podrán ser accesibles de manera segura y fácil en su teléfono inteligente”.
- 9.
“Los individuos de orígenes ancestrales diversos se beneficiarán equitativamente de los avances en genómica humana”.
- 10.
“Los descubrimientos genómicos conducirán a terapias curativas que implican modificaciones genómicas para docenas de enfermedades genéticas”.
Si bien es poco probable que la mayoría de estos puntos se alcance por completo, lograr una o más de estas requerirá que las personas se esfuercen por lograr algo que actualmente parece fuera de su alcance. Estas predicciones fueron diseñadas para ser de naturaleza inspiradora y aspiracional, lo que ha provocado discusiones sobre lo que podría ser posible, la vanguardia de la genómica humana en la próxima década26.
Aunque las promesas originan grandes expectativas sobre el potencial de las nuevas tecnologías genómicas y moleculares para la prevención y el tratamiento de enfermedades complejas, la evidencia sugiere que se necesita precaución y más moderación en relación con las promesas de la medicina personalizada.
El enfoque central en el individuo y en tecnologías de alto costo que benefician a una pequeña porción de la población podría incrementar las desigualdades. Por ello, es fundamental realizar una evaluación de costo-beneficio desde una perspectiva ética que considere si serán accesibles para que todos se beneficien y no agraven las disparidades de salud existentes27,28.
Declaración de conflicto de interésLa autora declara no tener conflictos de intereses.