Las cardiopatías congénitas (CC) son las malformaciones congénitas aisladas más frecuentes y las que tienen un mayor sub-diagnóstico. La incorporación de guías clínicas y de exámenes sistematizados han permitido una mejoría en el diagnóstico prenatal. La evaluación ecocardiográfica fetal realizada por un equipo de cardiología perinatal, permite identificar con gran certeza la alteración estructural, del ritmo y/o de la función del corazón fetal.
La medicina de precisión en cardiología perinatal, mediante la incorporación de técnicas de biología molecular, han posibilitado una mejoría en el diagnóstico y de la precisión del pronóstico de las cardiopatías congénitas. Se presenta la experiencia de un centro privado, en diagnóstico y uso de las técnicas de medicina de precisión en cardiología perinatal.
While congenital heart disease is the most frequent fetal malformation, it is, at the same time, the least frequently diagnosed one. The incorporation of clinical guidelines and systematized examinations have allowed an improvement in prenatal diagnosis. Fetal echocardiographic examination performed by a perinatal cardiology team permits, with great certainty, the identification of the type of structural, rhythm or functional alteration of the fetal heart.
Precision medicine, through the incorporation of molecular biology techniques in perinatal cardiology, has enabled an improvement in the diagnosis and accuracy of the prognosis of congenital heart disease. We present the experience of Clínica Las Condes with regards to diagnoses and Precision Medicine in perinatal cardiology.
Las alteraciones cardíacas congénitas son las malformaciones congénitas aisladas más frecuentes, con una incidencia de 8,2 por cada 1000 recién nacidos vivos1. Son responsables del 20% de las muertes neonatales y cerca de 50% de la mortalidad infantil debido a malformaciones congénitas1–9. Un estudio realizado en una población de recién nacidos vivos o muertos de más de 26 semanas de gestación en Bélgica, sin relación con alguna anomalía cromosómica describió una incidencia de 8,3 por 1.000 nacidos totales10. Sin embargo, es probable que exista una mayor incidencia en las gestaciones tempranas en las que existen mayor número de pérdidas ya sea de manera espontánea o interrupción electiva del embarazo.
El diagnóstico prenatal de las cardiopatías congénitas (CC) mejora los resultados perinatales, especialmente en las patologías ductus dependientes11–16, y además, en el largo plazo, permitiría un mejor neurodesarrollo17,18. Sin embargo, las CC son las malformaciones que más frecuentemente se sub-diagnostican9,10.
La tasa de detección prenatal varía ampliamente de acuerdo al país y a la malformación cardíaca que se trate; de esta forma, el diagnóstico in utero de las CC mayores, se estima en alrededor de un 50%1,19,20. Las fallas en la detección prenatal de CC, involucran variables dependientes de los sistemas y programas de salud, del operador y de la paciente21–24. La mejoría en las tasas de detección de los programas de cribado se puede lograr con la introducción de guías clínicas y protocolos, la implementación de sistemas de redes que faciliten la derivación de los pacientes sospechosos a expertos en cardiología fetal y con la configuración de equipos de cardiología perinatal15,25,26.
La ecocardiografía fetal representa la principal herramienta para el diagnóstico y evaluación detallada del sistema cardiovascular fetal. Es una herramienta útil desde finales del primer trimestre de gestación hasta el término del embarazo. Desde hace más de dos décadas el uso de la ecocardiografía fetal ha sido polémico, cuestionando muchas veces la técnica idónea, la definición exacta y la población objetivo a la que puede llegar. Por otra parte, la población de riesgo que constituyen los grupos de pacientes con indicaciones maternas o fetales, a los que se realiza ecocardiografía fetal, acumula solo el 10% de los recién nacidos cardiópatas. Teniendo esto en mente, la estrategia a utilizar fue definida como cribado que se realiza a la población general, y de esta forma permite sumar al grupo de bajo riesgo, donde se encuentra el 90% de los fetos portadores de CC.
La realización de un examen de cribado, permite maximizar la posibilidad de diagnosticar CC en los exámenes de ultrasonido de rutina durante el embarazo, y debe estar dirigido a toda la población. En aquellos casos donde se identifique una sospecha de alteración estructural, funcional o del ritmo cardíaco, el paciente debe ser derivado para la realización de una ecocardiografía fetal.
En el examen de ecocardiografía fetal es posible precisar el diagnóstico de las alteraciones estructurales del ritmo y de la función cardíaca.
En la etiología de las cardiopatías congénitas se han identificado anomalías cromosómicas, numéricas y estructurales, microdeleciones y alteraciones de gen único en más de un 45% de los casos27.
En los últimos años se ha incorporado la medicina de precisión a la cardiología perinatal, permitiendo mejorar el diagnóstico, pronóstico o tratamiento mediante la identificación de las alteraciones genéticas o moleculares subyacentes.
En este artículo se describirá en que consiste el cribado, la ecocardiografía fetal, y la utilidad de la medicina de precisión en las cardiopatías congénitas.
Cribado de cardiopatías congénitasEl examen de cribado se debe realizar a la población general, y si bien fue primariamente descrito para el segundo trimestre, actualmente se debe efectuar, también, en el examen de las 11 a 14 semanas, y en el tercer trimestre.
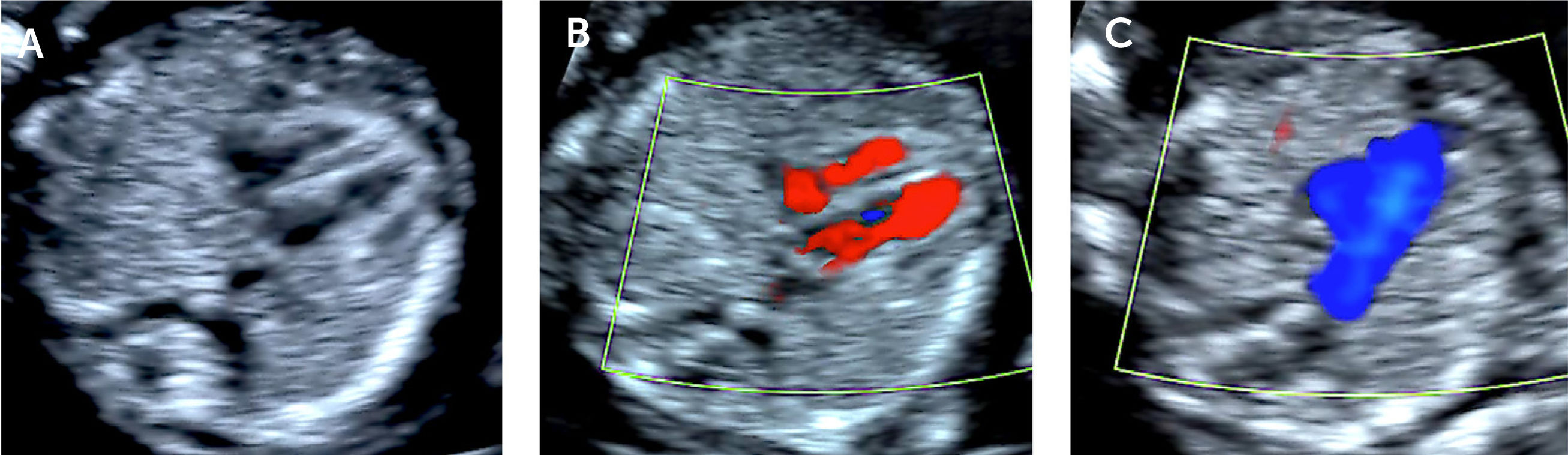
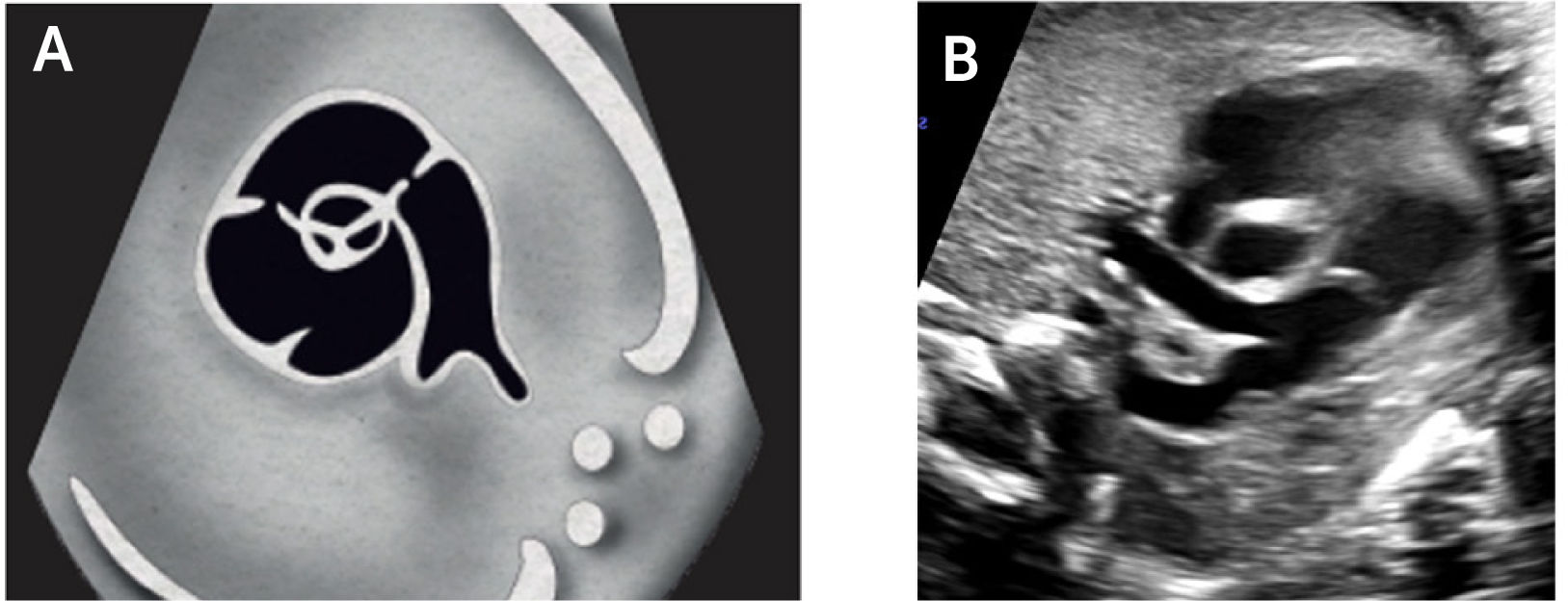
La visualización del corazón fetal en el examen de 11 a 14 semanas es factible de realizar vía trans abdominal desde las 12 semanas28. Con la utilización de transductores de alta frecuencia y utilizando Doppler color o Doppler de poder, es posible identificar adecuadamente la imagen de 4 cámaras, flujos de entrada y tractos de salida, especialmente la imagen de tres vasos (Figura 1 a, b, c). La imagen de 4 cámaras y tractos de salida forma parte integral de las guías clínicas para el examen del corazón fetal de la International Society of Ultrasound in Obstetrics and Gynecology (ISUOG).
La población considerada de riesgo representa las indicaciones clásicas de la ecocardiografía fetal y se pueden agrupar en indicaciones maternas y fetales (Tabla 1). Recientemente se han incorporado como grupos de riesgo los embarazos gemelares, especialmente los monocoriales, los que pueden tener un riesgo de presentar una CC de hasta 12 veces más29, y también los embarazos logrados con técnicas reproductivas de alta complejidad, especialmente ovo donación e inyección intracitoplasmática de espermatozoides (ICSI)30.
Indicaciones de ecocardiografía fetal
| Factores de riesgo fetal | Factores de riesgo materno |
|---|---|
| Embarazo in vitro y técnicas de alta complejidad | Teratógenos cardíacos-Carbonato de litio-Progestinas |
| Embarazo gemelar especialmente monocorial | -Anfetaminas-Alcohol-Anti convulsionantes |
| Anomalías extra cardíacas | -Alteraciones metabólicas maternas |
| Alteraciones del ritmo cardíaco | -Diabetes-Fenilcetonuria |
| Hidropesía fetal no inmune | Infecciones maternas-Rubéola |
| Sospecha de malformación fetal en ecografía nivel I | -Toxoplasmosis-Coxsackie-Citomegalovirus |
| Translucencia nucal aumentada | -Sarampión |
| Historia familiar de cardiopatías congénitas |
Sin embargo, entre los recién nacidos cardiópatas solo el 10% (5 a 20%) presenta alguna de estas indicaciones durante su vida intrauterina, el otro 90% (80 a 95%) de los recién nacidos cardiópatas se encuentra en la población general31–33. Las anomalías estructurales cardíacas son el principal hallazgo de la ultrasonografía prenatal34, por ello diferentes países y organizaciones han propuesto el “cribado de cardiopatías congénitas”, con el fin de abarcar toda la población, e incorporarlo a la rutina de los exámenes de ultrasonido realizados en el embarazo2–4.
Examen del corazón fetal: se distingue un examen de cribado2–4,35,36, y un examen diagnóstico detallado de las estructuras cardíacas fetales con ecocardiografía fetal diagnóstica. El primero, de acuerdo a las nuevas recomendaciones de la ISUOG, incluye, además del corte superior del abdomen y la visión de cuatro cámaras, la visualización de los tractos de salida2. En la ecocardiografía fetal diagnóstica, se agregan los planos de sección utilizados en la ecocardiografía de adultos e infantil además de la consejería frente al hallazgo de una CC37–39. Se describirá en detalle la metodología del examen de cribado del corazón fetal por ultrasonido, indicando la utilidad específica de cada uno de los modos utilizados en la evaluación del corazón normal y patológico.
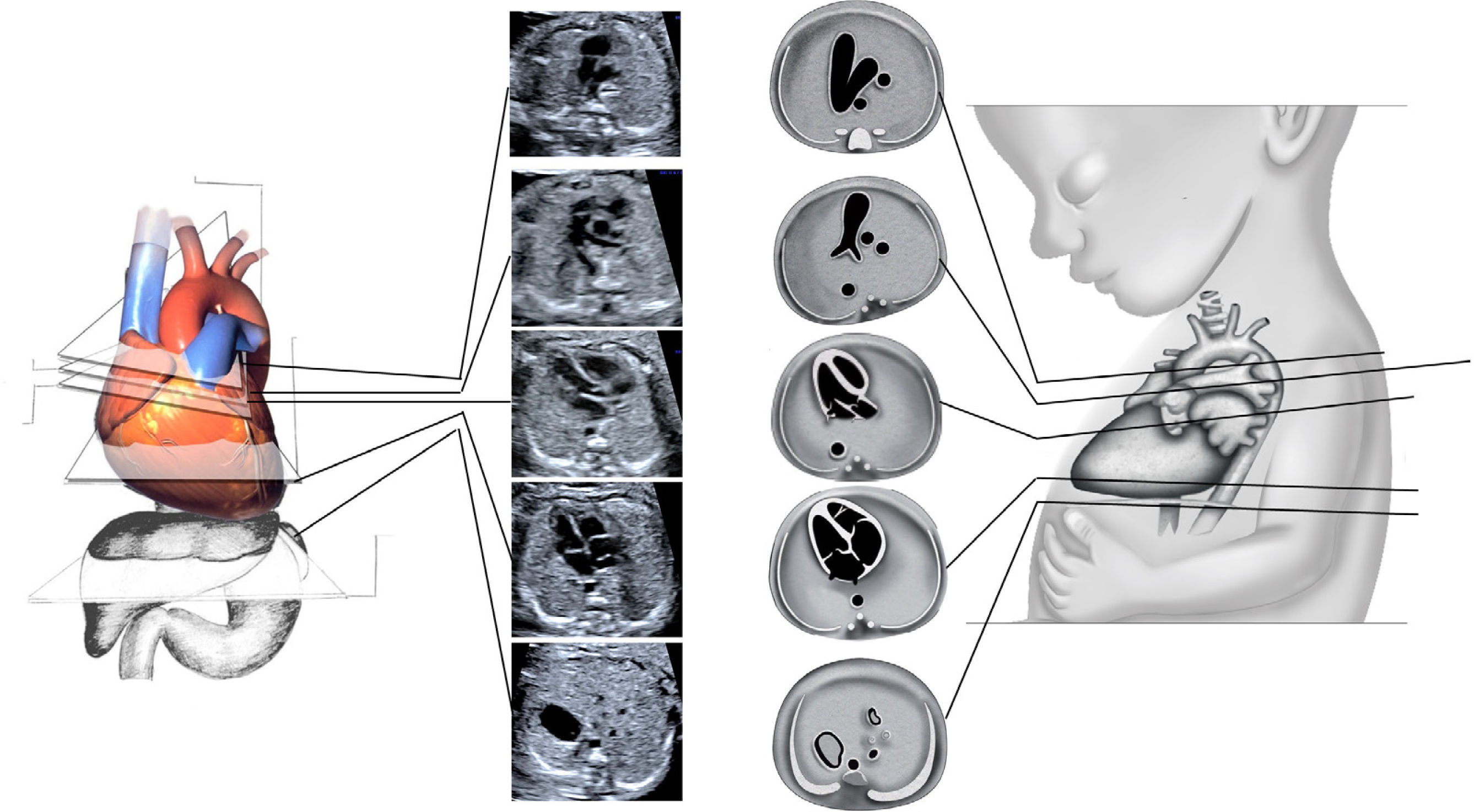
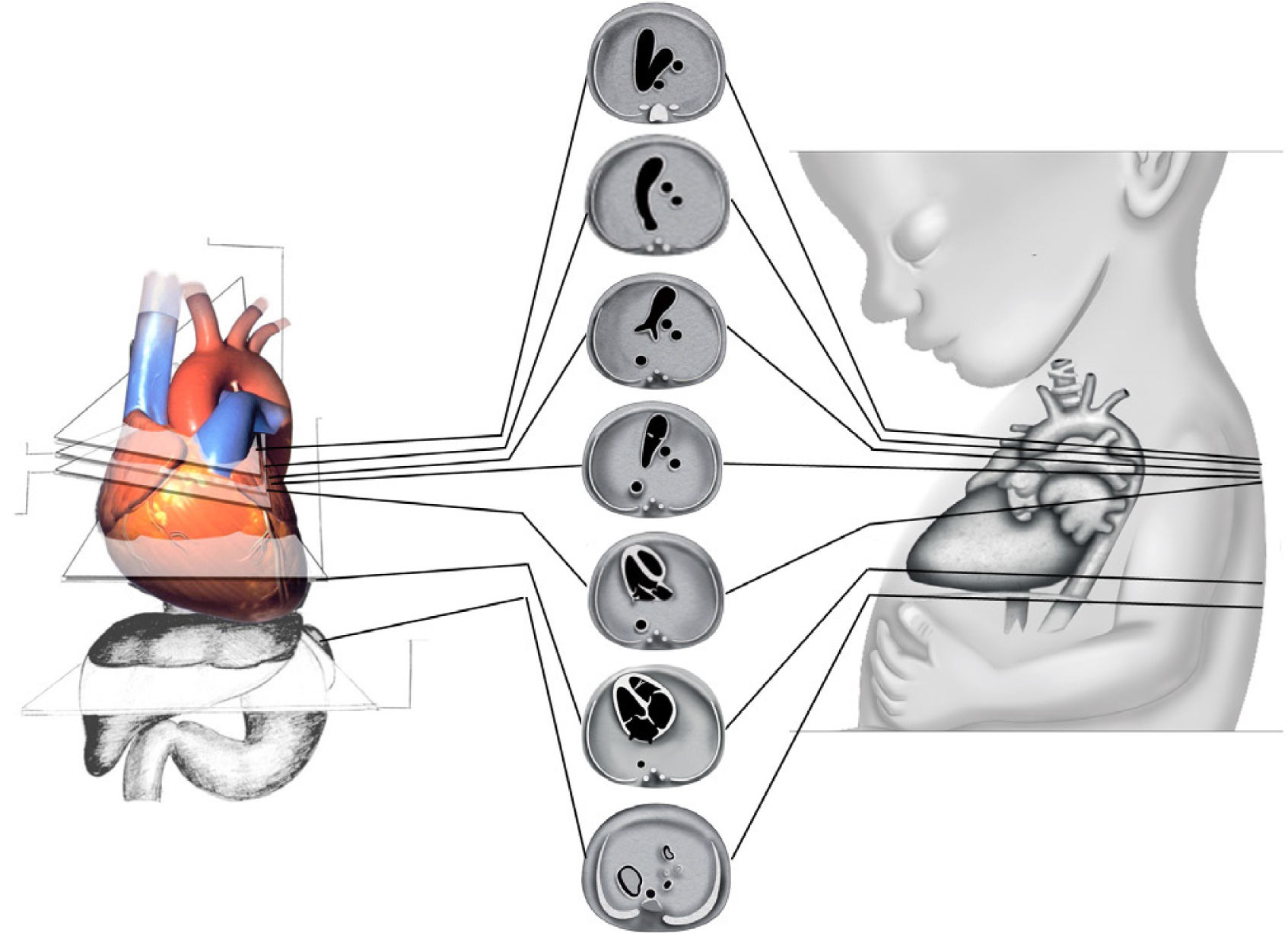
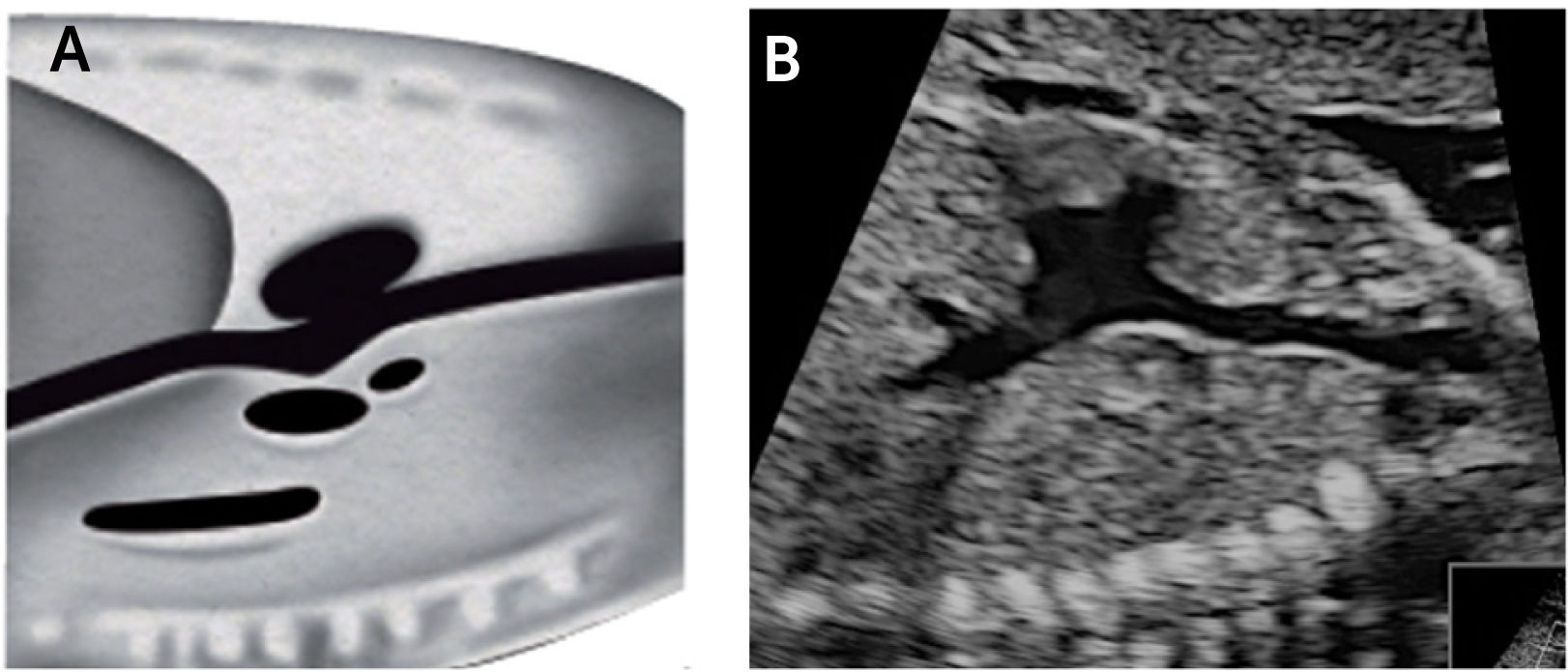
Examen de cribadoEn el examen se debe identificar la presentación y posición del feto in utero. El examen comienza con un plano axial en el abdomen, evidenciando la sombra gástrica a la izquierda y también con la identificación de aorta abdominal y vena cava inferior (Figura 2). Luego se asciende el plano de sección hacia cefálico del feto hasta obtener la visión de las cuatro cámaras, observando la punta del corazón hacia la izquierda con un área cardíaca cercana al 30% (Figura 2). El eje que forma el septum interventricular con el diámetro antero-posterior del tórax debe ser de 45°±20°. La combinación de estos dos planos de sección permite el diagnóstico de alteraciones del situs, alteraciones del área cardíaca y de aquellas que serán descritas en la imagen de cuatro cámaras2–4. Ascendiendo el plano de sección más hacia cefálico, se observa primero el tracto de salida de la arteria aorta y luego más hacia cefálico el tracto de salida de la arteria pulmonar (Figura 2). Al continuar el ascenso paralelo hacia el mediastino superior se evidencia el denominado plano de sección de los tres vasos y tres vasos tráquea (Figura 2). El ascenso de los planos se puede realizar en forma de planos paralelos sucesivos o angulando levemente el transductor hacia cefálico del feto2–4. La utilidad diagnóstica de cada uno de estos planos será descrita posteriormente. En la tabla 2, se indican las estructuras anatómicas que deben ser examinadas en las cuatro cámaras y tractos de salida del corazón fetal.
Planos de sección transversales ascendentes
Desde caudal a cefálico, abdomen, cuatro cámaras, tracto de salida de aorta, tracto de salida de pulmonar, tres vasos tráquea. Muñoz H, et al.4.
Cribado de cardiopatías congénitas
| Estructuras analizadas en cuatro cámaras y tractos de salida |
| Situs y visión general |
| Posición fetal |
| -Estómago y corazón a izquierda |
| -Área cardíaca un tercio del tórax |
| -Corazón a izquierda |
| -Eje cardíaco 45°±20° |
| -Cuatro cámaras |
| -Ritmo regular |
| -Sin hidropericardio |
| Aurículas |
| Dos aurículas de tamaño similar |
| -Flap de foramen ovale abre a izquierda |
| -Septum primum |
| -Al menos dos venas pulmonares en aurícula izquierda |
| Ventrículos |
| Dos ventrículos de tamaño similar |
| -Banda moderadora en ventrículo derecho |
| -Septum interventricular |
| Unión atrio ventricular y válvulas |
| Cruz del corazón |
| -Dos válvulas AV que abren libres |
| Válvula tricúspide más apical que mitral |
| Grandes vasos |
| Aorta tiene un arco del cual salen ramas, generalmente sale de VI |
| Pulmonar Un tronco que se divide en dos, generalmente sale de VD |
Siglas: AV: arterioventricular; VI válvula izquierda; VD: Válvula derecha.
Imagen de abdomen: se realiza un plano axial del tercio superior del abdomen, que sea lo más cercano a una circunferencia, se observan tres imágenes econegativas, desde izquierda a derecha, el estómago, la vena umbilical y la vesícula, no se deben observar los riñones. Por adelante de la columna y a izquierda se observa una imagen econegativa redonda que late, y corresponde a la arteria aorta. Más hacia adelante y a la derecha otra imagen similar, corresponde a la vena cava inferior (Figura 3).
Imagen de cuatro cámaras: se debe reconocer en primera instancia el situs cardíaco, área que ocupa el corazón y eje del mismo. El ritmo y la frecuencia cardíaca también deben ser parte del examen. El ápex está hacia la pared anterior del tórax, el ventrículo derecho es más anterior, el ventrículo izquierdo está más cerca de la columna. Ambas aurículas tienen apariencia y tamaños similares. El foramen oval abre hacia el atrio izquierdo. La “cruz del corazón” está formada por la parte más baja del tabique interauricular, la porción más alta del tabique interventricular, y lateralmente por el sitio de inserción de ambas válvulas auriculoventriculares. Se deben reconocer al menos dos venas pulmonares drenando en la aurícula izquierda, por lo que no basta con la observación en modo B, sino que es necesario evidenciar el flujo de entrada hacia la cámara auricular izquierda por medio del Doppler color.
Ambos ventrículos tienen tamaño similar por lo que para distinguirlos es necesario conocer características que los hacen particulares desde el punto de vista ecográfico, tales como que el ventrículo derecho es levemente más grande que el izquierdo, presenta un engrosamiento en la punta denominado banda moderadora, la inserción de la válvula tricúspide es levemente más apical que la mitral y que debido a la distribución muscular da la impresión que el ápex está formado solo por el ventrículo izquierdo (Figura 4). El septum interventricular ha de ser examinado con especial atención, ya que sus defectos no siempre son fáciles de evidenciar, por lo tanto, se debe insonar en un ángulo completamente perpendicular al septum, abarcando desde la cruz hasta la punta cardíaca, recorriendo desde la porción más anterior hacia lo posterior, y siempre se ha de complementar esta evaluación con Doppler color. Se deben también observar dos válvulas auriculoventriculares distintas, que abren separada y libremente.
Este plano de las cuatro cámaras permite pesquisar alteraciones de las cámaras, de los septum, y de los aparatos valvulares2–4,35. Sin embargo, muchas de las alteraciones denominadas ductus dependientes no son posibles de diagnosticar en este corte.
Imagen de tractos de salida: la guía ISUOG consideran estas imágenes como parte integral del cribado de malformaciones cardíacas. Entre las recomendaciones destaca determinar la normalidad de ambas arterias al observar: tamaño similar, la adecuada conexión ventrículo- arterial, cruce en los tractos de salida del ventrículo correspondiente y adecuada apertura de las válvulas arteriales.
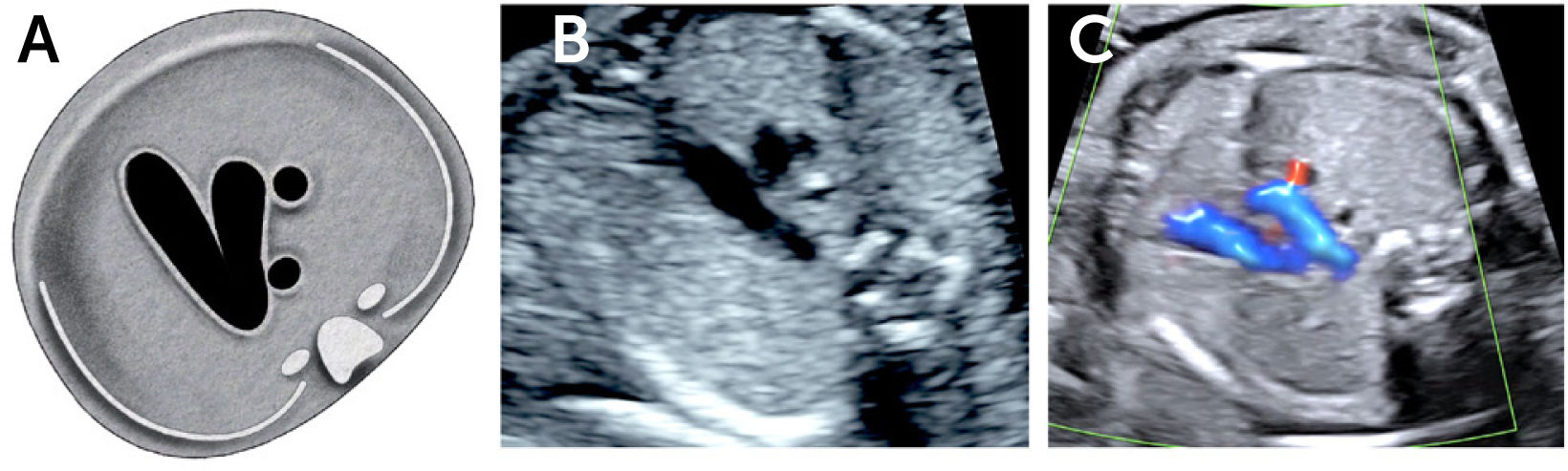
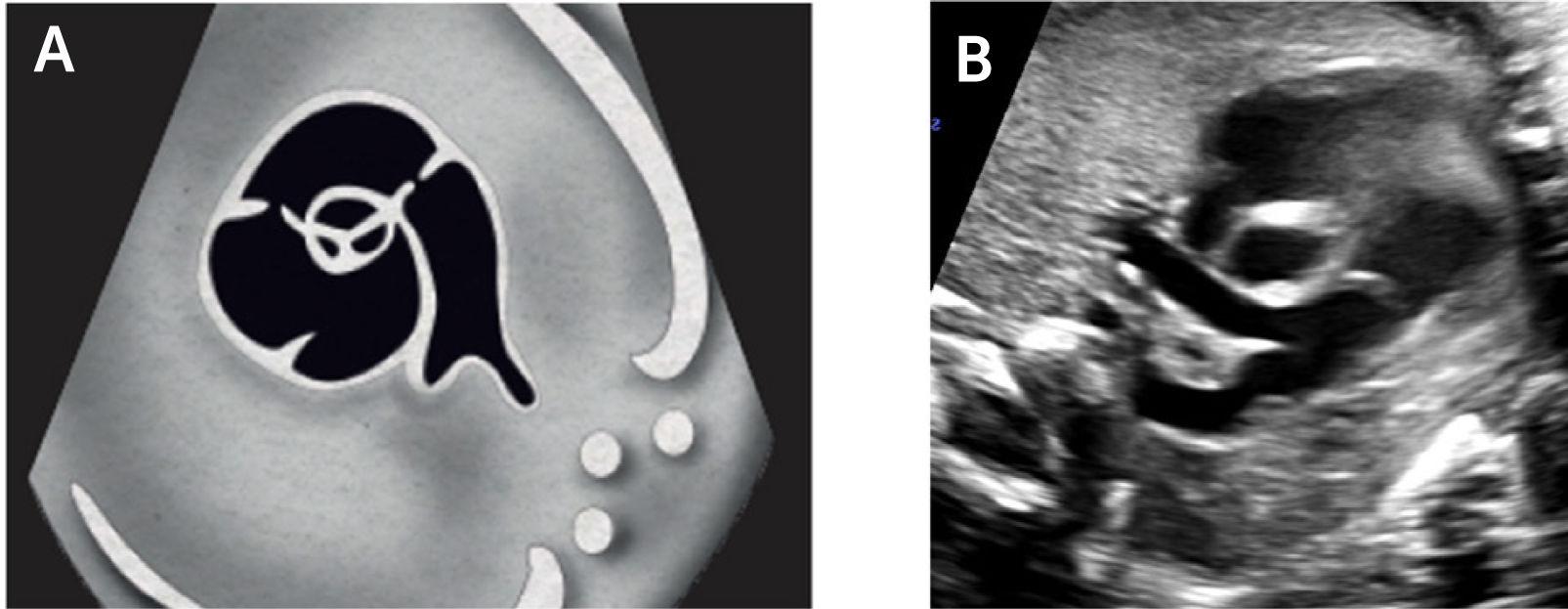
Imagen de cinco cámaras y tracto de salida izquierdo: es una modificación de la imagen de cuatro cámaras y se obtiene inclinando el plano de sección más hacia cefálico. Permite la visualización del tracto de salida de la arteria aorta entre aurículas y ventrículos, y se puede visualizar la válvula sigmoidea aórtica2–4 (Figura 5).
La visión del tracto de salida izquierdo se obtiene rotando el transductor, desde el corte anterior, de modo que el plano de sección esté ubicado entre la cadera izquierda y el hombro derecho del feto. Esta imagen muestra a la arteria aorta saliendo desde el ventrículo izquierdo. La pared anterior de la aorta aparece en un continuo con el septum interventricular, por lo que éste plano de sección permite el diagnóstico de defectos ventriculares septales, que pasan desapercibidos en el corte de cuatro cámaras. La válvula mitral se continua con la pared posterior de la arteria aorta2–4. Las válvulas sigmoideas aórticas deben moverse libremente.
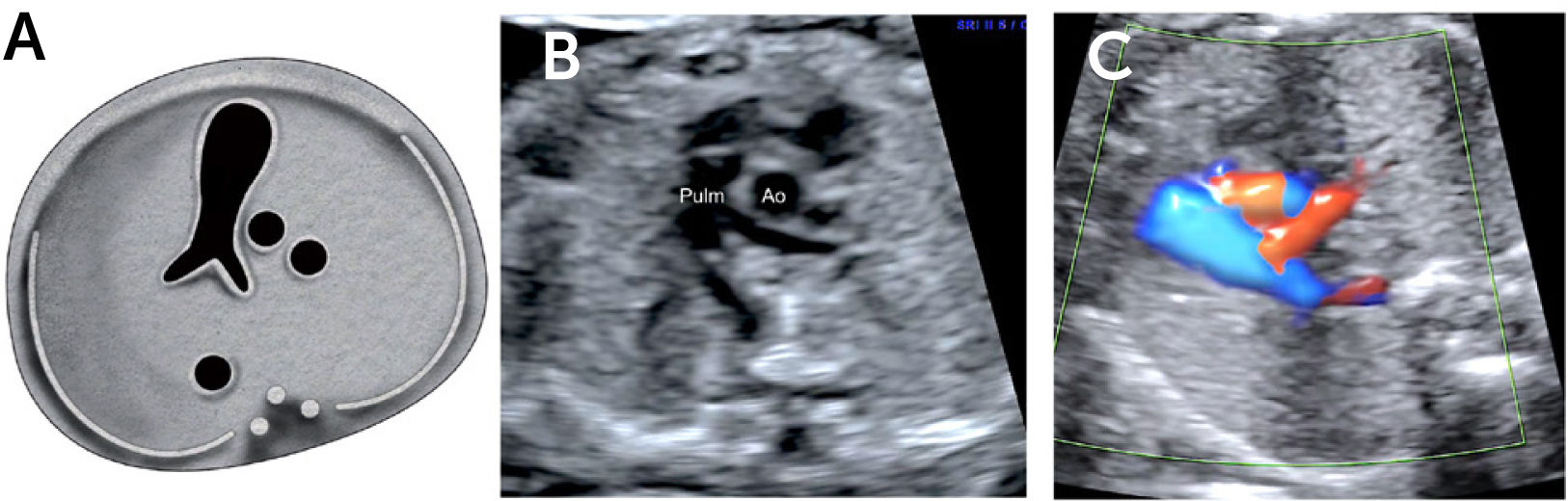
Imagen de arteria pulmonar y tracto de salida derecho: al ascender en forma paralela desde cuatro cámaras se visualiza la arteria aorta y luego la arteria pulmonar dividiéndose en sus dos ramas. También es posible obtener el tracto de salida derecho a partir del plano del tracto de salida izquierdo. Se puede obtener el tracto de salida de la cavidad ventricular derecha desplazando levemente el transductor hacia la derecha y hacia cefálico del feto, obteniendo la visualización de la arteria pulmonar y su válvula sigmoidea, saliendo desde el ventrículo derecho. De aquí, se dirige hacia la izquierda y más posterior que la aorta ascendente, para bifurcarse luego en sus ramas y su continuidad con el ductus arterioso que la conecta con la aorta descendente2–4 (Figura 6).
Imagen de los tres vasos y tres vasos tráquea: este plano se obtiene ascendiendo el plano de sección hacia el mediastino superior en forma paralela al plano de las cuatro cámaras pasando por aorta y pulmonar. En este corte se evidenciará la arteria pulmonar a izquierda la región ístmica de la arteria aorta y la vena cava superior a derecha, se debe evaluar la relación entre sí, la relación con la tráquea, tamaño, alineamiento y disposición (Figura 7). Este plano, fácil de realizar, es de gran importancia en el diagnóstico de las lesiones obstructivas de los grandes vasos, así como en defectos de conexión de estos2–4,39–43. También en este plano es posible evaluar el tamaño del timo, de especial utilidad en la sospecha de microdeleción 22q1138,42.
Doppler colorLa utilización del Doppler color es parte esencial en el cribado de cardiopatías congénitas2–4. Desde el punto de vista técnico se debe utilizar una caja de color lo más pequeña posible que permita ver la estructura deseada. Permite la observación de estructuras normales, venas pulmonares, arterias aorta y pulmonar, así como la visualización de defectos septales y estenosis o insuficiencias valvulares, por lo que es parte integral de la ecocardiografía fetal cumpliendo un rol diagnóstico que no debe ser desestimado2 (Figuras 1, 4 a 7).
Utilidad del cribadoRecientes investigaciones, en centros especializados a población de alto riesgo, demuestran que el diagnóstico antenatal de malformaciones cardíacas tiene una sensibilidad de alrededor de 90%44, existiendo cardiopatías de difícil diagnóstico, ya sea por su evolutividad, o por ser leves en su expresión. Nuestra experiencia muestra que se identificaron adecuadamente el 88% de las cardiopatías congénitas mayores45.
El objetivo de la realización del cribado es maximizar la sospecha diagnóstica de CC, mediante la incorporación del ultrasonido en el examen de rutina durante el embarazo. Ante el hallazgo de una alteración estructural, funcional o del ritmo, es necesario derivar al paciente para una ecocardiografía fetal, que involucra aspectos técnicos y asesoramiento, idealmente realizado por un equipo multidisciplinario de cardiología perinatal.
Ecocardiografía fetal diagnósticaLa ecocardiografía fetal está definida como el examen ultrasonográfico detallado del corazón fetal, el que permite, antes del nacimiento, identificar y caracterizar alteraciones estructurales, del ritmo y de la función27,37,38.
El examen ecocardiográfico es realizado por especialistas en medicina materno fetal, cardiólogos-pediatras o especialistas en cardiología fetal, debidamente entrenados e idealmente certificados3.
Técnicamente el examen se puede realizar en cualquier momento después de las 12 semanas de edad gestacional, siendo el mejor momento entre las 25 y 30 semanas, dependiendo de la necesidad médica de un pronto diagnóstico y valorando la ansiedad de los padres, versus la posibilidad técnica de realizar un examen completo. De tal forma que, cuando existe la sospecha de una malformación cardíaca en el segundo trimestre, el examen se puede realizar de inmediato, pero cuando la indicación es por riesgo elevado de aneuploidía en el examen de 11 a 14 semanas, por un resultado alterado en el estudio de DNA fetal en sangre materna o historia familiar de cardiopatía, el examen debe ser diferido para al menos las 13 semanas, e idealmente a las 16 o 20 semanas de gestación.
La ecocardiografía está reservada a indicaciones que incluyen indicaciones maternas, como historia familiar de cardiopatías y enfermedades auto inmunes, a indicaciones fetales como la sospecha de aneuploidía, de malformación cardíaca, de malformación extra cardíaca, de arritmias, etc., en un ultrasonido de rutina,15,25–38 (Tabla 1). Algunas indicaciones recientes de ecocardiografía son embarazo gemelar, fertilización in vitro y exposición a teratógenos, entre otras (Tabla 1).
El examen comienza, como en el examen de cribado, con planos axiales ascendentes sucesivos desde el abdomen, cuatro cámaras, tracto de salida de la arteria aorta y luego más hacia arriba el tracto de salida de la arteria pulmonar (Figura 8). En estos planos es necesario rotar y ascender levemente el transductor de modo de obtener una visión detallada de los tractos de salida que incluya el tronco y la bifurcación de la arteria pulmonar hasta el ductus arterioso (Figura 8). Al continuar el ascenso hacia el mediastino superior se evidencia el denominado plano de sección de los tres vasos y tres vasos tráquea (Figura 8).
Planos de sección transversales ascendentes
Desde caudal a cefálico, abdomen, cuatro cámaras, tracto de salida de aorta, tracto de salida de pulmonar desde la emergencia, división en ramas, confluencia en ductus arterioso, y tres vasos tráquea. Muñoz et al47.
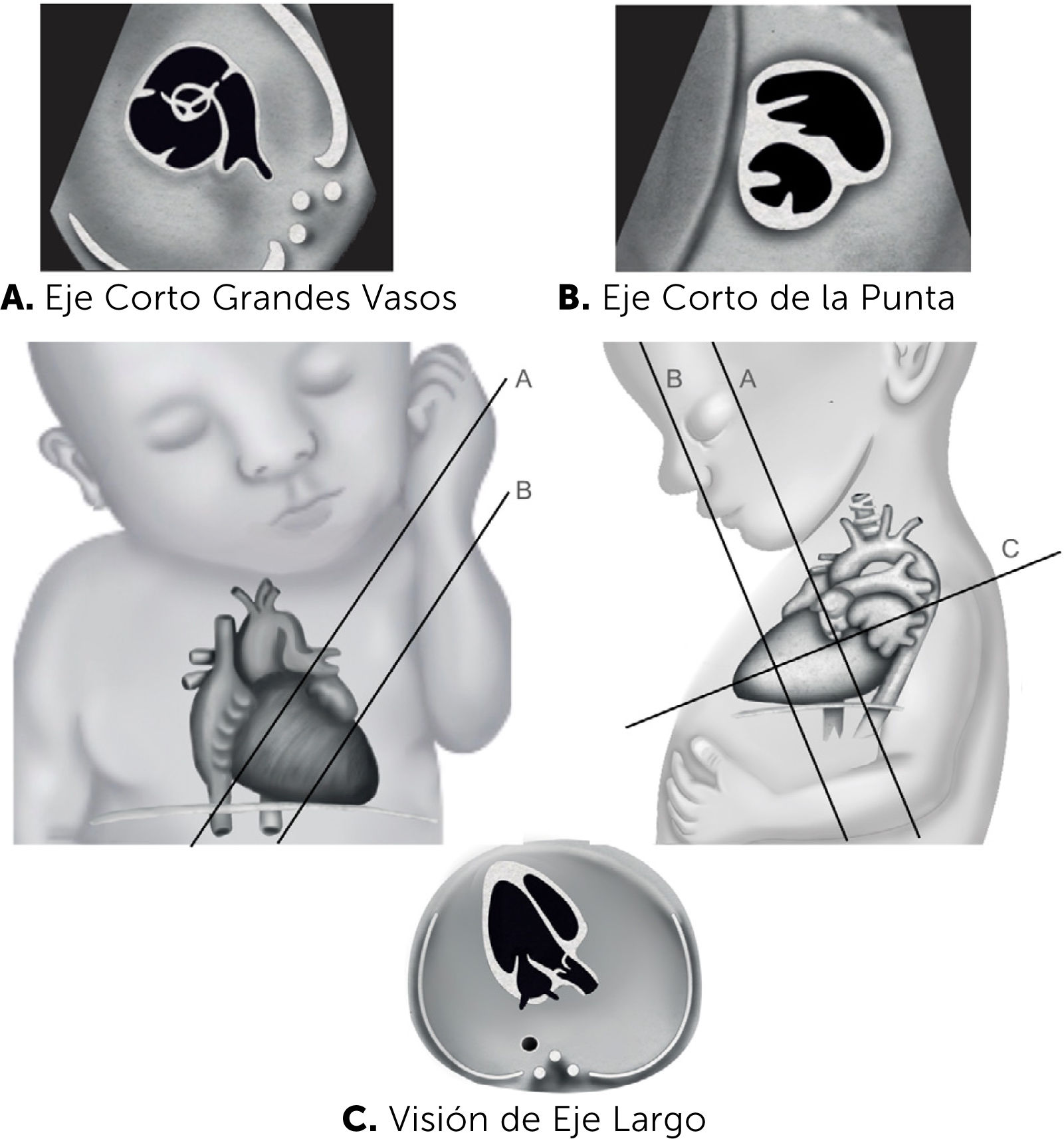
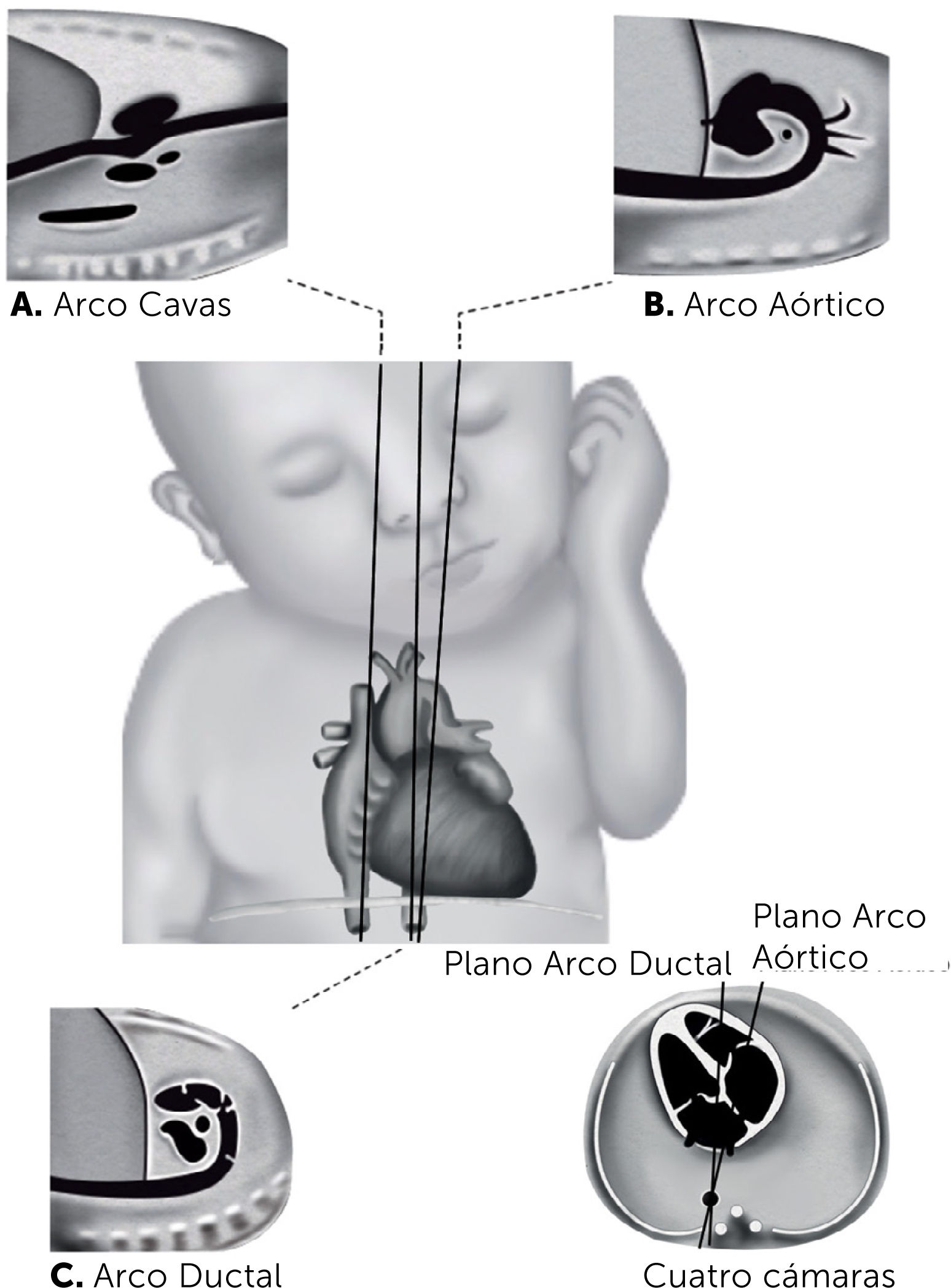
A los planos de cribado se adicionan, los ejes cortos y los sagitales. Los ejes cortos se obtienen en la aproximación lateral de la visión de cuatro cámaras, rotando el transductor en 90 grados. De esta forma al mover el plano de sección hacia la punta del corazón, se obtiene el eje corto de la punta, y al desplazar el transductor hacia la emergencia de los grandes vasos, se obtiene la visión de eje corto de los grandes vasos o de la base (Figura 9). Los planos sagitales se obtienen a partir de la imagen de cuatro cámaras, utilizando como punto de rotación la arteria aorta, y luego rotando el transductor en 90 grados. Realizando ajustes menores de la angulación entre 10 y 20 grados, es posible identificar el arco aórtico, arco ductal y eje de las venas cava, superior e inferior (Figura 10).
Planos de sección ejes cortos
A. Eje corto grandes vasos. B, Eje corto de la punta. C, Visión de eje largo. Muñoz et al47.
Planos de sección sagitales
A, Visión de venas cavas. B, Arco aórtico; C, Arco ductal. Muñoz et al47.
Eje corto. Se obtiene rotando el transductor en 90 grados, a partir de los planos de eje largo, de modo que el plano de sección sea perpendicular a éste. Permite la visualización de un corte de sección transversal de las cavidades ventriculares hacia la punta del corazón. En este corte es posible identificar los músculos papilares de la válvula mitral y, más hacia cefálico, las válvulas auriculoventriculares (Figura 11).
Eje corto de grandes vasos. Es el mismo plano de sección del corte anterior pero más hacia cefálico y hacia la base del corazón. Se visualiza la arteria aorta en un plano transversal y el tracto de salida del ventrículo derecho el que se continúa con la arteria pulmonar, la que se bifurca en sus ramas, incluido el ductus arterioso. (Figura 12). Este plano de sección es de gran utilidad en el diagnóstico de lesiones obstructivas del tracto de salida derecho.
Arco aórtico. No corresponde a un plano ecotomográfico clásico. Se obtiene realizando un plano de sección longitudinal del feto hacia la izquierda de la columna vertebral. Se observa parte de la aurícula derecha, aorta ascendente, cayado y aorta torácica. Se visualizan también las arterias subclavias, carótida común izquierda y tronco braquiocefálico (Figura 13). Esta imagen es de utilidad en el diagnóstico de transposición de grandes vasos, interrupción del cayado aórtico y coartación aórtica.
Arco ductal. Desde el plano anterior se desplaza el transductor a derecha con lo que se obtiene el tracto de salida del ventrículo derecho con la arteria pulmonar la que se continúa con la arteria aorta ístmica a través del ductus arterioso (Figura 14). Este plano tomográfico es de utilidad en las lesiones obstructivas del ventrículo derecho y en los casos de constricción del ductus arterioso.
Eje largo de venas cavas. Esta imagen tampoco corresponde a un corte ecotogomográfico clásico. Se obtiene haciendo un corte longitudinal del feto y desplazando el transductor a derecha de la columna. Se observa la aurícula derecha donde llegan las venas cava inferior y superior. Una modificación de este plano permite visualizar en sentido longitudinal la vena umbilical intra hepática, el ductus venoso y la vena cava inferior en un plano (Figura 15). Este plano de sección es de gran utilidad en el diagnóstico de síndromes de isomerismo cardíaco.
Biometría de las estructuras de corazónLa medida de dispersión más utilizada en la actualidad para evaluar los diferentes parámetros, corresponde a Z-Score. La biometría del corazón y de las diferentes estructuras que lo componen, son parte esencial de la ecocardiografía fetal, y si bien no es perentorio incluir todas las mediciones, si es necesario realizar la medición y Z-Score de todas las estructuras patológicas, en modo B y/o modo M21,48–51. En una reciente publicación de Sepúlveda y Crispi, están detalladas cuales estructuras cardíacas medir y cómo hacerlo52.
Evaluación de la función cardíaca fetalEn presencia de signos de insuficiencia cardíaca, patologías que puedan alterar la precarga, post carga o inotropismo, o frente a malformaciones que puedan provocar insuficiencia cardíaca, es necesario realizar una evaluación funcional del corazón y de la hemodinamia fetal. Los métodos más utilizados son evaluación de los tamaños del corazón o cavidades, fracción de acortamiento, movimientos longitudinales de los anillos valvulares, velocimetría Doppler de venas y válvulas aurículo ventriculares, incluido índice de Tei, y también nuevos métodos que incluyen strain y el análisis de 24 planos propuesto por DeVore53–63. Mediante la utilización de estos métodos se puede evaluar la hemodinamia fetal e identificar como cambios en el gasto cardíaco son causados por alteraciones de la precarga, post carga o inotropisimo, y como estos cambios impactan en el bienestar fetal. La evaluación de la función del corazón fetal e insuficiencia cardíaca están descritas en detalle en publicaciones recientes de DeVore, Muñoz y Solari64–66.
Ritmo normal y diagnóstico de arritmiasLa evaluación del ritmo normal y de sus alteraciones, se puede analizar utilizando modo M (aurícula y ventrículo) y Doppler pulsado simultáneo de vena y arteria pulmonar o en flujo de entrada y salida de ventrículo izquierdo. Es posible diagnosticar ritmos irregulares, taquicardias y bradicardias. Estas son tratadas en extenso en una revisión de Carvalho et al.67.
Medicina de precisión en cardiología perinatalEl Instituto Nacional de Salud (NIH) de Estados Unidos la define como una forma de acercamiento a la prevención, diagnóstico, pronóstico y tratamiento de las enfermedades que considera la variabilidad individual incluyendo la genética, el ambiente, la metabolómica, la proteómica y el estilo de vida68. La capacidad de recolectar, integrar y analizar grandes cantidades de datos relevantes es la base para desarrollar un “ecosistema de medicina de precisión” en el cual los recursos genéticos, bioquímicos y clínicos son compartidos entre los investigadores, los clínicos y los pacientes69,70.
La aplicación de los principios de la medicina de precisión en cardiología perinatal ha tenido un incremento progresivo en los últimos años gracias a la irrupción de las técnicas de biología molecular en el diagnóstico prenatal. Esto se ha reflejado en que hemos asistido a un explosivo aumento de publicaciones relacionadas con genética perinatal y manejo de cardiopatías congénitas.
El desarrollo embrionario del corazón es un proceso muy complejo que depende de la perfecta organización temporo-espacial de factores genéticos, epigenéticos y ambientales. Con el desarrollo tecnológico, fundamentalmente con el avance de la secuenciación masiva, su progresiva disponibilidad técnica y la disminución en los costos, se han logrado identificar más de 1100 genes en diferentes vías relacionadas con el desarrollo del corazón71.
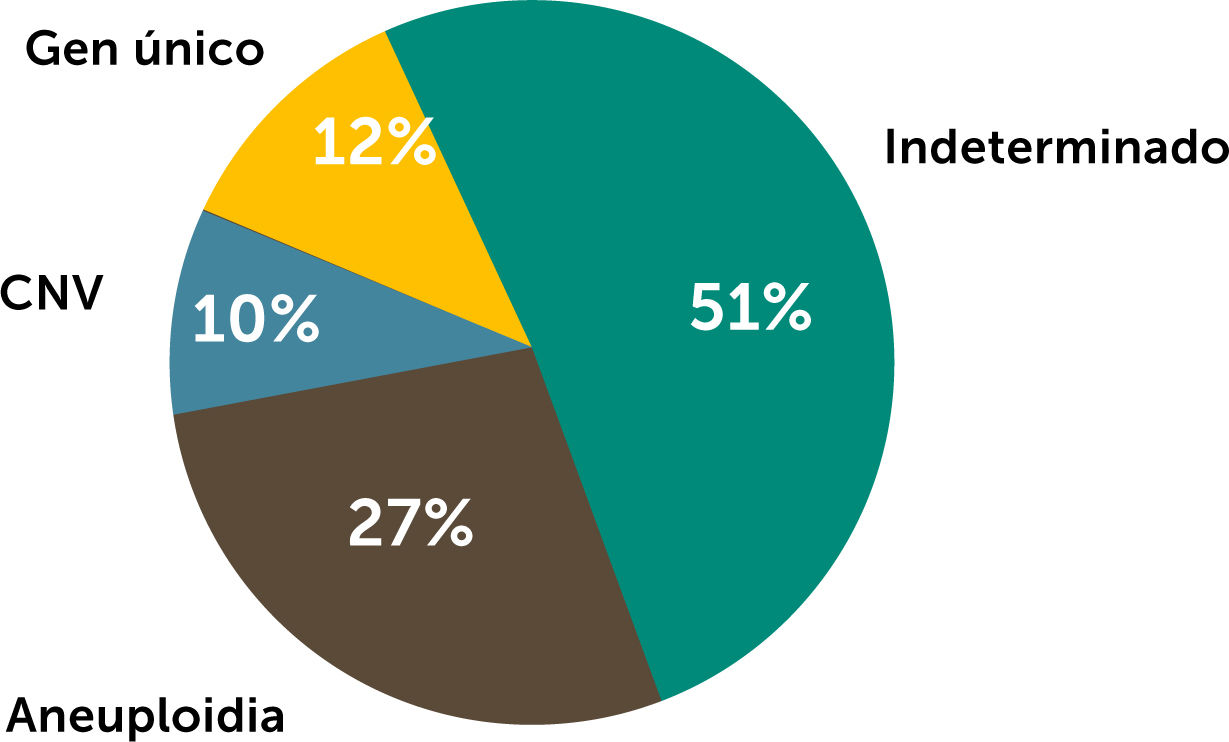
La incorporación de estas técnicas a la práctica clínica, incluyendo la hibridación genómica comparativa (CGH, por sus siglas en inglés), paneles específicos y secuenciación completa de exoma y genoma, ha permitido demostrar que aproximadamente en el 23 a 29% de las CC ocurren por alteraciones cromosómicas72,73, 10 a 15% por alteración del número de copia72–76, y el 2 a 12% por alteraciones de gen único27,72,73,77–81 (Figura 16). Por otra parte, hay cardiopatías con mayor asociación a alteraciones genéticas como la interrupción de arco aórtico (70%), tetralogía de Fallot (25%), y canal auriculoventricular (12%)73. Sin embargo, aún no se ha podido descifrar por completo el panorama molecular de las cardiopatías congénitas.
El grupo de pacientes cardiópatas con afecciones genéticas (excluidas las alteraciones cromosómicas), comparado con el grupo de los que no las tiene, presenta un significativo incremento en la mortalidad intrauterina, así como en la mortalidad al año de vida, y además tiene un mayor deterioro en el neurodesarrollo71.
Experiencia de un centro privadoEn un periodo de cinco años se revisaron 9823 nacimientos en nuestro centro. Cientotreinta y siete (1,4%) recién nacidos presentaron CC; 30 correspondían a una CC mayor. Veintiseis de estos pacientes fueron sometidos a un ultrasonido en nuestro centro, diagnosticándose la CC mayor in utero en el 89% (23/26). En los recién nacidos portadores de una CC mayor pesquisada in utero, el 44% (10/23) tuvo diagnóstico de precisión, de ellos, 6 de 10 fueron alteraciones cromosómicas y 4 de 10 eran debido a enfermedades de gen único80. En este último grupo la mortalidad fue 100%.
El número de pacientes con diagnóstico de precisión en cardiología perinatal ha aumentado significativamente en el último año (Tabla 3) (Figura 17), y el riesgo de etiología genética es mayor para algunas cardiopatías y también cuando están asociadas a malformaciones extra cardíacas o síndromes. Este incremento se debe, en parte a la derivación, a la caída de los costos de las pruebas moleculares, pero sobre todo al trabajo en equipo realizado en el Centro de Enfermedades Raras y la Unidad de Medicina Materno Fetal de Clínica Las Condes.
Diagnóstico perinatal de precisión en cardiopatías congénitas en Clínica Las Condes
| Enfermedad de gen único/deleción | n | Cardiopatía congénita |
|---|---|---|
| Síndrome de Noonan | 2 | Miocardiopatía hipertrófica |
| Cornelia de Lange | 1 | Doble tracto salida ventrículo derecho |
| Síndrome Costello | 1 | Miocardiopatía hipertrófica |
| CHARGE | 2 | Doble tracto salida ventrículo derecho |
| Síndrome Kabuki | 1 | Ventrículo único |
| Neurofibromatosis Tipo II | 1 | Insuficiencia cardíaca |
| 6p - Síndrome | 1 | Hipoplasia de arco aórtico |
| 4p - Síndrome | 1 | Insuficiencia cardíaca |
| Atrofia muscular espinal | 1 | Coartación de Aorta |
Periodo enero 1995 a noviembre 2022.
Exoma fue la técnica utilizada en todos los casos.
La medicina de precisión, no solo ha posibilitado mejoras en el diagnóstico, sino también permite definir de mejor manera el pronóstico. Además, el diagnóstico de precisión realizado en etapas precoces del embarazo, permite impactar sobre el curso de la enfermedad ya que, por una parte, dado que las enfermedades genéticas pueden progresar rápidamente, es posible reducir la morbilidad y mortalidad, determinando el mejor momento para el parto, y por otra parte adecuar los esfuerzos terapéuticos cuando se estime necesario83.
En cuanto a terapia, la medicina de precisión también ha posibilitado, mediante la técnicas de diagnóstico genético preimplantacional, la selección y transferencia de embriones sanos, no portadores de los genes de la enfermedad, como ocurre por ejemplo en miocardiopatías hipertróficas familiares, rabdomiomas asociados a esclerosis tuberosa, síndrome QT prolongado, entre muchas otras.
La edición de genética de células somáticas, en embriones, fetos, o recién nacidos, es teóricamente posible con técnicas como CRISP/Cas9. Esto ha abierto grandes expectativas para tratamientos futuros84,85, pero a su vez importantes dilemas éticos86. Si bien la medicina de precisión en cardiología perinatal ha permitido grandes avances en la prevención, diagnóstico y pronóstico de cardiopatías congénitas, su aporte en terapia está aún por llegar.
ConclusionesLas cardiopatías congénitas son las malformaciones más frecuentes, y, a la vez, las menos frecuentemente diagnosticadas. Sin embargo, la incorporación de las guías clínicas para el cribado des cardiopatías congénitas, han permitido mejorar significativamente el diagnóstico prenatal en Chile y el mundo. Asimismo, la incorporación de la técnica de ecocardiografía fetal tanto en lo estructural, análisis del ritmo y de la función han permitido identificar a los fetos cardiópatas de mayor riesgo.
Por su parte, la incorporación de la medicina de precisión en la cardiología perinatal, permite un diagnóstico certero en cerca del 50% de los casos, permitiendo establecer de mejor manera el pronóstico, y de esta manera optimizar el manejo de los pacientes cardiópatas no nacidos.
Es fundamental destacar la importancia de trabajar coordinadamente entre equipos cuando surgen sospechas de malformaciones congénitas ya sea detectadas in utero o por antecedentes familiares y hacer las interconsultas correspondientes. El desarrollo de técnicas de biología molecular ha permitido a los genetistas identificar muchas de las causas de estas enfermedades y junto a la ecocardiografía fetal detallada han permitido abordar tempranamente estas afecciones.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses
Referencias no citadas