El COVID-19 forma parte de la familia de los virus conocida como Coronaviridae. El nuevo patógeno β-coronavirus del subgénero Sarbecovirus se denominó inicialmente como el nuevo coronavirus (2019-nCoV); fue identificado en un brote de neumonía en Wuhan. Los pacientes desarrollan alteraciones en el sistema respiratorio, pudiendo llegar a padecer neumonía severa, edema pulmonar o síndrome de dificultad respiratoria aguda.
ObjetivoRevisar la evidencia científica disponible relacionada con el cuidado del sistema respiratorio, estableciendo pautas generales de tratamiento.
MétodosRevisión narrativa de la literatura. Se realizó una búsqueda, selección y revisión de artículos originales y secundarios escritos en inglés o español, en las diferentes bases de datos: NCBI, CENTRAL, MEDLINE y EMBASE, publicados hasta marzo del 2020.
ResultadosNo se ha definido un tratamiento específico ante la nueva enfermedad, teniendo como principal medida terapéutica el control sintomático. Se recomienda utilizar elementos de bioseguridad: gafas, gorros, guantes, bata larga impermeable, tapabocas de alta eficiencia en personal sanitario (FFP2 o N95). En el paciente sintomático, utilizar tapabocas quirúrgico, jabón hospitalario, toallas de papel y alcohol al 70% o isopropílico. Utilizar oxígeno mediante sistemas de bajo flujo. En ventilación mecánica, programar modos VCP o VCV, Vt 4-6ml/kg, Fr≤35, FiO2 para PaO2 de 60mmHg o SpO2 de 92-96%, PEEP 12-17cmH2O, ventilación prono si PAFI≤150 con una relación 16/8 o 18/6, óxido nítrico 5-20ppm.
ConclusionesUsar equipos de bioseguridad con el fin de interrumpir la transmisión. En hipoxemia, utilizar sistemas de oxigenoterapia a bajo flujo. Usar estrategias de protección pulmonar, disminución de volúmenes corrientes, presiones de meseta y frecuencias respiratorias, implementación de valores de PEEP elevados, bajos valores de presión de conducción y ventilación en prono, los cuales han demostrado mejoraría en la hipoxemia y la sobrevida en pacientes con síndrome de dificultad respiratoria aguda.
COVID-19 is part of the family of viruses known as Coronaviridae. The new pathogen β-coronavirus of the subgenus Sarbecovirus was initially named as a novel coronavirus (2019-nCoV), identified in a pneumonia outbreak in Wuhan. Patients developed alterations in the respiratory system leading to severe pneumonia, pulmonary oedema, and acute respiratory distress syndrome.
ObjectiveTo review the available scientific evidence related to the care of the respiratory system in order to establish general treatment guidelines.
MethodsNarrative review of the literature was carried out that included a search, selection, and review of original and secondary articles written in English or Spanish in the different databases: NCBI, CENTRAL, MEDLINE and EMBASE published up to March 2020.
ResultsNo specific treatment for the new disease has been defined, with symptomatic control as the main therapeutic measure. The use of biosecurity elements, such as goggles, hats, gloves, long waterproof aprons, high efficiency masks for healthcare personnel (FFP2 or N95) is recommended. In symptomatic patients use surgical masks, hospital soap, paper towels, and 70% alcohol or isopropyl alcohol. Use oxygen through low flow systems. A mechanical ventilation program in VCP or VCV modes, Vt 4-6ml/Kg, Fr≤35, FiO2 for PaO2=60mmHg or SpO2 92-96%, PEEP 12-17cmH2O, prone ventilation if PAFI≤150 with ratio 16/8 or 18/6, nitric oxide 5-20ppm.
ConclusionsUse biosecurity equipment in order to prevent transmission. In hypoxaemia use low flow oxygen therapy systems. Use lung protection strategies, decrease in tidal volumes, plateau pressures and respiratory rates, plus implementation of high PEEP values, low conduction pressure values and prone ventilation. These have been shown to improve hypoxaemia and survival in patients with acute respiratory distress syndrome.
En diciembre del 2019 se inició un brote de neumonía de causa desconocida en Wuhan, que se extendió rápidamente por toda China1,2. Se confirmó que el agente causal de esta enfermedad es un virus que forma parte de una cepa diferente a la observada en el síndrome de Medio Oriente y el síndrome respiratorio agudo severo (SARS)3. El nuevo patógeno β-coronavirus se denominó inicialmente como el nuevo coronavirus (2019-nCoV), pero el 12 de enero de 2020 la Organización Mundial de la Salud (OMS) lo denomina coronavirus 2019 (COVID-19)4. Informes epidemiológicos demostraron una alta infectividad de persona a persona en entornos sociales, familiares y hospitalarios. Ante este rápido aumento de nuevos casos a nivel mundial, la OMS declaró el estado de pandemia5.
Hasta ahora no se ha definido un tratamiento específico ante la nueva enfermedad, teniendo como principal medida terapéutica el control sintomático. A pesar de ello, el rápido deterioro de la condición de salud de los contagiados demuestra la pobre eficacia del tratamiento sintomático. En general, los pacientes desarrollaron alteraciones en el sistema respiratorio, llevándolos a neumonía severa, edema pulmonar, síndrome de dificultad respiratoria aguda (SDRA) o insuficiencia orgánica múltiple1,6. En la actualidad, la información disponible acerca de las características clínicas del COVID-19 es escasa; la mayoría de la evidencia científica disponible se basa en la experiencia de los diversos grupos de clínicos e investigadores que han hecho frente a la pandemia. Por tanto, el objetivo de este manuscrito es revisar la evidencia científica disponible relacionada con el cuidado del sistema respiratorio y establecer las pautas generales de tratamiento.
MétodosSe realizó una revisión narrativa de la literatura, para identificar la información más relevante hasta marzo del 2020 sobre la infección de COVID-19, en relación con la etiología, la prevención, el tratamiento y los escenarios de cuidado intensivo. Se realizó la búsqueda en las bases de datos NCBI, CENTRAL, MEDLINE y EMBASE; adicionalmente, se realizó una búsqueda en bola de nieve para identificar artículos potencialmente relevantes. La estrategia de búsqueda fue específica para cada base de datos e incluyó una combinación del encabezado del tema COVID-19 y los términos de texto libre para nuevo coronavirus 2019, 2019-nCoV, enfermedad respiratoria, neumonía, enfermedades infecciosas, ventilación mecánica, oxigenoterapia y bioseguridad.
Se revisaron artículos originales y secundarios de cualquier diseño, que incluyeran las palabras clave en parte del título o resumen, escritos en inglés o español, que estuvieran publicados en revistas de ciencias de la salud. Inicialmente, todos los resúmenes de artículos potencialmente relevantes fueron revisados. Si cumplía con los criterios de inclusión mencionados, el artículo era analizado por los investigadores y posteriormente se realizaba una extracción y clasificación de los datos más relevantes, dependiendo del diseño del estudio, y posteriormente se procedió a la elaboración del presente manuscrito.
Al considerarse un estudio de fuente secundaria no se precisó la aprobación por un comité de ética en investigación; sin embargo, se respetó la propiedad intelectual de los autores de los artículos incluidos, mediante la referenciación bibliográfica.
ResultadosCOVID-19: genoma y sus relacionesEl COVID-19 forma parte de la familia de los virus conocida como Coronaviridae, los cuales tienen un genoma de ácidos ribonucleicos (ARN) en sentido positivo, con una cadena sencilla que podría variar entre 26 y 32kb de longitud7. A lo largo de la historia, se han logrado identificar hospedadores aviares y mamíferos (camellos, murciélagos, ratones, perros y gatos, entre otros) del coronavirus8,9.
Los coronavirus pueden ser patógenos contaminantes o infectantes en los seres humanos. Se asocian a infecciones que generan síntomas de leves a severos, como ocurre con el caso del coronavirus del SARS (SARS-CoV), un nuevo β-coronavirus que surgió en Guangdong, sur de China, en noviembre de 200210, y resultó en más de 8.000 infecciones humanas y 774 muertes en 37 países durante 2002-200311; y el coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV), que se detectó por primera vez en Arabia Saudita en 201212 y fue responsable de 2.494 casos de infección confirmados por laboratorio y 858 muertes desde septiembre de 2012, incluidas 38 muertes después de una sola introducción en Corea del Sur8,9,13.
Se realizó el análisis filogenético de los genomas del 2019-nCoV asociado a los β-coronavirus representativos, lo que mostró subgéneros. El subgénero Sarbecovirus podría clasificarse en 2 cepas relacionadas así: una asociada al SARS-CoV de Rhinolophus sp. de Bulgaria y Kenia, y otra asociación del 2019-nCoV de Wuhan y cepas similares a SARS derivadas de murciélagos de Zhoushan, en el este de China (bat-SL-CoVZC45 y bat-SL-CoVZXC21), la cual se hizo mayormente representativa por la rama larga que separa al ser humano y al virus del murciélago. El 2019-nCoV era diferente del SARS-CoV en la filogenia del gen completo de la ARN polimerasa dependiente de ARN. Esta evidencia indicó que 2019-nCoV es un nuevo β-coronavirus del subgénero Sarbecovirus10,11,13,14.
La descripción de una nueva estructura genómica en coronavirus humano revela que sus propiedades de unión a diferentes receptores que podrían ser los ACE2, a pesar de la presencia de mutaciones de aminoácidos en el dominio de unión, es altamente transmisible entre animales salvajes y humanos, los primeros como hospederos naturales, y que en los últimos puede causar desde síndromes gripales hasta neumonías graves y distrés respiratorio7,11,12,14.
Medidas de bioseguridad dirigidas al personal sanitarioTeniendo en cuenta el mecanismo de propagación del virus y el comportamiento epidemiológico que ha venido presentando, se han establecido medidas de precaución para la población general y el personal de salud que se encuentra con alto riesgo de contagio. Con respecto a las medidas dirigidas al personal de salud, inicialmente se relaciona el uso de equipos de protección personal (EPP), siempre que se esté en contacto con pacientes identificados como casos probables o confirmados, para lo cual se debe contar con el equipo adecuado para evitar la infección por este microorganismo; en este caso, los EPP deben incluir: mascarilla quirúrgica, siempre que la distancia que exista con el paciente sea menor de un metro, o mascarilla FFP2 o N95, cuando se esté en contacto con un paciente sintomático respiratorio que se encuentre en aislamiento; en este caso es importante la revisión del filtro antes de cada uso15,16.
Adicionalmente, se debe contar con gafas o mascarillas de protección facial con el fin de proteger los ojos, la nariz y la mucosa bucal de cualquier riesgo de contacto con las secreciones respiratorias, sangre o fluidos corporales de una persona considerada como caso sospechoso o confirmado. Así mismo, el uso de guantes en los trabajadores sanitarios es crucial para evitar el contacto directo con secreciones, por tanto, es importante contar con un suministro adecuado y disponible de este recurso en todas las áreas de cuidado de los pacientes. No obstante, se recalca que la higiene de manos es esencial incluso cuando se utiliza este método de protección; es así como se han generado estrategias para garantizar el lavado de manos, dentro de las que se encuentra la ubicación del suministro de guantes en el mismo lugar donde se realiza la higiene de manos. Por último, debe usarse una bata de manga larga impermeable y desechable en caso de que exista riesgo de salpicaduras de fluidos corporales en el cuerpo del trabajador de salud15,17.
En la preparación del personal de salud antes de la atención a un sujeto con sospecha de coronavirus, se establecen 6 pasos de acuerdo con el riesgo identificado. El primero de ellos es el lavado de manos teniendo en cuenta los 5 momentos definidos por la OMS, posteriormente, se procede a poner la bata, la mascarilla FFP2 o N95, protector ocular y por último, los guantes. Por otra parte, en el momento de retirar los EPP se establecen 5 pasos: primero retirar la bata y los guantes, hacer higiene de manos, remover el protector ocular, seguido de la mascarilla y por último realizar lavado completo de manos17.
Teniendo en cuenta las directrices establecidas por la Organización Panamericana de la Salud, la OMS y el Instituto Nacional de Salud, se utiliza para el diagnóstico de COVID-19 el aspirado traqueal, sin embargo, en los casos en los cuales no sea posible la toma del examen, se tiene como segunda opción las muestras del tracto respiratorio superior como el aspirado nasofaríngeo y el hisopado laríngeo y orofaríngeo18,19. La toma de las muestras se debe realizar por personal de salud entrenado y capacitado para la recolección de secreción bronquial bajo los protocolos institucionales, incluyendo el uso de los EPP necesarios para el manejo de virus respiratorios19,20.
OxigenoterapiaLa administración de oxígeno (O2) suplementario es una de las estrategias terapéuticas más utilizadas en el mundo, para el tratamiento primario de la hipoxemia21. Su administración se cuantifica en porcentaje de la fracción de oxígeno (FiO2). El objetivo de la terapia con O2 es mantener los niveles de saturación arterial de O2 alrededor del 96%; en casos excepcionales como la enfermedad pulmonar obstructiva crónica, se permiten saturaciones alrededor del 88%22,23. Durante la terapia con O2 se debe evitar de hiperoxemia, debido a que altos niveles en la presión arterial de oxígeno (PaO2) aumentan la toxicidad relacionada con la liberación de especies reactivas de O2, provocando lesión en el pulmón, la retina o en el sistema nervioso central; además, altos valores de FiO2 por un tiempo prolongado pueden generar atelectasias por absorción21,22,24.
En la actualidad, se identifican 2 estrategias que permiten la administración de O2 terapéutico: sistemas de oxigenación convencional y cánula nasal de alto flujo (CNAF). El primero incluye una extensa lista de elementos que entregan O2 seco y se dividen en 2 grandes grupos: dispositivos de FiO2 aproximada que dependen del flujo y el volumen inspiratorio dependiente del paciente, como la cánula nasal (FiO2 0,24-0,40), la máscara simple (FiO2 0,35-0,50), la máscara de reinhalación parcial (FiO2 0,40-0,70) o la máscara sin reinhalación (FiO2 0,60-0,80), y por otro lado están los dispositivos que administran una FiO2 exacta con alto flujo de O2 que excede las demandas de flujo del paciente (sistema Venturi, FiO2 0,24-0,50%), adaptable a máscaras simples, mascarillas de traqueotomía y tubo T. La oxigenoterapia convencional ha demostrado ser de gran utilidad en el tratamiento de la hipoxemia; sin embargo, sus dispositivos son limitados por la mecánica ventilatoria del individuo25.
La experiencia actual de pacientes chinos infectados por coronavirus 2019 demostró que el tratamiento inicial de los síntomas disminuye la progresión de la enfermedad. Individuos con un índice de oxigenación menor de 200mmHg se transfirieron a un centro médico para iniciar la administración de O2 de preferencia con sistemas de oxigenación convencional sobre la ventilación no invasiva26. En esta situación es ideal mantener saturaciones de O2 mayores del 90% en hombres y mujeres no embarazadas, y entre 92-95% en mujeres embarazadas. Pacientes con hipoxemia leve deben recibir cánula nasal a 3l/min; si el paciente empeora, se debe considerar aumentar la FiO2 para mantener la saturación objetivo.
Cánula de alto flujoLa CNAF se ha convertido en una herramienta indispensable para tratar pacientes con disnea, falla respiratoria hipoxémica aguda y para prevenir la intubación27–31. Algunas de las ventajas de la CNAF son: aplicación sencilla, adecuada tolerancia, comodidad y reducción del trabajo respiratorio del paciente32–34.
Para el manejo de la falla respiratoria hipoxémica que desarrollan algunos pacientes con infección por COVID-19 se han utilizado diferentes estrategias de soporte, desde los dispositivos convencionales hasta la CNAF. Esta última se recomienda cuando los dispositivos convencionales no logran corregir la hipoxemia35, incluso la indicada sobre la ventilación mecánica no invasiva para disminuir la tasa de intubación36 y prevenir la transmisión nosocomial cruzada37. Aunque no hay evidencia de que la CNAF sea superior en los pacientes con infección por COVID-19, esta recomendación se basa en los resultados de estudios realizados en poblaciones de pacientes críticos. Revisiones sistemáticas y metaanálisis han mostrado que la CNAF, comparada con la terapia convencional, reduce la necesidad de intubación, aunque no afecta la mortalidad ni la estancia en UCI38–40, reduce significativamente la falla respiratoria postextubación y las frecuencias respiratorias, e incrementa la PaO241,42; además, ha mostrado tener un efecto profiláctico en la prevención de la neumonía asociada a la ventilación mecánica32. Estos resultados cobran relevancia en el contexto de la actual pandemia, dada la limitada disponibilidad de equipos para ventilación mecánica.
Aunque existe la preocupación del riesgo de transmisión con el uso de este dispositivo y algunos no lo recomiendan, existe evidencia que muestra que el riesgo de contaminación es similar al de los dispositivos convencionales43, y que en situaciones similares como lo fue la epidemia por SARS, los trabajadores de la salud expuestos a pacientes con soporte de alto flujo no tuvieron mayor riesgo de contraer la enfermedad44. De igual forma, con base en la evidencia existente se recomienda el uso de este dispositivo frente a la ventilación mecánica no invasiva en pacientes con falla respiratoria hipoxémica secundaria a neumonía45.
Para su uso se debe seleccionar muy bien el paciente, y no debe utilizarse en aquellos con hipercapnia y acidosis moderadas a severas, que se encuentren en estado de choque o tengan alteraciones del estado de conciencia. Así mismo, se debe realizar una estrecha monitorización evaluando al paciente en la primera hora y, si no presenta signos de mejoría en el patrón respiratorio y la oxigenación, debe considerarse la intubación y el soporte ventilatorio invasivo. Se recomienda el uso del CNAF, comenzando con 20l/min y aumentando gradualmente a 50-60l/min, ajustando la FiO2 de acuerdo con la saturación de O246.
Intubación traquealLa intubación traqueal de los pacientes con COVID-19 es considerada un procedimiento de alto riesgo tanto para el paciente como para el personal de salud. Para el primero, por el riesgo de complicaciones asociadas a la severidad de su cuadro, y para los segundos, por la probabilidad de adquirir la infección, como se evidenció en la pasada epidemia de SARS47.
El objetivo es realizar este procedimiento de la forma más segura, para lo cual es muy importante anticipar en lo posible los pacientes que lo requieren, de forma que el personal alcance a estar listo y no sea una situación de emergencia48. El siguiente paso después de definir la realización de la intubación es definir el equipo que la realizará y su preparación con los elementos de protección personal. Se alistan los dispositivos y medicamentos a utilizar, se define y comunica el plan con los roles de cada uno, se aconseja que cada miembro del equipo lleve su nombre escrito en un lugar visible. Es recomendable organizar un kit de intubación que contenga todos los elementos necesarios para la realización del procedimiento, y así mismo, elaborar una lista de chequeo35. El procedimiento debe ser realizado por la persona con mayor experiencia y mejor habilidad.
Durante el procedimiento se recomienda realizar preoxigenación con O2 al 100% durante 5min con alguna de las modalidades disponibles (máscara de no reinhalación, CNAF o un BVM)48, y realizar una secuencia de inducción rápida. Una vez administrados los medicamentos y el paciente haga apnea, se debe evitar ventilar; si llegase a ser necesario hacerlo, se puede utilizar un BVM con filtro y se recomienda que la ventilación sea efectuada por 2 personas, una que haga el sello de la máscara a la cara del paciente y otra que administre la ventilación, la cual debe ser con poca presión y bajo volumen. Con base en la evidencia existente en otros contextos se recomienda el uso de videolaringoscopio debido a que puede reducir el número de intentos y la duración del procedimiento, y minimizar la proximidad al paciente. Sin embargo, esto requiere la disponibilidad del dispositivo y un personal con habilidades para su uso35. Una vez realizada la intubación, se procede a inflar el neumotaponador y luego a verificar su posición preferiblemente con un capnógrafo, ya que el uso del estetoscopio para la auscultación es imposible por los elementos de protección personal; la radiografía o la ecografía se pueden utilizar para verificar que el tubo no esté en posición bronquial49.
Consideraciones para intubar a un paciente con COVID-1949–51:
- •
Formar un equipo con el menor número de personas posible para realizar el procedimiento, idealmente 3 (1) el que intuba; 2) un asistente; 3) quien administra medicamentos y monitoriza al paciente).
- •
Utilizar todos los elementos de protección recomendados (Nivel 3 de protección).
- •
Organizar un paquete de intubación con todos los elementos necesarios para este procedimiento.
- •
Elaborar un plan de intubación y revisarlo con el equipo de trabajo antes de ingresar a la habitación del paciente.
- •
La persona con mayor habilidad y experiencia debe encargarse de realizar la intubación.
- •
Evitar la ventilación con máscara, pero si es necesaria, debe hacerse con 2 personas, filtro, buen sello de la máscara y bajo volumen insuflado.
- •
Realizar una secuencia de inducción rápida para reducir el tiempo de exposición.
- •
Utilizar un videolaringoscopio si está disponible y alguien que lo sepa utilizar.
- •
Verificar la correcta posición del tubo con capnografía si se dispone.
- •
Inflar el neumotaponador entre 20 y 30cmH2O antes de iniciar la ventilación.
Hasta el momento parece indicar que la fisiopatología de la insuficiencia respiratoria aguda asociada al COVID-19 tiene un comportamiento similar al de la neumonía viral grave, razón por la cual, invariablemente, un porcentaje de los casos graves terminarán por desarrollar SDRA52. Esta entidad fue descrita por Petty y Ashbaugh en 1967 en una serie de 12 pacientes con similares características, los cuales desarrollaban dificultad respiratoria, infiltrados pulmonares difusos y lesión endotelial del capilar pulmonar, haciendo que se requiera más presión para insuflar el sistema respiratorio debido a la disminución de la distensibilidad pulmonar, generando insuficiencia respiratoria, en un periodo de horas a días, con una mortalidad asociada de hasta el 33 y el 50%53–55.
Ante una inminente presencia masiva de casos de COVID-19 en los centros de salud de Colombia, el manejo ventilatorio adecuado de los pacientes con dificultad respiratoria surge como un desafío; el personal de salud debe tener competencias en su manejo, teniendo en cuenta que muchos de los pacientes con COVID-19 terminan desarrollando SDRA; variables como la compliance y la presión de conducción están severamente comprometidas en el SDRA, pero en esta nueva entidad, no lo están. La implementación de estrategias de protección pulmonar, como la disminución de volúmenes corrientes, presiones de meseta y frecuencias respiratorias, han demostrado mejorar la sobrevida de los pacientes, de igual forma que la implementación de elevados valores de PEEP, bajos valores de presión de conducción y la ventilación en prono. A futuro también se esperan mayores estudios sobre la potencia mecánica como marcador de la lesión pulmonar asociada a la ventilación mecánica56.
La primera serie de pacientes reportada en China con COVID-19 refiere el uso de ventilación no invasiva y CNAF. Se evidenció una mejoría temporal de los índices de oxigenación y una reducción del trabajo respiratorio; este no se recomendó puesto que el desenlace final sería igual al de las infecciones virales complicadas, como la neumonía, razón por la cual no se lograría cambiar el curso natural de la enfermedad, retrasando el tiempo de intubación, exponiendo más tiempo al personal encargado de los cuidados de la salud a los aerosoles derivados de la implementación de estas técnicas terapéuticas57.
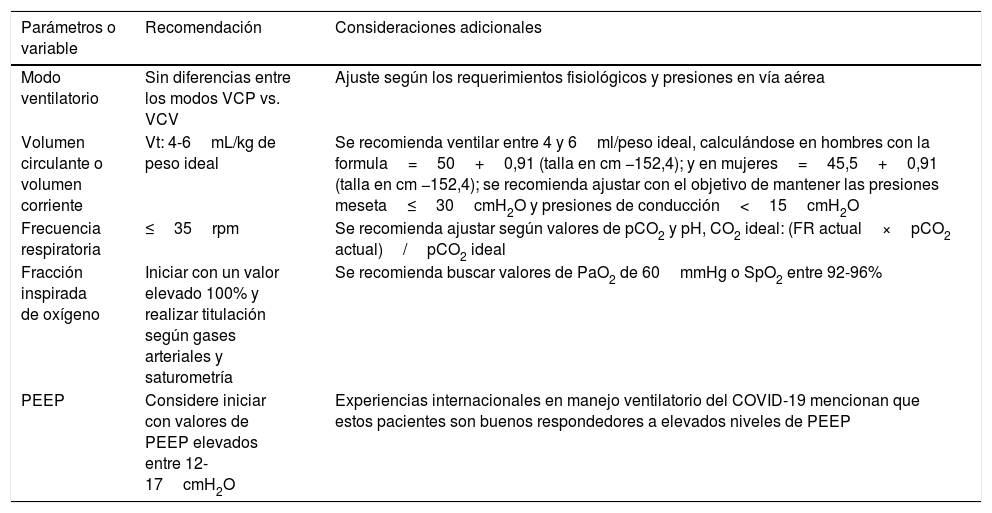
Ante una vasta evidencia en estrategias de protección pulmonar, se debe considerar la individualización del abordaje ventilatorio del paciente con SDRA, dado que todos los casos tienen respuestas variables y no estereotipadas a las diferentes estrategias antes mencionadas58. Se debe considerar (tabla 1):
- -
Utilizar un volumen corriente bajo. Se recomienda en el paciente con SDRA, ventilar con volúmenes corrientes de entre 4 y 6ml/peso ideal, calculándose en hombres con la fórmula: 50+0,91 (talla −152,4); y en mujeres: 45,5+0,91 (talla −152,4)59.
- -
Presión meseta entre 25-26cmH2O. Se ha asociado con una reducción del 9% en la mortalidad hospitalaria. Se recomienda realizar programación de parámetros con el objetivo de tener esta presión con valores menores de 30cmH2O60.
- -
Experiencias internacionales en el manejo del COVID-19. En países como China, Malasia, España e Italia se ha documentado que los pacientes responden muy bien a PEEP elevadas, entre 12 y 17cmH2O, lo que se correlaciona con estudios anteriores en SDRA en los que valores elevados de PEEP han tenido un impacto positivo en la oxigenación61. De igual forma, uno de los estándares históricos para su programación también ha sido la tabla del ARDSNET (Slutsky et al., 2002) y algunos estudios basados en la compliance del sistema respiratorio62. Durante la titulación de la PEEP, la presión de la meseta puede aumentar por encima de 30cmH2O, teniendo en cuenta que, si el aumento de PEEP disminuye la Pplat, se reclutará el pulmón63.
- -
Se recomienda monitorizar de forma periódica la presión de conducción buscando que los parámetros programados en volumen tidal la mantengan≤15cmH2O. La ventilación persiguiendo este objetivo ha demostrado una mejoría en la sobrevida del paciente con SDRA64.
- -
A pesar de que expertos internacionales han mencionado una mayor comodidad en ventilar a los pacientes con COVID-19 en modos convencionales controlados por presión, hay evidencia que demuestra la no superioridad frente a modos controlados por volumen, en términos de disminución de la mortalidad65.
- -
La titulación de la FiO2 se debe realizar con el objetivo de buscar la normoxemia en gases arteriales o saturaciones parciales de O2 entre 88-92%66; de igual forma, se ha utilizado la tabla de ARDSNET para la titulación de parámetros como la PEEP y la FiO259.
- -
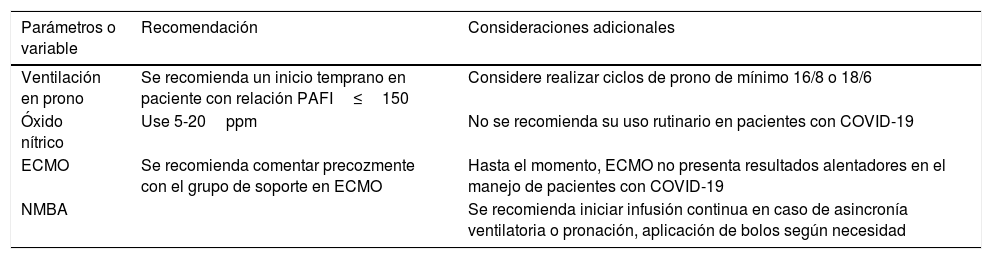
En pacientes con deterioro progresivo de la oxigenación con una relación Pa/Fi≤150, con una FiO2 de al menos 0,6, una PEEP de al menos 5cmH2O y un volumen corriente de 6ml/kg, la estrategia precoz de ventilación en prono ha demostrado mejorar la sobrevida. Considere pasar a decúbito prono, en una relación de al menos 16/8 o 18/6, como indica el estudio PROSEVA, a pesar de que experiencias actuales en el paciente con COVID-19 apuntan a que los ciclos de prono deben ser de al menos 24h y tratar de implementar maniobras de reclutamiento alveolar con el fin de reducir el número de ciclos de prono (tabla 2)67,68.
Tabla 2.Recomendación de uso de estrategias ventilatorias no convencionales para pacientes críticos con COVID-19
Parámetros o variable Recomendación Consideraciones adicionales Ventilación en prono Se recomienda un inicio temprano en paciente con relación PAFI≤150 Considere realizar ciclos de prono de mínimo 16/8 o 18/6 Óxido nítrico Use 5-20ppm No se recomienda su uso rutinario en pacientes con COVID-19 ECMO Se recomienda comentar precozmente con el grupo de soporte en ECMO Hasta el momento, ECMO no presenta resultados alentadores en el manejo de pacientes con COVID-19 NMBA Se recomienda iniciar infusión continua en caso de asincronía ventilatoria o pronación, aplicación de bolos según necesidad ECMO: oxigenación con membrana extracorpórea; NMBA: agentes bloqueantes neuromusculares; PAFI: relación entre presión arterial de oxígeno y fracción inspirada de oxígeno.
- -
La utilización de la ECMO se debe considerar cuando las estrategias convencionales de manejo ventilatorio para contrarrestar la hipoxemia refractaria han fallado. A pesar de que no parece ser una buena alternativa para manejar pacientes con COVID-19, en China se documentó una serie de 28 pacientes que recibieron ECMO: 14 murieron, 5 fueron destetados con éxito y 9 todavía permanecían en ECMO en el momento de publicar el editorial69,70.
- -
La inhalación de óxido nítrico es considerada por algunos autores como una estrategia de rescate para el manejo de la hipoxemia refractaria persistente en el COVID-19. Los valores recomendados oscilan entre 5-20ppm y se especula sobre la mejoría de la oxigenación. A pesar de esto, no recomiendan el uso rutinario en pacientes con COVID-19 debido a que los resultados en pacientes con SDRA no alteraban significativamente la mortalidad y su resultado positivo no llegaba a sobrepasar las 24h, llegando a provocar en muchos casos lesión renal aguda69,70.
Recomendaciones de configuración ventilatoria para pacientes críticos con COVID-19
| Parámetros o variable | Recomendación | Consideraciones adicionales |
|---|---|---|
| Modo ventilatorio | Sin diferencias entre los modos VCP vs. VCV | Ajuste según los requerimientos fisiológicos y presiones en vía aérea |
| Volumen circulante o volumen corriente | Vt: 4-6mL/kg de peso ideal | Se recomienda ventilar entre 4 y 6ml/peso ideal, calculándose en hombres con la formula=50+0,91 (talla en cm −152,4); y en mujeres=45,5+0,91 (talla en cm −152,4); se recomienda ajustar con el objetivo de mantener las presiones meseta≤30cmH2O y presiones de conducción<15cmH2O |
| Frecuencia respiratoria | ≤35rpm | Se recomienda ajustar según valores de pCO2 y pH, CO2 ideal: (FR actual×pCO2 actual)/pCO2 ideal |
| Fracción inspirada de oxígeno | Iniciar con un valor elevado 100% y realizar titulación según gases arteriales y saturometría | Se recomienda buscar valores de PaO2 de 60mmHg o SpO2 entre 92-96% |
| PEEP | Considere iniciar con valores de PEEP elevados entre 12-17cmH2O | Experiencias internacionales en manejo ventilatorio del COVID-19 mencionan que estos pacientes son buenos respondedores a elevados niveles de PEEP |
CO2: dióxido de carbono; FR: frecuencia respiratoria; pCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; PEEP: presión positiva al final de la espiración; SpO2: saturación de oxígeno; VCP: ventilación controlada por presión; VCV: ventilación controlada por volumen.
La presión transpulmonar sirve para fijar la PEEP, el volumen tidal y la presión inspiratoria en el SDRA, entendiéndose como la diferencia de presión entre los alvéolos y el esófago, medida durante una oclusión al final de una inspiración o espiración; a una presión alveolar determinada, la presión transpulmonar se reduce cuando la presión esofágica aumenta; es decir, a medida que la pared torácica es más rígida, la proporción de presión de la vía aérea que dilata los pulmones se reduce. La evidencia demuestra que las propiedades mecánicas de la pared torácica contribuyen de manera considerable e impredecible al aparato respiratorio71,72; la presión meseta es un sustituto inadecuado de la presión pulmonar73; titular PEEP en función de la presión esofágica/transpulmonar mejora la compliance y la oxigenación en SDRA, para mantener una presión transpulmonar espiratoria entre 0-10cmH2O e inspiratoria<25cmH2O74,75; además, puede evitar el uso de la ECMO en los pacientes más graves76.
La capnografía volumétrica no solo mide la presión exhalatoria de dióxido de carbono, sino que mide el volumen de dióxido de carbono espirado en un volumen corriente, un dato primordial a la hora de calcular la eliminación de dióxido de carbono corporal y determinar el espacio muerto; permite guiar la actividad metabólica en pacientes con ventilación asistida crónica77, permite calcular la ventilación alveolar, evalúa la relación eficacia/ineficiencia ventilatoria mediante el análisis del espacio muerto (VD) o ventilación ineficaz; donde la VD/VT es la relación entre la ventilación ineficaz y el volumen corriente, sirviendo como valor pronóstico en el SDRA. Los valores de VD/VT<0,4 son considerados normales; los valores>0,65 posterior a las 24h están asociados a un aumento en la mortalidad78,79; permite calcular el nivel óptimo de PEEP; el espacio muerto alveolar puede disminuir, mientras que la PEEP inducida por sobredistensión alveolar tiende a aumentar el espacio muerto80, y también permite valorar de forma dinámica la ventilación y la perfusión pulmonar, que pueden variar notablemente en cada ciclo respiratorio y cardiaco81.
Monitorizar la curva de presión-volumen permite inferir la compliance del sistema respiratorio, la cual es baja con volúmenes corrientes bajos, aumenta con volúmenes intermedios y disminuye con niveles altos de inflación pulmonar, altos valores de PEEP o grandes volúmenes corrientes. Normalmente el valor de la compliance es de 100ml/cmH2O, disminuye a 75ml/cmH2O en los pacientes acostados y es≤50ml/cmH2O en los pacientes con SDRA. En el punto de inflexión superior, cuando la curva es llevada a un volumen próximo a la capacidad pulmonar total, representa la aparición de sobredistensión alveolar, el fin del reclutamiento o bien la coexistencia de ambos fenómenos82.
La resistencia pulmonar es la relación entre diferencia de presión y un flujo determinado. Esta depende también del volumen pulmonar; se infiere que a medida que aumenta el volumen, disminuye la resistencia de las vías aéreas, y que a medida que aumenta el flujo, la resistencia de las vías aéreas también aumenta. En el SDRA y en bronquíticos crónicos, Rmáx puede alcanzar más de 20cmH2O/l/s, y el ΔRS es elevado, lo que se interpreta como una expresión de las desigualdades de las constantes de tiempo intrapulmonares82.
La tomografía de impedancia eléctrica se constituye una herramienta de monitorización para identificar la estrategia ventilatoria que asegure una distribución homogénea de la ventilación. Los iones disueltos en los tejidos corporales permiten la conducción eléctrica y, por tanto, a mayor contenido, mejor conducción; su recíproco, la impedancia, es la capacidad que tiene una unidad cúbica de un tejido para oponerse a la conducción eléctrica. Así, es posible estimar las variaciones de volumen gracias a los cambios de impedancia producidos por el ingreso y la salida de aire. Se debe tener en cuenta la relación entre R-ND y R-D, o el coeficiente upper/lower, cuyo objetivo es 0,8, especialmente luego de cambios del VT y la PEEP83–85.
ConclusionesUsar equipos de bioseguridad con el fin de interrumpir la transmisión. En hipoxemia, usar sistemas de oxigenoterapia de bajo flujo, de ser necesario el uso de cánula de alto flujo y/o intubación con inducción rápida. Usar estrategias de protección pulmonar, disminución de volúmenes corrientes, presiones de meseta y frecuencias respiratorias, implementación de valores de PEEP elevados, bajos valores de presión de conducción y ventilación en prono, los cuales han demostrado mejoría en la hipoxemia y en la sobrevida de pacientes con SDRA.
Conflicto de interesesLos autores manifiestan no tener ningún conflicto de intereses.
A la AMCI, por estar a la vanguardia de las políticas públicas en salud, y a Jenny Patricia Muñoz Lombo, por revisar y traducir el documento.