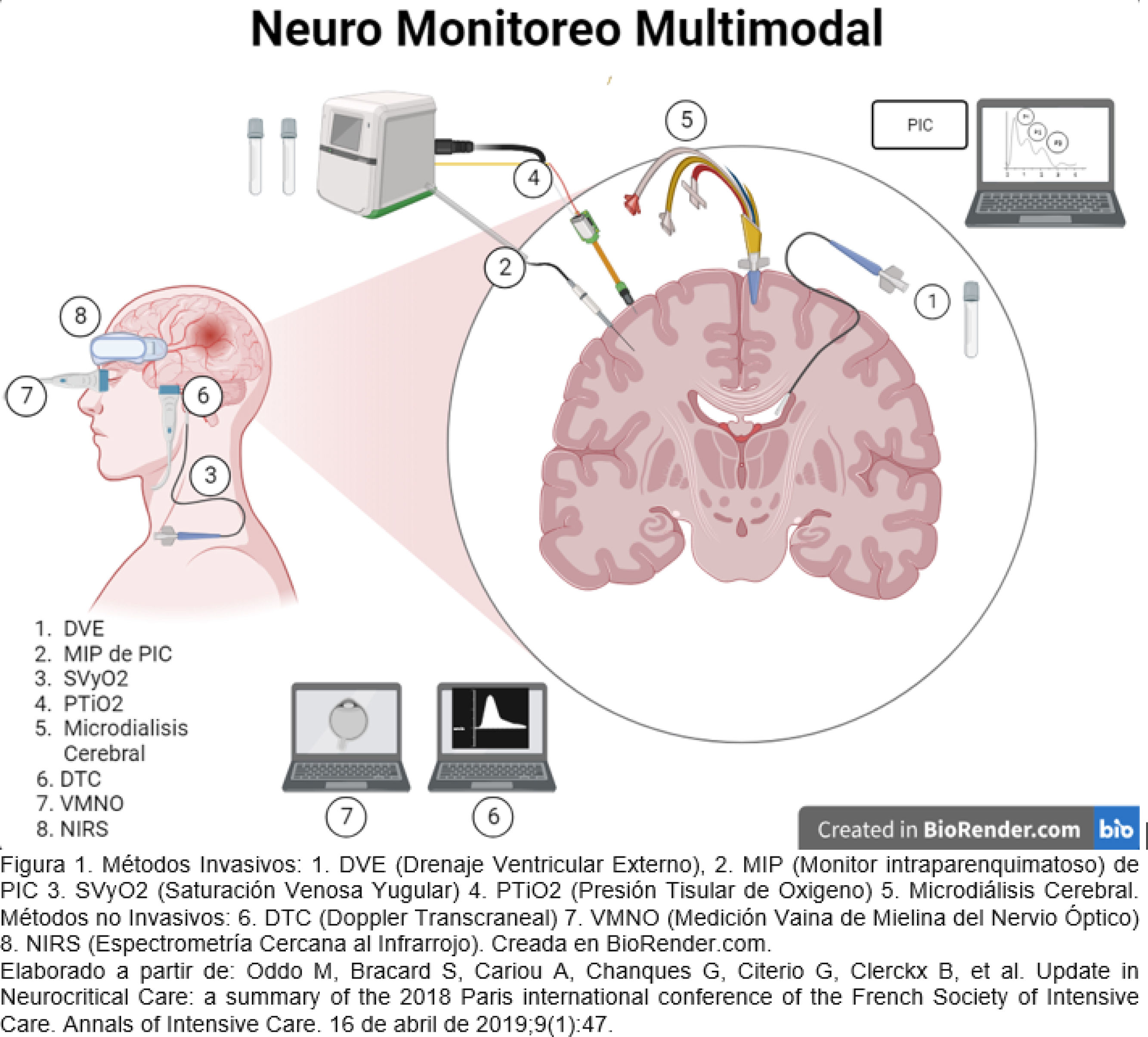
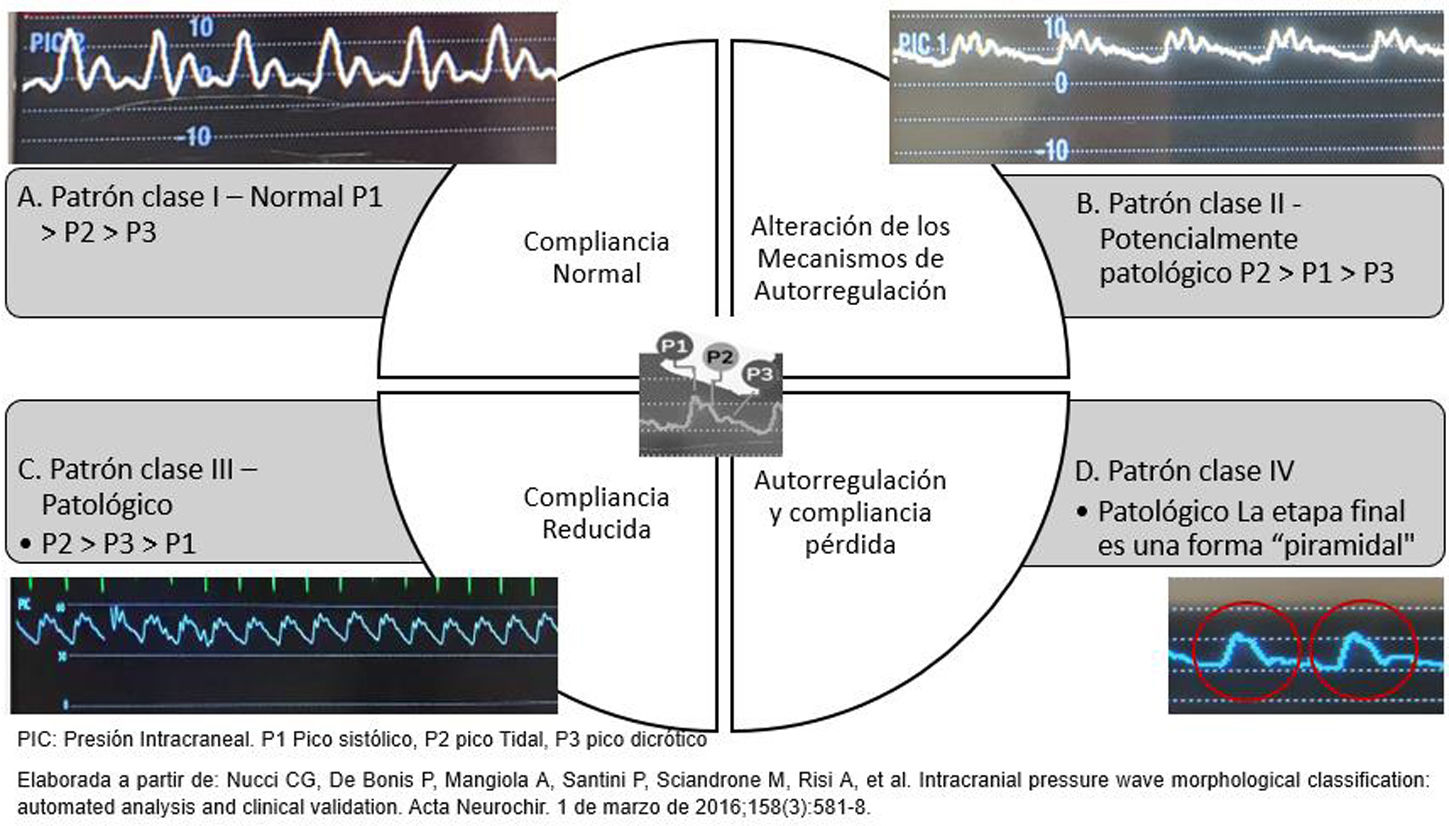
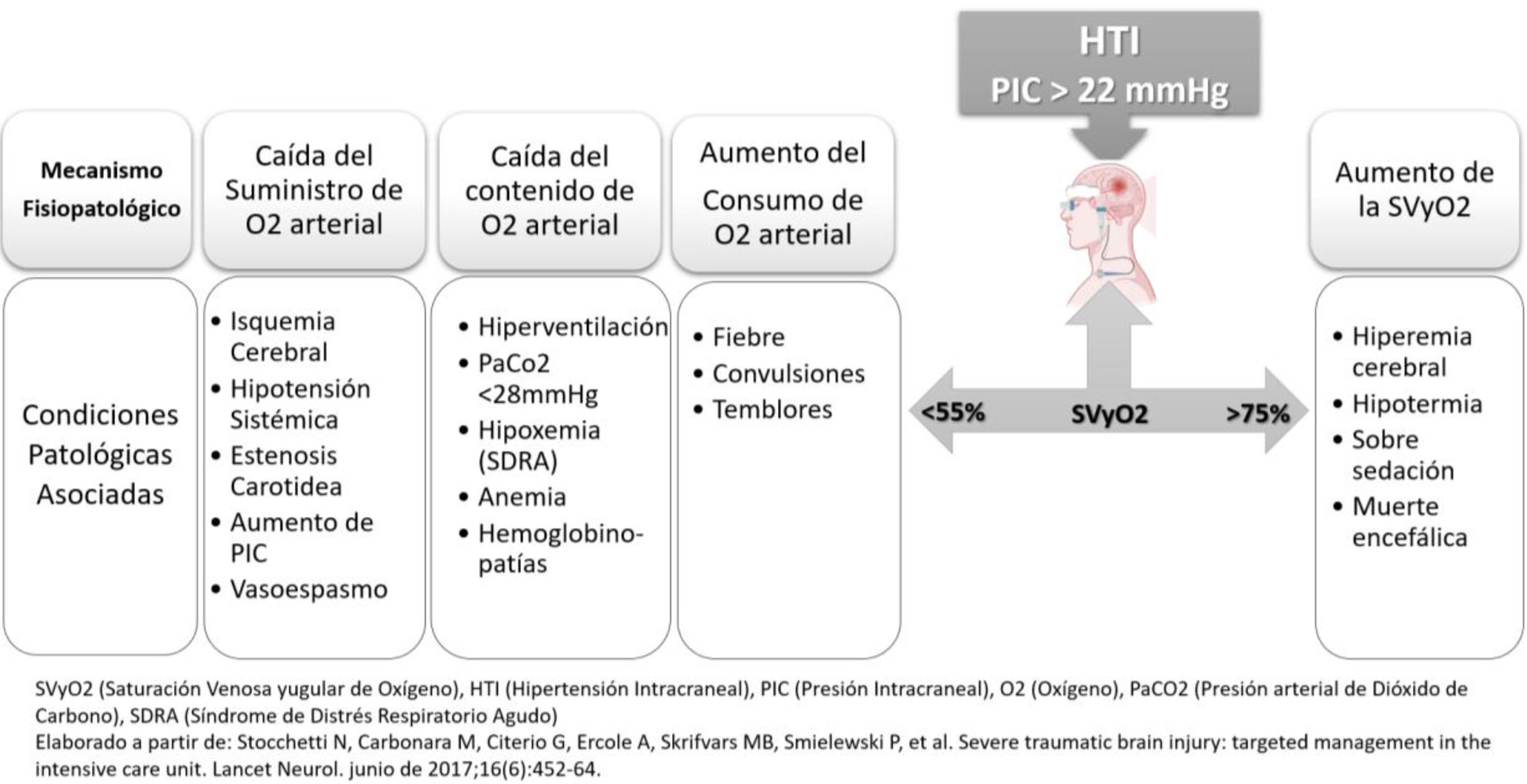
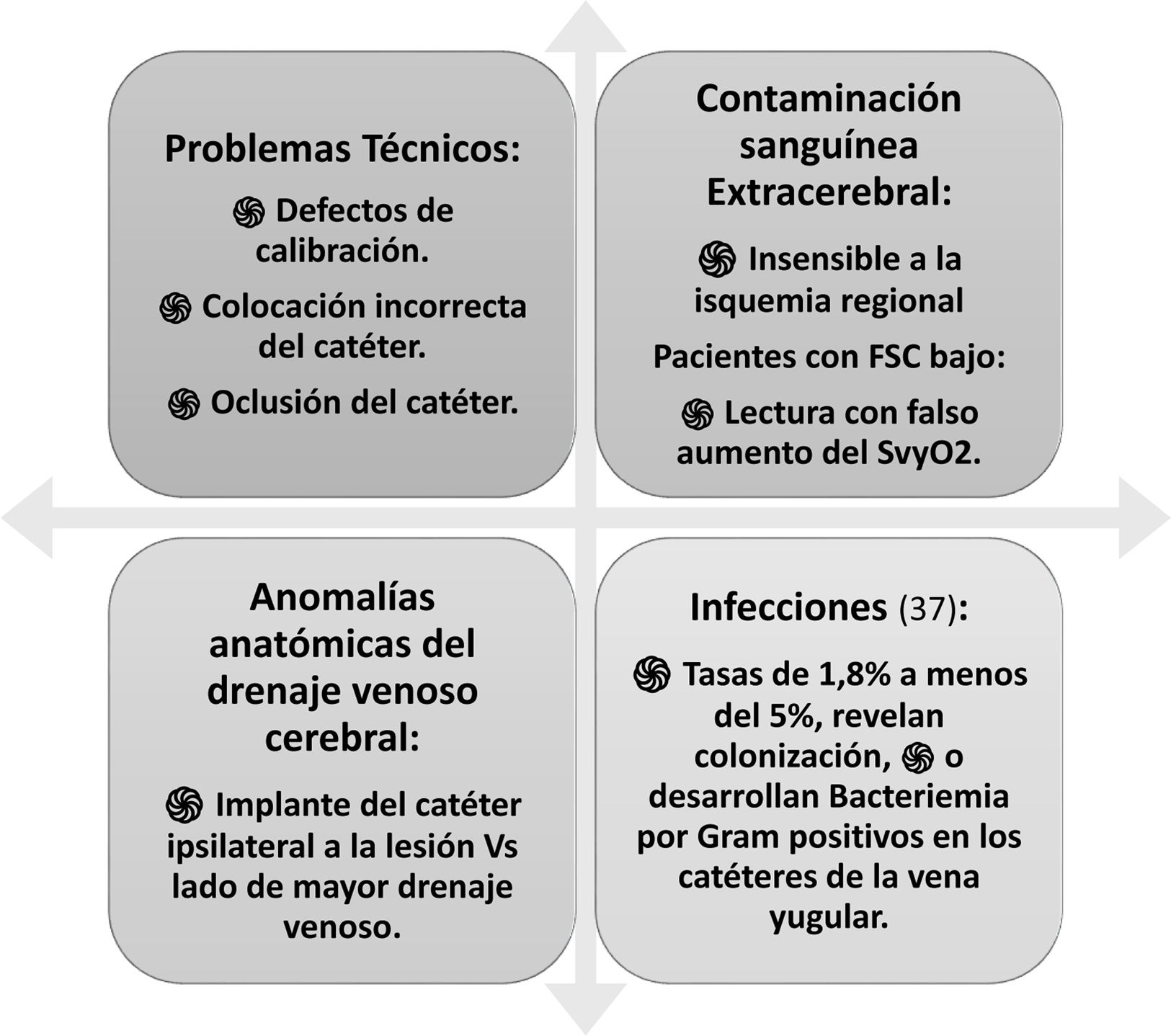
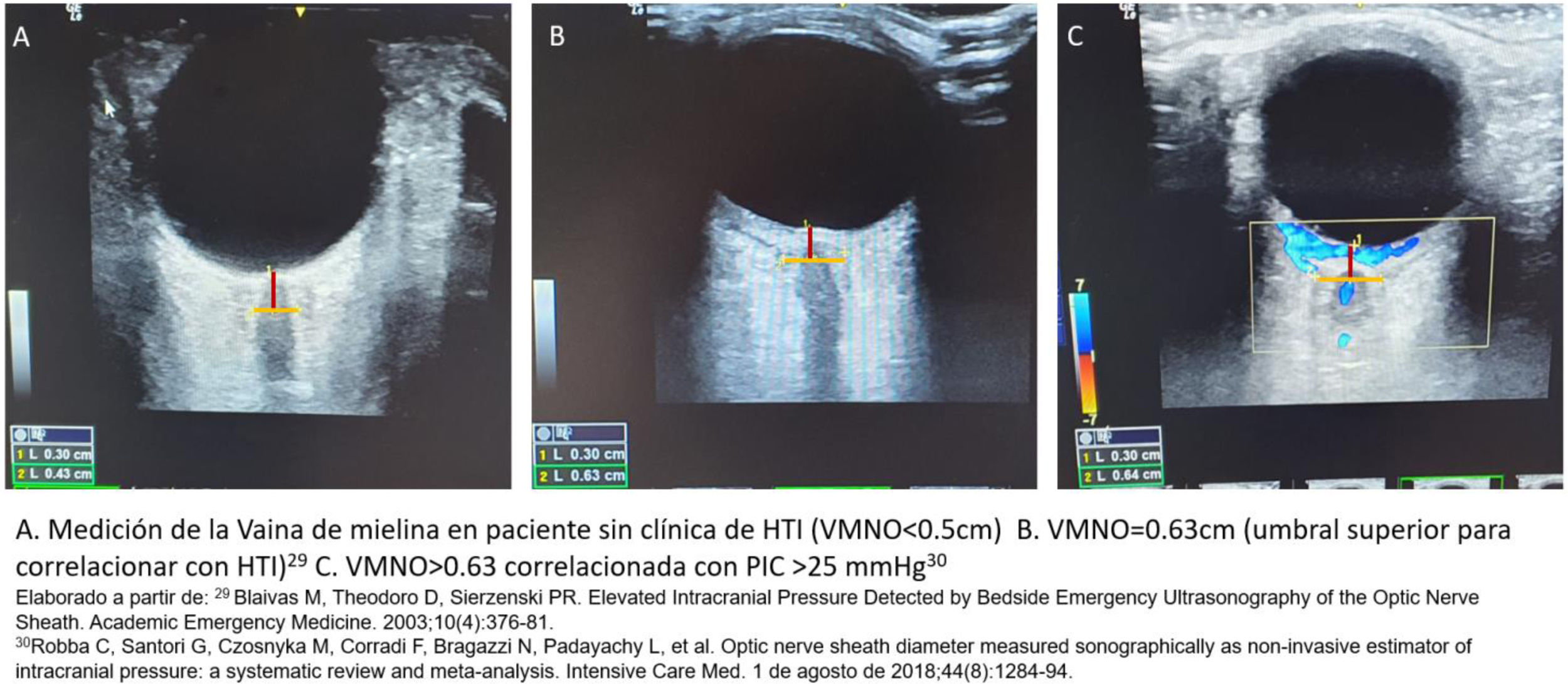
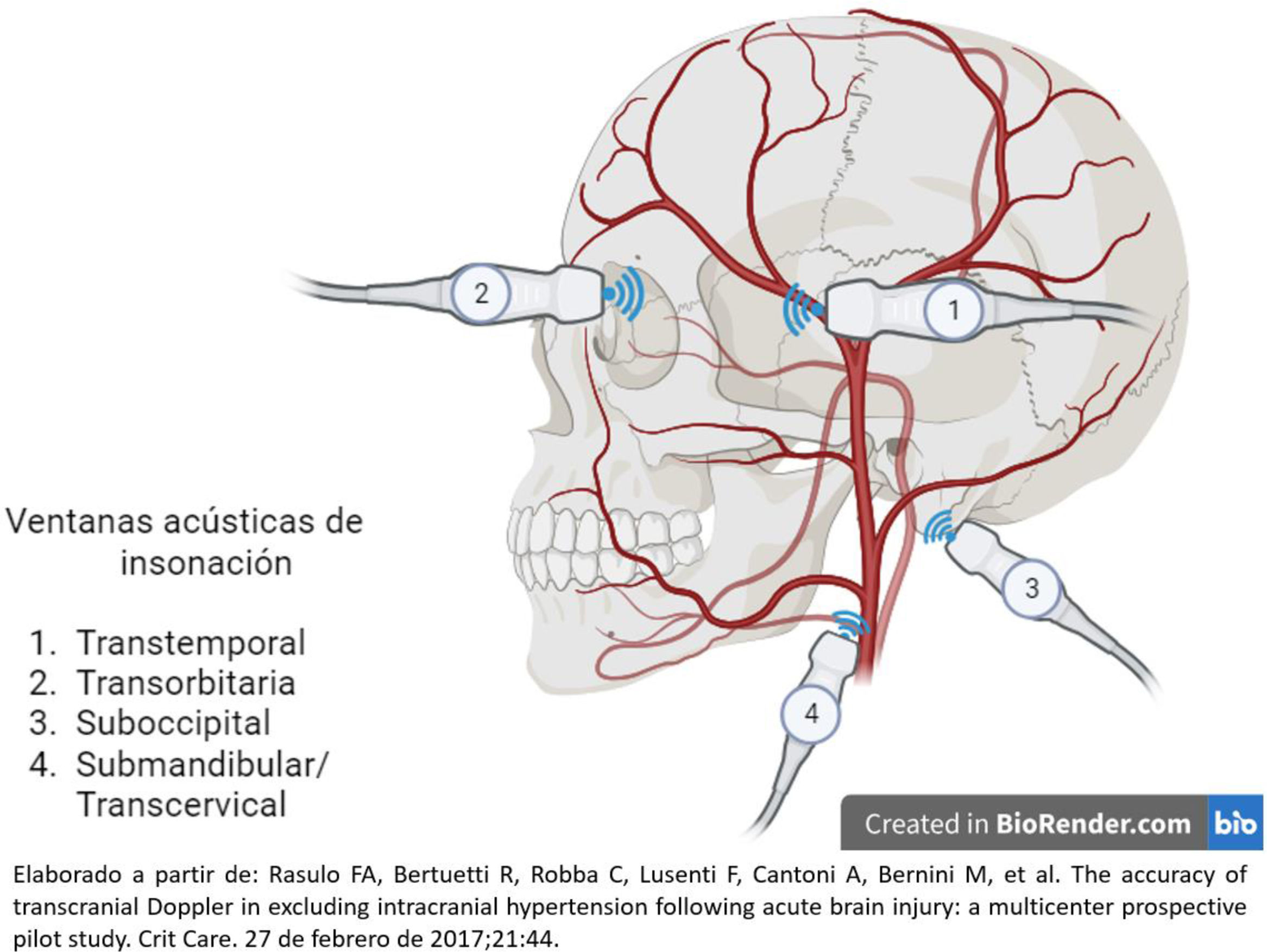
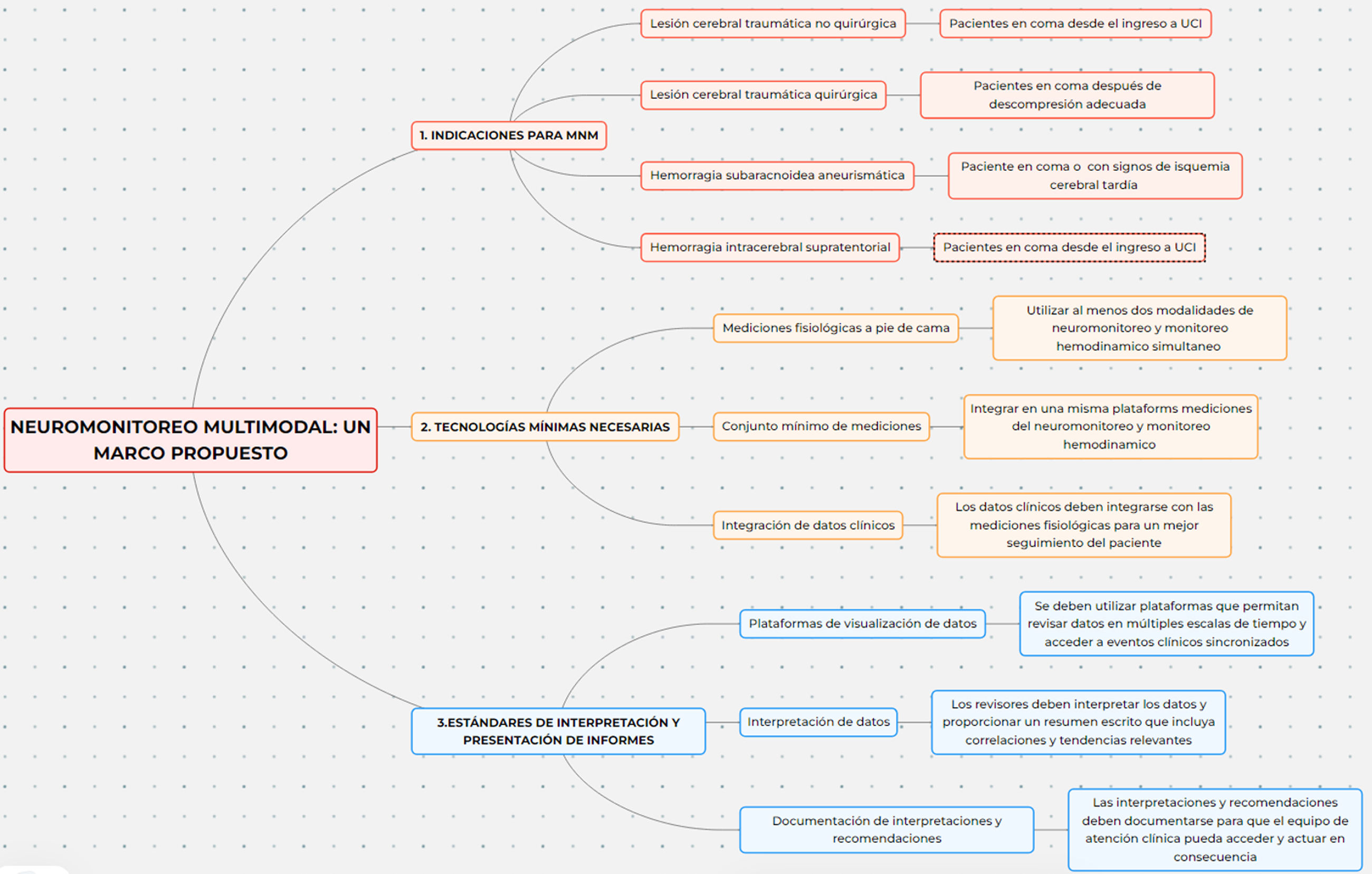
Existen múltiples estrategias de monitoreo para el seguimiento de pacientes con lesiones cerebrales ingresados en la unidad de cuidados intensivos (UCI). Estas estrategias generalmente comienzan con una evaluación neurológica, incluyen estudios de imagen y culminan con la implementación de tecnologías de punta y alta definición. Los resultados clínicos dependen de la interpretación de los datos generados. El neuromonitoreo ha recibido una atención creciente en los últimos años. La evidencia científica actual recomienda estándares de práctica para el uso de neuromonitoreo en pacientes críticamente enfermos, subrayando la necesidad de homogenizar tecnologías, esfuerzos y formación necesarios para integrar e interpretar la información procedente de la neuromonitorización multimodal (NMM). El futuro del neuromonitoreo se orienta hacia la integración e innovación de técnicas invasivas y no invasivas de NMM. En términos de presión intracraneal (PIC), el monitoreo con catéter intraventricular sigue siendo la técnica de referencia o estándar de oro. Además, las tecnologías de medición de la oxigenación cerebral, las evaluaciones ultrasonográficas como el Doppler transcraneal, la medición de la vaina del nervio óptico y las técnicas emergentes como la pupilometría automatizada y la espectrometría cercana al infrarrojo (NIRS) deben motivar al intensivista a conocer su fundamentación e interpretación, así como su aplicación para generar estrategias de tratamiento, hacer seguimiento a las mismas e impactar en mejores desenlaces clínicos. Esta revisión ofrece una evaluación actualizada de la situación de varias modalidades de neuromonitoreo y su uso en diferentes escenarios, destacando en cada método las ventajas y limitaciones para su implementación enfatizando en la utilidad en la UCI.
There are multiple monitoring strategies for the follow-up of patients with brain injuries admitted to the intensive care unit (ICU). These strategies begin with a neurological assessment, include imaging studies, and culminate with the implementation of cutting-edge, high-definition technologies. Clinical outcomes depend on the interpretation of the generated data. Neuromonitoring has received increasing attention in recent years. Current scientific evidence recommends practice standards for the use of neuromonitoring in critically ill patients, emphasizing the need to standardize technologies, efforts, and training necessary to integrate and interpret information from multimodal neuromonitoring (NMM). The future of neuromonitoring is oriented towards the integration and innovation of invasive and non-invasive NMM techniques. In terms of intracranial pressure (ICP), monitoring with an intraventricular catheter remains the reference technique or gold standard. Additionally, technologies for measuring cerebral oxygenation, ultrasonographic evaluations such as transcranial Doppler, optic nerve sheath measurement, and emerging techniques such as automated pupillometry and near-infrared spectroscopy (NIRS), should motivate intensivists to understand their foundation and interpretation, as well as their application to generate treatment strategies, monitor them, and impact better clinical outcomes. This review offers an updated assessment of the status of various neuromonitoring modalities and their use in different scenarios, highlighting the advantages and limitations of each method for implementation, emphasizing their utility in the ICU.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí