El Comité de Nutrición de la Federación Panamericana e Ibérica de Medicina Crítica y Terapia Intensiva presenta las Guías de Recomendaciones para los pacientes graves con COVID-19 que ameritan manejo en Cuidados Intensivos. Se realizó una revisión sistemática de la literatura por los miembros del comité de nutrición de la FEPIMCTI en las bases de literatura médica más relevantes, se realiza una selección y evaluación de la literatura disponible, relacionada de forma directa o indirecta al COVID-19, teniendo en cuenta las guías ASPEN y ESPEN. Se encontró escasa literatura específica con relación al objetivo, se construyeron las recomendaciones más relevantes con información extrapoladas del manejo diario de los pacientes graves y con ARDS.
The Nutrition Committee of the Pan American and Iberian Federation of Critical Medicine and Intensive Care (FEPIMCTI) presents the Recommendation Guidelines for seriously ill patients with COVID-19 that require management in Intensive Care. Using a systematic review of the literature carried out by the members of the Nutrition Committee of the FEPIMCTI in the most relevant medical literature bases, a selection and evaluation of the available literature was made, directly or indirectly related to COVID-19, having taken into account the American (ASPEN) and European (ESPEN) Parenteral and Enteral Nutrition guidelines. Little specific literature was found in relation to the objective. The most relevant recommendations were constructed with information extrapolated from the daily management of critically ill patients and those with acute respiratory distress syndrome (ARDS).
El Comité de Nutrición de la Federación Panamericana e Ibérica de Medicina Crítica y Terapia Intensiva se siente complacido de presentar estas recomendaciones para la terapia nutricional de los pacientes graves con COVID-19 que ameritan manejo en Cuidados Intensivos. Hemos podido consensuar una lista de recomendaciones nutricionales que puedan servir de orientación nutricional a los intensivistas que están tratando a estos pacientes graves.
El 31 de diciembre de 2019, China informó de casos de enfermedades respiratorias en humanos que aparecen primero en Wuhan, provincia de Hubei, que involucró un nuevo coronavirus SARS-CoV-2 (también conocido como 2019-nCoV). Esta nueva emergencia es una enfermedad zoonótica, con reservorio animal desconocido y con evidencia de transmisión de persona a persona1. El nuevo agente causante de esta neumonía, un coronavirus (SARS-CoV-2), fue identificado y secuenciado2 y se desarrollaron pruebas de diagnóstico3. El 30 de enero de 2020, la Organización Mundial de la Salud emitió una declaración pública mundial de alerta sanitaria sobre la aparición de una nueva epidemia viral4. Para el 11 de marzo la OMS declara pandemia mundial por el gran aumento de casos alrededor del mundo. Alcanzando hoy cifras en China de más de 84.000 infectados, Italia más de 209.000, España más de 232.000 y Estados Unidos más de 1,5 millones de infectados. Con un total mundial de más de 328.000 muertes al 20 de mayo de 2020. La mayoría han muerto en Cuidados Intensivos.
Nutrición e inmunidadNo existe antibiótico o tratamiento farmacológico apropiado, si el paciente tiene un sistema inmunológico deficiente. La mejor defensa natural contra el coronavirus es un sistema inmunológico eficiente5, y esto depende en gran medida del estado nutricional de cada paciente.
En los últimos años la literatura acumula evidencias de cómo las proteínas influyen sobre el sistema inmunitario. También hay muchos datos sobre cómo el componente nitrogenado no proteico, los nucleótidos de la dieta, modulan el sistema tanto a nivel intestinal como sistémico. Respecto a los lípidos, conocemos cada vez mejor cómo los ácidos grasos, sobre todo los omega-36, influyen sobre el sistema inmune y los procesos inflamatorios. En la última década se ha investigado para conocer a fondo el papel de ciertos micronutrientes sobre el sistema inmune, como el hierro, el cobre, el cinc y las vitaminas liposolubles (sobre todo la A, D y E)7; pero también se han obtenido datos que abogan por la importancia de otros micronutrientes como el selenio, la glutamina, arginina y cada vez más sobre vitamina C.
Es preciso recordar que el órgano inmunológico más grande del cuerpo es el intestino, específicamente el GALT (tejido linfático asociado al intestino). Y el éxito de esta función inmunológica depende de la presencia de nutrientes en el lumen intestinal. El GALT es un órgano linfoide secundario, que se encarga de procesar aquellos antígenos que interaccionan con la mucosa intestinal y de diseminar la respuesta inmunitaria.
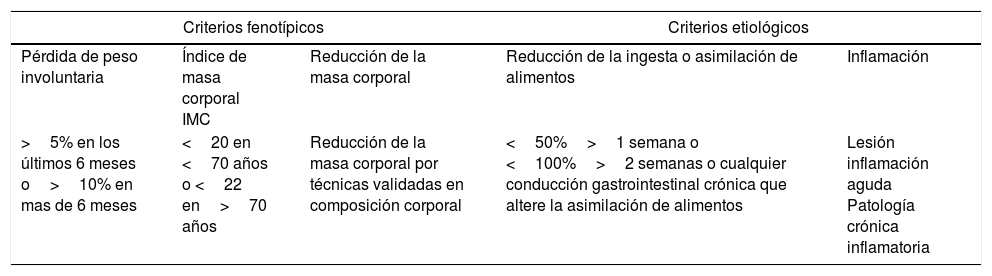
Evaluación nutricionalEn todos los pacientes con COVID-19 se debe pensar en su condición nutricional y más si se trata de pacientes mayores de 60 años que es el grupo de mayor riesgo de mortalidad al igual que aquellos que presentan comorbilidades o enfermedades inmunosupresoras. Las Guías ESPEN 20208 recomiendan utilizar el MUST9 o el NRS-200210. Es importante recordar el último consenso avalado por las más importantes sociedades de nutrición clínica del mundo, que son los criterios de Global Leadership Initiative on Malnutrition (GLIM)11 utilizando criterios fenotípicos y etiológicos (tabla 1). Para considerar al paciente malnutrido debe presentar, al menos, un criterio fenotípico y un criterio etiológico.
Criterios fenotípicos y etiológicos de malnutricion: Global Leadership Initiative on Malnutrition (GLIM)
| Criterios fenotípicos | Criterios etiológicos | |||
|---|---|---|---|---|
| Pérdida de peso involuntaria | Índice de masa corporal IMC | Reducción de la masa corporal | Reducción de la ingesta o asimilación de alimentos | Inflamación |
| >5% en los últimos 6 meses o>10% en mas de 6 meses | <20 en <70 años o <22 en>70 años | Reducción de la masa corporal por técnicas validadas en composición corporal | <50%>1 semana o <100%>2 semanas o cualquier conducción gastrointestinal crónica que altere la asimilación de alimentos | Lesión inflamación aguda Patología crónica inflamatoria |
Fuente: Cederholm et al.11.
En vista de que este coronavirus es altamente contagioso, no debe ser obligatorio que el nutricionista haga una evaluación nutricional rigurosa, podría ayudarse con entrevista al familiar vía teléfono o entrevista al paciente guardando una precaución prudente. En caso muy necesario que requiera tocar al paciente debe protegerse con el equipo de protección personal adecuado: mascarilla N-95, pantalla facial, mameluco o jumper, doble guante y protector de calzado. En ausencia de una evaluación nutricional estos pacientes críticos con COVID-19 deben iniciar terapia nutricional <48 h de ingreso a UCI.
En el paciente crítico con APACHE II≥10 y COVID-19, es evidente que cursa con una inflamación aguda o hiperaguda, lo que indicará el uso de terapia nutricional especializada y más si está con ventilación mecánica.
Nutrición enteralLo ideal sería recibir terapia nutricional vía oral. Sin embargo, a medida que se va instalando la falla respiratoria y la hipoxemia estos pacientes críticos no podrán comer por vía oral. Se debe tratar de colocar la sonda enteral antes de la intubación endotraqueal, teniendo mucho cuidado con la tos y difusión de aerosoles que se pueden generar12,13. Si no hay inestabilidad hemodinámica o shock (hipotensión que no responde a aumento de vasopresores, hipoxemia severa, lactato>3 y elevándose, etc.) se debe iniciar nutrición enteral temprana lo más pronto posible (<48 horas). La mayoría de los pacientes deben tolerar la nutrición intragástrica continua (no en bolos), no es necesario medir el residuo gástrico de rutina, a menos que exista alguna indicación especial (vómitos, distensión) se considerará volumen residual gástrico) alto>500 cc y requiere detener la nutrición enteral (NE) y esperar, aunque no hay consenso en esta cifra. Es preferible iniciar procinéticos de forma rutinaria14.
Algunos pacientes pueden presentar diarrea, ya que se ha descubierto la presencia de la proteína ACE2 (receptor del virus SARS-CoV-2) en células del esófago, estómago, duodeno y recto. Lo que sugiere una ruta de transmisión fecal-oral para este virus. Otra situación a tomar en cuenta es el riesgo que pueden tener algunos pacientes ancianos de desarrollar síndrome de realimentación, se recomienda iniciar con aproximadamente el 25% de las metas calóricas y después aumentar progresivamente, midiendo los niveles de potasio, magnesio y fósforo.
Posición pronoResulta muy frecuente que estos pacientes críticos con COVID-19 empeoren su hipoxemia a pesar del máximo apoyo dado por el ventilador mecánico. La posición prono es el proceso de colocar a un paciente en posición de tal manera que esté acostado con el pecho hacia abajo y hacia atrás (boca abajo). La posición prono se ha evaluado ampliamente en pacientes hospitalizados con ARDS desde que un estudio de 1976 mostró que colocar pacientes en posición prono podría mejorar la oxigenación. La indicación más frecuente es en pacientes que mantienen PaO2/FIO2 <150 con FIO2>50%15.
No existe evidencia que indique que nutrición enteral durante la posición prono aumente el riesgo de complicaciones. Sí se recomienda una estrecha monitorización de la tolerancia a la nutrición enteral para pacientes en posición prono. Las estrategias para aumentar la tolerancia de la NE a los pacientes en posición supina, como la elevación de la cabecera de la cama, la alimentación intestinal (yeyuno no es obligatorio) y el uso de un agente procinético, también pueden aumentar la tolerancia a la NE para los pacientes en posición prono16,17.
Se recomienda que en posición prono el paciente tenga una elevación del tórax entre 10-25° (posición de Trendelenburg inversa)12.
Nutrición parenteralLos pacientes con COVID-19 pueden requerir niveles significativos de sedación y bloqueo neuromuscular, lo que puede aumentar la incidencia de intolerancia gastrointestinal. Por lo tanto, el uso de nutrición parenteral (NP) debe utilizarse donde la alimentación enteral no está disponible o no logra completar el 60% de los requerimientos. Si existen limitaciones para la ruta enteral, se podría recomendar prescribir nutrición parenteral periférica en la población que no alcanza el objetivo proteico energético por nutrición oral o enteral8.
En caso de utilizar ventilación mecánica no invasiva (VMNI), la recomendación de comenzar la nutrición enteral podría verse afectada por el hecho de que la ubicación de la sonda enteral para la nutrición puede dar como resultado fuga de aire, por sello inadecuado, que puede comprometer la efectividad de la VMNI; dilataciones estomacales que pueden afectar la función diafragmática y afectan la efectividad de la VMNI. Las observaciones anteriores pueden explicar, al menos en parte, la implementación inadecuada de la NE que puede generar inanición del paciente, especialmente en las primeras 48 h de estadía en la UCI y un mayor riesgo de malnutrición y complicaciones relacionadas. Por lo tanto, la nutrición parenteral periférica puede considerarse en estas condiciones8.
Si se requiere NP en la primera semana de estadía en la UCI durante la fase inflamatoria aguda de COVID-19, el volumen y el contenido de dextrosa debe ser conservador, avanzando lentamente para alcanzar los mismos objetivos de energía. No se deben usar emulsiones lipídicas basadas en soja debido a su alto potencial proinflamatorio. Se recomienda lípidos omega-3. La mezcla de omega-3 y omega-9 del SMOF Lipid es una muy buena alternativa.
Considerar el uso de productos NP de bolsa multicámara como una forma potencial de disminuir el tiempo de elaboración del farmacéutico para la preparación de NP.
El uso adecuado de omega-3 (EPA y DHA) en el entorno de la UCI puede atenuar la respuesta metabólica a la lesión, reduce la pérdida de masa muscular magra, previene lesiones oxidativas en una variedad de tejidos, y mejora los resultados de la UCI. Los mecanismos propuestos para tales beneficios incluyen la modulación y limitación de la síntesis de mediadores proinflamatorios y la mejora de las vías para los mediadores antiinflamatorios18.
Una mejor comprensión de los beneficios observados ha sido recientemente apoyada por el descubrimiento y explicación de las moléculas de prorresolución especializadas. Estos compuestos, que se producen de manera endógena a partir de sustratos de EPA y DHA, han demostrado de manera concluyente y consistente que mejoran la resolución de la inflamación, mejoran la destrucción de bacterias por los macrófagos y promueven la regeneración de los tejidos19.
Las emulsiones de lípidos con omega-3 en nutrición parenteral parecen ser bien toleradas y otorgan beneficios clínicos adicionales, particularmente en pacientes de UCI, debido a sus efectos antiinflamatorios y de modulación inmunológica20.
Las Guías ESPEN 2019 en terapia intensiva recomiendan14:
- •
Lípidos intravenosos (incluidas las fuentes de lípidos no nutricionales) no debe exceder de 1,5g/ kg/día y debe adaptarse a tolerancia individual.Grado de recomendación: GPP y fuerte consenso (100% de acuerdo).
- •
Se pueden proporcionar emulsiones de lípidos parenterales enriquecidas con EPA y DHA (dosis de aceite de pescado: 0,1- 0,2g/kg/d) en pacientes que reciben NP.Grado de recomendación: 0 y fuerte consenso (100% de acuerdo).
Sobre la glutamina se debe recordar que las presentaciones comerciales de aminoácidos no contienen glutamina, siendo una limitante para el beneficio del paciente, ya que se trata de un metabolito inestable, con baja solubilidad, que precipita fácilmente y, en consecuencia, de difícil almacenamiento. Por ello se genera en forma de dipéptido: alanina-glutamina. En esta forma, es mucho más soluble, es estable en disolución y permite su hidrólisis inmediata con liberación de sus aminoácidos permitiendo la utilización de glutamina prácticamente al 100%.
Actualmente y basado en los estudios realizados hasta el momento, se acepta que la dosis a administrar por vía parenteral es de 0,3-0,5g/kg/d del dipéptido (aporte de 20-30g/d de glutamina) que se consideran que son suficientes para normalizar la concentración plasmática de glutamina en pacientes con hipercatabolismo21.
CaloríasPara el cálculo de los requerimientos calóricos se recomienda de manera empírica 15-20 kcal/kg/día los primeros 3-4 días en UCI y luego aumentar a 25-30kcal/kg/día. Lo ideal es usar la calorimetría indirecta a través de un equipo validado por ESPEN (COSMED Q-NRG) según el estudio ICALIC8,22. Garantizándose previamente que el personal cuente con equipo de protección personal adecuado y menor riesgo de contaminación y posteriormente esterilidad del equipo. ESPEN 20208 hace estas recomendaciones de calorías:
- •
27 kcal/kg/día - pacientes> 65 años con comorbilidades.
- •
30 kcal/kg/día - pacientes con comorbilidades y bajo peso.
- •
30 kcal/kg/día - para la mayoría de los pacientes. Ajustar según estado nutricional, nivel de actividad física, estado de la enfermedad y tolerancia.
Las Guías ASPEN12 recomiendan iniciar con 15-20kcal/kg/día la primera semana lo que representa un 70-80% del requerimiento calórico. Ya que en este periodo agudo existe una gran cantidad de sustratos circulando y dar el 100% de los requerimientos puede llevar a sobrenutrición. Las Guías brasileñas para COVID-1923 también recomiendan iniciar con 15-20kcal/kg/día durante los primeros 4 días en UCI y después progresar a 25kcal/kg/día.
ProteínasEl aporte de proteínas es crucial para mantener y evitar la pérdida de la masa libre de grasa (músculo) y para la síntesis de anticuerpos e inmunoglobulinas, tan necesarias para enfrentar al coronavirus. Por tanto se recomienda el uso de fórmulas hiperproteicas.
Según ESPEN 20208 las necesidades de proteínas generalmente se estiman utilizando fórmulas como:
1,0g/kg/día en personas mayores; la cantidad debe ajustarse individualmente con respecto al estado nutricional, nivel de actividad física, estado de la enfermedad y tolerancia.
> 1,0g/kg/día en pacientes hospitalizados polimórbidos para prevenir la pérdida de peso corporal, mejorar el resultado funcional y reducir el riesgo de complicaciones y reingreso hospitalario. En pacientes graves recomiendan 1,3g/kg/día8.
Las Guías ASPEN12 recomiendan el uso de fórmulas hiperproteicas para alcanzar una meta de 1,2-2,0g/kg/día. Las Guías brasileñas23, y Guías españolas24 recomiendan 1,5-2,0g/kg/día.
Muchos pacientes críticos con COVID-19 desarrollan falla renal que inclusive pueden requerir terapia de soporte dialítico. Es un grave error restringir el aporte de proteínas en estos pacientes críticos, ya existe suficiente literatura publicada25-28 que demuestra que estos pacientes evolucionan mejor recibiendo 1,5-2,0g/kg/día y deben dializarse. Jamás reducir el aporte de proteínas con la intención de evitar que el paciente requiera hemodiálisis. El uso de «fórmulas renales» está contraindicado en pacientes críticos por COVID-19 y falla renal. Cabe destacar que las «formulas renales» tienen doble densidad calórica y en su composición presentan mayor proporción de grasas; usar estas fórmulas solo para lograr un mayor aporte proteico, sin considerar que se ofrece igualmente un alto contenido de grasas y hidratos de carbono puede tener como consecuencia pobre control glucémico, hipertrigliceridemia e hipercapnia derivadas del aporte excesivo de calorías.
Pacientes críticos con falla renal en diálisis deben recibir más proteínas: 2,5g/k/día13.
GlutaminaGlutamina es el nutriente principal del sistema inmunológico, se utiliza rápidamente por subpoblaciones celulares del sistema inmune tales como los linfocitos, los macrófagos y los neutrófilos29-31. La glutamina es también el sustrato energético de células como los enterocitos y los colonocitos. Igualmente, la glutamina es captada ávidamente por los fibroblastos: las células precursoras de los fibrocitos involucrados en los procesos de reparación y cicatrización tisulares32. Todas estas células consumen glutamina preferencialmente gracias a la condición de este aminoácido como donante de átomos de carbono y nitrógeno. En virtud de lo anterior, se ha establecido a la glutamina como un aminoácido condicionalmente esencial en situaciones de estrés metabólico, debe ser aportado cuando la actividad metabólica de las subpoblaciones celulares antes mencionadas se incrementa notablemente como parte de los mecanismos de respuesta a la agresión.
La glutamina inhibe la expresión del factor nuclear kappa-beta (NF-kB) una molécula capaz de activar la expresión de cerca de 100 genes proinflamatorios33,34.
En resumen podemos concluir que un óptimo aporte de glutamina, en las dosis recomendadas, en pacientes críticos con COVID-19 se debe recomendar por dos razones:
- 1.
La glutamina es la fuente energética principal de las células del sistema inmunológico, ente principal que enfrenta al virus de manera natural.
- 2.
La glutamina tiene importante efecto antiinflamatorio, necesario para tratar de frenar la respuesta inflamatoria desmedida.
En pacientes críticos se ha recomendado su uso en diferentes guías y publicaciones35-38 demostrando reducción importante en infecciones, días en ventilador, días en UCI y menos días de hospitalización. Aminoácidos parenterales usualmente no contienen glutamina.
La dosis recomendada cuando se usa soluciones enriquecidas con glutamina es de 0,2-0,4g/kg/día, o cuando se utilice el dipéptido Ala-Glut es de 0,3-0,6g/kg/día37.
ArgininaLa arginina tiene entre sus acciones un efecto timotrófico, mejora la inmunidad celular, posee un efecto secretagogo, mejora el balance nitrogenado y es el precursor del óxido nítrico (ON). Su acción principal radica en ser el sustrato para dos enzimas claves en la activación inmune: la arginasa y la óxido nítrico sintasa inducible (iNOS)39. La arginasa cataliza la hidrólisis de la arginina durante el ciclo de la urea, dando lugar a la producción de urea y ornitina. La iNOS produce ON un vasodilatador encargado de regular el tono y la permeabilidad vascular, responsable de la perfusión vascular en múltiples tejidos y órganos, que actúa como agente antimicrobiano y bactericida y es utilizado por leucocitos y macrófagos para destruir gérmenes patógenos40.
Las Guías ASPEN 2016 contraindican el uso de arginina en sepsis. Pero su punto de corte fue el 31 de diciembre de 2013, es decir al salir en febrero de 2016 ya tenían 3 años de atraso, además no incluyen muchos estudios posteriores a favor de arginina en sepsis. Si al administrar estos farmaconutrientes (glutamina, arginina, omega-3) no se respetan las dosis recomendadas, y la indicación para óptimo soporte metabólico y terapia nutricional, los resultados no serán los esperados y no habrá buenos resultados.
Después de la pasada epidemia del SARS 2002 (virus SARS-CoV) se generaron algunos estudios que confirman que el óxido nítrico puede actuar contra este virus así41:
- -
ON inhibe la replicación viral del SARS CoV al frenar la palmitoliación de la proteína S42.
- -
ON inhibe la replicación viral y la síntesis de RNA.
- -
La vía de las toll like receptor se activa y favorece la síntesis de ON sintetaza, la cual actúa sobre el sustrato arginasa para producir más óxido nítrico43.
Estos pacientes graves con COVID-19 pueden perpetuarse en Cuidados Intensivos convirtiéndose en pacientes críticos crónicos (> 21 días en UCI)44 los cuales tienen una amplia diseminación de células mieloides supresoras las cuales expresan altos niveles de arginasa45, por tanto se reduce enormemente sus niveles de arginina. Tomando todo esto en cuenta y sobre todo el importante papel de la arginina en mantener la integridad del sistema inmunológico40,46 se recomienda el aporte extra de arginina en pacientes graves con COVID-19, la cual debe ser administrada en estos pacientes en dosis recomendadas aproximadas entre 15 a 25g/día.
Hidratos de carbonoLa glucosa continúa siendo el principal sustrato calórico en el paciente crítico. Una perfusión de glucosa a 4mg/kg/min solo suprime la neoglucogénesis en un 50% y el catabolismo proteico en un 10-15%, por lo que se recomienda no administrar nunca un aporte de glucosa> 5g/kg/día. En general, los hidratos de carbono representan el 50% de los requerimientos energéticos totales, aunque este porcentaje puede variar en dependencia de factores individuales y de la gravedad de la agresión24. Como consecuencia de su aporte y del estrés metabólico se produce hiperglucemia, que se ha asociado con peores resultados clínicos44, por ello se han realizado múltiples estudios y metaanálisis47,48, algunos de los cuales recomiendan mantener la glucemia en valores de entre 100 y 180mg/dl, recurriendo a insulina si se sobrepasa este límite, aunque no existe consenso respecto de la cifra límite más recomendable.
Muchos de los pacientes críticos con COVID-19 presentan cifras muy altas de glucemia, sean diabéticos o no, y los valores superiores a 180mg/dl estarían relacionados con peores resultados clínicos, sobre todo en complicaciones infecciosas, y el intento de mantener valores inferiores a 140mg/dl se asociaría con una mayor incidencia de hipoglucemias graves.
Las fórmulas nutricionales con alto contenido calórico (> 1,5kcal / ml) pueden reducir el tiempo de vaciado gástrico en algunos pacientes, especialmente en la fase aguda de la enfermedad, o en una posición prona, y los beneficios de cumplir con los requisitos nutricionales deben equilibrarse con el riesgo de intolerancia gastrointestinal49.
Con respecto la proporción de fórmulas de hidratos de carbono a grasas ESPEN recomienda una proporción de energía de grasas e hidratos de carbono entre 30:70 (sujetos sin deficiencia respiratoria) a 50:50 (pacientes ventilados)8.
Omega-3El aporte lipídico debe formar parte fundamental de la terapia nutricional ya que, además de aportar energía en poco volumen, es imprescindible para evitar un déficit de ácidos grasos esenciales (al menos un 2% de las calorías en forma de ácido linoléico y al menos un 0,5% en forma de ácido alfa-linolénico) y para mantener la estructura de las membranas celulares, así como para modular las señales intracelulares50,51. En comparación con los hidratos de carbono, el aporte de lípidos produce un menor efecto sobre la termogénesis, la lipogénesis, la estimulación de la liberación de insulina, la producción de CO2 y los valores de glucemia. El aporte total de lípidos debe estar en el rango de 0,7-1,5g/kg/día24.
Existe sobrada evidencia del efecto antiinflamatorio de los ácidos grasos omega-3 en ARDS y otras patologías inflamatorias52-55, para recomendarlos a pacientes con COVID-19, sobre todo a los pacientes críticos8,12.
Hoy se le presta atención a las resolvinas56. Las resolvinas son productos de la transformación enzimática de los ácidos grasos omega-3 que ayudan a la resolución de la inflamación. Dentro de las resolvinas se encuentran lipoxinas, resolvinas de la serie E, resolvinas de la serie D, protectinas y neuroprotectinas, y maresinas. Las resolvinas actúan localmente para controlar la extensión y la intensidad de la respuesta inflamatoria, protegen los tejidos y células inflamatorias locales que incluye la movilización de leucocitos en respuesta a señales quimiotácticas, la activación de fibrocitos para la síntesis y despliegue de un cerco de fibrina alrededor del foco primario, la salida de líquido hacia el intersticio para así diluir el efecto nocivo de los agentes causantes de la injuria, y la vasodilatación local con aumento de la permeabilidad capilar para facilitar la afluencia de las células inmunocompetentes al sitio de la lesión57.
En virtud de las propiedades antiinflamatorias de los ácidos grasos poliinsaturados omega-3, las emulsiones parenterales contentivas de estas especies químicas han sido empleadas en situaciones clínico-quirúrgicas donde se anticipa un elevado estrés metabólico, como la cirugía electiva, la sepsis y la infección, la falla de órganos, y la ventilación mecánica58.
Por consiguiente, basado en el alto potencial de los ácidos grasos omega-3 (EPA-DHA) para tener efectos antiinflamatorios en los pacientes críticos que se demuestran por reducción de los días en ventilador, días en UCI, días en hospital y evidentemente reducción de costos, se recomienda su aporte enteral o parenteral, para pacientes graves en ventilación mecánica con ARDS por COVID-19 a una dosis de EPA-DHA de 2-3g/día14,59-61.
MicronutrientesEn general, niveles bajos o ingestas insuficientes de micronutrientes como las vitaminas A, E, B6 y B12, Zn y selenio se han asociado con efectos adversos y malos resultados clínicos durante las infecciones virales62. Esta noción ha sido confirmada en una reciente revisión de Lei Zhang y Yunhui Liu63 quienes propusieron que además de las vitaminas A y D también las vitaminas B, C, ácidos grasos poliinsaturados omega-3, así como selenio, el cinc y hierro deben considerarse en la evaluación de micronutrientes en pacientes con COVID-19.
Estudios in vivo e in vitro han demostrado que los micronutrientes (vitaminas y minerales) con un amplia gama de efectos sobre la salud del cuerpo pueden regular las vías de señalización de los toll like receptors64.
Vitamina ALa predisposición a padecer infecciones virales o bacterianas se explica debido al papel de la vitamina A en la formación de una mucosa de las vías respiratorias intacta65. Las mucosas forman una barrera natural que tienen que atravesar los gérmenes que originan infecciones por la boca y la faringe. Una ingesta insuficiente de vitamina A provoca que los cilios de las mucosas de la nariz y los pulmones se vuelvan inmóviles y por lo tanto dejen de cumplir su función. Solo los cilios móviles son capaces de expulsar gérmenes intrusos u otras sustancias nocivas que accedan a las vías respiratorias antes de que puedan causar enfermedades. Con la reducción del movimiento de los cilios se forma además una mucosidad más espesa, medio de cultivo ideal para agentes patógenos66. También la mucosa intestinal tiene una importante función de barrera, y la vitamina A participa de forma decisiva en su efecto protector contra gérmenes patógenos. Además se considera que la vitamina A tiene un efecto directo sobre el sistema inmunitario, al influir en la formación y diferenciación de los glóbulos blancos. Esto es así especialmente en el caso de los linfocitos, que producen anticuerpos que ejercen un efecto protector en el conducto digestivo. La recomendación es 5.000 UI/día o 700-900 ug/día.
Vitaminas BLos complejos de vitaminas B están implicados en la defensa inmunitaria de diversas formas. Las vitaminas B6, B12 y B9 (folato) participan conjuntamente, entre otros, en la formación de proteínas relevantes para el sistema inmunitario y el ADN. Las vitaminas B se han relacionado especialmente con la mejora de la reacción inmune en enfermos graves67.
Vitamina CEl ácido ascórbico68 es una vitamina esencial, que no puede ser sintetizada por el ser humano, tiene numerosas propiedades biológicas comprobadas (antiinflamatorias, antioxidantes, inmunoestimulantes, antivirales)69,70 que pueden ser beneficiosas en pacientes con enfermedad por COVID-19. Además, es importante destacar que el ácido ascórbico tiene efectos sinérgicos probados cuando se combina con corticosteroides71. Por lo tanto, se recomiendan esteroides en pacientes con COVID-19 en insuficiencia respiratoria. El beneficio del ácido ascórbico (sin corticosteroides) en pacientes con insuficiencia respiratoria grave parece ser limitado. La vitamina C suprime la activación de NF-κB mediante la inhibición de la fosforilación inducida por el factor de necrosis tumoral α (TNFα) de la quinasa kappa-B inhibitoria (quinasa IκB).
La vitamina C también es compatible con las funciones inmunes y protege contra la infección causada por un coronavirus72. Atherton et al.73 informaron que la vitamina C aumentó la resistencia de cultivos de órganos traqueales de embriones de pollo a la infección por coronavirus aviar.
Vitamina DAdemás de desempeñar un papel fundamental en la regulación del metabolismo del calcio y el fosfato, la vitamina D también ejerce una función decisiva en la defensa inmunitaria. En la mayoría de los casos desarrolla sus beneficios junto con la vitamina A74,75.
Son muchos los indicios que apuntan a que si los niveles de vitamina D son bajos, las células asesinas del sistema inmunitario, las células T, no pueden activarse, por lo que no pueden luchar contra los agentes patógenos que se encuentran en el cuerpo. Solo cuando pasan de ser células normales del sistema inmunitario a convertirse en células asesinas son capaces de eliminar a los invasores76. Por lo tanto, la carencia de vitamina D parece estar asociada a un mayor riesgo de padecer infecciones del aparato respiratorio superior77.
Se consideran valores séricos bajos <20 ng/ml. Las dosis recomendadas son de 2.000 a 4.000 UI/día.
Vitamina ELa vitamina E también tiene efectos directos en la función inmunitaria, especialmente en enfermedades como la sepsis, así como también en personas mayores. Se ha podido establecer que en pacientes con sepsis grave el nivel de alfa tocoferol en suero era hasta un 68% menor que en voluntarios sanos. Cuanto menor era el nivel de alfa tocoferol, más severa era la enfermedad. Cuando la concentración de alfa tocoferol desciende se produce una muerte celular programada (apoptosis) de linfocitos. Esta mayor muerte celular de linfocitos que tiene lugar durante la sepsis se considera en general dañina, ya que debilita el sistema inmunitario78. Se debe administrar Vit E: 15-20mg/día.
Tiamina (B1)En aquellos pacientes con cifras elevadas de lactato el aporte de tiamina I.V. logra reducir las cifras del mismo con posible descenso en la mortalidad79. La tiamina puede revertir el estrés oxidativo que no está relacionado con la deficiencia de tiamina, lo que sugiere que la tiamina puede actuar como un antioxidante dirigido al sitio80. Por lo tanto, es probable que la deficiencia de tiamina agrave la lesión mitocondrial oxidativa y el fallo bioenergético causado por el agotamiento de la vitamina C. La dosis recomendada es de 200mg 2-3 veces/día.
CincEs un mineral necesario para el crecimiento, la diferenciación y la supervivencia celular, ya que participa en muchas funciones biológicas, como el metabolismo de proteínas y de ácidos nucleicos. Activa cientos de enzimas y puede actuar como agente antioxidante y antiinflamatorio. El incremento de cinc en la dieta reduce el estrés oxidativo y el daño en el ADN. Además de su importancia en el sistema inmune, también juega un importante papel en el sistema nervioso. Aunque desde hace años se sabe que deficiencias de cinc disminuyen la respuesta inmune, el mecanismo exacto por el que el cinc regula esta respuesta no está muy claro81.
Aumentando la concentración de cinc intracelular se puede deteriorar la replicación de una variedad de virus de RNA82. Además, el cinc inhibe la replicación del coronavirus del SARS (SARS-CoV). Por lo tanto, suplemento de cinc pueden tener efecto no solo en los síntomas relacionados con COVID-19 como diarrea e infección del tracto respiratorio inferior, pero también en COVID-19.
SelenioEl selenio es un oligoelemento esencial para los cambios redox en los mamíferos83. El estado nutricional del huésped juega un papel muy importante en la defensa contra enfermedades infecciosas84. La deficiencia nutricional impacta no solo la respuesta inmune sino también al virus en sí. La deficiencia de selenio en la dieta puede generar oxidación en el huésped, puede alterar el genoma viral, que normalmente el virus es benigno o levemente patógeno y puede volverse altamente virulento en el huésped deficiente de selenio bajo estrés oxidativo85.
La dosis recomendada es 100ug/día.
Ejercicio físico tempranoUna vez el paciente se encuentre en ventilación mecánica y sedado, debe iniciar un programa de ejercicio físico temprano para evitar la pérdida de masa muscular durante su permanencia en UCI que seguramente será prolongada (> 20 días en UCI)86,87. La gran mayoría de los pacientes críticos sedados en ventilador mecánico presentan los siguientes cambios:
- -
A las 4 h: deterioro muscular.
- -
A las 8 h: contracturas musculares.
- -
A las 48 h: se reduce la perfusión muscular, riesgo de isquemia y lesión.
- -
A la semana: se pierde el 10% de la masa muscular en voluntarios sanos.
Muchos pacientes salen de UCI pero pueden continuar con mucha debilidad que les impide ser autosuficientes inclusive después de su salida del hospital88,89. Una de las formas de evitar esto es que reciban nutrición hiperproteica durante su estadía en UCI y continuarse en la sala. Por el alto riesgo de contaminación por COVID-19 en vez de que el personal de Medicina Física y Rehabilitación permanezca al lado del paciente, se recomienda utilizar equipos mecánicos automatizados (Motomed) que mantienen la masa y fuerza muscular del paciente crítico.
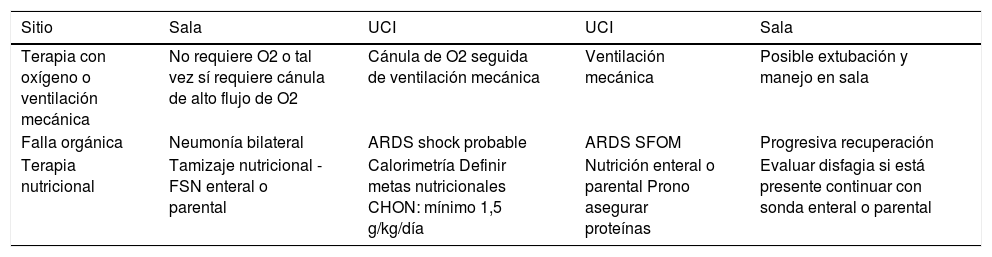
Finalmente debemos recordar que estas son recomendaciones para COVID-19 que ameritan manejo en Cuidados Intensivos por su condición de gravedad. La tabla 2 muestra un resumen de estas recomendaciones que podríamos utilizar ante la ausencia de estudios clínicos específicos con COVDI-19 y la tabla 3 muestra sus aplicaciones de acuerdo a las fases de la enfermedad en que se encuentre el paciente según ESPEN8.
Recomendaciones generales de terapia nutricional para pacientes graves COVID-19
| Recomendaciones | Micronutrientes |
| Evaluación Nutricional Must NRS2002 | Vitamina A: 700-900 ug |
| Calorimetría indirecta | Biotina: 250 ug/día |
| Iniciar <48 horas de UCI | Riboflavina: 50 ug/día |
| Nutrición enteral | Cianocobalamina: 50 ug/día |
| Parenteral: contraindicada la NE o no se tolera la NE | Tiamina:200mg 2/día |
| Macronutrientes | Vitamina C: 2 g IV c/6-8 h |
| Calorías: 25-30 Kcal/kg/día | Vitamina D: 2.000-4.000 UI/día |
| Proteínas: 1,5-2,0 g/kg/día | Vitamina E: 15-20 mg/día |
| Glutamina: 0,3-0,5 g/kg/día | Cinc: 75-100 mg/día |
| Arginina: 15-20 g/día | Selenio: 100 ug/día |
| Hidratos de carbono: 3-5 g/kg/día | |
| Glucemia<180 mg/dl | Ejercicio físico temprano |
| Lípidos: 0,5-1,5 g/kg/día | Evaluar por disfagia |
| Omega-3 (EPA-DHA) |
Fuente: elaboración propia.
Manejo nutricional según la fase en que se encuentre el paciente
| Sitio | Sala | UCI | UCI | Sala |
|---|---|---|---|---|
| Terapia con oxígeno o ventilación mecánica | No requiere O2 o tal vez sí requiere cánula de alto flujo de O2 | Cánula de O2 seguida de ventilación mecánica | Ventilación mecánica | Posible extubación y manejo en sala |
| Falla orgánica | Neumonía bilateral | ARDS shock probable | ARDS SFOM | Progresiva recuperación |
| Terapia nutricional | Tamizaje nutricional -FSN enteral o parental | Calorimetría Definir metas nutricionales CHON: mínimo 1,5 g/kg/día | Nutrición enteral o parental Prono asegurar proteínas | Evaluar disfagia si está presente continuar con sonda enteral o parental |
Fuente: ESPEN expert statements and practical guidance for nutritional management of individuals with SARS-CoV-2 infection90.
Esta pandemia de coronavirus ha tomado por sorpresa a todos los sistemas de salud del planeta, las cifras de contagios y muertes continúan lamentablemente en aumento a pesar de muchísimas medidas terapéuticas en los Cuidados Intensivos. Una parte fundamental de todo el armamentario terapéutico es la terapia nutricional que requieren estos pacientes desde su ingreso en la UCI, lo que ayuda a fortalecer su sistema inmunológico.
Desde promover una evaluación nutricional adecuada, incluyendo calorimetría indirecta en aquellos hospitales que cuentan con ella, sin que esto signifique exponer al personal de nutrición a contagios por COVID-19. Enfatizándose en el uso de la vía enteral, iniciando tempranamente con aportes hipocalóricos e hiperprotéicos y productos que ofrecen soporte metabólico y sobre todo efecto antiinflamatorio (glutamina, arginina, omega-3). Sumado al importante beneficio de recibir aportes extra de micronutrientes (vitaminas A, B, C y D, cinc, selenio) para fortalecer el sistema inmunológico.
Igualmente la importancia de que los pacientes puedan realizar ejercicio físico temprano, una vez esté más estable, para reducir debilidad por pérdida de masa magra, sin exponer al personal de salud a contagios.
Confiamos que estas recomendaciones puedan ser de mucha ayuda para tantos intensivistas y otros médicos que se están enfrentando a estos pacientes graves cada día.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.