La enfermedad por coronavirus COVID-19 ha generado la mayor crisis de salud pública de la era moderna. Se considera que el estado protrombótico inducido por la infección tiene una relación directa y de importancia sustancial con el daño agudo en el pulmón y con las complicaciones de la infección, incluida la muerte. Esta revisión de alcance (scoping review) resume y evalúa críticamente la evidencia sobre la relación entre la trombosis y la COVID-19, y se basa en una búsqueda bibliográfica sistemática de todos los artículos publicados hasta el 5 de mayo de 2020 e incluidos en las bases de datos PubMed, Scopus, Cochrane y Clinicaltrials.gov. Hemos incluido 26 artículos en la revisión, y hemos evaluado su calidad empleando la guía STROBE. Los principales síntomas que presentan los pacientes diagnosticados con COVID-19 son disnea, fiebre, tos, diarrea y vómitos. A nivel analítico destaca, en esta enfermedad, un aumento de dímero-D, fibrinógeno, tiempo de protrombina y linfopenia. En cuanto a las pruebas radiológicas, las técnicas más usadas para el diagnóstico de tromboembolismo pulmonar, trombosis venosa profunda y otros fenómenos trombóticos fueron la ecografía y la tomografía computarizada. Como conclusión, en la actualidad existe escasa evidencia científica con respecto a la COVID-19 y sus complicaciones trombóticas. Esta revisión resume este cuerpo de evidencia, evalúa su calidad, y ofrece conclusiones que orientan los siguientes pasos a dar en este área de investigación de enorme relevancia y crecimiento exponencial.
Coronavirus disease-19 (COVID-19) has triggered the worst public health crisis of modern times. The prothrombotic state induced by the infection is considered directly and substantially related to acute lung damage and other medical complications, including death. This scoping review summarises and critically assesses the existing evidence on the association between thrombosis and COVID-19, and is based on a systematic literature search of all articles published up to May 5th, 2020, included in the following databases: PubMed, Scopus, Cochrane, and Clinicaltrials.gov. A total of 26 articles were included, and their quality evaluated using STROBE guidelines. The main symptoms presented by patients that had been diagnosed with COVID-19 are dyspnoea, fever, cough, diarrhoea, and vomiting. In the laboratory findings, it is characteristic to observe an increase in D-dimer, fibrinogen, prothrombin time, and lymphopenia. Ultrasound and computed axial tomography were the radiological techniques most used for diagnosing pulmonary thromboembolism, deep vein thrombosis, and other thrombotic phenomena. In conclusion, there is still limited scientific evidence on COVID-19 and its thrombotic complications. This review summarises the body of evidence, assesses its quality, and offers conclusions that should help in the next steps in this highly relevant and expanding research area.
La pandemia de la enfermedad por coronavirus COVID-19, declarada el 11 febrero por la Organización Mundial de la Salud, ha generado una urgencia de salud pública mundial sin precedentes1. Hasta el 7 de junio de 2020 se registraron a nivel mundial cerca de 400.000 muertes (27.000 en torno a España hasta el 6 de junio) por COVID-192.
En el manejo clínico de la infección por SARS-CoV-2 no existe aún consenso sobre el tratamiento de elección: los regímenes terapéuticos han ido evolucionando conforme aumentaba el limitado conocimiento de la enfermedad con base en estudios de calidad heterogénea. En general, estos regímenes combinaban tratamientos etiológicos (antivirales), cobertura antibiótica, soporte respiratorio, inmunomoduladores como los corticoides (en este momento, la dexametasona es el único tratamiento con impacto claro sobre la mortalidad)3, o fármacos biológicos como anakinra o tocilizumab y diferentes métodos de tromboprofilaxis4,5.
Las alteraciones en la coagulación han ido ganando preponderancia dentro de los modelos fisiopatológicos más aceptados sobre la infección por SARS-CoV-2, y actualmente se considera que el estado protrombótico inducido por la infección tiene una relación directa y de importancia sustancial con el daño agudo en el pulmón y con las complicaciones de la infección, incluida la muerte6. En autopsias realizadas a pacientes con diagnóstico de COVID-19 se han detectado complicaciones trombóticas como trombosis venosa profunda o tromboembolismo pulmonar7. Sin embargo, existe aún un profundo desconocimiento en relación con el papel de la trombosis en las manifestaciones clínicas, patogenia y complicaciones y evolución de la enfermedad en la infección por SARS-CoV-25,8,9. Dadas las alteraciones severas de la coagulación se han propuesto diferentes rangos de profilaxis antitrombótica, incluso dosis anticoagulantes completas de manera empírica, sin que se haya realizado un estudio que demuestre el beneficio de las diferentes dosis. Esto ha llevado a una gran variabilidad en el manejo por parte de los profesionales sanitarios sin haberse evaluado aún la eficacia10,11.
El objetivo fundamental de esta scope review es revisar toda la literatura publicada acerca del papel de la trombosis en la infección por SARS-CoV-2, sus manifestaciones clínicas y sus complicaciones. Identificaremos toda la evidencia que existe sobre la relación entre trombosis y COVID-19, evaluaremos la calidad de la información publicada, y ofreceremos conclusiones en forma de resumen crítico de la evidencia y recomendaciones para la realización de futuros estudios.
Material y métodosPara esta scope review, seguimos el marco conceptual establecido por Arksey y ÓMalley, ampliamente aceptado en la literatura. Esta aproximación metodológica se basa en cinco puntos y se emplea como marco de referencia metodológico para realizar una scope review de forma correcta12.
Identificación de la pregunta de investigación¿Qué se conoce sobre la clínica trombótica causada por el SARS-CoV-2? ¿Existen síntomas similares entre los pacientes? ¿Existen hallazgos analíticos comunes en los pacientes con COVID-19? ¿Qué pruebas radiológicas han sido empleadas para el diagnóstico de las complicaciones trombóticas? ¿Cuál es la calidad de la evidencia publicada?
Identificación de estudios relevantesRealizamos una búsqueda sistemática de artículos científicos publicados a partir del 1 de diciembre de 2019, utilizando una combinación de los términos «COVID-19», «SARS-CoV-2», «thrombosis», «ultrasonography», «SCAN», «CTPA» y «coagulopathy» en los registros PubMed, Scopus, Cochrane y Clinicaltrials.gov, y la potenciamos buscando manualmente en la bibliografía de los artículos incluidos. En el material suplementario (Anexo 1) se muestran todas las combinaciones de palabras clave empleadas para la búsqueda. En el material suplementario (Anexo 2) se muestra un glosario de los términos médicos utilizados en este estudio.
Selección de estudiosIncluimos aquellos artículos que presentasen referencias a la infección y a las alteraciones clínicas, analíticas o radiológicas de la coagulación. Se excluyeron artículos no escritos en inglés o español. Establecimos como grupo de estudio a los adultos, permitiendo así la comparabilidad de los datos analíticos. Excluimos los estudios basados en mujeres embarazadas debido a la existencia de diferentes rangos analíticos. Esta revisión incluye publicaciones hasta el 5 de mayo de 2020.
Dos autores aplicaron los criterios de inclusión y exclusión de los artículos. Excluimos los artículos repetidos y, tras revisar inicialmente los títulos y resúmenes y, posteriormente, los textos completos, seleccionamos aquellos que trataban específicamente las manifestaciones clínicas, analíticas y radiológicas de la trombosis en pacientes con COVID-19. Evaluamos la calidad de los artículos incluidos siguiendo la escala STROBE por dos revisores, obteniéndose un índice kappa de 0,77.
Recopilación, resumen e informe de los resultadosClasificamos los artículos en tres áreas: clínica de la COVID-19, las alteraciones en los parámetros analíticos causados por el SARS-CoV-2 y los hallazgos radiológicos de estos pacientes.
Registro de los datosSe obtuvo de cada artículo el apellido del primer autor y su país de origen; la plataforma, revista y fecha de publicación; el tipo de artículo/estudio, tamaño muestral y las limitaciones descritas. Para comparar los hallazgos de laboratorio se extrajo de cada artículo el periodo de estudio y su población, así como los parámetros analíticos. En los artículos que profundizaron en la clínica y hallazgos radiológicos de la COVID-19 incluimos el porcentaje de las diferentes manifestaciones clínicas, las complicaciones trombóticas, así como los hallazgos por las dos técnicas de imagen más empleadas: la tomografía computarizada y la ecografía.
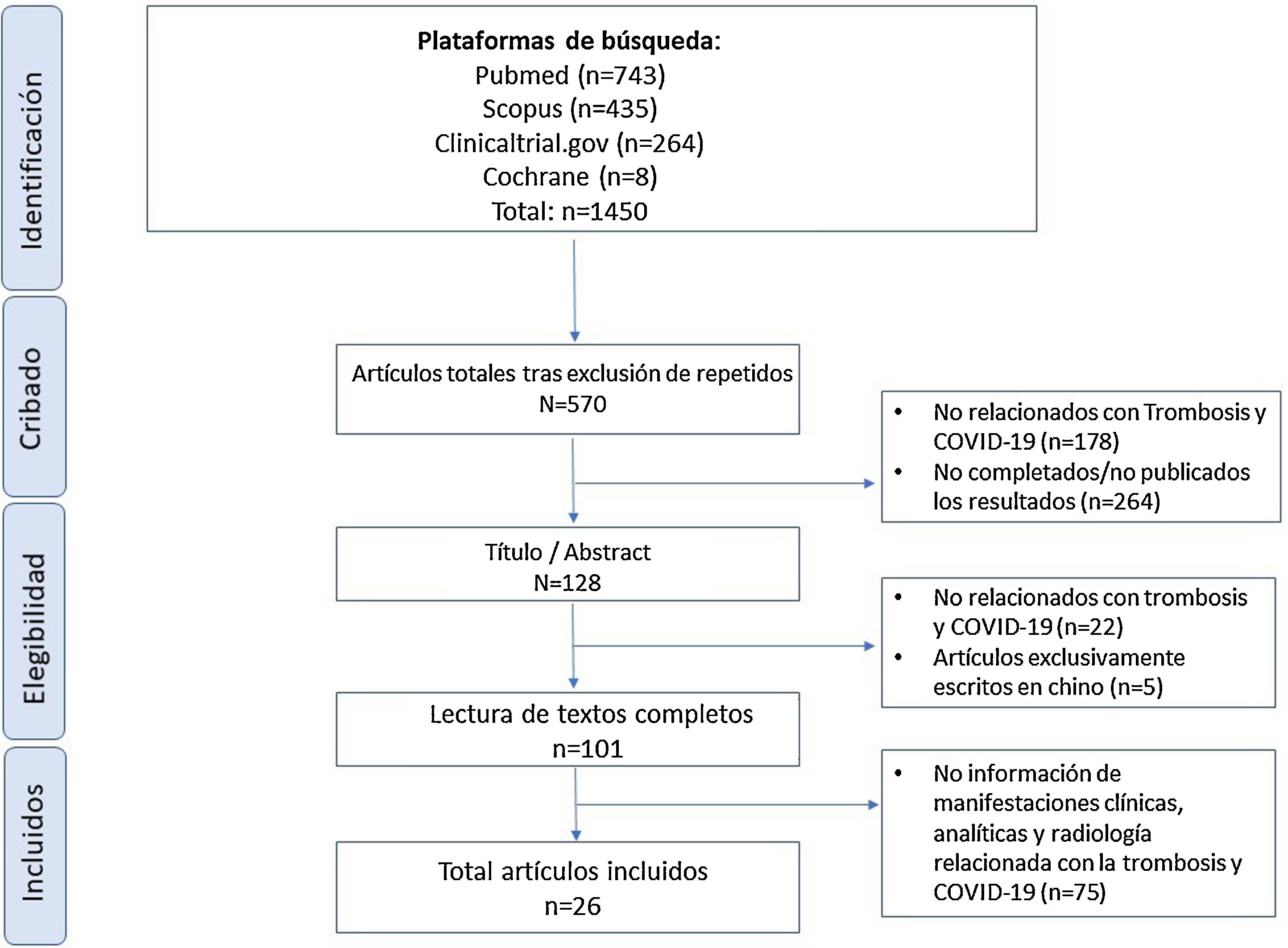
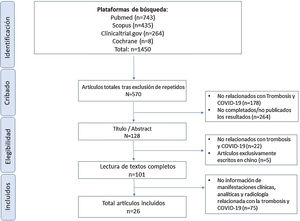
ResultadosCaracterísticas de los artículosTras la búsqueda inicial, encontramos 1.450 referencias; tras descartar publicaciones repetidas, el número quedó reducido a 570, que disminuyó a 128 artículos centrados en la relación entre COVID-19 y trombosis. Tras la lectura completa, seleccionamos 101 artículos por desarrollar explícitamente la relación entre COVID-19 y trombosis en su discusión o resultados.
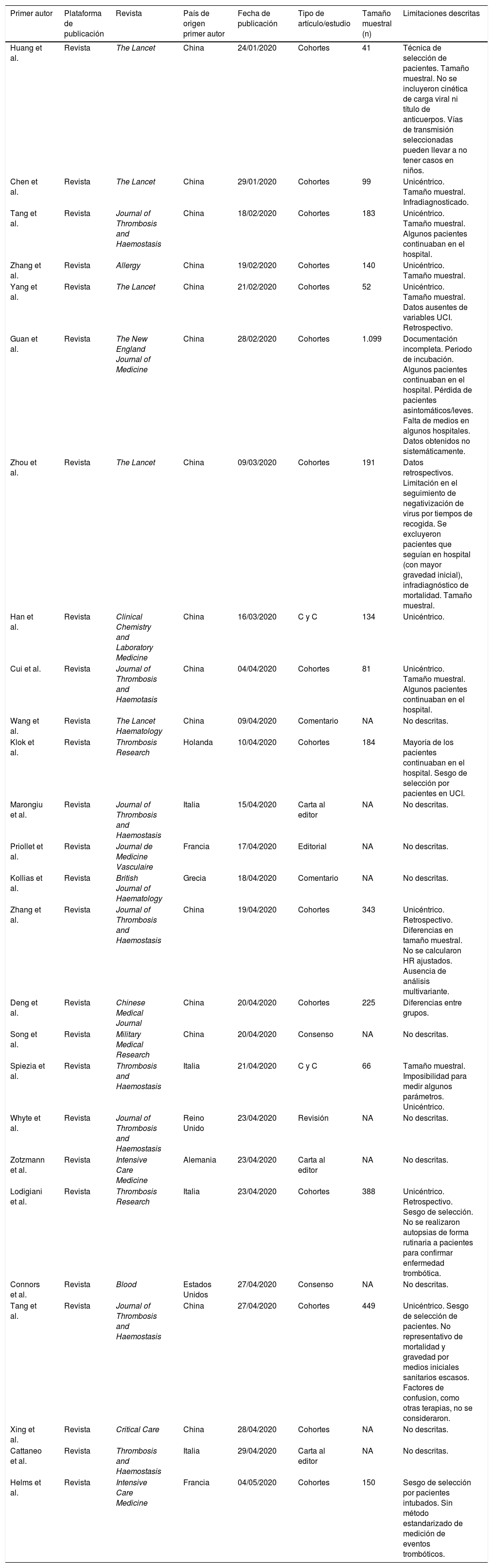
Finalmente, y tras una segunda lectura, se incluyeron un total de 26 artículos en esta revisión, por tratar específicamente las manifestaciones clínicas, radiológicas y analíticas de la trombosis en pacientes con COVID-19. Cabe destacar que el 57,6% de los artículos provienen de China y que de los 26 artículos, 17 son estudios observacionales. La figura 1 resume el flujo de inclusión de los artículos. El total de artículos incluidos con sus características se presentan en la tabla 1.
Características de los artículos/estudios incluidos en la scope review, del 1 de enero al 5 de mayo de 2020 (n = 26)
| Primer autor | Plataforma de publicación | Revista | País de origen primer autor | Fecha de publicación | Tipo de artículo/estudio | Tamaño muestral (n) | Limitaciones descritas |
|---|---|---|---|---|---|---|---|
| Huang et al. | Revista | The Lancet | China | 24/01/2020 | Cohortes | 41 | Técnica de selección de pacientes. Tamaño muestral. No se incluyeron cinética de carga viral ni título de anticuerpos. Vías de transmisión seleccionadas pueden llevar a no tener casos en niños. |
| Chen et al. | Revista | The Lancet | China | 29/01/2020 | Cohortes | 99 | Unicéntrico. Tamaño muestral. Infradiagnosticado. |
| Tang et al. | Revista | Journal of Thrombosis and Haemostasis | China | 18/02/2020 | Cohortes | 183 | Unicéntrico. Tamaño muestral. Algunos pacientes continuaban en el hospital. |
| Zhang et al. | Revista | Allergy | China | 19/02/2020 | Cohortes | 140 | Unicéntrico. Tamaño muestral. |
| Yang et al. | Revista | The Lancet | China | 21/02/2020 | Cohortes | 52 | Unicéntrico. Tamaño muestral. Datos ausentes de variables UCI. Retrospectivo. |
| Guan et al. | Revista | The New England Journal of Medicine | China | 28/02/2020 | Cohortes | 1.099 | Documentación incompleta. Periodo de incubación. Algunos pacientes continuaban en el hospital. Pérdida de pacientes asintomáticos/leves. Falta de medios en algunos hospitales. Datos obtenidos no sistemáticamente. |
| Zhou et al. | Revista | The Lancet | China | 09/03/2020 | Cohortes | 191 | Datos retrospectivos. Limitación en el seguimiento de negativización de virus por tiempos de recogida. Se excluyeron pacientes que seguían en hospital (con mayor gravedad inicial), infradiagnóstico de mortalidad. Tamaño muestral. |
| Han et al. | Revista | Clinical Chemistry and Laboratory Medicine | China | 16/03/2020 | C y C | 134 | Unicéntrico. |
| Cui et al. | Revista | Journal of Thrombosis and Haemotasis | China | 04/04/2020 | Cohortes | 81 | Unicéntrico. Tamaño muestral. Algunos pacientes continuaban en el hospital. |
| Wang et al. | Revista | The Lancet Haematology | China | 09/04/2020 | Comentario | NA | No descritas. |
| Klok et al. | Revista | Thrombosis Research | Holanda | 10/04/2020 | Cohortes | 184 | Mayoría de los pacientes continuaban en el hospital. Sesgo de selección por pacientes en UCI. |
| Marongiu et al. | Revista | Journal of Thrombosis and Haemostasis | Italia | 15/04/2020 | Carta al editor | NA | No descritas. |
| Priollet et al. | Revista | Journal de Medicine Vasculaire | Francia | 17/04/2020 | Editorial | NA | No descritas. |
| Kollias et al. | Revista | British Journal of Haematology | Grecia | 18/04/2020 | Comentario | NA | No descritas. |
| Zhang et al. | Revista | Journal of Thrombosis and Haemostasis | China | 19/04/2020 | Cohortes | 343 | Unicéntrico. Retrospectivo. Diferencias en tamaño muestral. No se calcularon HR ajustados. Ausencia de análisis multivariante. |
| Deng et al. | Revista | Chinese Medical Journal | China | 20/04/2020 | Cohortes | 225 | Diferencias entre grupos. |
| Song et al. | Revista | Military Medical Research | China | 20/04/2020 | Consenso | NA | No descritas. |
| Spiezia et al. | Revista | Thrombosis and Haemostasis | Italia | 21/04/2020 | C y C | 66 | Tamaño muestral. Imposibilidad para medir algunos parámetros. Unicéntrico. |
| Whyte et al. | Revista | Journal of Thrombosis and Haemostasis | Reino Unido | 23/04/2020 | Revisión | NA | No descritas. |
| Zotzmann et al. | Revista | Intensive Care Medicine | Alemania | 23/04/2020 | Carta al editor | NA | No descritas. |
| Lodigiani et al. | Revista | Thrombosis Research | Italia | 23/04/2020 | Cohortes | 388 | Unicéntrico. Retrospectivo. Sesgo de selección. No se realizaron autopsias de forma rutinaria a pacientes para confirmar enfermedad trombótica. |
| Connors et al. | Revista | Blood | Estados Unidos | 27/04/2020 | Consenso | NA | No descritas. |
| Tang et al. | Revista | Journal of Thrombosis and Haemostasis | China | 27/04/2020 | Cohortes | 449 | Unicéntrico. Sesgo de selección de pacientes. No representativo de mortalidad y gravedad por medios iniciales sanitarios escasos. Factores de confusion, como otras terapias, no se consideraron. |
| Xing et al. | Revista | Critical Care | China | 28/04/2020 | Cohortes | NA | No descritas. |
| Cattaneo et al. | Revista | Thrombosis and Haemostasis | Italia | 29/04/2020 | Carta al editor | NA | No descritas. |
| Helms et al. | Revista | Intensive Care Medicine | Francia | 04/05/2020 | Cohortes | 150 | Sesgo de selección por pacientes intubados. Sin método estandarizado de medición de eventos trombóticos. |
C y C: casos y controles; HR: hazard ratio; UCI: Unidad de Cuidados Intensivos; NA: no aplicable.
Los ensayos de Clinicaltrials.gov seleccionados (262) no pudieron ser incluidos al no estar publicados los resultados para la fecha final de búsqueda bibliográfica, centrados la mayoría en la tromboprofilaxis de la enfermedad.
Evaluamos la calidad de los artículos incluidos (26) siguiendo la escala STROBE por dos revisores (material suplementario, Anexo 3) Observamos elevada concordancia entre ambos revisores con un kappa = 0,77. Solo tres artículos describieron las medidas adoptadas para afrontar potenciales fuentes de sesgo, únicamente seis artículos explicaron cómo se determinó el tamaño muestral y tres discutieron la posibilidad de generalizar los resultados.
Los estudios incluidos en esta revisión no presentaron un tamaño muestral homogéneo, oscilando desde 1.099 pacientes en el realizado por Guan et al.13, hasta 41 pacientes por Huang et al.14, lo que dificulta su comparabilidad.
A su vez, los estudios incluidos en esta revisión presentaron grupos de comparación diferentes. Cui et al. compararon clínica y analíticamente pacientes que desarrollaron trombosis venosa profunda (TVP) frente a los que no15; Tang et al. dividieron su muestra en supervivientes y no supervivientes16. Zhang et al., por su parte, establecieron diferencias en la mortalidad en función del valor del dímero-D (DD)17. Huang et al. compararon pacientes ingresados en Unidad de Cuidados Intensivos (UCI) frente a ingresados en otras plantas14. Han et al. compararon los diagnosticados de COVID-19 frente a controles sanos18, al igual que Spiezia et al.19. Respecto a este punto cabe mencionar que la participación voluntaria en estudios se asocia a sujetos con un mayor interés científico y médico, que tienden a cuidar más su salud y, por lo tanto, no ser representativos de la población general20.
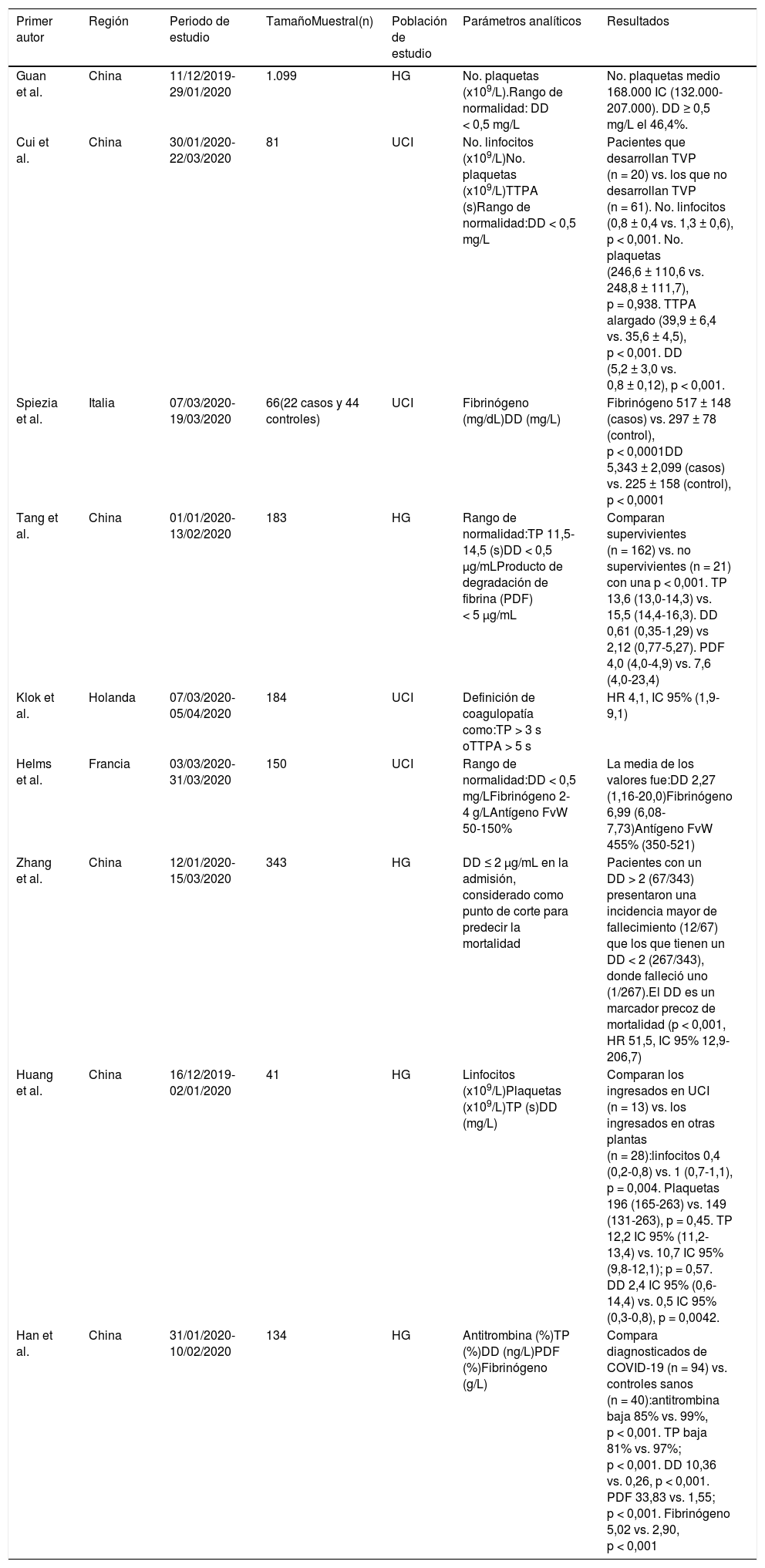
Características de los parámetros de coagulaciónCon relación a los parámetros analíticos, todos los artículos presentaron conclusiones similares, que se reflejan en la tabla 2.
Características analíticas de pacientes con COVID-19
| Primer autor | Región | Periodo de estudio | TamañoMuestral(n) | Población de estudio | Parámetros analíticos | Resultados |
|---|---|---|---|---|---|---|
| Guan et al. | China | 11/12/2019-29/01/2020 | 1.099 | HG | No. plaquetas (x109/L).Rango de normalidad: DD < 0,5 mg/L | No. plaquetas medio 168.000 IC (132.000-207.000). DD ≥ 0,5 mg/L el 46,4%. |
| Cui et al. | China | 30/01/2020-22/03/2020 | 81 | UCI | No. linfocitos (x109/L)No. plaquetas (x109/L)TTPA (s)Rango de normalidad:DD < 0,5 mg/L | Pacientes que desarrollan TVP (n = 20) vs. los que no desarrollan TVP (n = 61). No. linfocitos (0,8 ± 0,4 vs. 1,3 ± 0,6), p < 0,001. No. plaquetas (246,6 ± 110,6 vs. 248,8 ± 111,7), p = 0,938. TTPA alargado (39,9 ± 6,4 vs. 35,6 ± 4,5), p < 0,001. DD (5,2 ± 3,0 vs. 0,8 ± 0,12), p < 0,001. |
| Spiezia et al. | Italia | 07/03/2020-19/03/2020 | 66(22 casos y 44 controles) | UCI | Fibrinógeno (mg/dL)DD (mg/L) | Fibrinógeno 517 ± 148 (casos) vs. 297 ± 78 (control), p < 0,0001DD 5,343 ± 2,099 (casos) vs. 225 ± 158 (control), p < 0,0001 |
| Tang et al. | China | 01/01/2020- 13/02/2020 | 183 | HG | Rango de normalidad:TP 11,5-14,5 (s)DD < 0,5 μg/mLProducto de degradación de fibrina (PDF) < 5 μg/mL | Comparan supervivientes (n = 162) vs. no supervivientes (n = 21) con una p < 0,001. TP 13,6 (13,0-14,3) vs. 15,5 (14,4-16,3). DD 0,61 (0,35-1,29) vs 2,12 (0,77-5,27). PDF 4,0 (4,0-4,9) vs. 7,6 (4,0-23,4) |
| Klok et al. | Holanda | 07/03/2020-05/04/2020 | 184 | UCI | Definición de coagulopatía como:TP > 3 s oTTPA > 5 s | HR 4,1, IC 95% (1,9-9,1) |
| Helms et al. | Francia | 03/03/2020-31/03/2020 | 150 | UCI | Rango de normalidad:DD < 0,5 mg/LFibrinógeno 2-4 g/LAntígeno FvW 50-150% | La media de los valores fue:DD 2,27 (1,16-20,0)Fibrinógeno 6,99 (6,08-7,73)Antígeno FvW 455% (350-521) |
| Zhang et al. | China | 12/01/2020- 15/03/2020 | 343 | HG | DD ≤ 2 μg/mL en la admisión, considerado como punto de corte para predecir la mortalidad | Pacientes con un DD > 2 (67/343) presentaron una incidencia mayor de fallecimiento (12/67) que los que tienen un DD < 2 (267/343), donde falleció uno (1/267).El DD es un marcador precoz de mortalidad (p < 0,001, HR 51,5, IC 95% 12,9-206,7) |
| Huang et al. | China | 16/12/2019- 02/01/2020 | 41 | HG | Linfocitos (x109/L)Plaquetas (x109/L)TP (s)DD (mg/L) | Comparan los ingresados en UCI (n = 13) vs. los ingresados en otras plantas (n = 28):linfocitos 0,4 (0,2-0,8) vs. 1 (0,7-1,1), p = 0,004. Plaquetas 196 (165-263) vs. 149 (131-263), p = 0,45. TP 12,2 IC 95% (11,2-13,4) vs. 10,7 IC 95% (9,8-12,1); p = 0,57. DD 2,4 IC 95% (0,6-14,4) vs. 0,5 IC 95% (0,3-0,8), p = 0,0042. |
| Han et al. | China | 31/01/2020- 10/02/2020 | 134 | HG | Antitrombina (%)TP (%)DD (ng/L)PDF (%)Fibrinógeno (g/L) | Compara diagnosticados de COVID-19 (n = 94) vs. controles sanos (n = 40):antitrombina baja 85% vs. 99%, p < 0,001. TP baja 81% vs. 97%; p < 0,001. DD 10,36 vs. 0,26, p < 0,001. PDF 33,83 vs. 1,55; p < 0,001. Fibrinógeno 5,02 vs. 2,90, p < 0,001 |
DD: dímero-D; FvW: Factor de von Willebrand; HG: hospitalización general; HR: hazard ratio; IC: intervalo confianza; PDF: productos de degradación de la fibrina; TP: tiempo de protrombina; TTPA: tiempo de tromboplastina parcial activada; TVP: trombosis venosa profunda; UCI: Unidad de Cuidados Intensivos.
La primera serie descrita por Guan et al. sobre pacientes ingresados en la UCI por COVID-19 presentaba altos niveles de DD en el 46,4% de los casos13. Otro estudio llevado a cabo también en China comparó los parámetros analíticos en ingresados en UCI (n = 13) frente a ingresados en otras plantas (n = 28). Los pacientes de la UCI presentaban una cifra inferior de linfocitos, y unos valores de DD significativamente superiores a los hospitalizados en otros servicios14.
Posteriormente, otro grupo de investigación comparó los valores analíticos de los pacientes diagnosticados con COVID-19 (n = 94) frente a controles sanos (n = 40). Se obtuvo que tanto la antitrombina como el tiempo de protrombina (TP) presentaban unos valores inferiores en los diagnosticados de COVID-19 frente a los controles. Sin embargo, los niveles de DD, producto de degradación de la fibrina (PDF) y fibrinógeno fueron superiores en este grupo21. En otro estudio realizado en el mismo país, se compararon los valores analíticos de los supervivientes (n = 162) frente a los no supervivientes (n = 21) por COVID-19, mostrando unos niveles de TP, dímero-D y PDF superiores en fallecidos16.
Un estudio comparativo de pacientes diagnosticados con COVID-19 ingresados en la UCI que desarrollaron TVP (n = 20) frente a los que no la desarrollaron (n = 61), mostró que los primeros presentaban un tiempo de tromboplastina parcial activada (TTPA) alargado, elevados valores de DD, así como linfopenia significativa15.
Estudios de otras regiones geográficas reafirmaron los resultados previos. En Francia, un estudio sobre pacientes ingresados en la UCI mostró cifras de DD, fibrinógeno y actividad del antígeno factor de von Willebrand (FvW) superiores al rango de normalidad11. Una serie de casos y controles de pacientes de la UCI en Italia concluyó que el fibrinógeno y el DD estaban elevados en los casos19. En Holanda, Klok et al. definieron, para los pacientes en UCI ingresados por COVID-19, la coagulopatía como un TP mayor a tres segundos o un TTPA mayor a cinco segundos, y que el desarrollo de coagulopatía se asociaba con un riesgo prospectivo cuatro veces mayor de muerte10.
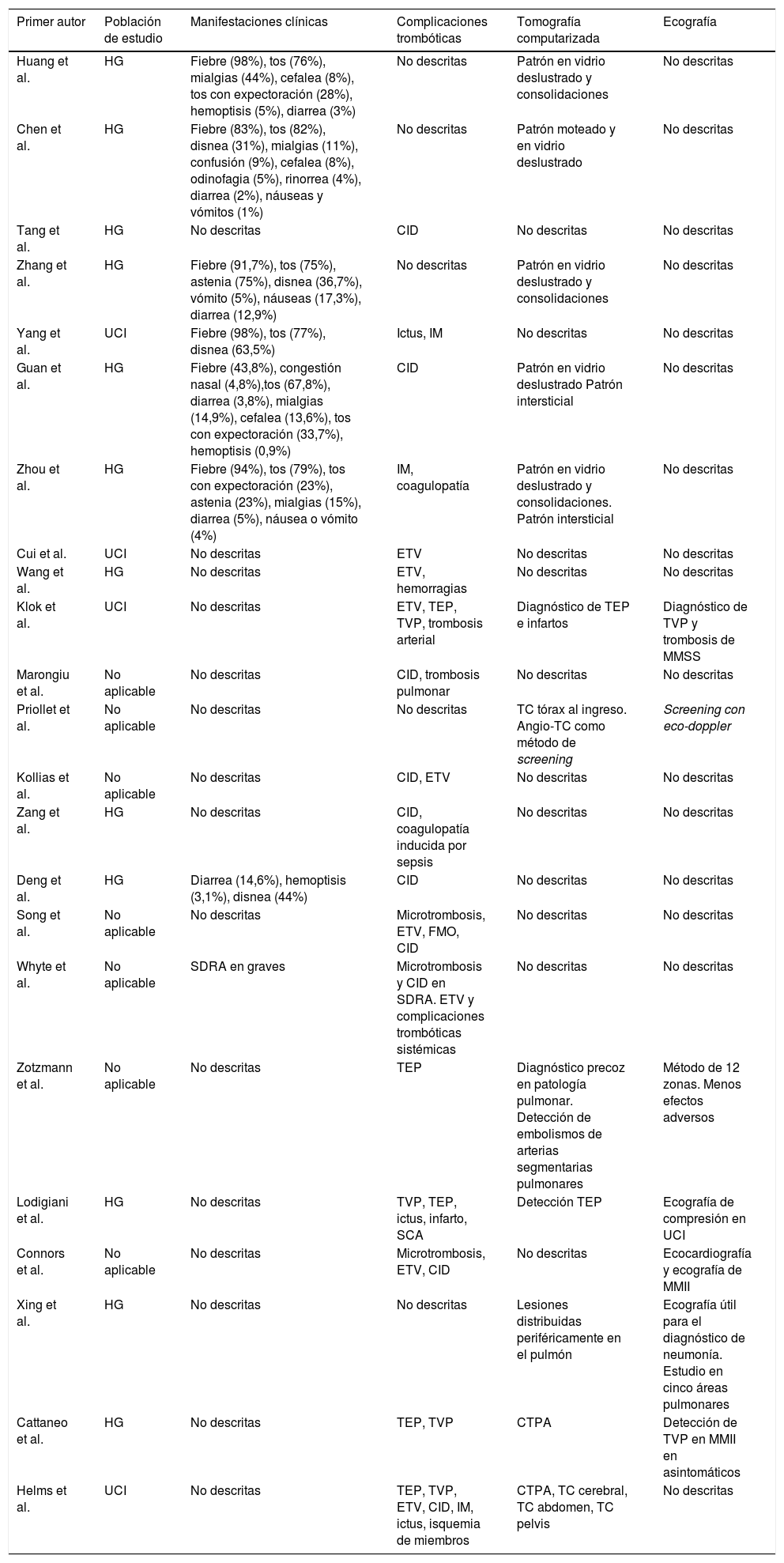
Características clínicas y radiológicas de los pacientes con COVID-19En cuanto a las manifestaciones clínicas y radiológicas asociadas a la coagulación, no todos los artículos seleccionados describieron dichas complicaciones, sus principales hallazgos se presentan en la tabla 3. Los primeros estudios publicados que describieron alteraciones analíticas en parámetros de la coagulación no registraron manifestaciones clínicas en relación a estos cambios, sino únicamente clínica respiratoria a causa de la neumonía y complicaciones gastrointestinales14,22.
Características clínicas y radiológicas de pacientes con COVID-19
| Primer autor | Población de estudio | Manifestaciones clínicas | Complicaciones trombóticas | Tomografía computarizada | Ecografía |
|---|---|---|---|---|---|
| Huang et al. | HG | Fiebre (98%), tos (76%), mialgias (44%), cefalea (8%), tos con expectoración (28%), hemoptisis (5%), diarrea (3%) | No descritas | Patrón en vidrio deslustrado y consolidaciones | No descritas |
| Chen et al. | HG | Fiebre (83%), tos (82%), disnea (31%), mialgias (11%), confusión (9%), cefalea (8%), odinofagia (5%), rinorrea (4%), diarrea (2%), náuseas y vómitos (1%) | No descritas | Patrón moteado y en vidrio deslustrado | No descritas |
| Tang et al. | HG | No descritas | CID | No descritas | No descritas |
| Zhang et al. | HG | Fiebre (91,7%), tos (75%), astenia (75%), disnea (36,7%), vómito (5%), náuseas (17,3%), diarrea (12,9%) | No descritas | Patrón en vidrio deslustrado y consolidaciones | No descritas |
| Yang et al. | UCI | Fiebre (98%), tos (77%), disnea (63,5%) | Ictus, IM | No descritas | No descritas |
| Guan et al. | HG | Fiebre (43,8%), congestión nasal (4,8%),tos (67,8%), diarrea (3,8%), mialgias (14,9%), cefalea (13,6%), tos con expectoración (33,7%), hemoptisis (0,9%) | CID | Patrón en vidrio deslustrado Patrón intersticial | No descritas |
| Zhou et al. | HG | Fiebre (94%), tos (79%), tos con expectoración (23%), astenia (23%), mialgias (15%), diarrea (5%), náusea o vómito (4%) | IM, coagulopatía | Patrón en vidrio deslustrado y consolidaciones. Patrón intersticial | No descritas |
| Cui et al. | UCI | No descritas | ETV | No descritas | No descritas |
| Wang et al. | HG | No descritas | ETV, hemorragias | No descritas | No descritas |
| Klok et al. | UCI | No descritas | ETV, TEP, TVP, trombosis arterial | Diagnóstico de TEP e infartos | Diagnóstico de TVP y trombosis de MMSS |
| Marongiu et al. | No aplicable | No descritas | CID, trombosis pulmonar | No descritas | No descritas |
| Priollet et al. | No aplicable | No descritas | No descritas | TC tórax al ingreso. Angio-TC como método de screening | Screening con eco-doppler |
| Kollias et al. | No aplicable | No descritas | CID, ETV | No descritas | No descritas |
| Zang et al. | HG | No descritas | CID, coagulopatía inducida por sepsis | No descritas | No descritas |
| Deng et al. | HG | Diarrea (14,6%), hemoptisis (3,1%), disnea (44%) | CID | No descritas | No descritas |
| Song et al. | No aplicable | No descritas | Microtrombosis, ETV, FMO, CID | No descritas | No descritas |
| Whyte et al. | No aplicable | SDRA en graves | Microtrombosis y CID en SDRA. ETV y complicaciones trombóticas sistémicas | No descritas | No descritas |
| Zotzmann et al. | No aplicable | No descritas | TEP | Diagnóstico precoz en patología pulmonar. Detección de embolismos de arterias segmentarias pulmonares | Método de 12 zonas. Menos efectos adversos |
| Lodigiani et al. | HG | No descritas | TVP, TEP, ictus, infarto, SCA | Detección TEP | Ecografía de compresión en UCI |
| Connors et al. | No aplicable | No descritas | Microtrombosis, ETV, CID | No descritas | Ecocardiografía y ecografía de MMII |
| Xing et al. | HG | No descritas | No descritas | Lesiones distribuidas periféricamente en el pulmón | Ecografía útil para el diagnóstico de neumonía. Estudio en cinco áreas pulmonares |
| Cattaneo et al. | HG | No descritas | TEP, TVP | CTPA | Detección de TVP en MMII en asintomáticos |
| Helms et al. | UCI | No descritas | TEP, TVP, ETV, CID, IM, ictus, isquemia de miembros | CTPA, TC cerebral, TC abdomen, TC pelvis | No descritas |
CID: coagulación intravascular diseminada; CTPA: angiografía pulmonar por tomografía computarizada; ETV: enfermedad tromboembólica venosa; FMO: fallo multiorgánico; HG: Hospital General; IM: infarto de miocardio; MMII: miembros inferiores; MMSS: miembros superiores; SCA: síndrome coronario agudo; SDRA: síndrome de distrés respiratorio agudo; TC: tomografía computarizada; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; UCI: Unidad de Cuidados Intensivos.
Tang et al. fueron los primeros en describir manifestaciones clínicas asociadas a estas alteraciones analíticas, sugiriendo por primera vez una relación entre la coagulación intravascular diseminada (CID) y la infección por SARS-CoV-223. De acuerdo con lo reportado por este grupo16, hasta tres de cada cuatro fallecidos cumplían criterios de la International Society on Thrombosis and Haemostasis para CID. En otros artículos más recientes se registraron los parámetros analíticos, pero no se recogieron complicaciones ni sintomatología trombóticas13,17,18. En artículos posteriores como el de Yang et al., aun describiéndose eventos de posible origen trombótico como ictus o paro cardíaco, no se establece asociación entre el virus y alteraciones de la coagulación24. Zhou et al. presentaron en sus resultados la coagulopatía como una de las complicaciones asociadas a la enfermedad, pese a no ser el eje central de su trabajo, describiendo la relación entre neumonía y alteraciones en los parámetros de coagulación, responsables de fenómenos protrombóticos e isquémicos en estos pacientes21.
Posteriormente, se publicaron estudios centrados en eventos trombóticos y SARS-CoV-2, como el realizado por Cui et al., que describe la presencia de enfermedad tromboembólica venosa (ETV) en la UCI de un hospital en Wuhan, China15; o el de Klok et al., que muestra la aparición de ETV, isquemia cardíaca o embolismos a nivel sistémico en pacientes infectados por el virus10. Otro estudio publicado por Wang et al. hizo referencia a la ETV como complicación y al riesgo de hemorragia asociado al tratamiento anticoagulante en estos pacientes25.
En los siguientes trabajos publicados, se sugiere la relación entre la coagulopatía con CID, ETV o trombosis pulmonar, y la infección por SARS-CoV-226,27. Zhang et al. describen la CID y la coagulopatía inducida por sepsis como complicaciones asociadas a las alteraciones analíticas que produce la infección viral17. Estudios como el de Deng et al. recogieron CID como complicación asociada a la neumonía por el coronavirus28. En el consenso elaborado por Song et al. se describen las alteraciones de la coagulación asociadas a la infección por SARS-CoV-2 y su manifestación en forma de CID, microtrombosis, ETV o incluso fallo multiorgánico; junto con otras alteraciones en relación al tratamiento anticoagulante (hemorragias a distintos niveles) u otros procedimientos como la oxigenación por membrana extracorpórea9. En la revisión realizada por Whyte et al. se mencionan complicaciones trombóticas asociadas al síndrome de distrés respiratorio agudo, como CID y microtrombos; además de complicaciones trombóticas a nivel sistémico29.
En la mayoría de los estudios más recientes se incluyen como principales complicaciones clínicas las manifestaciones trombóticas: CID, trombosis venosa profunda (TVP), tromboembolismo pulmonar (TEP), ictus isquémico o síndrome coronario agudo30,31.
Con respecto a las pruebas de imagen para el diagnóstico de complicaciones trombóticas, los artículos iniciales no aportaron información puesto que aún no estaban descritas estas complicaciones, únicamente se registró el uso de tomografía computarizada (TC) en algunos de ellos para la detección y caracterización de la neumonía13,14,17,21,22.
Se describe por primera vez la utilización de técnicas de imagen para la detección de fenómenos trombóticos en el estudio de Klok et al., empleándose la TC para el diagnóstico de TEP e infarto y la ecografía para el diagnóstico de TVP y trombosis de miembros superiores10. Posteriormente, se recomendó el uso de TC al ingreso de los pacientes como método diagnóstico, la angiografía pulmonar por TC (CTPA) para el screening de complicaciones pulmonares y realizar un eco-doppler para la detección de complicaciones trombóticas a otros niveles32. Zotzmann et al. describieron el uso de TC para el diagnóstico precoz de patología pulmonar y embolismos a este nivel. No obstante, recomiendan la ecografía como método de elección frente a la TC por ser un procedimiento de menor riesgo sin efectos adversos33.
En los estudios publicados más recientes se generalizó la utilización de técnicas de imagen para la detección de complicaciones trombóticas. Lodigiani et al. detectaron la presencia de TEP mediante TC y emplearon ultrasonografía de compresión en pacientes ingresados en la UCI30. En otros estudios se estandarizó el uso de ecografía para la detección de las complicaciones trombóticas31,34. Cattaneo et al. utilizaron tanto CTPA como eco-doppler de miembros inferiores, para la detección de complicaciones trombóticas35. Y más recientemente, Helms et al. realizaron CTPA, TC cerebral y TC de abdomen y pelvis en los pacientes de su estudio para detectar dichas complicaciones11.
DiscusiónEsta es la primera scope review que revisa los artículos que relacionan la infección por SARS-CoV-2 y las alteraciones en la coagulación, incluyendo sus repercusiones clínicas y radiológicas, en orden cronológico desde el 1 de diciembre de 2019 hasta el 5 mayo de 2020.
Los artículos revisados en este trabajo han sido seleccionados a partir de una búsqueda bibliográfica sistemática de toda la literatura disponible sobre la relación que existe entre la infección por el SARS-CoV-2 y la trombosis. De los 26 artículos incluidos, 15 fueron estudios de cohortes, tres cartas al editor, dos comentarios, dos consensos, dos casos y controles, una revisión y una editorial. El 57,6% de los estudios provienen de China. Esto se puede explicar porque los primeros pacientes descritos con COVID-19 fueron en este país. Un 15% de los estudios fueron realizados en Italia, país europeo que fue inicialmente el más afectado por la enfermedad.
Con respecto al diseño de estudio, un 57,6% fueron cohortes, solo un 7,6% casos y controles, y ningún ensayo clínico aleatorizado con resultados publicados, lo que limita la calidad de la evidencia científica. No obstante, en los próximos meses es de esperar que el número de ensayos publicados aumente y mejore la calidad de la evidencia.
Las diferencias en los grupos de comparación de los estudios podrían explicar algunas de las contradicciones en los resultados de las publicaciones. A nivel clínico, algunos artículos compararon supervivientes frente a no-supervivientes16, mientras que otros valoraron pacientes en UCI frente a hospitalización general14 y, por último, casos frente a controles sanos18. Los pacientes en UCI o aquellos fallecidos presentaron por lo general mayor frecuencia de variables clínicas de gravedad, como es de esperar, mientras que los hospitalizados no UCI una clínica más anodina.
Los principales síntomas que presentan los pacientes diagnosticados con COVID-19 son disnea, fiebre, tos, diarrea y vómitos. A nivel analítico, destaca característicamente un aumento de DD, fibrinógeno, TP y linfopenia. En cuanto a las pruebas radiológicas, las técnicas más usadas para el diagnóstico de TEP, TVP y otros fenómenos trombóticos fueron la ecografía y la TC. La presentación de fenómenos embólicos ha supuesto mayor morbimortalidad en los pacientes, aunque no se describe en todos ellos.
Guan et al. concluyeron en su estudio que la mayor parte de los pacientes no presentaban fiebre ni hallazgos radiológicos13. Estas afirmaciones contradicen lo descrito por otros autores como Huang et al., Zhang et al. o Zhou et al.14,17,21. No obstante, las diferencias en la población seleccionada y su localización geográfica podrían justificar estos resultados. Además, dentro de sus limitaciones Guan et al. admiten la pérdida de pacientes leves o asintomáticos, documentación y test de laboratorios incompletos, lo que supone un sesgo de selección.
Helms et al. y Tang et al. consideraron el límite de la normalidad de DD en < 0,5 μg/mL11,16, mientras que para Chen et al. su rango de normalidad es más amplio, desde 0 hasta 1,5 μg/mL22, siendo superado por el rango propuesto por Zhang et al. que consideraron normal un valor entre 0 y 0,243 μg/mL17. Esto demuestra que a nivel analítico se han empleado diferentes rangos de normalidad lo que puede llevar a distintas conclusiones, por la selección de un menor número de pacientes en aquellos casos en los que se establezca un punto de corte más elevado. No obstante, un punto de corte bajo implica una mayor sensibilidad que consideramos necesaria para registrar el mayor número de casos posibles ante el desconocimiento y gravedad de esta enfermedad, aunque luego implica realizar procedimientos más específicos confirmatorios.
Hay varias scope reviews publicadas hasta la fecha sobre la COVID-19, pero este estudio es el primero que analiza solo los artículos escritos acerca de la relación entre SARS-CoV-2 y la trombosis y que expone de forma ordenada y cronológica. Esta revisión amplía sustancialmente el periodo de estudio contemplado en la revisión de Lv et al., que trataba todos los aspectos clínicos de COVID-19 y no solamente la trombosis. En línea con esta revisión, encontramos que la publicación de artículos sobre COVID-19 sigue una tendencia exponencial36. La relevancia de este nuevo estudio radica en que puede servir para generar nuevas hipótesis y líneas de investigación, además de dar una visión global de la situación actual sobre COVID-19 y la trombosis. Hasta el 5 de mayo de 2020, se encontraban publicadas en PubMed 12 revisiones de alcance acerca de la enfermedad COVID-19. En Scopus se registraron siete, que ya estaban presentes en la búsqueda en PubMed. Sin embargo, no se encontró ninguna revisión de alcance publicada que tratase la relación COVID-19 y trombosis hasta la fecha.
Nuestra revisión incluye algunas limitaciones. En primer lugar, se introdujeron únicamente artículos publicados en inglés y se excluyeron los artículos escritos en chino, siendo éste el primer país afectado por la pandemia y con el mayor número de publicaciones. No obstante, lo más probable es que aquellos artículos de mayor evidencia científica estén publicados en inglés, si se tiene en cuenta el mayor impacto habitual de las revistas y la necesidad de varios editores y revisores. La segunda limitación que se presenta en este trabajo es que la fecha de fin de búsqueda e introducción de artículos fue el 5 de mayo, puede ser que existan artículos publicado a posteriori, que actualicen, confirmen o rechacen los resultados presentados en esta scope review. Por ejemplo, Klok et al. han confirmado sus resultados iniciales de elevada incidencia de fenómenos trombóticos en pacientes críticos con COVID-19, reportados en esta revisión10, con un nuevo reporte en el que amplían notablemente el seguimiento de los mismos pacientes y hallan resultados similares37. Los estudios incluidos en esta revisión son observacionales, debido a la ausencia de ensayos clínicos u otros estudios experimentales publicados o finalizados hasta la última fecha de búsqueda; y la mayor parte de ellos unicéntricos. Además, aunque las bases de datos consultadas albergan un volumen importante de información en ciencias de la salud, probablemente exista información científica sobre el tema objeto de estudio que no haya sido identificada en ellas; pero consideramos que al haber contrastado cuatro bases de datos se habrá encontrado la mayor parte de publicaciones sobre COVID-19 y trombosis.
Esta revisión pretender facilitar al lector una visión global y actualizada de la relación entre la COVID-19 y la trombosis. Además, permite apreciar las limitaciones de los estudios realizados hasta la fecha, con el fin de promover nuevos estudios que mejoren la evidencia actual.
ConclusiónEn la actualidad existe escasa evidencia científica con respecto a la enfermedad por SARS-CoV-2 y sus complicaciones trombóticas, debido al corto periodo de tiempo desde su descubrimiento. Por ello, se propone e incita a trabajar en nuevas líneas de investigación al respecto. De acuerdo con lo descrito en esta revisión y pese a que el número de artículos acerca de COVID-19 ha ido aumentando de forma exponencial hasta el 5 de mayo de 2020, sigue existiendo un amplio campo de estudio sin desarrollarse y es necesario continuar con la investigación de esta enfermedad y su relación con los fenómenos trombóticos.
AutoríaMaría Trinidad Baselga, María Luisa Fernández y Antonio Marín contribuyeron al artículo por igual.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo. En el momento de realizar el estudio, el Dr. Martínez-Alés estaba parcialmente financiado por una beca de la Fundación “la Caixa” (beca LCF/BQ/AA17/11610021).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece a Pilar Lancho Lavilla por la revisión de este estudio previo a su publicación.