Los coronavirus humanos son virus que se asocian a varias patologías respiratorias como el síndrome respiratorio agudo severo y el síndrome respiratorio del Medio Oriente. Esto ha puesto a esta familia de virus en el centro de atención de la comunidad científica debido a la alta patogenicidad en humanos, especialmente ahora con la nueva pandemia por la enfermedad por coronavirus del 2019 (COVID-19). La COVID-19 se manifiesta principalmente como enfermedad respiratoria aguda con compromiso respiratorio bajo, pero puede afectar múltiples órganos como lo es el riñón, lo cual a conlleva a peores desenlaces. En este manuscrito revisaremos el compromiso renal por los diferentes coronavirus, en especial en la COVID-19, al igual que las terapias que juegan algún papel en el tratamiento de esta.
Human coronaviruses are respiratory viruses that are associated with various respiratory diseases, such as severe acute respiratory syndrome and Middle East respiratory syndrome. This high pathogenicity puts coronaviruses in the spotlight of the scientific community, and due to the new coronavirus disease pandemic of 2019 (COVID-19). Although COVID-19 manifests mainly as an acute respiratory disease with low respiratory compromise, it can also affect multiple organs such as the kidney, which leads to worse outcomes. In this article, a review is presented on the renal compromise due to coronaviruses, especially in COVID-19, and the therapies that have a role in its treatment.
Los coronavirus (CoV) son virus de ARN de sentido positivo monocatenarios, con capacidad de mutación y recombinación rápidas1. Se sabe que los coronavirus causan infecciones respiratorias o intestinales en humanos y animales2. La aparición del virus del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), que causa la enfermedad del coronavirus 2019 (COVID-19, por sus siglas en inglés), se ha convertido rápidamente en una pandemia y se ha informado que una gran proporción de pacientes afectados tienen comorbilidades subyacentes que son potenciales causas de daño renal3,4. En este artículo, revisamos brevemente los conceptos básicos de los coronavirus y sus posibles efectos en el sistema renal y el compromiso renal agudo que genera la COVID-19.
Los coronavirus humanosEstructura y clasificaciónLos CoV reciben el nombre por la ultraestuctura de los mismos la cual consta de picos en forma de corona en su superficie y se agrupan en la subfamilia Coronaviridae. Esta familia se clasifica por agrupación filogenética, en cuatro grupos: α, β, γ y δ, de los cuales se sabe que α y β causan infección en humanos1. Los CoV contienen cuatro proteínas estructurales principales: la proteína espiga (S) (que participa en la unión del receptor del huésped y la posterior fusión del virus a la membrana celular), la proteína de la nucleocápside (N), la proteína de la membrana (M) y proteína de envoltura (E)5.
El primer CoV humano (HCoV) se identificó hace más de 50 años en cultivos de órganos traqueales embrionarios humanos6. A la fecha, cuatro tipos de HCoV son endémicos en humanos y generalmente causan infecciones respiratorias autolimitadas, que representan del 15% al ??30% de los resfriados comunes7. La infección con estos HCoV generalmente causa infecciones leves de las vías respiratorias superiores en adultos jóvenes, pero puede conducir a la hospitalización en pacientes de edad avanzada con enfermedad cardíaca y pulmonar subyacente8. Aunque la mayoría de las infecciones por HCoV son leves, las epidemias de coronavirus del síndrome respiratorio agudo severo (SARS-CoV) y coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV) han causado más de 10.000 casos en los últimos veinte años, con tasas de mortalidad del 10% para SARS-CoV y del 37% para MERS-CoV9.
Complicaciones renales del SARS-CoVEntre los pacientes con síndrome respiratorio agudo severo (SARS) asociado a CoV confirmado, encontramos un número significativo de casos con disfunción renal aguda. Chu et al. encontraron en su estudio de 536 pacientes con SARS, que 36 pacientes (6,7%) desarrollaron lesión renal aguda (LRA), con una duración media de 20 días (rango 5-48 días) después del inicio de la infección viral, a pesar de un nivel de creatinina sérica (CrS) normal al inicio del cuadro clínico10. Además, descubrieron que 33 pacientes con SARS y LRA presentaron una tasa de mortalidad significativamente mayor que aquellos sin compromiso renal (91,7% vs. 8,8%) (p < 0,0001)10.
Complicaciones renales del MERS-CoVLa prevalencia de manifestaciones extrapulmonares en el MERS-CoV se ha estimado en 92% de los pacientes, donde el 58% presentan compromiso renal11. En el estudio de Cha et al.12, se obtuvieron datos de 30 pacientes coreanos. Hallaron que 18 pacientes (60%) tenían proteinuria o hematuria en dos uroanálisis consecutivos, 15 (50%) pacientes mostraron resultados de más de 100 mg/g en la relación albuminuria/creatininuria y 8 (26,7%) pacientes mostraron LRA, la cual se evidenció a los 16 días con duración promedio de 18 días. La edad avanzada se asoció con una mayor incidencia de LRA en el análisis univariado y siguió siendo un predictor independiente y significativo después del ajuste por comorbilidades y la ventilación mecánica12.
Coronavirus 2 del síndrome respiratorio agudo severoSimilar a la aparición de los otros dos coronavirus, en diciembre de 2019 varios centros de salud de Wuhan, provincia de Hubei, China, informaron la aparición de un cuadro respiratorio de etiología desconocida13,14. El 9 de enero de 2020, un nuevo coronavirus fue identificado oficialmente como el responsable de este cuadro clínico, y para el 11 de febrero, el Comité Internacional de Taxonomía de Virus anunció el nombre del virus como «SARS-CoV-2». Este nombre fue elegido porque tanto el SARS-CoV-2 y el SARS-CoV están genéticamente relacionados, aunque son estructuralmente diferentes15.
El SARS-CoV-2 pertenece a la agrupación filogenética β y, similar al SARS-CoV, utiliza la enzima convertidora de angiotensina 2 como receptor para ingresar a la célula huésped16, además de que causa un cuadro clínico similar al SARS-CoV, caracterizado por síntomas respiratorios que varían de dificultad respiratoria leve a severa9,17-19 Además, comparte muchos hallazgos epidemiológicos, clínicos, radiológicos y de laboratorio, similares a la infección por SARS-CoV de 20039,17-19. La transmisión del SARS-CoV-2 principalmente es dada persona a persona a través del contacto cercano, por gotas respiratorias y tiene un período de incubación entre cuatro a 14 días20-22.
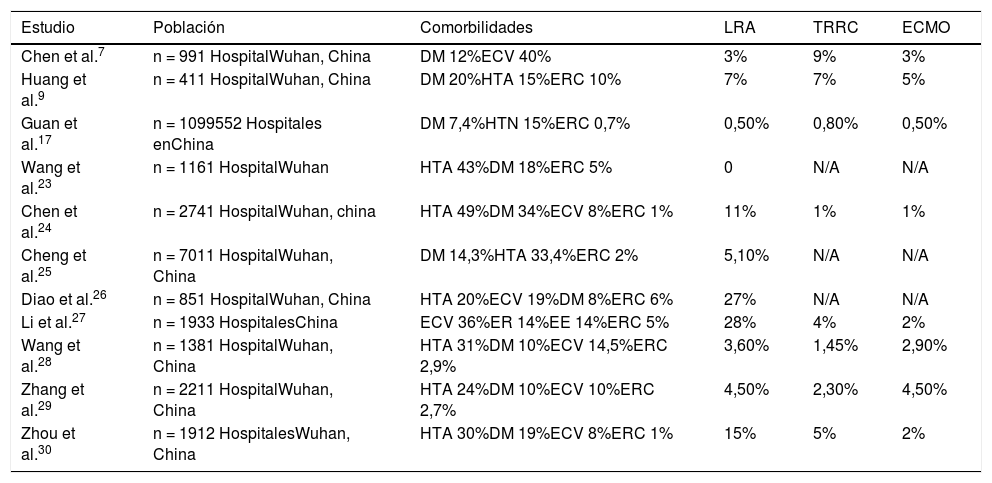
EpidemiologíaEl reporte de LRA en los pacientes con COVID-19 ha variado a través del tiempo con una prevalencia del 0,5% al 28%7,9,17,23-30. En una de las primeras cohortes publicada de 41 pacientes en Wuhan, China, sin antecedentes de enfermedad renal crónica (ERC), 7% cumplían los criterios para LRA, donde el 10% de los pacientes presentaron elevación de CrS (> 1,5 mg/dL)9. En cuanto a la incidencia se ha reportado que oscila entre el 1 al 28% (tabla 1).
Prevalencia de lesión renal aguda y manejo en pacientes con COVID-197,9,17,23-30
| Estudio | Población | Comorbilidades | LRA | TRRC | ECMO |
|---|---|---|---|---|---|
| Chen et al.7 | n = 991 HospitalWuhan, China | DM 12%ECV 40% | 3% | 9% | 3% |
| Huang et al.9 | n = 411 HospitalWuhan, China | DM 20%HTA 15%ERC 10% | 7% | 7% | 5% |
| Guan et al.17 | n = 1099552 Hospitales enChina | DM 7,4%HTN 15%ERC 0,7% | 0,50% | 0,80% | 0,50% |
| Wang et al.23 | n = 1161 HospitalWuhan | HTA 43%DM 18%ERC 5% | 0 | N/A | N/A |
| Chen et al.24 | n = 2741 HospitalWuhan, china | HTA 49%DM 34%ECV 8%ERC 1% | 11% | 1% | 1% |
| Cheng et al.25 | n = 7011 HospitalWuhan, China | DM 14,3%HTA 33,4%ERC 2% | 5,10% | N/A | N/A |
| Diao et al.26 | n = 851 HospitalWuhan, China | HTA 20%ECV 19%DM 8%ERC 6% | 27% | N/A | N/A |
| Li et al.27 | n = 1933 HospitalesChina | ECV 36%ER 14%EE 14%ERC 5% | 28% | 4% | 2% |
| Wang et al.28 | n = 1381 HospitalWuhan, China | HTA 31%DM 10%ECV 14,5%ERC 2,9% | 3,60% | 1,45% | 2,90% |
| Zhang et al.29 | n = 2211 HospitalWuhan, China | HTA 24%DM 10%ECV 10%ERC 2,7% | 4,50% | 2,30% | 4,50% |
| Zhou et al.30 | n = 1912 HospitalesWuhan, China | HTA 30%DM 19%ECV 8%ERC 1% | 15% | 5% | 2% |
DM: diabetes mellitus; ECMO: oxigenación por membrana extracorpórea; ECV: enfermedad cardiovascular; EE: enfermedad endocrina; ER: enfermedad respiratoria; ERC: enfermedad renal crónica; HTA: hipertensión arterial; LRA: lesión renal aguda; TRRC: terapia de reemplazo renal continua.
No todos los estudios han mostrado una clara relación entre la infección por COVID-19 y LRA. En el estudio prospectivo de 116 pacientes realizado por Luwen Wang23, el cual buscaba establecer los efectos de la infección por COVID-19 a nivel renal, solo el 10,8% de los casos presentaron elevaciones leves del nitrógeno ureico en sangre (BUN) o CrS, sin cumplir criterios para LRA, incluso en los cinco pacientes con ERC.
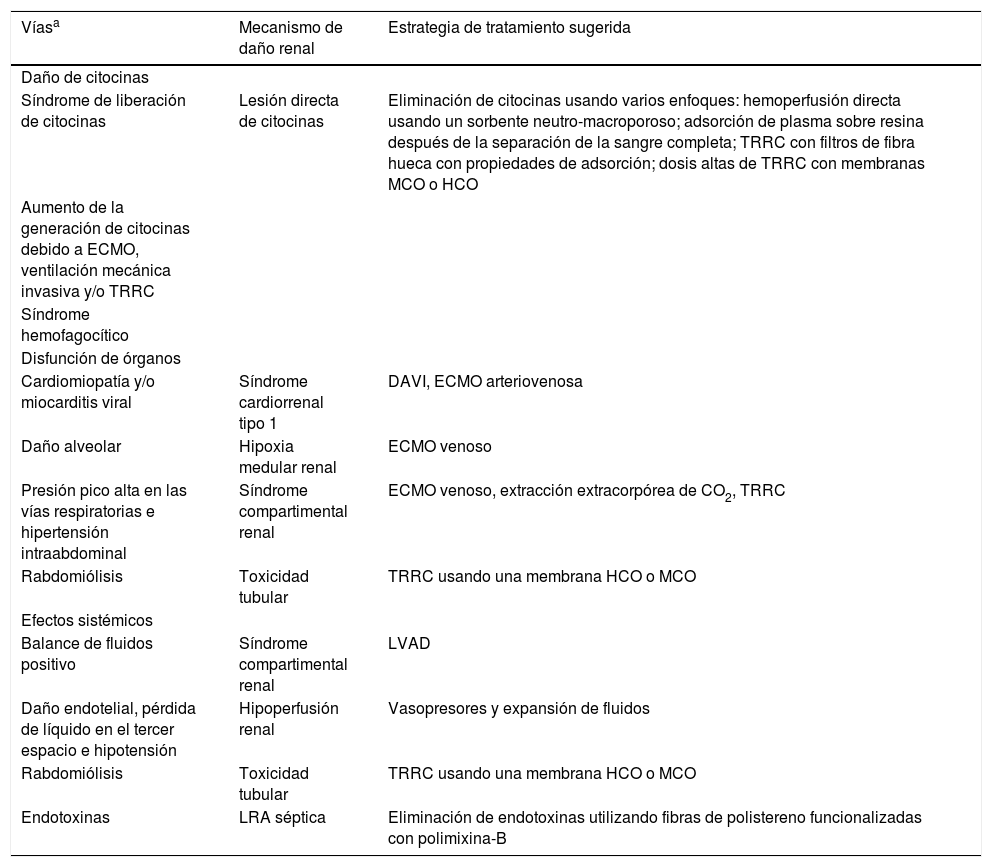
FisiopatologíaDentro de los mecanismos potenciales que explican el daño renal se han clasificado en cuatro aspectos: daño por citocinas, interacción recíproca con los otros órganos, efectos sistémicos relacionados a la ventilación mecánica y el síndrome de dificultad respiratoria aguda (SDRA)31 (tabla 2).
Mecanismos propuestos de lesión renal aguda en COVID-19
| Víasa | Mecanismo de daño renal | Estrategia de tratamiento sugerida |
|---|---|---|
| Daño de citocinas | ||
| Síndrome de liberación de citocinas | Lesión directa de citocinas | Eliminación de citocinas usando varios enfoques: hemoperfusión directa usando un sorbente neutro-macroporoso; adsorción de plasma sobre resina después de la separación de la sangre completa; TRRC con filtros de fibra hueca con propiedades de adsorción; dosis altas de TRRC con membranas MCO o HCO |
| Aumento de la generación de citocinas debido a ECMO, ventilación mecánica invasiva y/o TRRC | ||
| Síndrome hemofagocítico | ||
| Disfunción de órganos | ||
| Cardiomiopatía y/o miocarditis viral | Síndrome cardiorrenal tipo 1 | DAVI, ECMO arteriovenosa |
| Daño alveolar | Hipoxia medular renal | ECMO venoso |
| Presión pico alta en las vías respiratorias e hipertensión intraabdominal | Síndrome compartimental renal | ECMO venoso, extracción extracorpórea de CO2, TRRC |
| Rabdomiólisis | Toxicidad tubular | TRRC usando una membrana HCO o MCO |
| Efectos sistémicos | ||
| Balance de fluidos positivo | Síndrome compartimental renal | LVAD |
| Daño endotelial, pérdida de líquido en el tercer espacio e hipotensión | Hipoperfusión renal | Vasopresores y expansión de fluidos |
| Rabdomiólisis | Toxicidad tubular | TRRC usando una membrana HCO o MCO |
| Endotoxinas | LRA séptica | Eliminación de endotoxinas utilizando fibras de polistereno funcionalizadas con polimixina-B |
DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenación por membrana extracorpórea; HCO: alto corte; LRA: lesión renal aguda; MCO: corte medio; TRRC: terapia de reemplazo renal continua.
Las vías y mecanismos están interconectados y las estrategias de tratamiento influirán en diferentes aspectos simultáneamente.
Tomada y adaptada de Ronco et al.31
El síndrome de liberación de citocinas (SLC), también llamado tormenta de citosinas, puede ocurrir en múltiples condiciones como la sepsis, síndrome hemofagocítico y la terapia antineoplásica32. La aparición de SLC con la COVID-19 se ha documentado desde los primeros reportes de la enfermedad9,33. En el SLC, el daño renal se asocia con inflamación intrarrenal, incremento de la permeabilidad vascular, depleción de volumen y cardiomiopatía, que se relaciona con la aparición de un síndrome cardiorrenal tipo 1. Este síndrome se ha descrito con lesión endotelial sistémica que se manifiesta con derrames pleurales, hipertensión intraabdominal, depleción de volumen severa e hipotensión.
Múltiples citocinas se han relacionado con el SLC, pero la interleucina 6 (IL-6) ha mostrado un rol crítico en los pacientes con COVID-19 que ha mostrado un aumento importante en sus niveles sanguíneos en el SDRA33. Otras causas relacionadas con la aparición de SLC es el uso de terapias extracorpóreas como la membrana de oxigenación extracorpórea (ECMO), ventilación mecánica invasiva y la terapia de soporte renal continuo (TRRC). Terapias como el bloqueo monoclonal por anticuerpos contra la IL-6 se ha usado en este síndrome y en la pandemia de COVID-19.
Interacción recíproca entre los órganosRecientemente se ha confirmado la relación entre el daño alveolar y tubular en el SDRA. En el 2019 se evidenció en 357 pacientes con neumonía y SDRA, quienes tuvieron una incidencia de LRA en un 68%34. Los factores de riesgo de aparición y severidad de LRA fueron la edad, alto índice de masa corporal, diabetes mellitus, historia de falla cardiaca, presión pico elevada de la vía aérea y elevada puntuación de la escala de SOFA (Sequential Organ Failure Assessment). La presión positiva al final de la espiración, la posición prona y exposición a agentes nefrotóxicos no se relacionó con la aparición de LRA.
El daño renal tubular promueve la sobrerregulación y sobreproducción sérica de la IL-6 en LRA que se asocia con el aumento en la permeabilidad alvéolo-capilar y aparición de sangrado alveolar35. En 201 pacientes confirmados con COVID -19 se reportó que 41,8% presentaron SDRA y 4,5% tuvieron LRA9; esta población no mostró una relación positiva entre los niveles de IL-6 y el compromiso multiorgánico. Se han visto diferencias entre la prevalencia de LRA en pacientes con SDRA secundario a COVID-19 (4,5%)9, comparada con los pacientes que tienen SDRA asociada a otras causas (68%)34.
El SLC se asocia a miocarditis viral que lleva a congestión venosa renal, hipotensión e hipoperfusión renal, desembocando en caída de la tasa de filtración glomerular. El ECMO es un soporte cardiopulmonar que se puede usar de manera simultánea con TRRC y su adecuada y segura interacción también define el adecuado comportamiento de los órganos comprometidos.
Efectos sistémicosEn los pacientes con COVID-19 con choque es frecuente encontrar una sobrecarga de volumen hídrico asociada al manejo médico. La sobrecarga hídrica ha demostrado un impacto negativo en los pacientes con SDRA, incrementando la fuga alvéolo capilar y la congestión venosa renal, favoreciendo un síndrome de compartimento abdominal, este comportamiento de la sobrecarga hídrica podría ser similar en pacientes con COVID-197.
La sobreposición de infecciones puede ocurrir en los pacientes durante su estancia en cuidados intensivos. En una cohorte de 1.099 pacientes se encontró la aparición de choque séptico en 11 de 173 (6,4%) pacientes con compromiso severo por COVID-1917. Se podría asumir que la LRA séptica actúa de manera sinérgica con los mecanismos propios del virus al parénquima renal.
El efecto del SDRA y la ventilación mecánica en el riñón se explica por mecanismos hemodinámicos, neurohormonales, alteración de los gases sanguíneos y biotrauma. Otros mecanismos implicados son la alteración del sistema inmune, respuesta inflamatoria, estrés oxidativo, apoptosis y necrosis celular.
Histopatología renal en pacientes con COVID-19El daño viral directo hacia el epitelio tubular y hacia los podocitos se ha reportado como mecanismo posible en LRA y de enfermedad glomerular. Sin embargo, el conocimiento en este aspecto sigue siendo escaso. La serie de 26 casos postmórtem en China mostraron un espectro amplio de descripciones donde predominaba la lesión tubular aguda severa, vacuolización isométrica con viriones del SARS-CoV-2 en su citoplasma, desprendimiento de podocitos, oclusión y colapso glomerular severo que se relaciona con las manifestaciones clínicas que reportaron, así como con su pronóstico36.
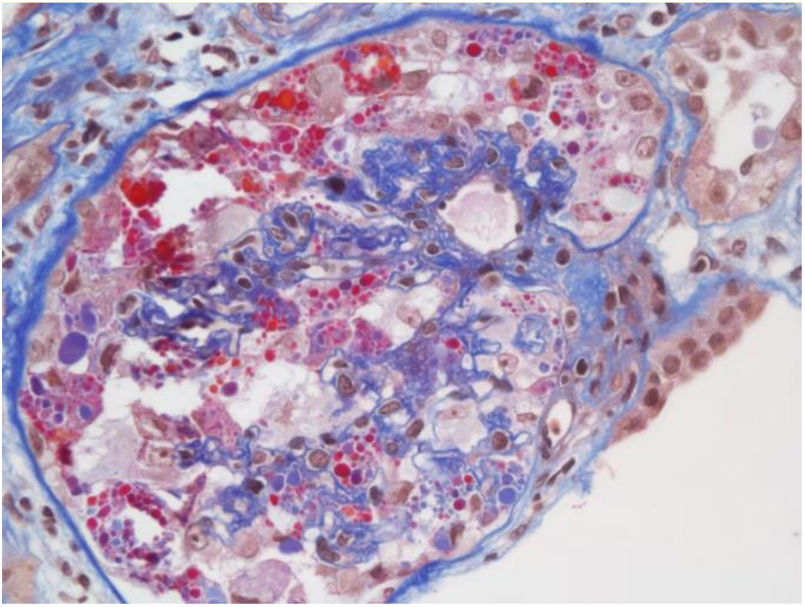
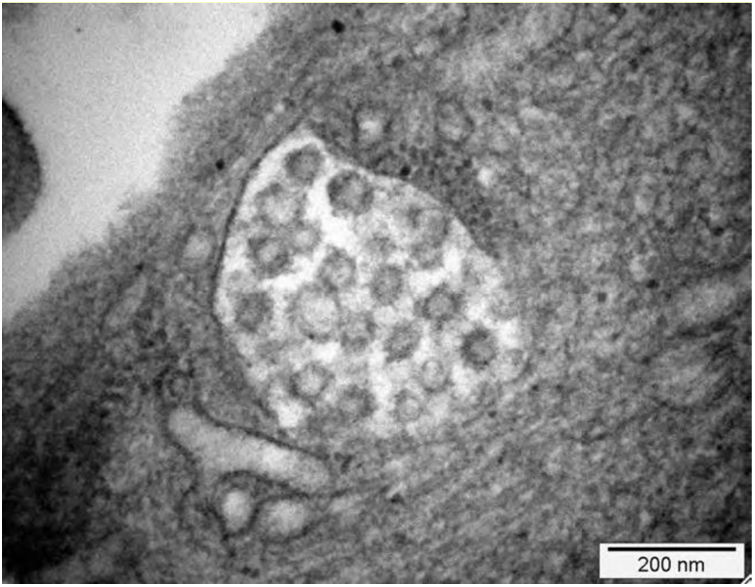
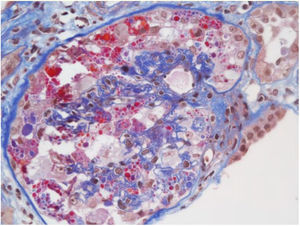
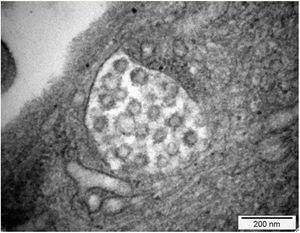
Se ha descrito lesión tubular la cual está determinada por pérdida de las microvellosidades y, en ciertos casos, en la histopatología se evidencia esclerosis global y signos de colapso glomerular con hipercelularidad endocapilar, lo que se tradujo en un deterioro rápidamente progresivo. No obstante, no se encontró en la inmunofluorescencia inmunoreactividad para anticuerpos o fracciones del complemento. En la microscopia electrónica no se evidenciaron inclusiones virales37. Sin embargo, este caso tuvo como aspecto destacado la presencia de mutación de apolipoproteína tipo 1 que pudo haber explicado este comportamiento clínico e histológico. Otro reporte de caso mostró un patrón focal y segmentario con hallazgos severos de colapso glomerular y necrosis tubular aguda (fig. 1); en la microscopia electrónica se encontraron vacuolas en el citoplasma de los podocitos, con inclusiones virales del SARS-CoV-2 (fig. 2)38.
Microscopia óptica: 200×, colapso glomerular severo, patrón focal y segmentario. Tomada de Kissling et al.38.
Microscopía electrónica: 15,000×. Presencia de vacuolas citoplasmáticas con inclusiones de morfología compatible con viriones de SARS CoV-2. Tomada de Kissling et al.38.
En el sistema renal las alteraciones en paraclínicos reportadas en los pacientes por COVID-19 van desde la elevación del BUN y la CrS, hasta la presencia de proteinuria y hematuria en el parcial de orina. En el estudio realizado por Li et al., el 31% y 22% de los pacientes presentaban elevación de BUN y CrS respectivamente. De los 193 incluidos en el estudio, a 147 pacientes se realizaron muestras de orina con hallazgo de proteinuria en el 60% de los casos y hematuria en el 48%27.
En otro estudio de 701 pacientes, se reportó proteinuria en el 43,9% y hematuria en el 26,7% de los pacientes. Además, elevación de CrS y BUN del 14,4% y 13,1% respectivamente25. En otra serie de casos de 198 pacientes en Shanghai, encontraron que el 36% tenía proteinuria al ingreso39.
Por último, se han realizado pruebas para aislar el ARN viral en la orina. En un estudio prospectivo, se obtuvieron muestras de orina, sangre, hisopado anal y faríngeo de nueve pacientes con COVID-19, lográndose aislar el ARN del SARS-CoV-2 en orina en un solo caso (11%)40. Adicionalmente en el estudio realizado por Wang et al.23, a 48 de los 116 pacientes incluidos en el estudio, se les realizó reacción en cadena de la polimerasa (PCR) en orina, reportando positivo en tres pacientes23. Sin embargo, dos estudios no lograron demostrar la presencia de SARS-CoV-2 en orina, uno realizado en Alemania con nueve pacientes41 y otro en las provincias de Hubei y Shandong42. Se desconoce si el tiempo o la gravedad de la COVID-19 está relacionada con el aislamiento del SARS-CoV-2 en la orina.
Otros hallazgos de laboratorios relacionados como factores pronóstico en los pacientes con COVID-19 fueron linfopenia, dímero D y ferritina; estos pacientes tuvieron mayor requerimiento de ventilación mecánica y mortalidad30, al igual que se asocian con el desarrollo de LRA43.
TratamientoHasta el momento no hay un tratamiento específico para tratar la infección por SARS-CoV-2, y dada su reciente aparición, aún no contamos con estudios de alta calidad para resolver las dudas médicas en cuanto su manejo. Las guías actuales para manejo de estos pacientes, sobretodo en el área de cuidado críticos, se basan en estudios previos de SDRA, sepsis y en los datos obtenidos de las pandemias previas por SARS y síndrome respiratorio del Medio Oriente. En cuanto a los pacientes que presentan LRA, el manejo consiste en medidas de soporte médico, uso de terapia de soporte renal (TSR) y recientemente se han planteado el uso específico de terapias extracorpóreas como métodos de purificación sanguínea44. A continuación, se expondrán las diferentes opciones terapéuticas disponibles para los pacientes con LRA y COVID-19.
Manejo médicoControl del balance hídricoFisiológicamente, la sobrecarga de líquidos produce edema tisular, disminución de la difusión de oxígeno y metabolitos, obstrucción del flujo sanguíneo capilar y del drenaje linfático, llevando a la disfunción progresiva de los órganos45. Los efectos adversos de la sobrecarga de líquidos son quizá más evidentes en los pulmones, donde la reanimación excesiva provoca edema pulmonar agudo o pseudo-SDRA. En pacientes con SDRA hay asociación con sobrecarga hídrica y peores resultados pulmonares46.
A pesar de lo anterior, el manejo óptimo de líquidos era desconocido hasta que en el 2006 se realizó un estudio que comparó estrategias liberales vs. restrictivas de fluidos en este grupo de pacientes47. Se demostró disminución casi estadísticamente significativa en el requerimiento de TSR en el grupo conservador de manejo de líquidos (10% vs. 14%; p = 0,06). Este hallazgo fue crítico porque ocurrió en pacientes con SDRA, en ventilación mecánica a altos niveles de presión espiratoria final positiva, demostrando que el balance hídrico parece ser un factor de riesgo de complicaciones y mortalidad. Igualmente, en este estudio, la restricción agresiva de líquidos buscando la euvolemia resultó en disminución en la aparición de estos desenlaces.
AntiviralesEl uso de antivirales en la COVID-19 ha seguido los modelos de tratamiento en las pandemias previas por coronavirus. En ambas patologías se documentó que el lopinavir/ritonavir con ribavirina, aumentaba el aclaramiento viral con menos eventos adversos; esto fue demostrado también en modelos animales48,49. Siguiendo estos resultados, Cao et al.39 estudiaron este medicamento en COVID-19, sin encontrar diferencias significativas en mejoría clínica y mortalidad a 28 días, pero sí condujo a menores estancias hospitalarias.
Recientemente se ha reportado el uso de remdesivir en estos pacientes, el cual es un análogo de nucleótidos que inhibe la RNA polimerasa viral con actividad en contra de los coronavirus50. Grein et al.51 en un estudio observacional de 53 pacientes describieron su experiencia en pacientes con infección por SARS-CoV-2 y uso de remdesivir. Sus resultados mostraron disminución del requerimiento de oxígeno en 68% de los pacientes. Por otra parte, en el ensayo clínico de Wang et al.52 158 pacientes fueron tratados con remdesivir vs. 79 pacientes con placebo, sin evidenciar diferencia significativa en mejoría clínica o mortalidad. Adicionalmente, no se reportaron diferencias en los efectos adversos. Por el momento, aunque parece una terapia segura se necesita más estudios para demostrar su efectividad.
AntimaláricosLa razón para usar antimaláricos en las infecciones virales data de la década de los sesentas, dado los hallazgos en estudios in vitro los cuales demostraron que éstos detienen la replicación viral53-55. Estos hallazgos han sido corroborados para el SARS-CoV en cultivos celulares56.
Con base en lo anterior se han hecho estudios evaluando la efectividad de este grupo de medicamentos frente a la infección por SARS-CoV-2, los cuales se resumen en un metaanálisis publicado en abril de 202057. En este estudio siete publicaciones fueron incluidas en la revisión sistemática y tres en el metaanálisis. Comparado con el control, el tratamiento con hidroxicloroquina (HCQ) demostró menos progresión radiológica del daño pulmonar, sin observar cambios estadísticamente significativos en erradicación virológica, progresión de la enfermedad o muerte.
AnticuerposOtros de los objetivos terapéuticos es poder modular el SLC presente en estos pacientes9 donde se ha visto tiene un rol crítico la elevación de niveles plasmáticos de IL-6. Se ha planteado el uso de tocilizumab, un anticuerpo monoclonal recombinante humanizado antagonista del receptor de la IL-6, como tratamiento adyuvante58. Ya existen reportes de casos en paciente con infección por SARS-CoV 2 que sugieren posible beneficio del uso de esta terapia. En el estudio realizado por Luo P. en 15 pacientes posterior a la aplicación de tocilizumab se evidenció una disminución de los niveles de IL-6 y proteína C reactiva59,60. Otro estudio realizado en 21 pacientes con criterios de severidad posterior al tratamiento presentaron mejoría en varios parámetros, como el requerimiento de oxígeno, imagen radiológica pulmonar, recuento de linfocitos y niveles de proteína C-reactiva, sin evidenciarse eventos adversos de importancia61. No obstante, aún se requieren estudios de mejor calidad de evidencia para llegar a dar una recomendación sistemática para estos pacientes. En el momento se encuentra varios estudios clínicos en proceso en pacientes con COVID-19 severo, una fase III y IV evaluando tocilizumab (NCT04320615; ChiCTR2000029765) y estudio fase II/III con unos de sarilumab (NCT04315298).
Por otra parte, dada la evidencia previa del aumento del sistema del complemento en la infección por coronavirus62, se han iniciado estudios para evaluar la efectividad del eculizumab, un anticuerpo monoclonal humano diseñado para unirse y bloquear a la proteína del complemento C563. En una serie de casos de cuatro pacientes con COVID-19 y compromiso pulmonar severo tratados con eculizumab, mostraron mejoría en marcadores inflamatorios (proteína C reactiva) y en evolución clínica64. En este momento se encuentran tres estudios clínicos en curso (NCT04288713, NCT04355494, NCT04346797) evaluando la efectividad y seguridad del uso de eculizumab en estos pacientes.
Plasma convalecienteEl plasma convaleciente es otra de las terapias aprobadas por la Food and Drug Administration (FDA) para tratar pacientes críticamente enfermos con COVID-1965. Este método, utilizado previamente en otras enfermedades como el ebola e influenza66,67, consiste en transfundir plasma de pacientes recuperados de la infección por SARS-CoV-2, el cual contendría anticuerpos específicos (IgG) contra el virus68.
El estudio de Shen et al.69 expone una serie de cinco casos de pacientes críticamente enfermos de COVID-19 con SDRA, los cuales fueron tratados con plasma convaleciente, mostrando descenso y negativización de la carga viral, mejoría en parámetros de oxigenación y disminución del puntaje de la escala SOFA a los 12 días posteriores a la transfusión. En otra serie de casos de 10 pacientes críticos tratados con plasma convaleciente se evidenció una mejoría en el recuento de linfocitos y descenso de la proteína C reactiva a los tres días, sin reportarse efectos adversos a la terapia70. En el momento, aunque aún falta estudios clínicos aleatorizados, el uso de plasma convaleciente parece ser seguro y una posible opción terapéutica, la cual debe seguir siendo estudiada.
Terapias extracorpóreasTerapia de soporte renalUno de los manejos importantes del paciente con COVID-19 son todas las medidas de soporte, entre ellas el uso de la TSR, la cual se ha requerido en algunos casos en la segunda semana de infección en los pacientes críticamente enfermos en UCI17.
Las recomendaciones vigentes sobre el manejo de la TSR en el paciente con LRA, indican el uso de la TRRC sobre la intermitente en el paciente hemodinámicamente inestable71. Lo anterior, dado la evidencia de mayor control del volumen, corrección constante del estado ácido-base y electrolitos, y el logro de la estabilidad hemodinámica72.
En el caso de pacientes con infección por SARS-CoV-2 y LRA, la evidencia del uso de TRRC vs. intermitente es aún insuficiente. Un estudio retrospectivo de 36 pacientes con COVID-19 y LRA admitidos a UCI, evidenció menor mortalidad con TRRC comparado con hemodiálisis intermitente del 54,4% vs. 78% respectivamente73. Al momento se necesita desarrollar una evidencia más robusta para estos grupos especiales.
Los criterios a tener en cuenta para el inicio de la TRRC y terapias de purificación sanguínea en paciente con COVID-19 críticamente enfermo son: alteración de marcadores inflamatorios (IL-6/proteína C reactiva/lactato/albúmina), escala SOFA alta, biomarcadores de LRA tempranos, necesidad de vasopresores, inestabilidad hemodinámica, LRA progresiva y nivel de sobrecarga hídrica74. En TRRC la dosis aportada definitiva recomendada por las guías KDIGO de entrega mínima es de 20-25 mL/kg/h71.
Sin embargo, conociendo el beneficio de las terapias convectivas en cuanto a la estabilidad hemodinámica y de la evidencia de un mayor aclaramiento de citocinas con el uso de estas75 es importante tener en cuenta el nivel de entrenamiento del personal que realiza este tipo de terapias, con el objetivo de evitar variaciones en la prescripción, disminuir errores y aumento del riesgo de contagio del SARS-CoV-274.
Por último, teniendo en cuenta que la LRA se presenta más en paciente crítico17, recientemente la Sociedad Americana de Nefrología publicó las recomendaciones para el paciente con COVID-19 y enfermedad renal con requerimiento de TSR. Dentro de esta publicación se destaca el uso eficiente de recursos disponible, el manejo multidisciplinario de la LRA, pautas de prescripción de terapias, métodos de monitorización y vigilancia de complicaciones en esta población especial76.
Un aspecto relevante en el manejo de este tipo de terapias es el uso de anticoagulación en el circuito extracorpóreo. Ya conociendo la fisiopatología de la COVID-19 y el compromiso renal y extrarrenal, se conoce el desencadenamiento de SLC, por lo que estos pacientes van a tener más riesgo de coagulación del filtro. Para evitar esta complicación se pueden usar el citrato o la heparina. Como primera opción se recomienda la anticoagulación regional con citrato, asociado a flujo sanguíneo superior a 120 mL/min para evitar la coagulación prematura del circuito31. Sin embargo, si el centro de atención no utiliza el citrato de manera rutinaria pueden aumentar los eventos adversos77.
En caso de no disponibilidad de citrato se recomienda como segunda opción la heparinización sistémica con heparina no fraccionada. Se debe tener en cuenta el protocolo institucional para control de tiempos de coagulación y evitar riesgos de complicaciones78.
Terapias de purificación sanguínea extracorpóreasPartiendo de la teoría del SLC presentada por los pacientes con COVID-19, se ha propuesto el uso de terapia extracorpórea (hemoperfusión, hemoadsorción y hemofiltración de alto volumen) con el fin de promover la eliminación de las citocinas inflamatorias circulantes y así pasar de un sistema inmune no controlado a uno con mejor capacidad de respuesta e inmunohomeostasis79,80.
El objetivo de las terapias extracorpóreas es intervenir en algunos pasos de la desregulación del sistema inmune. La mayoría se enfoca en un solo objetivo, como la remoción de endotoxinas o citocinas44. Sin embargo, la evidencia actual con estas terapias se basa en estudios en pacientes con modelos de sepsis bacteriana.
Teniendo en cuenta el origen viral de esta enfermedad, más el SLC, se pueden considerar estrategias extracorpóreas dirigidas a remover citocinas inflamatorias. Uno de los métodos utilizados para la remoción de citocinas es la hemofiltración de alto volumen, con dosis de ultrafiltración mayor de 50 mL/kg/h, la cual permite eliminación de moléculas hidrofílicas de peso molecular medio81. No obstante, no se ha logrado disminuir la mortalidad con el uso de esta terapia82. El estudio IVOIRE83 no logró encontrar una diferencia significativa en la mortalidad entre el grupo de alto volumen (70 mL/kg/h) y el grupo de volumen estándar (35 mL/kg/h). Por lo anterior, aún no hay evidencia para recomendar o contraindicar el uso de esta modalidad de terapia.
Otras técnicas de purificación sanguínea son el uso de membranas especializadas de adsorción o de alto corte de remoción para citocinas diseñadas para absorber mediadores inflamatorios que pueden estar relacionados con SLC84. En el momento se han visto sus beneficios secundarios como disminución de marcadores proinflamatorios, reducción de soporte vasopresor y tiempos de ventilación mecánica en las series de casos85. Sin embargo, se requieren estudios que ofrezcan mayor número de casos para establecer diferencias de mortalidad con estas terapias.
El experimento clínico realizado con membranas de hemoadsorsión por Schadler et al.86 no demostró disminución significativa en las concentraciones plasmáticas de IL-6 y no encontró diferencias en los desenlaces secundarios medidos como puntaje de escalas de disfunción orgánica múltiple, tiempo de ventilación y parámetros de oxigenación. Sin embargo, esta, en conjunto con otras membranas y tecnologías de purificación sanguínea extracorpóreas, fueron aprobadas por la FDA para manejo de investigación en pacientes con COVID- 19, por lo que se espera en un futuro tener mayor evidencia al respecto87.
En pacientes con ERC en terapia de reemplazo renal se han estudiado otro tipo de membranas de alto corte con evidencia de una mayor eliminación de citocinas y una pérdida menor y controlable de albúmina, en comparación con membranas de hemodiálisis88,89. Sin embargo esta tecnología no ha sido utilizada de manera sistemática en pacientes con choque séptico. Actualmente se encuentra en realización un estudio piloto implementando este tipo de membrana en pacientes con infección por SARS-CoV-290.
Por otra parte, ante la posibilidad de sobreinfección de estos pacientes y de presentar sepsis de origen bacteriano, el uso de terapias extracorpóreas para remover exotoxinas se convierte en otra opción terapéutica. Existen los sistemas de hemoperfusión con polimixina B91 que se han usado en sepsis por gramnegativos, pero con resultados no concluyentes en cuanto a reducción de mortalidad92. Sin embargo, su eficacia en el aclaramiento de citocinas y moléculas bacterianas es indudable, con el tiempo y otro tipo de estudios podrían mostrar beneficios clínicos como el retiro temprano de soporte vasopresor y ventilatorio en pacientes con disfuncion multiorgánica93.
Hay que tener en cuenta que, a la hora de implementar este tipo de terapias, no sólo conllevan a la eliminación de citocinas si no a otro tipo de sustancias como moléculas de tamaño medio (vitaminas, oligoelementos y medicamentos)94, destacando entre ellos el grupo de antimicrobianos hidrofílicos como la vancomicina y amikacina95, lo cuales son comúnmente usados en este tipo de pacientes. Dado lo anterior se recomienda una estrategia de monitorización estricta de los medicamentos administrados para asegurar concentraciones apropiadas de antibióticos en este contexto particular44.
Terapias de oxigenación por membrana extracorpóreaLa infección por SARS-CoV-2 en algún porcentaje de pacientes puede inducir SDRA, lo cual lleva a considerar el uso de terapias ECMO. Los estudios han reportado el uso de ECMO en pacientes críticos con MERS-CoV23. La necesidad de ECMO-VV reportada hasta ahora durante la pandemia es baja (entre 2,9-4% de los pacientes ingresados en UCI) y el uso del ECMO-VA se ha reportado en casos muy seleccionados96.
En pacientes con ECMO se ha reportado incidencia de LRA hasta en un 60%97; el uso seguro y adecuado depende de lo eficiente que se pueda hacer la conexión usando la máquina de TRRC a través de un catéter venoso central o, la más recomendada, que es conectar el hemofiltro al circuito ECMO98,99. Con el uso de estos dispositivos de soporte extracorpóreo, se han reportado como complicaciones la generación de citocinas. Sin embargo, en la COVID-19 su papel no ha sido establecido31.
PronósticoSe conoce previamente la asociación entre LRA y el aumento en la mortalidad en paciente hospitalizado y en estado crítico100. En el 2005, en los pacientes con infección por SARS-CoV, se estableció aumento en la mortalidad en aquellos pacientes que presentaron LRA asociada10. En el caso de los pacientes con la COVID-19, el estudio publicado por Li et al. sugiere aumento de riesgo de mortalidad de 5,3 veces27, mientras en la cohorte de Cheng et al. se estimó una razón de riesgo (HR) de 2,21 comparado con aquellos sin LRA. Adicionalmente se evidenció aumento de mortalidad en los pacientes con elevación del BUN, CrS, proteinuria y hematuria, con un HR hasta de 2,51, 3,61, 5 y 8,51 respectivamente25.
ConclusionesEn resumen, la COVID-19 es una pandemia causada por un nuevo coronavirus, que se ha convertido en una amenaza humana global. Los registros de pacientes han mostrado que el compromiso renal es frecuente en esta infección y sus manifestaciones se relacionan con daño glomerular y LRA, la cual se ha convertido en un factor predictor independiente de mortalidad. El uso de las terapias de soporte renal tiene un papel crítico en el manejo de los pacientes e igualmente, desafiando la posibilidad, el uso de nuevas tecnologías que pueden tener un racional fisiopatológico en su aplicación. Sin embargo, se requiere mayor soporte de éstas para ofrecer recomendaciones clínicas más robustas. Por último, cada día se expone nueva evidencia acerca de los diferentes aspectos de la COVID-19 dado el aprendizaje a través de la pandemia, por lo que se está enfrentado continuamente a nuevo conocimiento y cambios en las teorías establecidas que modificarán en el futuro la práctica clínica en cuanto al manejo de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.