Las relaciones de esta infección por virus respiratorio sincitial (VRS), bronquiolitis y asma infantil se van acercando poco a poco, a medida que se avanza en el conocimiento de la fisiopatología del asma y los mecanismos inflamatorios implicados en la aparición de hiperreactividad bronquial. Existen numerosos autores que trabajan sobre esta línea de investigación, aportando conclusiones parciales, pero que parecen coincidir, pese a proceder de distintas unidades de estudio.
El VRS es un virus ARNm, se incluye en la familia de los Paramixoviridae, el género Pneumovirus y la especie VRS, el virión dispone de nucleocápside helicoidal y envoltura lipoproteica con formaciones espiculares. Carece de neuraminidasa y hemaglutinina y la cápsula lipoproteica está formada por proteínas F y G que definen los grupos serológicos A y B (1, 2). La proteína G es esencial para la unión del virus a la superficie celular y la proteína F efectúa la fusión a la célula respiratoria; ambas proteínas son esenciales para que el virus infecte y además interaccionan con el sistema inmune. El diámetro de las partículas infecciosas, oscila entre 150 y 300 mm y suelen sobresalir de la célula huésped dando lugar a formas filamentosas de unas 10 m de longitud. Por su estructura y tamaño apenas se parece a otros virus respiratorios y es por ello fácil de identificar.
La infección afecta inicialmente a las vías respiratorias altas, quedando limitada muchas veces a esta zona, pero en niños menores de 1 año y de éstos en los menores de 6 meses, es frecuente la diseminación a vías respiratorias bajas produciendo clínica de bronquiolitis, neumonía y bronconeumonía con gravedad variable dependiendo de factores tales como la prematuridad; bajo peso al nacer con edad gestacional normal; existencia de patología previa respiratoria o cardíaca (asma bronquial extrínseca, displasia broncopulmonar, fibrosis quística, cardiopatía congénita); la edad menor de tres meses; la existencia de bajo peso en el momento inicial de la infección y la historia familiar o personal de atopia, aun cuando el niño no haya manifestado aún clínica de asma (3, 4) (tabla I). Todos estos factores no sólo propician la presentación de bronquiolitis, sino la mayor gravedad de la misma y la aparición más frecuente de complicaiones futuras, entre ellas el asma.
Se ha sugerido que serían mecanismos inmunitarios los que formarían el sustrato de estos factores predisponentes, lo cierto es que en el lactante pequeño y en el niño menor de 1 año existe déficit o inmadurez inmunitaria fisiológica, humoral y celular y que en todos los factores predisponentes citados, está agravada esta deficiencia inmunitaria. Por ello cabe pensar que la menor defensa inmunitaria frente a la infección vírica por VRS favorece la progresión a vías bajas de una infección de vías altas y la aparición de bronquiolitis.
Una vez el virus penetra en las células del epitelio mucoso respiratorio, se produce la replicación vírica pasando el virión rápidamente de célula a célula y más tarde a sangre (viremia). La respuesta inmunitaria que se establece es variada, se forman anticuerpos IgM, IgG e IgA detectables en suero, con poca capacidad de defensa inmune; anticuerpos IgA secretores en mucosa bronquial que actúan parcialmente como defensa de barrera frente a sucesivas reinfecciones; linfocitos T citotóxicos; que reconocen células infectadas por VRS asociados con antígenos HLAI y las destruyen, siendo éste el mecanismo defensivo más efectivo, pero que conlleva destrucción celular y aparición secundaria de síntomas debido a descamación celular y posible lesión epitelial (5).
La inmunidad que confiere no es definitiva y se producen reinfecciones posteriores, pero sí parece haber una inmunidad parcial, porque las infecciones por VRS son siempre más leves que la primoinfección.
Se entiende por bronquiolitis, la inflamación de las vías respiratorias bajas (bronquios, bronquiolos) de etiología vírica, que cursa clínicamente con dificultad respiratoria y ruidos respiratorios audibles, sobre todo sibilancias, que acontece en un niño menor de 2 años. Algunos autores añaden a esta definición que debe tratarse del primer brote; pero es conocido que puede haber más de un brote de bronquiolitis en el mismo año, aunque los sucesivos suelen ser más leves (6).
Se produce típicamente en invierno, y también en los cambios de estación en que el frío y las variaciones bruscas de temperatura, favorecen las infecciones en general y las virasis en particular. Lo habitual es que se presente en el primer año de vida y más entre los 3 y 6 meses, momento de menor defensa inmunitaria. Los agentes víricos que se implican con mayor frecuencia son VRS entre el 53,3 y el 70 %, adenovirus alrededor del 13 %, influenza A-B con 7 % y parainfluenza 4,7 % (7).
Los síntomas clínicos de la enfermedad se inician por un proceso catarral de vías altas, rinitis, tos, con febrícula o fiebre alta, al que se añade, polipnea, espiración alargada, respiración superficial y sibilancias audibles. La exploración clínica y radiológica confirman signos de atrapamiento aéreo y en las formas complicadas y graves se pueden presentar focos de condensación múltiples de aspecto bronconeumocócico. En general son bronquiolitis leves que responden bien al tratamiento; entre los niños que precisan hospitalización el exitus es de 2 a 5 % y son lactantes pequeños con factores de riesgo añadido. Los niños con cardiopatías congénitas e inmunodeficiencias padecen formas graves de infección por VRS con elevada mortalidad (8), que se estima en el 78 % para las inmunodeficiencias y el 37 % para las cardiopatías congénitas.
Las complicaciones graves son poco frecuentes. De especial interés es la aparición posterior de cuadros de bronquitis disneizante de repetición, secundarios a hiperreactividad bronquial y la presentación de asma bronquial extrínseca tras un primer episodio de bronquiolitis (9-11).
El diagnóstico de bronquiolitis se hace por los síntomas y signos clínicos, con ayuda de pocas pruebas complementarias. El diagnóstico de la infección por VRS se realiza mediante la determinación de anticuerpos neutralizantes en suero, con dos determinaciones separadas por intervalos de 2 o 3 semanas. Determinación por método enzimático de los antígenos víricos en secreciones nasofaríngeas o bronquiales (ELISA VRS), de gran utilidad, alta fiabilidad y especificidad, que proporciona el diagnóstico en unas horas. Determinación de anticuerpos frente a proteínas de virus, en suero (Western Blot) en el que se aíslan anticuerpos frente a proteínas G, F, VPM y VPB32 (12). Identificación del virus por inmunofluorescencia en secreciones respiratorias (tabla II).
El tratamiento es sintomático, manteniendo una correcta hidratación y alimentación, oxígeno si existe hipoxia y broncodilatadores, agonistas B2 parecen ser los más útiles. En niños con bronquiolitis en los que se efectuó exploración funcional respiratoria, se detectó un descenso de la capacidad vital forzada (CVF), de flujo espiratorio forzado en el primer segundo (FEF1), del flujo medio forzado (FMF25-75) y aumento de las resistencias (Rw), tras aplicar tratamiento broncodilatador mejoraron todos los parámetros pero sobre todo el FMF25-75 que ascendió un 30 % (13). Los corticoides no tienen indicación más que en las formas muy graves, en las que han fracasado los demás métodos.
El tratamiento etiológico se efectuó hasta hace unos años, con ribavirina en aerosol, continuo durante 18-24 horas. Se vio que los niños tratados con ribavirina estaban menos expuestos a sufrir bronquitis disneizante o asma que los no tratados, pero los elevados riesgos derivados de su uso desaconsejan su empleo en la actualidad. Algunos autores, de forma experimental han aplicado tratamiento con interferón alfa-2 recombinante. En la actualidad el uso profiláctico de anticuerpos monoclonales anti-VRS, de clase IgG1, frente a los serotipos A y B, está indicado en prematuros de menos de 32 semanas y más de 6 meses de vida, y niños con enfermedad pulmonar crónica (14).
BRONQUIOLITIS Y ASMA
La presentación de asma bronquial, en los años posteriores a un primer brote de bronquitis por VRS fue referida inicialmente por Mc Intosh (15), invocando una patogenia común y confirmando con el seguimiento durante más de 5 años de estos niños, la mayor frecuencia de bronquitis disneizante y asma (50 %). Trabajos más recientes de Hibbert (9) y Schroechkenstein (16) confirman de nuevo este hecho, aumentando el porcentaje de aparición de asma hasta en un 71 % de los niños bien controlados, durante los 5 años posteriores al primer brote de bronquiolitis que ocurrió en los primeros 12 meses de vida. Otros autores citan cifras algo menores entre el 25 y el 57 %. Stein et al efectuaron un seguimiento de 888 niños que padecieron bronquiolitis VRS, hasta los 13 años observando que a los 3-5 años padecían asma el 69 %, a los 4-5 años el 55 % y a los 6-8 años el 31 % (17) (tabla III). En nuestra experiencia, los niños que padecieron bronquiolitis VRS antes de los 6 meses, 58 de ellos sobre 75, tuvieron asma del lactante en los 3 años siguientes 30, es decir, el 51 %. Los que tenían más de 6 meses en el momento de la bronquiolitis fueron 17, y 5 de ellos presentaron bronquitis disneizante en los 3 años siguientes, es decir, el 29 %.
En un trabajo prospectivo realizado por la Dra. Garriga y nosotros, se han seleccionado 50 niños de edades comprendidas entre 3 y 7 meses que tuvieron bronquiolitis VRS, desde diciembre de 1997 a febrero de 1998, con un seguimiento posterior hasta el año 2000. De ellos, 22 (44 %) tuvieron asma y los 28 restantes (56 %) tuvo episodios aislados de tos y sibilancias, que no entraban en los criterios de asma. En los niños con asma (22) se elevó en todos la IgE total, al cabo de los 2 años de seguimiento, pero sólo uno de los niños presentó sensibilización al huevo.
La dificultad respiratoria que aparece en el brote inicial de bronquiolitis, se explica muy bien por el efecto citopático del virus sobre el árbol respiratorio del lactante. Durante el primer año de vida el calibre de los bronquios es pequeño en comparación con la superficie alveolar, el cartílago es blando y hay un número de glándulas mucosas mayor que en otras edades. Esta situación favorece la fácil oclusión de la vía aérea por fenómenos mecánicos. A ello se une la acción del virus que destruye células epiteliales mucosas, produce inflamación y descamación del epitelio mucoso, aumento de detritos que taponan los finos bronquios del niño. Como resultado de la necrosis celular y descamación epitelial, quedan al descubierto los receptores vagales, que al ser estimulados por el frío, o la acción mecánica de la descamación, condicionan la aparición de broncospasmo y disnea (18). Estos fenómenos explican bien la disnea en la fase aguda de la bronquiolitis, pero no totalmente la presentación de broncospasmo y disnea posterior.
El VRS produce inflamación de la mucosa bronquial, cuyos efectos pueden persistir durante 6-7 semanas aun después de la curación del primer episodio. Este epitelio inflamado y denudado, es terreno predispuesto para futuras reinfecciones víricas, de menor gravedad, pero que cursarán con disnea por irritación de los receptores vagales al descubierto. La inflamación producida por cualquier mecanismo (VRS, inhalación de histamina, de metacolina o de ozono) es capaz de alterar las uniones intercelulares del epitelio mucoso bronquial, lo que condicina, aún sin lesión importante necrótica, la facilidad para la penetración de irritantes, que estimulan los receptores vagales y conducen a broncospasmo (19). En la inflamación de cualquier origen, acuden al foco células como los leucocitos polimorfonucleares y exacerban su función los macrófagos, ambas células activadas, liberan in situ radicales libres de oxígeno, proteasas y metabolitos del ácido araquidónico, todos ellos, tienen la propiedad de lesionar el epitelio bronquial y denudar los receptores vagales, cuyo estímulo inespecífico, condiciona la aparición de broncospasmo (20).
El VRS destruye gran número de células epiteliales in vivo e in vitro. La replicación vírica en las células epiteliales inicia los fenómenos lesivos respiratorios que incluyen proteólisis de LkB y activación de NFkB, incremento en la secreción de múltiples citocinas (TNF-a, G-CSF y IFN-g), quimiocinasas (IL-8, proteína inflamatoria de macrófagos y RANTES) y moléculas de adhesión, que están elevadas en las vías aéreas durante las infecciones víricas y a su vez reclutan y activan células inflamatorias (neutrófilos, eosinófilos y células T activadas) que se encuentran igualmente elevadas en el asma (21).
La infección por virus respiratorio sincitial produce además otros efectos a largo plazo. Persisten durante semanas o meses las lesiones inflamatorias y el aumento de la sensibilidad de los receptores vagales. La acción del propio virus sobre los receptores B bronquiales, es de bloqueo, con lo que aparece tendencia al broncospasmo e hiperreactividad bronquial. La mucosa inflamada, con las uniones intercelulares alteradas, facilita la penetración de neumoalergenos a su través, la sensibilización y la presentación de asma bronquial extrínseca. En este sentido, estarán más predispuestos los niños con historia familiar de atopia, IgE elevada previamente a la enfermedad, niños con enfermedad alérgica asociada e hijos de madres fumadoras. También es conocido que el VRS produce IgE específica (22, 23), frente a antígenos víricos, la unión de Ag viral anticuerpo específico IgE en la superficie de los mastocitos bronquiales, produce la liberación de mediadores y la atracción de células que continúan, amplifican y mantienen la inflamación del epitelio bronquial (tabla IV). Cabe destacar como más lesivas las proteínas liberadas por el eosinófilo, con acción tóxica, destructiva, descamativa y lesional para el epitelio bronquial (24) (tabla V).
Recientes trabajos (25-27) han evidenciado la hipótesis de que las proteínas G del VRS induce el estímulo de los LTH2 que libera IL-4 que estimula la producción de IgE y la sensibilización a neumoalergenos y alergenos de faneras animales.
Se admite hoy que una serie de datos apreciables durante una bronquitis por VRS, pueden constituir un valor predictivo de las recaídas de asma del lactante. Tales son la elevación de IgE específica frente a VRS, aumento de PCE (proteína catiónica eosinófila) en suero o secreciones, el aumento de interferón gamma (IFN-g) en secreciones, la presencia en suero de eosinofilia o eosinopenia y el aumento de IgE total de forma transitoria (26) (tabla VI).
El riesgo de padecer asma después de una bronquiolitis VRS, según Martínez (27) podría estructurarse según criterios mayores: 1) bronquiolitis grave; 2) sibilancias presentadas en tres episodios o más, en los 6 meses siguientes a la bronquiolitis; 3) historia familiar de asma, y 4) dermatitis atópica. Y valorando como criterios menores: 1) rinorrea inespecífica; 2) sibilancias; 3) eosinofilia, y 4) sexo varón. El riesgo de asma del lactante se establecería con la existencia de los criterios mayores 1 o 2 más 3 o 4. O también con los criterios mayores 1 o 2 y dos criterios menores (tabla VII).
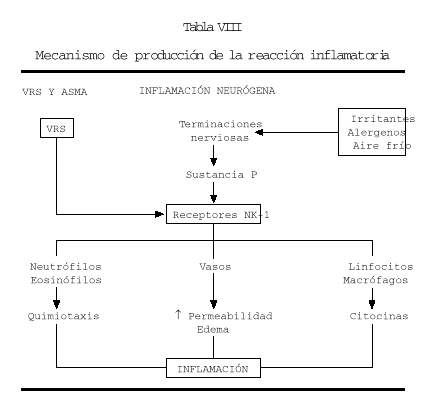
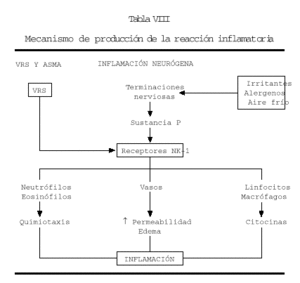
Una atractiva hipótesis patogénica que explicaría el asma posbronquiolitis VRS es la de la inflamación neurógena que parece probada a través de las investigaciones de Piedimonte et al (29). El VRS en el lactante con bronquiolitis, está en vías respiratorias inferiores y al tener unos pulmones inmaduros, la inervación pulmonar es más rica por lo que las terminaciones nerviosas pulmonares del lactante, resultan estimuladas por el VRS que da lugar a la liberación de sustancia P, cuyo receptor de alta afinidad (NK-1) se encuentra en los vasos y células como neutrófilos, eosinófilos, linfocitos y macrófagos. Como consecuencia de ello en los vasos se produce aumento de la permeabilidad y edema, los neutrófilos y eosinófilos emigran al pulmón y los linfocitos y macrófagos secretan citocinas, todo lo cual constituye la inflamación de las vías aéreas. Después de la resolución de la infección aguda la estimulación de los nervios pulmonares por aire frío, alergenos o irritantes, induce inflamación recurrente mediada por linfocitos T que expresan NK-1 (tabla VIII).
En conclusión, se puede afirmar hoy que la bronquiolitis por VRS constiruye un factor de riesgo para el desarrollo de asma del lactante. El riesgo aumenta en niños con antecedentes familiares o personales de atopia. La formas graves de bronquiolitis por VRS son más frecuentes en atópicos. La parición de asma extrínseca tras bronquiolitis por VRS es más frecuente, que en niños que no han padecido bronquiolitis por VRS.