La síntesis de andrógenos en la mujer se produce en las glándulas suprarrenales, en el ovario y en los tejidos diana para la acción androgénica (piel, músculo y tejido adiposo). El exceso de producción androgénica (o hiperandrogenismo) en la adolescencia puede determinar alteraciones en estos tejidos diana, condicionando la aparición de hirsutismo, acné, trastornos menstruales o virilización, cuya intensidad y momento de aparición dependerán del origen del exceso de producción de andrógenos.
El hirsutismo es el exceso de crecimiento de vello corporal en la mujer en zonas androgénicas: supralabial, mentón, mejillas, pabellones auriculares, tórax (supraesternal y areolas mamarias), abdomen (línea alba), espalda, glúteos, y cara interna y anterior de los muslos. En general, el hirsutismo se debe a un exceso de producción de andrógenos o a un aumento del metabolismo cutáneo de los andrógenos. La sensibilidad a los andrógenos de los folículos pilosos y de las glándulas sebáceas cutáneas varía según su localización1, lo que explica la diferente expresividad clínica frente a un mismo grado de hiperandrogenismo.
La hipertricosis es el aumento de pelo corporal en zonas donde ya hay normalmente en la mujer: antebrazos, piernas y, menos frecuentemente, en muslos y tronco. Habitualmente, no se debe a un exceso de andrógenos sino que depende de factores raciales y familiares, o es secundaria al uso continuado de fármacos como glucocorticoides, fenitoína, minoxidil o ciclosporina.
Las irregularidades menstruales son frecuentes en los primeros 2 años después de la menarquia. Durante este período, aproximadamente la mitad de los ciclos son anovulatorios; este período de anovulación fisiológica puede ser anormalmente prolongado en algunas adolescentes y resultar en el desarrollo de hiperandrogenismo ovárico o síndrome del ovario poliquístico (SOP), que es la causa más frecuente de hirsutismo y trastornos menstruales en la adolescencia2. Las irregularidades menstruales no asociadas a hirsutismo pueden ser también la manifestación inicial de trastornos alimentarios, o asociarse a la práctica de ejercicio físico intenso, como el atletismo de competición.
Puntos clave
La vía de síntesis de los andrógenos es común para el ovario y la suprarrenal en respuesta a sus respectivas hormonas tróficas hipofisarias, la hormona luteinizante (LH) y la hormona adrenocorticotropa (ACTH).
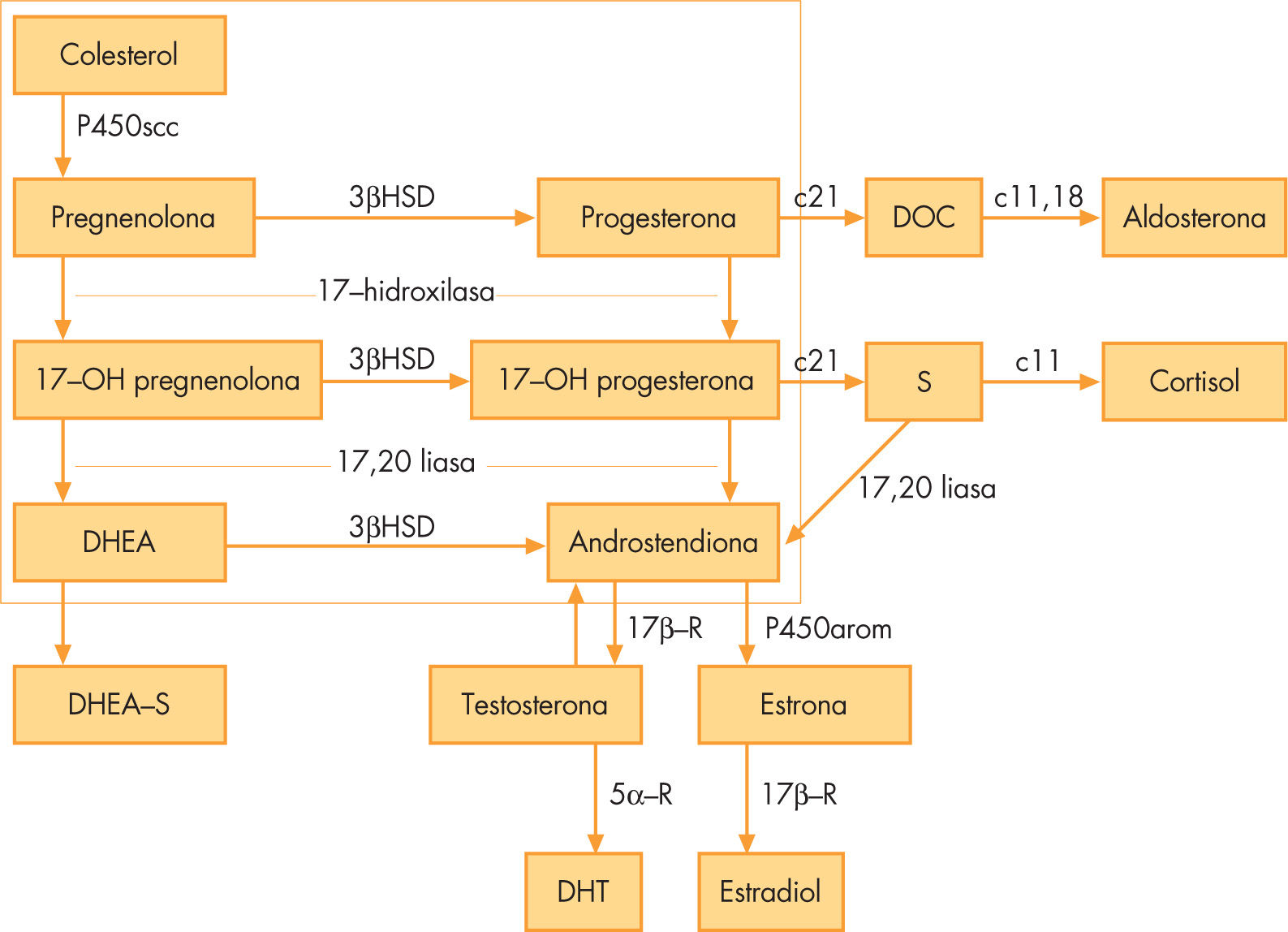
La biosíntesis androgénica se inicia mediante una enzima limitante que rompe la cadena lateral del colesterol dando lugar a la pregnenolona (fig. 1). La pregnenolona sigue 2 vías de conversión, una es la vía de los esteroides Δ3, en la cual, por acción del citocromo P450c17, que posee actividad 17α-hidroxilasa y 17–20 liasa, pasa a 17-hidroxipregnenolona (17OHPreg) y dehidroepiandrosterona (DHEA), respectivamente, y la otra es la vía de los esteroides Δ4, donde la progesterona pasa por las mismas actividades enzimáticas a 17-hidroxiprogesterona (17-OHP) y androstendiona. Las celulas de la teca ovárica bajo el estímulo de la LH segregan androstendiona y testosterona; la androstendiona es aromatizada por las células de la granulosa estimuladas por la hormona foliculostimulante (FSH) para dar lugar a los estrógenos. La síntesis de los andrógenos ováricos varía durante el ciclo menstrual, siendo mínima en la primera fase del ciclo, denominada fase folicular (del primero al octavo día del ciclo menstrual).
La suprarrenal fetal es una fuente importante de sulfato de dehidroepiandrosterona (DHEAS). La secreción de DHEAS y de los demás andrógenos suprarrenales disminuye durante la infancia para experimentar, alrededor de los 6–8 años, un incremento gradual. Este proceso, denominado adrenarquia fisiológica, no tiene en general expresión clínica; el aumento de las concentraciones séricas de DHEAS es el marcador bioquímico de la adrenarquia5. El ovario secreta mínimas cantidades de DHEAS.
Transporte de los andrógenosLos esteroides sexuales son transportados en el plasma por una globulina específica, la sex hormone binding globulin (SHBG), similar a las proteínas transportadoras para la tiroxina o los corticoides. La SHBG transporta principalmente testosterona y estradiol. Una fracción menos importante de las hormonas sexuales es transportada inespecíficamente por la albúmina, y aproximadamente un 1% de la testosterona circula en plasma en forma libre. Dicha fracción libre es la que se considera biológicamente activa, ya que es la que difunde en las células diana para unirse al receptor androgénico4.
Durante la pubertad, la SHBG disminuye ligeramente en las niñas y muy marcadamente en los niños. Los andrógenos, la insulina, la hormona de crecimiento y los glucocorticoides disminuyen la síntesis de SHBG, mientras que los estrógenos y las hormonas tiroideas la aumentan. El aumento de la fracción libre de testosterona por disminución de la SHBG con concentraciones normales de testosterona total puede ser la causa de algunas formas de hirsutismo, fundamentalmente en adolescentes con obesidad.
Lectura rápida
El hirsutismo es el exceso de crecimiento de vello corporal en la mujer en zonas androgénicas. La hipertricosis es el aumento de pelo corporal en zonas donde hay normalmente en la mujer. Las irregularidades menstruales son frecuentes en los primeros 2 años posmenarquia; durante este período la mitad de los ciclos son anovulatorios. La causa más frecuente de hirsutismo y trastornos menstruales pasados 2 años desde la menarquia en adolescentes es el hiperandrogenismo ovárico o síndrome del ovario poliquístico (SOP).
Definición del síndrome del ovario poliquísticoEl SOP es una entidad con una gran heterogeneidad clínica y biológica, lo que ha originado que haya gran controversia en cuanto a sus criterios diagnósticos. Actualmente, hay 3 definiciones en uso. La primera de ellas (National Institutes of Health [NIH], 1990) requiere para el diagnóstico la presencia de hiperandrogenismo y de anovulación crónica, habiendo excluido otras entidades. En otra reunión de consenso más reciente (Rotterdam 2003) se consideraron necesarios para el diagnóstico 2 de los 3 criterios siguientes: a) hiperandrogenismo clínico y/o bioquímico; b) oligoovulación o anovulación crónica, y c) ovarios poliquísticos en la ecografía.
La actividad hormonal de los andrógenos está regulada en los tejidos diana, especialmente en la piel, por 2 proteínas: el receptor androgénico y la enzima 5α-reductasa (5a-R). A nivel periférico, la actividad 5α-R transforma la testosterona en dihidrotestosterona (DHT), el más activo de los andrógenos, ya que es el que tiene mayor afinidad por el receptor. Mientras que la actividad 5α-R presente en los genitales externos no la actividad cutánea de la 5α-R está aumentada con valores de andrógenos en suero normales1. La actividad 5α-R no se limita exclusivamente a la testosterona sino que la DHT producida puede también ser secundaria a la acción de la enzima en la androstendiona. Parece haber una cierta correlación entre la actividad 5α-R y la concentración de un metabolito de la testosterona y la DHT, el 3α-androstanediol. Un lugar específico de unión de los andrógenos es el folículo piloso, donde una excesiva estimulación androgénica dará lugar a un excesivo crecimiento del pelo y a la presencia de hirsutismo. En el hirsutismo idiopático puede haber un aumento de la sensibilidad de la piel para convertir la androstendiona y la testosterona en DHT.
Lectura rápida
La última definición (Androgen Excess Society, 2006) considera de nuevo esencial la inclusión del hiperandrogenismo como criterio diagnóstico. En nuestra opinión, la definición del NIH de 1990 —que no tiene en cuenta la imagen ecográfica de ovarios poliquísticos— es la más adecuada para definir la entidad en adolescentes. El SOP se acompaña con frecuencia —aun en ausencia de obesidad— de hiperinsulinismo, resistencia a la insulina, dislipemia, alteraciones de marcadores de inflamación, y de distribución centrípeta de la grasa corporal. Las pacientes con SOP tienen mayor riesgo de desarrollar precozmente diabetes tipo 2 y enfermedad cardiovascular. Las adolescentes con obesidad y aquellas con bajo peso al nacer seguido de una recuperación rápida y exagerada de peso, especialmente si se asocia al desarrollo de pubarquia precoz y de pubertad adelantada rápidamente evolutiva, tienen mayor riesgo de desarrollar SOP. Una hipótesis reciente apunta a un origen prenatal del SOP, en el que la predisposición genética para secretar un exceso de insulina y/o andrógenos podria manifestarse antes o durante la pubertad, y resultar en grados variables de hiperinsulinismo, hiperandrogenismo y en un exceso de producción de LH. Estas alteraciones podrian ser más o menos precoces y evolucionar hacia un SOP clínico dependiendo de factores ambientales.
Uno o más de los siguientes mecanismos pueden desempeñar un papel en el desarrollo de hirsutismo: a) aumento de la secreción androgénica, glandular o extraglandular; b) aumento de la producción extraglandular de andrógenos activos por aumento de la conversión periférica de los precursores esteroideos; c) aumento de la disponibilidad de los andrógenos con actividad biológica, y d) aumento de la sensibilidad de los tejidos diana a los andrógenos o aumento de la actividad enzimática en las estructuras cutáneas dependientes de los andrógenos.
El hiperandrogenismo ovárico —aumento de la síntesis androgénica de origen ovárico— o SOP es la causa más frecuente de hirsutismo en la adolescente, y suele asociarse a trastornos menstruales que típicamente se inician entre 2 y 3 años después de la menarquia3,4.
Síndrome del ovario poliquísticoDefiniciónLa asociación de ovarios poliquísticos, amenorrea, hirsutismo y obesidad fue descrita por Stein y Leventhal en 19356. Posteriormente, se observó que estas pacientes presentaban además anovulación crónica, hiperandrogenismo, aumento de las concentraciones plasmáticas de LH e inversión del cociente LH/ FSH, y se constató la presencia ecográfica de ovarios poliquísticos.
El SOP es una entidad con una gran heterogeneidad clínica y biológica, lo que ha originado que haya gran controversia en cuanto a sus criterios diagnósticos. Actualmente, hay 3 definiciones en uso. La primera de ellas (National Institutes of Health [NIH])7 requiere para el diagnóstico la presencia de hiperandrogenismo y de anovulación crónica, habiendo excluido otras entidades. En otra reunión de consenso más reciente (Rotterdam 20038) se consideraron necesarios para el diagnóstico 2 de los 3 criterios siguientes: a) hiperandrogenismo clínico y/o bioquímico; b) oligoovulación o anovulación crónica, y c) ovarios poliquísticos en la ecografía. La última definición (Androgen Excess Society, 20069) considera de nuevo esencial la inclusión del hiperandrogenismo como criterio diagnóstico. En nuestra opinión, la definición del NIH de 1990 —que no tiene en cuenta la imagen ecográfica de ovarios poliquísticos— es la más adecuada para definir la entidad en adolescentes.
El SOP se acompaña con frecuencia, y aun en ausencia de obesidad, de aumento de las concentraciones de insulina (hiperinsulinismo) y de resistencia a la acción insulínica. Estas alteraciones suelen asociarse a un perfil lipídico aterogénico —con aumento de las concentraciones de colesterol unido a lipoproteínas de baja densidad (cLDL) y triglicéridos, y disminución de las concentraciones de colesterol unido a lipoproteínas de alta densidad (cHDL)—, a alteraciones de marcadores de inflamación —específicamente a un incremento del cociente neutrófilos/linfocitos, a valores elevados de interleucina (IL)-6 y de proteína C reactiva, y a concentraciones bajas de adiponectina (una hormona con acción antidiabetogénica)— y a un aumento de los depósitos de grasa en abdomen10–14. El hiperinsulinismo, la dislipidemia, las alteraciones de los marcadores de inflamación, y la distribución centrípeta de la grasa corporal son factores de riesgo para el desarrollo de diabetes tipo 2 y enfermedad cardiovascular. Por este motivo, se ha sugerido que el SOP es un estado roinflamatorio, prediabetes tipo 2 y pre-enfermedad cardiovascular y, por tanto, podría considerarse parte del denominado síndrome metabólico o síndrome X, que se caracteriza, entre otras alteraciones, por la asociación de obesidad, dislipemia, hipertensión y resistencia a la insulina15. Las pacientes con SOP tienen mayor riesgo de desarrollar precozmente diabetes tipo 2 y enfermedad cardiovascular; este riesgo está en relación directa con el grado de hiperinsulinismo y resistencia a la insulina, y aún es más elevado si hay obesidad.
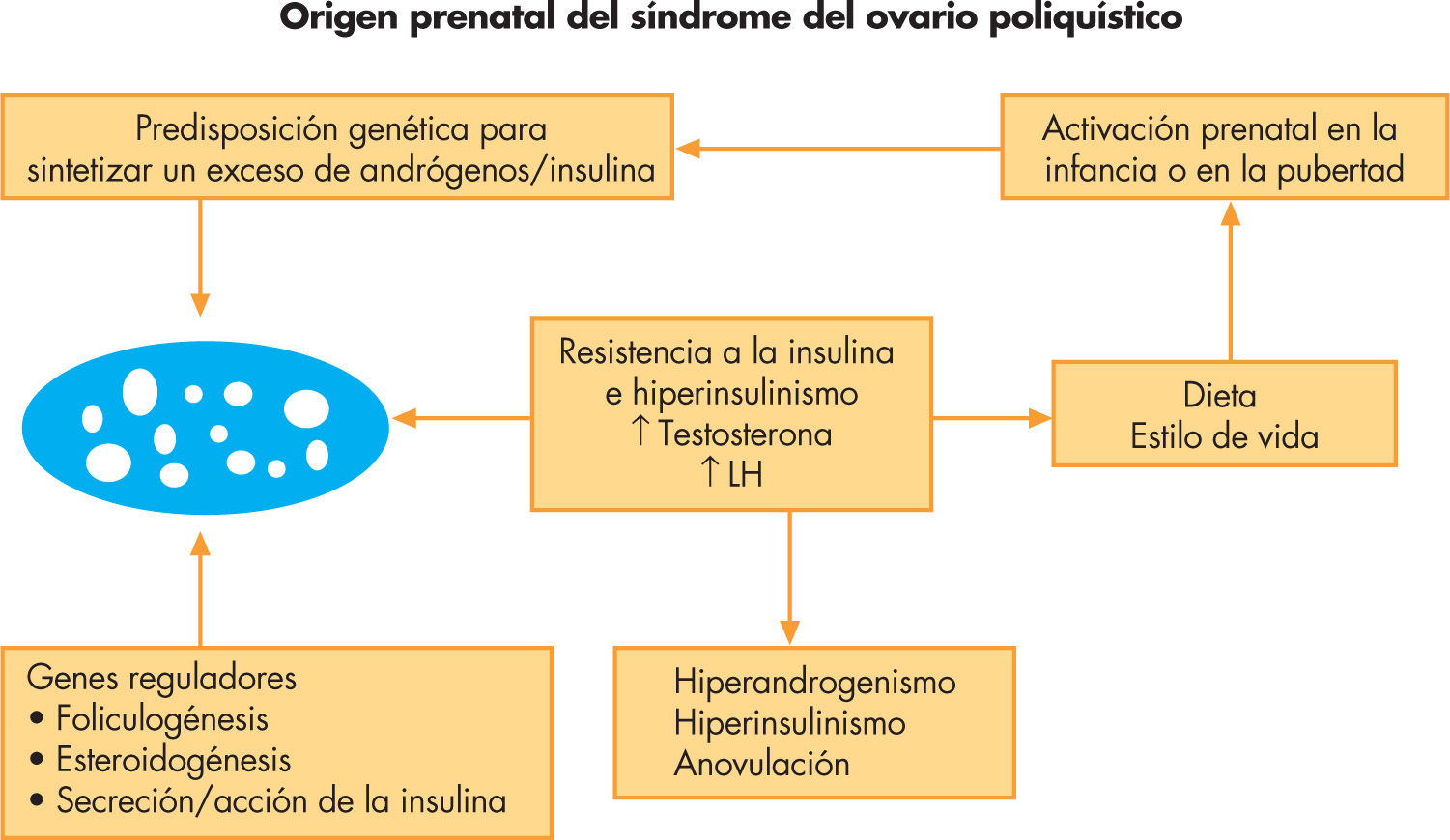
FisiopatologíaLa base genética del SOP permanece desconocida debido, en parte, a la falta de series homogéneas de pacientes. Hasta la actualidad, se han estudiado más de 100 genes, algunos de ellos se han corroborado en diversas series, mientras que otros se han rebatido. Entre ellos se encuentran diversos genes de la esteroidogénesis ovárica y suprarrenal, genes relacionados con la secreción y acción de la insulina, y el receptor de andrógenos16. Recientemente se han estudiado genes asociados a la inflamación y a los estados de hipercoagulabilidad. La mayoría de autores coincide en que la herencia genética es poligénica, y que la modulación por factores ambientales y de estilo de vida explican la gran heterogeneidad de su expresividad clínica. En este sentido, una hipótesis reciente apunta a un origen prenatal del SOP, en el que la predisposición genética para secretar un exceso de insulina y/o andrógenos podría ya manifestarse en etapas precoces de la vida y/o durante la pubertad, y resultar en grados variables de hiperinsulinismo, hiperandrogenismo y en un exceso de producción de LH (fig. 2). Estas alteraciones podrían manifestarse más o menos precozmente y evolucionar hacia un SOP clínico dependiendo de la influencia de factores ambientales.
Fisiopatología del síndrome del ovario poliquístico: origen prenatal. Modificada de Franks3.
La identificación de pacientes con mayor riesgo para desarrollar SOP ofrece la posibilidad de instaurar medidas preventivas con el objetivo de evitar o retrasar las complicaciones a medio y largo plazo asociadas a la entidad.
Entre las entidades de riesgo para el desarrollo de SOP hay que señalar: a) la obesidad de inicio precoz asociada a resistencia a la insulina; b) el bajo peso al nacer asociado a una recuperación posnatal rápida y exagerada de peso y al desarrollo de pubarquia precoz (aparición de vello pubiano antes de los 8 años), y/o pubertad adelantada e hiperinsulinismo17; c) la prolongación del período de anovulación fisiológica más allá de 2 años posmenarquia2, y d) la hiperplasia suprarrenal congénita y otros trastornos virilizantes.
Las pacientes con pubarquia precoz y antecedentes de bajo peso al nacer presentan hiperinsulinismo, dislipemia y alteración de los marcadores de inflamación ya al diagnóstico de la entidad. Estas adolescentes presentan con frecuencia una pubertad adelantada rápidamente evolutiva con menarquia temprana, talla final por debajo de la talla diana e hiperandrogenismo ovárico subclínico en los primeros meses posmenarquia, que evoluciona a SOP clínico en un porcentaje significativo de casos en el plazo de 2 a 3 años17–19.
Presentación clínica del síndrome del ovario poliquísticoLa combinación de hirsutismo moderado de progresión lenta e irregularidades menstruales al menos 2 años después de la menarquia, acné, acantosis nigricans (áreas de pigmentación cutánea en cuello y axilas, que son la expresión clínica de la presencia de resistencia a la insulina), obesidad y/o exceso de adiposidad central son la forma de presentación clínica más común del SOP.
Lectura rápida
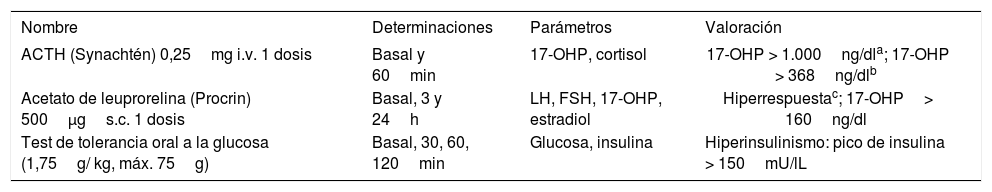
El protocolo diagnóstico incluye la determinación del índice de andrógenos libre (IAL) (testosterona total (nmol/l x 100/sex hormone-binding globulin [SHBG] [nmol/l]) y de las concentraciones séricas de 17-hidroxiprogesterona (17-OHP) en la fase folicular del ciclo menstrual o después de, al menos, 2 meses de amenorrea. Un IAL normal (< 5) sugiere hirsutismo idiopático. Un IAL muy elevado (> 30) o valores muy altos de testosterona total (> 200ng/dl) asociados al desarrollo de hirsutismo severo de rápida evolución sugieren un tumor productor de andrógenos. Un IAL moderadamente elevado es sugestivo de SOP; en estas adolescentes, es aconsejable medir las concentraciones basales de glucosa e insulina, y el perfil lipídico. Está indicado realizar un test de ACTH cuando las cifras basales de 17-OHP en fase folicular son > 200ng/dl. Cifras de 17-OHP post-ACTH > 1.000ng/ dl obligan a descartar la presencia de una hiperplasia suprarrenal congénita por déficit de 21-hidroxilasa mediante estudio genético. La prevalencia de este defecto enzimático no es superior al 3%.
En la anamnesis es importante constatar la presencia de signos/síntomas sugestivos de SOP en otros miembros de la familia, así como de factores de riesgo para el desarrollo de SOP en la paciente, como un bajo peso al nacer, desarrollo de sobrepeso en la infancia, pubarquia precoz, y pubertad o menarquia adelantadas. Asimismo, se debe preguntar por la edad de inicio y el grado de progresión del hirsutismo, así como por el uso de medicaciones (ácido valproico, antipsicóticos).
En el examen físico se necesita el peso y la talla, para calcular el índice de masa corporal, y se constatará la presencia y el grado de hirsutismo, de acuerdo con la escala de Ferriman y Gallwey20. Una puntuación > 8 es diagnóstica de hirsutismo, pero en el SOP dicha puntuación suele estar alrededor de 12–15; una puntuación > 30 es sospechosa de tumor secretor de andrógenos (o de administración de derivados androgénicos), y suele acompañarse de otros signos de virilización, como clitoromegalia, alopecia y aumento de la masa muscular. Un cociente cintura cadera elevado (> 0,8) sugiere la presencia de un exceso de adiposidad central; la presencia de acantosis nigricans, como se ha comentado anteriormente, se asocia a resistencia a la insulina.
Lectura rápida
El test de tolerancia oral a la glucosa (TTOG) está indicado en las pacientes con riesgo de desarrollar intolerancia a la glucosa (p. ej., las pacientes obesas y aquellas con bajo peso al nacer seguido de una recuperación exagerada de peso). La presencia de ovarios poliquísticos ecográficos no es necesaria para el diagnóstico de SOP, por lo que no se recomienda realizar una ecografía de manera sistemática.
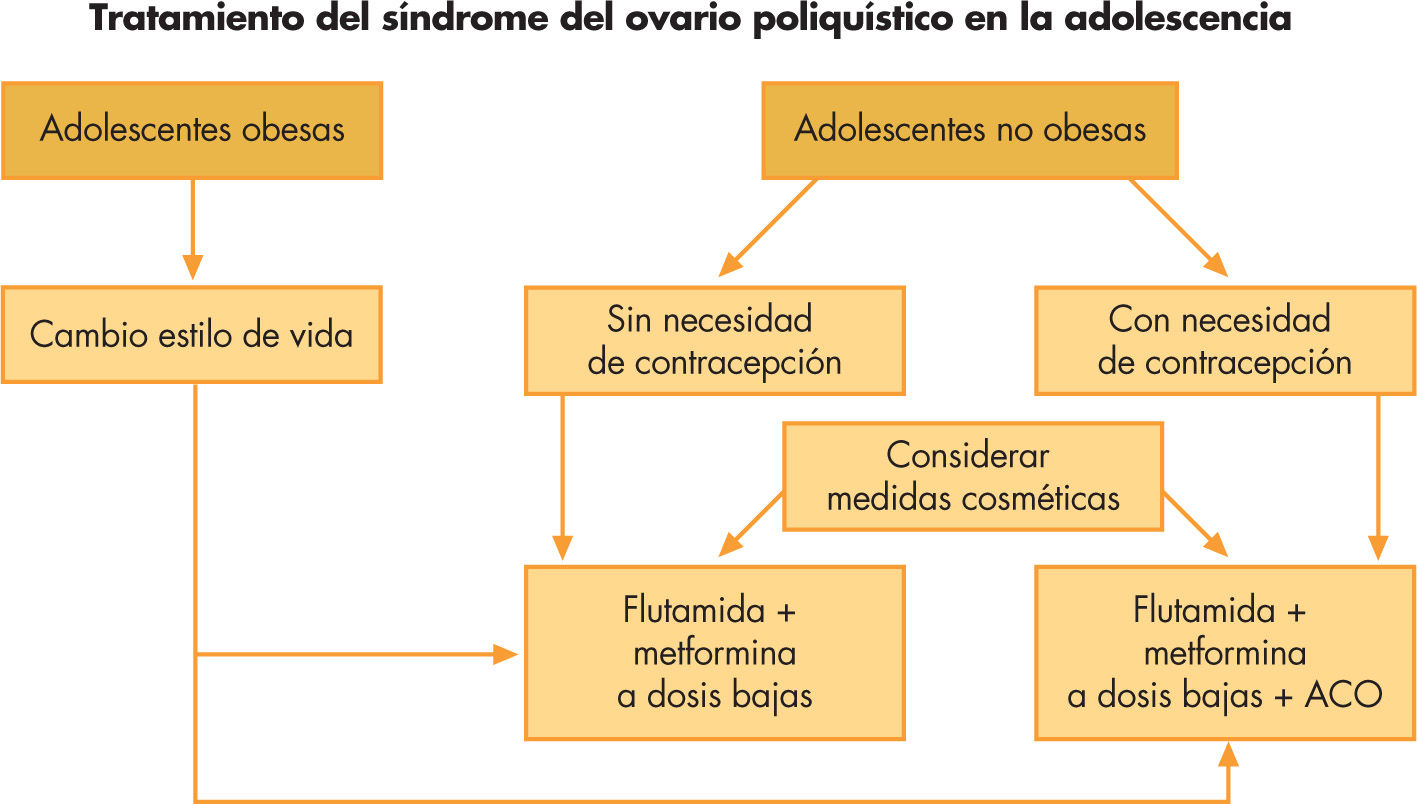
Tratamiento del síndrome del ovario poliquísticoEn adolescentes con sobrepeso u obesidad, la dieta y el ejercicio físico son los pilares fundamentales del tratamiento, tanto para normalizar los ciclos mentruales como para evitar las complicaciones a largo plazo. Las medidas cosméticas están indicadas en el hirsutismo idiopático y pueden ser útiles en las fases iniciales del tratamiento en el SOP con hirsutismo moderado o severo, ya que la terapéutica farmacológica no es efectiva sobre el vello hasta transcurridos 6–12 meses. El tratamiento farmacológico tiene como objetivo mejorar los síntomas derivados del exceso de andrógenos y modificar los marcadores de riesgo cardiovascular que pueden favorecer las complicaciones a medio y largo plazo.
La analítica inicial debe incluir la determinación del índice de andrógenos libre (IAL) (testosterona total [nmol/l × 100/SHBG {nmol/l]) y de las concentraciones séricas de 17-OHP en la fase folicular del ciclo menstrual (días quinto-octavo del ciclo) o después de al menos 2 meses de amenorrea. Un IAL normal (< 5) sugiere la existencia de hirsutismo idiopático. Un IAL muy elevado (> 30) o valores muy altos de testosterona total (> 200ng/dl) asociados al desarrollo de hirsutismo severo de rápida evolución sugieren la existencia de un tumor productor de andrógenos; en estos casos, se recomienda determinar otros andrógenos ováricos (androstendiona) o suprarrenales (DHEAS). Un IAL moderadamente elevado es sugestivo de SOP; en estas adolescentes, es aconsejable medir las concentraciones basales de glucosa e insulina, y el perfil lipídico.
Está indicado realizar un test de ACTH cuando las concentraciones basales de 17-OHP en fase folicular son > 200ng/dl. Si los valores de 17-OHP post-ACTH son > 1.000ng/dl se debe descartar la presencia de una hiperplasia suprarrenal congénita por déficit de 21-hidroxilasa mediante estudio genético (tabla 1). Los valores de 17-OHP post-ACTH entre 1.000 y 1.500ng/dl suelen corresponder a heterocigotos, mientras que los homocigotos suelen presentar concentraciones de 17-OHP post-ACTH > 1.500ng/dl. La prevalencia de este defecto enzimático no es superior al 3%. En algunas pacientes, la respuesta de 17-OHP se considera “exagerada” (superior al promedio + 2 desviaciones estándar de los valores normales). En estos casos, se habla de hiperrespuesta o de hiperandrogenismo suprarrenal funcional; esta respuesta es frecuente en adolescentes con SOP.
Tests utilizados en el diagnóstico diferencial del hiperandrogenismo
| Nombre | Determinaciones | Parámetros | Valoración |
|---|---|---|---|
| ACTH (Synachtén) 0,25mg i.v. 1 dosis | Basal y 60min | 17-OHP, cortisol | 17-OHP > 1.000ng/dla; 17-OHP > 368ng/dlb |
| Acetato de leuprorelina (Procrin) 500μgs.c. 1 dosis | Basal, 3 y 24h | LH, FSH, 17-OHP, estradiol | Hiperrespuestac; 17-OHP> 160ng/dl |
| Test de tolerancia oral a la glucosa (1,75g/ kg, máx. 75g) | Basal, 30, 60, 120min | Glucosa, insulina | Hiperinsulinismo: pico de insulina > 150mU/lL |
ACTH: hormona adrenocorticotropa; i.v.: intravenoso: LH: hormona luteoestimulante; FSH: hormona folículo-estimulante; 17-OHP, 17-hidroxiprogesterona; s.c.: subcutáneo.
Sospecha de forma no clásica de hiperplasia suprarrenal congénita por déficit de 21-hidroxilasa. El diagnóstico definitivo requiere confirmación molecular.
El test de estimulación con agonistas de GnRH (acetato de leuprorelina, 500μg subcutáneos) es de interés para constatar la existencia de SOP. La determinación de la 17-OHP ovárica basal y a las 24h de administrar el agonista permite determinar la respuesta gonadal (tabla 1); en los casos de SOP las gonadotropinas hipofisarias (LH y FSH) se encuentran significativamente elevadas a las 3h de administrar el agonista.
El test de tolerancia oral a la glucosa (TTOG) está indicado en las pacientes con mayor riesgo de desarrollar intolerancia a la glucosa (p. ej., las pacientes obesas y aquellas con antecedente de bajo peso al nacer seguido de una recuperación exagerada de peso).
La presencia de ovarios poliquísticos ecográficos no es necesaria para el diagnóstico de SOP7, por lo que no se recomienda realizar una ecografía de manera sistemática. La interpretación de la morfología ovárica es compleja; por un lado, los criterios diagnósticos ecográficos de poliquistosis ovárica se han modificado en los últimos años21, por otro, se ha demostrado que la morfología ovárica es parcialmente dependiente del crecimiento prenatal22, y que hasta un 10% de las adolescentes asintomáticas presenta ovarios poliquísticos ecográficos23.
La valoración de la composición corporal mediante absorciometría de doble energía se reserva, en general, para estudios de investigación, y puede ser útil en la valoración de los resultados del tratamiento. En adolescentes con SOP, la masa grasa, sobre todo el componente visceral de la grasa abdominal, se encuentra aumentada —aún en ausencia de obesidad— mientras que la proporción de masa magra se encuentra disminuida24,25.
Los estudios de imagen como la tomografía computarizada o la resonancia magnética pueden ser necesarios en caso de sospecha tumoral.
Tratamiento del síndrome del ovario poliquísticoEn adolescentes con sobrepeso u obesidad, la dieta y el ejercicio físico constituyen los pilares fundamentales del tratamiento, tanto para normalizar la ciclicidad menstrual como para evitar las complicaciones a largo plazo, como la diabetes tipo 2.
Las medidas cosméticas para eliminar el vello como la depilación eléctrica o el láser están indicadas en el hirsutismo idiopático, y pueden ser de utilidad en las fases iniciales del tratamiento en el SOP con hirsutismo moderado o severo, ya que la terapéutica farmacológica no es efectiva sobre el vello corporal hasta transcurridos 6–12 meses.
El tratamiento farmacológico tiene como objetivo no sólo mejorar los síntomas derivados del exceso de andrógenos sino también modificar los marcadores de riesgo cardiovascular que pueden favorecer las complicaciones a medio y largo plazo.
Clásicamente, el tratamiento de elección del SOP, independientemente de la necesidad de contracepción y de la edad de la paciente, ha sido la administración de anticonceptivos orales (ACO), constituidos por diferentes asociaciones de estroprogestágenos. Los ACO mejoran el hirsutismo, el acné y regularizan los ciclos menstruales, ya que disminuyen el IAL al aumentar los niveles de SHBG. Los ACO conteniendo progestágenos no androgénicos, como la drospirenona (Yasmin®, 30μg etinilestradiol + 3mg de drospirenona; Yasminelle®, 20μg etinilestradiol + 3mg de drospirenona), y los que contienen una combinación de etinilestradiol y un antiandrógeno (Diane®, 35μg de etinilestradiol + acetato de ciproterona) son los más utilizados. Sin embargo, diversos estudios han demostrado que estos preparados en monoterapia agravan la resistencia a la insulina y la adiposidad corporal, e incrementan el riesgo cardiovascular25,26. El tratamiento combinado con un sensibilizante de la insulina (metformina, 850mg/día) y un antiandrógeno puro (flutamida 62,5mg/ día) a dosis bajas normaliza no sólo la hipersecreción de andrógenos y los síntomas clínicos, incluyendo la frecuencia ovulatoria, sino que también mejora el estado metabólico, la composición corporal y los marcadores de riesgo que acompañan al hiperandrogenismo ovárico, por ejemplo los parámetros de inflamación (IL-6, neutrofilia relativa, y proteína C reactiva), aumentando los valores de adiponectina10,14,25. La mejoría del hiperinsulinismo podría mediar estas modificaciones y, por tanto, disminuir el riesgo de enfermedad cardiovascular y de diabetes tipo 2. La flutamida es un bloqueador del receptor de andrógenos, que carece de actividad progestágena, estrogénica, corticoide o antigonadotrópica. Aunque se han descrito casos aislados de hepatitis fulminante en pacientes que recibieron flutamida a dosis 10 veces superiores a las recomendadas para el tratamiento del SOP, diversos autores han reportado la seguridad del tratamiento prolongado con flutamida a dosis bajas en poblaciones numerosas de adolescentes y mujeres jóvenes con SOP27–29. La adición de un ACO que contenga drospirenona al tratamiento combinado con flutamida y metformina en el caso de que haya riesgo de embarazo, no modifica los efectos beneficiosos de la terapéutica combinada sobre los marcadores de riesgo cardiovascular.
Lectura rápida
Los anticonceptivos orales (ACO) mejoran la sintomatología y regularizan los ciclos menstruales, pero administrados en monoterapia agravan la resistencia a la insulina y la adiposidad corporal, e incrementan el riesgo cardiovascular. El tratamiento combinado con un sensibilizante de la insulina (metformina 850mg/día) y un antiandrógeno puro (flutamida 62,5mg/día) a dosis bajas normaliza no sólo la hipersecreción de andrógenos y los síntomas clínicos sino que también mejora el estado metabólico, la composición corporal y los marcadores de riesgo. La adición de un ACO que contenga drospirenona al tratamiento combinado si hay riesgo de embarazo no modifica los efectos beneficiosos de la terapéutica sobre los marcadores de riesgo cardiovascular. Se recomienda una duración mínima del tratamiento de 2 años. El tratamiento preventivo con metformina en pacientes de riesgo para el desarrollo de SOP es efectivo si se inicia antes de la pubertad, por lo que el período peripuberal podría constituir una ventana adecuada de intervención en estas pacientes.
Recientemente, se ha reportado que la adición de dosis bajas de pioglitazona (un agonista PPARγ) al tratamiento combinado con metformina y flutamida consigue normalizar aún más los parámetros endocrinometabólicos y, además, disminuye la proporción de grasa visceral y el grosor de la íntima carotídea, que se encuentra aumentada en estas pacientes y que constituye un factor adicional de riesgo cardiovascular24,30.
Se recomienda una duración mínima del tratamiento de 2 años. Sin embargo, el período de remisión obtenido al suspender el tratamiento es muy variable y se precisa mayor número de estudios prospectivos para llegar a un consenso25. Las recomendaciones terapéuticas se resumen en la figura 3.
Prevención del síndrome del ovario poliquísticoEn adolescentes con pubarquia precoz y bajo peso al nacer, la administración de metformina inmediatamente después de la menarquia mejora el cuadro endocrinometabólico, pero los efectos beneficiosos desaparecen al suspender el tratamiento31. Por el contrario, el inicio de la terapéutica con metformina al diagnóstico de la pubarquia precoz y, por tanto, antes del inicio de la pubertad, consigue modular su inicio y progresión, retrasa la edad de la menarquia, mejora la composición corporal reduciendo la grasa total y visceral, y parece tener efectos sostenidos aun después de suspender la terapéutica, por lo que es posible que esta intervención mejore no sólo la talla final sino que también reduzca el riesgo de desarrollar SOP clínico32–34.
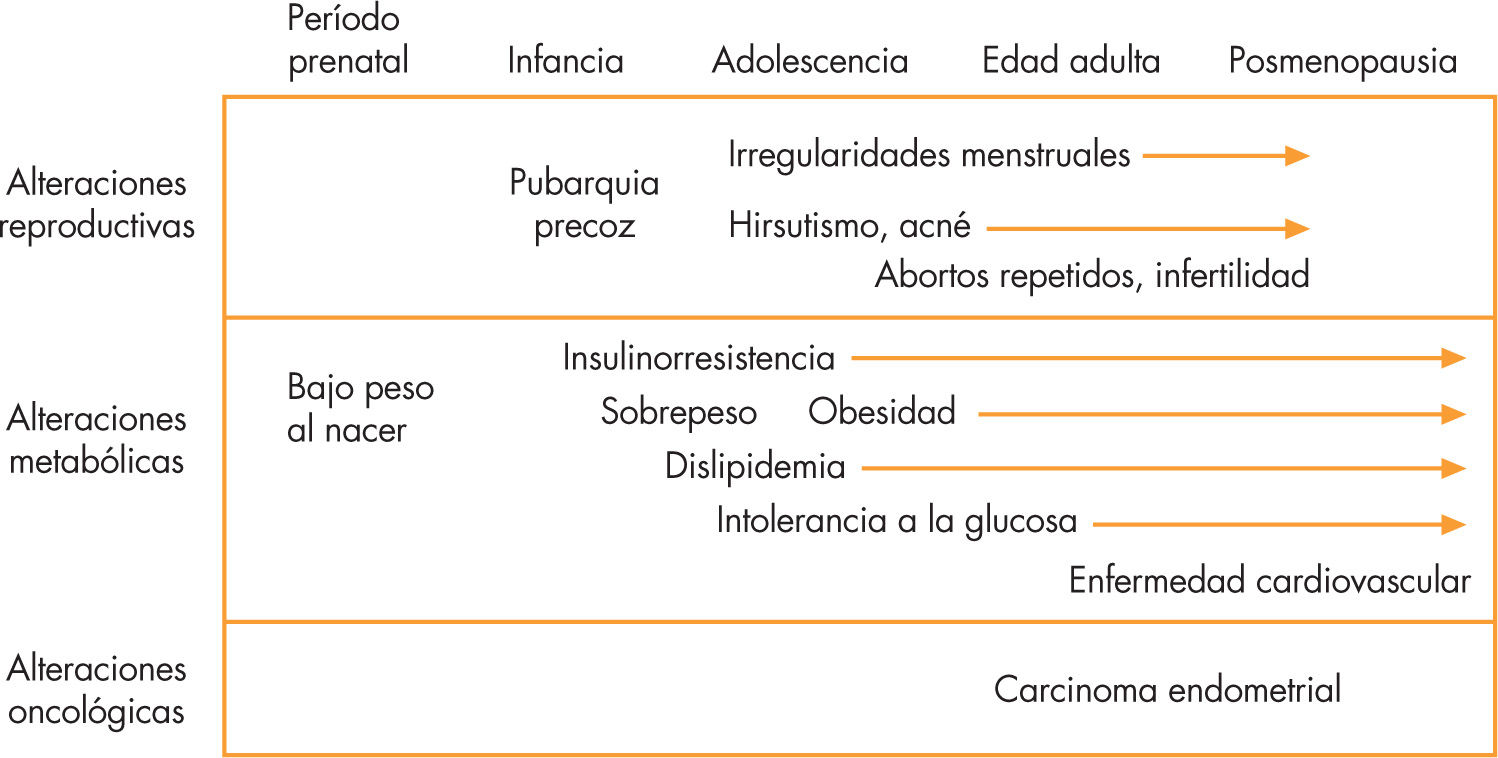
Consideraciones finalesLas pacientes con hiperandrogenismo ovárico tienen mayor riesgo de desarrollar precozmente diabetes tipo 2 y enfermedad cardiovascular; este riesgo está en relación directa con el grado de hiperinsulinismo y resistencia a la insulina, y aún es más elevado si hay obesidad (fig. 4). El tratamiento combinado con flutamida y metformina potencialmente puede evitar o retardar las complicaciones a largo plazo. El tratamiento preventivo con metformina en pacientes de riesgo para desarrollar SOP parece ser efectivo si se inicia antes de la pubertad.
Consecuencias del hiperandrogenismo a lo largo del desarrollo. Adaptada de Sam y Dunaif15.