Puntos clave
La tuberculosis (TB) continúa representando un problema de salud relevante a pesar de los avances terapéuticos de las últimas décadas. El último informe del Centro Europeo de Prevención de Enfermedades refleja la situación de esta enfermedad en los países de la Unión Europea y la Región Europea de la Organización Mundial de la Salud (OMS)1. En sus conclusiones señala que continúa la tendencia a la baja, si bien la disminución observada entre 2008 y 2007 es la menor de los últimos 4 años (1,2%); un incremento sostenido en la notificación de pediatría y sugiere el aumento en las tasas de transmisión.
En España, en 2009, según datos de la Red de Vigilancia Epidemiológica, se registraron 6.566 casos2. Esta cifra sitúa a la TB como la tercera enfermedad notificable por vía respiratoria, sólo superada por gripe y varicela.
Agente etiológicoLa TB es un enfermedad infecciosa causada por el bacilo de la tuberculosis; pertenece al complejo Mycobacterium tuberculosis (MTB), grupo muy homogéneo de bacterias con una enorme identidad genética que incluye, entre otros, M. tuberculosis, M. bovis y M. africanum.
EpidemiologíaEl único reservorio del bacilo de la tuberculosis es la especie humana y la fuente de infección es la persona que presenta una TB respiratoria (pulmonar, bronquial o laríngea). El principal modo de transmisión es la vía aérea. El riesgo de desarrollar una TB es máximo durante el primer y segundo año tras la infección. En el 90% de los casos el bacilo permanece en estado latente, sin causar enfermedad, denominándose infección tuberculosa latente (ITL) que se puede detectar por una prueba de tuberculina positiva y test de interferón gamma positivo (IGRA).
La persona infectada no enferma, no presenta ningún síntoma y no es contagiosa. La TB es contagiosa mientras persistan bacilos viables en el esputo. Los niños pueden transmitir TB, si bien la probabilidad de que esto ocurra es menor que en adultos. Los pacientes con cultivo de esputo negativo y formas de TB extrapulmonar se consideran no contagiosos. El grado de transmisibilidad depende del grado de contagiosidad y de la duración e intimidad del contacto. La TB se asocia con determinantes sociales desfavorables; los niños pertenecen al mismo grupo de riesgo que los adultos convivientes.
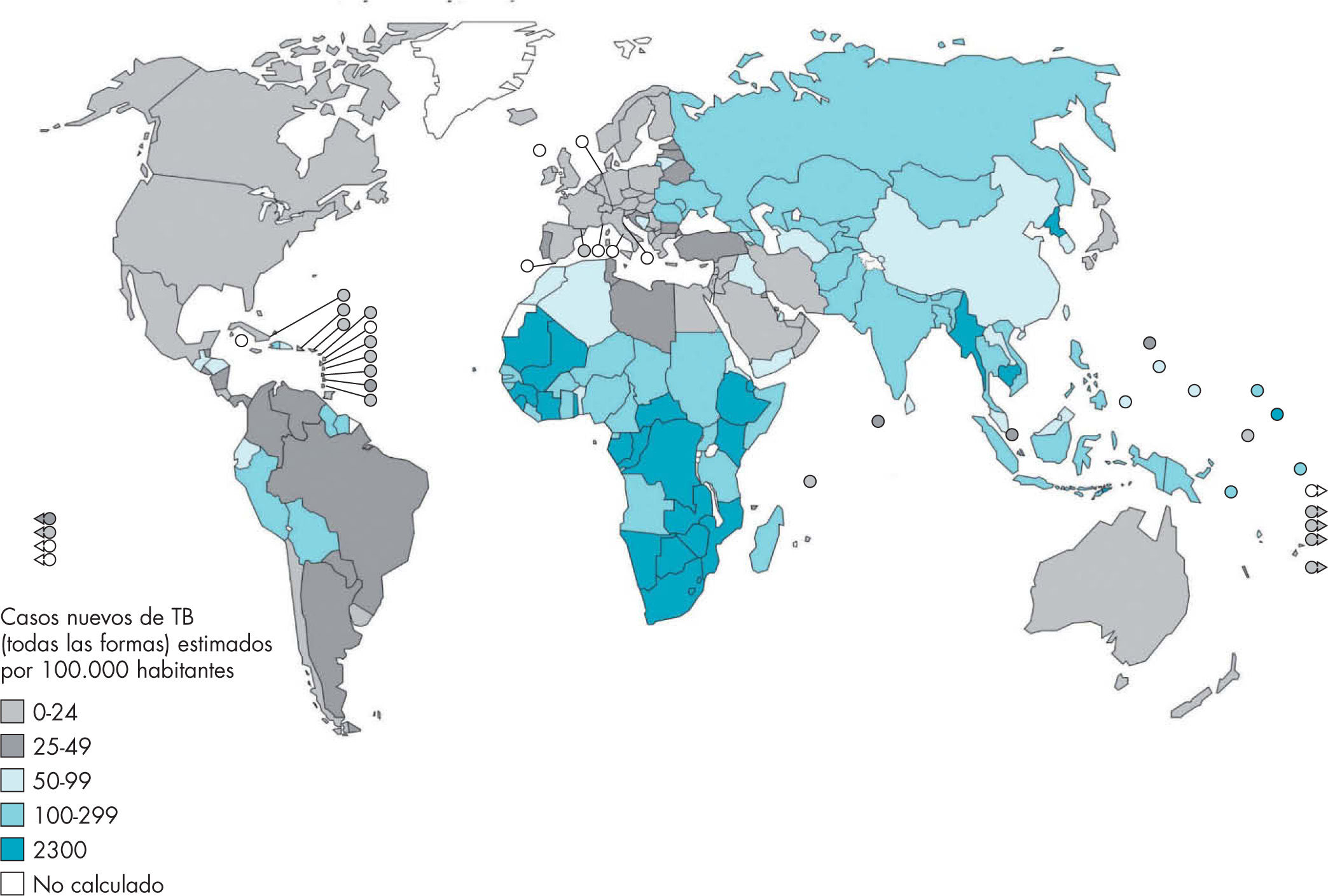
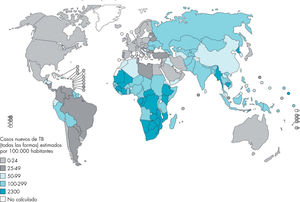
Incidencia mundialLa TB es un importante problema de salud pública que se ha visto empeorado por el virus de la inmunodeficiencia humana (VIH)/sida, la aparición de cepas multirresistentes a fármacos y los movimientos migratorios. En 2008, la OMS estimaba su importancia global en 8,9-9,9 millones de casos incidentes; 9,6-13,3 millones de casos prevalentes; 1,1-1,7 millones de muertos por TB en personas no infectadas por el VIH y 0,45-0,62 millones de muertos en las infectadas por este virus3. Las zonas geográficas consideradas de alta incidencia de TB se señalan en figura 1.
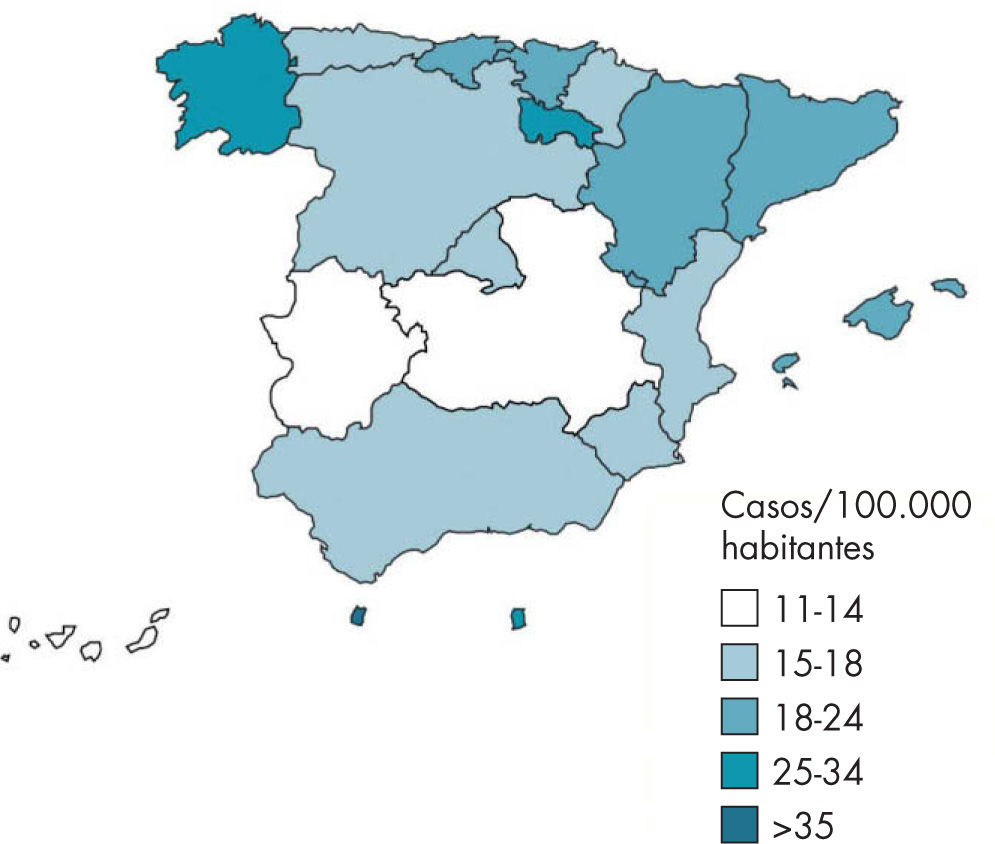
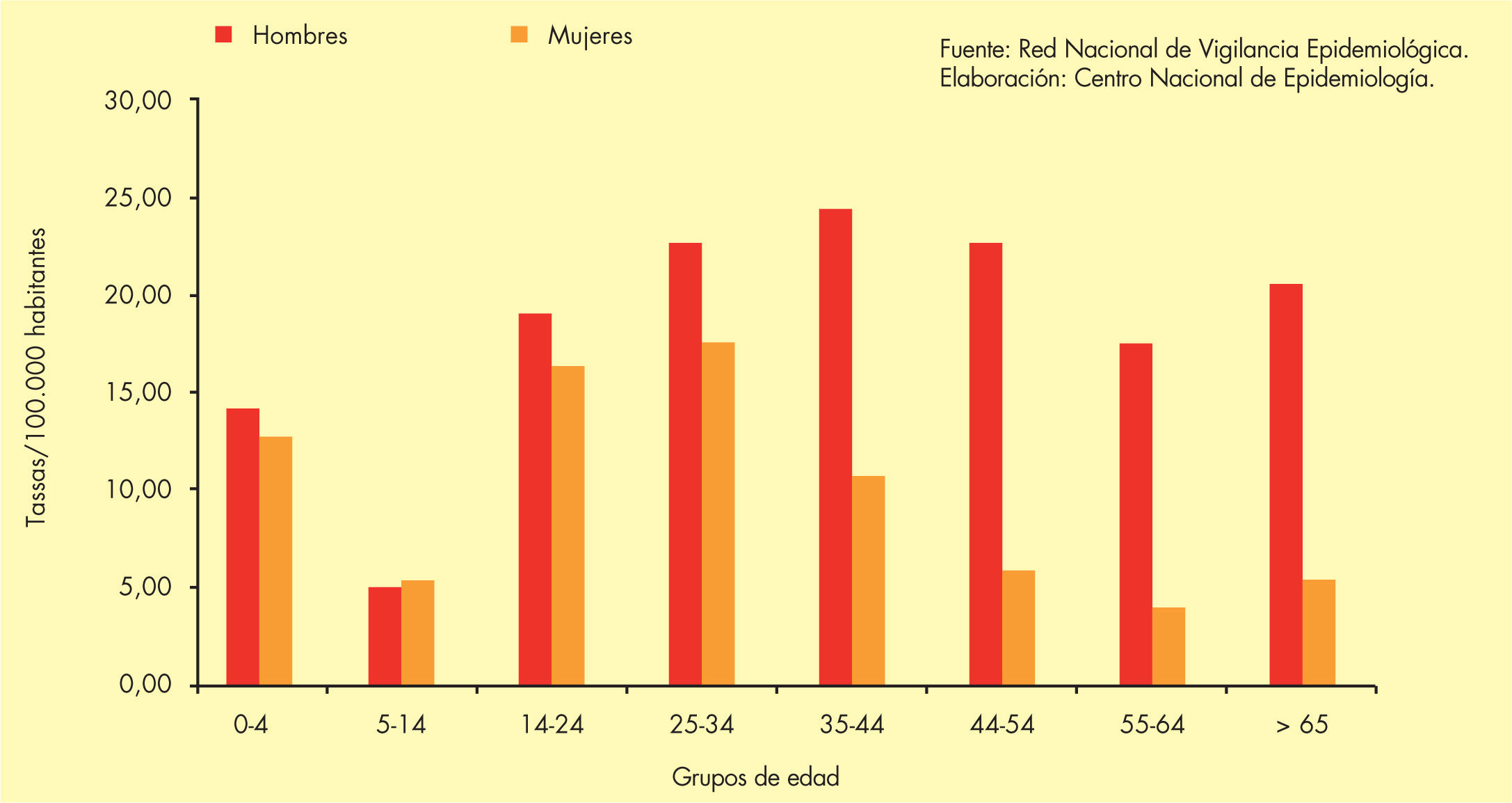
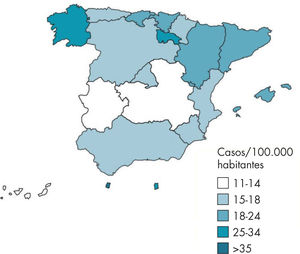
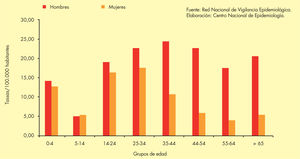
Incidencia en EspañaEn España, según el sistema de Enfermedades de Declaración Obligatoria (EDO), la evolución de la TB respiratoria presenta una tendencia descendente desde 1999. En 2008, el número de casos declarados de TB respiratoria fue de 6.498 (tasa de 14,54 casos/105 habitantes)4, con gran variabilidad según las comunidades autónomas (figs. 2 y 3).
Vacunas frente a la tuberculosisLa vacuna contra la tuberculosis elaborada con bacilo de Calmette-Guérin (BCG) es la vacuna más utilizada y, probablemente, la más controvertida. La BCG protege contra las formas más graves, meníngea y miliar. Su eficacia contra las formas respiratorias es variable.
La OMS recomienda su uso en países de alta endemia y en aquellos con alta incidencia.
ComposiciónLa vacuna BCG es una vacuna viva, no patógena, preparada a partir de una cepa atenuada de M. bovis. Calmette y Guérin necesitaron 13 años y más de 200 subcultivos para conseguir su atenuación. Estudios genéticos demuestran que en la vacuna actual se han perdido más de 100 genes en distintas regiones, algunos de ellos implicados en la virulencia5. La BCG induce una respuesta principalmente de tipo celular. La cepa original de BCG se distribuyó a distintos países y laboratorios, modificando su virulencia residual y características inmunogénicas y variando, en las distintas cepas vacunales, el número de genes delecionados y su composición en lípidos. Las distintas vacunas BCG son conocidas por el nombre del laboratorio de producción o del lugar, BCG Copenhague, BCG Japón, BCG Pasteur, etc. La publicación de la secuencia completa de BCG Pasteur ha revelado diferencias en sus características genéticas y moleculares6. Éstas permitirían explicar las diferencias en las vacunas BCG, siendo unas cepas «más inmunógenas» (Japón, Rusia y Moreau) y otras «menos inmunógenas» (Glaxo 1077, Danesa 1331).
Inmunogenicidad, eficacia y efectividadLa mayoría de estudios han demostrado que la BCG protege contra formas graves de TB. Los estudios que han evaluado la protección conferida por BCG han mostrado un rango de eficacia del 46-100% en TB meníngea o miliar y entre el 0 y el 80% en la TB pulmonar7–9. Esta protección variaría con la latitud geográfica, en sentido de, a mayor lejanía del ecuador, mayor eficacia. Probablemente, la exposición a otras micobacterias, más intensa en climas cálidos, induzca cierto grado de inmunidad y enmascare su protección10.
Existe acuerdo en considerar que la BCG tiene un limitado papel en la disminución de la transmisión. Por ello la investigación en vacunas más eficaces tiene como objetivo primordial prevenir las formas respiratorias11.
IndicacionesEn España, la BCG no se aplica de forma sistemática en la población pediátrica, al no encontrarse incluida en el calendario vacunal de la AEP, aunque sí está presente en el calendario vacunal del País Vasco.
En países con alta incidencia, la OMS recomienda la vacunación BCG de forma sistemática. No se recomienda la revacunación. En países con una situación epidemiológica intermedia, tiende a reemplazarse por la vacunación selectiva en grupos de alto riesgo.
Pauta de administraciónLa vacunación con BCG se puede administrar en cualquier momento de la vida. En países de alta endemia se recomienda que ésta sea lo más precoz posible. Puede administrarse simultáneamente con otras vacunas.
Vía de administración y dosisVía intradérmica a la dosis de entre 2-8 × 105 unidades formadoras de colonias (UFC) de BCG diluida en 0,1ml. En menores de un año se recomienda la mitad de esta cantidad en la misma concentración. Se recomienda su aplicación en la región deltoidea.
Inmunidad inducida por BCGLa BCG induce inmunidad principalmente de tipo celular, y por ello el estudio serológico no aporta información relevante.
- —
Control prevacunal: no se recomienda vacunar a los positivos a tuberculina. En el adulto es necesario descartar infección por VIH y embarazo.
- —
Control posvacunal: no existe ninguna técnica inmunológica que permita valorar la protección conferida. La prueba de tuberculina positiva tras la vacunación con BCG indica que el individuo vacunado ha desarrollado hipersensibilidad celular retardada, pero no indica protección contra la TB. Los individuos vacunados pueden ser diferenciados de los individuos infectados por las pruebas de tuberculina positivas, IGRA–.
La vacunación intradérmica con BCG produce un complejo primario en el punto de inyección. El riesgo de complicaciones locales es muy bajo; en algunos individuos se puede presentar una reacción vacunal excesiva con ulceración, absceso subcutáneo o adenitis supurativa; no se conoce el riesgo de otros efectos adversos que pueden depender de la dosis y cepa utilizada.
Se han descrito diseminaciones vacunales y se han comunicado casos de TB diseminada en niños infectados por el VIH vacunados durante el primer año de vida.
Contraindicaciones y precaucionesLa BCG está contraindicada en el embarazo y no se debe administrar a personas con inmunodeficiencias, incluyendo pacientes infectados por el VIH.
InteraccionesLos medicamentos antituberculosos, excepto la piracinamida, destruyen el bacilo vacunal. Está contraindicada en personas que reciben corticoides por vía sistémica o tratamiento inmunosupresor.
ConservaciónSe conserva refrigerada a temperatura entre + 2 y + 8ºC. Se presenta en envase multidosis (10 dosis) liofilizado. El preparado debe ser reconstituido con 1ml de diluyente. Una vez reconstituido precisa nevera y administrará en 4-6h. Debe protegerse de la luz.
Presentaciones comercialesEn España, la presentación más generalizada es la comercializada por Pfizer. Preparada a partir de la Cepa Danesa 1331 y fabricada por el Statens Serum Institut (Copenhague). Se presenta en viales de 10 dosis de 0,1ml; reconstituida contiene 0,075mg de BCG con una concentración mínima de 2 × 106 UFC.
En otros países, las cepas más utilizadas son BCG Danish, BCG Rusia, BCG Moreau (Río de Janeiro), BCG Japón y BCG Pasteur.
Nuevas vacunas preventivas contra la tuberculosisLas principales estrategias en la investigación en nuevas vacunas contra la TB son dos: a) aumentar la inmunidad de los individuos vacunados con BCG, y b) encontrar una vacuna más eficaz que pueda reemplazar la BCG.
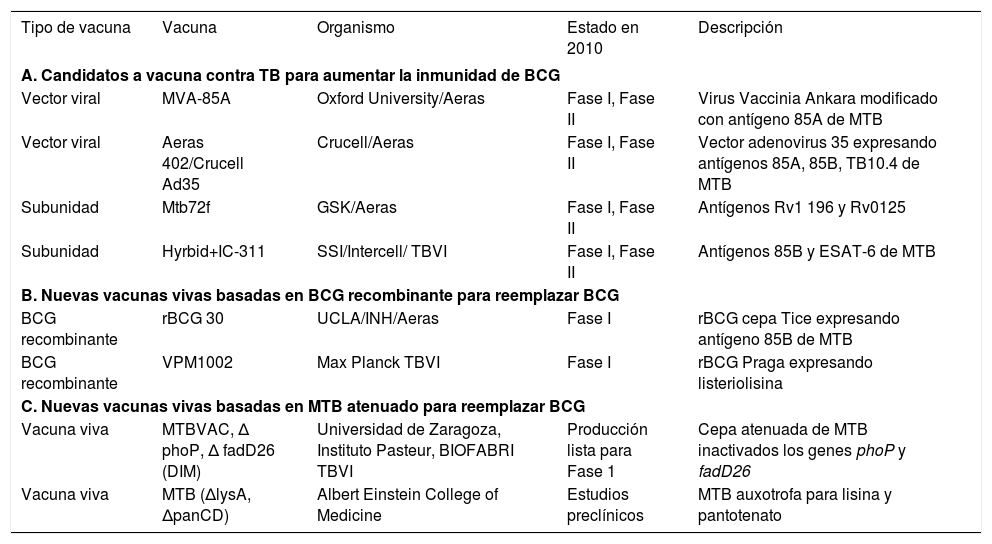
Diferentes candidatos a vacunas subunidades se están ensayando para aumentar la inmunidad de BCG. La estrategia BCG + virus Vaccinia Ankara modificado, de la Universidad de Oxford, se encuentra en fase avanzada de ensayos en humanos (v. tabla 1).
Vacunas preventivas en desarrollo.
| Tipo de vacuna | Vacuna | Organismo | Estado en 2010 | Descripción |
|---|---|---|---|---|
| A. Candidatos a vacuna contra TB para aumentar la inmunidad de BCG | ||||
| Vector viral | MVA-85A | Oxford University/Aeras | Fase I, Fase II | Virus Vaccinia Ankara modificado con antígeno 85A de MTB |
| Vector viral | Aeras 402/Crucell Ad35 | Crucell/Aeras | Fase I, Fase II | Vector adenovirus 35 expresando antígenos 85A, 85B, TB10.4 de MTB |
| Subunidad | Mtb72f | GSK/Aeras | Fase I, Fase II | Antígenos Rv1 196 y Rv0125 |
| Subunidad | Hyrbid+IC-311 | SSI/Intercell/ TBVI | Fase I, Fase II | Antígenos 85B y ESAT-6 de MTB |
| B. Nuevas vacunas vivas basadas en BCG recombinante para reemplazar BCG | ||||
| BCG recombinante | rBCG 30 | UCLA/INH/Aeras | Fase I | rBCG cepa Tice expresando antígeno 85B de MTB |
| BCG recombinante | VPM1002 | Max Planck TBVI | Fase I | rBCG Praga expresando listeriolisina |
| C. Nuevas vacunas vivas basadas en MTB atenuado para reemplazar BCG | ||||
| Vacuna viva | MTBVAC, ∆ phoP, ∆ fadD26 (DIM) | Universidad de Zaragoza, Instituto Pasteur, BIOFABRI TBVI | Producción lista para Fase 1 | Cepa atenuada de MTB inactivados los genes phoP y fadD26 |
| Vacuna viva | MTB (∆lysA, ∆panCD) | Albert Einstein College of Medicine | Estudios preclínicos | MTB auxotrofa para lisina y pantotenato |
BCG: bacilo de Calmette-Guérin; MTB: Mycobacterium tuberculosis; TB: tuberculosis.
Aeras: http://www.aeras.org/; TBVI: Tuberculosis Vaccine Initiative European Foundation (http://www.tbvi.eu/). Para una lista completa de vacunas TB http://www.stoptb.org/wg/new_vaccines/
Se investigan nuevas vacunas vivas que confieran una mayor protección. En este grupo se encuentran las vacunas basadas en BCG recombinante (rBCG) a la que se le añaden genes que aumenten su inmunidad y vacunas vivas atenuadas a partir de la atenuación racional de M. tuberculosis que contengan los antígenos mayores, delecionados en BCG, e inactiven los genes de virulencia, buscando una nueva generación de vacunas capaces de reemplazar a BCG (v. tabla 1). Hoy, más de 100 años después del desarrollo de BCG, hay cerca de una veintena de candidatos a vacuna preventiva en desarrollo; varios en ensayos en humanos y otros en avanzadas etapas preclínicas (la lista completa de candidatos se puede encontrar en http://www.stoptb.org/wg/new_vaccines/). El desarrollo de una nueva vacuna que confiera mayor grado de protección es un reto para la comunidad científica que permitiría, con un bajo coste, el plantearse erradicar la tuberculosis a medio plazo y reemplazar la actual BCG12,13. Los escenarios para el futuro de las nuevas vacunas contra la TB14 son tres:
- —
Una vacuna subunidad que aumente la inmunidad de los individuos vacunados con BCG administrada 14 semanas tras la vacuna con BCG (boost) y con una eficacia de del 70% en 10 años y que pudiera estar disponible para su uso a partir del año 2013.
- —
Una nueva vacuna capaz de reemplazar a BCG con una dosis administrada al nacimiento (prime) y con una eficacia del 70% en 10 años y que pudiera estar disponible para su uso a partir del año 2015.
- —
Tras demostrar la eficacia de las 2 estrategias anteriores se podría plantear el utilizar una nueva vacuna que reemplace a la BCG con una dosis administrada al nacimiento más una vacuna subunidad y con una eficacia del 80% en 10 años.