El alprostadil tiene efecto vasodilatador y antiagregante. Es bien conocido su efecto endotelial, pero se desconocen sus posibles efectos pleiotrópicos sobre el músculo esquelético y si estos difieren en el músculo isquémico.
ObjetivoDeterminar el efecto del alprostadil sobre el metabolismo del músculo esquelético y valorar diferencias en su acción sobre el músculo isquémico frente al sano.
Material y métodosSe obtuvieron muestras de tejido de 10pacientes con isquemia irreversible intervenidos de amputación supracondílea, tanto de músculo isquémico (extensor corto de los dedos del pie, grupoI) como de músculo sano (músculo cuádriceps del borde de amputación, grupoS). Ambos grupos se cultivaron basalmente y con 5ng de alprostadil. Se analizó la expresión proteómica de las siguientes enzimas: triosa-fosfato-isomerasa (TPI), malato deshidrogenasa (MDH), lactato deshidrogenasa (LDH) y piruvato carboxilasa (PC). Se determinaron también sus productos, lactato y piruvato.
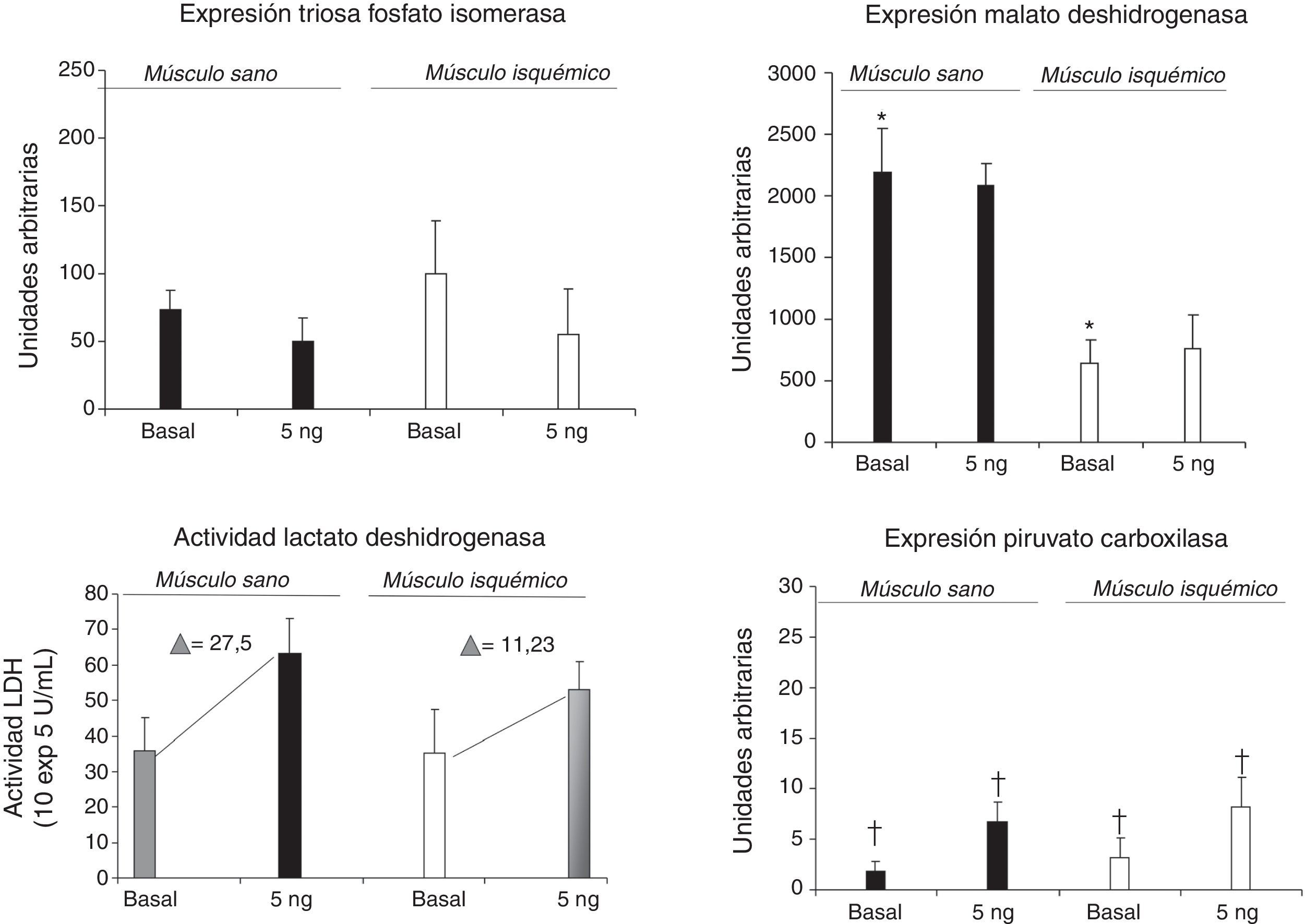
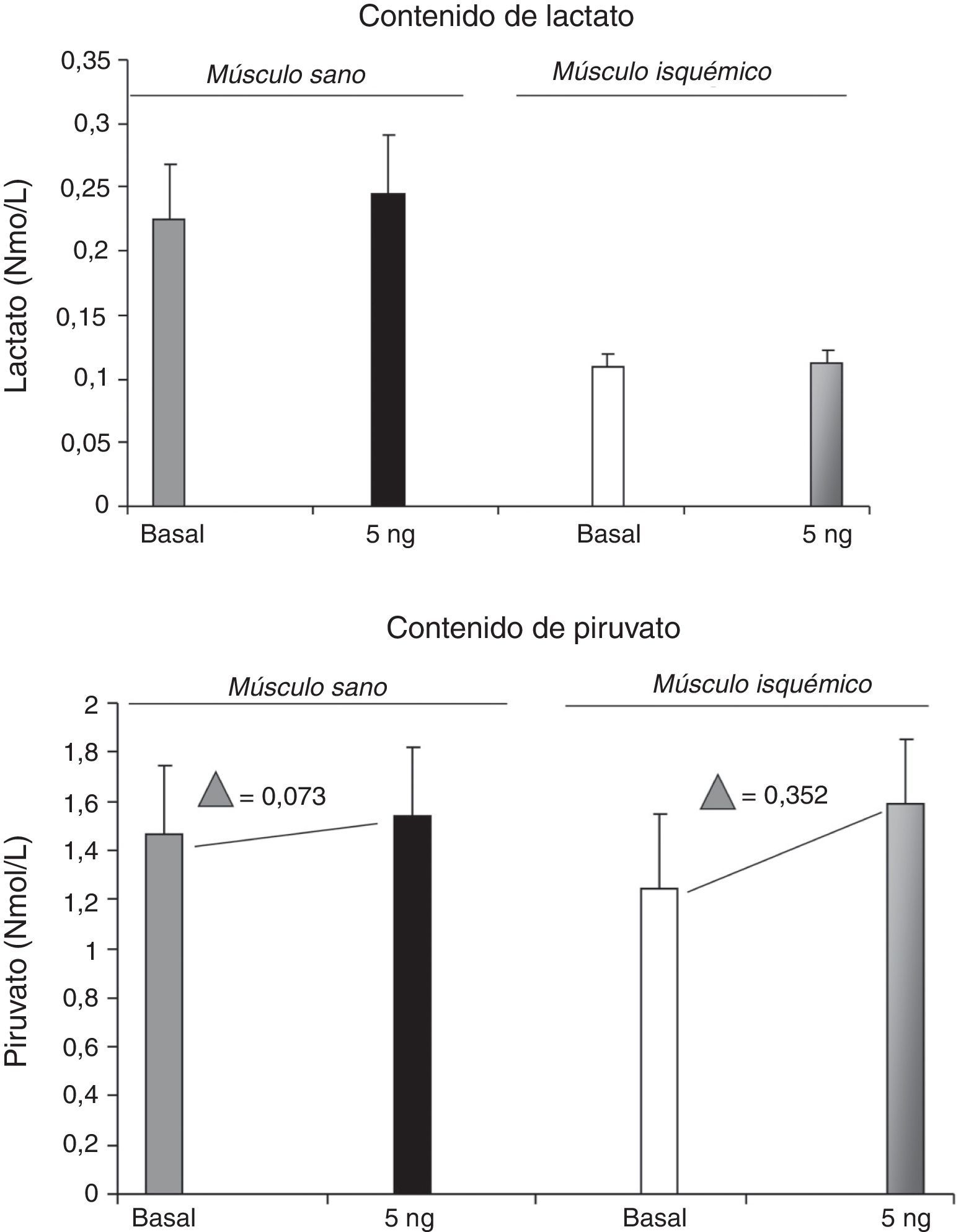
ResultadosLa MDH presentó una disminución en el grupoI en las muestras basales (2.196±348 grupo S vs 644±192 grupoI, p<0,05). La PC estaba aumentada en el grupoI en ambos tipos de muestras (basal: 1,80±1,27 vs 3,16±2,25; alprostadil: 6,72±2,13 vs 8,16±3,63, grupoS vs grupoI, respectivamente, p<0,05). No hubo diferencias significativas en la concentración de lactato ni en la de piruvato.
ConclusionesLa reducción de MDH en el músculo isquémico sugiere una reducción del ciclo de Krebs. El alprostadil estimula la expresión de PC, que induce la formación de oxalacetato; este se introduce en el ciclo de Krebs, permitiéndole funcionar parcialmente en el músculo isquémico y mejorando la obtención de energía.
Alprostadil has vasodilator properties and inhibits platelet aggregation. Its effects on endothelial wall have been widely studied, but there is no knowledge about possible skeletal muscle effects, and differences with ischemic muscle.
ObjectiveTo determine the effects of alprostadil on skeletal muscle metabolism, and to investigate possible differences with ischemic muscle.
MethodsSamples were obtained in 10patients with leg above-knee amputation due to severe irreversible ischemia, of ischemic muscle (extensor digitorum brevis, groupI), and healthy muscle (quadriceps femoris, amputation edge, groupS). Muscle segments were incubated with alprostadil 5ng, or without it (baseline). Proteomic analysis of metabolic enzymes was performed: Triose-phosphate isomerase (TPI), malate dehydrogenase (MDH), lactate dehydrogenase (LDH) and pyruvate carboxylase (PC). Lactate and pyruvate was also determined.
ResultsA decrease in malate dehydrogenase was observed in groupI in the baseline samples (2196±348 groupS vs 644±192 groupI, P<.05). PC was increased in both samples in groupI (baseline: 1.80±1.27 vs 3.16±2.25; alprostadil: 6.72±2.13 vs 8.16±3.63, groupS vs groupI, respectively, P<.05). No changes were observed in pyruvate and lactate.
DiscussionDecreased MDH in ischemic muscle suggests a Krebs cycle reduction. Alprostadil stimulates the expression of PC, which leads to oxaloacetate production. This product is inserted in Krebs cycle, improving energy obtaining. In this manner, Krebs cycle can work partially in ischemic muscle.
El alprostadil (prostaglandina E1) es una prostaglandina natural presente en las vesículas seminales y tejidos del cuerpo cavernoso de los varones y en la placenta y el ductus arteriosus del feto. Tiene un efecto reconocido como vasodilatador y antiagregante, por lo que es utilizado actualmente en el tratamiento de los pacientes con isquemia crítica (estadiosiii y iv de Fontaine) no revascularizable, y en los pacientes con isquemia crítica que son revascularizados como terapia adyuvante para mejorar la perfusión tisular periférica1-4.
Se conoce bien el efecto que realiza este fármaco a nivel del endotelio, pero no se conoce con exactitud si produce algún efecto sobre el músculo esquelético, y si tiene diferentes acciones en el músculo esquelético isquémico frente al músculo esquelético sano.
ObjetivoDeterminar el efecto del alprostadil sobre el proteoma (expresión proteica) del músculo esquelético isquémico a nivel de las enzimas metabólicas, comparando con la expresión proteica del músculo esquelético sano.
Material y métodoMuestrasEntre febrero y noviembre de 2011 se obtuvieron muestras de 10pacientes sometidos a amputación supracondílea de extremidad inferior. Los criterios de inclusión fueron isquemia crónica avanzada de la extremidad (estadiosiii y iv de la clasificación de Fontaine), no revascularizable, con oclusión femoropoplítea en la exploración física, y buenos registros de volumen del pulso (PVR) a nivel del muslo distal en el estudio hemodinámico. Se excluyeron los enfermos con infección activa severa en el pie o que hubieran recibido tratamiento anteriormente con alprostadil. En los casos en que el paciente estuviera tomando estatinas y antiagregantes previamente, se realizó un periodo de lavado de los mismos de al menos 10días. La selección se realizó de forma consecutiva.
En todos los pacientes se obtuvo consentimiento informado para su participación y el estudio fue aprobado por el Comité Ético del centro donde se llevó a cabo la obtención y el procesamiento de muestras.
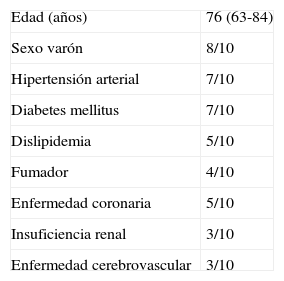
Se recogieron las siguientes características de los pacientes: edad; sexo; factores de riesgo cardiovascular: hipertensión arterial (presión arterial sistólica >140mmHg o con tratamiento antihipertensivo), diabetes mellitus (glucemia basal >110mg/dl o HbA1c>7%, o tratamiento con antidiabéticos orales o insulina), dislipidemia (cifras de colesterol total >240mg/dl, triglicéridos >150mg/dl o ratio HDL/LDL<0,3, o con tratamiento hipolipemiante), fumador (habitual o exfumador de menos de un año); enfermedad coronaria (historia de angina de pecho, infarto agudo de miocardio o revascularización miocárdica quirúrgica o percutánea); insuficiencia renal (valores de creatinina >1,5mg/dl) y enfermedad cerebrovascular (antecedente de ictus, ataque isquémico transitorio o revascularización carotídea previa).
En cada paciente se obtuvieron especímenes de 2localizaciones: muestras de músculo isquémico (extraído del músculo extensor corto de los dedos a nivel del pie) o grupoI, y muestras de músculo sano del borde de amputación (músculo cuádriceps) o grupoS.
El material obtenido se conservó en medio estándar RPMI (Roswell Park Memorial Institute) blanco en condiciones estériles y se cultivó de forma inmediata.
CultivoLas piezas quirúrgicas se cortaron en piezas de 10mm de diámetro y se cultivaron en placas de cultivo con medio SG-2 (Humedia-SG2, Kurabou Enterprises, Osaka, Japón) en una atmósfera de 95%O2 5%CO2 a 37°C durante 48h y bajo condiciones estériles. De cada grupo de muestras (I y S) se realizaron 2cultivos, uno basal, sin fármaco, y otro con alprostadil, a una concentración de 5ng/ml. La concentración se basó en estudios similares realizados en células endoteliales4,5. El medio se cambió cada 12h. Por tanto, de cada paciente se obtuvieron 4cultivos (grupoI basal, grupoI con alprostadil, grupoS basal, grupoS con alprostadil).
Las muestras de músculo fueron homogeneizadas con un Ultra-Turrax T8 IKA-Werke en un tampón conteniendo 8mol/l de urea, CHAPS 2% p/v, 40mmol/l de ditiotreitol, anfolito Bio-LyteTH 0,2% (Bio-Rad) y 0,01% p/v de azul bromofenol. Los tejidos homogeneizados fueron centrifugados a 10.000g durante 10min y el sobrenadante se conservó a –80°C para su posterior análisis.
Análisis proteómicoEl mapa de expresión proteica del músculo se realizó mediante una doble electroforesis, según la técnica descrita en publicaciones previas6, la primera en un gradiente de pH inmovilizado (IPG-strips, BioRad) y la segunda sobre geles de SDS-PAGE (sodium dodecyl sulfate-polyacrylamide gel electrophoresis) al 10%.
La cuantificación de proteína se realizó utilizando la reacción del ácido bicinconínico (Pierce).
Para la primera dimensión de la doble electroforesis se cargaron muestras de 250μg de proteína total en tiras de geles de gradiente de pH inmovilizado (IPG) con un pH de 3 a 10. El foco isoeléctrico se realizó con el sistema Protean IEF cell system (Bio-Rad Labs) a 50V durante 60h seguido de rápidas subidas lineales de tensión y voltaje limitados por una corriente máxima de 50μA por gel.
Tras la electroforesis por isoelectroenfoque se realizó la segunda dimensión con las proteínas de las tiras, que fueron disueltas en geles de electroforesis de SDS-PAGE al 10% mediante el sistema ProteanIIXL (Bio-Rad Labs).
A continuación, los geles fueron fijados y teñidos con plata con el kit Silver Stain Plus (Bio-Rad Labs), siguiendo las instrucciones del fabricante, y después escaneados (escáner UMAX POWERLOOKIII), mediante el software Magic Scan V4.5. El análisis de imagen se llevó a cabo con el programa Quantity One 4.2.3 (Bio-Rad Labs).
Para la espectrometría de masas (EM), las manchas de interés (las proteínas a estudio) se recortaron de los geles teñidos con plata y fueron digeridas con tripsina modificada (Promega, Madison, WI, EE.UU.). Las muestras se analizaron utilizando un Analizador Proteómico 4700 (Applied Biosystem), funcionando en modo reflector positivo. Los datos generados del espectro permitieron identificar las proteínas mediante la huella peptídica, usando el programa MASCOT y comparando con la base de datos Mascot 1.9 (http://www.matrixscience.com). Las identificaciones obtenidas por la EM se aceptaron basándose en una evaluación triple que tiene en cuenta datos de peso molecular, anotación del espectro y migración esperada versus observada en los geles de doble electroforesis.
El análisis proteómico que realizamos se centró en las principales proteínas implicadas en las distintas vías metabólicas de la célula muscular: triosa-fosfato-isomerasa (TPI), malato deshidrogenasa (MDH), lactato deshidrogenasa (LDH) y piruvato carboxilasa (PC).
Determinación de lactato y piruvatoPara la determinación del piruvato y del lactato, productos de las vías metabólicas analizadas, se emplearon, respectivamente, los kits de ensayo K609-100 y K607-100 (BioVision Research Products, CA, EE.UU.), según las instrucciones del fabricante.
EstadísticaEl análisis estadístico se realizó mediante tests no paramétricos (U de Mann-Whitney, Wilcoxon). Se exigió un valor de p<0,05 para considerar diferencias estadísticamente significativas. El análisis de los datos obtenidos se realizó mediante el programa SPSS para Windows.
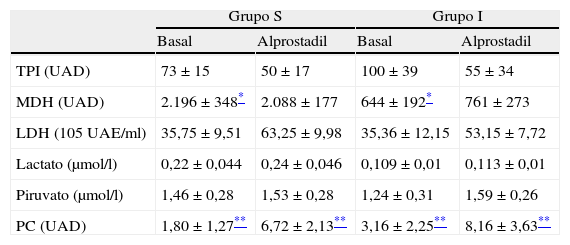
ResultadosEn la tabla 1 se resumen las características clínicas de los pacientes. Los resultados del análisis proteómico de las enzimas estudiadas y la determinación de lactato y piruvato se representan en la tabla 2 y en las figuras 1 y 2.
Proteínas implicadas en las distintas rutas metabólicas y sus productos
| Grupo S | Grupo I | |||
| Basal | Alprostadil | Basal | Alprostadil | |
| TPI (UAD) | 73±15 | 50±17 | 100±39 | 55±34 |
| MDH (UAD) | 2.196±348* | 2.088±177 | 644±192* | 761±273 |
| LDH (105 UAE/ml) | 35,75±9,51 | 63,25±9,98 | 35,36±12,15 | 53,15±7,72 |
| Lactato (μmol/l) | 0,22±0,044 | 0,24±0,046 | 0,109±0,01 | 0,113±0,01 |
| Piruvato (μmol/l) | 1,46±0,28 | 1,53±0,28 | 1,24±0,31 | 1,59±0,26 |
| PC (UAD) | 1,80±1,27** | 6,72±2,13** | 3,16±2,25** | 8,16±3,63** |
LDH: lactato deshidrogenasa; MDH: malato deshidrogenasa; PC: piruvato carboxilasa; TPI: triosa-fosfato-isomerasa; UAD: unidades arbitrarias densitométricas; UAE: unidades de actividad enzimática
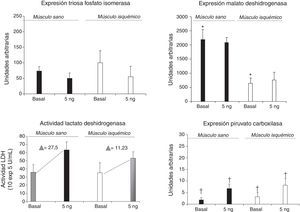
En cuanto a los cultivos basales, se observó una disminución significativa de la MDH en el músculo isquémico respecto al músculo sano. En los cultivos con alprostadil no se observaron diferencias en la MDH entre ambos grupos, pero sí el aumento de la PC en el músculo isquémico respecto al sano.
La TPI, una de las enzimas claves en la regulación de la vía glucolítica, no mostró diferencias en el músculo isquémico frente al sano en las muestras basales, ni tampoco al incubarlo con alprostadil. No se obtuvieron tampoco diferencias significativas en la LDH (glucólisis anaerobia) en las muestras basales entre ambos grupos, aumentando de forma no significativa al incubar con alprostadil tanto en el grupoI como en el S.
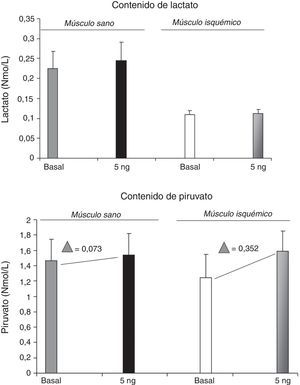
No se observaron diferencias significativas en los niveles de lactato ni piruvato en las muestras basales ni en las incubadas con fármaco en ninguno de los 2grupos.
DiscusiónLas proteínas están implicadas en todas las funciones celulares, controlan cualquier mecanismo que ocurre en el interior celular y son modificadas en diferentes enfermedades. El proteoma de una célula es el conjunto de proteínas que se expresan en una célula. Por lo tanto, el proteoma dicta el fenotipo de la célula y su funcionalidad, así como la funcionalidad del tejido en el cual la célula está contenida. El fenotipo puede variar en condiciones normales, únicamente por el estado de crecimiento de la célula o la edad, además de evidentemente variar por la intervención en respuesta a los estímulos que aparecen durante enfermedades crónicas o agudas. Las proteínas pueden experimentar modificaciones postransduccionales debido a situaciones patológicas o incluso a tratamientos farmacológicos. El proteoma, por lo tanto, es un elemento dinámico de la célula, a diferencia del genoma, que es un elemento estático. La proteómica es el estudio del proteoma, o lo que es lo mismo, de las proteínas de una célula que se expresan en un momento dado, pero no solo las que aparecen en la célula mediante la expresión de un gen, sino también todas las modificaciones proteicas debidas a transcriptos alternativos o modificados en el proceso postranslacional, así como la combinación de estos dos.
En resumen, y en términos sencillos, la proteómica nos va a permitir comparar la expresión proteica general de las células, sometidas a diferentes maniobras experimentales. Hasta el momento actual la proteómica en investigación cardiovascular se ha realizado mayoritariamente en miocardiopatías7,8.
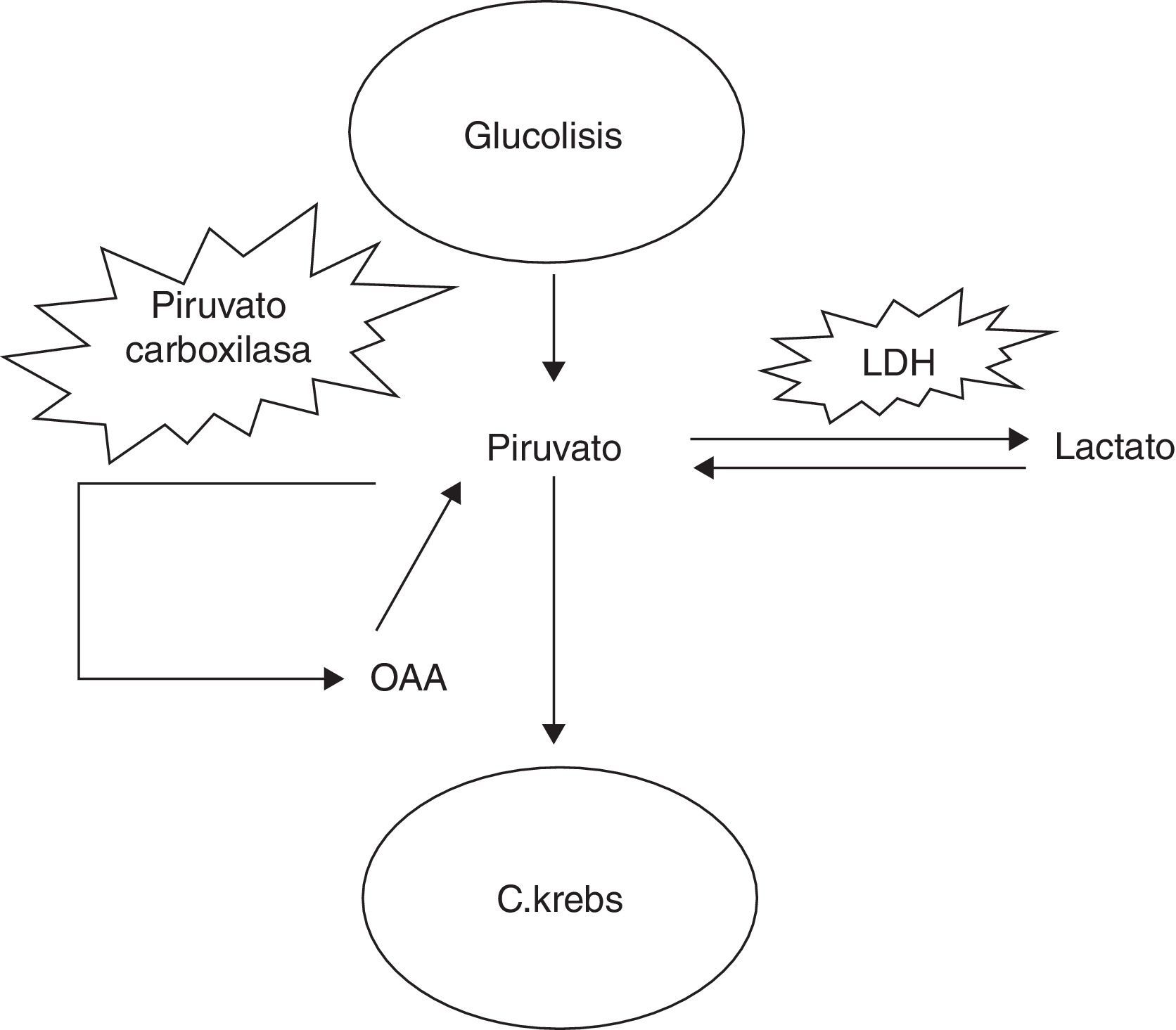
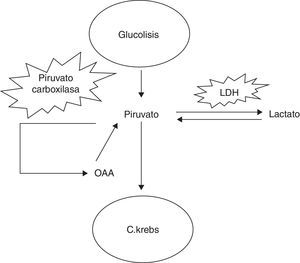
La glucólisis es una de las vías metabólicas principales de obtención de la energía. Los 10pasos enzimáticos de conversión de la glucosa en piruvato se continúan en condiciones aeróbicas con la reacción del ciclo del ácido cítrico o ciclo de Krebs y la fosforilación oxidativa.
Sin embargo, bajo condiciones anaeróbicas el piruvato es convertido en lactato en los tejidos musculares (fig. 3).
En los últimos años se han realizado múltiples estudios de proteómica en el músculo esquelético9. Los niveles de expresión y las modificaciones postransduccionales de las enzimas glucolíticas están claramente alterados durante el desarrollo, o distintos procesos adaptativos fisiológicos como la actividad neuromuscular aumentada o la atrofia por desuso. La vía glucolítica también se modifica en muchas enfermedades neuromusculares, incluyendo la debilidad en la contracción muscular relacionada con la diabetes, la distrofia muscular o la sarcopenia de la vejez.
La isquemia crónica de miembros inferiores supone una situación patológica a nivel del músculo, con una disminución del aporte sanguíneo, y con ello de oxígeno y otras sustancias, ante el que se establecen respuestas a nivel molecular. En este estudio hemos analizado la proteómica de las células musculares en pacientes con isquemia de la extremidad, a nivel de las principales enzimas metabólicas y sus productos, y su relación con el músculo sano. Asimismo, se estudia por primera vez el efecto del alprostadil sobre ambos.
Hemos encontrado en el músculo isquémico una disminución de la malato deshidrogenasa, no encontrándose diferencias en la glucólisis (TPI) ni en la vía anaeróbica (LDH, lactato). El alprostadil produjo un aumento de la piruvato carboxilasa (ciclo de Krebs) tanto en el músculo sano como en el isquémico.
La reducción de malato deshidrogenasa en el músculo isquémico sugiere una reducción del ciclo de Krebs, en relación con un menor aporte de oxígeno en el músculo isquémico. En estudios de realizados en músculo esquelético de pacientes ancianos se ha observado una disminución de la extracción de oxígeno y, mediante proteómica, una disminución de las enzimas mitocondriales o enzimas del ciclo de Krebs10-13.
Según los resultados obtenidos, el alprostadil no modifica esta vía directamente pero estimula la expresión de piruvato carboxilasa, induciendo así la formación de oxalacetato, que se introduce en el ciclo de Krebs. Esto permite funcionar parcialmente el ciclo de Krebs en el musculo isquémico (fig. 3), mejorando así la obtención de energía.
Una de las limitaciones del estudio es que se ha realizado con cultivos de tejidos. Hay que contar con la limitación intrínseca que supone un estudio in vitro, que no refleja las distintas interacciones que tendrán lugar en el conjunto del organismo. Asimismo, la identificación de las proteínas mediante la doble electroforesis no es exacta, y puede subestimar la presencia de elementos poco abundantes, las proteínas integradas en la membrana o componentes con peso molecular muy elevado14-17. Además, las proteínas con valores de punto isoeléctrico (pI) extremos no suelen ser bien detectadas en sistemas con un amplio rango de pI. Otra cuestión importante es la distorsión de los puntos de proteínas debido a la presencia de distintas especies o isoformas con extensas modificaciones postranslacionales. El análisis mediante EM en ese sentido resuelve la mayoría de estos problemas.
Se ha considerado en este estudio como sano el músculo cuádriceps del borde de amputación, en pacientes que presentaban pulso femoral y buenos PVR en muslo, aunque en sentido estricto los pacientes con isquemia irreversible de la extremidad que precisan una amputación mayor no son pacientes «sanos». No se han usado en este caso muestras control, como por ejemplo de pacientes amputados por causa traumática, en los que no existieran antecedentes de enfermedad cardiovascular conocida. Asimismo hay que tener en cuenta que eran pacientes de edad avanzada, en los que de por sí, como ya se ha comentado, se han observado cambios en las enzimas mitocondriales asociados a la vejez. Otras características de los pacientes que podrían haber influido en los resultados son la presencia de diabetes mellitus o el uso de fármacos perioperatorios que pudieran haber modificado el metabolismo del músculo, aunque, como ya se ha comentado, se realizó un periodo de lavado de al menos 10días en pacientes que previamente estuvieran tomando estatinas y antiagregantes.
En conclusión, es la primera vez que se estudia el efecto del alprostadil sobre músculo sano e isquémico en humanos. La reducción de malato deshidrogenasa en el músculo isquémico sugiere una reducción del ciclo de Krebs. El alprostadil no modifica esta vía pero estimula la expresión de piruvato carboxilasa, induciendo la formación de oxalacetato, que se introduce en el ciclo de Krebs. De este modo, el aprostadil permite funcionar parcialmente el ciclo de Krebs del músculo isquémico, mejorando la obtención de energía.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste proyecto recibió una Beca de Investigación de la Fundación SEACV, así como una Beca de Laboratorios Esteve.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado como Comunicación Oral en el 59 Congreso Nacional de la SEACV, Girona, 30 de mayo a 1 de junio de 2013. Obtuvo el Premio Martorell de dicho Congreso.