La tromboembolia de pulmón (TEP) es la tercera causa de muerte cardiovascular, después del infarto agudo de miocardio y del ictus, y supone un importante problema de salud.
ObjetivoSeis sociedades médicas españolas involucradas en la atención de pacientes con TEP han elaborado un documento de consenso, que aporta recomendaciones sobre el diagnóstico, pronóstico y tratamiento de la TEP en función de la calidad de la evidencia disponible, del balance entre el riesgo y el beneficio de las intervenciones, y del coste.
MétodoSe partió de 2 documentos ampliamente conocidos (ACCP 2012 y NICE 2013) que utilizan el sistema GRADE. Adicionalmente, se realizó una revisión sistemática de la bibliografía (entre enero de 2012 y marzo de 2013). A partir de todos estos documentos, 2 autores elaboraron un manuscrito de base para la discusión final (panel constituido por los coordinadores de las sociedades científicas participantes).
ResultadoEl consenso se alcanzó mediante discusión entre los miembros del panel, considerando los beneficios y riesgos de las intervenciones, la práctica clínica habitual, las recomendaciones de otras normativas, la preferencia de los pacientes y los criterios de equidad.
ConclusiónEn total se hacen 42 recomendaciones o sugerencias.
Pulmonary embolism (PE) is a serious health problem and is the third cause of cardiovascular death, after acute myocardial infarction and stroke.
ObjectiveA consensus document has been prepared by six Spanish medical societies involved in the treatment of patients with PE. The document presents recommendations on the diagnosis, prognosis, and treatment of PE, taking into account the quality of the available evidence, the risk-benefit ratio of the treatments, and the costs.
MethodTwo widely known documents (ACCP 2012 and NICE 2013) that use the GRADE system were distributed. A systematic review of the literature was performed between January 2012 and March 2013. Two authors prepared a manuscript using all these documents as a basis for the final discussion by a panel consisting of the coordinators of the participating Scientific Societies.
ResultsA consensus was reached after discussion by the members of the panel, taking into consideration the benefits and risks of the treatments, normal clinical practice, the recommendations in other guidelines, patient preference, and equity criteria.
ConclusionA total of 42 recommendations or suggestions were made.
Sociedades médicas españolas involucradas en la atención de pacientes con tromboembolia de pulmón (TEP) han elaborado un documento de consenso sobre el diagnóstico, pronóstico y tratamiento de la TEP en función de la calidad de la evidencia disponible, del balance entre riesgo/beneficio de las intervenciones, y del coste. Se partió de 2 documentos1,2 que utilizan el sistema GRADE3. Adicionalmente, se realizó una revisión sistemática de la bibliografía (enero de 2012-marzo de 2013). A partir de estos documentos 2 autores elaboraron un manuscrito de base para la discusión final (panel constituido por los coordinadores de las sociedades científicas participantes). El consenso se alcanzó mediante discusión entre los miembros del panel, considerando los beneficios y riesgos de las intervenciones, la práctica clínica habitual, las recomendaciones de otras normativas, la preferencia de los pacientes y los criterios de equidad.
La TEP supone el enclavamiento en las arterias pulmonares de un trombo desprendido (émbolo) del territorio venoso. En la mayoría (90-95%) el émbolo procede de una trombosis venosa profunda (TVP) de las extremidades inferiores, a menudo asintomática.
Los factores de riesgo (tabla 1) para desarrollar TEP están relacionados con los mecanismos etiopatogénicos de la enfermedad: estasis, lesión endotelial e hipercoagulabilidad. Cuando la TEP se asocia a factores de riesgo desencadenantes se denomina provocada o secundaria; en caso contrario, espontánea o idiopática.
Factores de riesgo para la enfermedad tromboembólica venosa
| Riesgo alto |
| Prótesis o fractura de cadera o rodilla |
| Cirugía mayor |
| Politraumatismo |
| Daño espinal |
| Riesgo moderado |
| Inmovilización con férula de escayola de EEII |
| Ictus con parálisis de EEII |
| Puerperio |
| TEP o TVP previa |
| Fármacos o dispositivos hormonales estrogénicos |
| Trombofilia |
| Cáncer |
| Quimioterapia |
| Fármacos antipsicóticos |
| Enfermedad inflamatoria intestinal |
| Artroscopia de rodilla |
| Catéteres o dispositivos venosos centrales |
| Riesgo bajo |
| Edad avanzada |
| Cirugía laparoscópica |
| Reposo cama > 3 días |
| Viajes prolongados de > 6-8 h |
| Obesidad mórbida |
| Varices |
| Embarazo |
EEII: extremidades inferiores; TEP: tromboembolia pulmonar; TVP: trombosis venosa profunda.
Se estima una incidencia de TEP de 1/1.000 hab./año y, según el Ministerio de Sanidad español, en el año 2010, se diagnosticaron 22.250 casos con una mortalidad hospitalaria del 8,9%.
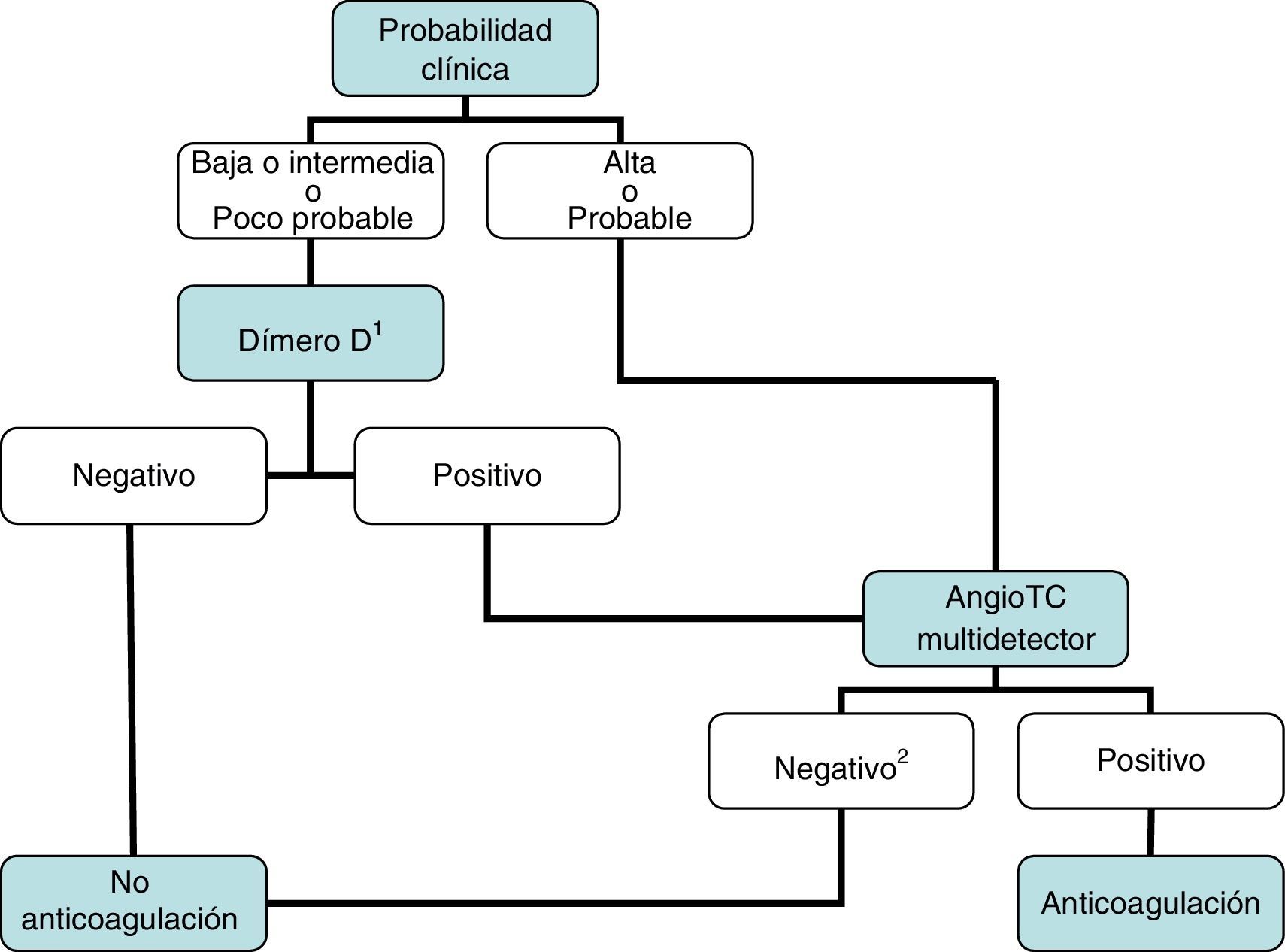
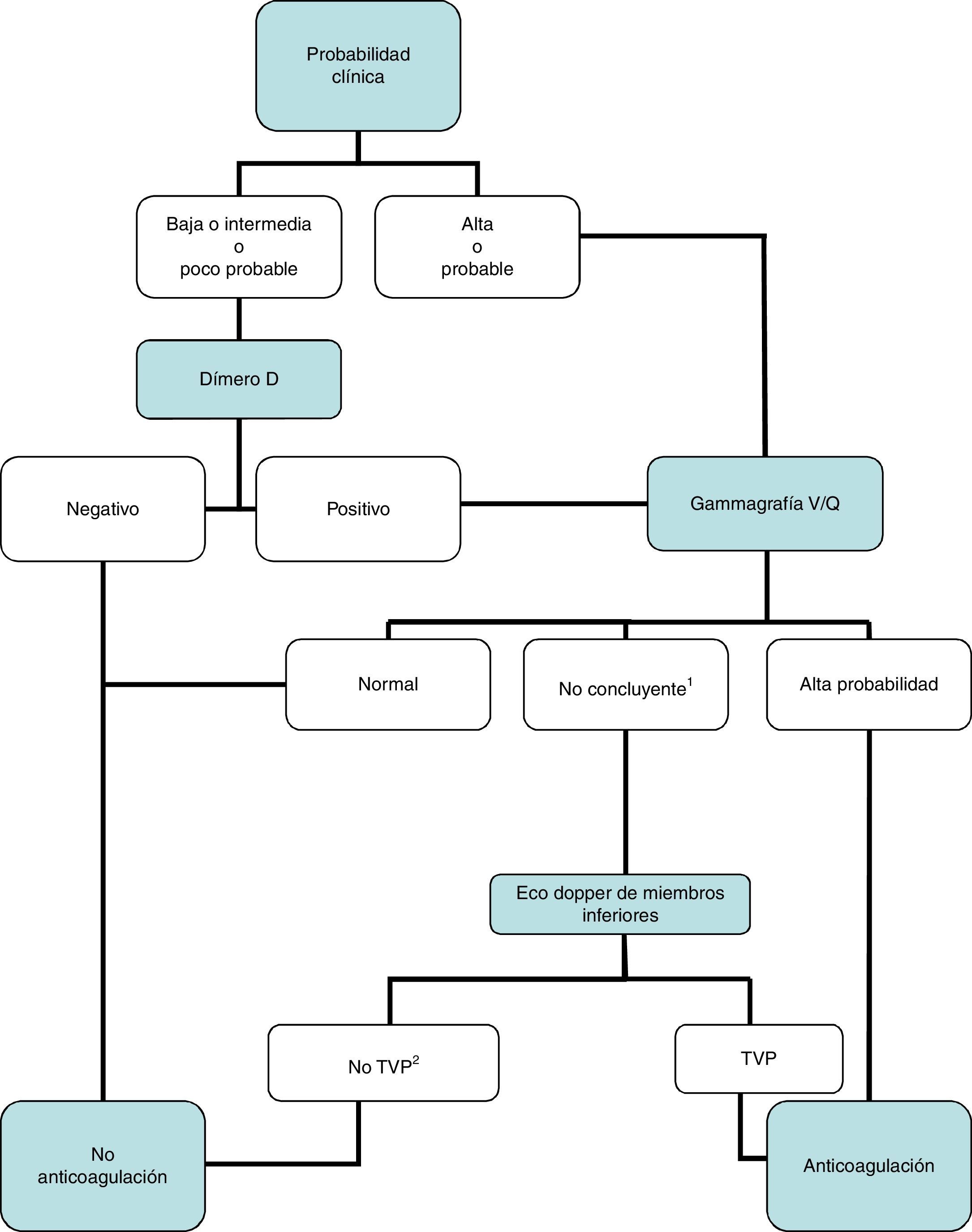
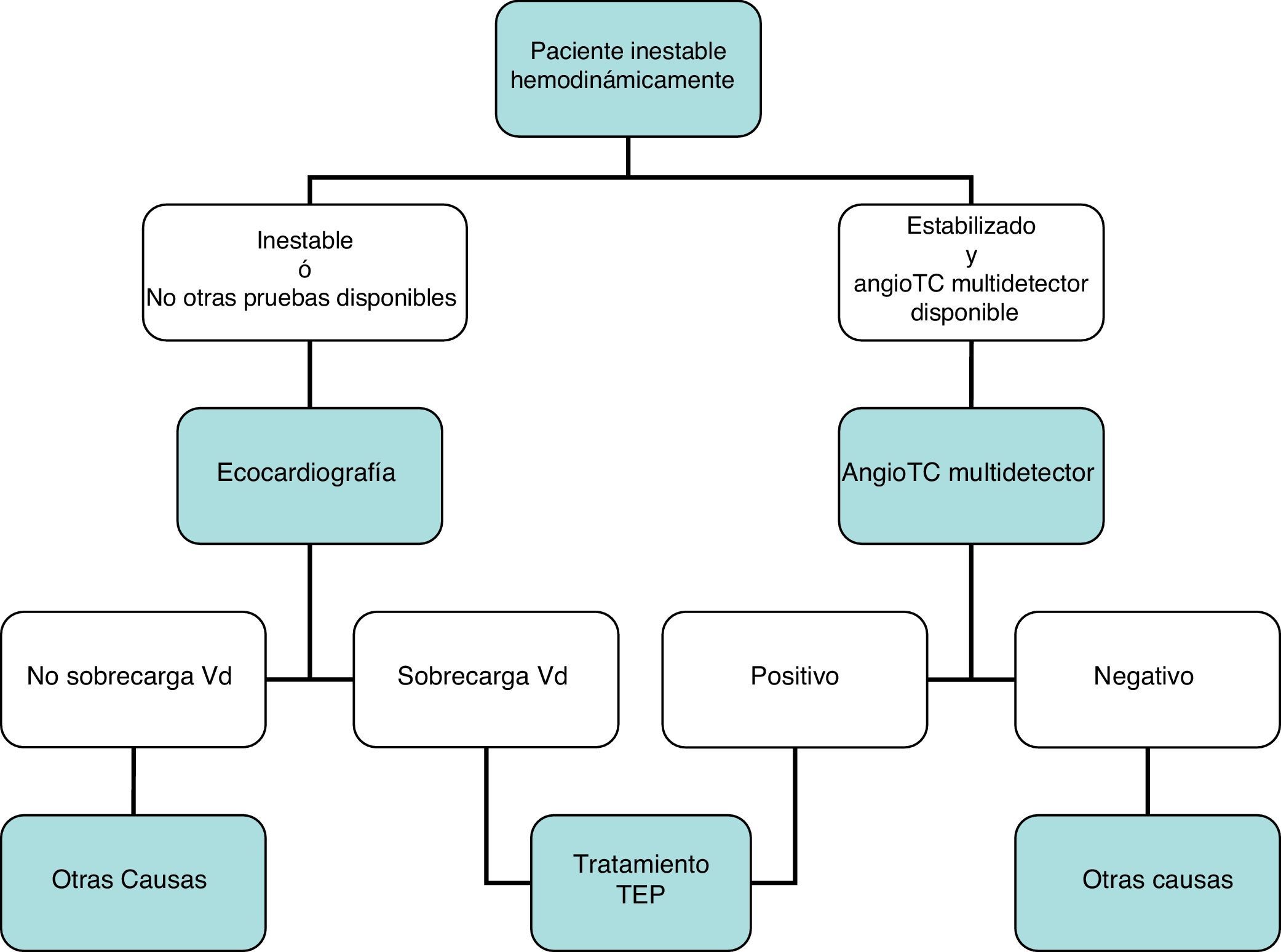
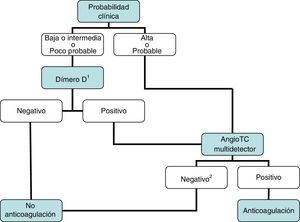
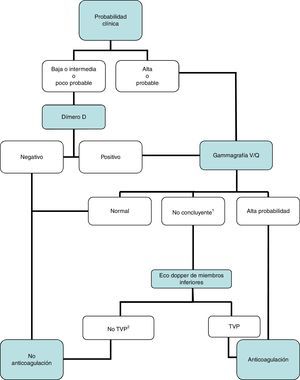
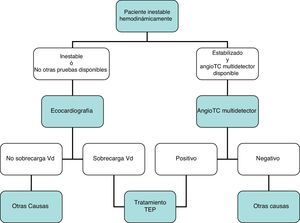
DiagnósticoNinguna prueba aislada es sensible y específica para confirmar o descartar una TEP aguda sintomática. Por ello, se combinan sospecha clínica, dímero D y pruebas de imagen. Los algoritmos diagnósticos mejoran el pronóstico de los pacientes con sospecha de TEP4. Proponemos dos algoritmos para pacientes estables hemodinámicamente con sospecha de TEP (figs. 1 y 2) y otro para inestables (fig. 3). Inicialmente el proceso diagnóstico no justifica demoras terapéuticas.
- •
Se recomienda iniciar precozmente (antes de los resultados de las pruebas diagnósticas) el tratamiento anticoagulante en pacientes con probabilidad clínica intermedia o alta de TEP.
Gammagrafía V/Q: algoritmo diagnóstico para el paciente ambulatorio estable hemodinámicamente.
1Se refiere a gammagrafías V/Q de baja o intermedia probabilidad.
2En caso de alta probabilidad clínica, gammagrafía de perfusión no concluyente, y eco de miembros inferiores negativa, se debe valorar la necesidad de angio-TC multidetector, de acuerdo con el especialista correspondiente.
Angio-TC: angiotomografía computarizada: TVP: trombosis venosa profunda.
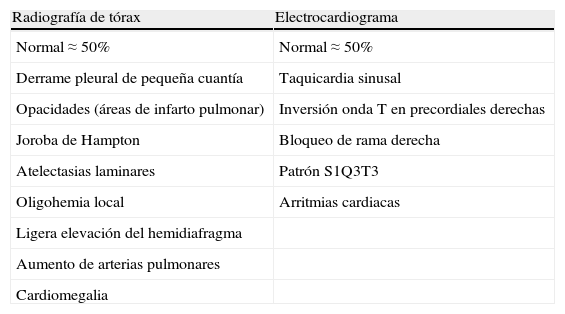
Se debe considerar una TEP aguda sintomática en disnea de nueva aparición, empeoramiento de disnea habitual, dolor torácico, síncope o hipotensión sin una explicación alternativa, particularmente cuando las pruebas básicas (radiografía de tórax, electrocardiograma y gasometría arterial) no descartan diagnósticos diferenciales. La tabla 2 recoge los hallazgos radiológicos y electrocardiográficos habituales en la TEP.
Radiografía de tórax y electrocardiograma en la tromboembolia de pulmón aguda sintomática
| Radiografía de tórax | Electrocardiograma |
| Normal ≈ 50% | Normal ≈ 50% |
| Derrame pleural de pequeña cuantía | Taquicardia sinusal |
| Opacidades (áreas de infarto pulmonar) | Inversión onda T en precordiales derechas |
| Joroba de Hampton | Bloqueo de rama derecha |
| Atelectasias laminares | Patrón S1Q3T3 |
| Oligohemia local | Arritmias cardiacas |
| Ligera elevación del hemidiafragma | |
| Aumento de arterias pulmonares | |
| Cardiomegalia |
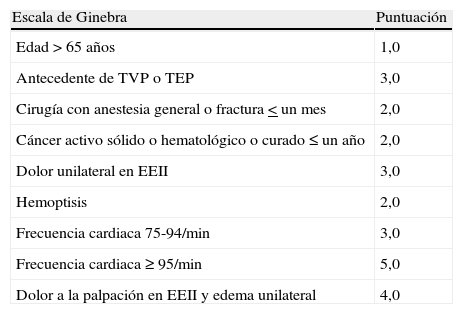
La evaluación mediante reglas de predicción de probabilidad clínica clasifica a los pacientes en 3 categorías de distinta prevalencia de TEP (10% para probabilidad baja, 25% intermedia y > 60% alta) y facilita la interpretación de las demás pruebas diagnósticas. Las escalas de Wells y de Ginebra (tablas 3 y 4) están ampliamente validadas.
- •
Se recomienda utilizar escalas clínicas tipo (Wells o Ginebra) como primer escalón en la aproximación diagnóstica al paciente hemodinámicamente estable con sospecha de TEP.
Escala de Wells de puntuación para la graduación de la probabilidad clínica en la tromboembolia de pulmón aguda sintomática
| Escala de Wells | Puntuación |
| Diagnóstico alternativo menos probable que la TEP | 3,0 |
| Síntomas o signos de TVP | 3,0 |
| Antecedentes de TEP o TVP | 1,5 |
| Inmovilización de al menos 3 días o cirugía en el último mes | 1,5 |
| Frecuencia cardiaca > 100/min | 1,5 |
| Hemoptisis | 1,0 |
| Cáncer en tratamiento activo o paliativo en los últimos 6 meses | 1,0 |
| Para dímero D muy sensible | Para dímero D menos sensible | ||
| Baja probabilidad: | < 2 puntos | TEP poco probable: | < 4 puntos |
| Intermedia probabilidad: | 2-6 puntos | TEP probable: | > 4 puntos |
| Alta probabilidad: | > 6 puntos | ||
Escala de Ginebra de puntuación para la graduación de la probabilidad clínica en la tromboembolia de pulmón aguda sintomática
| Escala de Ginebra | Puntuación |
| Edad > 65 años | 1,0 |
| Antecedente de TVP o TEP | 3,0 |
| Cirugía con anestesia general o fractura < un mes | 2,0 |
| Cáncer activo sólido o hematológico o curado ≤ un año | 2,0 |
| Dolor unilateral en EEII | 3,0 |
| Hemoptisis | 2,0 |
| Frecuencia cardiaca 75-94/min | 3,0 |
| Frecuencia cardiaca ≥ 95/min | 5,0 |
| Dolor a la palpación en EEII y edema unilateral | 4,0 |
Baja probabilidad: 0-3 puntos; Intermedia probabilidad: 4-10 puntos; Alta probabilidad: > 11 puntos
EEII: extremidades inferiores; TEP: tromboembolia de pulmón; TVP: trombosis venosa profunda.
Prueba de alta sensibilidad pero baja especificidad, pues su elevación también se asocia a otras situaciones (edad avanzada, infección, cáncer, embarazo, etc.).
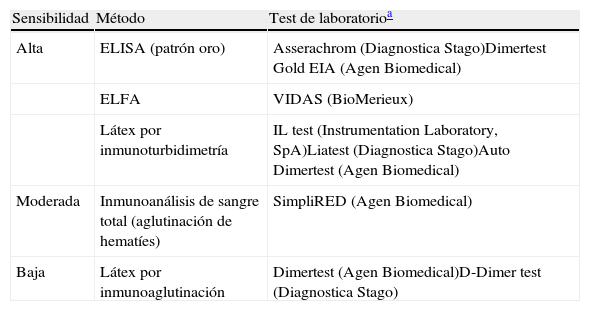
En pacientes normotensos con probabilidad de TEP baja o intermedia, un dímero D de alta sensibilidad negativo excluye el diagnóstico de TEP. En estos pacientes que no son anticoagulados, la incidencia de TEP en los 3 meses es de 0,14%5. Los métodos de determinación de dímero D (tabla 5) de sensibilidad moderada o baja solo excluyen la enfermedad en el grupo de pacientes con probabilidad clínica baja (o con TEP improbable según la escala de Wells dicotómica).
- •
Se recomienda conocer la sensibilidad del método de determinación de dímero D usado en cada medio.
- •
Un dímero D de alta sensibilidad negativo excluye la TEP en pacientes con probabilidad clínica baja o intermedia.
- •
Un dímero D de sensibilidad moderada o baja negativo excluye la TEP en pacientes con probabilidad clínica baja (o TEP improbable).
- •
Se recomienda no realizar una determinación de dímero D en pacientes con probabilidad clínica alta para TEP.
Técnicas de determinación de dímero D para la tromboembolia de pulmón aguda sintomática
| Sensibilidad | Método | Test de laboratorioa |
| Alta | ELISA (patrón oro) | Asserachrom (Diagnostica Stago)Dimertest Gold EIA (Agen Biomedical) |
| ELFA | VIDAS (BioMerieux) | |
| Látex por inmunoturbidimetría | IL test (Instrumentation Laboratory, SpA)Liatest (Diagnostica Stago)Auto Dimertest (Agen Biomedical) | |
| Moderada | Inmunoanálisis de sangre total (aglutinación de hematíes) | SimpliRED (Agen Biomedical) |
| Baja | Látex por inmunoaglutinación | Dimertest (Agen Biomedical)D-Dimer test (Diagnostica Stago) |
ELFA: Enzyme-Linked Fluorescence Assay; ELISA: Enzime-Linked InmunoSorbent Assay.
De elección para el diagnóstico de TEP. En un metaanálisis6, el riesgo tromboembólico de los pacientes que no fueron anticoagulados a partir de una angio-TC negativa fue de 1,2%, con un riesgo de TEP fatal de 0,6%. PIOPED II7 evaluó la utilidad diagnóstica de la angio-TC de 4, 8 o 16 detectores en pacientes con sospecha de TEP (sensibilidad del 83% y especificidad del 96%). Al indicar una angio-TC es importante conocer sus incovenientes en la población general, mujeres (embarazadas) y pacientes con insuficiencia renal8,9.
- •
Una angio-TC multidetector (técnicamente adecuada) negativa descarta la TEP, excepto en los pacientes con probabilidad clínica alta para la enfermedad.
- •
Se recomienda la realización de pruebas diagnósticas adicionales en pacientes con sospecha de TEP y angio-TC multidetector no concluyente.
- •
Se sugiere la realización de pruebas diagnósticas adicionales en pacientes con sospecha alta de TEP y una angio-TC multidetector negativa.
- •
Se recomienda no realizar de forma rutinaria flebografía por TC para incrementar el rendimiento diagnóstico de la angio-TC multidetector.
Reservada para pacientes con alergia a contrastes yodados, insuficiencia renal o mujeres embarazadas con sospecha de TEP donde el ecodoppler (ED) venoso ha sido negativo, y siempre que la radiografía de tórax sea normal.
En el estudio PIOPED I10 la gammagrafía fue diagnóstica (normal o de alta probabilidad) en tan solo el 30-50% de los pacientes. En el resto, la gammagrafía ventilación perfusión (V/Q) fue no concluyente (baja, intermedia o indeterminada probabilidad).
- •
Una gammagrafía V/Q normal descarta la TEP clínicamente significativa.
- •
Una gammagrafía V/Q de alta probabilidad confirma la TEP en pacientes con probabilidad clínica intermedia o alta de la enfermedad.
- •
Se recomienda la realización de pruebas diagnósticas adicionales en pacientes con sospecha de TEP y gammagrafía V/Q no concluyente.
De elección para detectar TVP concomitante a TEP. Especialmente sensible y específica en TVP sintomáticas de territorios proximales. Su rendimiento disminuye en casos asintomáticos y de localización distal. Aproximadamente el 50% de los pacientes con TEP aguda sintomática presentan TVP concomitante en el momento del diagnóstico, de las cuales solo la mitad son sintomáticas. Su uso se reserva para pacientes con discordancia entre la probabilidad clínica y el resultado de las pruebas de imagen torácicas, para pacientes con pruebas torácicas no concluyentes y para embarazadas como primera exploración.
- •
Se recomienda la realización de una ED como primera exploración en pacientes embarazadas con sospecha de TEP.
A priori no se diferencia de la angio-TC en la obtención de imágenes del árbol arterial pulmonar. Tiene la ventaja de utilizar como contraste el gadolinio, que no contiene yodo, y de no radiar al paciente. En PIOPED III11 su sensibilidad fue del 78% y su especificidad del 99%. Al ampliar el estudio con fleborresonancia, la sensibilidad aumentó al 92% (especificidad del 96%). La exploración fue técnicamente inadecuada en el 25% de los pacientes, lo que constituye su mayor limitación. Podría reservarse para pacientes con alergia al contraste yodado. En caso de insuficiencia renal grave está contraindicada por la toxicidad del gadolinio. Se debe evitar en el embarazo y en la lactancia, aunque no hay evidencias claras de efectos teratogénicos.
- •
Se recomienda no realizar de forma rutinaria una angiorresonancia pulmonar para el diagnóstico de los pacientes con sospecha de TEP.
Carece de utilidad en el algoritmo diagnóstico de los pacientes con sospecha de TEP. Aunque la angio-TC multidetector también es la prueba diagnóstica de elección en los pacientes inestables hemodinámicamente con sospecha de TEP, la ecocardiografía (a pie de cama) aporta información muy valiosa en los centros en los que la angio-TC multidetector no esté disponible, o en casos donde la inestabilidad del paciente impida su traslado a la sala de radiología. En pacientes críticos, la ausencia de signos ecocardiográficos de disfunción o sobrecarga de cavidades derechas descarta la TEP como causa de compromiso hemodinámico.
- •
Se recomienda no realizar de forma rutinaria una ecocardiografía transtorácica para el diagnóstico de los pacientes estables con sospecha de TEP.
La TEP presenta un amplio espectro de manifestaciones, con diferente pronóstico y tratamiento. El factor pronóstico más importante es la situación hemodinámica en el momento del diagnóstico12. La TEP de alto riesgo (antiguamente TEP masiva), se caracteriza por hipotensión arterial o shock, supone el 5% de los casos y se asocia a una mortalidad precoz de un 15%. Se recomienda tratamiento trombolítico para estos pacientes.
La mayoría de TEP se presentan con pocos síntomas. La mortalidad precoz de los pacientes con TEP hemodinámicamente estables es del 2-10%. La estratificación de riesgo de estos últimos pacientes debería identificar 2 subgrupos: a) bajo riesgo de mortalidad, en el que se podrían beneficiar del alta precoz o incluso de tratamiento ambulatorio; y b) mayor riesgo asociado a TEP (riesgo intermedio; antigua TEP submasiva), en el que se podrían beneficiar de tratamientos agresivos (monitorización intensiva, fibrinólisis)13.
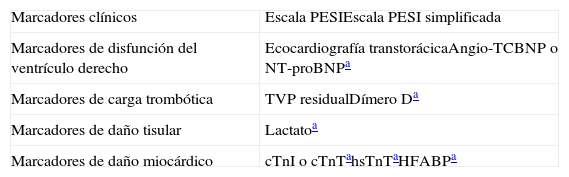
Factores pronósticosLos factores pronósticos usados en pacientes normotensos con TEP se resumen en la tabla 6. Evalúan la situación clínica y el estado de salud general del paciente, la disfunción del ventrículo derecho, la carga trombótica y el daño miocárdico.
Herramientas pronósticas para pacientes estables hemodinámicamente con tromboembolia de pulmón aguda sintomática
| Marcadores clínicos | Escala PESIEscala PESI simplificada |
| Marcadores de disfunción del ventrículo derecho | Ecocardiografía transtorácicaAngio-TCBNP o NT-proBNPa |
| Marcadores de carga trombótica | TVP residualDímero Da |
| Marcadores de daño tisular | Lactatoa |
| Marcadores de daño miocárdico | cTnI o cTnTahsTnTaHFABPa |
Angio-TC: angiotomografía computarizada; BNP: péptido natriurético cerebral; cTnI: troponina cardiaca I; cTnT: troponina cardiaca T; HFABP: proteína ligadora de ácidos grasos cardiacos; hsTnT: troponina T de alta sensibilidad; PESI: Pulmonary Embolism Severity Index; TVP: trombosis venosa profunda;
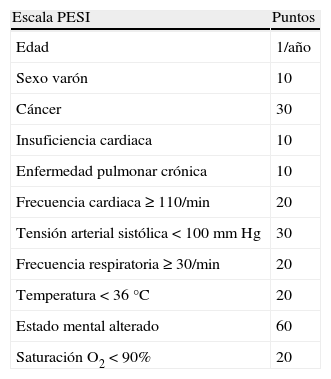
Las herramientas más útiles para seleccionar pacientes de bajo riesgo con TEP aguda sintomática son las escalas clínicas pronósticas. La combinación de variables que tiene en cuenta la edad, la comorbilidad y la repercusión cardiovascular de la TEP identifica de manera fiable un subgrupo de pacientes (aproximadamente el 30%) con un riesgo de mortalidad precoz inferior al 2%. Las escalas Pulmonary Embolism Severity Index (PESI) y PESI simplificada (PESIs) (tablas 7 y 8) han sido validadas para identificar pacientes de bajo riesgo14,15. PESIs es más sencilla y conserva la capacidad pronóstica del original.
Escala Pulmonary Embolism Severity Index (PESI) pronóstica en pacientes con tromboembolia pulmonar aguda sintomática escala
| Escala PESI | Puntos |
| Edad | 1/año |
| Sexo varón | 10 |
| Cáncer | 30 |
| Insuficiencia cardiaca | 10 |
| Enfermedad pulmonar crónica | 10 |
| Frecuencia cardiaca ≥ 110/min | 20 |
| Tensión arterial sistólica < 100mm Hg | 30 |
| Frecuencia respiratoria ≥ 30/min | 20 |
| Temperatura < 36°C | 20 |
| Estado mental alterado | 60 |
| Saturación O2 < 90% | 20 |
Estratificación de riesgo: Clase I (riesgo muy bajo): < 65 puntos; Clase II (riesgo bajo): 66-85 puntos; Clase III (riesgo intermedio): 86-105 puntos; Clase IV (riesgo alto): 106-125 puntos; Clase V (riesgo muy alto): > 125 .puntos.
Escala Pulmonary Embolism Severity Index simplificada (PESIs) pronóstica en pacientes con tromboembolia pulmonar aguda sintomática
| Escala PESI simplificada | Puntos |
| Edad > 80 años | 1 |
| Cáncer | 1 |
| Enfermedad cardiopulmonar crónica | 1 |
| Frecuencia cardiaca ≥ 110/min | 1 |
| Tensión arterial sistólica < 100mm Hg | 1 |
| Saturación O2 < 90% | 1 |
Estratificación de riesgo: Riesgo bajo: 0 puntos; Riesgo alto: ≥ 1 punto.
No está aclarado el valor de la combinación de las escalas clínicas y de los marcadores bioquímicos (particularmente el péptido natriurético cerebral [BNP] o la troponina de alta sensibilidad [hsTnT]) o pruebas de imagen (ecocardiograma transtorácico o ED) para la identificación de este grupo de pacientes de bajo riesgo.
- •
Se recomienda utilizar escalas clínicas pronósticas bien validadas (PESI o PESIs) como primer escalón para la identificación de pacientes con TEP de bajo riesgo.
El método más utilizado para evaluar la función del ventrículo derecho es la ecocardiografía transtorácica. Su uso para la identificación de los pacientes con TEP de riesgo intermedio está limitado por la dependencia del operador, el coste y la disponibilidad en muchos centros. Además, no existe un patrón ecocardiográfico suficientemente fiable como para justificar, de forma aislada, la utilización de tratamiento fibrinolítico16.
Las imágenes que genera la angio-TC permiten no solo confirmar o descartar el diagnóstico de TEP, sino también valorar la extensión de la obstrucción arterial y la presencia o no de dilatación ventricular derecha17,18. No se recomienda su uso aislado para identificar a pacientes con TEP de riesgo intermedio que se podrían beneficiar de tratamiento fibrinolítico.
Varios metaanálisis han demostrado el valor pronóstico de la isquemia miocárdica (elevación de troponina I o T) en pacientes hemodinámicamente estables con TEP, aunque la asociación no es suficientemente sólida como para justificar la escalada terapéutica19,20. El estrés del miocito cardiaco libera péptidos natriuréticos a la circulación (BNP y NT-pro-BNP)21,22. Parece que identifican pacientes con TEP de riesgo intermedio. Sin embargo, la sensibilidad para muerte por TEP de estos biomarcadores es insuficiente para establecer la indicación de tratamiento trombolítico.
Se ha demostrado asociación entre la persistencia de trombos en el sistema venoso profundo de EEII y la mortalidad a corto y medio plazo de los pacientes con TEP23. La presencia de TVP concomitante podría servir para identificar, junto con otras pruebas de imagen y biomarcadores cardiacos, un perfil de paciente con riesgo especialmente elevado de complicaciones asociadas a la propia TEP.
- •
Se sugiere la combinación de pruebas pronósticas (que identifiquen disfunción del ventrículo derecho, isquemia miocárdica, estrés del miocito cardiaco o carga trombótica) para identificar a los pacientes con TEP de riesgo intermedio.
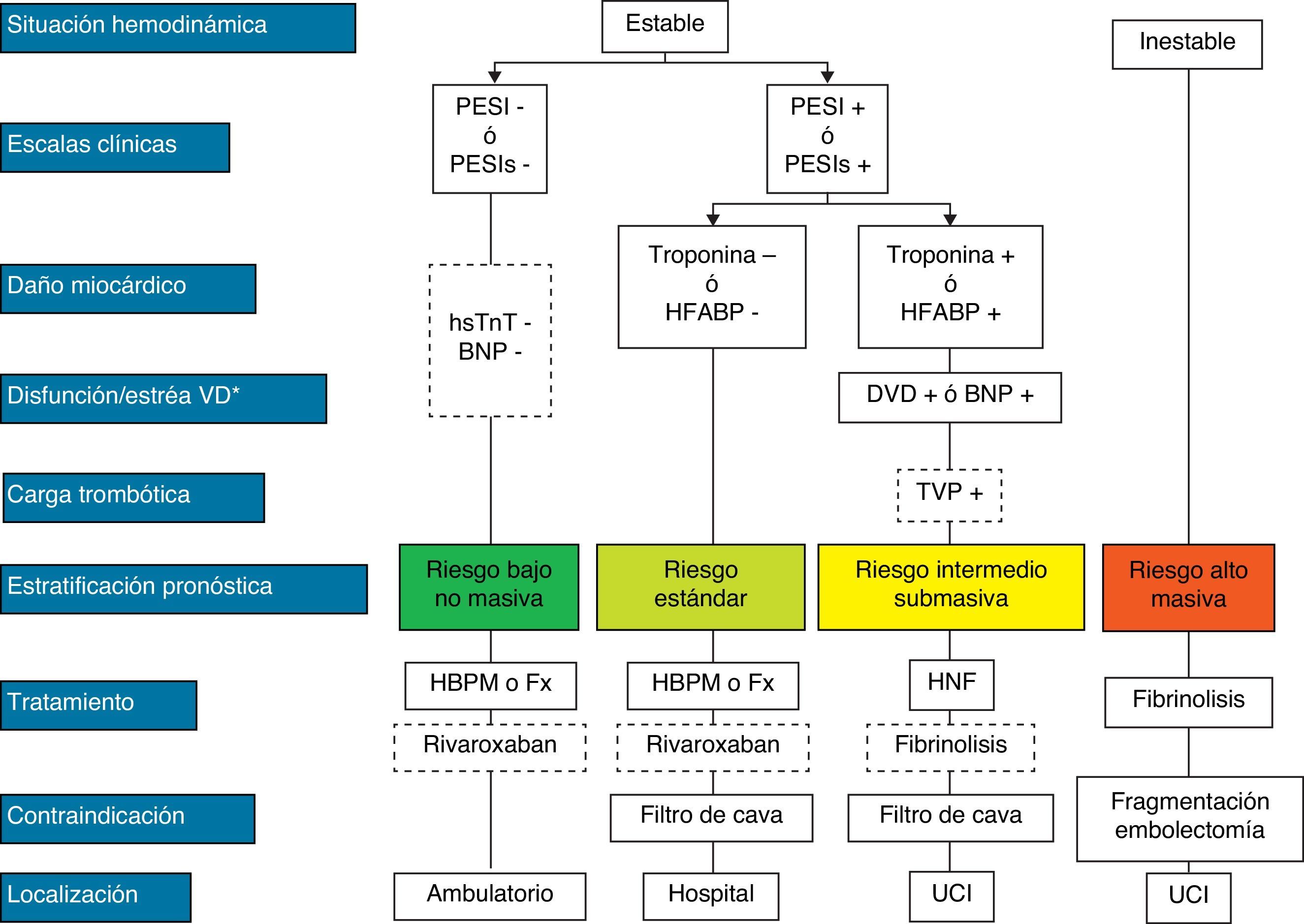
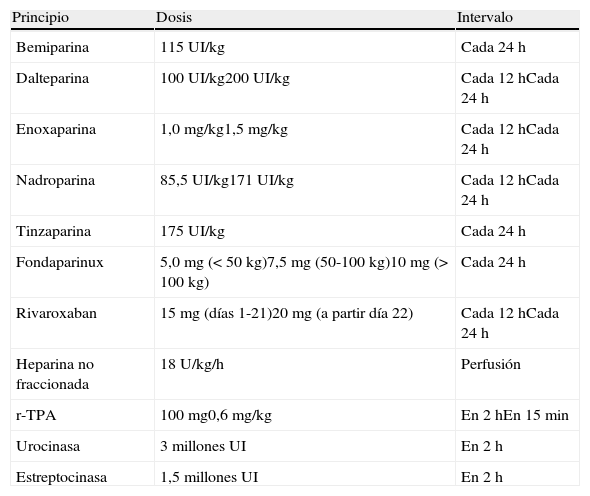
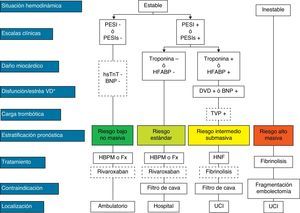
El tratamiento inicial de la TEP tiene como objetivos la estabilización del paciente, aliviar los síntomas, resolver la obstrucción vascular y prevenir recurrencias. En la mayoría, estos objetivos se alcanzan con la anticoagulación. Una minoría, con inestabilidad hemodinámica (TEP de alto riesgo) o contraindicación para la anticoagulación, requiere otros tratamientos farmacológicos (trombolíticos) o mecánicos (filtros de vena cava) (fig. 4). La tabla 9 recoge las pautas de administración de los fármacos aprobados para el tratamiento de la fase aguda de la TEP.
Estratificación pronóstica y tratamiento de la tromboembolia de pulmón en fase aguda.
aShock cardiogénico o tensión arterial sistólica < 90mm Hg mantenida, no debida a hipovolemia, sepsis o arritmias cardiacas.
La línea discontinua indica ausencia de evidencia definitiva (fibrinólisis) o de experiencia clínica amplia (rivaroxaban).
Para aquellas situaciones no contempladas en el algoritmo, se recomienda hospitalización y tratamiento anticoagulante convencional.
BNP: péptido natriurético cerebral; DVD: disfunción ventricular derecha; Fx: fondaparinux; HBPM: heparina de bajo peso molecular; HFABP: proteína ligadora de ácidos grasos cardiacos; HNF: heparina no fraccionada; hsTnT: troponina T de alta sensibilidad; PESI: Pulmonary Embolism Severity Index; PESI, PESI simplificado;
TEP: tromboembolia de pulmón; TVP: trombosis venosa profunda; UCI, unidad de cuidados intensivos.
Pautas de tratamiento de la fase aguda de la tromboembolia de pulmóna
| Principio | Dosis | Intervalo |
| Bemiparina | 115 UI/kg | Cada 24 h |
| Dalteparina | 100 UI/kg200 UI/kg | Cada 12 hCada 24 h |
| Enoxaparina | 1,0 mg/kg1,5 mg/kg | Cada 12 hCada 24 h |
| Nadroparina | 85,5 UI/kg171 UI/kg | Cada 12 hCada 24 h |
| Tinzaparina | 175 UI/kg | Cada 24 h |
| Fondaparinux | 5,0mg (< 50 kg)7,5mg (50-100 kg)10mg (> 100 kg) | Cada 24 h |
| Rivaroxaban | 15mg (días 1-21)20mg (a partir día 22) | Cada 12 hCada 24 h |
| Heparina no fraccionada | 18 U/kg/h | Perfusión |
| r-TPA | 100 mg0,6 mg/kg | En 2 hEn 15 min |
| Urocinasa | 3 millones UI | En 2 h |
| Estreptocinasa | 1,5 millones UI | En 2 h |
r-TPA: activador tisular del plasminógeno recombinante; UI, unidades internacionales.
La heparina no fraccionada (HNF) ha sido el fármaco de elección para el tratamiento de la TEP. Habitualmente se utiliza por vía intravenosa en infusión continua. Requiere monitorización mediante el tiempo parcial de tromboplastina activada. Se suele administrar un bolo de 80 U/kg para conseguir un efecto anticoagulante más rápido. En pacientes que son tratados con dosis inferiores y no alcanzan un tiempo parcial de tromboplastina activada terapéutico durante los primeros días de tratamiento aumenta el riesgo de recurrencia. Actualmente la HNF se reserva para pacientes en los que se considera la utilización de tratamiento fibrinolítico (TEP de riesgo intermedio o alto), y pacientes con alto riesgo de sangrado que van a ser anticoagulados. En pacientes con insuficiencia renal grave, las heparinas de bajo peso molecular (HBPM) (a las dosis recomendadas en ficha técnica) podrían ser más eficaces y seguras que la HNF24.
La mayoría de estudios sugieren que las HBPM y la HNF son equivalentes en términos de eficacia y seguridad para el tratamiento de la fase aguda de la TEP. En un metaanálisis las HBPM se asociaron a menos recurrencias y menos sangrados mayores, sin diferencias en la mortalidad25.
Fondaparinux. El programa Matisse evaluó su eficacia y seguridad para el tratamiento de la fase aguda de la TVP y TEP26. Comparado con la HNF no se observaron diferencias en la tasa de recurrencias, sangrados mayores o mortalidad en los 3 primeros meses. Una ventaja potencial de este fármaco es que no se asocia a trombocitopenia inducida por heparina (TIH).
- •
En pacientes estables hemodinámicamente con TEP aguda se sugiere la utilización de HBPM o fondaparinux frente a la HNF.
- •
En pacientes con TEP aguda e insuficiencia renal grave se sugiere el uso de HBPM a dosis ajustadas a la HNF.
Los anticoagulantes orales pueden administrarse el primer día del inicio de la anticoagulación, sin perder eficacia. Dos ensayos con warfarina demuestran: 1) que se deben evitar dosis de carga (que pueden producir hemorragias) sin implicar un retraso a la hora de alcanzar niveles terapéuticos; 2) que comenzar los antagonistas de la vitamina K (AVK) a dosis más bajas evita caídas excesivas de los niveles de proteína C, lo que induciría teóricamente un estado de hipercoagulabilidad.
- •
En pacientes estables hemodinámicamente con TEP se recomienda mantener la anticoagulación parenteral como mínimo 5 días, y hasta que el INR sea > 2,0 durante 24 h.
Rivaroxaban, en el análisis conjunto de 2 ensayos (TVP y TEP), se asoció a una eficacia similar al tratamiento estándar y una reducción a la mitad en las hemorragias graves27,28. Su administración oral, a dosis fijas, podría simplificar, con un único fármaco, el tratamiento agudo y a largo plazo de la TEP.
Apixaban, en un ensayo (34% TEP)29, demostró similar eficacia y reducción significativa de las hemorragias graves y hemorragias no graves clínicamente relevantes, al compararlo con el tratamiento estándar.
Dabigatran no ha sido evaluado en esta fase del tratamiento de la TEP aguda sintomática.
- •
En pacientes estables hemodinámicamente con TEP se sugiere el tratamiento con rivaroxaban en monoterapia.
Los resultados de un ensayo sugieren que, comparado con la hospitalización, el tratamiento ambulatorio en pacientes de bajo riesgo es igual de eficaz y seguro en términos de recurrencias, sangrados y mortalidad30. Se podría considerar el tratamiento ambulatorio de pacientes con TEP: 1) clínicamente estables con buena reserva cardiopulmonar y una escala clínica validada de bajo riesgo (ej., PESIs), 2) buen soporte social con rápido acceso a atención médica y 3) cumplimentación del tratamiento.
- •
En pacientes con TEP de bajo riesgo y condiciones domiciliarias adecuadas se sugiere el alta precoz en lugar del alta estándar (más de 5 días de ingreso).
Varios metaanálisis han demostrado que la movilización precoz es una práctica segura en pacientes con TVP proximal31. Para pacientes con TEP sintomática las evidencias son menos consistentes. La TVP concomitante empeora el pronóstico de los pacientes con TEP, particularmente cuando se asocia a disfunción del ventrículo derecho e isquemia miocárdica32.
- •
Se sugiere la movilización precoz de los pacientes con TEP de bajo riesgo.
- •
En pacientes con TEP de riesgo intermedio se sugiere reposo durante los primeros días de tratamiento.
Acelerar la lisis del coágulo produce una mejoría hemodinámica más rápida que la HNF, aunque no hay diferencias en la trombosis residual después de 5 a 7 días. El análisis de un subgrupo de pacientes del Urokinase Pulmonary Embolism Trial, que comparó urocinasa seguida de HNF o HNF solamente, demostró que la fibrinólisis disminuye la mortalidad en pacientes con shock secundaria a TEP masiva33. En función de estos hallazgos, y en ausencia de riesgo de sangrado alto, el tratamiento trombolítico está indicado en pacientes con TEP aguda sintomática e inestabilidad hemodinámica34. La inestabilidad hemodinámica es poco frecuente, pero hasta la mitad de los pacientes con TEP sin inestabilidad hemodinámica tienen signos clínicos o ecocardiográficos de disfunción del ventrículo derecho (TEP de riesgo intermedio). Aunque no se recomienda rutinariamente35, y a la espera de la publicación de los resultados del Pulmonary Embolism Thrombolysis Study36, la decisión de utilizar tratamiento trombolítico en un grupo muy seleccionado de pacientes dependerá de su riesgo de sangrado y de la gravedad del cuadro clínico.
- •
En pacientes con TEP y shock cardiogénico se recomienda la administración de tratamiento fibrinolítico sistémico.
- •
En pacientes con TEP e hipotensión arterial sin riesgo alto de sangrado se sugiere la administración de tratamiento fibrinolítico sistémico.
- •
En la mayoría de los pacientes estables hemodinámicamente con TEP se recomienda no administrar tratamiento fibrinolítico.
- •
En pacientes estables hemodinámicamente con TEP de riesgo intermedio y con riesgo de sangrado bajo, particularmente en los menores de 75 años, se sugiere valorar la administración de tratamiento fibrinolítico.
Están indicados en pacientes con TEP y contraindicación para la anticoagulación. Un ensayo evaluó la utilidad de los filtros, como complemento a la anticoagulación convencional, en pacientes con TVP proximal y alto riesgo de TEP37. Los filtros redujeron la frecuencia de TEP durante los primeros 12 días de tratamiento y se detectó una tendencia a un menor número de episodios mortales. A los 2 años no hubo diferencias entre los 2 grupos (mortalidad o recurrencias), debido a un incremento de TVP en el grupo con filtros. De forma indirecta, estos hallazgos apoyan el uso de los filtros en pacientes en los que la anticoagulación está contraindicada en la fase aguda. Es mejor colocar un filtro recuperable, que deberá ser retirado tan pronto como se pueda iniciar la anticoagulación.
- •
En pacientes estables hemodinámicamente con TEP y contraindicación para la anticoagulación, se recomienda la colocación de un filtro recuperable de vena cava inferior.
Fragmentación mecánica del trombo, en pacientes con TEP de alto riesgo y contraindicación para el uso de fibrinolíticos. La embolectomía pulmonar es otro tratamiento para la TEP de alto riesgo. Está indicada en casos de trombos en cavidades derechas, alto riesgo de embolia arterial paradójica o en aquellos pacientes con TEP de alto riesgo en los que la fibrinólisis no ha sido efectiva38. Los resultados mejoran si los pacientes son intervenidos antes de desarrollar un shock cardiogénico.
- •
En pacientes con TEP de alto riesgo y a) que tengan contraindicación para la fibrinólisis, b) en los que haya fracasado la fibrinólisis, o c) si es probable que el shock produzca el fallecimiento del paciente antes de que la fibrinólisis sea efectiva, se sugiere el uso de técnicas de cateterismo intervencionista o de embolectomía pulmonar si se dispone de experiencia y recursos adecuados.
Un metaanálisis de estudios que realizaron angio-TC por sospecha de TEP encontró una incidencia de TEP subsegmentaria de 4,7 y de 9,4% en pacientes controlados con TC unidetector y multidetector respectivamente39. No hubo diferencias entre los 2 grupos en la incidencia de eventos trombóticos durante los 3 primeros meses de seguimiento cuando los pacientes no fueron anticoagulados en función de una angio-TC negativa.
Tratamiento de la tromboembolia de pulmón incidentalSe detecta una TEP incidental (no sospechada) en un 2% de los pacientes (la mayoría con cáncer) a los que se realiza una TC torácica por razones distintas a la sospecha de TEP. Evidencias indirectas sugieren que la TEP incidental empeora el pronóstico de estos pacientes40. La recomendación para indicar la anticoagulación es más consistente cuando la TEP incidental se asocia a TVP concomitante, la TEP es lobar o de arterias principales y el riesgo de sangrado no es alto.
- •
Se sugiere anticoagular a los pacientes con TEP incidental de localización segmentaria, lobar o principal.
La duración adecuada del tratamiento anticoagulante requiere del balance entre riesgo de recurrencia y hemorragia.
Riesgo de recurrenciaEste riesgo depende de 1) eficacia del tratamiento en el episodio agudo, 2) duración de tratamiento a largo plazo, 3) posibilidad de que el paciente tenga un factor de riesgo intrínseco para sufrir un nuevo episodio de TEP.
En un metaanálisis de pacientes que habían sufrido un primer episodio de TVP/TEP no secundaria a cáncer y que habían recibido distintas duraciones de tratamiento, el riesgo de recurrencia aumentó significativamente para duraciones inferiores a 3 meses41. No hubo diferencias en el riesgo de recurrencia para duraciones de 3 meses comparadas con 6 o más meses. Así, se acepta que el tratamiento a largo plazo de pacientes con TEP debe tener una duración mínima de 3 meses.
El mismo metaanálisis y una revisión sistemática42 observaron como el riesgo de recurrencia es significativamente menor para los eventos provocados por un factor de riesgo transitorio (ej. cirugía) respecto de los eventos no provocados.
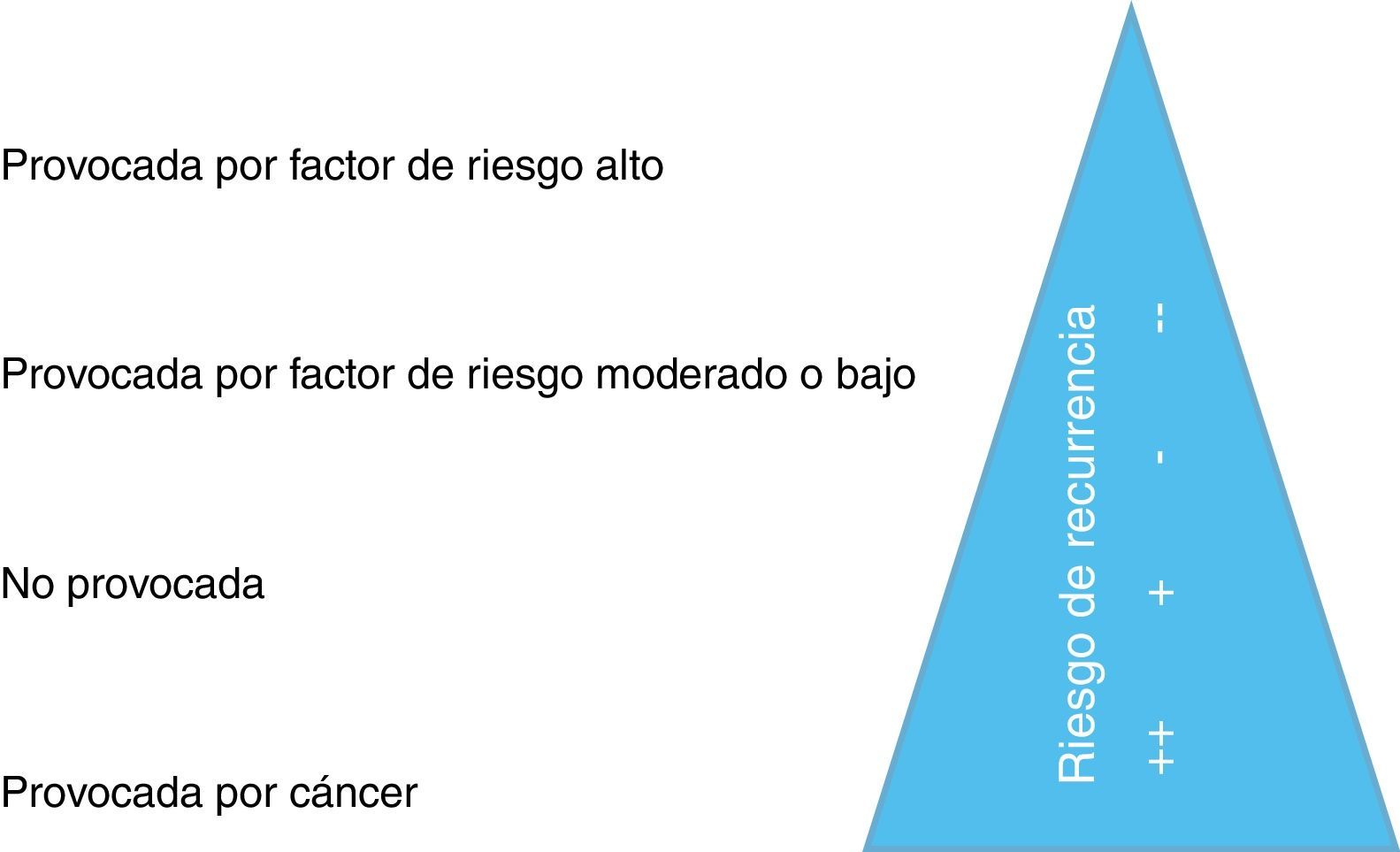
Aunque no hay uniformidad en la literatura sobre la duración del tratamiento, esta normativa estratifica la TEP como provocada por un factor de riesgo mayor, provocada por un factor de riesgo menor, no provocada o secundaria a cáncer (fig. 5).
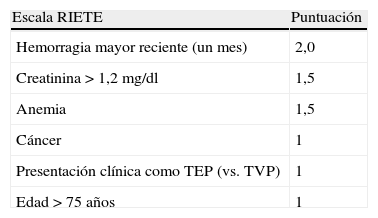
Riesgo de hemorragiaNo hay escalas de riesgo hemorrágico suficientemente validadas en pacientes anticoagulados por TVP/TEP. RIETE43 aporta una escala de predicción de riesgo hemorrágico durante los 3 primeros meses de tratamiento anticoagulante en pacientes con TVP o TEP (tabla 10). La escala clasificada a los pacientes en 3 grupos de riesgo: bajo, intermedio y alto. Los sangrados mayores en la cohorte de validación interna fueron 0,1, 2,8 y 6,2%.
Escala RIETE de riesgo hemorrágico en pacientes con enfermedad tromboembólica venosa durante los 3 primeros meses de tratamiento anticoagulante
| Escala RIETE | Puntuación |
| Hemorragia mayor reciente (un mes) | 2,0 |
| Creatinina > 1,2 mg/dl | 1,5 |
| Anemia | 1,5 |
| Cáncer | 1 |
| Presentación clínica como TEP (vs. TVP) | 1 |
| Edad > 75 años | 1 |
Riesgo bajo: 0-3 puntos; Riesgo intermedio: 1-4 puntos; Riesgo alto: > 4 puntos.
RIETE: Registro Internacional para la Enfermedad TromboEmbólica venosa; TEP: tromboembolia de pulmón; TVP: trombosis venosa profunda.
A partir del tercer mes de tratamiento anticoagulante la evidencia es más limitada. ACCP1 propone una escala de riesgo hemorrágico a partir de una serie de variables asociadas a sangrados en la literatura (tabla 11). Según este modelo, el riesgo de sangrado mayor es bajo (0,3%) en ausencia de cualquier factor de riesgo, moderado (0,6%) en presencia de un factor, y alto (≥ 2,5%) si hay 2 o más factores. Este modelo no ha sido validado.
Escala ACCP de riesgo hemorrágico en pacientes anticoagulados más de 3 meses por enfermedad tromboembólica venosa
| Variable |
| Edad > 65 años |
| Edad > 75 años |
| Hemorragia previa |
| Cáncer |
| Cáncer con metástasis |
| Insuficiencia renal |
| Insuficiencia hepática |
| Trombocitopenia |
| Ictus previo |
| Diabetes |
| Anemia |
| Antiagregantes |
| Control deficiente de la anticoagulación |
| Comorbilidad y capacidad funcional reducida |
| Cirugía reciente |
| Caídas frecuentes |
| Abuso de alcohol |
Fuente: Modificado de Kearon et al.1
Riesgo bajo: 0 factores de riesgo; Riesgo moderado: 1 factor de riesgo; Riesgo alto: > 2 factores de riesgo.
ACCP: American College of Chest Physicians.
Existen 2 estrategias de decisión sobre la duración de la anticoagulación a largo plazo en pacientes con TEP: poblacional e individualizada. La primera de ellas solo considera la TEP provocada, la TEP no provocada o la TEP secundaria a cáncer para realizar recomendaciones fijas sobre la duración del tratamiento anticoagulante. La segunda tiene en cuenta las características del paciente (edad, sexo, comorbilidad, presentación del evento) y algún otro factor adicional (dímero D) para sugerir planes individualizados de duración del tratamiento anticoagulante. Los autores de esta normativa sugieren una aproximación mixta para tomar decisiones.
- •
En pacientes con TEP provocada por factores de riesgo transitorios quirúrgicos se recomienda tratamiento anticoagulante durante 3 meses.
- •
En pacientes con TEP provocada por factores de riesgo transitorios no quirúrgicos se sugiere tratamiento anticoagulante durante 3 meses.
- •
En pacientes con TEP no provocada se recomienda tratamiento anticoagulante durante un mínimo de 3-6 meses, y se sugiere valorar tratamiento indefinido en función del balance entre el riesgo de recurrencia y el riesgo de hemorragia.
- •
En pacientes con cáncer se recomienda tratamiento anticoagulante un mínimo de 3-6 meses, y se sugiere prolongar el tratamiento mientras el cáncer esté activo.
- •
En pacientes con un segundo episodio de TEP no provocada se recomienda tratamiento anticoagulante indefinido.
- •
En pacientes con indicación de anticoagulación indefinida se recomienda la reevaluación periódica de esta indicación.
En pacientes con TVP o TEP seguidos durante 5 años, la presentación inicial del evento trombótico en forma de TEP multiplicó por 3 el riesgo de que la recurrencia trombótica fuera de nuevo una TEP (vs. TVP)44.
Dímero DPROLONG45 determinó un dímero D al mes de suspender la terapia anticoagulante en pacientes con un primer episodio de TVP/TEP no provocada que habían recibido un mínimo de 3 meses de tratamiento con AVK. Los pacientes con dímero D negativo no fueron anticoagulados, mientras que aquellos con dímero D positivo fueron aleatorizados a reiniciar o suspender las AVK. La tasa de recurrencias durante el seguimiento fue: 15% en el grupo dímero D positivo no anticoagulado, 6,2% en el dímero D negativo, y 2,6% en el dímero D positivo y anticoagulado. Estos resultados se han confirmado en metaanálisis posteriores.
Trombosis venosa profunda residualUn metaanálisis46 concluyó que la TVP residual estaba modestamente asociada al aumento del riesgo de recurrencia para todos los pacientes con TVP (provocada o no provocada), pero el efecto desaparecía cuando se consideraba exclusivamente el subgrupo de pacientes con TVP no provocada. Su limitación radica en que la evaluación es operador dependiente.
Primer episodio versus segundo episodio de tromboembolia de pulmónDespués de un segundo episodio de TVP/TEP, el riesgo de recurrencia es aproximadamente 1,5 veces mayor que después del primero47. El riesgo de recurrencia es alto cuando el segundo episodio se produce al poco tiempo de suspender la anticoagulación.
Trombofilia hereditaria y adquiridaEn un metaanálisis48 el riesgo de recurrencia trombótica fue de 1,6 para pacientes heterocigotos del factor V Leiden, 2,6 para homocigotos, y 1,4 para heterocigotos del gen de la protrombina 20210A. Dado que la asociación entre trombofilia hereditaria y riesgo de recurrencia es débil (si es que existe), no se aconseja su determinación para decidir la duración del tratamiento anticoagulante.
Los estudios que evalúan la asociación entre anticuerpos antifosfolípido y el riesgo de recurrencia no aportan datos consistentes para decidir la duración de la anticoagulación en función de su detección.
Otros factores de riesgo de recurrenciaLa edad avanzada, el género varón, la obesidad, el síndrome postrombótico secundario a TVP concomitante a la TEP, algunos fármacos antipsicóticos y ciertas enfermedades crónicas como la enfermedad inflamatoria intestinal se han asociado a un riesgo aumentado de recurrencias al suspender la anticoagulación.
Modelos predictivos de recurrencia para pacientes con tromboembolia de pulmón no provocadaSe han desarrollado modelos predictivos para identificar pacientes con TEP no provocada y bajo riesgo de recurrencia. Sin embargo, ninguno ha sido validado. Los modelos más utilizados son la escala DASH49, el normograma de Viena50 y el modelo canadiense51.
Fármacos para el tratamiento a largo plazoEn esta normativa solo se hacen recomendaciones o sugerencias para los fármacos aprobados en España para esta indicación.
Antivitaminas KAcenocumarol y warfarina son las AVK disponibles en España. El control de la acción terapéutica requiere monitorización (INR). Un INR entre 2,0 y 3,0 presenta el mejor balance entre eficacia y seguridad52, y reduce un 80% el riesgo de recurrencia. Después de haber completado un mínimo de 6 meses con un rango entre 2,0 y 3,0, un ensayo clínico encontró que la administración de AVK con un rango más bajo, entre 1,5 y 1,9, redujo el riesgo de recurrencia en un 64% sin incrementar el riesgo de sangrado mayor53.
En pacientes con dificultad para la monitorización periódica o para mantener un INR estable (más del 50% de determinaciones en rango durante un período de 6 meses), el balance entre eficacia y seguridad de las AVK no está garantizado.
Heparinas de bajo peso molecularEstán indicadas durante al menos los 3 primeros meses de tratamiento de la TVP/TEP en pacientes con cáncer activo, donde se han mostrado más eficaces que las AVK. Sin embargo, como las dosis para el tratamiento a largo plazo no están bien establecidas y su administración es parenteral, no se recomienda su uso como primera elección en pacientes con TVP/TEP no secundaria a cáncer, aunque podrían constituir una alternativa para pacientes con dificultad para controlar adecuadamente los niveles de AVK o INR inestable.
Nuevos anticoagulantes oralesEn el momento de la redacción de este consenso la Agencia Europea del Medicamento solo ha aprobado rivaroxaban para la prevención secundaria tras un primer episodio de TVP o TEP. Otros anticoagulantes comercializados para otras indicaciones, como dabigatran o apixaban, están pendientes de aprobación.
Einstein-EXT27 asignó al azar pacientes que habían completado 6 a 12 meses de anticoagulación (AVK o rivaroxaban) a recibir rivaroxaban o placebo. Durante el período de estudio, rivaroxaban redujo significativamente el riesgo de recurrencias. No hubo diferencias significativas en la incidencia de hemorragias mayores, pero rivaroxaban incrementó el riesgo de hemorragias graves o hemorragias no graves clínicamente relevantes.
En AMPLIFY-EXT54 se compararon 2 dosis de apixaban (2,5 y 5mg) con placebo en pacientes con TVP/TEP que habían completado 6 a 12 meses de tratamiento anticoagulante. Durante el periodo de estudio, apixaban redujo significativamente el riesgo de recurrencias, sin diferencias en la incidencia de hemorragias graves o no graves clínicamente relevantes.
En RE-MEDY y RE-SONATE55, dabigatran fue comparado con AVK y con placebo (respectivamente) en pacientes con TVP/TEP que habían completado un mínimo de 3 meses de anticoagulación (AVK o dabigatran). Durante el periodo de estudio, dabigatran fue igual de eficaz que los AVK y más eficaz que placebo en la reducción de las recurrencias. Dabigatran redujo la incidencia total de hemorragias graves o no graves clínicamente relevantes cuando se comparó con AVK, pero aquellas aumentaron cuando se comparó con placebo.
AspirinaRecientemente WARFASA56 y ASPIRE57 han evaluado la eficacia y seguridad de aspirina frente a placebo en la prevención secundaria de pacientes con un primer episodio no provocado de TEP o TVP. En WARFASA la aspirina fue comparada con placebo en pacientes que habían completado un periodo de tratamiento con AVK de 6-18 meses (TVP 63%; TEP 37%). Durante 2 años de seguimiento la aspirina redujo significativamente el riesgo de recurrencia, sin incrementar los episodios hemorrágicos. En ASPIRE la aspirina fue comparada con placebo en pacientes que habían completado un periodo de tratamiento con AVK de 6 semanas a 24 meses. No se observaron diferencias en la proporción de recurrencias, aunque sí se produjo un beneficio clínico global en la reducción del evento compuesto de episodios cardiovasculares, hemorragias y muerte por cualquier causa.
- •
Para la mayoría de los pacientes con TEP se recomienda el uso de AVK, con una diana de INR 2,5 (rango 2,0-3,0), para el tratamiento anticoagulante a largo plazo.
- •
Se sugiere no utilizar AVK con una diana de INR 1,5-1,9 para el tratamiento anticoagulante a largo plazo.
- •
Para pacientes con TEP secundaria a cáncer se recomienda el uso de HBPM durante todo el tratamiento.
- •
En pacientes con dificultad para la monitorización periódica o para mantener un INR estable con AVK se sugiere el uso de rivaroxaban para el tratamiento anticoagulante a largo plazo.
- •
En pacientes con TEP no provocada en los que se suspenda la anticoagulación oral se sugiere valorar el uso de aspirina, a dosis de 100mg/día, una vez completada la duración míni ).
En una revisión de 4 estudios en los que se realizaron pruebas seriadas de imagen, el porcentaje de pacientes con TEP residual fue de 87% a los 8 días, 68% a las 6 semanas, 65% a los 3 meses, 57% a los 6 meses y 52% a los 11 meses58. Sin embargo, en un estudio de 673 pacientes procedentes de un único centro que fueron seguidos durante 3 meses, la tasa de recurrencias trombóticas sintomáticas fue de sólo 3%59. Por tanto, existe una discordancia entre el porcentaje de pacientes con trombosis residual y el porcentaje de pacientes con recurrencias trombóticas.
La incidencia de hipertensión pulmonar tromboembólica crónica (HPTEC) sintomática en pacientes que han sufrido un episodio de TEP oscila según las series y el período de seguimiento, y ha llegado hasta 3.8%60. Algunas características del episodio inicial de TEP (edad > 70 años, edad joven, sexo mujer, presión sistólica pulmonar > 50 mm Hg, TEP masiva o submasiva, TEP recurrente o idiopática) aumentan el riesgo de desarrollar HPTEC61.
- •
En pacientes con antecedentes de TEP se recomienda no realizar pruebas torácicas de imagen para evaluar la persistencia de trombosis residual o la reperfusión de los defectos iniciales.
- •
En pacientes con antecedentes de TEP y síntomas o signos sugestivos de HPTEC se recomienda realizar una ecocardiografía transtorácica de control.
Búsqueda de neoplasia oculta en la TEP no provocada
La ETEV se asocia a una neoplasia oculta en aproximadamente el 10% de los pacientes. El estudio Trousseau62 comparó la utilidad del despistaje ampliado de cáncer mediante TC toracoabdominal y mamografía (en mujeres) con el despistaje limitado. Los resultados no mostraron diferencias en la incidencia de neoplasias ni en la mortalidad entre los dos grupos de pacientes. El despistaje ampliado aumentó significativamente el gasto sanitario debido al proceso diagnóstico adicional asociado a los resultados falsos positivos.
- •
En pacientes con un episodio de TEP no provocada se sugiere no realizar pruebas específicas para la búsqueda de neoplasia si no hay clínica o exploraciones complementarias básicas que orienten a la presencia de dicha enfermedad.
Sociedad Española de Angiología y Cirugía Vascular (SEACV): Sergi Bellmunt, Jorge Cuenca, Álvaro Fernández, Fidel Fernández, Vicente Ibáñez, Francisco Lozano, José Ramón March, Antonio Romera; Sociedad Española de Cardiología (SEC): Luis Almenar, Antonio Castro, Pilar Escribano, María Lázaro, José Luis Zamorano; Sociedad Española de Medicina de Urgencias y Emergencias (SEMES): José Ramón Alonso, José Ramón Casal, José Miguel Franco, Sonia Jiménez, Marta Merlo, Ramón Perales, Pascual Piñera, Pedro Ruiz-Artacho; Coral Suero; Sociedad Española de Medicina Interna (SEMI): Raquel Barba, Carmen Fernández-Capitán, Ferrán García-Bragado, Vicente Gómez, Manuel Monreal, José Antonio Nieto, Antoni Riera-Mestre, Carmen Suárez, Javier Trujillo-Santos; Sociedad Española de Neumología y Cirugía Torácica (SEPAR): Francisco Conget, Luis Jara, David Jiménez (coordinador), José Luis Lobo, Javier de Miguel, Dolores Nauffal, Mikel Oribe, Remedios Otero, Fernando Uresandi (coordinador); Sociedad Española de Trombosis y Hemostasia (SETH): Pere Domenech, José Ramón González-Porras, Ramón Lecumberri, Pilar Llamas, Eva Mingot, Elena Pina, Javier Rodríguez-Martorell.
David Jiménez declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals; Boehringer Ingelheim Pharmaceuticals, Inc.; Bristol-Myers Squibb Company; Daiichi Sankyo, Inc; Leo Pharma; ROVI; Sanofi-Aventis.
Fernando Uresandi declara haber recibido financiación por impartir conferencias en eventos educacionales y/o asesoría científica y/o investigación de Bayer HealthCare Pharmaceuticals.
Publicación original: Uresandi F, Monreal M, García-Bragado F, Domenech P, Lecumberri R, Escribano P, Zamorano JL, Jiménez S, Ruiz-Artacho P, Lozano F, Romera A, Jiménez D; en representación del Consenso nacional sobre el diagnóstico, estratificación de riesgo y tratamiento de los pacientes con tromboembolia pulmonar. Consenso nacional en el diagnóstico, estratificación del riesgo y tratamiento de pacientes con embolismo pulmonar. Arch Bronconeumol 2013;49:534–47.
Una lista completa de las sociedades y de los autores participantes está disponible en el anexo A.