Una fístula aortoentérica (FAE) es una comunicación entre la aorta y un asa de intestino adyacente de manera directa o tras cirugía reconstructiva aórtica o endovascular. Es una entidad con una tasa de morbimortalidad asociada muy elevada, cuyo diagnóstico precisa un alto grado de sospecha según la clínica y datos indirectos de las técnicas de imagen (tomografía computarizada). La opción terapéutica más adecuada continúa siendo un tema controvertido. El tratamiento endovascular de esta complicación presenta unas tasas de morbimortalidad a corto plazo aparentemente menores, aunque su papel como tratamiento definitivo resulta muy discutible. El objetivo de este estudio es ofrecer una revisión actualizada de las modificaciones en el diagnóstico y manejo de las FAE.
An aortoenteric fistula (AEF) is a communication between the aorta and an adjacent bowel loop, directly or due to reconstructive aortic or endovascular surgery. It has a very high associated morbidity and mortality rate, and the diagnosis requires a high index of suspicion based on clinical data and indirect imaging techniques (computed tomography). The most appropriate therapeutic option remains controversial. Endovascular treatment of this complication shows apparently lower morbidity and mortality rates in the short-term, although its role as a definitive treatment is very debatable. The objective of this study is to provide an update and review on changes in the diagnosis and management of AEF.
Las fístulas aortoentéricas (FAE) continúan siendo una enfermedad con una elevada morbimortalidad por hemorragia o sepsis, requiriendo un rápido diagnóstico en el que es fundamental la sospecha clínica, y en el que la elección del tratamiento quirúrgico o, en los últimos años, endovascular más adecuado resulta controvertida.
Las FAE primarias se definen como una comunicación directa entre la aorta nativa y el tracto gastrointestinal. En series de autopsias se ha descrito una incidencia del 0,04-0,07% y se estima que están presentes en el 0,69-2,36% de todos los aneurismas de aorta abdominal (el 83% de las FAE primarias se asocian con aneurismas de aorta abdominal)1. Las FAE secundarias a cirugía aórtica se producen por decúbito de un asa sobre la prótesis (fístula paraprotésica) o sobre la línea de sutura aórtica (FAE secundaria verdadera). Su incidencia oscila entre el 0,4 y el 1,6%2 y se estima que subyacerían en el 20-45% de las infecciones de prótesis aórticas3. La incidencia de esta complicación aumenta cuando la cirugía primaria es debida a un aneurisma de aorta abdominal sintomático (0,66-1,7%), comparada con cirugía electiva por afecciones oclusivas (0,2-0,5%) o aneurismáticas (0,17%)4,5. En una revisión previa se ha descrito que, en el 54,3% de las FAE secundarias, la cirugía primaria fue por enfermedad aneurismática, y hasta casi 1/3 de ellas eran sintomáticas6. Aunque cabría pensar que el riesgo de esta complicación debería ser mínimo tras una reconstrucción aórtica endovascular, dado que la prótesis queda en el interior del saco aneurismático, desde que en el año 1998 Norgren et al. describieron a un paciente con una fístula duodenal tras tratamiento con endoprótesis de un aneurisma de aorta abdominal, se han publicado alrededor de 40 casos en la literatura7–12. Su verdadera incidencia se desconoce aunque se cree que sería menor que tras cirugía abierta.
EtiopatogeniaEl mecanismo exacto de la patogénesis de las FAE no ha sido aún dilucidado, aunque los factores mecánicos e infecciosos parecen ser los responsables más frecuentes de esta complicación.
El 54% de las FAE primarias ocurren en la porción fija retroperitoneal del duodeno distal, 2/3 en la tercera porción del duodeno. Otros sitios que pueden verse implicados son: esófago (28%), intestino delgado y grueso (15%), y estómago (2%)1. En la mayoría de los casos, esta enfermedad surge con relación a la existencia de un aneurisma de aorta abdominal aterosclerótico (73%)13, mientras que el 26% suelen ser debidas a aneurismas micóticos o traumáticos. El 1% restante se debería a causas como radiación, infección, tumores, úlceras pépticas, enfermedad inflamatoria intestinal (enfermedad de Crohn) e ingestión de cuerpos extraños1,14.
En el caso de las FAE secundarias, la causa dominante es la cirugía reconstructiva vascular. El estrés mecánico pulsátil produciría la erosión intestinal, conduciendo a la contaminación de la prótesis. Es complicado dilucidar en muchos casos si el factor mecánico ha sido el desencadenante de la fístula o si esta es debida a una infección protésica. Por un lado, las infecciones protésicas precoces, por disrupción de la sutura aórtica, producen pseudoaneurismas anastomóticos que causarían una erosión intestinal, la cual conllevaría la formación de una FAE. Sin embargo, en las fístulas y erosiones entéricas tardías, años después de la cirugía primaria, es frecuente encontrar la prótesis bien incorporada y sin signos de infección excepto en el punto de comunicación con el intestino, lo que hace más probable que sea el factor mecánico el desencadenante de estas fístulas. El factor predisponente más importante es el fallo al separar la prótesis y la anastomosis del intestino adyacente. Así, es importante prevenir la elongación protésica y asegurar la cobertura de toda la prótesis con tejido retroperitoneal o con epiplón para evitar el contacto directo de la prótesis y el intestino. Las reintervenciones quirúrgicas de la aorta infrarrenal, la disección excesiva de la flexura duodenoyeyunal y de su pedículo mesentérico, la lesión entérica identificada y reparada, o a veces inadvertida, son factores que aumentan el riesgo de infección protésica y de FAE6,15.
En el caso de FAE tras reparación endovascular de un aneurisma de aorta abdominal (EVAR), el mecanismo más frecuente es la erosión de la pared aórtica por el stent9. Esto puede ser debido a un mecanismo directo o debido a un fallo mecánico como fractura del stent o migración y kinking del mismo8,9. También se han publicado casos de FAE asociados a erosión de la pared aórtica y duodenal por coils para la embolización de endofugas tipo ii y casos relacionados con erosión de la pared intestinal por crecimiento del aneurisma debido a endofugas tipo i9. Otro posible mecanismo sería la erosión de la pared intestinal por el tejido adventicial inflamatorio de la pared del aneurisma7,9. También se ha postulado que la existencia de una infección primaria de la endoprótesis sería el mecanismo subyacente a la formación de la FAE16,17. Sin embargo, en algunos casos no está claro cuál es el mecanismo de formación de la FAE ya que no se observaron datos de endofugas, inflamación ni fallo mecánico de la endoprótesis. La hipótesis de algunos autores implicaría la existencia de una endotensión persistente en el saco aneurismático, lo cual causaría la fistulización sin fallos en el stent9,11,18.
Aspectos clínicosEn las FAE primarias, la tríada clásica es hemorragia gastrointestinal (64-94%), dolor abdominal (32-48%) y masa abdominal pulsátil (17-25%). Sin embargo, estos signos y síntomas solo se dan de manera concomitante en el 11% de los casos1,19. También se han descritos otros síntomas como dolor de espalda, melenas, fiebre, sepsis y shock1,14. Normalmente, los episodios iniciales de melenas o hematemesis son autolimitados debido al cierre de la fístula por trombo o por contracción del intestino a nivel de la misma, configurando el sangrado «centinela», que suele preceder a las hemorragias masivas. El rápido reconocimiento de los síntomas y la sospecha clínica son esenciales para una actuación inmediata.
En las FAE secundarias, la hemorragia digestiva se ha descrito como el síntoma más frecuente (61-94%), seguido de los signos de infección (50-70%) y de los síntomas de isquemia aguda (20-30%)6,14,20. Otros síntomas son dolor abdominal (30%), dolor de espalda (15%), masa inguinal (12%) y masa abdominal pulsátil (6%)14. La prevalencia del sangrado «centinela» es del 31,78%6. Por lo tanto, la hemorragia digestiva en un paciente portador de una prótesis aórtica debería suscitar un alto índice de sospecha de existencia de FAE, incluso en ausencia de signos o síntomas de infección crónica. De hecho, la existencia de hemorragia digestiva tras cirugía reconstructiva aórtica debería considerarse que es causada por la existencia de una FAE hasta que se demuestre lo contrario.
DiagnósticoLas 3 pruebas diagnósticas más utilizadas para la detección de FAE son la tomografía computarizada (TC) abdominal con contraste intravenoso, la endoscopia (esofagogastroduodenoscopia) y la arteriografía. La selección de los estudios depende del estado clínico del paciente y de los recursos existentes.
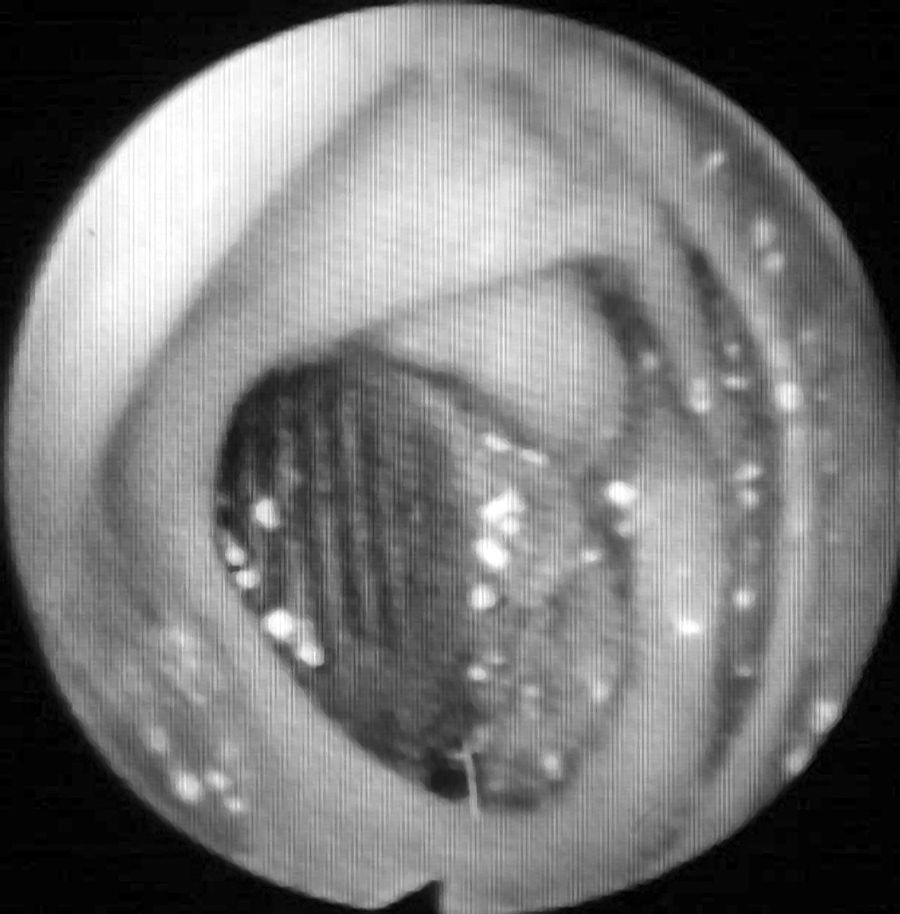
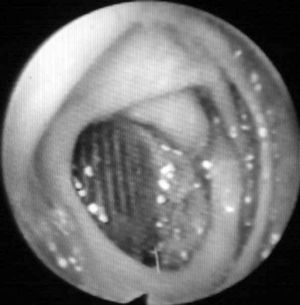
La endoscopia digestiva es conveniente realizarla en todos los pacientes con antecedentes de cirugía aórtica que presentan una hemorragia digestiva alta, no solo para intentar detectar la erosión de la pared intestinal por la prótesis (fig. 1) (lo cual ocurre muy raramente, incluso con el uso de cápsulas endoscópicas) sino, esencialmente, para descartar otras causas de sangrado (sobre todo úlceras gastroduodenales y varices esofágicas)21. Hay autores que defienden que, como las FAE pueden presentarse en cualquier segmento intestinal, debería realizarse endoscopia digestiva alta y baja. El hallazgo endoscópico de otras enfermedades gastrointestinales o la ausencia de hallazgos patológicos en la endoscopia no excluye la presencia de una FAE6,20.
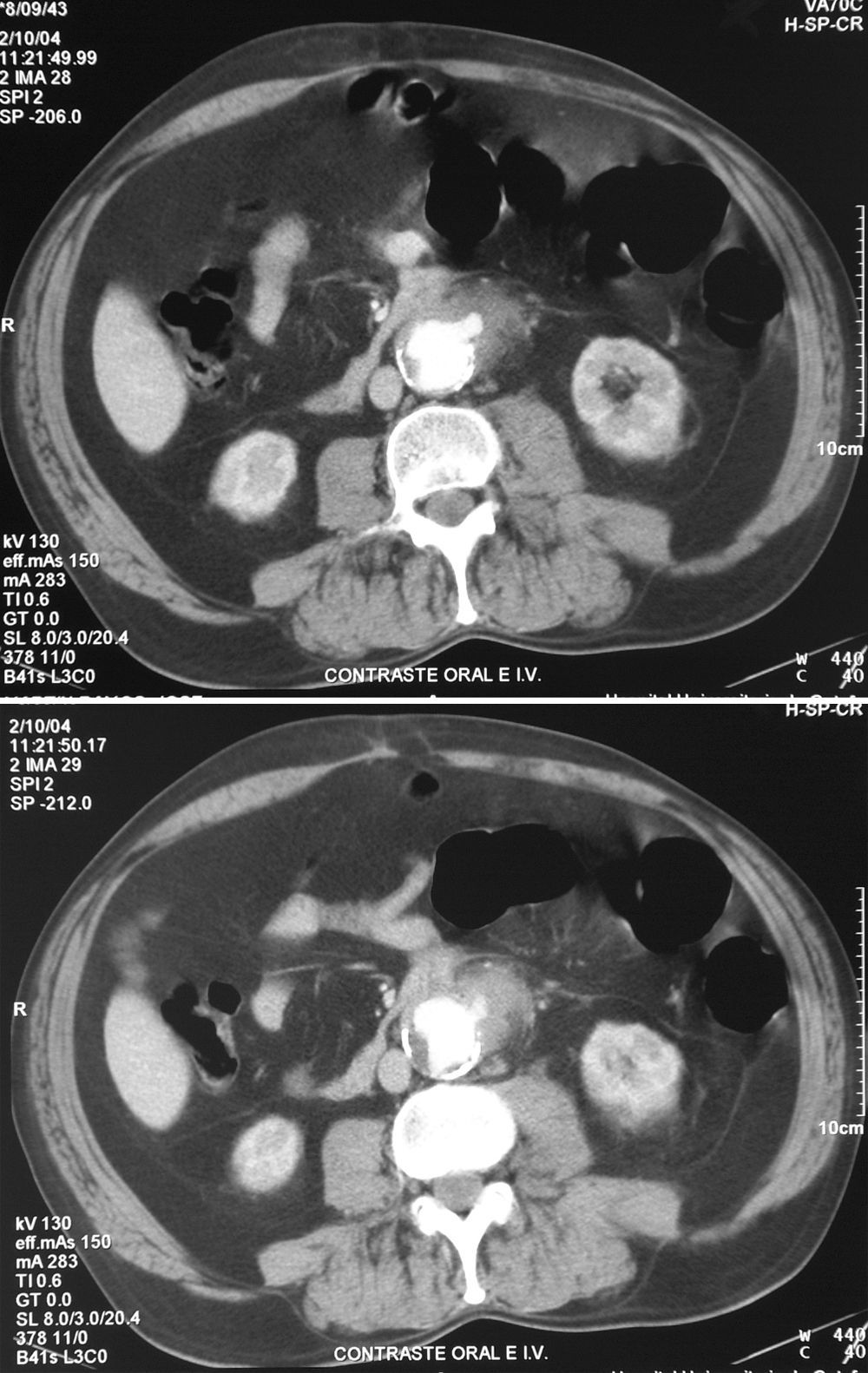
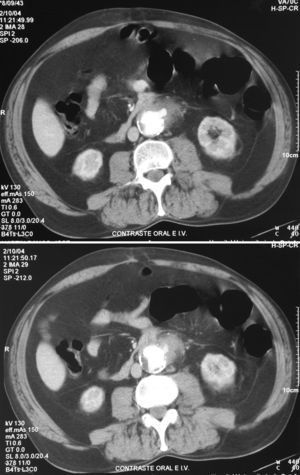
La TC con contraste intravenoso sería una prueba más efectiva y menos invasiva que la endoscopia, con la ventaja adicional de no tener riesgo de mover el posible trombo aórtico que evita el sangrado. Por esto y por su amplia disponibilidad, corto tiempo de adquisición de imágenes y su elevada resolución, la TC ha pasado a ser la primera línea de evaluación ante la sospecha de FAE. Su sensibilidad y especificidad varían según las series (sensibilidad 40-90% y especificidad 33-100%)22. La baja sensibilidad y especificidad de algunas series podría deberse a la falta de reconocimiento de los signos «indirectos» de esta dolencia. Los criterios de elevada sospecha diagnóstica de FAE serían: la presencia de colecciones o gas periprotésico; engrosamiento o retracción de la pared intestinal en contacto con la aorta o prótesis y engrosamiento del tejido adyacente al intestino; existencia de pseudoaneurismas o alteraciones de la integridad protésica y, extravasación de contraste en la luz intestinal, lo cual es extremadamente raro y patognomónico de FAE (fig. 2), aunque la falta de estos signos nunca debe ser una razón para descartar el diagnóstico de FAE20,21.
La arteriografía ha tenido su papel para planear la reconstrucción aórtica aunque ha sido desplazada por la TC. Actualmente su utilidad estaría en relación con la embolización o colocación de endoprótesis para tratar sangrados masivos secundarios a la FAE14.
La resonancia magnética nuclear no ha demostrado su utilidad ya que requiere mucho tiempo de adquisición y no permite diferenciar el gas periprotésico de las calcificaciones de la pared aórtica14,21. La gammagrafía con leucocitos marcados tiene elevadas sensibilidad y especificidad, mayores del 80%, para el diagnóstico de infección protésica23. La gammagrafía con glóbulos rojos marcados con tecnecio puede ser útil para detectar sangrados intestinales ocultos. Dependiendo de las series, su sensibilidad varía entre el 60 y el 100% para hemorragia intestinal, con un porcentaje de falsa localización del sangrado entre el 3 y el 50%21. El PET scan podría ayudar al diagnóstico, pero tiene un elevado número de falsos positivos, por lo que debe ser considerado en conjunto con los otros parámetros clínicos y biológicos24.
En un paciente con hemorragia digestiva y antecedentes de cirugía aórtica, aunque las pruebas diagnósticas fuesen negativas, algunos autores han llegado a plantear la laparotomía para excluir con seguridad dicha dolencia25. Es importante insistir en la necesidad de un elevado índice de sospecha clínica basada en la historia y el examen físico del paciente para el correcto diagnóstico, ya que se han descrito tasas de mortalidad superiores al 75% en el caso de diagnóstico tardío6,26–28.
TratamientoEl diagnóstico de una FAE implica la muerte del paciente por hemorragia o sepsis si no se trata, por lo que requiere un tratamiento intensivo cuyos objetivos serán: la confirmación del diagnóstico, control del sangrado, reparación del defecto intestinal, erradicación de la infección asociada y revascularización. La tasa de supervivencia está inversamente relacionada con el intervalo de tiempo entre el inicio del sangrado y la intervención quirúrgica29.
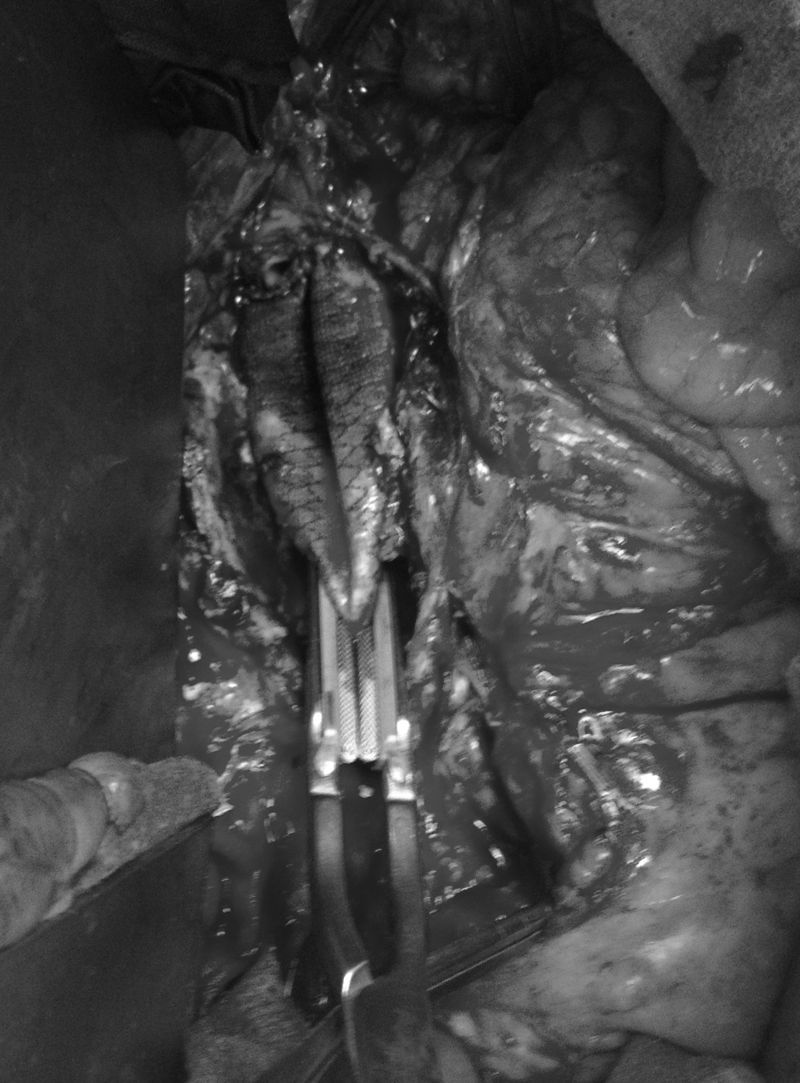
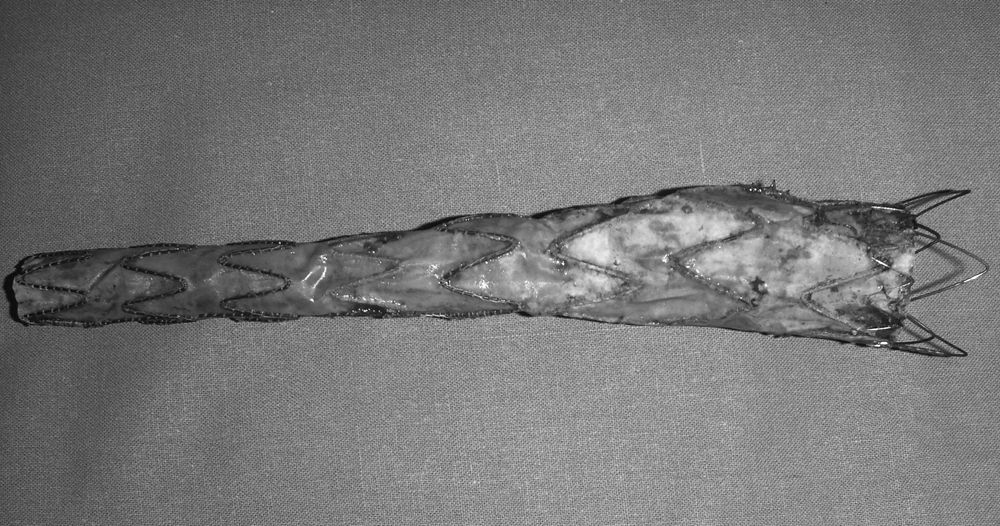
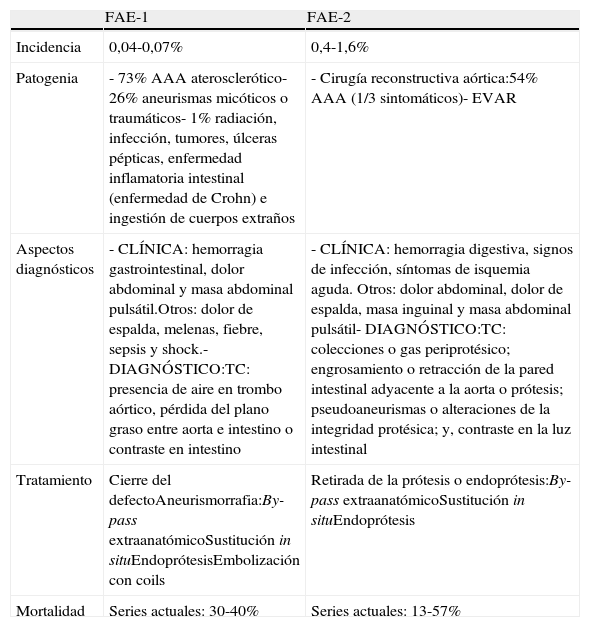
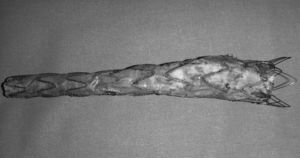
La FAE continúa siendo una de las complicaciones más serias de la cirugía reconstructiva aórtica con tasas de mortalidad, según las series más recientes, entre el 13 y el 57% de los casos3. Así mismo, asocia una elevada morbilidad con tasas de amputación de miembros inferiores de hasta el 9%30, el 22,22% de reinfección protésica20 y un 20% de trombosis en los casos de bypass extraanatómico25. En el caso de las FAE primarias, la mortalidad ha disminuido en las últimas décadas, desde el 56-93% en los años 70, al 30-40% en las revisiones más recientes13,31,32 (tabla 1). Cuál es el manejo más adecuado de esta enfermedad continúa siendo controvertido. El tratamiento tradicional consiste en la retirada de la prótesis con cierre del muñón aórtico y reparación de la lesión intestinal junto con, simultánea o escalonadamente, revascularización mediante bypass extraanatómico. Otra opción es la sustitución in situ de la prótesis infectada por otro conducto (venas autólogas33, arterias criopreservadas, prótesis de dacron impregnadas en plata o rifampicina) (figs. 3 y 4). Bergvist et al. publicaron en 2009 una revisión sistemática con 332 casos, describiendo que la mortalidad es menor en aquellos pacientes en los que se realiza la revascularización de las extremidades con un bypass extraanatómico en primer lugar y, varios días después, la retirada de la prótesis aórtica34. Sin embargo, son pocos los pacientes que se mantienen hemodinámicamente estables para retrasar la retirada de la prótesis. Esta técnica quirúrgica conlleva además un riesgo de fuga posterior y sangrado a través de la ligadura del muñón aórtico, habiéndose descrito tasas de mortalidad relacionadas con esta complicación de hasta el 89%20,35. El riesgo de sangrado del muñón se describe en el 6-50%, con un riesgo de presentar una nueva fístula del 9-22%6,23,36. La epiploplastia se ha descrito como método para disminuir esta incidencia37. Cuando el defecto intestinal es menor de 3cm, puede realizarse una sutura directa de la pared intestinal. Si el defecto es mayor, debe realizarse resección duodenal4. O¿Connor et al., en 2006, publican un metaanálisis en el que comparan la mortalidad de la reconstrucción in situ frente a la retirada y derivación extraanatómica en el tratamiento de prótesis aórticas infectadas. Describen tasas de mortalidad menores para la reconstrucción in situ con prótesis impregnadas en rifampicina comparadas con la derivación extraanatómica38. Por otro lado, Batt et al.3 publicaron un estudio multicéntrico retrospectivo en el que analizaron 37 casos de FAE sin encontrar diferencias significativas en cuanto a mortalidad perioperatoria entre las 2 técnicas. Por tanto, resulta muy controvertido afirmar cuál es el tratamiento óptimo para esta enfermedad y, quizás, lo más difícil sea seleccionar el tratamiento adecuado para cada tipo de paciente. En revisiones previas3,6,20, se describen tasas de mortalidad precoz para la reconstrucción in situ del 8-25%, mientras que para la retirada de la prótesis y bypass extraanatómico, estas son del 9-44%, con tasas de rotura del muñón aórtico de hasta el 20% a 30 días. Las tasas de mortalidad precoz en la sustitución por injertos criopreservados son del 12-50%, con tasas de rotura precoz de la prótesis de hasta el 16%39–42.
Tabla comparativa entre FAE primarias (FAE-1) y secundarias (FAE-2)
| FAE-1 | FAE-2 | |
| Incidencia | 0,04-0,07% | 0,4-1,6% |
| Patogenia | - 73% AAA aterosclerótico- 26% aneurismas micóticos o traumáticos- 1% radiación, infección, tumores, úlceras pépticas, enfermedad inflamatoria intestinal (enfermedad de Crohn) e ingestión de cuerpos extraños | - Cirugía reconstructiva aórtica:54% AAA (1/3 sintomáticos)- EVAR |
| Aspectos diagnósticos | - CLÍNICA: hemorragia gastrointestinal, dolor abdominal y masa abdominal pulsátil.Otros: dolor de espalda, melenas, fiebre, sepsis y shock.- DIAGNÓSTICO:TC: presencia de aire en trombo aórtico, pérdida del plano graso entre aorta e intestino o contraste en intestino | - CLÍNICA: hemorragia digestiva, signos de infección, síntomas de isquemia aguda. Otros: dolor abdominal, dolor de espalda, masa inguinal y masa abdominal pulsátil- DIAGNÓSTICO:TC: colecciones o gas periprotésico; engrosamiento o retracción de la pared intestinal adyacente a la aorta o prótesis; pseudoaneurismas o alteraciones de la integridad protésica; y, contraste en la luz intestinal |
| Tratamiento | Cierre del defectoAneurismorrafia:By-pass extraanatómicoSustitución in situEndoprótesisEmbolización con coils | Retirada de la prótesis o endoprótesis:By-pass extraanatómicoSustitución in situEndoprótesis |
| Mortalidad | Series actuales: 30-40% | Series actuales: 13-57% |
AAA: aneurisma de aorta abdominal; EVAR: reparación endovascular de aneurisma de aorta abdominal; TC: tomografía computarizada.
La sustitución in situ aportaría mejores resultados a largo plazo en cuanto a permeabilidad de la prótesis (86-90% a 5 años43), frente al 62% a 2 años25 y el 70% a 4 años para los bypass extraanatómicos44.
En general, la sustitución in situ se ha considerado que debe reservarse para situaciones en las que la infección esté circunscrita, como en erosiones enteroprotésicas, y está relativamente contraindicada en casos de sepsis sistémica, supuración y necrosis periaórtica difusa y en casos de infección por bacterias gramnegativas, especialmente Pseudomonas, Proteus y Staphylococcus aureus43,45. El tiempo que se debe tener al paciente con cobertura antibiótica una vez realizada la sustitución in situ continúa siendo controvertido, y no se han encontrado datos suficientes al respecto en la literatura revisada. Los factores predictivos que se han asociado con una mayor tasa de mortalidad precoz incluyen la inestabilidad hemodinámica como clínica de presentación, la necesidad de cirugía urgente, la necesidad de transfusión sanguínea preoperatoria por anemia y la necesidad de pinzamiento suprarrenal38.
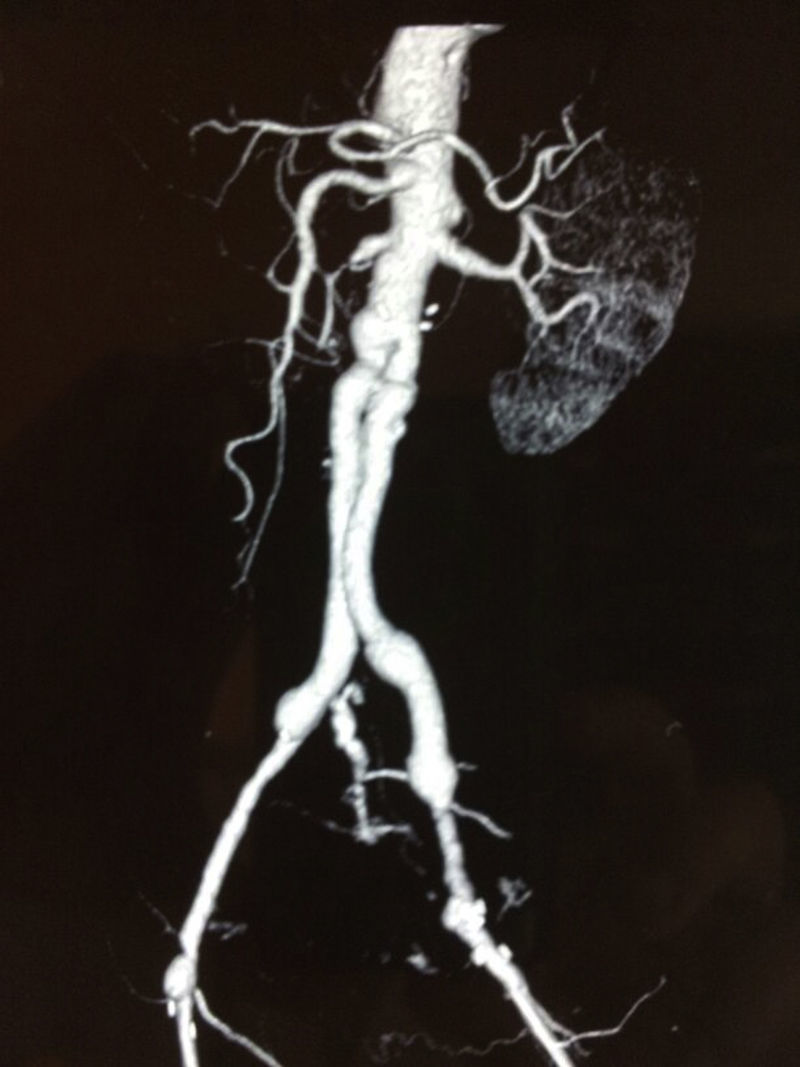
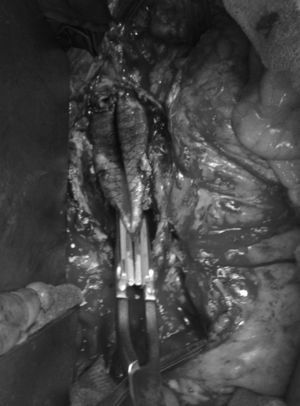
En los últimos años, el manejo tradicional de esta enfermedad se ha modificado por el auge de las técnicas endovasculares en 2 sentidos: a) la aparición de FAE tras EVAR y b) el manejo de esta complicación mediante la implantación de una endoprótesis aórtica. Según las series publicadas, la aparición de una FAE post-EVAR asocia una mortalidad postoperatoria de entre el 7 y el 50%8,9,46. En estos casos, se recomienda la retirada de la endoprótesis (fig. 5) aunque la controversia continúa en la técnica para la reconstrucción: sustitución in situ versus cierre y bypass extraanatómico. El método para retirar la endoprótesis va a depender de varios factores, incluyendo el tipo de endoprótesis originalmente colocada, la presencia de stent suprarrenal y garfios o lengüetas, la presencia de prótesis adicionales, cuffs o coils colocados en reintervenciones, la morfología actual del aneurisma, la presencia de inflamación periaórtica, la incorporación del stent en la pared del vaso, sobre todo en la región proximal, y, lo más importante, la urgencia de la reparación47–52. La simple tracción o la tracción con compresión de la prótesis puede no ser suficiente para permitir su retirada. Se recomienda un control aórtico seguro proximal al área en cuestión. Si la retirada total de la endoprótesis no fuese posible debido a las condiciones locales que podrían suponer una rotura aórtica completa (con afectación de arterias renales o mesentérica superior), se recomienda cortar el stent libre o la porción proximal de la endoprótesis, retirar el resto e incorporar esa zona en el procedimiento de reparación46,53. A estas dificultades técnicas cabría añadir el hecho de que, con el aumento del número de pacientes tratados con EVAR, la experiencia en cirugía aórtica abierta de las nuevas generaciones de cirujanos vasculares puede llegar a ser considerablemente menor, lo que influiría en la morbimortalidad de este tipo de complicaciones.
Por otro lado, las técnicas endovasculares han surgido como una opción más en el manejo de las FAE, permitiendo un rápido control del sangrado con mínimo daño, que evitaría la reintervención en un abdomen hostil y eliminarían las complicaciones asociadas a la cirugía abierta. Sin embargo, la presencia de una comunicación aortoentérica serviría como nido para un crecimiento bacteriano continuado con persistencia de la infección. Este hecho es el que pondría en duda la seguridad y eficacia a largo plazo de este procedimiento. Burks et al.54 publican una serie de 7 pacientes con FAE tratados con técnicas endovasculares (uno mediante embolización con coils y 6 con endoprótesis), todos ellos considerados de alto riesgo quirúrgico por su comorbilidad. Todos recibieron tratamiento antibiótico de por vida. Un paciente murió en el postoperatorio por sepsis fúngica y otros 2 precisaron reintervenciones por infección persistente de la prótesis. Hubo 3 muertes tardías por infarto miocárdico, ictus y neumonía. Los resultados de este estudio indican que la implantación de una endoprótesis podría utilizarse para controlar la hemorragia aguda y que la antibioterapia de por vida podría obtener la supresión a largo plazo de la infección. Sin embargo, sin un adecuado desbridamiento de todo el material y tejido contaminado, el riesgo de infección de la prótesis por la flora intestinal continúa existiendo. En 2009, se publica una revisión sistemática55 de FAE tratadas endovascularmente, analizando 41 casos con un seguimiento medio de 13 meses. Solo 18 pacientes (43,9%) recibieron antibioterapia de por vida. El 51,22% desarrollaron complicaciones, las más importantes relacionadas con nuevos/recurrentes/persistentes episodios de sepsis o sangrado recurrente. De las 12 muertes que hubo en el seguimiento, el 58,33% fueron debidas a complicaciones infecciosas. El análisis univariante reveló que los signos de infección preoperatorios y la existencia de complicaciones infecciosas en el postoperatorio se asociaban con peores resultados. La antibioterapia de por vida no demostró mejorar los resultados en cuanto a prevención de sepsis. Los autores concluyen que la reparación endovascular de las FAE se asocia con una elevada incidencia de nuevos/recurrentes/persistentes episodios de sepsis o sangrado recurrente. Dado que los signos de infección preoperatorios se asocian con peores resultados tras reparación endovascular, al menos en este grupo de pacientes, esta debería ser considerada un «puente» a una reparación definitiva posterior, tras optimizar las condiciones clínicas del paciente.
Comparar los resultados del tratamiento quirúrgico tradicional frente a las técnicas endovasculares es sumamente complicado, dada la incidencia de la enfermedad y la gran cantidad de variables asociadas a ambas técnicas. Baril et al.56 compararon el tratamiento quirúrgico tradicional de las FAE con la reparación endovascular. El grupo endovascular presentó menor porcentaje de complicaciones postoperatorias que el quirúrgico, aunque la mayoría de ellas estaban relacionadas con persistencia de los signos infecciosos. Sin embargo, el grupo endovascular presentaba una mayor tasa de complicaciones tardías relacionadas con la infección mientras que en el grupo quirúrgico la supervivencia media tras el alta hospitalaria fue superior. Un estudio multicéntrico retrospectivo57 más reciente realiza esta misma comparación en 25 pacientes con FAE. Los resultados a corto plazo revelan una menor morbilidad en el grupo tratado de manera endovascular frente a cirugía (25 y 77%, respectivamente; p=0,028). De igual manera, la morbilidad fue más elevada en el grupo de pacientes con sepsis perioperatoria. La mortalidad intrahospitalaria fue superior en el grupo quirúrgico (0 vs. 35%; p=0,13) y en pacientes con sepsis preoperatoria (32 vs. 0%; p=0,28). Al analizar los resultados a largo plazo, objetivaron que la ventaja inicial en cuanto a supervivencia de la terapia endovascular se perdía a los 2 años de seguimiento. El 75% de las FAE recurrentes se dieron en pacientes tratados de manera endovascular y de los 6 pacientes que desarrollaron nuevos o recurrentes signos de sepsis, 4 fueron del grupo endovascular. Los autores concluyen que el tratamiento endovascular serviría preferentemente como «puente» a una reparación quirúrgica abierta posterior cuando el paciente esté hemodinámicamente estable y los signos de infección locales y sistémicos estén resueltos.
ConclusionesLas tasas de morbimortalidad asociadas a la existencia de una FAE continúan siendo hoy en día muy elevadas. Es esencial el diagnóstico de sospecha en todo paciente que presente hemorragia gastrointestinal y asocie la existencia de un aneurisma de aorta abdominal o antecedentes de cirugía aórtica, incluida EVAR, teniendo en cuenta que la negatividad de las pruebas diagnósticas no excluye su existencia. La elección del tratamiento óptimo de esta enfermedad continúa siendo controvertido y dependerá de la situación hemodinámica del paciente, de los signos de sepsis, de la comorbilidad asociada, y de las posibilidades técnicas y experiencia de cada centro.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.