La evolución y transformación de la especialidad de Angiología y Cirugía Vascular en los últimos 20 años hacia modos mínimamente invasivos, materializados en la cirugía endovascular, ha constituido un punto de inflexión en el aprendizaje de las técnicas y procedimientos quirúrgicos vasculares. El uso de modelos animales para la adquisición de las habilidades y destreza quirúrgica necesarias para la realización de cirugía endovascular representa la culminación en el aprendizaje de la misma como paso previo necesario y exigible para su ejecución en el humano. En este artículo se describe el contenido y evolución de los cursos de cirugía endovascular en modelos animales, como reflejo de la evolución de la especialidad a lo largo de los últimos 15 años.
The evolution and transformation of the Angiology and Vascular Surgery specialty in the last 20 years to minimally invasive methods, materialised in endovascular surgery, has been a turning point in the training in vascular surgery techniques and procedures. The use of animal models to acquire the skills and dexterity needed to perform endovascular surgery is the high point in the learning of this technique as a necessary and mandatory prior step to practicing it on humans. The contents and progress of the endovascular surgery courses on animal models are presented in this article, as a reflection of the progress of this speciality over the last 15 years.
Tras la experiencia acumulada desde el año 2000, con la realización de 14 cursos consecutivos en modelo animal para la difusión y aprendizaje de las técnicas endovasculares, el objetivo de este trabajo es mostrar el contenido, estructura y organización de este tipo de cursos, subrayando su inevitable evolución con el transcurso de los años, como consecuencia de los cambios en nuestra especialidad derivados de la consolidación de la cirugía endovascular en la misma.
En los últimos 20 años hemos asistido a una transformación profunda en las indicaciones y formas de tratamiento acerca de la revascularización de los pacientes portadores, tanto de enfermedad arterial periférica1–4, como de aneurismas arteriales, especialmente a nivel de la aorta abdominal5–10.
Los nuevos modos de todas las cirugías, desde principios de este siglo, tienen como paradigma la búsqueda de la mínima invasión, intentando disminuir el trauma quirúrgico y todo lo que gira a su alrededor: reducir la agresión, sentir el menor dolor, buscar una rápida recuperación y mejora de la calidad de vida.
La cirugía endovascular cumple todos los criterios como cirugía mínimamente invasiva, de ahí su arrolladora aceptación, tanto por pacientes como por cirujanos, y su espectacular desarrollo, de la mano de grandes inversiones en innovación tecnológica, conjuntada con la presión convincente de la industria.
El aprendizaje de la cirugía endovascular, como el de todas las cirugías, debe seguir un modelo piramidal11 o, si se prefiere, en peldaños de escalera, comenzando por una formación teórica lo más sólida posible, paralela a la adquisición de habilidades, y combinando todos los recursos que las modernas tecnologías ponen a nuestro alcance, desde los simuladores mecánicos a los de realidad virtual, para culminar este proceso en el aprendizaje en el modelo animal12,13.
Necesidades de aprendizajeDesde la perspectiva de los 14 cursos consecutivos realizados hasta ahora, la evolución experimentada ha ido de la mano de los cambios acontecidos en nuestra propia especialidad desde comienzos de siglo: de ser una especialidad médico quirúrgica tradicional se ha pasado, hoy en día, a realizar un elevadísimo porcentaje de sus técnicas de modo endovascular, algunas de forma mayoritaria4,9.
Es importante recordar ahora la clara visión de futuro y la apuesta decidida por parte de las distintas juntas directivas de nuestra Sociedad, desde el año 1998 hasta la actualidad, en favor de la cirugía endovascular, como parte irrenunciable de la especialidad, posibilitando que el tratamiento quirúrgico de un paciente pudiera ser enfocado individualmente, de forma indistinta y a veces mixta de manera abierta o endovascular. Desde esta perspectiva de servicio a las necesidades de reciclaje y formación de los antiguos y nuevos miembros de la especialidad y en sintonía con las diferentes estrategias de sus responsables, nacieron estos cursos y así han continuado.
Todos los cursillistas en la actualidad, no en el pasado, son residentes en periodo de formación. Constatamos como, con el paso de los años, los residentes vienen mejor formados en estas técnicas, aunque tampoco podemos dejar de subrayar la gran diferencia de niveles observada entre compañeros del mismo año, según el servicio de procedencia. En unos, el residente de cuarto año posee unas habilidades prácticas superiores a las de algunos de quinto: es la diferencia entre solo observar y no practicar y practicar después de ver; de ahí la enorme importancia que, especialmente para algunos de ellos, tiene participar en estos cursos antes de finalizar su periodo de formación.
Niveles de aprendizajeSiguiendo el modelo escalonado de aprendizaje, debemos identificar precozmente a los que, por diversas razones ya expuestas, vienen más rezagados: a ellos se les dedica una atención especial desde el principio, lo cual permitirá al resto ir cumpliendo el programa de forma más homogénea. Pretendemos acomodarnos, dentro de nuestras posibilidades, al nivel de cada cursillista para que, convenientemente tutorizado, pueda evitar saltos apresurados en sus modos de aprendizaje, siendo las claves la realización personal de maniobras básicas y la interiorización de aquello que no se debe hacer, con objeto de evitar malas costumbres futuras y posibles complicaciones.
La posibilidad de repetir, tantas veces como sea necesario, hasta lograr el aprendizaje de los actos que se practican, es una peculiaridad que solamente en este tipo de cursos de realidad total en modelo animal se puede llevar a término sin peligro para la integridad de las personas, como sucedería en los primeros casos de realización en humano de una angioplastia o despliegue de un stent.
Si ejemplificamos en 3 niveles los grados de aprendizaje: inicial, intermedio y suficiente, en el desarrollo de cada curso pretendemos que todos los cursillistas superen el nivel intermedio. El nivel suficiente significa tener la soltura necesaria para navegar y cateterizar selectivamente ramas de los troncos supraaórticos, carótidas, viscerales, renales, realizar cruces contralaterales y realizar personalmente angioplastias virtuales en los lugares señalados, para finalizar con despliegues de stents de diferentes características en aquellos territorios previamente seleccionados. Asimismo, todos han realizado personalmente cirugía de EVAR y TEVAR en el modelo simulado, con el mismo tipo de materiales y dispositivos de clínica humana que habrían de usar posteriormente en sus servicios.
Anestesia de modelos animales en cirugía endovascularLa mejora de las técnicas anestésicas debe considerarse un aspecto esencial del refinamiento de los métodos experimentales y en la docencia, ya que un factor de vital importancia en el desarrollo y mejora de los modelos es la reducción del número de animales empleados, siguiendo así el principio de reemplazo, reducción y refinamiento. Es importante tener en cuenta que una incorrecta técnica anestésica puede ocasionar efectos adversos sobre la calidad de los resultados obtenidos en el transcurso de la experimentación animal o en el adecuado desarrollo del curso, por lo que se debe emplear el protocolo anestésico más idóneo para cada especie y para cada procedimiento concreto.
No existe un método ni un agente anestésico único que nos proporcione una anestesia segura y adecuada, por lo que se debe realizar una anestesia balanceada y equilibrada, combinando distintos agentes que nos proporcionen hipnosis, analgesia, relajación muscular, mínimos efectos secundarios y mínima interacción con el desarrollo de los procedimientos, ya sean experimentales o docentes14,15.
Por lo tanto, una elección correcta de la técnica anestésica nos proporciona una mejora de las tasas de supervivencia de los modelos animales, lo que incrementa la aceptación ética y la eficiencia de estos modelos. En definitiva, empleando el protocolo anestésico más adecuado, aseguramos el bienestar animal, reducimos la morbilidad, optimizamos el rendimiento y garantizamos la calidad de la investigación y del objetivo docente, cumpliendo de esta forma con la filosofía del empleo de animales de experimentación, expresada en la actual normativa europea y española vigente. Así, el 22 de septiembre de 2010, el Parlamento Europeo y el Consejo adoptaron la directiva 2010/63/UE, relativa a la protección de los animales utilizados para fines científicos, que fue incorporada a nuestro ordenamiento a través del Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia16.
En su capítulo IV, artículo 26, señala que los procedimientos deberán llevarse a cabo con anestesia general o local, salvo que se considere que es inapropiada porque sea más traumática para el animal que el procedimiento en sí o sea incompatible con los fines del procedimiento. Además, deberán utilizarse analgésicos u otros métodos idóneos para garantizar, en la medida de lo posible, que el dolor, el sufrimiento, la angustia o la lesión sean mínimos, y los procedimientos que impliquen lesiones graves que puedan causar dolores intensos no se llevarán a cabo sin anestesia17,18.
Modelo animalEntendemos por modelo animal aquel que, no solo nos permite investigar su biología o comportamiento, así como diferentes procesos patológicos, inducidos o espontáneos, sino que, además, en uno o más aspectos, refleje las mismas características que en humanos u otras especies animales de más difícil, o a veces imposible, estudio. Parece evidente que la elección cuidadosa de la especie a emplear como modelo es una de las decisiones más importantes que hemos de tomar antes del inicio de una investigación biomédica.
El empleo de la especie porcina tanto en docencia como en investigación cardiovascular permite una aproximación mucho más exacta a los procesos patológicos humanos que la proporcionada por otros modelos animales, por lo que su empleo cada vez es mayor. Por lo tanto resulta de vital importancia la posibilidad de extrapolar los resultados obtenidos en estos estudios, o lo que es lo mismo, la posibilidad de aplicación posterior de dichos resultados, obtenidos en un modelo animal, a la especie humana.
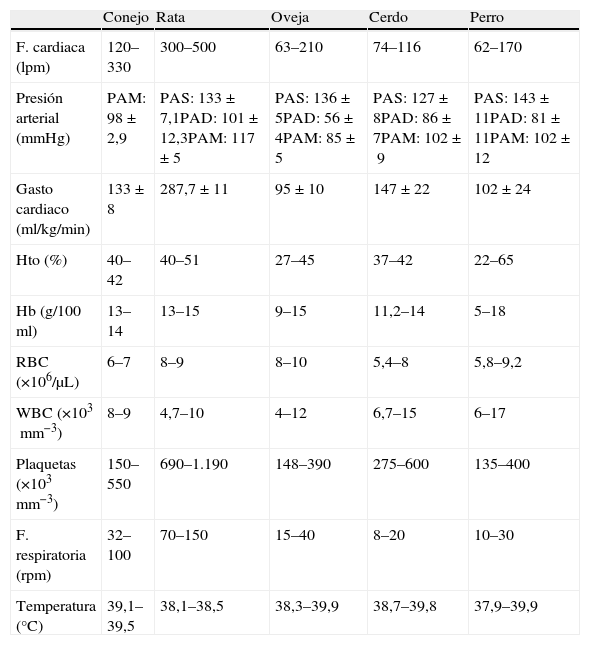
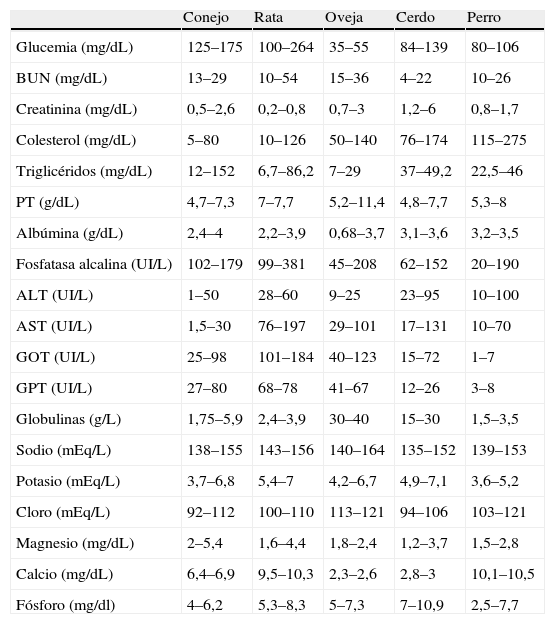
Elección de la especie animalResulta de vital importancia el conocimiento de las características de la especie elegida como modelo animal, sus parámetros fisiológicos normales (tablas 1 y 2) y sus particularidades anestésicas, con el fin de elegir la técnica y protocolo anestésico más adecuados, para cada especie y para cada ensayo experimental concreto.
Parámetros hematológicos, respiratorios y temperatura
| Conejo | Rata | Oveja | Cerdo | Perro | |
| F. cardiaca (lpm) | 120–330 | 300–500 | 63–210 | 74–116 | 62–170 |
| Presión arterial (mmHg) | PAM: 98±2,9 | PAS: 133±7,1PAD: 101±12,3PAM: 117±5 | PAS: 136±5PAD: 56±4PAM: 85±5 | PAS: 127±8PAD: 86±7PAM: 102±9 | PAS: 143±11PAD: 81±11PAM: 102±12 |
| Gasto cardiaco (ml/kg/min) | 133±8 | 287,7±11 | 95±10 | 147±22 | 102±24 |
| Hto (%) | 40–42 | 40–51 | 27–45 | 37–42 | 22–65 |
| Hb (g/100ml) | 13–14 | 13–15 | 9–15 | 11,2–14 | 5–18 |
| RBC (×106/μL) | 6–7 | 8–9 | 8–10 | 5,4–8 | 5,8–9,2 |
| WBC (×103mm−3) | 8–9 | 4,7–10 | 4–12 | 6,7–15 | 6–17 |
| Plaquetas (×103mm−3) | 150–550 | 690–1.190 | 148–390 | 275–600 | 135–400 |
| F. respiratoria (rpm) | 32–100 | 70–150 | 15–40 | 8–20 | 10–30 |
| Temperatura (°C) | 39,1–39,5 | 38,1–38,5 | 38,3–39,9 | 38,7–39,8 | 37,9–39,9 |
Parámetros normales de bioquímica, enzimas séricas y electrolitos en plasma
| Conejo | Rata | Oveja | Cerdo | Perro | |
| Glucemia (mg/dL) | 125–175 | 100–264 | 35–55 | 84–139 | 80–106 |
| BUN (mg/dL) | 13–29 | 10–54 | 15–36 | 4–22 | 10–26 |
| Creatinina (mg/dL) | 0,5–2,6 | 0,2–0,8 | 0,7–3 | 1,2–6 | 0,8–1,7 |
| Colesterol (mg/dL) | 5–80 | 10–126 | 50–140 | 76–174 | 115–275 |
| Triglicéridos (mg/dL) | 12–152 | 6,7–86,2 | 7–29 | 37–49,2 | 22,5–46 |
| PT (g/dL) | 4,7–7,3 | 7–7,7 | 5,2–11,4 | 4,8–7,7 | 5,3–8 |
| Albúmina (g/dL) | 2,4–4 | 2,2–3,9 | 0,68–3,7 | 3,1–3,6 | 3,2–3,5 |
| Fosfatasa alcalina (UI/L) | 102–179 | 99–381 | 45–208 | 62–152 | 20–190 |
| ALT (UI/L) | 1–50 | 28–60 | 9–25 | 23–95 | 10–100 |
| AST (UI/L) | 1,5–30 | 76–197 | 29–101 | 17–131 | 10–70 |
| GOT (UI/L) | 25–98 | 101–184 | 40–123 | 15–72 | 1–7 |
| GPT (UI/L) | 27–80 | 68–78 | 41–67 | 12–26 | 3–8 |
| Globulinas (g/L) | 1,75–5,9 | 2,4–3,9 | 30–40 | 15–30 | 1,5–3,5 |
| Sodio (mEq/L) | 138–155 | 143–156 | 140–164 | 135–152 | 139–153 |
| Potasio (mEq/L) | 3,7–6,8 | 5,4–7 | 4,2–6,7 | 4,9–7,1 | 3,6–5,2 |
| Cloro (mEq/L) | 92–112 | 100–110 | 113–121 | 94–106 | 103–121 |
| Magnesio (mg/dL) | 2–5,4 | 1,6–4,4 | 1,8–2,4 | 1,2–3,7 | 1,5–2,8 |
| Calcio (mg/dL) | 6,4–6,9 | 9,5–10,3 | 2,3–2,6 | 2,8–3 | 10,1–10,5 |
| Fósforo (mg/dl) | 4–6,2 | 5,3–8,3 | 5–7,3 | 7–10,9 | 2,5–7,7 |
La especie porcina se ha convertido en la actualidad en una de las más utilizadas en experimentación animal y docencia debido a su alta disponibilidad y a sus similitudes anatómicas y fisiológicas con la especie humana (tabla 3). Sin embargo, deben tenerse en cuenta ciertas consideraciones o inconvenientes que determinan el protocolo y técnica anestésica de elección: difícil manejo, vías venosas periféricas de pequeño tamaño, posibilidad de hipertermia maligna, alta susceptibilidad a padecer estrés y alta tasa de arritmias cardiacas19–24.
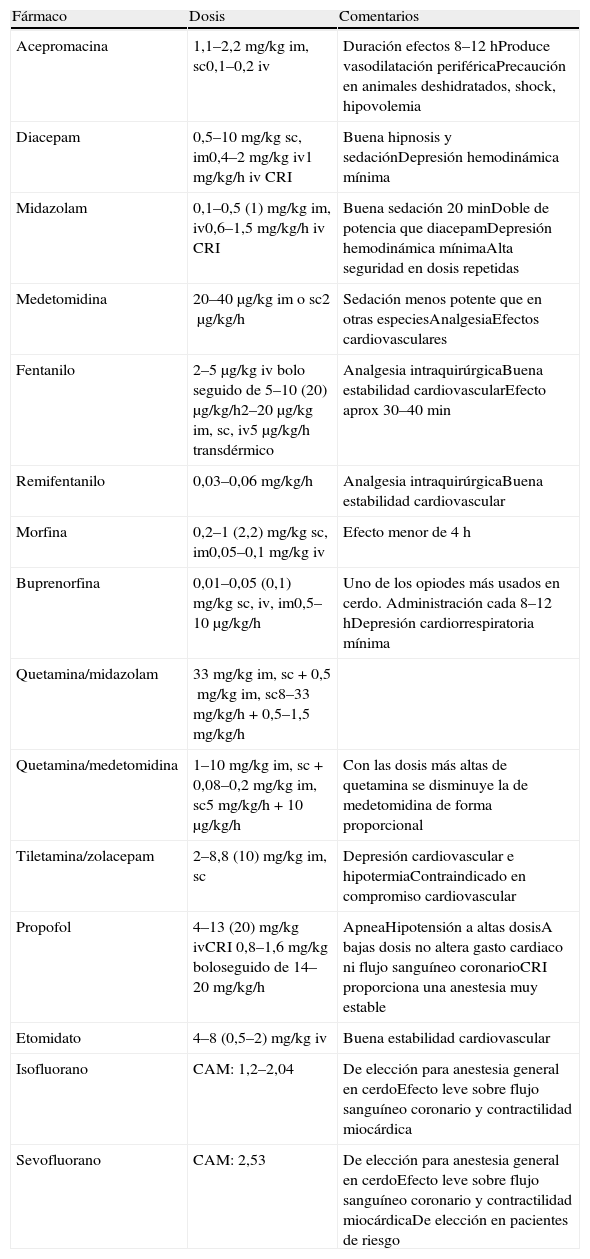
Dosis recomendadas de fármacos anestésicos en la especie porcina
| Fármaco | Dosis | Comentarios |
| Acepromacina | 1,1–2,2mg/kg im, sc0,1–0,2 iv | Duración efectos 8–12hProduce vasodilatación periféricaPrecaución en animales deshidratados, shock, hipovolemia |
| Diacepam | 0,5–10mg/kg sc, im0,4–2mg/kg iv1mg/kg/h iv CRI | Buena hipnosis y sedaciónDepresión hemodinámica mínima |
| Midazolam | 0,1–0,5 (1) mg/kg im, iv0,6–1,5mg/kg/h iv CRI | Buena sedación 20 minDoble de potencia que diacepamDepresión hemodinámica mínimaAlta seguridad en dosis repetidas |
| Medetomidina | 20–40μg/kg im o sc2μg/kg/h | Sedación menos potente que en otras especiesAnalgesiaEfectos cardiovasculares |
| Fentanilo | 2–5μg/kg iv bolo seguido de 5–10 (20) μg/kg/h2–20μg/kg im, sc, iv5μg/kg/h transdérmico | Analgesia intraquirúrgicaBuena estabilidad cardiovascularEfecto aprox 30–40min |
| Remifentanilo | 0,03–0,06mg/kg/h | Analgesia intraquirúrgicaBuena estabilidad cardiovascular |
| Morfina | 0,2–1 (2,2) mg/kg sc, im0,05–0,1mg/kg iv | Efecto menor de 4h |
| Buprenorfina | 0,01–0,05 (0,1) mg/kg sc, iv, im0,5–10μg/kg/h | Uno de los opiodes más usados en cerdo. Administración cada 8–12hDepresión cardiorrespiratoria mínima |
| Quetamina/midazolam | 33mg/kg im, sc+0,5mg/kg im, sc8–33mg/kg/h+0,5–1,5mg/kg/h | |
| Quetamina/medetomidina | 1–10mg/kg im, sc+0,08–0,2mg/kg im, sc5mg/kg/h+10μg/kg/h | Con las dosis más altas de quetamina se disminuye la de medetomidina de forma proporcional |
| Tiletamina/zolacepam | 2–8,8 (10) mg/kg im, sc | Depresión cardiovascular e hipotermiaContraindicado en compromiso cardiovascular |
| Propofol | 4–13 (20) mg/kg ivCRI 0,8–1,6mg/kg boloseguido de 14–20mg/kg/h | ApneaHipotensión a altas dosisA bajas dosis no altera gasto cardiaco ni flujo sanguíneo coronarioCRI proporciona una anestesia muy estable |
| Etomidato | 4–8 (0,5–2) mg/kg iv | Buena estabilidad cardiovascular |
| Isofluorano | CAM: 1,2–2,04 | De elección para anestesia general en cerdoEfecto leve sobre flujo sanguíneo coronario y contractilidad miocárdica |
| Sevofluorano | CAM: 2,53 | De elección para anestesia general en cerdoEfecto leve sobre flujo sanguíneo coronario y contractilidad miocárdicaDe elección en pacientes de riesgo |
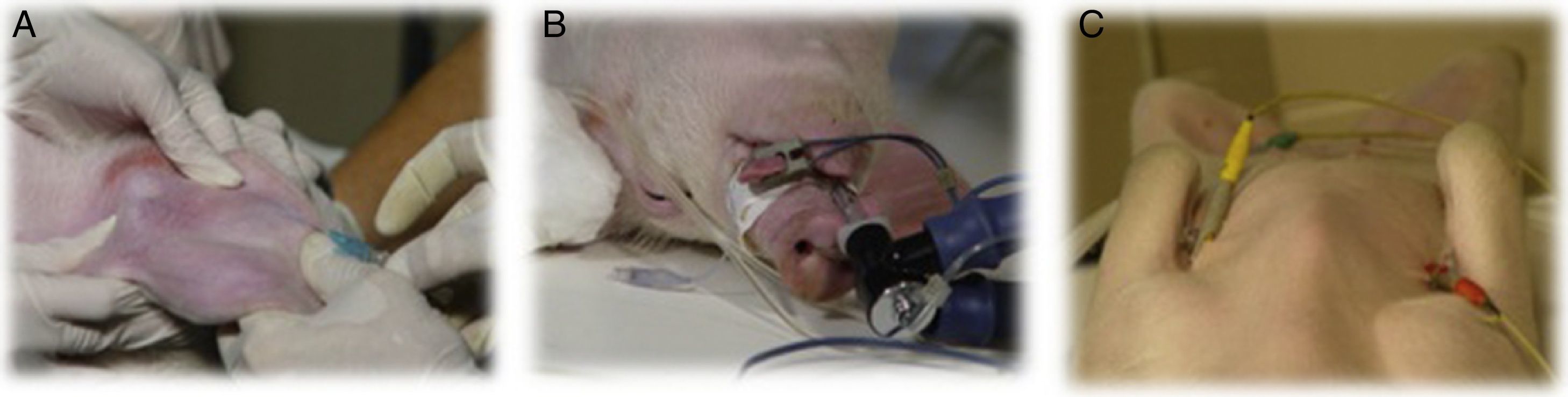
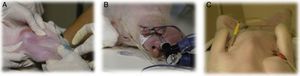
El acceso venoso periférico es difícil de conseguir en animales no sedados o anestesiados, utilizando preferentemente las venas marginales auriculares aunque también pueden cateterizarse la vena cefálica o la safena (fig. 1A).
Aunque no es habitual la emesis, se recomienda un ayuno de sólidos de 6-10 h en animales adultos y lechones, y de 1-3 h en neonatos, con acceso libre al agua de bebida. Un ayuno de 8-12 h proporciona un vaciado del estómago y el intestino delgado mientras que el vaciado del colon requiere 48-72 h25.
La monitorización debe ser lo más completa posible durante todo el periodo anestésico incluyendo capnografía, pulsioximetría, electrocardiografía y medida de presiones arteriales (fig. 1B y C).
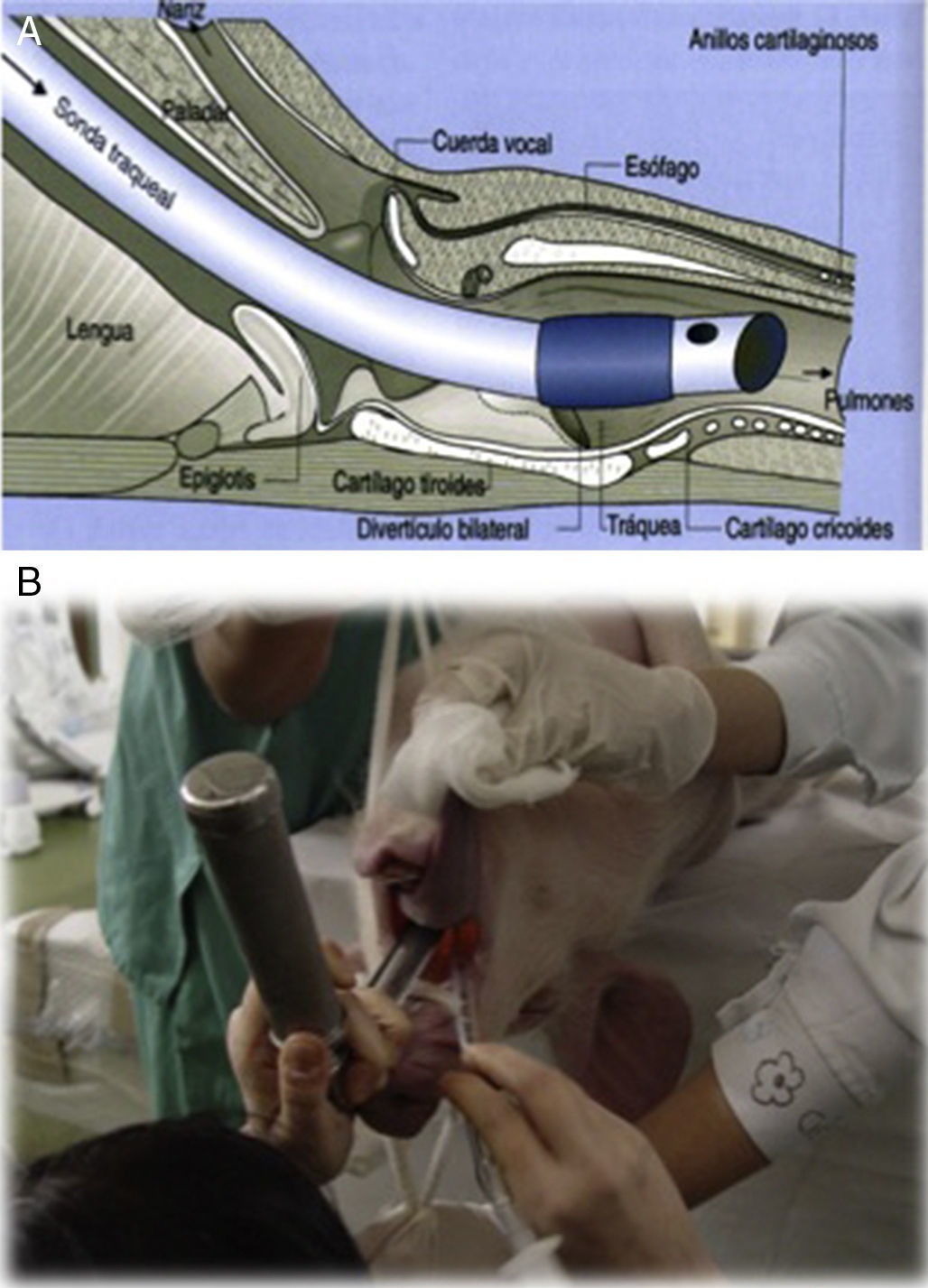
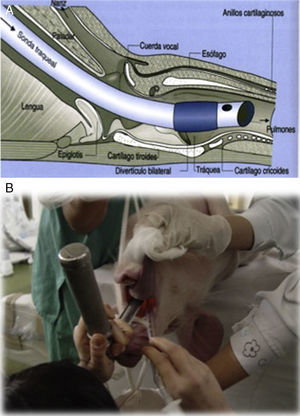
La intubación endotraqueal es recomendable para mantener el control de la vía aérea siempre que se realice anestesia general. Esta maniobra en el cerdo es más difícil que en otras especies, debido a sus características anatómicas como son: presencia de un divertículo laríngeo ventral, laringe y tráquea de pequeño tamaño (siendo necesarios tubos endotraqueales de menor diámetro que los utilizados en un perro de peso similar) y laringe en forma de «V» muy angulada que obliga a rotar el tubo endotraqueal 180° una vez que ha llegado al suelo de la laringe para poder alcanzar la tráquea; además, la apertura de la cavidad oral es limitada, siendo el acceso más difícil que en otras especies (fig. 2A y B). Se debe tener en cuenta que la manipulación reiterada de la laringe puede provocar la aparición de hemorragia, edema laríngeo o laringoespasmo, especialmente frecuente, este último, en animales bajo un estado anestésico superficial o en lechones de menos de 2 meses de edad.
Además, esta especie posee una alta variabilidad individual de respuesta a los fármacos, incluso bajo condiciones ambientales muy similares o idénticas. Esta diferencia de respuesta aún no ha sido estudiada adecuadamente, destacando la importancia que tiene la comprensión de las respuestas fisiológicas y farmacológicas típicas de esta especie26–28.
Son animales altamente sensibles a las manipulaciones y al estrés, debido a que poseen un sistema cardiovascular inestable y a que su capacidad termorreguladora está muy limitada ya que poseen una baja superficie corporal con relación a su masa corporal. Debido a ello resulta imprescindible la selección y diseño de un buen protocolo anestésico en esta especie, y muy particularmente en ensayos experimentales o cuando son empleados como modelos animales en cursos de procedimientos cardiovasculares29–37. Las complicaciones más frecuentes asociadas con la inmovilización farmacológica y anestesia del cerdo son la depresión respiratoria, apnea, hipertermia maligna, depresión cardiovascular y el síndrome de estrés porcino38–41.
OrganizaciónTodos los cursos, desde el primero iniciado en junio del año 2000, han tenido un contenido eminentemente práctico. Los realizamos en el Departamento de Cirugía y Radiología de la Facultad de Veterinaria de la Universidad de León, combinando una parte teórica previa a las prácticas instrumentales. Estas las repartimos en 4 sesiones de entre hora y media y 2 h de duración cada una, con pequeños tiempos intercalados de descanso y refrigerio, necesarios para actualizar las mesas de instrumental y demás labores de mantenimiento de los puestos de trabajo propiamente dichos.
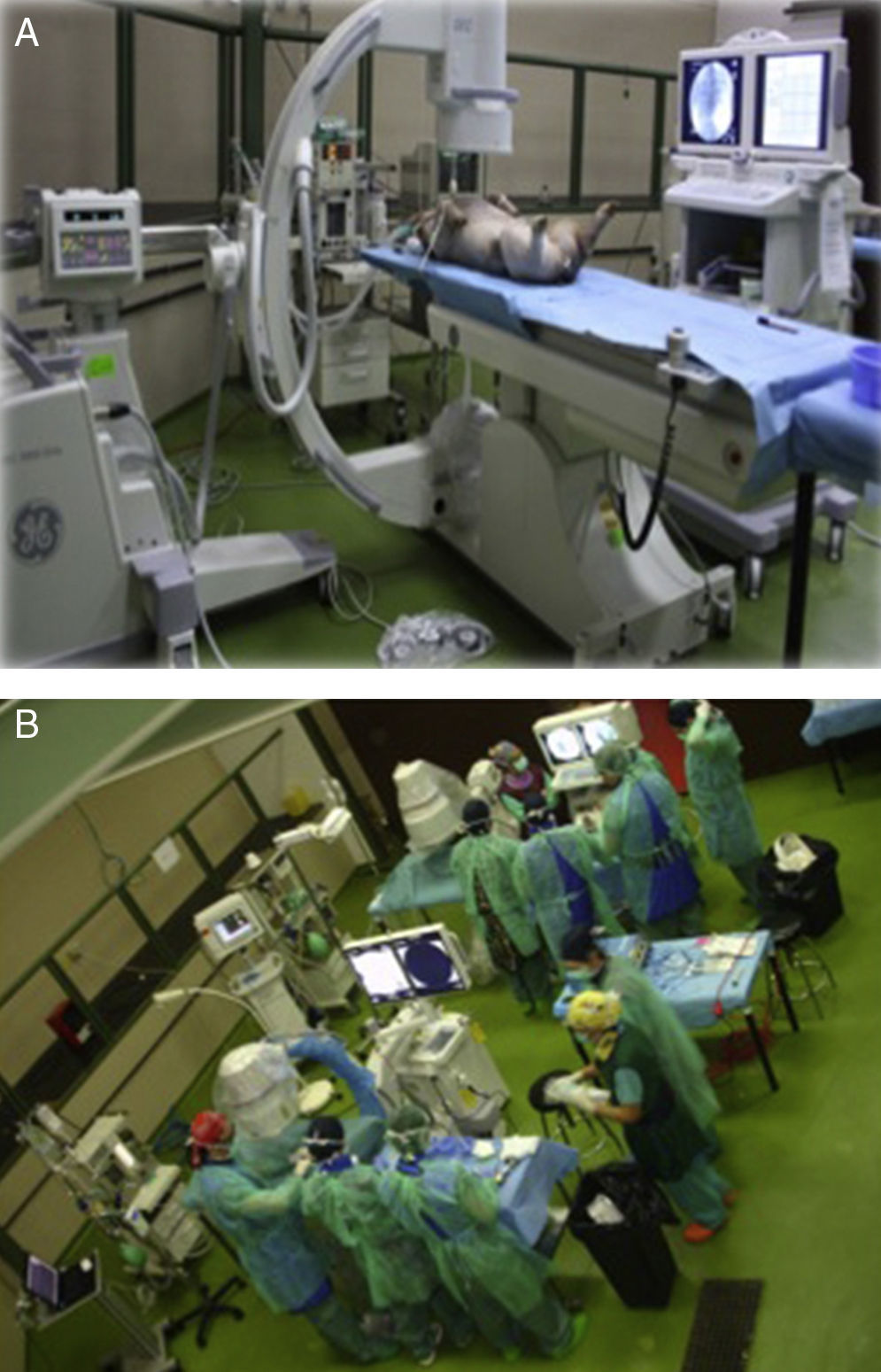
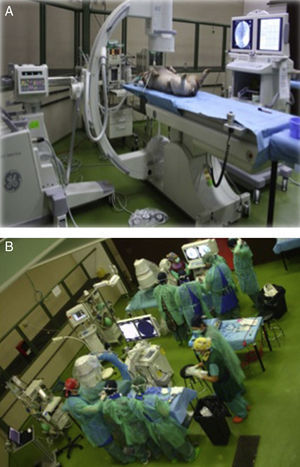
Instalamos para la ocasión 4 quirófanos radiológicos completos con cerdo anestesiado, que funcionan simultáneamente con toda la dotación necesaria, atendidos por personal de veterinaria y por nuestro personal de enfermería y auxiliar que se desplazan especialmente para los cursos (fig. 3A y B). La mayoría de los profesores que actúan de monitores se eligen según su perfil, de servicios de muy distinta procedencia, ajenos a la organización.
Los quirófanos radiológicos se completan con otros 2 puestos, también bajo arco de RX, en los que en el interior de sendos maniquíes de tamaño humano (simulador mecánico), hemos replicado un árbol vascular de material de PTFE con las mismas medidas de aorta torácica, troncos supraaórticos, axilares, aorta abdominal, troncos viscerales renales, sector aortoilíaco y femoropoplíteo distal. En ellos se intercala un saco aneurismático en aorta torácica o abdominal, que se repara iterativamente mediante EVAR y TEVAR, con los mismos dispositivos usados en clínica humana cedidos para la ocasión. También sirve, alternativamente, de modelo de entrenamiento de navegación endovascular, por el excelente deslizamiento que se consigue en el PTFE.
Desde hace años también hemos podido contar con simuladores electrónicos. Debo señalar que al principio tenían un éxito espectacular, pero con el paso de los años han cedido protagonismo, posiblemente por el mayor nivel de los cursillistas.
ProgramaComenzamos a primera hora con contenidos teóricos, mientras se van preparando al mismo tiempo los animales en sus respectivos quirófanos radiológicos. Como la anatomía del modelo animal del cerdo es, con sus diferencias, bastante similar a la humana, la primera clase teórica, impartida por un veterinario, consiste en un completo repaso a la anatomía del modelo que se van a encontrar, con todo tipo de imágenes tanto anatómicas como radiológicas, tal como van a aparecer en sus pantallas. Los siguientes temas tratan de explicar los diversos materiales y dispositivos que se van a utilizar durante las prácticas, así como la enseñanza de las diferentes habilidades técnicas y sus trucos o peculiaridades.
La primera práctica siempre la planteamos de navegación endovascular por todo el árbol arterial con intercambio de guías y catéteres, de esta manera el monitor detecta el nivel de cada cursillista para establecer el ritmo de avance y clasificación del grupo, por si hubiese que realizar cambios en caso necesario. Cada vez es más frecuente que la navegación sea un repaso rápido de la anatomía para situarse en el modelo, cateterizando selectivamente todas las arterias deseadas, para continuar en la misma práctica por todo el grupo con maniobras de angioplastia periférica, siempre simuladas, y colocación de stent en las zonas periféricas de los miembros superiores señaladas como estenosadas.
La segunda práctica consiste en la realización en el modelo de una angioplastia con colocación de stent (ATP+stent) en la arteria carótida externa, siendo en el cerdo de mayor calibre que la interna, y siguiendo todos los pasos como se hace en humano, incluido el despliegue, colocación y repliegue del filtro.
La tercera práctica tiene por objeto una ATP+stent simulada sobre ambas arterias renales.
En la cuarta práctica, al final de la tarde, se cateterizan selectivamente la arteria mesentérica superior y el tronco celíaco para el implante de stents.
En el segundo día, durante la quinta práctica, se navegan y practican ATP de los troncos distales.
En la sexta práctica se realizan, sobre simulador mecánico con árbol vascular replicado, bajo arco de RX, correcciones de aneurismas prefabricados sobre aorta torácica, utilizando los diferentes dispositivos TEVAR humanos.
En la séptima práctica se corrigen, sobre el modelo simulado, aneurismas de aorta abdominal con los dispositivos EVAR, siguiendo los mismos pasos.
La octava práctica sirve para realizar alguna forma de repesca o recordatorio para aquellos grupos menos avanzados, o a los que, por circunstancias del curso, no les hubiera dado tiempo a completar alguna práctica.
Durante todo el tiempo del curso en salas diferentes, los cursillistas van rotando de forma programada por simuladores electrónicos.
ComentariosEn los 2 últimos años, siguiendo las nuevas necesidades de aprendizaje de nuestros cursillistas MIR, detectadas por encuestas, las 2 tardes del curso se dedican en el modelo animal a aprendizaje de suturas y anastomosis de injertos vasculares en diferentes territorios anatómicos, compartiendo ese tiempo en prácticas de EVAR y TEVAR en modelo simulado. Es decir el curso ha dejado de ser solo endovascular para hacerse mixto, tal como es la práctica quirúrgica actual de nuestra especialidad: abierta y endovascular.
Una peculiaridad de los cursos, condicionada por el aprovechamiento del modelo, es que se deben organizar el ritmo y la localización territorial de las diferentes prácticas, de manera que dicho modelo sufra lo menos posible los fenómenos de isquemia-reperfusión, o que se puedan producir fenómenos de isquemia demasiado prolongada o definitiva que puedan dar lugar a la desestabilización hemodinámica del modelo y situaciones de taquicardia, taquiarritmia o fibrilación ventricular, tan temida por los anestesistas veterinarios a lo largo de la práctica.
Es de justicia destacar la gran experiencia personal y el avanzado grado de adiestramiento de nuestros colegas veterinarios en estas situaciones, merced a la práctica intensiva conseguida a lo largo de más de 20 años en tantos cursos, cursillos, tesis doctorales, investigaciones etc., que mantienen en repetidas ocasiones cada año con cardiólogos hemodinamistas, radiólogos intervencionistas, traumatólogos, cirujanos maxilofaciales, etc., además de la colaboración anual de nuestros cursos de cirugía endovascular42,43.
ReflexionesEl papel de estos cursos de cirugía endovascular va indefectiblemente unido a la historia y evolución de la Cirugía Vascular en los últimos 20 años. La idea de este tipo de cursos en modelo animal surgió en el año 2000 en respuesta a la apremiante necesidad de aprendizaje de una técnicas que, aunque originariamente procedentes de otros campos, en su evolución quirúrgica comenzaban a formar parte del arsenal terapéutico del cirujano vascular. Durante los primeros años de este curso, la posibilidad de entrenamiento en modelo animal constituyó para varias generaciones de cirujanos vasculares instruidos en la cirugía clásica, el modo perfecto y necesario de reciclaje y aprendizaje antes de su aplicación en humano. En la actualidad, la generalización de las técnicas endovasculares, ya habituales en la práctica totalidad de las unidades docentes de Angiología y Cirugía Vascular en detrimento de la cirugía abierta, ha convertido este tipo de cursos en una forma de entrenamiento híbrido, en cirugía abierta y endovascular, como fiel reflejo de la cirugía vascular del siglo xxi.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.